Биология внутренних вод, 2021, № 4, стр. 343-352
Особенности микробного состава содовых озер Белозерской группы (Республика Бурятия)
С. В. Зайцева a, *, Е. Ю. Абидуева a, К. В. Зайцева b, Ч.-Х. Сун c
a Институт общей и экспериментальной биологии Сибирское отделение Российской академии наук
Улан-Удэ, Рoccия
b Московский физико-технический институт, Национальный исследовательский университет
Московская обл, Долгопрудный, Россия
c Институт медицинской биотехнологии Китайской академии медицинских наук
Пекин, Китай
* E-mail: svet_zait@mail.ru
Поступила в редакцию 13.03.2020
После доработки 24.12.2020
Принята к публикации 12.01.2021
Аннотация
Определены особенности микробного разнообразия осадков содовых озер Верхнее и Нижнее Белое (Республика Бурятия). Микробные сообщества донных осадков имеют ключевое значение в биогеохимических циклах озерных экосистем благодаря высокому разнообразию и численности микроорганизмов. Расположение двух озер на расстоянии ~1 км друг от друга позволило исследовать возможные закономерности распространения и биогеографии отдельных групп микроорганизмов в локальном масштабе. Доминирующее положение в сообществах занимают бактерии филумов Proteobacteria и Bacteroidetes (до 55% общего микробного разнообразия). Кодоминантами (>1% сравнительного обилия) в осадках оз. Верхнее Белое выступают бактерии филумов Firmicutes, Spirochaetes и Verrucomicrobia, в осадках оз. Нижнее Белое – Firmicutes, Verrucomicrobia, Planctomycetes, Patescibacteria и Tenericutes. Отмечена высокая степень сходства в составе микробных сообществ этих озер на всех уровнях микробной классификации. Общие роды занимают 76–78% микробного разнообразия и включают доминирующие и кодоминирующие бактерии. Значительное количество последовательностей (до 1.22% в осадках оз. Верхнее Белое и 3.2% в оз. Нижнее Белое) связано с суперфилумом Patescibacteria, эволюционно обособленной группой бактерий.
ВВЕДЕНИЕ
Системы мелководных соленых и солоноватых озер с различной минерализацией, расположенные на компактной площади со сходными ландшафтными и гидрографическими условиями, рассматриваются в качестве природных модельных объектов в гидрогеохимическом, геологическом и биологическом аспектах (Солотчина и др., 2012; Namsaraev et al., 2015; Boros et al., 2016; Schagerl, 2016; Косолапов, Косолапова, 2018; Ануфриева и др., 2019). Наибольшее внимание уделено исследованию микробных сообществ донных осадков, которые благодаря высокому разнообразию и численности микроорганизмов имеют ключевое значение в основных биогеохимических циклах озерных экосистем (Xiong et al., 2012; Зайцева и др., 2014, 2018; Sorokin et al., 2014; Namsaraev et al., 2015; Vavourakis et al., 2018). Таксономический анализ микробного разнообразия расширяет понимание вопросов экологии и микробной биогеографии этих экстремальных экосистем (Pagaling et al., 2009; Xiong et al., 2012; Vavourakis et al., 2018). Озера, расположенные в условиях аридного климата, рассматриваются 651673 среды (Huo et al., 2015; Namsaraev et al., 2015). Это обусловлено как фактором быстроизменяющихся экологических условий, в зависимости от климатических и геоландшафтных изменений, так и современными возможностями изучения экологии и адаптаций микробиоты.
Исследованные озера Верхнее и Нижнее Белое формируют Белозерскую группу в системе Еравнинско-Гусиноозерских озер (Республика Бурятия), связанную с линейной межгорной впадиной в зоне Байкальского рифта. Байкальский рифт наряду с Восточно-Африканским рифтом является еще одним примером дивергентной границы внутри континентальной коры (Schagerl, 2016). Расположение двух озер на расстоянии ~1 км друг от друга и на одинаковых высотах (606 м над уровнем моря) почти нивелирует изменчивость, связанную с конкретными местными различиями, – климатические эффекты, геология и атмосферные осадки. Это позволяет сделать более точные выводы о параметрах окружающей среды, влияющих на разнообразие и распространение микроорганизмов.
Цель работы – определить микробное разнообразие в донных осадках молекулярно-генетическими методами, а также исследовать возможные закономерности распространения отдельных групп микроорганизмов в локальном масштабе.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Озера Верхнее Белое (50°37′425″ с.ш., 105°45′075″ в.д.) и Нижнее Белое (50°36′367″ с.ш., 105°45′801″ в.д.) расположены в южной части Боргойской степи (Джидинский район, Республика Бурятия). Территория характеризуется аридным климатом, низкими зимними температурами, большой сухостью воздуха и небольшим годовым количеством осадков (250–330 мм). Озерные бассейны не имеют стока, тип водно-минерального питания смешанный: за счет атмосферных осадков, вымывающих соли из почв и горных пород водосбора, и за счет родников и ручьев. Площадь и глубина озер варьируют в зависимости от температурных условий и количества осадков.
Пробы поверхностных осадков отбирали 20 августа 2018 г. Физико-химические параметры придонной воды и осадков определяли непосредственно в местах отбора проб с использованием портативных приборов, макрокомпонентный состав придонной воды – в лабораторных условиях по методике, описанной ранее (Зайцева и др., 2018). Для проведения молекулярных исследований 5–10 г поверхностного слоя (0–5 см) осадков из прибрежной зоны озер отбирали в 50-миллилитровые пластиковые флаконы (BD Falcon TM, Greiner Bio-One, Германия), которые затем помещали в холодильник и хранили при температуре 4°C. ДНК из образцов осадков выделяли с помощью набора PowerSoil DNA Isolation Kit в соответствии с рекомендациями изготовителя на оборудовании Центра коллективного пользования “Геномные технологии, протеомика и клеточная биология” Федерального государственного бюджетного научного управления Всероссийского НИИ сельскохозяйственной метеорологии. Микробное разнообразие определяли в трех повторностях, анализировали усредненные значения. Для амплификации использовали набор праймеров Ferier_F515: 5'-GTGCCAGCMGCCGCGGTAA-3' и Ferier_R806: 5'-GGACTACVSGG GTATCTAAT-3'. Создание и секвенирование библиотек проводили согласно рекомендациям Illumina Sample Preparation Guide. Секвенирование библиотек проводили на платформе Illumina MiSeq. Для биоинформационного анализа применяли программы QIIME ver. 1.9.1 и SILVA (Quast et al., 2013).
Соответствующие последовательности близкородственных видов получали из базы данных GenBank с помощью сервера EzBioCloud. Множественное выравнивание сделано с использованием инструмента MUSCLE в программном пакете MEGA версии 7.0 (Edgar, 2004). Филогенетические деревья построены методом максимального правдоподобия (maximum likelihood, ML) (Felsenstein, 1981) на основе генетических расстояний, рассчитанных с использованием двухпараметрической модели Кимуры (Kimura, 1980) в программе MEGA 7.0.
Статистическую и математическую обработку данных выполняли в программе XLSTAT (Addinsoft, Франция). Для обработки данных при анализе распространения некоторых классов бактерий в микробных сообществах использовали метод многомерного шкалирования (Zuur et al., 2007).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Физико-химическая характеристика мест отбора проб. Озера характеризовались мелководностью со средними глубинами до 2 м, соленостью и щелочным значением рН воды (табл. 1). В период исследований отмечены максимальные значения минерализации воды за все годы наших исследований этих озер. Ранее минерализация воды в оз. Верхнее Белое не превышала 12–15 г/л, в оз. Нижнее Белое варьировала от 4.3 до 12 г/л (Зайцева и др., 2018). По гидрохимическим характеристикам озера являются типичными содовыми водоемами, с высоким щелочным рН (до 10), низкой концентрацией кальция и магния, преобладанием в анионном составе карбонатов и гидрокарбонатов (HC${\text{O}}_{3}^{ - }$ + C${\text{O}}_{3}^{{2 - }}$ >25 e%). По составу доминирующих ионов вода озера Верхнее Белое отнесена к типу гидрокарбонатной натриевой (HC${\text{O}}_{3}^{ - }$ до 32.7 e%, Na+ 99.6 e%), вода оз. Нижнее Белое – к гидрокарбонатно-сульфатной натриевой, среди анионов доминировали гидрокарбонаты (31.8 e%) и сульфаты (30.9 e%), среди катионов – натрий (98.9 e%) (табл. 2).
Таблица 1.
Физико-химические параметры мест отбора проб в августе 2018 г.
| Озеро | Площадь, км2 | Глубина, м | Т, °С | ОВП, мВ | рН | Минерализация, г/л |
Хлорофилл a, мкг/л |
|---|---|---|---|---|---|---|---|
| Верхнее Белое | 3.0 | 2.7 | 26.4 | –322 | 9.80 | 34.7 | 3.5 ± 1.6 |
| Нижнее Белое | 2.7 | 1.95 | 27.3 | –325 | 9.75 | 20.9 | 15.3 ± 1.5 |
Таблица 2.
Анионно-катионный состав воды озер, г/л
| Озеро | Na+ | Са2+ | Mg2+ | Fe3+ | HC${\text{O}}_{3}^{ - }$ | C${\text{O}}_{3}^{{2 - }}$ | S${\text{O}}_{4}^{{2 - }}$ | Cl– | F– |
|---|---|---|---|---|---|---|---|---|---|
| Верхнее Белое | 12.2 | 0.020 | 0.009 | 0.0014 | 10.6 | 2.9 | 5.8 | 3.2 | 0.00057 |
| Нижнее Белое | 7.0 | 0.052 | 0.009 | 0.00055 | 5.9 | 1.8 | 4.6 | 1.6 | 0.00057 |
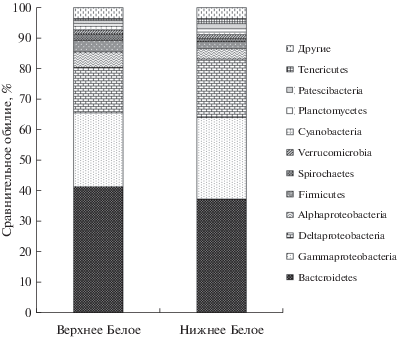
Разнообразие микробных сообществ. В поверхностных осадках исследуемых озер развивались достаточно разнообразные микробные сообщества. При кластерном расстоянии 0.03 количество ОТЕ в образцах оз. Верхнее Белое варьировало от 430 до 439, в оз. Нижнее Белое – от 442 до 452. Индекс видового разнообразия Шеннона на уровне рода в сообществе осадков оз. Верхнее Белое был 6.5, в оз. Нижнее Белое – 6.6. В составе микробных сообществ в осадках оз. Верхнее Белое обнаружены представители 35 бактериальных и трех архейных филумов, в оз. Нижнее Белое – 39 бактериальных и четыре архейных филума. Доминировали бактерии Proteobacteria и Bacteroidetes, на их долю приходилось 42–55 и 32–45% общего числа классифицированных последовательностей соответственно (рис. 1). Кодоминантами (>1% сравнительного обилия) в осадках оз. Верхнее Белое выступали бактерии филумов Firmicutes, Spirochaetes и Verrucomicrobia, в осадках оз. Нижнее Белое – Firmicutes, Verrucomicrobia, Planctomycetes, Patescibacteria и Tenericutes.
Наиболее многочисленный класс Gammaproteobacteria (24–27%) составляли алкалофильные, галотолерантные представители родов Nitrincola (6–10%), экстремально-галотолерантные Halomonas (2%) (порядок Oceanospirillales), Azoarcus (7–10%) из порядка Betaproteobacteriales, Thioalkalispira (2%) из порядка Ectothiorhodospirales (рис. 2). Следует отметить, что представители порядка Ectothiorhodospirales были многочисленны во всех образцах (от 2.1 до 6.4%), но на уровне родов наблюдалось различие в составе микробных сообществ озер: последовательности, ассоциированные с родами Thioalkalispira и Thioalkalivibrio, занимали значительную долю (от 0.3 до 6%) в осадках обоих озер, бактерии рода Ectothiorodospira обнаружены лишь в микробном сообществе оз. Верхнее Белое.
Рис. 2.
Сравнительное обилие (%) 40 наиболее многочисленных родов и ОТЕ.  – оз. Верхнее Белое, ◼ – оз. Нижнее Белое, ★ – роды, из которых ранее охарактеризованы
изоляты, обладающие способностью преобразовывать неорганические соединения серы.
– оз. Верхнее Белое, ◼ – оз. Нижнее Белое, ★ – роды, из которых ранее охарактеризованы
изоляты, обладающие способностью преобразовывать неорганические соединения серы.
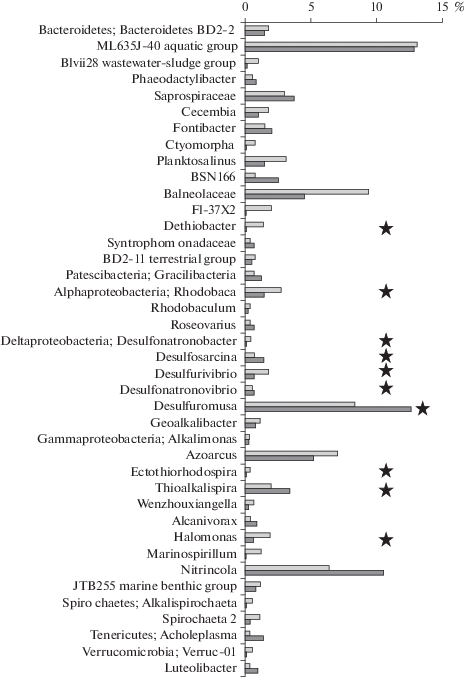
Наиболее многочисленным родом класса Alphaproteobacteria были алкалофильные Rhodobaca, которые достигали 3–5% общего разнообразия. Лидеры по ОТЕ, представляющие Deltaproteobacteria, ассоциированы с родом Desulfuromusa (8–13%). Также был распространен род облигатно-алкалофильных бактерий Desulfonatronovibrio (0.5–2%). Алкалофильные галотолерантные бактерии родов Desulfonatronobacter (порядок Desulfobacterales), Desulfonatronum и Desulfonatronospira (порядок Desulfovibrionales) составляли значительную долю (~0.1–0.3%) среди сульфатредуцирующих бактерий.
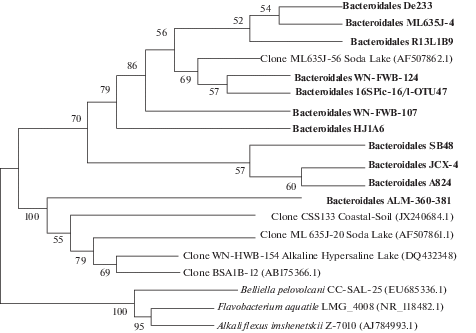
Большинство связанных с Bacteroidetes OTЕ не были классифицированы на уровне рода. Значительное количество Bacteroidetes отнесены к порядку Bacteroidales (15–17%). Последовательности некультивируемой группы ML635J-40 (порядок Bacteroidales) составляли 8–11%. Они показали высокий уровень сходства с клонами, выделенными из содовых и соленых озер (рис. 3). Другими распространенными группами были умеренно галофильные бактерии Balneolaceae и некультивируемые бактерии из класса Rhodothermia также многочисленные в других содовых озерах (Vavourakis et al., 2018). В осадках оз. Верхнее Белое они занимали до 11%, оз. Нижнее Белое – до 5%. ОТЕ, представляющие Actinobacteria, были, главным образом, соотнесены с порядком Nitriliruptorales.
Рис. 3.
Филогенетическое дерево 16S рРНК последовательностей, отнесенных классификатором SILVA к группе Bacteroidales; ML635J-40 aquatic group (отмечены жирным шрифтом), и референсных штаммов из других щелочных или соленых местообитаний. На дендрограмме представлены значения >50%.
Наиболее многочисленные ОТЕ, ассоциированные с Firmicutes, представлены сем. Syntrophomonadaceae, предполагаемые галоалкалифильные группы, обычно обнаруживаемые в содовых озерах (Vavourakis et al., 2018). В осадках оз. Верхнее Белое доминировал род Dethiobacter – алкалофильные, умеренные галотолерантные хемолитоавтотрофные бактерии, единственный валидный вид которых D. alkaliphilus впервые выделен из осадков содовых озер Монголии (Sorokin et al., 2008). В грунтах оз. Нижнее Белое бактерии этого рода были немногочисленны, количество их последовательностей не превышало 0.14% общего обилия, в сообществе преобладали некультивируемые клостридии семейств Syntrophomonadaceae и Ruminococcaceae.
В микробном сообществе оз. Нижнее Белое >1% общего числа составляли последовательности рода Luteolibacter, филума Tenericutes.
Архейное разнообразие представляли в основном некультивируемые Nanoarchaeota и Euryarchaeota, однако их обилие было невысоким и не превышало 0.6 и 0.2%, соответственно. Единичные последовательности некультивируемых архей филумов Crenarchaeota и Diapherotrites определены в осадках оз. Нижнее Белое, а некультивируемые аммоний-окисляющие археи порядка Nitrososphaeria – в грунтах оз. Верхнее Белое. Количество последовательностей, соотнесенных с метанобактериями родов Methanocalculus, Methanolobus и Methanosalsum, не превышало 0.1%.
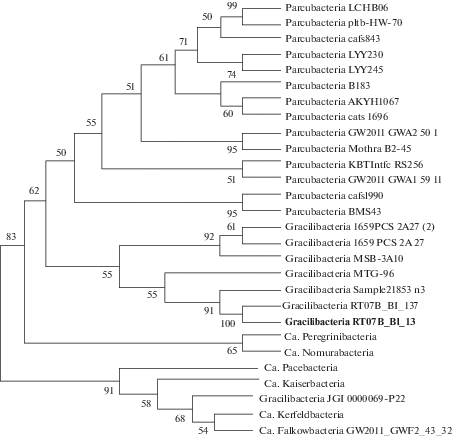
Значительное количество последовательностей – до 1.22% в осадках оз. Верхнее Белое и до 3.2% в оз. Нижнее Белое – связано с суперфилумом Patescibacteria, включающему >20 филумов-кандидатов и образующему отдельный кластер на эволюционном древе (Rinke et al., 2013; Castelle, Banfield, 2018). В грунтах оз. Нижнее Белое обнаружено 18 ОТЕ, соотнесенных с шестью классами: Gracilibacteria, ABY1, CPR2, Parcubacteria, Saccharimonadia и Microgenomatia. Наиболее многочисленный класс Gracilibacteria составлял 72% всех последовательностей, ассоциированных с Patescibacteria. На представителей класса ABY1 приходилось в среднем 22%, большая часть их отнесена к Candidatus Falkowbacteria. Единичные последовательности класса Microgenomatia обнаружены лишь в осадках оз. Нижнее Белое. В оз. Верхнее Белое преобладали представители Gracilibacteria (до 95% последовательностей Patescibacteria), остальные классы были представлены лишь единичными последовательностями (рис. 4).
Рис. 4.
Филогенетическое дерево 16S рРНК последовательностей, принадлежащих суперфилуму Patescibacteria на основе классификатора SILVA. Наиболее многочисленная в микробном сообществе группа Gracilibacteria отмечена жирным шрифтом. На дендрограмме представлены значения >50%.
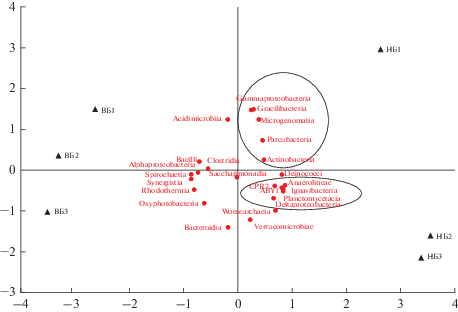
Микроорганизмы суперфилума Patescibacteria характеризуются симбиотическим образом жизни (Castelle, Banfield, 2018), при котором эти предполагаемые облигатные ферментеры получают необходимые метаболиты от симбиотического бактериального или архейного партнера и, в свою очередь, обеспечивают конечные продукты ферментации (Rinke et al., 2013; Brown et al., 2015; Nelson, Stegen, 2015; Castelle, Banfield, 2018). Проанализировано распространение 24 наиболее многочисленных классов в осадках озер (рис. 5). В результате выявлены возможные симбионты, ассоциированные с классами Gracilibacteria, ABY1, CPR2, Parcubacteria, Saccharimonadia и Microgenomatia. Так, Gracilibacteria, Parcubacteria и Microgenomatia имели сходные тенденции распространения с Gammaproteobacteria и Actinobacteria. Представители ABY1 и CPR2 демонстрировали возможное созависимое распространение с Deltaproteobacteria, Anaerolineae, Ignavibacteria и Planctomycetacia. Класс ABY1 в микробных сообществах озер представлен несколькими ОТЕ Ca. Falkowbacteria. Проведенные ранее исследования (Anantharaman et al., 2016) идентифицировали функциональные гены-маркеры сульфатредукции dsrD в геномах Ca. Falkowbacteria и выявили их высокое сходство с генами сульфатредуцирующих Deltaproteobacteria.
Рис. 5.
Сравнительный анализ распространения классов Patescibacteria в микробных сообществах поверхностного слоя осадков исследованных озер методом многомерного шкалирования (PCoA). ВБ1, ВБ2, ВБ3 – образцы из оз. Верхнее Белое, НБ1, НБ2, НБ3 – из оз. Нижнее Белое. Круг и эллипс объединяют возможных симбионтов с классами Gracilibacteria, ABY1, CPR2, Parcubacteria и Microgenomatia.
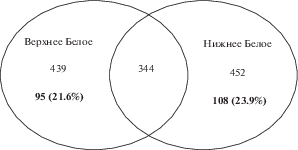
При помощи диаграмм Венна проведено сравнение микробных сообществ осадков в исследованных озерах по составу общих и уникальных родов (рис. 6). Общие роды занимали 76–78% микробного разнообразия и включали доминирующие и содоминирующие бактерии. Уникальные для каждого местообитания роды, за редким исключением, были представлены единичными последовательностями. В целом, следует отметить высокую степень сходства в составе микробных сообществ этих озер на всех уровнях микробной классификации.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследуемые озера, по-видимому, представляют собой остатки обширного древнего водоема (Солотчина и др., 2012). При значительном сходстве морфометрических, геологических и геохимических характеристик озер имеется ряд биотопных различий. Озеро Нижнее Белое характеризуется преобладанием низких, топких и заболоченных берегов с большим количеством органической массы и повышенным содержанием хлорофилла а в воде. Песчаные берега оз. Верхнее Белое почти лишены растительности. По-видимому, объяснением наблюдаемых гидрохимических и микробиологических различий в экосистемах исследуемых озер может быть большее орнитолимнологическое влияние на оз. Нижнее Белое. Традиционно эти два озера служат местами пролета, отдыха и гнездования мигрирующих околоводных и водоплавающих птиц, – мощных биовекторов в экосистеме озер за счет процессов биоаккумулирования и повышения концентрации питательных веществ (N, P), что отражается в гораздо более высоких уровнях хлорофилла а (Boros et al., 2016).
Поверхностный слой донных осадков в содовых озерах традиционно рассматривается как местообитание наиболее разнообразных и метаболически активных микробных сообществ (Vavourakis et al., 2018). Исследование показало, что, несмотря на сравнительно невысокую минерализацию (≤35 г/л), состав микробных сообществ содовых озер Верхнее и Нижнее Белое на разных уровнях классификации сходен с микробными сообществами озер с более экстремальными значениями солености (Vavourakis et al., 2018; Zhao et al., 2020).
На уровне рода самые многочисленные ОТЕ филогенетически тесно связаны с несколькими некультивируемыми Bacteroidetes, классифицированными SILVA как ML635J-40 aquatic group. Эта группа также многочисленна в экстремальных условиях содового оз. Моно Лейк (Humayoun et al., 2003), в поверхностных осадках высокоминерализованных озер Кулундинской степи (Алтай, Россия) с минерализацией 100–400 г/л (Vavourakis et al., 2018). Еще один лидер в микробных сообществах – род Nitrincola (Gammaproteobacteria), включающий алкалофильных, галотолерантных факультативно анаэробных бактерий, способных восстанавливать нитраты (Joshi et al., 2020). Все пять признанных видов этого рода, описанные к настоящему времени, выделены из содовых или соленых щелочных местообитаний (Borsodi et al., 2017; Joshi et al., 2020). Наибольшее сходство выявлено с алкалофильными, галотолерантными штаммами Nitrincola alkalilacustris, выделенными из содовых озер Венгрии (Borsodi et al., 2017). Следует отметить высокую численность последовательностей, которые представляют роды, обладающие способностью преобразовывать неорганические соединения серы. Сероокисляющие Rhodobaca (Alphaproteobacteria) преобладали в осадках оз. Верхнее Белое (до 3%), хемолитоавтотрофные Thioalkalispira (Gammaproteobacteria) в большем количестве обнаружены в осадках оз. Нижнее Белое (до 6%). Литоавтотрофные сульфатредуцирующие бактерии из родов Desulfonatronovibrio и Desulfonatronospira (Deltaproteobacteria) и серо/тиосульфатредукторы, способные к литоавтотрофному диспропорционированию полисульфидов, из родов Desulfurivibrio и особенно многочисленные Desulfuromusa (Deltaproteobacteria), вместе составляли значительную часть сообщества (~12–15%). Многие члены последних трех функциональных групп обладают способностью связывать азот в дополнение к неорганическому углероду (Sorokin et al., 2014; Vavourakis et al., 2018). Помимо очевидного высокого метаболического и таксономического разнообразия бактерий цикла серы, в верхнем слое отложений может поддерживаться разнообразное гетеротрофное сообщество, включающее как универсальные, так и очень специализированные бактерии-деструкторы.
Значительное количество последовательностей (до 1.22% в осадках оз. Верхнее Белое и до 3.2% в оз. Нижнее Белое) связано с суперфилумом Patescibacteria, который содержит Parcubacteria (OD1), Saccharibacteria (TM7), Gracilibacteria (GN02) и Microgenomates (OP11) (Peura et al., 2012; Rinke et al., 2013), а также входит в Candidate Phyla Radiation (CPR) – большую монофилетическую группу некультивируемых бактериальных линий, известных, почти исключительно, на основе геномов, полученных с использованием молекулярно-генетических методов (Castelle, Banfield, 2018). В последнее время все большее внимание уделяется этому разнообразному суперсуперфилуму, включающему >70 филумов-кандидатов, образующему отдельный кластер на эволюционном древе (Wrighton et al., 2012; Brown et al., 2015; Nelson, Stegen, 2015; Castelle, Banfield, 2018). Выявлен целый ряд особенностей этих бактерий, начиная от необычного, предположительно, эписимбиотического образа жизни, а также сверхмалые размеры клеток, вставки внутри генов 16S рРНК, отсутствие рибосомных белков L30, небольшие размеры генома (часто <1 МБ) и метаболические ограничения (частичный цикл трикарбоновых кислот, отсутствие комплексов цепей переноса электронов и неполные пути биосинтеза нуклеотидов и аминокислот) (Brown et al., 2015; Tian et al., 2020). Считается, что они произошли от очень ранних организмов (возможно, с небольшими геномами), а их эволюционные траектории были сформированы, вероятно, комбинацией потери генов, горизонтальным переносом генов и конвергентной эволюции (Tian et al., 2020). Обнаружено, что Parcubacteria (OD1) и Microgenomates (OP11) широко распространены в грунтовых водах, отложениях, озерах и других водоносных горизонтах (Tian et al., 2020), а также в бескислородных местообитаниях, богатых органическими веществами, и, вероятно, участвуют в круговороте C, H и S (Wrighton et al., 2012). В содовых и содово-соленых озерах несколько новых галоалкалофильных Patescibacteria идентифицированы среди доминирующих таксонов (Vavourakis et al., 2018; Zhao et al., 2020). Это согласуется с исследованиями круговорота питательных веществ Microgenomates и Parcubacteria, которые связаны с экосистемами, богатыми серой (Peura et al., 2012; Rinke et al., 2013).
Выводы. Выявлено высокое сходство в разнообразии микробных сообществ и распространении доминирующих таксонов в локальном масштабе содовых озер Верхнее Белое и Нижнее Белое. Уникальные для каждого местообитания роды, за редким исключением, представлены единичными последовательностями и определялись экологическими и гидрохимическими особенностями каждого озера. Помимо очевидного высокого метаболического и таксономического разнообразия бактерий цикла серы, в осадках содовых озер поддерживается разнообразное гетеротрофное сообщество, включающее как универсальные, так и очень специализированные бактерии – деструкторы.
Список литературы
Ануфриева Е.В., Колесникова Е.А., Шадрин Н.В. 2019. Распространение и динамика численности экстремально галотолерантного вида Eucypris mareotica (Fisher, 1855) (Crustacea, Ostracoda) в гиперсоленых озерах Крыма // Биол. внутр. вод. Т. 12. № 2. Вып. 1. С. 42. https://doi.org/10.1134/S0320965219020037
Зайцева С.В., Абидуева Е.Ю., Намсараев Б.Б. и др. 2014. Микробное сообщество донных осадков солоноватого щелочного озера Белое (Забайкалье) // Микробиология. Т. 83. № 6. С. 722.
Зайцева С.В., Абидуева Е.Ю., Раднагуруева А.А. и др. 2018. Структура микробных сообществ в осадках щелочных озер Забайкалья с различной минерализацией // Микробиология. Т. 87. № 4. С. 1.https://doi.org/10.1134/S0026365618040183
Косолапов Д.Б., Косолапова Н.Г. 2018. Пико- и наноплактон водных экосистем Долины озер и Котловины Больших Озер (Монголия) // Биология внутренних вод. № 3. С. 36. https://doi.org/10.1134/S0320965218030099
Солотчина Э.П., Скляров Е.В., Солотчин П.А. и др. 2012. Реконструкция климата голоцена на основе карбонатной осадочной летописи малого соленого озера Верхнее Белое (Западное Забайкалье) // Геология и геофизика. Т. 53. № 12. С. 1756.
Anantharaman K., Brown C.T., Hug L.A. et al. 2016. Thousands of microbial genomes shed light on interconnected biogeochemical processes in an aquifer system // Nat. Commun. V. 7. P. 13219.
Borsodi A.K., Korponai K., Schumann P. et al. 2017. Nitrincola alkalilacustris sp. nov. and Nitrincola schmidtii sp. nov., alkaliphilic bacteria isolated from soda pans, and emended description of the genus Nitrincola // Int. J. Syst. Evol. Microbiol. V. 67(12). P. 5159. https://doi.org/10.1099/ijsem.0.002437
Boros E., Pigniczki C., Sápi T. et al. 2016. Waterbird-Mediated Productivity of Two Soda Pans in the Carpathian Basin in Central Europe // Waterbirds. V. 39(4). P. 388.
Brown C.T., Hug L.A., Thomas B.C. et al. 2015. Unusual biology across a group comprising more than 15% of domain Bacteria // Nature. V. 523. P. 208. https://doi.org/10.1038/nature14486
Castelle C.J., Banfield J.F. 2018. Major new microbial groups expand diversity and alter our understanding of the tree of life // Cell. V. 172. P. 1181. https://doi.org/10.1016/j.cell.2018.02.016
Edgar R.C. 2004. MUSCLE: multiple sequence alignment with high accuracy and high throughput // Nucleic Acids Res. V. 32. P. 1792.
Felsenstein J. 1981. Evolutionary trees from DNA sequences: a maximum likelihood approach // J. Mol. Evol. V. 17. P. 368.
Humayoun S.B., Bano N., James T. et al. 2003. Depth distribution of microbial diversity in Mono Lake, a meromictic soda lake in California // Appl. Environ. Microbiol. V. 69. P. 1030.
Huo S., Ma Ch., Xi B. et al. 2015. Establishing water quality reference conditions for nutrients, chlorophyll a and Secchi depth for 7 typical lakes in arid and semiarid ecoregion // China. Environ. Earth Sci. V. 73(8). P. 4739.
Joshi A., Thite S., Dhotre D. et al. 2020. Nitrincola tapanii sp. nov., a novel alkaliphilic bacterium from An Indian Soda Lake // Int. J. Syst. Evol. Microbiol. V. 70(2). P. 1106. https://doi.org/10.1099/ijsem.0.003883
Kimura M. 1980. A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequence // J. Mol. Evol. V. 16. P. 111.
Namsaraev Z.B., Zaitseva S.V., Gorlenko V.M. et al. 2015. Microbial processes and factors controlling their activities in alkaline lakes of the Mongolian plateau // Chin. J. Oceanol. Limnol. V. 33. P. 1391. https://doi.org/10.1007/s00343-015-4373-6
Nelson W.C., Stegen J.C. 2015. The reduced genomes of Parcubacteria (OD1) contain signatures of a symbiotic lifestyle // Front. Microbiol. V. 6. P.713. https://doi.org/10.3389/fmicb.2015.00713
Pagaling E., Wang H., Venables M. et al. 2009. Microbial Biogeography of Six Salt Lakes in Inner Mongolia, China, and a Salt Lake in Argentina // Appl. Environ. Microbiol. V. 75. P. 5750.
Peura S., Eiler A., Bertilsson S. et al. 2012. Distinct and diverse anaerobic bacterial communities in boreal lakes dominated by candidate division OD1 // ISME J. V. 6. P. 1640. https://doi.org/10.1038/ismej.2012.21
Quast C., Pruesse E., Yilmaz P. et al. 2013. The SILVA ribosomal RNA gene database project: improved data processing and web-based tools // Nucl. Acids Res. V. 41. P. D590.
Rinke C., Schwientek P., Sczyrba et al. 2013. Insights into the phylogeny and coding potential of microbial dark matter // Nature. V. 499. P. 431.
Schagerl M. 2016. Soda Lakes of East Africa. Vienna: Springer. P. 408. https://doi.org/10.1007/978-3-319-28622-8_1
Sorokin D.Y., Tourova T.P., Mußmann M. et al. 2008. Dethiobacter alkaliphilus gen. nov. sp. nov., and Desulfurivibrio alkaliphilus gen. nov. sp. nov.: two novel representatives of reductive sulfur cycle from soda lakes // Extremophiles. V. 12. P. 431. https://doi.org/10.1007/s00792-008-0148-8
Sorokin D.Y., Berben T., Melton E.D. et al. 2014. Microbial diversity and biogeochemical cycling in soda lakes // Extremophiles. V. 18. P. 791.
Tian R., Ning D., He Z. et al. 2020. Small and mighty: adaptation of superphylum Patescibacteria to groundwater environment drives their genome simplicity // Microbiome. V. 8. P. 51. https://doi.org/10.1186/s40168-020-00825-w
Vavourakis C.D., Andrei A.S., Mehrshad M. et al. 2018. A metagenomics roadmap to the uncultured genome diversity in hypersaline soda lake sediments // Microbiome. V. 6(1). P. 168. https://doi.org/10.1186/s40168-018-0548-7
Wrighton K.C., Thomas B.C., Sharon I. et al. 2012. Fermentation, hydrogen, and sulfur metabolism in multiple uncultivated bacterial phyla // Science. V. 337. (6102:1661-5). https://doi.org/10.1126/science.1224041
Xiong J., Liu Y., Lin X. et al. 2012. Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau // Environ. Microbiol. V. 14. P. 2457.
Zhao D., Zhang S., Xue Q. et al. 2020. Abundant Taxa and Favorable Pathways in the Microbiome of Soda-Saline Lakes in Inner Mongolia // Front. Microbiol. V. 11. P. 1740. https://doi.org/10.3389/fmicb.2020.01740
Zuur A.F., Leno E.N., Smith G.M. 2007. Statistics for Biology and Health – Analysing Ecological Data. New York: Springer.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод