Биология внутренних вод, 2021, № 4, стр. 417-429
Организация и функции осмотически активных фракций протеома плазмы рыб (Pisces) (обзор)
А. М. Андреева *
Институт биологии внутренних вод им И.Д. Папанина Российской академии наук
Некоузский р-н, Ярославская обл., пос. Борок, Россия
* E-mail: aam@ibiw.ru
Поступила в редакцию 04.12.2020
После доработки 23.12.2020
Принята к публикации 12.01.2021
Аннотация
Проведен анализ разнообразия состава осмотически активных белковых фракций плазмы у представителей низших водных пойкилотермных позвоночных – рыб (Pisces), в группе костных рыб (Osteichthyes). Низкомолекулярные белки плазмы рассмотрены на примере модельных видов двоякодышащих рыб (Dipnoi), осетрообразных (Аcipenseriformes) и наиболее детально – в группе экологически пластичных костистых рыб (Teleostei); в качестве групп сравнения использовали модельных представителей примитивных бесчелюстных рыбообразных (Petromyzoniformes) и высших позвоночных (Mammalia). Результаты показали присутствие альбуминов в низкомолекулярных фракциях плазмы у древних и низших костистых рыб, у бесчелюстных рыбообразных и млекопитающих. Выявлен особый статус высших Teleostei, у которых вместо альбумина в составе низкомолекулярных фракций доминируют другие белки – белок тепловой акклимации, ингибиторы сериновых и цистеиновых протеиназ, и липопротеины высокой плотности. Белковое разнообразие осмотически активных фракций плазмы в разных группах позвоночных рассмотрено в форматах концепций о консервативном составе белков плазмы позвоночных, крупномономерной организации белков плазмы, критической солености и “безальбуминовой” модели капиллярного обмена у рыб. На обсуждение выносится эволюционная модель протеома плазмы позвоночных, в которой определены стратегии формирования и эволюции протеома плазмы у предков позвоночных, рассмотрена их связь с соленостью внешней и внутренней среды.
ВВЕДЕНИЕ
Важность проблемы организации протеома плазмы позвоночных обусловлена его ключевой ролью в поддержании баланса внеклеточной жидкости в организме. Вопросы его организации традиционно регламентируют концепции о консервативном фракционном составе белков плазмы Vertebrata и их крупномономерной организации (Schulz, Schirmer, 1979). Сравнительные исследования глобулинов плазмы высших и низших Vertebrata указывают на их гомологию (Anderson et al., 2004; Lucitt et al., 2008; Babaei et al., 2013). Что касается белков НМ-фракций плазмы, то они демонстрируют высокий уровень разнообразия, особенно в группе водных пойкилотермных низших позвоночных – Pisces. Так, у хрящевых (Elasmobranchii) и высших костистых (Teleostei) рыб в составе НМ-фракций плазмы отсутствует альбумин (Ballantyne, 2016; Li et al., 2017a), а группу Teleostei отличает гетерогенность НМ-фракций (Кирпичников, 1987; Andreeva, 2012) и обилие в них олигомерных белков (Andreeva, 2019). Объяснить эти особенности на основе сведений о структуре протеома плазмы высших позвоночных невозможно, поскольку в состав их НМ-фракций входит только один белок – альбумин. Между тем, среди белков плазмы именно НМ-фракция проявляет наибольшую осмотическую активность, участвуя в эффективном связывании воды и поддержании КОД плазмы, поэтому анализ стратегий ее организации в низших таксонах (Pisces) имеет прямое отношение к проблеме эволюционного становления капиллярного обмена у позвоночных.
В обзоре проведен сравнительный анализ разнообразия белкового состава осмотически активных фракций плазмы в группе костных рыб (Osteichthyes). НМ-белки плазмы рассмотрены на примере модельных видов двоякодышащих рыб (Dipnoi), осетрообразных (Аcipenseriformes) и наиболее детально – в группе костистых рыб (Teleostei). В качестве групп сравнения использовали примитивных бесчелюстных рыбообразных (Petromyzoniformes) и высших позвоночных (Mammalia). Анализ осмотически активных белковых фракций плазмы рыб проводили в формате концепций о консервативном составе белков плазмы Vertebrata, крупномономерной организации белков плазмы (Schulz, Schirmer, 1979), критической солености (Хлебович, 1974) и “безальбуминовой” модели капиллярного обмена рыб (Андреева, 2020). На обсуждение выносится “эволюционная модель” протеома плазмы позвоночных. Она предлагает возможный сценарий преобразований протеомов жидкой среды организма у предков современных рыб в ходе освоения ими пресных и океанических вод, а также объясняет разнообразие осмотически активных фракций протеома плазмы современных Teleoste расширенным белковым составом фракций и разным профилем белок–белковых взаимодействий.
Развитие концепции о консервативном составе белков плазмы позвоночных на примере группы Pisces
Концепция формировалась на основе результатов фракционирования плазмы разных групп позвоночных с помощью технологии электрофореза, позволившей разделить белки по величине заряда и по Mr (Gaal et al., 1970). В протеоме плазмы высших и низших позвоночных были дифференцированы фракции α-, β- и γ-глобулинов и НМ-белков; глобулины характеризуются меньшей подвижностью в электрическом поле и бóльшими величинами Mr, а НМ-белки – более высокой подвижностью в электрическом поле и меньшими величинами Mr (Tiselius, 1937; Moore, 1945; Deutsch, McShan, 1949; Gaal et al., 1970). Такой состав характерен для “истинных” белков плазмы, выполняющих в системе кровообращения специфические функции. Они представлены в плазме достаточно высокими концентрациями и имеют в структуре препробелка сигнальный пептид, определяющий конечную внеклеточную локализацию белка (Schulz, Schirmer, 1979). В плазме также присутствуют “транзитные” белки; они попадают в кровоток в результате разрушения клеток, а также из вирусов и бактерий; величины их Mr варьируют в широком диапазоне. Концентрации этих белков в плазме в норме незначительны (Anderson et al., 2004), поэтому они не вносят существенного вклада в КОД и не рассматриваются в рамках данного обзора.
Вслед за электрофоретическим фракционированием плазмы были установлены общие для всех позвоночных белки-маркеры глобулиновых фракций – иммуноглобулины, гаптоглобины, трансферрины (Larsson et al., 1985; Power et al., 2000; Wicher, Fries, 2006). С помощью 2D-электрофореза и масс-спектрометрии MALDI подтвержден высокий уровень перекрывания протеомов плазмы высших и низших позвоночных по гомологичным глобулинам (Anderson et al., 2004; Lucitt et al., 2008; Babaei et al., 2013; Li et al., 2016). Между тем, маркеры НМ-фракций, названные Alb, у млекопитающих и рыб были представлены, большей частью, разными белками. В отличие от глобулинов позвоночных, кодируемых ортологичными генами, НМ-белки высших и некоторых низших позвоночных не являются гомологами, их кодируют разные гены.
Альбумины: организация, представленность в разных группах Vertebrata. Первоначально под “альбуминами” (Alb) подразумевали осмотически активные белки, связывающие воду и имеющие более высокие по сравнению с глобулинами отрицательный заряд и подвижность в электрофорезе. Такие белки есть у всех Vertebrata. Согласно современным представлениям, под альбумином подразумевают белок из суперсемейства альбуминоидов (ALB/AFP/VDB; PDB: cl00031), состоящий из альбуминовых доменов (“Albumin domain”) и стабилизированный S–S-связями. Среди Vertebrata такие белки есть у млекопитающих, птиц, рептилий, амфибий (Li et al., 2017a), примитивных бесчелюстных миногообразных (Petromyzontiformes) (Gray, Doolittle, 1992) и у рыб – древних двоякодышащих (Dipnoi) (Metcalf et al., 2003), хрящевых ганоидов (Acipenseriformes) и низших костистых (Osteoglossiformes, Salmoniformes) (Byrnes, Gannon, 1990; Salem et al., 2010; Pasquier et al., 2016) (табл. 1).
Таблица 1.
Количество записей об альбуминах модельных видов Vertebrata – Mammalia, Pisces и Agnatha в NCBI (данные от 16.11.2020 г.)
| Таксон | Записи | Название белка по PDB |
PDB | |
|---|---|---|---|---|
| PubMed | PDB | |||
| Mammalia | ||||
| Homo sapiens | 160 064 | 887 | Human serum albumin | NP_000468.1 |
| Dipnoi | ||||
| Neoceratodus forsteri | 1 | 2 | Albumin | P83517.1 |
| Petromyzoniformes | ||||
| Petromyzon marinus | 10 | 13 | Plasma albumin, serum albumin SDS-1 |
AAB27041.1 XP_032800944.1 |
| Acipenseriformes | ||||
| Acipenser ruthenus | 1 | 6 | Serum albumin 2 | RXM99468.1 |
| Osteoglossiformes | ||||
| Scleropages formosus | – | 6 | Serum albumin-2-like | XP_018613844.1 |
| Salmoniformes | ||||
| Esox lucius Salmo salar |
16 25 |
17 20 |
Serum albumin 2 Albumin 1 |
XP_012992300.1 NP_001117137.1 |
Среди первоочередных функций альбуминов в перечисленных группах позвоночных (кроме осетрообразных, по которым сведения о функции отсутствуют) отмечены транспортная (связывание воды, неорганических катионов, жирных кислот, гормонов, билирубина, лекарств) и осмотическая (регуляция КОД (PDB NCBI: cl00031)).
Некоторые структурные характеристики альбуминов на примере модельных видов из разных групп позвоночных приведены ниже.
Mammalia. Альбумин человека (human serum albumin, HSA) состоит из 585 а.о. и имеет Mr ~ ~ 66.5 кДа (UniProtKB: P02768). Белок организован в виде трех доменов, каждый стабилизирован пятью–шестью S–S-связями (Schoentgen et al., 1986; Lichenstein et al., 1994; PDB: 5Z0B_A); всего в белке имеется 17 S–S-мостиков (Saber et al., 1977) (рис. 1). В структуре белка отсутствует углевод, что типично для альбуминов млекопитающих, а также рептилий (Metcalf et al., 1998b, 2003, 2007). НМ-фракции плазмы млекопитающих состоят только из альбумина, на его долю приходится ~60% общего белка плазмы (Anguizola et al., 2013).
Рис. 1.
Схема организации альбумина: а – альбумин миноги Petromyzon marinus в форме препептида из 1423 а.о. (GenBank: AAB27041.1), выделено семь доменов (D1–D7) с номерами а.о. (39–1415); б – альбумин лосося Salmo salar из 608 а.о., выделено три домена (D1–D3) с номерами а.о. (20–598) (XP_013998969.1); в – альбумин человека Homo sapiens, выделены три домена (D1–D3) с номерами а.о. (1–585) (Chain A, Serum albumin PDB: 5Z0B_A); г – схема расположения 12 цистеинов (С) и 6 S–S-мостиков в домене D3 HSA (EMBL-EBI: IPR014760 Serum albumin, N-terminal).
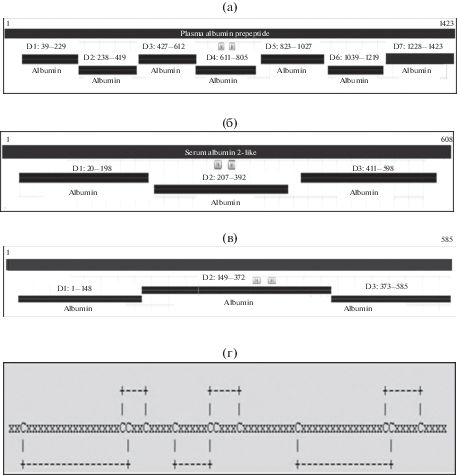
Petromyzoniformes. Альбумин миноги (препробелок) Petromyzon marinus состоит из 1423 а.о. и семи доменов (рис. 1); Mr 159.094 кДа (FASTA); белок стабилизируют 41 S-S-связь (связей). Имеет в структуре белка углеводы (NCBI: AAB27041.1; UniProtKB: Q91274).
Dipnoi. У представителя двоякодышащих – рогозуба Neoceratodus forsteri – альбумин имеет близкую к HSA величину Mr ~ 65 кДа (Metcalf et al., 2003). В структуре гомологичного альбумину человека фрагмента из 101 а.о. c Mr 11.413 кДа (FASTA) выделены два домена (Gray, Doolittle, 1992) (ALBU_NEOFS P83517.1). Не содержит углеводов в структуре белка (Metcalf et al., 2007).
Acipenseriformes. Альбумин стерляди Acipenser ruthenus состоит из 690 а.о., Mr 78.553 кДа (FASTA); организован в виде трех доменов (A0A662YVA5_ACIRT).
Osteoglossiformes. Альбумин (albumin-2-like) Scleropages formosus состоит из 610 а.о. (NCBI Reference Sequence: XP_018613844.1).
Salmoniformes. Альбумин лосося Salmo salar состоит из 608 а.о., Mr 67.151 кДа (ALBU1_SALSA P21848); белок организован в виде трех доменов и стабилизирован 18 S-S- связями (Byrnes, Gannon, 1990) (рис. 1). Альбумины других лососевых (чавычи Oncorhynchus tshawytscha и кумжи Salmо trutta) имеют близкие Sаlmo salar параметры (Byrnes, Gannon, 1990; Metcalf et al., 1998a, 1998b; Xu, Ding, 2005). Альбумины лососевых не содержат углеводов, однако, у кумжи в структуре белка выявлены сиаловые кислоты (Metcalf et al., 1998b).
В целом, у позвоночных встречаются альбумины с числом доменов от двух до десяти; у рыб описаны только одно-, двух- и трехдоменные альбумины (рис. 1), последние наиболее распространены среди Vertebrata (Li et al., 2017a).
Белковый состав НМ-фракций плазмы у костных рыб. У млекопитающих в НМ-фракциях плазмы доминирует альбумин; в электрофорезе ближе к аноду расположен еще один белок – “преальбумин”, являющийся тироксин-связывающим белком транстиретином (TTR). Однако его концентрация в плазме ≤0.04 г% (Dellière, Cynober, 2017), что не предполагает существенного вклада этого белка в осмоляльность плазмы.
У осетрообразных Acipenseriformes (Chondrostei) в составе НМ-фракций плазмы обнаружены только альбумины (Кузьмин, 1996; Кузьмин, Кузьмина, 2005). У низших Teleostei в составе НМ-фракции наряду с альбуминами (Byrnes, Gannon, 1990; Metcalf et al., 1998а, 1998b, 1999) обнаружены другие белки (Андреева и др., 2015), которые доминируют в НМ-фракциях плазмы у высших Teleostei (табл. 2).
Таблица 2.
Белки, доминирующие в НМ-фракции плазмы Teleostei, элементы их структуры и функций на примере модельных видов по UniProtKB и PDB NCBI
| Белок, суперсемейство по PDB |
Модельный вид по UniProtKB (a.o.; Mr, Да)* | Функция по UniProtKB/PDB |
|---|---|---|
| Белок тепловой акклимации (Wap65), Hemopexin (cl024 71) |
Cyprinus carpio A0A2K8J325_CYPCA (445 а.о.; 50503) |
Транспорт гема из плазмы в печень; реакция на воспаление, бактериальные и вирусные инфекции |
| Серпины (Spi), Serine Proteinase Inhibitors – Serpin (cl38926) |
Danio rerio Q7ZVL5_DANRE (395 а.о.; 43776) |
Ингибируют сериновые протеазы, регулируют свертываемость крови; участвуют в фолдинге белков, транспорте гормонов, иммунной защите |
| Фетуины (Fet), CY – Cystatin (cl09238) |
Danio rerio E7FE90_DANRE (499 а.о.; 56750) |
Ингибируют цистеиновые протеазы; участвуют в иммунной защите; контролируют клеточный рост |
| Аполипопротеин АI (АpoАI), A1/A4/E domain – Apolipoprotein (cl27567) |
Danio rerio APOA1_DANRE O42363 (262 а.о.; 30256) |
Связывает и транспортирует липиды в составе липопротеинов высокой плотности (HDL) |
| Аполипопротеин AII (ApoАII), ApoA-II (cl04697) |
Danio B3DFP9_DANRE 141 а.о.; 15537 |
Входит в состав HDL и может замещать АроА-I в HDL; проявляет антибактериальную активность |
Белок тепловой акклимации – “warm temperature acclimated 65 kDa protein” или Wap65. Гомологичен гемопексину (Нх) млекопитающих. Основные функции – связывание “отработанного” гема, попавшего в плазму при деструкции гем-содержащих белков, и транспортировка его в печень. Установлена его роль в воспалении как белка острой фазы (Diaz-Rosales et al., 2014), титр белка в плазме меняется при повышении температуры и бактериальной и вирусной инфекциях (Sha et al., 2008; Sarropoulou et al., 2010; Cho et al., 2012).
Ингибиторы сериновых протеиназ серпины – Serpin или Spi. Регулируют различные физиологические процессы, реагируют на воспаление и вирусный патогенез; представлены нативной ингибирующей и неактивной (неингибирующей) формами (Janciauskiene, 2001).
Ингибиторы цистеиновых протеиназ фетуины – Fetuin или Fet. Обнаружены в семенной плазме радужной форели Oncorhynchus mykiss (Nynca et al., 2011), в плазме карповых рыб (Andreeva et al., 2015, 2019; Андреева, 2020). Участвуют в остром воспалении, иммунном ответе на бактериальные инфекции и органогенезе (Liu et al., 2016, 2017b).
Аполипопротеины АроА-I и Аро-14 (“14 kDa apolipoprotein”) гомологичны аполипопротеинам А-I и A-II млекопитающих соответственно (Choudhury et al., 2009; Dietrich et al., 2015). Оба белка входят в состав HDL, участвуют в транспорте липидов к клеткам, регулируют отток холестерина от клеток. В составе HDL, АроА-I выполняет роль кофактора лецитинхолестерин-ацилтрансферазы (LCAT, КФ 2.3.1.43), структурной основы HDL и лиганда для связывания с рецепторами (Teramoto, 1994; Lamant et al., 2006). Аро-II может замещать АроА-I в HDL (Ibdah et al., 1989; Saito et al., 2004).
Wap65, Spi, Fet и Apo обнаружены в разных тканях Teleostei (Tsai et al., 2004; Braceland et al., 2013; Low et al., 2013; Dietrich et al., 2015). Но только в плазме их общая доля в составе НМ-фракций может достигать 50% от тотального белка плазмы: ~20% приходится на Wap65 + Ihn и ~33–36% на аполипопротеины в составе HDL (Andreeva, 2019). У Salmonidae доля HDL от общего белка плазмы (~36%) (Babin, Vernier, 1989) может даже превышать долю сывороточного альбумина (~25–28%) (Шульман, 1978; Metcalf et al., 1998а, 1998b; Byrnes, Gannon, 1990; Xu, Ding, 2005).
Развитие концепции о крупномономерной организации белков плазмы на примере группы Teleostei
Концепция формировалась на основе сведений о структуре белков плазмы человека (Schulz, Schirmer, 1979). Мономерными называют белки из одной полипептидной цепи, (например, альбумины) или белки из нескольких цепей, связанных ковалентно (например, иммуноглобулины, в структуре которых Н- и L-цепи связаны ковалентно). Олигомерные белки состоят из нескольких цепей, связанных друг с другом нековалентно. Под влиянием ряда факторов они могут распадаться на субъединицы, которые с легкостью фильтруются в интерстиций, по этой причине белки–олигомеры не считаются надежными факторами КОД.
Для реализации осмотической функции требуется преимущественное нахождение белков внутри сосудов, хотя бы в течение некоторого времени. Таким свойством обладают только достаточно крупные белковые молекулы с Mr ≥ 60 кДа и “неделимой” структурой; именно так организованы белки плазмы Mammalia.
В отличие от Mammalia, НМ-фракции плазмы Teleostei содержат высокий титр олигомерных структур. В виде олигомерных комплексов организованы аполипопротеины АроА-I и Аро-14 (Аро-II) в составе HDL, где они ассоциированы с липидами. Их стехиометрию можно представить как [(ApoAI)n(Apo14)m]Lp, где n, m – степень олигомеризации белков, а Lp – липиды (Андреева, 2017; Andreeva, 2019; Андреева, 2020). HDL доминируют в плазме костистых рыб, их концентрация более чем в 3 раза превышает содержание HDL в плазме человека (Babin, Vernier, 1989; Stoletov et al., 2009).
Организация протеома плазмы рыб и концепция критической солености В.В. Хлебовича
Теоретические основы влияния КС на разные уровни биологической интеграции разработаны в виде концепции критической солености (Хлебович, 1974). Она рассматривает КС как область раздела пресноводной и морской фаун, при переходе через которую параметры биологических систем меняются нелинейно. Критической областью является диапазон солености 5–8‰, в котором еще сохраняется целостность биохимических структур, но при снижении солености ниже этого интервала их стабильность нарушается. Автор концепции отмечает, что соленость внешней среды, в которой формировались предки низших организмов, не имевшие настоящей внутренней среды, была, предположительно, несколько выше 5–8‰ и приближалась к 10‰. Поэтому формирование биохимических структур и метаболизм у первичных пойкилосмотических форм происходили, предположительно, при солености ~10‰. От этих форм произошли организмы с настоящей внутренней средой, в том числе и организмы с гиперосмотической регуляцией, колонизировавшие пресные воды и сохранившие внутреннюю соленость ~10‰. Они дали начало наземным организмам, гипоосмотическим морским и ультрагалинным организмам, а также вторично-морским пойкилосмотическим организмам, поддерживающим осмотический гомеостаз за счет минеральной и органической фракций (Хлебович, 1974).
При оценке границ КС тестируемого вида учитываются оптимальные границы солености для процессов оплодотворения и для обитания молоди и половозрелых форм. Например, для пресноводных Teleostei они варьируют от 5–8 до 7–10‰ и от 10 до 12‰ и даже 16‰ соответственно (Мартемьянов, 1989; Martemyanov, Borisovskaya, 2012). В применении к белкам жидкой среды организма водных пойкилотермных область КС проявляет себя как барьер, при пересечении которого меняется стабильность белков. Это доказано опытами in vitro, в которых разведенные образцы плазмы и гемолимфы организмов мутнели при снижении солености за границы КС (Хлебович, 1974). В качестве возможных мишеней КС автором отмечены белковые комплексы, реакции которых на изменение солености могли бы реализоваться в их перестройках по типу распада или ассоциации. Последующие исследования в экспериментах in vivo подтвердили это предположение. Так, на примере молоди и половозрелых пресноводных костистых рыб – серебряных карасей, плотвы и леща, – акклимированных к условиям КС и вновь помещенных в пресную воду, показано, что их сывороточные комплексы (HDL) претерпевают обратимые структурные реорганизации, диссоциируя в соленой воде и ассоциируя в исходные структуры при возвращении рыб в пресную воду (Andreeva, 2010; Andreeva et al., 2019; Андреева, 2020). Функциональный эффект распада олигомерных структур (HDL) может заключаться в повышении общего количества осмотически активных частиц в плазме, росте ее осмоляльности и, как следствие, в дополнительной “накачке” воды в организм акклимированных к КС рыб (Андреева, 2020).
Другим аспектом развития концепции КС в применении к белкам рыб является обнаружение разного профиля белок–белковых взаимодействий в составе протеома плазмы у морских и пресноводных Teleostei, проявляющегося в разном балансе мономерных и олигомерных белков (Андреева, 2017; Andreeva, 2019; Андреева, 2020). Объяснение этому феномену дает эволюционная модель протеома плазмы Pisces.
Эволюционная модель протеома плазмы Pisces
В вопросе о происхождении последнего общего предка всех рыб до сих пор не достигнута ясность. Разные авторы сходятся на том, что осмолярность внутренней среды в кладе “Teleostei – Tetrapoda” составляла ~9 или 10‰, что может указывать на пресноводное или мезогалинное происхождение данной группы (Хлебович, 1974; Halstead, 1985; Evans, Claiborne, 2009).
Представленная в данном обзоре эволюционная модель разработана для предков позвоночных с настоящей внутренней средой соленостью ~9–10‰ и гиперосмотической регуляцией в соответствии с концепцией критической солености (Хлебович, 1974). Она регламентирует основные этапы становления протеома плазмы в виде разных сценариев его преобразований, касающихся белок–белковых взаимодействий, учитывая их согласованность с изменениями солености окружающей и внутренней среды. Модель рассматривает исходный анцестральный (А) тип протеома у организмов без настоящей внутренней среды в виде слабо ассоциированных друг с другом полипептидных цепей (рис. 2).
Рис. 2.
Гипотетическая схема эволюции протеома внутренней жидкой среды организма от анцестрального (А-типа) к пресноводному (П-типу), морскому (М-типу) и наземному типу, согласованная со схемой основных путей эволюции соленостных отношений животных и среды (Хлебович, 1974). В соответствии с ней предполагается наличие промежуточных форм: 1 – первичные пойкилоосмотичные организмы без настоящей внутренней среды, протеом А-типа из слабо ассоциированных белков; 2 – предок с настоящей внутренней средой и гиперосмотической регуляцией, П-тип протеома, доминируют олигомеры, есть альбумин; 3 – низшие Teleostei с гиперосмотической регуляцией; П-тип протеома, доминируют олигомеры, есть альбумин; 4 – высшие Teleostei с гиперосмотической регуляцией, П-тип протеома, доминируют олигомеры, нет альбумина; 5 – высшие Teleostei с гипоосмотической регуляцией, М-тип протеома, доминируют мономеры; нет альбумина; 6 – Mammalia, в протеоме доминируют альбумины. Тонкие стрелки – направление преобразований протеома; TGD (teleost genome duplication) – событие полногеномной дупликации.
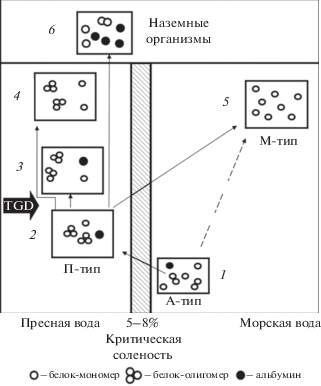
Эти исходные формы дали начало организмам с настоящей внутренней средой и гиперосмотической регуляцией. В условиях пресных вод содержание Na+ во внутренней среде этих организмов поддерживалось, вероятно, на уровне 140–150 моль/кг, отмеченном у современных пресноводных костистых рыб (Мартемьянов, 1992). При таком уровне Na+ белки внутренней среды могли объединяться в олигомерные комплексы; это способствовало снижению КОД и стабилизировало водный баланс организма в условиях гипотоничной по отношению к нему внешней среды. Тип протеома жидкой среды организма с преобладанием олигомерных структур назван ассоциированным или пресноводным (П). Высокое содержание олигомеров (HDL) в плазме современных пресноводных Teleostei согласуется с данной моделью (Andreeva, 2010, 2012, 2019).
При попадании предковых форм в условия повышенной солености могла быть задействована другая стратегия – распад белковых ассоциатов на отдельные мономерные белки. Она могла реализоваться у форм с гипоосмотической осморегуляцией. Содержание Na+ в их внутренней среде было выше, чем у пресноводных рыб, и, вероятно, поддерживалось на уровне 180–250 или моль/кг, отмеченном у современных морских Teleostei (Martemyanov, 2020). Повышенное содержание Na+ поддерживало мономерную организацию их белков плазмы. Такая организация протеома внутренней среды способствовала росту КОД и общего осмотического давления плазмы, а, следовательно, защите организма от обезвоживания. Тип протеома внутренней среды организма с преобладанием мономерных белков был назван диссоциированным или морским (М). Высокие уровни гетерогенности НМ-фракций плазмы у современных морских Teleostei, обилие мономерных белков и нестабильное присутствие в них олигомерных структур (HDL) согласуются с данной моделью (Andreeva, 2010, 2012, 2019; Андреева и др., 2015; Андреева, 2017).
Различия между разными типами протеомов эволюционная модель объясняет разными сценариями расселения предков рыб. Большинство исследователей сходится на том, что смена соленостных условий происходила в несколько этапов. Рассмотрим один из вероятных сценариев: первые древние рыбы появились в соленых (Nelson et al., 2006) или солоноватых (Хлебович, 1974) водах; на следующем этапе (до появления Аctinopterygii) они освоили пресные воды, а во время второй волны экспансии морей (после появления Teleostei) – высокосоленые акватории. Обозначив солоноватые, пресные и морские воды как СВ, ПВ и МВ соответственно, этапы расселения исходных форм и предков Pisces из солоноватых в пресные, из пресных в морские и из солоноватых в морские можно обозначить как СВ → ПВ, ПВ → МВ и СВ → МВ. При смене солености организмы оказывались перед проблемой адаптации внутренней среды к осмотическим условиям внешней среды на основе сформированного типа протеома плазмы – анцестрального (А) или пресноводного (П), поэтому при изменении солености СВ → ПВ, ПВ → МВ и СВ → МВ соответствующие преобразования протеомов можно представить как A → П и П → М и А → М (рис. 2).
События предположительно третьей полногеномной дупликации WGD (whole genome duplication), коснувшиеся из позвоночных только костистых рыб (teleost genome duplication, TGD), стали возможной причиной потери в группе высших Teleostei белка альбумина (Noel et al., 2010; Braasch et al., 2016; Pasquier et al., 2016). По этой причине ключевыми факторами баланса внеклеточной жидкости организма у костистых рыб стали другие белки, присутствующие в плазме, предположительно – Wap65, Spi, Fet и Apo (в составе HDL). В то же время, наземные позвоночные, взявшие начало от примитивных пресноводных предков с гиперосмотической регуляцией, выстроили систему поддержания осмотического гомеостаза внутри организма на основе альбумина (рис. 2).
Таким образом, наличие или отсутствие альбумина в плазме современных Teleostei эволюционная гипотеза объясняет событиями WGD, разный состав заменивших альбумин НМ-белков (Wap65, Spi, Fet, Аро) – особенностями метаболизма в водной среде, интенсивность которого различается в пресной и соленой воде (Tarallo et al., 2016), а разный баланс мономерных и олигомерных белков в плазме современных пресноводных и морских костистых рыб – разными соленостными условиями среды, в которой формировались предковые формы. По-видимому, заменившие альбумин белки плазмы костистых рыб должны были соответствовать определенным критериям осмотически активных белков, чтобы выполнять осмотическую функцию связывания воды и контроля баланса внеклеточной жидкости в организме.
В отличие от специализированного осмотически активного альбумина млекопитающих, белки Wap65, Inh и HDL-частицы выполняют в организме рыб, прежде всего, функции транспорта и иммунной защиты. Их высокий титр в плазме обусловлен востребованностью, прежде всего, этих функций: HDL требуется для транспорта липидов, лежащих в основе энергетики рыб; Wap65 необходим для утилизации гема и в реакциях организма на воспаление и инфекции (бактериальные и вирусные), Inh также участвуют в иммунном ответе организма на вирусные и бактериальные инфекции (табл. 2). Высокое содержание в плазме позволяет этим белкам участвовать и в осморегуляции, создавая КОД в соответствии с уравнением Вант-Гоффа для коллоидных растворов:
π = (c/M) × RT,
где π – осмотическое давление, с – концентрация частиц в коллоидном растворе, M – молекулярная масса белка, R – универсальная газовая постоянная, Т – температура (Детлаф, Яворский, 1989). Согласно уравнению, бóльший вклад в КОД вносят белки с меньшими размерами и бóльшей концентрацией. Величины Mr для Wap65 и Inh (~40–70 кДа) сопоставимы с Mr альбумина (~66.5 кДа), а размеры HDL (~5–14 нм) сопоставимы с размерами альбуминовых глобул (~4–14 нм) (Kragh-Hansen, 1990); общая концентрация этих белков в плазме рыб достигает почти 50%. Таким образом, данные белки удовлетворяют критериям осмотически активных белков и, следовательно, способны заменить альбумин в части создания необходимого для жизнедеятельности уровня КОД.
Способы проявления осмотической активности белками плазмы в формате “безальбуминовой” гипотезы капиллярного обмена. Стратегии организации осмотически активной части протеома плазмы рыб
Белковый состав осмотически активных фракций и содержание белка в интерстиции у млекопитающих и рыб различны – у Mammalia концентрация белка в интерстиции значительно уступает таковой в плазме, а у рыб она варьирует в широком диапазоне значений (Hargens et al., 1974; Olson et al., 2003; Andreeva et al., 2017, 2019), в результате осмотический эффект белков плазмы реализуется по-разному.
Будучи локализованными преимущественно внутри сосудов, белки плазмы Mammalia, половина которых приходится на альбумин, создают незначительный перевес неорганических катионов (прежде всего, Na+) в плазме, по сравнению с интерстициальной жидкостью (эффект Гиббса–Даннона), в результате чего осмоляльность плазмы незначительно превосходит осмоляльность интерстициальной жидкости (Nguyen, Kurtz, 2006). Поскольку структура альбумина идеально приспособлена для удержания неорганических катионов по причине высокой концентрации поверхностного отрицательного заряда и отсутствия углеводов, то она способна связать и удержать достаточно диполей воды во внутрисосудистом пространстве для создания и поддержания КОД. Альбумин млекопитающих, будучи специализированным осмотически активным белком плазмы, обеспечивает до 80% ее осмотического эффекта (Levitt, Levitt, 2016).
“Безальбуминовая” модель капиллярного обмена рыб рассматривает в качестве основного белкового фактора поддержания баланса внеклеточной жидкости в организме не альбумин, а другие белки НМ-фракций плазмы рыб – Wap65, Inh, HDL (а также альбумины в группе низших Teleostei) (Андреева, 2020). Проявление осмотической активности белками плазмы рыб происходит по сценарию, отличному от такового Mammalia, из-за присутствия белка в интерстиции. У рыб концентрация белка в интерстициальной жидкости подвержена сильному колебанию. Так, у серебряного карася наиболее низкие концентрации белка в интерстиции отмечены в условиях голодания; сопоставимые с плазмой – в период нагула, превосходящие плазму – в преднерестовый период (Andreeva et al., 2019). Находясь по обе стороны капиллярной стенки, белки реагируют на изменения температуры (и/или солености) окружающей их микросреды изменением степени ионизации поверхностных аминокислотных остатков, в результате чего меняется взаимодействие белков с небольшими осмолитами, например амфифильными дипептидами, и профиль белок–белковых взаимодействий. Присутствие олигомерных структур (олигомерных аполипопротеинов, ассоциированных с липидами в составе HDL) по обе стороны капиллярной стенки и их способность к ассоциации/диссоциации облегчают задачу “выравнивания” осмотических концентраций жидкостей и поддержания их изотонии (Андреева, 2020). Отмеченный выше высокий титр олигомерных структур в крови Teleostei предполагает и их высокий вклад в осморегуляцию. Согласно “безальбуминовой” модели, даже при наличии в плазме рыб альбумина, его осмотическая активность на фоне обилия белка в интерстиции не будет столь эффективной как у млекопитающих (Андреева, 2020).
Описанные в эволюционной модели типы протеомов плазмы – ассоциированный (пресноводный) и диссоциированный (морской) – можно рассматривать как стратегии организации белков плазмы в пресной и соленой воде у костистых рыб с гипер- и гипоосмотичной осморегуляцией. Учитывая особенности организации осмотитически активных белковых фракций плазмы рыб, можно предположить широкий спектр возможностей адаптации их внутренней среды к условиям внешней среды благодаря варьированию состава и относительного содержания отдельных белков и балансу мономерных и олигомерных белков. Наращивая титр востребованных в метаболизме белков, удовлетворяющих критериям осмотической активности, рыбы оказались достаточно пластичными в адаптациях к меняющимся условиям среды, что проявилось в их успешном расселении по разнообразным акваториям.
Особое место в стабилизации водного баланса в организме рыб “безальбуминовая” модель отводит HDL. Их основная функция заключается в транспорте липидов, однако, имеющиеся в литературе данные указывают на их участие в иммунной защите и регенерации (Harel et al., 1990; Ndiaye et al., 2000; Concha et al., 2003, 2004; Braceland et al., 2013). Анализ реорганизаций HDL по типу ассоциации/диссоциации по разные стороны капиллярной стенки у рыб в природных условиях и в условиях экспериментальной солености показал их направленность на поддержание изотонии внеклеточных жидкостей в организме рыб (Andreeva et al., 2019; Андреева, 2020) и, следовательно, на осморегуляторную функцию.
ЗАКЛЮЧЕНИЕ
Анализ разнообразия осмотически активных белковых фракций плазмы в группе Pisces выявил, с одной стороны, их отличия от высших позвоночных, а с другой стороны, – различия внутри самой группы. От млекопитающих их отличает “расширенный” белковый состав фракции, отсутствие альбумина (“безальбуминовая” гипотеза капиллярного обмена (Андреева, 2020)) или его слабая роль в поддержании осмотического гомеостаза. Группа Teleostei оказалась неоднородной по наличию альбумина; кроме того, у пресноводных и морских рыб выявлены различия в профиле белок–белковых взаимодействий и широкий диапазон варьирования концентрации белка в интерстиции. К факторам, определившим эти черты, можно отнести зависимый от среды характер обменных процессов у низших пойкилотермных Vertebrata, отсутствие антигравитационных приспособлений сердечно-сосудистой системы (Olson et al., 2003) и настоящей лимфатической системы (Koltowska et al., 2013).
В эволюционной модели важная роль в организации протеома внутренней среды отводится концентрации натрия, модулирующему профиль белок–белковых взаимодействий. Модель объясняет этот феномен воздействием сильного электролита (NaCl) на слабые полиэлектролиты (белки) и титром Na+ во внутренней среде (Андреева, 2020). Эти предположения подтверждаются сведениями о разном балансе мономерных и олигомерных белков в плазме пресноводных и морских Teleostei (Андреева, 2017), имеющих разные концентрации Na+ в плазме (Мартемьянов, 1992; Martemyanov, 2020).
Назначение осмотически активных белков плазмы заключается в эффективном связывании воды внутри сосудов, поддержании их волемии и КОД плазмы. У пресноводных Teleostei более низкий, по сравнению с морскими видами, уровень Na+ в плазме поддерживает преобладание в ней олигомерных структур, содержание фракции связанной воды при этом варьирует от 0.5 до 2.5% (Мартемьянов, 1992, 2014; Андреева, 2017). У морских рыб более высокий по сравнению с пресноводными видами уровень Na+ в плазме поддерживает преобладание в ней мономерных белков; содержание связанной воды составляет 1.2–2.0% (Андреева, 2017; Martemyanov, 2020). Таким образом, относительно стабильный уровень связывания воды коллоидами плазмы в сосудах в условиях разного содержания в ней натрия достигается у пресноводных и морских рыб разными стратегиями организации осмотически активной части протеома.
В формате обновленной гипотезы Старлинга, слабая выраженность эффекта Гиббса–Доннана (из-за наличия белка в интерстции) не дает представления о степени участия белков плазмы рыб в поддержании осмотического гомеостаза (Olson, 1992). “Безальбуминовая” модель объясняет вклад белков плазмы рыб в осморегуляцию их структурными реорганизациями по типу ассоциаций/диссоциаций, взаимодействием с небольшими осмолитами небелковой природы, направленными на поддержание изотонии внеклеточных жидкостей рыб в широком диапазоне варьирования средовых факторов (Андреева, 2020).
Рассматривая анцестральный тип протеома внутренней среды организма у предков рыб как исходную для всех позвоночных динамичную и способную к перестройкам “платформу”, эволюционная модель выводит из нее все возможные способы организации протеомов плазмы, включая осмотически активные фракции, в разных группах Vertebrata. Анализ этих стратегий в низших таксонах имеет прямое отношение к проблеме эволюционного становления капиллярного обмена как основы осмотического гомеостаза у всех позвоночных.
Список литературы
Андреева А.М. 2017. Стехиометрия белковых агрегатов плазмы рыб // Тр. Инст. биол. внутр. вод РАН. Вып. 80(83). С. 5. https://www.elibrary.ru/download/elibrary_29871197_74751717.pdf
Андреева А.М. 2020. Структурная организация белков плазмы как фактор капиллярной фильтрации в группе Pisces // Биология внутренних вод. № 6. С. 600.https://doi.org/10.31857/S0320965220060030
Андреева А.М., Рябцева И.П., Федоров Р.А. 2015. Организация белковых комплексов плазмы у костистых рыб // Тр. Инст. биол. внутр. вод РАН. Вып. 72(75). С. 5. https://ibiw.ru/scan/upload/112532.pdf
Детлаф А.А., Яворский Б.М. 1989. Курс физики: Учеб. пособ. для вузов. Москва: Высшая школа.
Кирпичников В.С. 1987. Генетика и селекция рыб. Ленинград: Наука.
Кузьмин Е.В. 1996. Альбуминовая система сыворотки крови осетрообразных в речной период жизни // Вопр. ихтиол. Т. 36. № 1. С. 101.
Кузьмин Е.В., Кузьмина О.Ю. 2005. Популяционный анализ электрофоретической изменчивости альбуминов сыворотки крови европейской (A. ruthenus L.) и сибирской (A. ruthenus marsiglii Brandt.) стерляди // Генетика. Т. 41. № 2. С. 246.
Мартемьянов В.И. 1989. Влияние солености на пресноводных рыб // Зоол. журн. Т. LXVIII. Вып. 5. С. 72.
Мартемьянов В.И. 1992. Содержание катионов в плазме, эритроцитах и мышечной ткани рыб Волжского плеса Рыбинского водохранилища // Журн. эвол. биохим. и физиол. Т. 28. № 5. С. 576.
Мартемьянов В.И. 2014. Методы определения общей, свободной и связанной фракций воды в организме и тканях гидробионтов // Вода: химия и экология. № 2. С. 86.
Хлебович В.В. 1974. Критическая соленость биологических процессов. Ленинград: Наука.
Шульман Г.Е. 1978. Элементы физиологии и биохимии общего и активного обмена у рыб. Киев: Наукова думка.
Anderson N.L., Polanski M., Pieper R. et al. 2004. The human plasma proteome: a nonredundant list developed by combination of four separate sources // Mol. Cell. Proteomics. V. 3. P. 311. https://doi.org/10.1074/mcp.M300127-MCP200
Andreeva A.M. 2010. The role of structural organization of blood plasma proteins in the stabilization of water metabolism in bony fish (Teleostei) // J. Ichthyol. V. 5. № 7. P. 552. https://doi.org/10.1134/S0032945210070076
Andreeva A.M. 2012. Structural and functional organization of fish blood proteins. New York: Nova Science Publ.
Andreeva A.M. 2019. The Strategies of Organization of the Fish Plasma Proteome: with and without Albumin // Russ. J. Mar. Biol. V. 45. № 4. P. 263. https://doi.org/10.1134/S1063074019040023
Andreeva A.M., Lamas N.E., Serebryakova M.V. et al. 2015. Reorganization of low-molecular-weight fraction of plasma proteins in the annual cycle of cyprinidae // Biochemistry. V. 80. P. 208. https://doi.org/10.1134/S0006297915020078
Andreeva A.M., Serebryakova M.V., Lamash N.E. 2017. Oligomeric protein complexes of apolipoproteins stabilize the internal fluid environment of organism in redfins of the Tribolodon genus [Pisces; Cypriniformes, Cyprinidae] // Comp. Biochem. Physiol., Part D: Genomics Proteomics. V. 22. P. 90. https://doi.org/10.1016/j.cbd.2017.02.00
Andreeva A.M., Vasiliev A.S., Toropygin I.Yu. et al. 2019. Involvement of apolipoprotein A in maintaining tissue fluid balance in goldfish Carassius auratus // Fish Physiol. Biochem. V. 45. № 5. P. 1717. https://doi.org/10.1007/s10695-019-00662-1
Andreeva A.M., Toropygin I.Yu., Garina D.V. et al. 2020. The Role of High_Density Lipoproteins in Maintaining Osmotic Homeostasis in the Goldfish Carassius auratus L. (Cyprinidae) // J. Evol. Biochem. Physiol. V. 56. № 2. P. 102. https://doi.org/10.1134/S0022093020020027
Anguizola J., Matsuda R., Barnaby O.S. et al. 2013. Review: Glycation of human serum albumin // Clin. Chim. Acta. V. 425. P. 64. https://doi.org/10.1016/j.cca.2013.07.013
Babaei F., Ramalingam R., Tavendale A. et al. 2013. Novel blood collection method allows plasma proteome analysis from single zebrafish // J. Proteome Res. V. 12. № 4. P. 1580. https://doi.org/10.1021/pr3009226
Babin P.J., Vernier J.M. 1989. Plasma lipoproteins in fish // J. Lipid Res. V. 30. P. 467. https://www.jlr.org/content/30/4/467.long
Ballantyne J.S. 2016. Some of the most interesting things we know, and don’t know, about the biochemistry and physiology of elasmobranch fishes (sharks, skates and rays) // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. V. 199. P. 21. https://doi.org/10.1016/j.cbpb.2016.03.005
Braasch I., Gehrke A.R., Smith J.J. et al. 2016. The spotted gar genome illuminates vertebrate evolution and facilitates human-teleost comparisons // Nat. Genet. V. 48. № 4. P. 427. https://doi.org/10.1038/ng.3526
Braceland M., Bickerdike R., Tinsley J. et al. 2013. The serum proteome of Atlantic salmon, Salmo salar, during pancreas disease (PD) following infection with salmonid alphavirus subtype 3 (SAV3) // J. Proteomics. V. 94. P. 423.
Byrnes L., Gannon F. 1990. Atlantic salmon (Salmo salar) serum albumin: cDNA sequence, evolution, and tissue expression // DNA Cell Biol. V. 9. № 9. P. 647. https://doi.org/10.1089/dna.1990.9.647
Cho Y.S., Kim B.S., Kim D.S. et al. 2012. Modulation of warm-temperature acclimation- associated 65-kDa protein genes (Wap65-1 and Wap65-2) in mud loach (Misgurnus mizolepis, Cypriniformes) liver in response to different stimulatory treatments // Fish Shellfish Immunol. V. 32. 662e9.
Choudhury M., Yamada S., Komatsu M. et al. 2009. Homologue of mammalian apolipoprotein A-II in non-mammalian vertebrates // Acta Biochim. Biophys. Sin. (Shanghai). V. 41. № 5. P. 370.
Concha M.I., Molina S., Oyarzun C. et al. 2003. Local expression of apolipoprotein A-I gene and a possible role for HDL in primary defence in the carp skin // Fish Shellfish Immunol. V. 14. № 3. P. 259. https://doi.org/10.1006/fsim.2002.0435
Concha M.I., Smith V.J., Castro K. et al. 2004. Apolipoproteins AI and A-II are potentially important effectors of innate immunity in the teleost fish Cyprinus carpio // Eur. J. Biochem. V. 271. № 14. P. 2984. https://doi.org/10.1111/j.1432-1033.2004.04228.x
Dellière S., Cynober L. 2017. Is transthyretin a good marker of nutritional status? // Clinical Nutrition. V. 36(2). P. 364.
Deutsch H.F., McShan W.H. 1949. Biophysical studies of blood plasma proteins; electrophoretic studies of the blood serum proteins of some lower animals // J. Biol. Chem. V. 180. № 1. P. 219. https://pubmed.ncbi.nlm.nih.gov/18133388
Diaz-Rosales P., Pereiro P., Figueras A. et al. 2014. The warm temperature acclimation protein (Wap65) has an important role in the inflammatory response of turbot (Scophthalmus maximus) // Fish Shellfish Immunol. V. 41(1). P. 80. https://doi.org/10.1016/j.fsi.2014.04.012
Dietrich M.A., Nynca J., Adamek M. et al. 2015. Expression of apolipoprotein A-I and A-II in rainbow trout reproductive tract and their possible role in antibacterial defence // Fish Shellfish Immunol. V. 45. P. 750.
Evans D.H., Claiborne J.B. 2009. Osmotic and ionic regulation in fishes // Osmotic and Ionic Regulation. P. 295. Boca Raton: Taylor and Francis Group.
Gaal O., Medgyesi G.A., Vereczkey L. 1980. Electrophoresis in the Separation of Biological Macromolecules. Budapest (Akadémia Kiadó).
Gray J.E., Doolittle R.F. 1992. Characterization, primary structure, and evolution of lamprey plasma albumin // Protein Sci. V. 1(2). P. 289. https://doi.org/10.1002/pro.5560010211
Halstead L.B. 1985. The vertebrate invasion of fresh water // Philos. Trans. R. Soc. Part B: Biol. Sci. V. 309. P. 243.
Harel A., Fainaru M., Rubinstein M. et al. 1990. Fish apolipoprotein-A-I has heparin binding activity: implication for nerve regeneration // J. Neurochem. V. 55. № 4. P. 1237. https://doi.org/10.1111/j.1471-4159.1990.tb03130.x
Hargens A.R., Millard R.W., Johansen K. 1974. High capillary permeability in fishes // Comp. Biochem. Physiol. V. 48A. P. 675.
Ibdah J.A., Krebs K.E., Phillips M.C. 1989. The surface properties of apolipoproteins A-I and A-II at the lipid/water interface // Biochim. Biophys. Acta. V. 1004. № 3. P. 300.
Janciauskiene S. 2001. Conformational properties of serine proteinase inhibitors (serpins) confer multiple pathophysiological roles // Biochim. Biophys. Acta. V. 1535(3). P. 221. https://doi.org/10.1016/s0925-4439(01)00025-4
Koltowska K., Betterman K.L., Harvey N.L., Hogan B.M. 2013. Getting out and about: the emergence and morphogenesis of the vertebrate lymphatic vasculature // Development. V. 140. P. 1857. https://doi.org/10.1242/dev.089565
Kragh-Hansen U. 1990. Structure and ligand binding properties of human serum albumin // Dan. Med. Bull. V. 37. № 1. P. 57. https://pubmed.ncbi.nlm. nih.gov/2155760
Lamant M., Smih F., Harmancey R. et al. 2006. ApoO, a novel apolipoprotein, is an original glycoprotein up-regulated by diabetes in human heart // J. Biol. Chem. V. 281. № 47. P. 36289.
Larsson M., Pettersson T., Carlstrom A. 1985. Thyroid hormone binding in serum of 15 vertebrate species: isolation of thyroxine-binding globulin and prealbumin analogs // Gen. Comp. Endocrinol. V. 58. № 3. P. 360.
Levitt D., Levitt M. 2016. Human serum albumin homeostasis: a new look at the roles of synthesis, catabolism, renal and gastrointestinal excretion, and the clinical value of serum albumin measurements // Int. J. Gen. Med. V. 9. P. 229. https://doi.org/10.2147/IJGM.S102819
Li C., Tan X.F., Lim T.K. et al. 2016. Comprehensive and quantitative proteomic analyses of zebrafish plasma reveal conserved protein profiles between genders and between zebrafish and human // Sci. Rep. V. 6. № 24329. P. 1. https://doi.org/10.1038/srep24329
Li S., Cao Y., Geng F. 2017a. Genome-wide identification and comparative analysis of albumin family in vertebrates // Evol. Bioinf. Online. V. 13. P. 1. https://doi.org/10.1177/1176934317716089
Li C., Gao C., Fu Q. et al. 2017b. Identification and expression analysis of fetuin B (FETUB) in turbot (Scophthalmus maximus L.) mucosal barriers following bacterial challenge // Fish & Shellfish Immunol. V. 68. P. 386.
Lichenstein H.S., Lyons D.E., Wurfel M.M. et al. 1994. Afamin is a new member of the albumin, alpha-fetoprotein, and vitamin D-binding protein gene family // J. Biol. Chem. V. 269. № 27. P. 18149.
Liu F., Su B., Gao C. et al. 2016. Identification and expression analysis of TLR2 in mucosal tissues of turbot (Scophthalmus maximus L.) following bacterial challenge // Fish Shellfish Immunol. V. 55. 654e661.
Low C.F., Shamsudin M.N., Chee H.Y. et al. 2013. Putative apolipoprotein A-I, natural killer cell enhancement factor and lysozyme g are involved in the early immune response of brown-marbled grouper, Epinephelus fuscoguttatus, Forskal, to Vibrio alginolyticus // J. Fish Dis. V. 37. № 8. P. 693.
Lucitt M.B., Price T.S., Pizarro A. et al. 2008. Analysis of the zebrafish proteome during embryonic development // Mol. Cell. Proteomics. V. 7. № 5. P. 981. https://doi.org/10.1074/mcp.M700382-MCP200
Martemyanov V.I. 2020. Indicators of Osmotic and Ion Regulation in the Fish of the White Sea // J. Ichthyol. V. 60. № 2. P. 305. https://doi.org/10.1134/S0032945220020101
Martemyanov V.I., Borisovskaya E.V. 2012. Indices of salt and water metabolism in tubenose goby Proterorhinus marmoratus Pallas, introduced into Rybinsk Reservoir, and in indigenous carp Cyprinus carpio L. depending on environmental salinity // Russ. J. Biol. V. 3. P. 110.
Metcalf V.J., Brennan S.O., Chambers G.K et al. 1998a. The albumin of the brown trout (Salmo trutta) is a glycoprotein // Biochim. Biophys. Acta. V. 1386. № 1. P. 90–96. https://doi.org/10.1016/S0167-4838(98)00060-0
Metcalf V., Brennan S., Chambers G et al. 1998b. The albumins of Chinook salmon (Oncorhynchus tshawytscha) and brown trout (Salmo trutta) appear to lack a propeptide // Arch. Biochem. Biophys. V. 350. № 2. P. 239. https://doi.org/10.1006/abbi.1997.0509
Metcalf V.J., Brennan S.O., George P.M. 1999. The Antarctic toothfish (Dissostichus mawsoni) lacks plasma albumin and utilizes high density lipoprotein as its major palmitate binding protein // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. V. 124. № 2. P. 147. https://doi.org/10.1016/s0305-0491(99)00051-6
Metcalf V., Brennan S., George P. 2003. Using serum albumin to infer vertebrate phylogenies // Appl. Bioinformatics. V. 2(3 Suppl). P. 97.
Metcalf V.J., George P.M., Brennan S.O. 2007. Lungfish albumin is more similar to tetrapod than to teleost albumins: purification and characterization of albumin from Australian lungfish, Neocaratodus forsteri // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. V. 147(3). P. 428.
Moore D.H. 1945. Species differences in serum protein patterns // J. Biol. Chem. V. 161. P. 21. https://pubmed.ncbi.nlm.nih.gov/21005711
Ndiaye D., Katoh H., Ge Y.P. et al. 2000. Monoclonal antibodies to plasma high density lipoprotein (HDL) of eel (Anguilla japonica) // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. 2000. V. 125. № 4. P. 473. https://doi.org/10.1016/s0305-0491(00)00159-0
Nelson J.S. 2006. Fishes of The World. Hoboken. New Jork: John Wiley.
Nguyen M., Kurtz I. 2006. Quantitative interrelationship between Gibbs-Donnan equilibrium, osmolality of body fluid compartments, and plasma water sodium concentration // J. Appl. Physiol. V. 100. P. 1293. https://doi.org/10.1152/japplphysiol.01274.2005
Noel E.S., Reis M., Arain Z., Ober E.A. 2010. Analysis of the Albumin/ Fetoprotein/Afamin/Group specific component gene family in the context of zebrafish liver differentiation // Gene Expression Patterns. V. 10. № 6. P. 237. https://doi.org/10.1016/j.gep.2010.05.002
Nynca J., Słowinska M., Dietrich M.A. et al. 2011. Isolation and identification of fetuin-B-like protein from rainbow trout seminal plasma and its localization in the reproductive system // Comp. Biochem. Physiol., Part B: Biochem. Mol. Biol. V. 158. P. 106. https://doi.org/10.1016/j.cbpb.2010.10.002
Olson K.R. 1992. Blood and extracellular fluid volume regulation: role of the renin-angiotensin system, kallikrein-kinin system, and atrial natriuretic peptides // Fish Physiol. V. 12. Part B. P. 136. https://doi.org/10.1016/S1546-5098(08)60010-2
Olson K.R., Kinney D.W., Dombrowski R.A., Duff D.W. 2003. Transvascular and intravascular fluid transport in the rainbow trout: revisiting Starling,s forces, the secondary circulation and interstitial compliance // J. Exp. Biol. V. 206. P. 457. https://doi.org/10.1242/jeb.00123
Pasquier J., Cabau C., Nguyen T. et al. 2016. Gene evolution and gene expression after whole genome duplication in fish: the PhyloFish database // BMC Genomics. V. 17. № 368. P. 1. https://doi.org/10.1186/s12864-016-2709-z
Power D.M., Elias N.P., Richardson S.J. et al. 2000. Evolution of the thyroid hormone-binding protein, transthyretin // Gen. Comp. Endocrynol. V. 119. P. 241. https://doi.org/10.1006/gcen.2000.7520
Saber M.A., Stockbauer P., Moravek L., Meloun B. 1977. Disulfide bonds in human serum albumin // Collect. Czech. Chem. Commun. V. 42. P. 564.
Saito H., Lund-Katz S., Phillips M. 2004. Contributions of domain structure and lipid interaction to the functionality of exchangeable human apolipoproteins // Prog. Lipid Res. V. 43. P. 350. https://doi.org/10.1016/j.plipres.2004.05.002
Salem M., Xiao C., Womack J. et al. 2010. A microRNA repertoire for functional genome research in rainbow trout (Oncorhynchus mykiss) // Mar. Biotechnol. V. 12. № 4. P. 410. https://doi.org/10.1007/s10126-009-9232-z
Sarropoulou E., Fernandes J.M.O., Mitter K. et al. 2010. Evolution of a multifunctional gene: The warm temperature acclimation protein Wap65 in the European seabass Dicentrarchus labrax // Molecular Phylogenetics and Evolution. V. 55(2). P. 640. https://doi.org/10.1016/j.ympev.2009.10.001
Schoentgen F., Metz-Boutigue M.H., Jolles J. et al. 1986. Complete amino acid sequence of human vitamin D-binding protein (group-specific component): evidence of a threefold internal homology as in serum albumin and alpha-fetoprotein // Biochim. Biophys. Acta. 1986. V. 871. № 2. P. 189. https://doi.org/10.1016/0167-4838(86)90173-1
Schulz G.E., Schirmer R.H. 1979. Principles of Protein Structure. New York: Springer.
Sha Z., Peng Xu, Tomokazu Takano et al. 2008. The warm temperature acclimation protein Wap65 as an immune response gene: Its duplicates are differentially regulated by temperature and bacterial infections // Mol. Immunol. V. 45(5). P. 1458. https://doi.org/10.1016/j.molimm.2007.08.012
Stoletov K., Longhou Fang, Soo-Ho Choin et al. 2009. Vascular Lipid Accumulation, Lipoprotein Oxidation, and Macrophage Lipid Uptake in Hypercholesterolemic Zebrafish // Circul. Res. V. 104. P. 952. https://doi.org/10.1161/CIRCRESAHA.108.189803
Tarallo A., Angelini C., Sanges R. et al. 2016. On the genome base composition of teleosts: the effect of environment and lifestyle, BMC Genomics. V. 17. № 173. P. 2. https://doi.org/10.1186/s12864-016-2537-1
Teramoto T. 1994. Structure and function of apolipoproteins // Nihon Rinsho. V. 52. № 12. P. 3100–3107.
Tiselius A.E. 1937. Electrophoresis of serum globulin: Electrophoretic analysis of normal and immune sera // Biochem. J. V. 31. № 9. P. 1464. https://doi.org/10.1042/bj0311464
Tsai P.L., Chen C.H., Huang C.J. et al. 2004. Purification and cloning of an endogenous protein inhibitor of carp nephrosin, an astacin metalloproteinase // J. Biol. Chem. V. 279. № 12. P. 11146. https://doi.org/10.1074/jbc.M310423200
Wicher K.B., Fries E. 2006. Haptoglobin, a hemoglobin-binding plasma protein, is present in bony fish and mammals but not in frog and chicken // Proc. Natl. Acad. Sci. U.S.A. V. 103. № 11. P. 4168. https://doi.org/10.1073/pnas.0508723103
Xu Y., Ding Z. 2005. N-terminal sequence and main characteristics of Atlantic salmon (Salmo salar) albumin // Prep. Biochem. Biotechnol. V. 35. № 4. P. 283–290. https://doi.org/10.1080/10826060500218081
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


