Биология внутренних вод, 2021, № 4, стр. 406-416
Связь пищевого спектра рыб с составом зоопланктона и зообентоса в субарктическом озере
Н. А. Березина a, *, Л. Ф. Литвинчук a, А. А. Максимов a
a Зоологический институт Российской академии наук
Санкт-Петербург, Россия
* E-mail: nadezhda.berezina@zin.ru
Поступила в редакцию 10.12.2019
После доработки 05.02.2021
Принята к публикации 20.02.2021
Аннотация
Изучены сезонные вариации биомасс планктонных и донных беспозвоночных и их вклада в питание рыб длиной тела >10 см: окуня Perca fluviatilis L. и ряпушки Coregonus albula L. в олиготрофном субарктическом оз. Кривое. Выявлена связь пищевого спектра рыб с составом зоопланктона и зоо-бентоса. Показано, что рыбы предпочитают потреблять массовые объекты (в основном, донных беспозвоночных), однако существенны как сезонная вариабельность их вклада в рацион, так и их относительная значимость у рыб разной длины. Доля амфипод Gammarus lacustris Sars и Monoporeia affinis (Lindstrom) достигала >90% летом и >40% осенью в общей массе пищевого комка окуня. Ряпушка потребляла амфипод летом (>50%), а осенью предпочитала моллюсков (до 50%). Кладоцеры важны в осеннем питании рыб (18‒25%). В диете более крупного окуня (18‒25 см) возрастали доли колюшки и ряпушки, но амфиподы превалировали (>40%).
ВВЕДЕНИЕ
Изучение трофических связей между планктонными, бентосными и нектонными организмами в водной экосистеме необходимо для понимания ее функционирования. Влияние хищничества рыб на организмы с более низким положением в трофической сети в озерах зависит от многих причин, в том числе от доступности пищевых объектов, сложности пищевой сети, онтогенетической смены питания у рыб и изменчивости абиотических факторов. Показано, что в малых озерах с упрощенной структурой трофических сетей хищники часто используют литоральные или донные источники энергии, поскольку доступность пелагических ресурсов в таких озерах, как правило, ниже, чем в крупных экосистемах (Schindler, Scheuerell, 2002). Многочисленные в высоких широтах малые озера характеризуются низкой первичной продукцией (олиготрофный статус), и запаса пелагических источников пищи может не хватать рыбам, поэтому основные источники их питания концентрируются в прибрежных и донных биотопах (Eloranta et al., 2010; Berezina et al., 2018).
Евразийский окунь Perca fluviatilis L. и европейская ряпушка Coregonus albula L. – наиболее распространенные и массовые виды ихтиоценоза в малых озерах северных регионов России (Решетников, 1980; Kottelat, Freyhof, 2007; Стерлигова и др., 2016). Известно, что окуни среднего размера (в возрасте 1+‒3+) проходят через бентосоядную стадию (Yazıcıoğlu et al., 2016), питаясь ракообразными во многих озерах (Berezina, Strelnikova, 2010). Ряпушка, известная как зоопланктофаг в большинстве озер бореальной зоны (Northcote, Hammar, 2006; Czarkowski et al., 2007; Халько и др., 2019), на севере (в озерах субарктики) часто питается зообентосом (Berezina et al., 2018, Зубова, Кашулин, 2019). Причины пищевой специализации рыб и замена одного объекта питания на другой могут быть связаны с доступностью объектов подходящих размеров и их количеством, что требует изучения состава сообществ планктона и бентоса и жизненных циклов массовых видов. Предполагалось, что сезонная динамика популяций массовых видов беспозвоночных, которая проявляется в смене их размерно-массовых характеристик вследствие рождения молоди, роста особей и умирания (или вылета насекомых из водоема) может вызывать изменения в характере питания рыб.
Цель работы – оценить вклад планктонных и донных беспозвоночных в рацион окуня Pеrса fluviatilis и ряпушки Coregonus albula в олиготрофном высокоширотном малом оз. Кривое.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
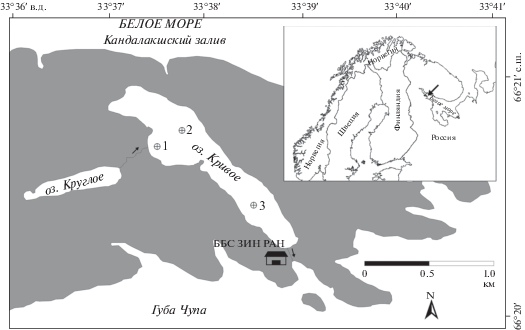
Озеро Кривое – малое субарктическое озеро, расположенное на побережье Белого моря у мыса Картеш на севере России (66°21′ с.ш., 33°38′ в.д.) (рис. 1). Его площадь 0.5 км2, средняя глубина 12 м, максимальная – 32 м. Прибрежная зона глубиной 0–3 м занимает 20% площади озера.
Основные лимнологические особенности этого озера были подробно описаны ранее (Winberg et al., 1973; Хлебович, 2010; Berezina et al., 2017; 2018). Безледный период на озере длится с середины мая ‒ начала июня до конца ноября, в остальное время оно покрыто льдом. Температура поверхностных вод в конце мая – начале июня достигает 4–5°C, к концу июня и в сентябре – 10–16°C. Максимальная температура воды (19–22°C) отмечена в июле и августе. Как правило, с июня по сентябрь на глубинах 5–7 м формируется термоклин с температурой воды в эпилимнионе >10°C и 4–7°C в гиполимнионе. Для озера характерны низкие показатели продукции фитопланктона (85–100 мг С/(м2 сут)) и концентрации хлорофилла а (0.2–3.0 мкг/л), что свидетельствует об олиготрофии этого озера.
Исследование рыб и планктона и бентоса проводили в июне и сентябре 2017 и 2019 гг. на двух станциях, расположенных в мелководной части озера (глубины до 15 м) – ст. 1 (3 м) и ст. 2 (8 м), где концентрируется основная масса рыб. Дополнительно отбирали пробы зоопланктона в самой глубокой части озера (глубина 32 м) на ст. 3 в эпилимнионе (на горизонте 0–5 м). Пробы зообентоса отбирали на мелководье, где глубина варьирует от 0.5 до 1.0 м, в зависимости от уровня озера (рис. 1). При описании жизненных циклов доминирующих видов привлекались данные, полученные авторами в предыдущие годы исследования озера (2002–2016 гг.).
Зоопланктон собирали планктонной сетью Джеди (размер ячеи 0.082 мм). Определение и подсчет зоопланктона проводили в камере Богорова. Пробы зообентоса на илисто-песчаных грунтах (ст. 1, 2) отбирали с помощью стандартного дночерпателя Ван-Вина с площадью захвата 1/40 м2, на мелководье с зарослями тростника и рдеста и песчано-каменистым грунтом – штанговым дночерпателем Заболоцкого (1/40 м2). Пробы отмывали от ила через сито с размерами ячеи 0.25 мм.
Рыбу вылавливали с помощью набора жаберных сетей длиной 30–50 м с размерами ячеи 10, 16, 25 и 38 мм, размещая их на ст. 1, 2 в пелагиали и профундали озера. Сети устанавливали на ночь (6–8 ч), рыбу, вынутую из сети, немедленно помещали на лед и отправляли в лабораторию. Определяли общую длину (с точностью измерения ±1 мм) и сырую массу (±0.1 г). Собраны рыбы в возрасте второго года и старше и >10 cм общей длины тела, мальков рыб не исследовали. После сбора и измерений желудки рыб извлекали из полости тела и фиксировали 4%-ным формалином.
Содержимое желудка рыб анализировали в лаборатории под микроскопом МБС-10. Наполненность желудка оценивали в пределах 0–100% шкалы. Исследовали только желудки с наполнением 50–100%, >20 желудков каждого вида рыб в одну дату сбора. Содержимое желудка взвешивали, затем переносили в чашку Петри и под бинокуляром все пищевые компоненты идентифицировали и разделяли на группы. Затем подсчитывали количество экземпляров и определяли сырую массу пищевых объектов в каждой группе. Рассчитывали вклад различных групп пищевых объектов в общую массу пищевого комка (%) и индекс относительной значимости (RI) каждой группы в питании рыб (Hyslop, 1980) с учетом частоты встречаемости (FO), численности (N) и массы (W) по формуле:
RI = 100(FO + N + W)/∑1…n(FO + N + W).
Для всех показателей вычисляли среднее арифметическое значение и стандартную ошибку (M+SE). Для анализа различий в показателях между годами, сезонами и группами использовали метод главных компонент (ANOVA), F-тест для парного сравнения и корреляционный и регрессионный анализ (R).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Зоопланктон. В составе зоопланктона оз. Кривое отмечено 18 видов. Доминировали коловратка Asplanchna priodonta и несколько видов ветвистоусых раков (табл. 1). Коловратку A. priodonta отмечали в оба месяца наблюдений на всех станциях, наибольшая биомасса зарегистрирована в июне (>200 мг/м3). Из рачкового планктона по биомассе лидировала босмина Bosmina longirostris, в сентябре ее биомасса достигала 136 мг/м3 (ст. 1). Средний размер тела Asplanchna рriodonta был 0.5 мм, Bosmina longirostris – 0.3 мм (лето 2017 г.).
Таблица 1.
Биомасса (мг/м3) доминирующих групп зоопланктона в оз. Кривое в 2017 г.
| Группа зоопланктона |
Июнь | Cентябрь | ||||
|---|---|---|---|---|---|---|
| Ст. 1 | Ст. 2 | Ст. 3 | Ст. 1 | Ст. 2 | Ст. 3 | |
| Микрофаги | ||||||
| Conochilus unicornis Rousselet, 1892 | 1.3 | − | 0.15 | 5.1 | 3.2 | 7.5 |
| Filinia terminalis (Plate, 1886) | 0.3 | − | 0.01 | − | − | − |
| Keratella cochlearis (Gosse, 1851) | − | − | − | − | − | <0.1 |
| Kellicottia longispina (Kellicott, 1879) | 1.2 | 1.83 | 0.34 | − | − | 0.1 |
| Polyarthra remata Skorikov, 1896 | − | − | 0.32 | − | − | − |
| Synchaeta sp. | − | − | − | − | 0.2 | − |
| Макрофильтраторы | ||||||
| Alonella nana (Baird, 1843) | <0.1 | − | − | − | − | − |
| Bosmina longirostris (O.F. Müller, 1785) | 2.1 | 1.1 | 0.1 | 135. 8 | 59.1 | 27.8 |
| Ceriodaphnia pulchella Sars, 1862 | 1.6 | 1.0 | 0.3 | 22.9 | 1.5 | 10.6 |
| Daphnia cristata Sars, 1862 | − | 0.4 | − | 1.7 | 14.3 | 59.1 |
| Holopedium gibberum Zaddach, 1855 | 2.7 | − | 0.5 | 0.7 | <0.1 | − |
| Sida cristallina (O.F. Müller, 1776) | 0.3 | 0.4 | − | − | 3.0 | − |
| Науплиусы Сyclopoida | 1.9 | 0.6 | 0.7 | − | − | 0.1 |
| Науплиусы Сalanoida | 2.7 | 0.5 | 1. 9 | 0.2 | 1.5 | 0.3 |
| Копеподиты I–III стадий Сalanoida | 5.5 | 0.7 | 5.5 | 20.3 | 2.4 | 5.5 |
| Копеподиты I–III стадий Сyclopoida | 3.3 | 7.1 | 5.4 | 0.1 | 10.9 | 0.1 |
| Альго- и зоофаги | ||||||
| Eudiaptomus graciloides (Lilljeborg, 1888) | 2.3 | − | − | 8.1 | 4.5 | 4.5 |
| Факультативные хищники | ||||||
| Asplanchna priodonta Gosse, 1850 | 71.4 | 208.3 | 150.08 | 75.0 | 55.6 | 25.0 |
| Cyclops scutifer Sars, 1863 | 3.2 | 0.7 | − | 5.5 | − | 0.3 |
| Хищники | ||||||
| Bipalpus hudsoni (Imhof, 1891) | − | − | − | 3.7 | <0.1 | <0.1 |
| Leptodora kindtii (Focke, 1844) | 0.1 | − | 0.7 | − | 1.5 | − |
| Polyphemus pediculus (L., 1761) | − | − | − | 3.0 | 3.0 | 3.3 |
Sida crystallinа – одна из наиболее крупных кладоцер (1.7–2 мм) в оз. Кривое, ее немногочисленное присутствие в планктонных пробах объяснялось приуроченностью к зоне с зарослями рдеста и тростника (глубина 1‒4 м). В качестве источника пищи S. cristallina потребляет органическое вещество эпифитов, растущих на макрофитах (Choi et al., 2016). Этот рачок ‒ важный объект питания рыб, но доминирует в теплое время при прогреве воды >20°C.
Каланоида рода Eudiaptomus graciloides может быть ценным кормовым объектом рыб, особенно в период размножения, когда самки носят окрашенные яйца и заметны для рыб. В оз. Кривое E. graciloides размножается в феврале–марте (подо льдом), к лету появляются копеподиты первых стадий, к ноябрю их развитие завершается. В сентябре взрослые рачки преобладают над копеподитами, длина половозрелых особей достигает 1 мм.
Cyclops scutifer – типичный представитель зоопланктона оз. Кривое и один из обычных видов в северных холодноводных озерах Европы. В оз. Кривое большую часть года его популяция держится в слоях ниже 15 м при низких температурах воды (4–5°C). В таких условиях время созревания рачков удлиняется, поэтому популяция C. scutifer может состоять из смеси поколений, имеющих одно- и двухлетний возраст. После вскрытия озера ото льда у рачков отмечены суточные вертикальные миграции, распределение в озере неоднородное.
Зообентос. В зообентосе озера зарегистрированы олигохеты (24 вида с доминированием Stylaria lacustris (L.) и Lumbriculus variegatus (Müller)), пиявок (Glossiphoniidaе gen sp., Helobdella stagnalis L.), двустворчатых (Sphaerium suecicum = S. corneum (L., 1758) и Pisidium crassum (Stelfox)) и брюхоногих моллюсков (Lymnaea stagnalis L., L. ovata (Draparnaud), Anisus contortus (L.) и Valvatidae), амфипод (Gammarus lacustris Sars, Monoporeia affinis (Lindstrom), Gammaracanthus loricatus (Sabine)) и амфибиотических насекомых. Среди насекомых обычны личинки поденок (Ephemera vulgata L., Heptagenia fuscogrisea (Retzius), Caenis horaria (L.) и др.), личинки и куколки ручейников (18 видов с доминированием Phryganea bipunctata Retzius, Atripsodes cinereus (Curtis) и родов Agrypnia и Limnephilus), личинки вислокрылки (Sialis flavilatera L.) и личинки >50 групп и видов двукрылых с доминированием мокрецов (Palpomyia lineata (Meigen), Dasyhelea modesta (Winnertz)), табанид (Chrysops relictus Meigen), лимонид (Dicranota bimaculata (Schummel)) и хирономид (Sergentia coracina (Zetterstedt), Procladius choreus (Meigen) и родов Ablabesmyia, Cladotanytarsus, Cryptochironomus и Psectrocladius).
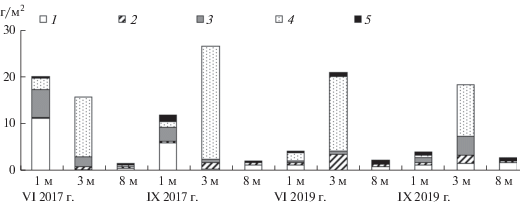
Динамика биомассы основных групп макрозообентоса в прибрежье оз. Кривое в исследуемый период носила сходный характер в межгодовом аспекте, когда максимальные величины биомасс отмечали в начале вегетационного сезона (июнь) и осенью (Berezina et al., 2017). Такого рода закономерности изменения биомассы характерны и для других малых озер Карелии (Winberg et al., 1973; Яковлев, 2005; Куликова, Рябинкин, 2015). Они обусловлены наибольшим нарастанием биомассы донных животных при низких температурах в течение осенне-весеннего периода и снижением общей биомассы бентоса после массового вылета амфибиотических насекомых в первой половине лета (Голубков, 2000), при котором изменяется и соотношение основных групп бентоса. По биомассе основу сообщества на ст. 1 формируют амфиподы Gammarus lacustris, моллюски родов Pisidium и Sphaerium, поденки Ephemera vulgata, вислокрылки и хирономидa Sergentia coracina, на более глубокой ст. 2 ‒ амфипода Monoporeia affinis и личинки хирономид.
Биомасса беспозвоночных немного различалась между станциями, но в целом наибольших значений достигала в литорали – 18–19 г/м2 в 2017 г. и 11–13 г/м2 в 2019 г. На глубине 8 м этот показатель существенно снижался (в 7−12 раз) и имел значения 1.8–2.8 г/м2 (рис. 2). В комплекс основных групп входили моллюски (95−99% из них двустворчатые моллюски), амфиподы, хирономиды и личинки насекомых (поденок, ручейников и вислокрылок). Различия по биомассе достоверны между этими таксонами (F4.11 = 3.56, p = = 0.013), моллюски наиболее сильно отличались по биомассе от всех остальных групп. Биомассы амфипод и личинок насекомых (коэффициент корреляции 0.78) и хирономид и моллюсков (0.67) положительно коррелировали между собой. Моллюски вносили существенный вклад (от 60 до 90%) в общую биомассу на глубине 3 м, амфиподы – 40−67% на глубинах 8–9 м и 30–56% − в литорали. Биомасса прибрежных амфипод (Gаmmarus lacustris) имела значимые межгодовые различия (выше в 2017 г.), биомасса глубоководных амфипод (Monoporeia affinis) была сходна в разные годы, варьируя от 0.7 до 1.9 г/м2.
Рис. 2.
Средняя биомасса разных групп макрозообентоса в оз. Кривое: в литорали – мелководье и ст. 1 и в сублиторали – ст. 2. 1 – амфиподы, 2 – хирономиды, 3 – ручейники, поденки и вислокрылки, 4 – моллюски, 5 – прочие.
Продолжительность жизни Gаmmarus lacustris в этом озере составляет около одного года. Первые самки с яйцами появляются к концу мая и началу июня (Berezina et al., 2021). В течение июня–октября основная часть его популяции сосредоточена на мелководных участках глубиной 0.2‒1.5 м, где есть благоприятные условия для питания, роста и размножения. В это время половозрелые особи гаммаруса имеют размеры 8‒14 мм. Большинство самок G. lacustris выметывает молодь в начале июля, и размножение полностью прекращается. К августу “старые” особи отмирают, а основу популяции (~70% ее общей численности) составляют особи нового поколения длиной тела 2–5 мм. В сентябре преобладают (90–95% общей численности) рачки с длиной тела 3–8 мм, крупные рачки (>12 мм) отсутствуют. Поздней осенью в прибрежье устанавливается лед (до 70 см толщиной), и популяция амфипод мигрирует на зимовку в более глубокие (1.5‒5 м) районы озера с температурой воды 2‒4°C. К концу марта–началу апрелю следующего года амфиподы нового поколения достигают дефинитивных размеров (8–14 мм).
Жизненный цикл амфиподы Monoporeia affinis во многом отличается от такового предыдущего вида (Berezina et al., 2021). В изученном озере этот вид моноцикличен, достигает половой зрелости (при длине тела 6–8 мм) к осени второго года жизни. Самцы в озере встречаются с октября до конца зимы, после спаривания с самками они погибают. В декабре–январе самки откладывают яйца и вынашивают их в течение всей зимы в марзупиуме (выводковой камере). Пополнение популяции М. affinis молодью размером 1.5 мм происходит в конце марта или начале апреля. После выхода молоди в марте самки отмирают. К осени особи весенней генерации достигают 5 мм и зимой почти не растут, возобновляя рост весной следующего года. Таким образом, летом популяция М. affinis представлена особями двух когорт – перезимовавшей генерацией (5–6 мм) и молодью (2–3 мм), – а осенью – подросшими сеголетками (4–5 мм) и взрослыми половозрелыми рачками (7–8 мм) второго года жизни.
Личинки поденки-эфемеры Ephemera vulgata, как и личинки ручейника Phryganea bipunctata и вислокрылок Sialis sp. достигают высоких биомасс в бентосе озера в сентябре–октябре, зимуют и весной следующего года заканчивают развитие, вылетая из озера в конце мая–начале июня. Летом встречаются мелкие личинки младших возрастов. В зависимости от условий размножение может происходить каждый год (унивольтинный цикл) или 1 раз в 2–3 года (семивольтинный). В бентосе отмечены личинки поколений разных лет, поэтому биомассы этих групп насекомых в озере сильно варьируют в межгодовом аспекте.
Моллюски Pisidium crassum и Sphaerium corneum очень многочисленны в литорали. Размножение этих видов начинается поздней весной, первая молодь появляется в июне. В середине июня большинство двустворок (5–6 мм) несут молодь в мантийной полости (до 18‒30 экз. в одном моллюске). Летом молодь концентрируется в основном на мелководье, наиболее крупные особи предпочитают глубины 3‒4 м.
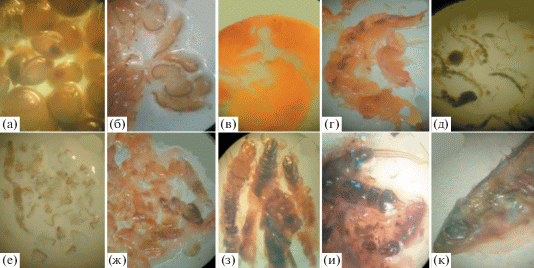
Состав пищевого комка рыб. Спектр питания окуня и ряпушки широк и включает 10 групп беспозвоночных, объединяющих 25 видов и форм. Основные объекты питания представлены на рис. 3. Межгодовые различия в среднемассовом вкладе (%) групп в питание окуня и ряпушки недостоверны (W-тест, все значения р > 0.05; окунь – F = = 0.71, p = 0.23, ряпушка – F = 0.51, p = 0.08). Уровень межгодового сходства пищевого спектра достигал 88% у окуня и 91% у ряпушки.
Рис. 3.
Фото основных пищевых объектов в содержимом желудков окуня и ряпушки: а – моллюск Sphaerium nitidum, б – амфипода Monoporeia affinis, в – амфипода Gammarus lacustris, г – амфиподы Gammaracanthus loricatus и Monoporeia affinis, д – личинки и куколки хирономид, е – кладоцера Bosmina longirostris, ж – кладоцера Sida crystallina и личинки жука Hydroporus sp., з – личинки ручейников Phryganeidae и вислокрылки Sialis, и – личинки поденки Ephemera vulgatа и ручейников, к – девятииглая колюшка (из окуня).
Доли амфипод Gаmmarus lacustris и Monoporeia affinis в пищевом комке окуня достигали в среднем 86% (2017 г.) и 81% (2019 г.) (рис. 4). Выявлены достоверные сезонные различия во вкладе разных групп в питание этого вида (ANOVA, F3.19 = 7.00, p = 0.0001). Так, вклад Gаmmarus lacustris в пищевом комке окуня составил 78% в июне 2017 г. и был на 40% ниже в сентябре (F-тест, F = = 3.07, p = 0.02), вклад Monoporeia affnis снижался с 16% в июне до 5% в сентябре (F-тест, F = 4.4, p = = 0.003). Моллюски (Lymnaea spp., Sphaeriidae) и рыбы (девятииглая колюшка и ряпушка) по доле в массе пищевого комка в сентябре (8–11%) значимо превышали таковые в июне (0‒6%). Планктонные Sida crystallinа, Bosmina longirostris и, в меньшей степени, Eudiaptomus graciloides потреблялись окунем осенью (до 18% массы пищевого комка), летом эти виды в питании не отмечены.
Рис. 4.
Средний вклад объектов (% массы пищевого комка) в питание окуня Рerca fluviatilis (а) и ряпушки Coregonus albula (б) в июне и сентябре 2017 и 2019 гг. в оз. Кривое.
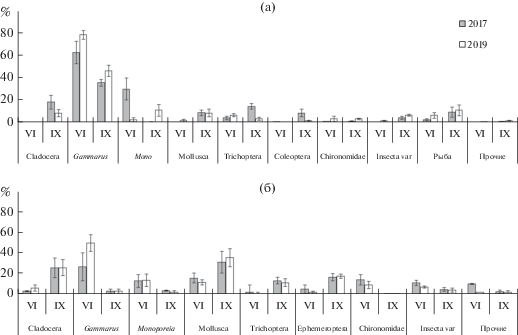
В пищевом комке ряпушки сезонные различия в выборе предпочитаемых объектов питания ярко выражены (рис. 4). В июне доля амфипод Gаmmarus lacustris и Monoporeia affinis достигала в среднем >50% по массе, мелких двустворчатых моллюсков – 14%, куколок и личинок двукрылых – 12%. В сентябре масса амфипод в пищевом комке ряпушки снизилась до 5%, а доля моллюсков возросла в три раза (рис. 4). Основными объектами питания в это время были моллюски Lymnaea spp. и Sphaeriidae, личинки насекомых Phryganea bipunctata, Ephemera vulgatа, кладоцеры Sida crystallina и Bosmina longirostris (>25% по массе). Также ряпушка потребляла икру своих же сородичей, однако доля этого компонента была <5%. Отмечены и наземные насекомые (муравьи), экзувии насекомых, колонии ностока и детрит.
Прослеживаются вариации в составе и относительной значимости объектов питания у рыб разной длины (рис. 5, 6). В июне в питании окуня всех размерных групп 54–84% составляли гаммарусы, в меньшей степени – монопорейи (>25% у окуня – размером <17 см). С ростом окуня в пище достоверно снизилась доля личинок ручейников (R = –0.93, F1.6 = 24.5; p < 0.016), а доля рыб (колюшек) в питании стала более заметной (10‒14% при длине >18 см).
Рис. 5.
Индекс относительной значимости (RI, %) основных компонентов питания у разноразмерных групп окуня Рerca fluviatilis рассчитан как среднее для двух изученных лет: а – июнь, б – сентябрь. Объекты питания: 1 – Cladocera, 2 – Gammarus lacustris, 3 – Monoporeia affinis, 4 – Sphaerium, Lymnaea, 5 – Chironomidae (куколки, экзувии, личинки), 6 – личинки водных насекомых (ручейников, поденок, вислокрылок, жуков и др.), 7 – рыбы (колюшка и ряпушка).
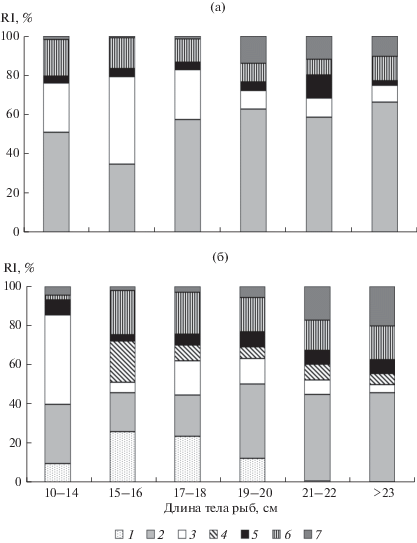
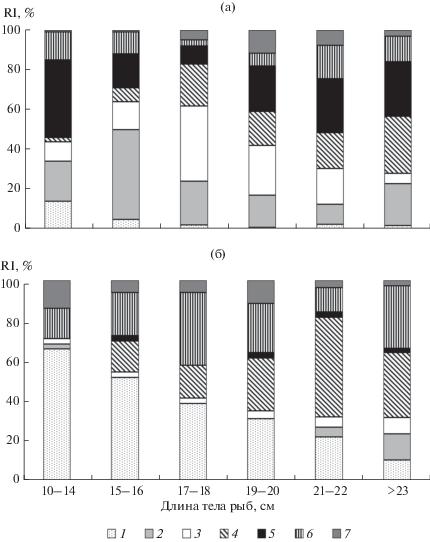
Рис. 6.
Индекс относительной значимости (RI, %) основных компонентов питания у разноразмерных групп ряпушки Coregonus albula рассчитан как среднее для двух изученных лет: а – июнь, б – сентябрь. Объекты питания: 1 – Cladocera, 2 – Gammarus lacustris, 3 – Monoporeia affinis, 4 – Sphaerium, Lymnaea, 5 – Chironomidae (куколки, экзувии, личинки), 6 – личинки водных насекомых (ручейников, поденок, вислокрылок, жуков и др.), 7 – прочее (икра рыб и редкие группы (пиявки, копеподы, мокрецы и другие двукрылые, муравьи, детрит)).
В сентябре у окуня разного размера выявлены различия в значимости амфиподы Monoporeia affinis как объекта питания. У мелких рыб доля этого вида была до 45%, а с увеличением размера рыб снижалась (R = –0.82, F1.6 = 8.13; p = 0.021), при этом доля Gаmmarus lacustris оставалась высокой и у наиболее крупных рыб (>40%). У окуня размером 19–23 см доля рыб (колюшек, ряпушек) в пище достигала 17‒20%, отмечены останки Gammaracanthus loricatus (рис. 3) с глубин >20 м.
Ряпушка характеризовалась высокой сезонной вариабельностью вклада в питание разных групп бентоса и планктона (F1.4 = 218, p < 0.0001). Летом основу питания ряпушки размером 10‒16 см формировали амфиподы разных видов, куколки хирономид и личинки ручейников. У рыб 17‒22 см доля моллюсков Lymnaea spp. была выше (R = 0.88, F1.4 = 13.2; p = 0.02), а доля амфипод в 2 раза ниже, чем у рыб меньшей длины (R = –0.87, F1.4 = 12; p = 0.03).
Осенью при увеличении роли планктонных рачков в питании ряпушки наблюдалась четкая корреляция их значимости с размером рыб (R = –0.86, F1.4 = 16.9; p = 0.03). У мелкой (≤ 15 см) ряпушки индекс относительной значимости планктонных рачков был >65% (рис. 6), это ~450‒1000 экз. Bosmina longirostris или 100–250 экз. Sida crystallina. С увеличением длины ряпушки доля кладоцер достоверно снижалась до 10%. Более крупная ряпушка предпочитала потреблять зообентос, включая личинок поденок, ручейников и гаммарусов. Также, с ростом рыб доля моллюсков Sphaeriidae в их питании возрастала (R = 0.91, F1.4 = 18.6; p = 0.01).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На основе полученных результатов выявлено, что бентосные беспозвоночные – наиболее важный пищевой ресурс для среднеразмерных окуня и ряпушки в оз. Кривое. В сезонном аспекте доля разных групп в пище варьирует, но летом (>90%) и осенью (>40%) в питании окуня наиболее значимы амфиподы (Gаmmarus lacustris, Monoporeia affinis) (рис. 2), доминирующие в зообентосе озера. В питании ряпушки доля этих амфипод в июне >50%, однако осенью в ее пище доминируют моллюски (до 50%) и кладоцеры (до 18%).
Смена объектов питания окуня и ряпушки осенью, наблюдаемая в оба года исследований, отмечена ранее (Berezina et al., 2018). Она может быть обусловлена сезонными изменениями в структуре сообществ беспозвоночных: массовым развитием тех или иных видов или достижением ими размеров, при которых рыбы способны использовать их в пищу. По крайней мере, это справедливо для амфипод, моллюсков (рис. 2) и Bosmina longirostris (табл. 1), наибольшие биомассы которых в сообществах отмечены в периоды их наиболее интенсивного использования в пищу рыбами. Ряпушка Coregonus albula, известная как зоопланктофаг, в условиях северного озера активно питается зообентосом. В некоторых арктических регионах вселившаяся в озера мелкоразмерная ряпушка включала в пищу даже рыб, поскольку зоопланктона было недостаточно (Gamst et al., 2011; Reshetnikov et al., 2020).
Смена рыбами пищевых объектов напрямую связана с особенностями жизненных циклов видов жертв и определяется достаточной биомассой объекта в озере. Доминирование в первой половине лета крупных половозрелых особей Gаmmarus lacustris в составе бентоса обуславливает и высокую интенсивность питания ими окуня и ряпушки. С появлением потомства и последующим отмиранием взрослого поколения, основу в популяции этих амфипод формируют мелкие особи новой генерации, менее потребляемые рыбами. Осенью пищевой спектр рыб формируется за счет других представителей бентофауны – личинок насекомых (ручейников, поденок) и моллюсков. Крупные окуни больше, чем в летний период, питались колюшкой и ряпушкой (до 20%), но, по-прежнему, основу их пищи составлял зообентос (на 40% амфиподы).
Во многих озерах других регионов окуни на бентосоядной стадии часто потребляют амфипод в качестве основного корма (Eckmann et al., 2008). Например, в Ладожском озере доля амфипод Gmelinoides fasciatus и Monoporeia affinis в рационе окуня была >60% (Berezina, Strelnikova, 2010). В оз. Кривое окунь при достижении длины тела 18 cм перешел на питание рыбой, в других озерах это случается раньше, при длине 15–16 cм (Haakana et al., 2007; Yazıcıoğlu et al., 2016). Время наступления рыбоядной стадии окуня различается в разных озерах и зависит от плотности и размерных характеристик других рыб (Persson, Eklöv, 1995).
Хотя в годовом масштабе макробеспозвоночные, по-видимому, являются наиболее важным пищевым ресурсом рыб в оз. Кривое, в осеннем питании окуня (18% массы пищевого комка) и ряпушки (25%) рачковый планктон также важен. Летом планктонные рачки отмечены в питании ряпушки в незначительных количествах, окунь же ими совсем не питался. В прошлые годы (2004, 2008) в озере были выявлены сходные черты в летнем питании окуня (Стрельникова и др., 2019). В 2009 г. (Berezina et al., 2018) так же, как и в изученные годы, отмечали увеличение доли кладоцер в пищевом комке рыб (до 22%) в осенний период (сентябрь, октябрь). В питании арктического гольца Salvelinus alpinus (L.) также выявлено увеличение доли зоопланктона (с 6 до 82%) в конце сезона открытой воды (Eloranta et al., 2010), хотя в течение лета основу его пищи составляли донные беспозвоночные. Эта особенность при подготовке рыб к зимовке, она связана с необходимостью запасания ими липидов, которые в большом количестве содержатся в ракообразных (Eloranta, 2010).
Веслоногий рачок Cyclops scutifer не употреблялся в пищу рыбами. Другой веслоногий рачок Eudiaptomus graciloides встречался в питании окуня и ряпушки только осенью и в незначительных количествах (<2%), что, по-видимому, связано с его небольшой биомассой в озере (4–8 мг/м3) (табл. 1). Как и в оз. Кривое, в других озерах он входил в рацион ряпушки только осенью (Czarkowski et al., 2007).
Из планктонных ракообразных основные пищевые объекты ряпушки в оз. Кривое – наиболее массовые (Bosmina longirostris) и крупные (Sida cristallina) кладоцеры, которые менее подвижны, по сравнению с веслоногими рачками. В разных озерах в питании рыб доминируют планктонные рачки разных видов, массовые в том или ином водоеме. Так, в оз. Вигры (Wigry, Польша) ряпушка предпочитает питаться Cyclops vicinus Uljanin и Daphnia spp. (Czarkowski et al., 2007), в оз. Меларэн (Mälaren, Швеция) – Bosmina sp. (Northcote, Hammar, 2006). Однако, планктонный доминирующий в оз. Кривое вид Asplanchna priodonta, несмотря на относительно крупные размеры и высокие биомассы (до 88%) (табл. 1), не отмечен в пище ряпушки. Возможно, эта коловратка была недоучтена, поскольку имеет мягкое тело и быстро разрушается уже в пищеводе рыб, в то время как рачки долго сохраняются в желудке (Sutela, 1994). Другие виды коловраток также не встречались в пище рыб из оз. Кривое. Вместе с тем имеются сведения о присутствии коловраток Synchaeta pectinata Ehrenberg, Filina maior (Colditz) и Keratella cochlearis (Gosse) в пище ряпушки оз. Плещеево (Халько и др., 2019).
Задача дальнейших исследований – изучить спектр питания рыб в подледный период (декабрь– конец мая), поскольку такие данные единичны. Возможно, в зимне-весенний период особая роль будет определена для размножающихся ракообразных, достигших в этот период максимальных размеров, биомасс и пищевого качества. Также необходимо сравнительное изучение питания рыб в разных озерах арктического региона.
Выводы. Изучение состава зоопланктона и зоо-бентоса и их вклада в питание рыб длиной тела >10 см: окуня Perca fluviatilis и ряпушки Coregonus albula в олиготрофном субарктическом оз. Кривое показало четкую связь пищевого спектра рыб с динамикой биомасс массовых видов беспозвоночных. Ряпушка, известная преимущественно как планктофаг, в условиях северного озера, где рачкового планктона мало, активно питалась зоо-бентосом амфиподами – летом и сфереидами – осенью. Основу питания молоди окуня составляли крупные амфиподы (40–90%). Выявлено осеннее возрастание роли планктонных ракообразных (20%) в питании обоих видов рыб. Крупный окунь не переходил к облигатной ихтиофагии, оставаясь эврифагом с высокой долей донных беспозвоночных. Для окуня и ряпушки характерна сезонная смена пищевых объектов, повторяющаяся из года в год и связанная с особенностями жизненных циклов видов зоопланктона и зообентоса, потенциальных объектов питания этих рыб. Таким образом, основной момент, определяющий характер питания окуня и ряпушки в субарктических озерах, – массовое развитие доступных кормовых организмов. При этом важны и качественные характеристики кормовых объектов, т.е. выбор рыбами в пищу не только массовых и относительно крупных, но и ценных в пищевом отношении организмов.
Список литературы
Голубков С.М. 2000. Функциональная экология личинок амфибиотических насекомых // Труды Зоологического института РАН. Т. 284.
Зубова Е.М., Кашулин Н.А. 2019. Питание сига Coregonus lavaretus, европейской ряпушки C. albula и европейской корюшки Osmerus eperlanus в оз. Имандра // Тр. Ферсмановской научной сессии Геологического института Кольского научного центра РАН. Т. 16. С. 203.
Куликова Т.П., Рябинкин А.В. 2015. Зоопланктон и макрозообентос малых водоемов разных типов ландшафтов южной Kарелии // Тр. Карельского научного центра РАН. № 6. 2015. С. 47. https://doi.org/10.17076/bg25
Решетников Ю.С. 1980. Экология и систематика сиговых рыб. Москва: Наука.
Стерлигова О.П., Ильмаст Н.В., Савосин Д.С. 2016. Окунь Perca fluviatilis (Percidae) разнотипных водоемов Карелии // Ученые записки Петрозаводского государственного университета. № 2(155). С. 57.
Стрельникова А.П., Березина Н.А., Жгарева Н.Н. 2019. Особенности летнего питания и пищевая специализация молоди окуня в оз. Кривое (северная Карелия) // Гидробиол. журн. Т. 55. № 6. С. 46.
Халько Н.А., Терещенко Л.И., Малина Ю.И., Базаров М.И. 2019. Сезонные и межгодовые изменения спектра питания европейской ряпушки Coregonus albula (L.) в оз. Плещеево // Биол. внутр. вод. № 2. Вып. 2. С. 99. https://doi.org/10.1134/S0320965219030100
Хлебович Т.В. 2010. Структурные и трофические характеристики протозойного планктона приполярного озера (Северная Карелия) // Биол. внутр. вод. № 3. С. 59.
Яковлев В.А. 2005. Пресноводный зообентос северной Фенноскандии (разнообразие, структура и антропогенная динамика). Апатиты: Изд-во Карельск. науч. центра РАН. Ч. 2.
Berezina N.A., Strelnikova A.P. 2010. The role of the introduced amphipod Gmelinoides fasciatus and native amphipods as fish food in two large-scale north-western Russian inland water bodies: Lake Ladoga and Rybinsk Reservoir // J. Appl. Ichthyol. V. 26 Issue s2. P. 89. https://doi.org/10.1111/j.1439-0426.2010.01493.x
Berezina N.A., Strelnikova A.P., Maximov A.A. 2018. The benthos as the basis of vendace and perch diets in an oligotrophic subarctic lake // Polar Biology. V. 41. P. 1789. https://doi.org/10.1007/s00300-018-2319-0
Berezina N.A., Maximov A.A., Umnova L.P. et al. 2017. Excretion by benthic invertebrates as important source of phosphorus in oligotrophic ecosystem (Lake Krivoe, Northern Russia) // J. Sib. Fed. Univ. Biology. V. 10. № 4. P. 485. https://doi.org/10.17516/1997-1389-0046
Berezina N., Kalinkina N., Maximov A. 2021. Distribution and functional ecology of malacostracan crustaceans in Russian Northern and Arctic Lakes // Lake Water: Properties and Uses (Case Studies of Hydrochemistry and Hydrobiology of Lakes in Northwest Russia). Series: Climate Change and its Causes, Effects and Prediction. New York: Nova Science Publishers. P. 229.
Choi J., Jeong K., Kim S. et al. 2016. Distribution and attachment characteristics of Sida crystallina (O.F. Müller, 1776) in lentic freshwater ecosystems of South Korea // J. Ecol. Environ. V. 40. 7. https://doi.org/10.1186/s41610-016-0006-z
Czarkowski T.K., Martyniak A., Kapusta A. et al. 2007. Feeding ecology of vendace, Coregonus albula (L.), in Lake Wigry (northeastern Poland) // Arch. Pol. Fish. V. 15. № 2. P. 117.
Eckmann R., Mörtl M., Baumgärtner D. et al. 2008. Consumption of amphipods by littoral fish after the replacement of native Gammarus roeseli by invasive Dikerogammarus villosus in Lake Constance // Aquatic Invasions. V. 3. P. 187. https://doi.org/10.3391/ai.2008.3.2.9
Eloranta A.P., Kahilainen K.K., Jones R.I. 2010. Seasonal and ontogenetic shifts in the diet of Arctic charr Salvelinus alpinus in a subarctic lake // J. Fish Biol. V. 77. P. 80. https://doi.org/10.1111/j.1095-8649.2010.02656.x
Gamst S., Gjelland K.Ø., Reshetnikov Y.S. et al. 2011. A planktivorous specialist turns rapacious: Piscivory in invading vendace Coregonus albula // J. Fish Biol. V. 78. P. 332. https://doi.org/10.1111/j.1095-8649.2010.02831.x
Haakana H., Huuskonen H., Karjalainen J. 2007. Predation of perch on vendace larvae: diet composition in an oligotrophic lake and digestion time of the larvae // J. Fish. Biol. V. 70. P. 1171. https://doi.org/10.1111/j.1095-8649.2007.01383.x
Hyslop E.J. 1980. Stomach contents analysis – a review of methods and their application // J. Fish. Biol. V. 17. P. 411. https://doi.org/10.1111/j.1095-8649.1980.tb02775.x
Kottelat M., Freyhof J. 2007. Handbook of European Freshwater Fishes. Kottelat. Cornol, Switzerland. Freyhof. Berlin, Germany. ISBN: 978-2-8399-0298-4. 646 p.
Northcote T.G., Hammar J. 2006. Feeding ecology of Coregonus albula and Osmerus eperlanus in the limnetic waters of Lake Malaren, Sweden // Boreal Env. Res. V. 11. P. 229.
Persson L., Eklöv P. 1995. Prey refuges affecting interaction between piscivorous perch (Perca fluviatilis) and juvenile perch and roach (Rutilus rutilus) // Ecology. V. 76. P. 70. https://doi.org/10.2307/1940632
Reshetnikov Y.S., Sterligova O.P., Anikieva L.V., Koroleva I.M. 2020. Manifestation of unusual features in fish exposed to a new environment by the example of vendace Coregonus albula and European smelt Osmerus eperlanus // J. Ichthyol. V. 60. P. 491. https://doi.org/10.1134/S0032945220030145
Schindler D.E., Scheuerell M.D. 2002. Habitat coupling in lake ecosystems // Oikos. V. 98. P. 177. https://doi.org/10.1034/j.1600-0706.2002.980201.x
Sutela T. 1994. Digestion of zooplankton in the alimenary tract of vendace (Coregonus albula) larvae // J. Fish Biol. V. 44. № 4. P. 591. https://doi.org/10.1111/j.1095-8649.1994.tb01235.x
Winberg G.G., Alimov A.F., Boullion V.V. et al. 1973. Biological productivity of two subarctic lakes // Freshwater Biol. V. 3. Iss. 2. P. 177. https://doi.org/10.1111/j.1365-2427.1973.tb00071.x
Yazıcıoğlu O., Yılmaz S., Yazıcı R. et al. 2016. Feeding ecology and prey selection of European perch Perca fluviatilis inhabiting a eutrophic lake in northern Turkey // J. Fresh. Ecol. V. 31. P. 641. https://doi.org/10.1080/02705060.2016.1220432
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод