Биология внутренних вод, 2021, № 5, стр. 501-509
Структура макрозообентоса пойменных озер в условиях разной продолжительности весеннего половодья
А. А. Прокин a, *, Д. Г. Селезнев a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл, Россия
* E-mail: prokina@mail.ru
Поступила в редакцию 25.12.2020
После доработки 10.03.2021
Принята к публикации 22.03.2021
Аннотация
В результате исследований макрозообентоса шести пойменных озер на территории Хоперского заповедника в годы с разной продолжительностью весеннего половодья описаны изменения структурных характеристик сообществ донных макробеспозвоночных. В засушливый год сообщества характеризуются высокой степенью доминирования отдельных видов и низким фаунистическим сходством. В последующие годы с продолжительным половодьем в сообществах происходит гомогенизация видового состава и структуры.
ВВЕДЕНИЕ
Пойменные озера важны для формирования видового состава гидробионтов всех водных объектов речной системы. В то же время, несмотря на широкое распространение данного типа водоемов на равнинах умеренных широт всех континентов, они привлекают недостаточное внимание исследователей. С одной стороны, это связано с их относительно небольшими размерами и, как следствие, невысокой хозяйственной значимостью, с другой – со сложностью сезонной и многолетней динамики, которая преимущественно определяется основной рекой поймы (Junk et al., 1989; Bunn, Arthington, 2002), в первую очередь периодичностью и продолжительностью затопления поймы во время половодья и паводков – поемностью (Фащевский, 2007), или в другой терминологии – паводковым пульсом (Junk et al., 1989; Tockner et al., 2000). Чем более периодичны в ряду лет и продолжительны половодья, тем моложе средний сукцессионный возраст фитоценозов поймы (Максимов, 1974; Мосин, Ефимовская, 2007). В пойменных озерах богаче видовой состав и выше количественные показатели развития сообществ фитопланктона (Яценко-Степанова, 2011), зоопланктона (Крылов, 2013; Krylov, 2015; Крылов, Жгарева, 2016; Napiórkowski et al., 2019) и макробеспозвоночных (Obrdlik, Garcia-Lozano, 1992; Van den Brink et al., 1994; Прокин, Селезнев, 2018). Макрозообентос озер, имеющих постоянную связь с рекой через протоки, богаче в видовом отношении и продуктивнее, чем в не связанных с рекой (Pan et al., 2011), что характерно и для рыбного населения (Reid et al., 2012). Эффект увеличения обилия макрозообентоса отмечен также после искусственного восстановления связи пойменных озер с рекой через протоку (Obolewski et al., 2014, 2016).
Известно, что при длительном половодье и высоком уровне воды в лагунах, в отдельных водоемах внутри одной системы происходит гомогенизация среды обитания и биологических сообществ. В частности, она проявляется в снижении коэффициентов вариации большого количества физических и химических характеристик воды, первичной продукции, увеличения сходства сообществ макрофитов и рыбного населения (Thomaz et al., 2007).
Ранее авторами проведены исследования донных и фитофильных макробеспозвоночных пойменных озер Хоперского заповедника. В ряде публикаций (Прокин, Решетников, 2013; Прокин, 2014а, 2014б; Прокин, Селезнев, 2018) представлены данные о качественном и количественном составе, сезонной динамике макрозообентоса, определена роль половодья в формировании донных сообществ, подтверждено значение пересыхания или резкого падения уровня воды в качестве точки слома (Scheffer et al., 2001) – пускового механизма экосистемных перестроек в малых пойменных озерах (Прокин, Селезнев, 2018).
Цель настоящей работы – исследовать межгодовые изменения структурных характеристик летнего аспекта сообществ донных макробеспозвоночных озер в годы с разной продолжительностью весеннего половодья.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили в июле 2011–2013 гг. на шести пойменных озерах р. Хопер на территории Хоперского заповедника: Малое Голое (М. Голое), Большое Голое (Б. Голое), Ульяновское, Большое Щурячье (Б. Щурячье), Большое Подпесочное (Б. Подпесочное), Крутобережное. Расположение озер указано в работах (Прокин, 2014б; Krylov, 2015). Площадь озер варьировала от 0.003 до 0.13 км2, максимальная глубина достигала 5.9 м.
Пробы макрозообентоса отбирали ковшевым дночерпателем Петерсена с площадью захвата 0.025 м2 (2011 г.) и коробчатым дночерпателем ДАК-100 с площадью захвата 0.01 м2 (2012–2013 гг.), по два подъема на одну пробу в трех биотопах каждого озера – наиболее глубоком участке вне зарослей макрофитов (профундаль), прибрежье в поясе растений с плавающими листьями (литораль) и в поясе гелофитов (зоне уреза). Материал фиксировали в 75%-ном этаноле, идентификацию организмов проводили в лабораторных условиях по определителям, указанным ранее (Прокин, Решетников, 2013). Всего отобрано и обработано 50 проб.
Сведения о трофической специализации организмов взяты из монографии Монакова (Monakov, 2003). Использована классификация трофических групп и гильдий из работы Силиной, Прокина (Силина, Прокин, 2008). Сапробиологическую принадлежность видов определяли по работе Fauna Aquatica Austriaca (2002). На основе этих данных рассчитывали индекс Пантле–Букка в модификации Сладечека (P–B) и проводили анализ методом Зелинки и Марвана (Zelinka, Marvan, 1961, 1966; Жгарева, 2007).
Различия видового состава макрозообентоса озер в разные годы анализировали с помощью непараметрического дисперсионного анализа и теста оценки однородности многомерной дисперсии (Anderson, 2006; Шитиков, Мастицкий, 2017). В качестве дистанции в обоих тестах использовали B–K, характеризующую фаунистическое различие, βD – как таксономическое β-разнообразие (Anderson et al., 2006). Для определения отличающихся групп (годов) применяли перестановочные post-hoc тесты с 999 перестановками. Для визуализации использовали метод анализа главных координат (principal coordinates analysis – PCoA).
Частотные распределения видов по численности приближались гиперболическим H-распределением, известным также как распределение Ципфа–Парето (Zipf, 1949; Яблонский, 1986); параметр альфа подбирали оценкой наименьших квадратов для нелинейных моделей и рассматривали как один из параметров, характеризующих степень организации структуры сообществ.
Для описания структурных особенностей сообществ макрозообентоса, кроме n, анализировали ряд характеристик, рассчитанных по численности видов, усредненной для трех изученных биотопов каждого озера: H, в котором информация рассматривается как мера разнообразия (Алимов, 2000) с учетом Hmax и Hmin при данном наборе видов (Odum, 1969); СN (Simpson, 1949), R (Von Foerster, 2003).
Структуру сообществ оценивали с помощью энтропии Реньи как параметрического обобщения энтропии Шеннона (Якимов и др., 2016). VR оценивали площадью фигуры, ограниченной максимальными и минимальными значениями энтропии по всем озерам за год на интервале значений параметра Rα от 0 до 64 включительно. Площадь вычисляли методом трапеций.
Для анализа видового разнообразия сообществ с учетом их таксономической (Rtax) и трофической (Rtroph) структур использовали квадратичную энтропию Рао (Rao, 1982), где дистанция между видами определялась удаленностью видов на соответствующем иерархическом дереве (Clarke, Warwick, 1998). Таксономическая иерархия содержит 7 уровней: тип–класс–отряд–подотряд или надсемейство–семейство–род–вид. В трофической иерархии выделено три уровня: принадлежность к хищным, мирным или всеядным–трофическая группа–гильдия. Для оценки MDtax и MDtroph рассчитывали средние дистанции между видами в приведенных выше иерархиях. В качестве первичных данных использовали индекс плотности (Арабина и др., 1988).
Расчеты проводили в среде статистического анализа R 3.5 с применением пакетов lmPerm и vegan. Исходные данные можно скачать по ссылке: http://ibiw.ru/upload/staff/267/khoper_sp.zip.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Озеро Крутобережное не заливалось в 2011 г., а озера Ульяновское, Б. Щурячье и Б. Подпесочное – с 2006 г. по 2011 г. В результате мощного половодья 2012 г. площадь водной поверхности перечисленных водоемов увеличилась на 24–60%, а максимальный подъем воды от уровня в марте составил 5 м, что превысило среднемноголетние значения на ~1.5 м. В 2013 г. оз. Ульяновское не заливалось, в остальных озерах полые воды стояли >2 мес. При этом площадь озер снизилась на 5–25%, кроме оз. Крутобережного, площадь которого не изменилась.
Отдельно можно выделить озера Б. Голое и М. Голое. Первое связано с рекой через протоку, а второе соединяется с ним. В период исследования эти озера заливались полыми водами ежегодно, их площадь достигала 100% среднемноголетней, продолжительность половодья увеличилась с 25 до 45 сут (Прокин, 2014а; Прокин, Селезнев, 2018).
Видовой состав озер в исследуемый период значимо отличался от года к году (p = 0.001). Апостериорные сравнения выделили 2011 г. (уровень значимости отличий 2011–2012 годов, p = 0.015; 2011–2013 гг., p = 0.027) и не показали значимых различий между 2012 и 2013 гг. (p = 0.081). Оценка β-разнообразия в исследуемые годы также значимо различалась (p = 0.035): в 2011 г. она была выше, чем другие годы (2011–2012 гг., p = 0.039; 2011–2013 гг., p = 0.037), различия между 2012 и 2013 гг. статистически незначимы (p = 0.45) (рис. 1).
Рис. 1.
Диаграмма фаунистического сходства озер в исследуемый период, метод главных координат (PCoA). Эллипс покрывает 95% данных в группе. Обозначения как в табл. 1.
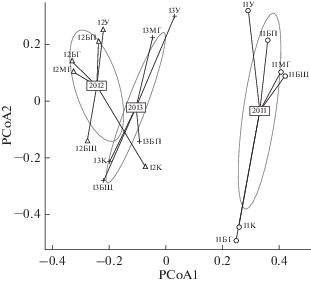
В ряду лет средняя дистанция по индексу Брея–Кертиса снижается, то есть увеличивается фаунистическое сходство между озерами, β-разнообразие также снижается. Видовое богатство (α–разнообразие) растет в 2012 г. и сохраняется на высоком уровне в 2013 г. (табл. 1).
Таблица 1.
Структурные показатели сообществ донных макробеспозвоночных в исследованных озерах
| Озеро | Год | n | H ± m | Hmax | Hmin | R | CN | α |
|---|---|---|---|---|---|---|---|---|
| МГ | 2011 | 26 | 4.17 ± 0.06 | 4.70 | 0.56 | 0.11 | 0.07 | 0.66 |
| 2012 | 36 | 3.25 ± 0.03 | 5.17 | 0.08 | 0.37 | 0.23 | 1.67 | |
| 2013 | 23 | 2.91 ± 0.04 | 4.52 | 0.10 | 0.36 | 0.28 | 1.82 | |
| БГ | 2011 | 14 | 1.15 ± 0.08 | 3.81 | 0.19 | 0.70 | 0.72 | 4.76 |
| 2012 | 25 | 3.27 ± 0.04 | 4.64 | 0.12 | 0.30 | 0.19 | 1.28 | |
| У | 2011 | 9 | 1.91 ± 0.07 | 3.17 | 0.15 | 0.40 | 0.42 | 2.01 |
| 2012 | 15 | 3.23 ± 0.02 | 3.91 | 0.08 | 0.17 | 0.14 | 0.84 | |
| 2013 | 13 | 3.00 ± 0.04 | 3.70 | 0.12 | 0.19 | 0.18 | 1.07 | |
| БЩ | 2011 | 11 | 3.01 ± 0.07 | 3.46 | 0.37 | 0.13 | 0.15 | 0.80 |
| 2012 | 19 | 3.04 ± 0.02 | 4.25 | 0.05 | 0.28 | 0.16 | 0.92 | |
| 2013 | 16 | 2.11 ± 0.04 | 4.00 | 0.08 | 0.47 | 0.35 | 1.49 | |
| БП | 2011 | 17 | 3.61 ± 0.07 | 4.09 | 0.56 | 0.12 | 0.12 | 0.90 |
| 2012 | 12 | 1.78 ± 0.03 | 3.58 | 0.04 | 0.50 | 0.49 | 2.39 | |
| 2013 | 28 | 3.45 ± 0.03 | 4.81 | 0.09 | 0.28 | 0.14 | 0.93 | |
| К | 2011 | 10 | 1.33 ± 0.06 | 3.32 | 0.11 | 0.60 | 0.63 | 3.44 |
| 2012 | 10 | 2.42 ± 0.03 | 3.32 | 0.08 | 0.27 | 0.24 | 1.03 | |
| 2013 | 19 | 2.72 ± 0.03 | 4.25 | 0.07 | 0.36 | 0.20 | 1.01 |
Примечание. Здесь и табл. 3: МГ – М. Голое, БГ – Б. Голое, У – Ульяновское, БЩ – Б. Щурячье, БП – Б. Подпесочное, К – Крутобережное.
Структурные индексы, увеличивающиеся при возрастании доминирования (α, СN, R), или, наоборот, выравненности (H) в распределении обилия видов, хорошо характеризуют межгодовые процессы изменений сообществ в этом отношении (табл. 1), однако не позволяют обобщенно оценить ситуацию. В этом отношении использование энтропии Реньи, учитывающей комплекс индексов, дает более наглядный результат.
Анализ кривых Реньи по озерам показал, что в 2011 г. (рис. 2a) донные беспозвоночные формируют два различных типа организации сообществ: 1) с низким разнообразием (n, H) и высокой степенью доминирования (Б. Голое, Крутобережное и Ульяновское – три нижних кривых); 2) без явного доминирования, с относительно высоким значением H и n (Б. Щурячье, Б. Подпесочное, М. Голое – три верхних кривых). В озерах Б. Голое и Крутобережное доминирует Chaoborus flavicans (Meigen, 1830) – 640 экз./м2 (85% N) и 727 экз./м2 (79% N) соответственно, в оз. Ульяновское – Cladotanytarsus gr. mancus – 360 экз./м2 (63% N). Более низкое положение кривой энтропии в области высоких значений Rα для первых двух озер, по сравнению с оз. Ульяновское, обусловлено резким доминированием: в оз. Б. Голое наиболее многочисленный вид превышает второй по численности в 32 раза, в оз. Крутобережное в 15 раз, в оз. Ульяновское лишь в 4.5 раза. Из наклона кривых энтропии Реньи в области Rα < 1 также видно отличие структуры видового состава оз. Б. Голое от таковой в других водоемах: здесь повышено разнообразие редких видов. Минимальную численность в оз. Б. Голое имеют 10 видов из 14 (71%), в оз. Крутобережное – лишь 3 из 10 (33%).
Рис. 2.
Энропия Реньи: a – 2011 г., б – 2012 г., в – 2013 г. Здесь и на рис. 3. 1 – Б. Голое, 2 – Б. Подпесочное, 3 – Б. Щурячье, 4 – Крутобережное, 5 – М. Голое, 6 – Ульяновское.

В 2012 г. видовой состав и структура сообществ озер становятся более однородными (рис. 2б). В оз. Б. Голое и Крутобережное при увеличении N (и n в оз. Б. Голое) снижается доминирование, причем доминант 2011 г. Chaoborus flavicans сменяется Chironomus cingulatus Meigen, 1830. Сообщества озер с выровненной структурой в 2011 г., теперь становятся многочисленными и резко доминантными. В оз. М. Голое доминирует Chironomus cingulatus (2783 экз./м2, 46% N), не встречавшийся в 2011 г., в оз. Б. Подпесочное – Glyptotendipes cauliginellus (Kieffer, 1913) (2233 экз./м2, 68% N). В озерах Ульяновское и Б. Щурячье повышаются N и H при сохранении структуры, выражающейся формой кривой.
В 2013 г. структура сообществ незначительно меняется относительно 2012 г., однако существенные изменения происходят в составе доминантов (рис. 2в). В оз. Крутобережное за счет редких видов вдвое увеличивается n, доминирующее положение занимает новый для озера Glyptotendipes glaucus (Meigen, 1818) (1033 экз./м2, 29% N), в два раза увеличивается численность Chaoborus flavicans (950 экз./м2, 26% N), возрастает численность некоторых других видов. В оз. Б. Подпесочное n также резко увеличивается за счет малочисленных видов (13 из 28 или 46% имеют минимальную численность) при снижении численности доминантов. Они представлены Endochironomus albipennis (Meigen, 1830) (916 экз./м2; 22% N) и Glyptotendipes paripes (Edwards, 1929) (883 экз./м2; 21% N). Структурная перестройка произошла и в оз. Б. Щурячье: из семи видов с высокой численностью в 2012 г. три вида не обнаружены, доминантное положение сохранили Chironomus cingulatus (1233.3 экз./м2; 50% N) и Chaoborus flavicans (800 экз./м2; 32% N). Остальные виды представлены единичными экземплярами.
Вариация энтропии Реньи в 2012–2013 гг. была 68.5–54.45 (в среднем 61.5) – вдвое ниже, чем в 2011 г. (124.1). Высокая вариация в 2011 г. во многом достигалась за счет озер М. Голое и Б. Голое, тогда как в вариацию 2012–2013 гг. они почти не вносили вклада (табл. 2).
Таблица 2.
Среднегодовые структурные показатели сообществ макробеспозвоночных в исследованных озерах
| Показатель | 2011 | 2012 | 2013 |
|---|---|---|---|
| n ± m | 14.5 ± 2.6 (11.7 ± 1.8) | 19.5 ± 4.0 (14.0 ± 2.0) | 19.8 ± 2.6 (19.0 ± 3.2) |
| α ± m | 2.1 ± 0.7 (1.8 ± 0.6) | 1.4 ± 0.2 (1.3 ± 0.4) | 1.3 ± 0.2 (1.1 ± 0.1) |
| H ± m | 2.5 ± 0.5 (2.4 ± 0.6) | 2.8 ± 0.3 (2.6 ± 0.3) | 2.8 ± 0.2 (3.0 ± 0.3) |
| СN ± m | 0.4 ± 0.1 (0.3 ± 0.1) | 0.2 ± 0.05 (0.3 ± 0.1) | 0.2 ± 0.03 (0.2 ± 0.1) |
| Nmax(%) ± m | 48.8 ± 12.5 (48.7 ± 13.2) | 39.3 ± 6.7 (38.1 ± 10.3) | 36.9 ± 5.7 (33.5 ± 5.9) |
| VR | 124.1 (75.4) | 68.5 (68.1) | 54.5 (53.5) |
| B-K ± m | 0.83 ± 0.05 (0.87 ± 0.03) | 0.72 ± 0.02 (0.75 ± 0.03) | 0.69 ± 0.04 (0.67 ± 0.06) |
| βD | 0.54 (0.53) | 0.47 (0.46) | 0.44 (0.41) |
| Rtax ± m | 0.4 ± 0.1 (0.3 ± 0.1) | 0.4 ± 0.1 (0.3 ± <0.1) | 0.4 ± 0.1 (0.5 ± 0.1) |
| MDtax ± m | 47.9 ± 6.9 (38.0 ± 4.6) | 55.4 ± 7.5 (46.5 ± 7.8) | 63.8 ± 3.2 (62.7 ± 3.9) |
| Rtroph ± m | 0.6 ± 0.1 (0.5 ± 0.1) | 0.6 ± 0.05 (0.6 ± 0.1) | 0.6 ± 0.1 (0.7 ± <0.1) |
| MDtroph ± m | 70.0 ± 4.1 (66.5 ± 5.4) | 70.7 ± 1.6 (70.6 ± 1.5) | 71.2 ± 3.6 (74.6 ± 1.6) |
Таксономическая и трофическая энтропия Рао не показала однонаправленных тенденций для разных озер в течение исследуемого периода. В то же время, средние таксономические и трофические дистанции для озер от 2011 г. к 2013 г. в целом выросли во всех озерах, кроме озер Б. Голое и М. Голое, в которых однозначной тенденции не наблюдалось (табл. 3).
Таблица 3.
Средняя дистанция между видами в таксономической и трофической иерархии, разнообразие Рао и индекс Пантле–Букка
| Озеро | Год | Rtax | MDtax | Rtroph | MDtroph | P–B |
|---|---|---|---|---|---|---|
| МГ | 2011 | 0.75 | 70.69 | 0.80 | 79.51 | 2.67 |
| 2012 | 0.46 | 72.48 | 0.53 | 72.30 | 2.56 | |
| 2013 | 0.38 | 68.90 | 0.38 | 77.13 | 2.47 | |
| БГ | 2011 | 0.46 | 71.51 | 0.47 | 79.59 | 2.70 |
| 2012 | 0.70 | 74.74 | 0.66 | 69.83 | 2.40 | |
| У | 2011 | 0.21 | 24.96 | 0.37 | 61.73 | 2.10 |
| 2012 | 0.42 | 51.21 | 0.62 | 73.56 | 2.40 | |
| 2013 | 0.50 | 56.12 | 0.65 | 70.41 | 2.33 | |
| БЩ | 2011 | 0.51 | 38.94 | 0.63 | 65.70 | 2.20 |
| 2012 | 0.41 | 48.88 | 0.69 | 72.85 | 2.63 | |
| 2013 | 0.29 | 52.78 | 0.60 | 76.17 | 2.54 | |
| БП | 2011 | 0.46 | 47.56 | 0.73 | 74.91 | 2.41 |
| 2012 | 0.25 | 57.52 | 0.37 | 59.38 | 2.42 | |
| 2013 | 0.65 | 70.37 | 0.75 | 78.80 | 2.55 | |
| К | 2011 | 0.12 | 31.84 | 0.25 | 61.00 | 2.48 |
| 2012 | 0.24 | 21.30 | 0.58 | 71.50 | 2.30 | |
| 2013 | 0.36 | 63.57 | 0.68 | 77.42 | 2.63 |
Значения индекса Пантле–Букка в период исследований изменялись незначительно и разнонаправлено, варьируя в области границы α- и β‑мезосапробной зон (табл. 3).
Зарегистрированы изменения в составе фауны по представленности видов с различной сапробной валентностью. В 2011 г. большинство озер характеризовалось увеличением от олигосапробов к β- и α-мезосапробам, с дальнейшим снижением в ряду полисапробов V и VI подгрупп. Специфичная сапробиологическая структура макрозообентоса формировалась в оз. Б. Голое и М. Голых, соединенных с основной рекой через протоку. Озеро Б. Голое в этот период выделялось бóльшим числом олигосапробов и меньшим α-мезосапробов, преобладанием полисапробов VI подгруппы; оз. М. Голое –меньшим числом β-мезосапробов и бóльшим α-мезосапробов (рис. 3а).
Рис. 3.
Сапробиологическая структура сообществ озер по методу Зелинки–Марвана: a – 2011 г., б – 2012 г., в – 2013 г. II(o) – олигосапробы, III(b) – β-мезосапробы, IV(a) – α-мезосапробы, V(p) – полисапробы подгруппы V, VI(p) – полисапробы подгруппы VI. Обозначения озер, как на рис. 2 .
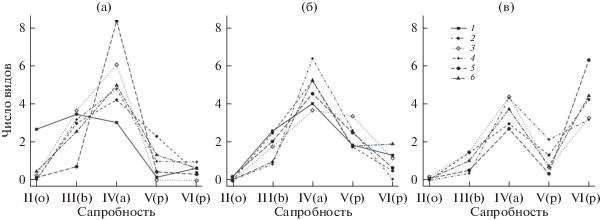
В 2012 г., после сильного весеннего половодья, сапробиологическая структура большинства озер несколько выровнялась, озера Б. Голое и М. Голое стали соответствовать общей тенденции, а в небольших по площади и сильно заросших в 2011 г. озерах Ульяновское и Б. Щурячье повысилось число видов полисапробов (рис. 3б).
В 2013 г., также с весенним половодьем, во всех озерах произошло увеличение числа видов полисапробов подгруппы VI, превысившее число α-мезосапробов (рис. 3в).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По данным Давыденко и Бирюкова (2014), в период 1935–1973 гг. частота интенсивных весенних паводков была в 5 раз выше, чем в период 1974–2012 гг. Паводок 2012 г. прервал самый засушливый с 1972 г. период и произошел после минимального уровня грунтовых вод в 2011 г. (в 75% наблюдательных скважин), когда среди озер заповедника большая их часть (61%) оказалась в критическом (абсолютный минимум уровня) или близком к нему состоянии (Давыденко, Бирюков, 2014).
Известно, что изменения качества факторов среды или выход силы воздействия за диапазон значений, обеспечивающих стабильное функционирование экосистем, выводит их из равновесия и вызывает структурные и функциональные перестройки (Lewontin, 1969; Алимов, 2000; Scheffer et al., 2001 и др.). В рассмотренный нами период 2012–2013 гг. перестройки структуры сообществ наблюдались в условиях резкого увеличения продолжительности половодья после многолетнего засушливого периода, из которого был изучен 2011 г., характеризовавшийся для большинства озер многолетним отсутствием связи с рекой, а также высокими температурами воздуха и воды.
Большинство использованных методов показали значимые отличия 2011 г. от 2012, 2013 гг., тогда как различия между 2012 и 2013 гг. оказались статистически незначимы при сохранении тенденции. Так, в ряду лет происходило увеличение фаунистического сходства макрозообентоса озер (табл. 2), а также структурного сходства сообществ, выражавшегося в снижении вариации энтропии Реньи (рис. 2) и β-разнообразия сообществ (рис. 1). В то же время, α-разнообразие, таксономическая и трофическая неоднородность в большинстве озер увеличивались.
В 2011 г. специфичная сапробиологическая структура макрозообентоса формировалась в оз. М. Голое и Б. Голое, имеющих связь с рекой. В 2012 г., после сильного весеннего половодья, сапробиологическая структура большинства озер выровнялась, а в 2013 г. во всех озерах произошло увеличение числа видов полисапробов. Это свидетельствует о вовлечении в круговорот дополнительной, вероятно, терригенной органики и выравнивании трофического статуса в озерах за счет весенних паводков, что подтверждается изменением коэффициента трофности зоопланктона (Krylov, 2015; Крылов, Жгарева, 2016).
Таким образом, в 2012–2013 гг., по сравнению с 2011 г., наблюдается увеличение сходства: фаунистического состава сообществ озер, доминантно-информационной (рис. 2) и сапробиологической (рис. 3) структур сообществ. В этот период увеличивается число видов, общих для всех озер (с одного до четырех). Данную ситуацию можно описать как гомогенизацию (Thomaz et al., 2007) сообществ макрозообентоса, которую мы связываем с изменением продолжительности весеннего половодья.
В период исследований в озерах, не имеющих постоянной связи с рекой, увеличивается видовое богатство, а также таксономическая и трофическая неоднородность (табл. 3). Это связано с тем, что виды разной таксономической и трофической принадлежности впервые регистрируются в 2012–2013 гг. сразу в нескольких озерах.
В экстремальных условиях 2011 г. сообщества большинства озер (за исключением М. Голое) характеризуются пониженным видовым богатством, низким таксономическим и трофическим разнообразием (табл. 1–3) при высокой степени доминирования отдельных видов. После заполнения озер полыми водами в 2012–2013 гг., в сообществах снижается доля численности первого доминанта (Nmax, %), значения α, СN, при увеличении n, H, MDtax, MDtroph (табл. 3). Для всех показателей, кроме n, в период исследований снижается ошибка среднего, показывающая разброс значений (табл. 2). Выявленные тенденции проявляются более четко для сообществ четырех озер, которые не имеют постоянной связи с рекой, где, в том числе, возрастают значения Rtax и более выражено Rtroph (табл. 3).
Полученные данные свидетельствуют, что сообщества озер, постоянно связанные с рекой, характеризуются меньшей зависимостью структурных показателей от межгодовых изменений продолжительности весеннего половодья. Таким образом, существование постоянной связи с рекой можно считать важным фактором не только для формирования более разнообразных и обильных сообществ (Pan et al., 2011; Reid et al., 2012; Obolewski et al., 2014, 2016), но и для сохранения их структурной стабильности.
Одним из основных признаков приближения к точке слома (потери устойчивости) считается увеличение дисперсии флуктуаций параметров системы (Dakos et al., 2011, 2019; Barnosky et al., 2012). Описанная нами выше противоположная картина повышения разнообразия и гомогенизации сообществ, проявляющаяся на уровне их состава и структуры, может свидетельствовать о том, что после продолжительного половодья они приобретают черты более устойчивых систем, удаляющихся от точки слома. Это новое понимание важности регулярного половодья для сообществ на уровне их структуры имеет значение для сохранения и восстановления сообществ в современных условиях, которые описываются (Tockner et al., 2000; Tockner, Stanford, 2002; Erwin, 2009) как деградация пойменных экосистем в мировом масштабе.
Выводы. В условиях увеличения продолжительности весеннего половодья в макрозообентосе озер происходит гомогенизация видового состава, сапробиологической и доминантно-информационной структуры сообществ при росте таксономического и трофического разнообразия. Основное направление структурных перестроек сообществ в этот период – рост выравненности распределения обилия видов. Увеличение числа видов-полисапробов, вероятно, свидетельствует о неполном завершении восстановления структуры сообществ в течение двух лет с длительным периодом половодья. Межгодовые изменения структуры сообществ более заметны в сообществах озер, не имеющих постоянной связи с рекой. Структурные показатели сообществ свидетельствуют, что длительное весеннее половодье следует воспринимать как благоприятный фактор для их организации, в отличие от краткого паводка или его отсутствия.
Список литературы
Алимов А.Ф. 2000. Элементы теории функционирования водных экосистем. Санкт-Петербург: Наука.
Арабина И.П., Савицкий Б.П., Рыдный С.А. 1988. Бентос мелиоративных каналов Полесья. Минск: Ураджай.
Давыденко В.В., Бирюков В.И. 2014. Особенности гидрологии поверхностных и грунтовых вод в Хоперском заповеднике // Труды Хоперского государственного заповедника. Вып. 9. С. 83.
Жгарева Н.Н. 2007. Фауна зарослей // Экосистема малой реки в изменяющихся условиях среды. Москва: Товарищество. науч. изданий КМК. С. 249.
Крылов А.В. 2013. Видовое богатство зоопланктона пойменных озер Хоперского заповедника // Тр. Хоперского гос. заповедника. Вып. 8. С. 54.
Крылов А.В., Жгарева Н.Н. 2016. Влияние поемности на летний зоопланктон малых озер // Известия РАН. Сер. географическая. № 1. С. 58. https://doi.org/10.15356/0373-2444-2016-1-58-66
Максимов А.А. 1974. Структура и динамика биоценозов речных долин. Новосибирск: Наука.
Мосин В.Г., Ефимовская С.Л. 2007. Влияние паводков и половодий на динамику и функционирование пойменных природных комплексов долины р. Вычегды // Известия Российского государственного педагогического университета им. А. И. Герцена. № 38. С. 130.
Прокин А.А. 2014a. Количественные и структурные характеристики сообществ макрозообентоса пойменных озер Хоперского заповедника // Тр. Хоперского гос. заповедника. Вып. 9. С. 211.
Прокин А.А. 2014б. Макрозообентос пойменных озер Хоперского заповедника, по данным 2013 г. // Проблемы разработки полезных ископаемых и стратегия устойчивого развития регионов России (на примере Воронежской области): Матер. науч. конф. Воронеж: Элист. С. 140.
Прокин А.А., Решетников А.Н. 2013. Фауна водных макробеспозвоночных пойменных озер Хоперского заповедника // Тр. Хоперского гос. заповедника. Вып. 8. С. 137.
Прокин А.А., Селезнев Д.Г. 2018. Межгодовые измения видового богатства и количественных характеристик макрозообентоса пойменных озер Хоперского заповедника // Биология внутр. вод. № 1. С. 60. https://doi.org/10.7868/S0320965218010084
Силина А.Е., Прокин А.А. 2008. Трофическая структура макрозообентоса болотных водоемов лесостепной зоны Среднерусской возвышенности // Биология внутр. вод. № 3. С. 35.https://doi.org/10.1134/S1995082908030061
Фащевский Б.В. 2007. Экологическое значение поймы в речных экосистемах // Ученые записки Росс. гос. гидромет. ун-та. № 5. С. 118.
Шитиков В.К., Мастицкий С.Э. 2017. Классификация, регрессия и другие алгоритмы Data Mining с использованием R. Электронная книга, адрес доступа: https://github.com/ranalytics/data-mining
Якимов В.Н., Гелашвили Д.Б., Розенберг Г.С., Кривоногов Д.М. 2016. Современные методы анализа филогенетического разнообразия экологических сообществ // Сборник трудов Зоологического музея МГУ им. М.В. Ломоносова. Т. 54. С. 72.
Яблонский А.И. 1986.Математические модели в исследовании науки. Москва: Наука.
Яценко-Степанова Т.Н. 2011. Структурно-функциональная характеристика водорослевого сообщества и ее использование в оценке трофности водоемов озерного типа: Автореф. дис. … докт. биол. наук. Оренбург.
Anderson M.J. 2006. Distance-based tests for homogeneity of multivariate dispersions // Biometrics. V. 62. № 1. P. 245. https://doi.org/10.1111/j.1541-0420.2005.00440.x
Anderson M.J., Ellingsen K.E., Mc Ardle B.H. 2006. Multivariate dispersion as a measure of beta diversity // Ecology Letters. V. 9. Issue 1. P. 683. https://doi.org/10.1111/j.1461-0248.2006.00926.x
Barnosky A., Hadly E., Bascompte J. et al. 2012. Approaching a state shift in Earth’s biosphere // Nature. V. 486. P. 52. https://doi.org/10.1038/nature11018
Bunn S.E., Arthington A.H. 2002. Basic principles and ecological consequences of altered flow regimes for aquatic biodiversity // Environ. Manage. V. 30. P. 492. https://doi.org/10.1007/s00267-002-2737-0
Clarke K.R., Warwick R.M. 1998. A taxonomic distinctness index and its statistical properties // J. Appl. Ecol. V. 35. P. 523. https://doi.org/10.1046/j.1365-2664.1998.3540523.x
Dakos V., Kéfi S., Rietkerk M., van Nes E.H., Scheffer M. 2011. Slowing down in spatially patterned ecosystems at the brink of collapse // The American Naturalist. V. 177(6). P. 153. https://doi.org/10.1086/659945
Dakos V., Matthews B., Hendry A.P. et al. 2019. Ecosystem tipping points in an evolving world // Nature Ecology and Evolution. V. 3. P. 355. https://doi.org/10.1038/s41559-019-0797-2
Erwin K.L. 2009. Wetlands and global climate change: the role of wetland restoration in a changing world // Wetlands Ecol. Manage. V. 17(1). P. 71. https://doi.org/10.1007/s11273-008-9119-1
Fauna Aquatica Austriaca. A comprehensive species inventory of Austrian aquatic organisms with ecological notes. 2002. Vienna: Federal Ministry of Agriculture, Forestry, Environment and Water management.
Junk W.J., Bayley P.B., Sparks R.E. 1989. The flood pulse concept in river-floodplain systems // Can. J. Fish. Aquat. Sci. V. 106. P. 110.
Krylov A.V. 2015. Interannual changes in the summer zooplankton in the lakes of the Khopyor River flood plain // Biol. Bull. V. 42. № 10. P. 891. https://doi.org/10.1134/S1062359015100076
Lewontin R.C. 1969. The meaning of stability // Brookhaven Symp. Biol. V. 22. P. 13.
Monakov A.V. 2003. Feeding of freshwater invertebrates. Ghent: Kenobi Productions.
Napiórkowski P., Bakowska M., Mrozińska N. et al. 2019. The effect of hydrological connectivity on the zooplankton structure in floodplain lakes of a regulated large river (the Lower Vistula, Poland) // Water. V. 11. 1924. https://doi.org/10.3390/w11091924
Obolewski K., Glińska-Lewczuk K., Strzelczak A., Burandt P. 2014. Effects of floodplane lake restoration on macroinvertebrate assemblages – a case study of the lowland river (the Słupia River, N Poland) // Polish J. Ecol. V. 62. P. 557. https://doi.org/10.3161/104.062.0314
Obolewski K., Glińska-Lewczuk K., Ozgo M., Astel A. 2016. Connectivity restoration of floodplain lakes: an assessment based on macroivertebrate communities // Hydrobiologia. V. 774. P. 23. https://doi.org/10.1007/s10750-015-2530-8
Obrdlik P., Garcia-Lozano L. 1992. Spatio-temporal distribution of macrozoobenthos abundance in the Upper Rhine alluvial floodplain // Archiv für Hydrobiologie. Bd. 124. № 2. P. 205.
Odum E.P. 1969. The strategy of ecosystem development // Science. V. 164. Issue 3877. P. 262. https://doi.org/10.1126/science.164.3877.262
Pan B.-Zh., Wang H-J., Liang X-M., Wang H-Zh. 2011. Macrozoobenthos in Yangtze floodplain lakes: patterns of density, biomas, and production in relation to river connectivity // J. North American Benthological Society. V. 30(2). P. 589. https://doi.org/10.1899/10-025.1
Rao C.R. 1982. Diversity and dissimilarity coefficients: a unified approach // Theoretical Population Biology. V. 21(1). P. 24. https://doi.org/10.1016/0040-5809(82)90004-1
Reid M.A., Delong M.D., Thoms M.C. 2012. The influence of hydrological connectivity on food web structure in floodplain lakes // River Research and Applications. V. 28. P. 827. https://doi.org/10.1002/rra.1491
Scheffer M., Carpenter S.R., Foley J. et al. 2001. Catastrophic shifts in ecosystems // Nature. V. 413. P. 591. https://doi.org/10.1038/35098000
Simpson E.H. 1949. Measurement of diversity // Nature. V. 163. № 4148. P. 668. https://doi.org/10.1038/163688a0
Thomaz S.M., Bini L.M., Bozelli R.L. 2007. Floods increase similarity among aquatic habitats in river floodplain system // Hydrobiologia. V. 579. P. 1. https://doi.org/10.1007/s10750-006-0285-y
Tockner K., Florian M., Ward J.V. 2000. An extension of the flood pulse concept // Hydrological Processes. V. 14. P. 2861. https://doi.org/10.1002/1099-1085(200011/12)14:16/17< 2861::AID-HYP124>3.0.CO;2-F
Tockner K., Stanford J.A. 2002. Riverine flood plains: present state and future trends // Environ. Conserv. V. 29. P. 308. https://doi.org/10.1017/S037689290200022X
Van den Brink F.W.B., Beljaaeds M.J., Boots N.C.A., Van der Velde G. 1994. Macrozoobenthos abundance and community composition in three lower Rhine floodplain lakes with varying inundation regimes // Regulated Rivers: Research and Management. V. 9(4). P. 279. https://doi.org/10.1002/rrr.3450090408
Von Foerster H. 2003. Understanding understanding: essays on cybernetics and cognition. New York: Springer.
Zelinka M., Marvan P. 1961. Zur Prazisierung der biologischen Klassification der Reinheit flissender Gewasser // Archiv für Hydrobiologie. Bd. 57. № 3. S. 389.
Zelinka M., Marvan P. 1966. Bemerkungen zu neuen Metoden der saprobiologischen Wasserbeurteilung // Verhandlungen des Internationalen Verein Limnologie. Bd. 16. S. 817.
Zipf J.K. 1949. Human behaviour and the principle of least effort. Cambridge: Addison Wesley Press.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


