Биология внутренних вод, 2022, № 1, стр. 3-13
Функциональная классификация фитопланктона и микробиологические параметры для оценки состояния прибрежных вод Южного Байкала
Д. В. Малашенков a, *, И. В. Мошарова b, В. В. Ильинский a, С. А. Мошаров b
a Московский государственный университет им. М.В. Ломоносова
Москва, Россия
b Институт океанологии им. П.П. Ширшова Российской академии наук
Москва, Россия
* E-mail: dvmalashenkov@gmail.com
Поступила в редакцию 28.01.2021
После доработки 17.02.2021
Принята к публикации 17.03.2021
- EDN: DIYFDC
- DOI: 10.31857/S0320965222010089
Аннотация
На основании исследований структуры фитопланктона и количественных микробиологических параметров дана оценка экологического состояния прибрежных вод южного участка оз. Байкал в июне 2017 г. Выявлено 19 функциональных групп, пять из которых играли основную роль: Z (пикопланктонные цианобактерии из олиготрофных озер), LO (динофлагелляты и цианобактерии, характерные для мезотрофных озер в летний период), X1 (виды, типичные для богатых биогенами мелководных озер), MP (тихо- и меропланктонные организмы, в основном диатомеи), E (фитофлагелляты, типичные для олиготрофных водоемов). Значения индекса сообщества Q, полученного на основании данных о структуре фитопланктона, указывали на “отличный” экологический статус озера. По данным о содержании хлорофилла а и микробиологическим параметрам воды южной части оз. Байкал охарактеризованы как олиготрофные и олигосапробные. Тем не менее, на станциях в районе мыса Шаманский и г. Байкальск наблюдали тенденцию к мезотрофному и β-мезосапробному статусу. Отсутствие корреляционных связей между параметрами, характеризующими уровень развития фито- и бактериопланктона, также может свидетельствовать в пользу олиготрофного статуса прибрежных вод южной части оз. Байкал.
ВВЕДЕНИЕ
Озеро Байкал – крупнейший континентальный водоем в мире, находящийся под защитой ЮНЕСКО как объект Всемирного наследия. В настоящее время основные экологические проблемы озера связаны с эвтрофикацией прибрежных вод (Бондаренко, Логачева, 2016; Izmest’eva et al., 2016; Kobanova et al., 2016; Khodzher et al., 2017). Известно, что антропогенному воздействию в наибольшей степени подвержена именно южная часть озера. Это связано с высокой рекреационной нагрузкой и влиянием ранее накопленных отходов Байкальского целлюлозно-бумажного комбината (Афонина и др., 2015).
Известно, что прибрежные озерные воды наиболее уязвимы к антропогенному воздействию, поскольку именно в литоральных зонах крупных древних озер формируется наибольшее видовое разнообразие планктонных и бентосных сообществ (Timoshkin et al., 2016). Фито- и бактериопланктон cчитаются наиболее чувствительными индикаторами состояния окружающей среды, поскольку быстро реагируют на ее изменения (Reynolds, 2006; Bellinger, Sigee, 2015). Состояние этих групп организмов часто отражают экологическую ситуацию в водоеме (Crossetti, Bicudo, 2008).
В современных исследованиях широко используется экосистемный подход, при котором оценивают состав и структурные показатели продуцентов (функциональные группы фитопланктона, индекс сообщества, физиологическое состояние), а также количественные характеристики организмов-редуцентов (в основном гетеротрофного бактериопланктона) (Padisák et al., 2009; Cremona et al., 2014; Семенченко, Разлуцкий, 2017).
Цель работы – дать оценку состоянию прибрежных вод Южного Байкала, основанную на функциональной классификации фитопланктона и на микробиологических показателях.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
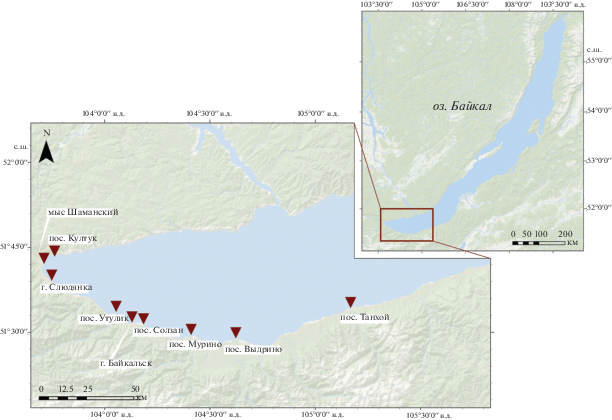
Отбор проб. Исследования проводили на девяти прибрежных станциях, расположенных вблизи населенных пунктов вдоль южной, наиболее плотно заселенной части оз. Байкал в период с 18 по 20 июня 2017 г. (рис. 1). Пробы отбирали на расстоянии 10 м (прибрежные станции, “прибрежье”) и 100 м от береговой линии озера (удаленные станции, “открытая вода”). Пробы для исследования фитопланктона и содержания Хл а и феофитина отбирали с глубины 0.5 м батометром Руттнера (объем 1 л). Пробы бактериопланктона отбирали с той же глубины батометром-бутылкой. Батометр-бутылка представляла собой предварительно простерилизованную склянку, закрытую притертой пробкой, и закрепленную с помощью хомута на металлической трубке длиной 1.5 м. Батометр погружали на заданную глубину и, удерживая его на этой глубине, выдергивали из склянки пробку с помощью лески, предварительно прикрепленной к пробке. После заполнения склянки водой батометр-бутылку извлекали и закрывали склянку стерильной пробкой. Фиксацию проб фито- и бактериопланктона осуществляли нейтрализованным формалином (конечная концентрация формальдегида – 4%).
Анализ проб фитопланктона. Пробы концентрировали общепринятым осадочным методом (Садчиков, 2003). Идентификацию и оценку численности фитопланктона проводили под микроскопом “Leica DM2500” (Leica Microsystems, Германия) с DIC-контрастом и рабочими увеличениями ×400, 630, 1000 с использованием программного обеспечения LAZ EZ (Leica Microsystems). Для подсчета численности клеток использовали счетные камеры c сеткой типа “Нажотта” объемом 0.05 мл; для каждой пробы просчитывали ≥3000 кл. (Садчиков, 2003). Для расчета биообъемов клеток фитопланктона использовали метод геометрического подобия (Hillebrand et al., 1999; Sun, Liu, 2003). Сумму биообъемов всех клеток конвертировали в общую биомассу, выраженную в мг/л.
Определение содержания хлорофилла а и феофитина. Пробы воды (300 мл) фильтровали через стекловолокнистые фильтры GF/F (Whatman®, MilliporeSigma, США) под вакуумом 0.2 атм., которые затем помещали в 90%-ный ацетон для получения экстрактов. Содержание Хл а и феофитина в экстракте определяли флуориметрически (UNESCO, 1994; Arar, Collins, 1997; Holm-Hansen et al., 2005).
Анализ проб бактериопланктона. Для учета общей численности бактерий применяли метод эпифлуоресцентной микроскопии с окраской бактериальных клеток водным раствором акридинового оранжевого (Практическая гидробиология…, 2006). Просчитывали ≥30 полей зрения на каждом фильтре, при этом суммарная численность просчитанных клеток была ≥400.
Обработка данных и статистический анализ. Идентифицированные и просчитанные виды фитопланктона объединяли в ФГ в соответствии с классификацией, предложенной (Reynolds et al., 2002) с дополнениями (Padisák et al., 2009). Численность и биомассy ФГ использовали для расчета фитопланктонного индекса Q (Padisák et al., 2006).
Индекс сапробности S (Sládeček, 1973) рассчитывали с помощью таблиц видов-индикаторов сапробности, составленных (Marvan et al., 2005). Для сравнения сообществ на разных участках вычислен индекс сходства Брея–Кертиса. По показателям Хл a рассчитывали индекс трофического состояния (TSI) (Carlson, 1977).
Для определения зависимостей между группами вычисляли коэффициенты корреляции Пирсона или Спирмена (исходя из полученных результатов теста Шапиро–Уилка о нормальности распределения выборки). Значимость различий между выборками определяли с помощью дисперсионного анализа (ANOVA) и критерия Краскела–Уоллиса, а также T-критерия Уилкоксона для попарного сравнения выборок. Статистический анализ данных проводили с использованием программных пакетов PAST v. 4.02 (Hammer et al., 2001) и Statistica 10.0 (StatSoft, США). Значения средних величин представлены с указанием стандартной ошибки (±SE).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фитопланктон. В период наблюдений в фитопланктоне Южного Байкала выявлено 119 видов, представляющих девять таксономических групп. Наибольшим видовым богатством характеризовались группы Bacillariophyta (45 видовых и внутривидовых таксонов), Chlorophyta (28) и Cyanobacteria (25); на долю других таксономических групп приходилось в сумме <18% общего числа идентифицированных видов (рис. 2а).
Рис. 2.
Таксономический состав (а) и распределение видов по 19 ФГ (б) фитопланктона Южного Байкала в июне 2017 г. ◼ – наиболее богатые видами ФГ (обозначения см. табл. 1).
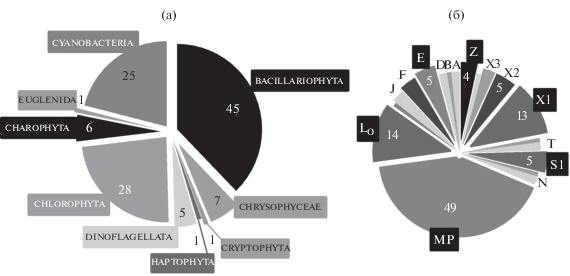
Среди идентифицированных видов фитопланктона отмечены представители 19 ФГ (краткое описание доминирующих ФГ дано в табл. 1). Функциональные группы фитопланктона объединяют в себе виды, характеризующиеся сходной физиологией, морфологией и экологией, имеющие сопоставимые потребности и оптимумы и, зачастую, сосуществующие в сообществе (Salmaso et al., 2015). Наибольшая доля видов относилась к группе MP (49 видов), представляющей тихо- и меропланктонные автотрофные организмы (в основном диатомеи), которые могут случайно попадать в фитопланктон из других сообществ (Padisák et al., 2009). Кроме того относительно высоким обилием отличалась группа LO (14 видов), представленная динофлагеллятами и колониальными цианобактериями, типичными для поверхностных вод мезотрофных озер в летний период, и группа X1 (13 видов), включающая организмы, характерные для перемешанного слоя эвтрофных мелководных озер (рис. 2б).
Таблица 1.
Функциональные группы (ФГ) в фитопланктоне южной акватории оз. Байкал (июнь 2017 г.)
| ФГ | Число видов | Описание | Доминирующие таксоны |
|---|---|---|---|
| E | 5 | Миксотрофные фитофлагелляты, типичные для бедных биогенами водоемов | Dinobryon sociale, D. bavaricum |
| F | 4 | Колонии зеленых водорослей, типичных для глубоко перемешанных мезо-эвтрофных озер | Elakatothrix gelatinosa Oocystis sp. |
| K | 1 | Колонии пикоцианобактерий, типичных для богатых биогенами вод | Romeria sp. |
| LO | 14 | Динофлагелляты и некоторые колониальные цианобактерии, характерные для поверхностных вод мезотрофных озер в летний период | Gymnodinium baicalense, Anathece minutissima, Cyanodictyon planctonicum |
| MP | 49 | Тихо- и меропланктонные автотрофные организмы, которые могут случайно попадать в фитопланктон из других сообществ | Диатомеи из родов Cymbella, Gomphonema, Amphora, Navicula и др. |
| S1 | 5 | Нитчатые цианобактерии, адаптированные к условиям низкой освещенности в перемешанных мутных водах | Pseudanabaena minima, Planktolyngbya limnetica |
| T | 2 | Виды (в основном нитчатые харовые и зеленые водоросли), характерные для глубокого хорошо перемешанного эпилимниона в летний период | Mougeotia sp. |
| X1 | 13 | Виды, характерные для перемешанного слоя эв- и гиперэвтрофных мелководных озер | Ankistrodesmus arcuatus, Monoraphidium contortum |
| Y | 1 | Криптомонады и небольшие динофлагелляты, способные обитать в разнообразных средах при условии низкого пресса зоопланктона | Cryptomonas sp. |
| Z | 4 | Одноклеточные пикоцианобактерии, характерные для металимниона и верхнего гиполимниона олиготрофных озер | Synechococcus sp., Cyanobium sp., Synechocystis sp. |
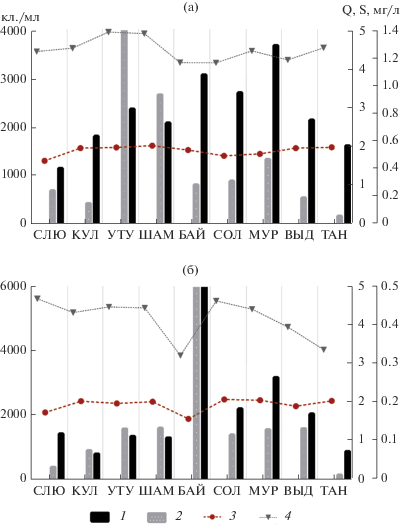
Наибольшая численность фитопланктона в пробах, отобранных в прибрежной зоне, отмечена на участке у пос. Мурино (рис. 3а), где по численности доминировала зеленая водоросль Ankistrodesmus arcuatus Korshikov (кодон X1), а также одноклеточные и колониальные пикоцианобактерии (кодон Z), наибольшая биомасса – в районе пос. Утулик, где отмечали массовое развитие диатомей из MP-группы, в частности видов рода Cymbella. На удалении от берега наибольшая численность и биомасса фитопланктона зарегистрирована в районе г. Байкальск (рис. 3б). Здесь наблюдали активное развитие хризофитовых из рода Dinobryon (в особенности D. sociale (Ehrenberg) Ehrenberg, кодон E), а также одноклеточных пикоцианобактерий. В целом, численность и биомасса фитопланктона были выше в прибрежных водах, чем на удалении от берега (Кращук и др., 2020). Более высокие показатели биомассы в прибрежье (в среднем в 2 раза) обусловлены бóльшим присутствием здесь крупноклеточных тихопланктонных диатомей.
Рис. 3.
Показатели общей численности (кл./мл) и биомассы (мг/л) фитопланктона, индекса сапробности S и фитопланктонного индекса Q в прибрежной зоне (а) и на удалении от берега (б) в южной части оз. Байкал. 1 – общая численность, 2 – общая биомасса, 3 – индекс сапробности S, 4 – фитопланктонный индекс Q. По оси абсцисс – станции: СЛЮ – г. Слюдянка, КУЛ – пос. Култук, УТУ – пос. Утулик, ШАМ – мыс Шаманский, БАЙ – г. Байкальск, СОЛ – пос. Солзан, МУР – пос. Мурино, ВЫД – пос. Выдрино, ТАН – пос. Танхой.
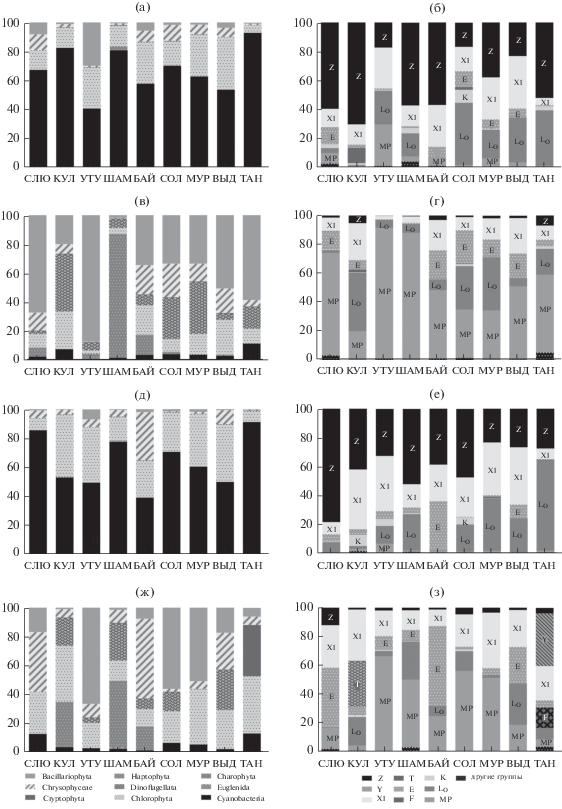
В целом, и в прибрежной зоне, и на открытой воде основными организмами, формирующими численность фитопланктона, были цианобактерии из функциональных групп Z и LO, а также зеленые водоросли из группы X1 (рис. 4а, 4б и рис. 4д, 4е). В то же время, на некоторых участках в прибрежной зоне заметный вклад в общую численность вносили диатомеи из группы MP, а на удалении от берега активнее развивались хризофитовые из группы E, типичные в бедных биогенами олиготрофных озерах. Основной вклад в биомассу на большинстве станций в прибрежной зоне вносили тихопланктонные диатомеи из группы МР. Кроме того, на станциях Култук, Солзан и Мурино относительно высокая биомасса отмечена для цианобактерий из группы LO (рис. 4в, 4г). Биомасса фитопланктона на удаленных от берега станциях (Утулик, Шаманский, Солзан, Мурино) также формировалась в основном за счет диатомей из группы MP. На станциях Слюдянка и Байкальск доминирующее положение по биомассе занимали виды рода Dinobryon из группы E, на ст. Выдрино отмечена повышенная биомасса динофлагеллят Gymnodinium baicalense Antipova из группы LO. На ст. Култук по биомассе доминировала нитчатая харовая водоросль cf. Mougeotia sp. из группы T, на ст. Танхой – криптофитовые рода Cryptomonas из группы Y (рис. 4ж, 4з).
Рис. 4.
Вклад (%) таксономических (а, в, д, ж) и функциональных (б, г, е, з) групп в общую численность (а, б, д, е) и биомассу (в, г, ж, з) фитопланктона на прибрежных участках (а–г) и в 100 м от берега (д–з) Южного Байкала. Остальные обозначения, как на рис. 3.
Полученные результаты соотносятся с данными предыдущих лет по видовому составу фитопланктона оз. Байкал и по его основным ФГ в исследованный сезон (Reynolds, 2006; Поповская и др., 2015), в том числе со значительной ролью в этот период пикопланктонных цианобактерий из Z-группы (Nakano et al., 2003; Belykh et al., 2006; Белых и др., 2011), характерных для металимниона олиготрофных озер (Reynolds et al., 2002). Наши данные подтверждают результаты предыдущих исследований, свидетельствующих о наличии потенциально миксотрофных хризофитовых, криптомонад и динофлагеллят (Reynolds, 2006; Hampton et al., 2014) и уменьшении роли центрических диатомей из B-группы, в частности Aulacoseira baikalensis (Wislouch) Simonsen, A. islandica (O. Müller) Simonsen и Stephanodiscus meyeri Genkal & Popovskaya, в последние годы (Бондаренко, Логачева, 2016; Bondarenko et al., 2019, 2020a, 2020b). Несмотря на отмечавшееся в весенний период 2017 г. в южной акватории озера массовое развитие диатомеи Synedra acus subsp. radians (Kützing) Skabichevskii (D-кодон) (Bondarenko et al., 2020a), во второй половине июня доля данного вида в сообществе оказалась незначительна, что может свидетельствовать о переходе к фазе “чистой воды”.
Дисперсионный анализ не позволил выявить статистически значимые различия в структуре фитопланктона, как между станциями, а также при сравнении сообществ в прибрежье и на удаленных от берега участках озера. В подтверждение этому, индекс сходства Брея–Кертиса показал в целом невысокие значения для прибрежных (0.13 ± 0.02) и удаленных от берега станций (0.10 ± 0.02) и при сравнении структуры сообщества в прибрежье и на открытой воде (0.25 ± 0.1). Расчет T-критерия Уилкоксона позволил выявить статистически значимые различия в структуре фитопланктона в прибрежье и на удалении от берега лишь для станций Байкальск (p <0.01) и Утулик (p <0.05). Для этих участков также отмечены минимальное (3.23, Байкальск, открытая вода) и максимальное (4.96, Утулик, прибрежье) значения индекса Q (рис. 3), который позволяет оценить качество воды в соответствии с классификацией с Водной рамочной директивой ЕС (WFD) (Padisák et al., 2006). Среднее значение этого показателя было 4.34 ± 0.45, что соответствует “отличному” экологическому статусу в системе WFD. Значения индекса сапробности (S) на всех станциях в акватории Южного Байкала в период исследований находились в рамках, характеризующих β-мезосапробную зону (Sládeček, 1973) – от 1.59 (Байкальск, открытая вода) до 2.1 (Солзан, прибрежье); в среднем 1.92 ± 0.15 (рис. 3).
Содержание Хл а и феофитина. Хл а – активная функциональная часть биомассы фитопланктона. Его содержание в водах южной части оз. Байкал в июне 2017 г. варьировало от 0.56 до 6.94 мкг/л (в среднем 1.88 ± 0.34 мкг/л). Полученные ранее данные (Зайцева, Дагурова, 2013; Шимараева и др., 2017) указывали на более низкий уровень содержания в воде Хл а (в среднем 1.16 ± 0.04 мкг/л) в летний период в местах туристско-рекреационного пользования.
На прибрежных станциях содержание Хл а варьировало в широких пределах – от 0.56 до 6.94 мкг/л (в среднем 2.14 ± 0.64 мкг/л). Наиболее высокое содержание Хл а отмечено в акваториях у мыса Шаманский и у г. Байкальск – 6.94 и 3.03 мкг/л соответственно (рис. 5). Содержание Хл а на удаленных от берега станциях в среднем оказалось ниже, чем в прибрежных водах. Размах варьирования был в меньших пределах 0.59–2.85 мкг/л (в среднем 1.62 ± 0.26 мкг/л). Максимальные значения также отмечены в районе мыса Шаманский и г. Байкальск (2.68 и 2.85 мкг/л соответственно).
Рис. 5.
Распределение концентрации Хл a (1, 2) и доли феофитина (3, 4) в воде прибрежных (1, 3) и удаленных (2, 4) станций южной части оз. Байкал. Остальные обозначения, как на рис. 3.
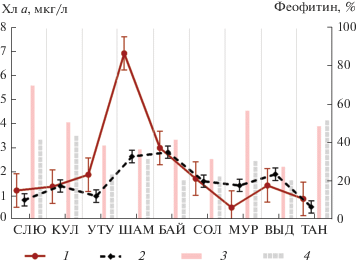
В период исследований доля феофитина (неактивной формы Хл а) в общей сумме Хл а и феофитина колебалась от 21 до 70% (в среднем 39 ± 3.2%). Высокие величины феофитина (в среднем 45 ± 0.04%) наблюдали в прибрежных водах озера, на удаленных станциях они были ниже (в среднем 32 ± 0.04%). Значения феофитина >40% соответствуют угнетенному состоянию фитопланктона и пониженной продукционной активности (Мошаров, Сергеева, 2018). Таким образом, на прибрежных станциях активность фитопланктона в среднем была ниже, несмотря на его более высокую биомассу, чем на удаленных станциях.
Содержание Хл а значимо коррелировало со значениями биомассы фитопланктона (r = 0.6 при n = 18 и p < 0.05), которые также были выше на прибрежных станциях по сравнению с удаленными. Среди ФГ наиболее сильно с содержанием Хл а коррелировала биомасса цианобактерий из группы S1 (r = 0.88, p < 0.001).
Средние значения индекса трофического состояния, рассчитанного по содержанию Хл а (34.9 ± 1.4), указывают на олиготрофный статус вод южной части озера. При этом значения этого индекса для станций Байкальск и Шаманский (41.5 и 49.6 в прибрежье и 40.9 и 40.3 – на открытой воде соответственно) характеризуют воды озера на этих участках как мезотрофные (Carlson, 1977).
Бактериопланктон. ОЧБ – показатель, дающий представление об общем количестве бактериопланктона в водоеме. Наиболее высокие значения ОЧБ были характерны для прибрежных станций – среднее значение ОЧБ для них достигало 1.42 ± 0.08 млн кл./мл при варьировании от 1.02 до 1.97 млн кл./мл (Мошарова и др., 2018). Численность бактериопланктона в водах удаленных от берега станций оказалась ниже (в среднем 1.32 ±0 .1 млн кл./мл) при варьировании от 0.93 до 1.79 млн кл./мл. Максимальные значения ОЧБ обнаружены в акватории у г. Байкальск и на прибрежной, и на удаленной от берега станции – 1.97 и 1.79 млн кл./мл соответственно. Наиболее низкие значения ОЧБ выявлены в водах станций, находящихся около пос. Танхой (1.02 млн кл./мл на прибрежной станции и 0.93 млн кл./мл на открытой воде).
На прибрежных станциях биомасса бактериопланктона была в среднем выше, чем на удаленных станциях. В прибрежье среднее значение достигало 144.34 ± 29.9 мг С/м3 при варьировании от 11.93 до 305.00 мг С/м3, на открытой воде – 95.01 ± 21.1 мг С/м3 и от 11.05 до 180.99 мг С/м3 соответственно). Максимальные значения биомассы обнаружены на прибрежных и удаленных станциях у г. Байкальск, минимальные – на прибрежных и удаленных станциях у пос. Танхой (max и min показатели даны в предыдущем предложении). Согласно ГОСТ 17.1.2.04–77, по средним величинам ОЧБ прибрежные воды обследованного южного участка оз. Байкал в июне 2017 г., за исключением станции у пос. Танхой, могут быть охарактеризованы как β-мезосапробные. Повышенные значения микробиологических показателей в прибрежных водах возле г. Байкальск, пос. Слюдянка и пос. Култук отмечают и другие авторы (Парфенова и др., 2008; Верхозина и др., 2014). Это обычно связывают с влиянием дренажных вод Байкальского целлюлозно-бумажного комбината, а также сточных вод из очистных сооружений прибрежных населенных пунктов (Афонина и др., 2015).
Известно, что обилие бактериопланктона зависит от присутствия в воде двух видов доступного органического вещества – аллохтонного и автохтонного. В водоемах с олиготрофным статусом бактериопланктон ориентирован в первую очередь на аллохтонное органическое вещество и потому не связан с довольно низким уровнем развития фитопланктона (Del Giorgio, Scarborough, 1995; Sommaruga, Conde, 1997; Мошарова и др., 2017). По результатам корреляционного анализа полученных данных, характеризующих уровень развития фитопланктона (концентрация Хл а) и бактериопланктона (численность и биомасса) в южной части оз. Байкал, не выявлено значимых коэффициентов корреляций между этими параметрами. Показано, что отсутствие подобных корреляций характерно для олиготрофных водоемов (Мошарова и др., 2017), однако в эвтрофных условиях корреляционная связь этих параметров в большинстве случаев хорошо выражена (Sommaruga, Conde, 1997; Ильинский и др., 2013; Мошарова и др., 2015, 2016).
Выводы. Исследования южного участка оз. Байкал в июне 2017 г. показали, что на основании значений численности и биомассы фитопланктона и концентрации Хл а данный сезон можно охарактеризовать как переходный к фазе “чистой воды”. Доминирующее положение в фитопланктоне занимал комплекс ФГ, типичных для олиготрофных озер (Z, E), а также характерных для поверхностных прибрежных вод в летний период (LO, X1, MP). Выявлено, что в пространственном аспекте сообщество характеризуется незначительной вариативностью структуры. Полученные на основании данных о ФГ значения индекса Q соответствуют “отличному” экологическому статусу озера. Значения параметров, характеризующих обилие и состояние фитопланктона, свидетельствуют, что воды южной акватории озера на всех станциях в период исследований соответствовали β-мезосапробной зоне. Наблюдавшиеся в исследованной акватории южной части оз. Байкал величины ОЧБ и биомассы бактерий позволяют оценить воды Южного Байкала как олигосапробные, и только прибрежные воды у г. Байкальск и у мыса Шаманский соответствуют β-мезосапробному уровню. Индекс трофического состояния, рассчитанный по данным о содержании Хл а характеризует воды южной части Байкала в целом как олиготрофные, в то время как воды на станциях у мыса Шаманский и у г. Байкальск имеют тенденцию к мезотрофному статусу. Отсутствие корреляционных связей между параметрами, характеризующими уровень развития фито- и бактериопланктона, позволяет предположить олиготрофный статус прибрежных вод южной части оз. Байкал.
Комплексный подход, основанный на данных о функциональных группах фитопланктона, содержании Хл а и феофитина, а также на значениях микробиологических параметров, примененный к исследованию оз. Байкал, представляется весьма перспективным для оценки экологического состояния водоемов. Однако для уверенного положительного заключения об эффективности такой комплексной оценки необходимы дальнейшие исследования ее применимости в сезонном и многолетнем аспектах.
Список литературы
Афонина Т.Е., Коломина Т.М., Пономаренко Е.А., Слаута А.А. 2015. Оценка качества водных ресурсов в прибрежной части оз. Байкал и источники их загрязнения // Вестник ИрГТУ. № 6. С. 37.
Белых О.И., Тихонова И.В., Сороковикова Е.Г. и др. 2011. Пикопланктонные Cyanoprokaryota родов Synechococcus Nageli и Cyanobium Rippka et Cohen-Baz. из озера Байкал (Россия) // Альгология. Т. 21. № 1. С. 36.
Бондаренко Н.А., Логачева Н.Ф. 2016. Структурные изменения в фитопланктоне прибрежной зоны озера Байкал // Гидробиол. журн. Т. 52. № 6. С. 17.
Верхозина Е.В., Верхозина В.А., Савилов Е.Д., Верхотуров В.В. 2014. Антибиотикоустойчивость микробного сообщества экосистемы озера Байкал в районе пос. Листвянка, г. Слюдянки и г. Байкальска // Бюлл. Восточно-Сибирского науч. центра Сиб. отд. Росс. акад. мед. наук. № 3. С. 62.
Зайцева С.В., Дагурова О.П. 2013. Содержание хлорофилла а и биогенных элементов в прибрежной воде озера Байкал // Вест. Бурятского гос. ун-та. № 3. С. 33.
Ильинский В.В., Мошарова И.В., Акулова А.Ю., Мошаров С.А. 2013. Современное состояние гетеротрофного бактериопланктона Косинского Трехозерья // Вод. ресурсы. Т. 40. № 5. С. 477.
Кращук Л.С., Шимараева С.В., Зилов Е.А. 2020. Пространственно-временные изменения фитопланктона в оз. Байкал в период позднего лета. I. Температура воды и численность фитопланктона // Биология внутр. вод. № 1. С. 27.
Мошаров С.А., Сергеева В.М. 2018. Оценка функционального состояния морского фитопланктона по флуоресцентным показателям и соотношению концентраций феофитина и хлорофилла а // Вопр. совр. альгологии. www.algology.ru. № 1(16).
Мошарова И.В., Ильинский В.В., Ильина О.В. 2018. Оценка современного состояния прибрежных вод южной части озера Байкал по санитарно-микробиологическим показателям с применением тест-систем // Здоровье населения и среда обитания. № 9. С. 54.
Мошарова И.В., Ильинский В.В., Мошаров С.А. 2016. Состояние гетеротрофного бактериопланктона эстуария реки Енисей и зоны Обь-Енисейского речного выноса в осенний период в связи с факторами окружающей среды // Вод. ресурсы. Т. 43. № 2. С. 1.
Мошарова И.В., Мошаров С.А., Ильинский В.В. 2017. Особенности распространения бактериопланктона с активным метаболизмом в водной толще желоба Святой Анны в Карском море в осенний период 2011 г. // Океанология. Т. 57. № 1. С. 1.
Мошарова И.В., Ильинский В.В., Маторин Д.Н. и др. 2015. Мониторинг вод реки Москва с помощью микробиологических параметров и флуоресценции хлорофилла а // Микробиология. Т. 84. № 6. С. 1.
Парфенова В.В., Кравченко О.С., Павлова О.Н. 2008. Распределение и антибиотикорезистентность бактерий рода Enterococcus, изолированных из воды озера Байкал // Сиб. мед. журн. № 3. С. 78.
Поповская Г.И., Усольцева Г.В., Домышева В.М. и др. 2015. Весенний фитопланктон пелагиали озера Байкал в 2007–2011 годы // География и природные ресурсы. № 3. С. 74.
Практическая гидробиология. Пресноводные экосистемы: Учеб. для студ. биол. спец. университетов. 2006. Москва: Изд-во “ПИМ”. С. 358.
Садчиков А.П. 2003. Методы изучения пресноводного фитопланктона: методическое руководство. Москва: Университет и школа.
Семенченко В.П., Разлуцкий В.И. 2017. Экологическое качество поверхностных вод. Минск: Белорусская наука.
Шимараева С.В., Пислегина Е.В., Кращук Л.С. и др. 2017. Динамика хлорофилла а в пелагиали южного Байкала в период прямой температурной стратификации // Биология внутр. вод. № 1. С. 60. https://doi.org/10.7868/S0320965217010168
Arar E.J., Collins G.B. 1997. Method 445.0 In vitro determination of chlorophyll a and pheophytin a in marine and freshwater algae by fluorescence. Washington, DC: U.S. Env. Protection Agency.
Bellinger E.G., Sigee D.C. 2015. Freshwater algae: identification, enumeration and use as bioindicators. West Sussex. UK: John Wiley & Sons Ltd. 275 p.
Belykh O.I., Sorokovikova E.G., Tikhonova I.V., Saphonova T.A. 2006. Autotrophic picoplankon of Lake Baikal: species composition and structure // Hydrobiology. V. 568. Suppl. 1. P. 9.
Bondarenko N.A., Ozersky T., Obolkina L.A. et al. 2019. Recent changes in the spring microplankton of Lake Baikal, Russia // Limnologica. V. 75. P. 19. https://doi.org/10.1016/j.limno.2019.01.002
Bondarenko N.A., Vorobyova S.S., Zhuchenko N.A., Golobokova L.P. 2020a. Current state of phytoplankton in the littoral area of Lake Baikal, spring 2017 // J. Great Lakes Res. V. 46. P. 17. https://doi.org/10.1016/j.jglr.2019.10.001
Bondarenko N.A., Rusanov I.I., Chernitsyna S.M. et al. 2020b. Under-ice microalgae and algae of the interstitial icy water functioning in Lake Baikal littoral zone // Microbiology. V. 89. P. 337. https://doi.org/10.1134/S0026261720030054
Carlson R.E. 1977. A trophic state index for lakes // Limnology and Oceanography. V. 22. P. 361.
Cremona F., Kõiv T., Kisand V. et al. 2014. From bacteria to piscivorous fish: estimates of whole-lake and component-specific metabolism with an ecosystem approach // PLoS One V. 9. e101845. https://doi.org/10.1371/journal.pone.0101845
Crossetti L.O., Bicudo C.E.M. 2008. Phytoplankton as a monitoring tool in a tropical urban shallow reservoir (Garças Pond): the assemblage index application // Hydrobiologia. V. 610. P. 161.
del Giorgio P.A., Scarborough G. 1995. Increase in the proportion of metabolically active bacteria along gradients of enrichment in freshwater and marine plankton: implication for estimates of bacterial growth and production rates // J. Plankton Res. V. 17. № 10. P. 1905.
Hammer Ø., Harper D.A., Ryan P.D. 2001. PAST: Paleontological statistics software package for education and data analysis // Palaeontol. Electron. V. 4. P. 9.
Hampton S.E., Gray D.K., Izmest’eva L.R. et al. 2014. The rise and fall of plankton: long-term changes in the vertical distribution of algae and grazers in Lake Baikal, Siberia // PLoS One V. 9. e88920. https://doi.org/10.1371/journal.pone.0088920
Hillebrand H., Dürselen C.D., Kirschtel D. et al. 1999. Biovolume calculation for pelagic and benthic microalgae // J. Phycol. V. 35. P. 403.
Holm-Hansen O., Kahru M., Hewes C.D. 2005. Deep chlorophyll a maxima (DCMs) in pelagic Antarctic. II // Mar. Ecol.: Prog. Ser. V. 297. P. 71.
Izmest’eva L.R., Moore M.V., Hampton S.E. et al. 2016. Lake-wide physical and biological trends associated with warming in Lake Baikal // J. Great Lakes Res. V. 42. P. 6. https://doi.org/10.1016/j.jglr.2015.11.006
Kobanova G.I., Takhteev V.V., Rusanovskaya O.O., Timofeyev M.A. 2016. Lake Baikal ecosystem faces the threat of eutrophication source // International Journal of Ecology. V. 2016. P. 1.
Khodzher T., Domysheva V., Sorokovikova L. et al. 2017. Current chemical composition of Lake Baikal water // Inland Waters. V. 7. № 3. P. 250. https://doi.org/10.1080/20442041.2017.1329982
Marvan P., Maršálek B., Heteša J. et al. 2005. Comments on the revised tables of algal (and other botanical) water quality indicators listed in CSN 75 7716 – discussion material for assessment of trophic status of water bodies // Association Flos Aquae www.cyanobacteria.net on 6th May 2005.
Nakano S.-I., Mitamura O., Sugiyama M. et al. 2003. Vertical planktonic structure in the central basin of Lake Baikal in Summer, 1999, with special reference to the microbial food web // Limnology. V. 4. P. 155.
Padisák J., Borics G., Grigorszky I., Soróczki-Pintér E. 2006. Use of phytoplankton assemblages for monitoring ecological status of lakes within the Water Framework Directive: the assemblage index // Hydrobiologia. V. 553. P. 1.
Padisák J., Crossetti L.O., Naselli-Flores L. 2009. Use and misuse in the application of the phytoplankton functional classification: a critical review with updates // Hydrobiologia. V. 621. P. 1.
Reynolds C.S., Huszar V., Kruk C. et al. 2002. Towards a functional classification of the freshwater phytoplankton // J. Plankton Res. V. 24. P. 417.
Reynolds C.S. 2006. The ecology of phytoplankton. Cambridge, UK: Cambridge Univ. Press. 535 p. https://doi.org/10.1017/CBO9780511542145
Salmaso N., Naselli-Flores L., Padisák J. 2015. Functional classifications and their application in phytoplankton ecology // Freshwater Biol. V. 60. P. 603. https://doi.org/10.1111/fwb.12520
Sládeček V. 1973. System of water analysis from the biological point of view // Archiv für Hydrobiol. V. 7. P. 1.
Sommaruga R., Conde D. 1997. Seasonal variability of metabolically active bacterioplankton in the euphotic zone of a hypertrophic lake // Aquat. Microb. Ecol. V. 13. P. 241.
Sun J., Liu D. 2003. Geometric models for calculating cell biovolume and surface area for phytoplankton // J. Plankton Res. V. 25. P. 1331.
Timoshkin O.A., Samsonov D.P., Yamamuro M. et al. 2016. Rapid ecological change in the coastal zone of Lake Baikal (East Siberia): Is the site of the world’s greatest freshwater biodiversity in danger? // J. Great Lakes Res. V. 42. P. 487.
UNESCO. 1994. Protocols for the Joint Global Ocean Flux Study (JGOFS) core measurements // IOC/SCOR manual and guides. Paris: UNESCO Publ. № 29. P. 128.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод