Биология внутренних вод, 2022, № 1, стр. 84-95
Токсичность донных отложений Рыбинского водохранилища по многолетним данным биотестирования. Сообщение 2. Тератологические исследования
И. И. Томилина a, *, Л. П. Гребенюк a, Р. А. Ложкина a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Ярославская обл., Некоузский р-н, Россия
* E-mail: i_tomilina@mail.ru
Поступила в редакцию 17.11.2020
После доработки 19.05.2021
Принята к публикации 22.06.2021
- EDN: WHBDOE
- DOI: 10.31857/S0320965222010132
Аннотация
Экспериментально подтверждено тератогенное воздействие донных отложений Рыбинского водохранилища на структуру ротового аппарата личинок Chironomus riparius, вызывающее возникновение патоморфологических изменений. В среднем за весь период наблюдений по плесам доля личинок хирономид с патоморфологическими нарушениями достигала для Моложского плеса 29.4, Центрального – 24.6, Волжского – 24.0, Шекснинского – 26.2, в контроле – 6.7%. Изменения регистрировали у всех структур ротового аппарата личинок хирономид. Количество деформаций ротового аппарата личинок хирономид может отражать уровень загрязнения донных отложений и служить достоверным биомаркером при проведении мониторинга экологического состояния пресноводных экосистем.
ВВЕДЕНИЕ
Биотестирование представляет собой комплекс различных подходов для оценки состояния разных организмов, находящихся под воздействием комплекса естественных и антропогенных факторов. Фундаментальным показателем их состояния служит эффективность физиологических процессов, обеспечивающих нормальное развитие организма. Основным тестируемым параметром при установлении токсичности природных сред (воды, водной вытяжки, нативных донных отложений) по-прежнему остается выживаемость организмов, хотя подобные тесты часто позволяют лишь предположить токсичность исследуемых проб. Более перспективным в качестве показателя представляется использование физиологических, а тем более морфологических отклонений от нормы, поскольку этому предшествуют стойкие и долговременные биохимические процессы, которые приводят к изменению физиологического состояния тест-организма, ухудшения качества его потомства или гибели.
Комары-звонцы (Diptera, Chironomidae) – массовые и повсеместно распространенные в природе двукрылые насекомые, которые широко используются в качестве биоиндикаторов и тест-организмов в экотоксикологических исследованиях (Зинченко, 2005; Di Veroli et al., 2012; Corbi et al., 2019). В настоящее время опубликовано большое количество работ по исследованию тератогенного эффекта при воздействии различных токсикантов на хирономид в полевых и лабораторных условиях (Meregalli et al., 2000; Martinez et al., 2003; Di Veroli et al., 2014). Патоморфологические изменения структур ротового аппарата личинок хирономид возникают в условиях загрязнения среды обитания тяжелыми металлами и токсическими органическими соединениями (Bhattacharyay et al., 2006; MacDonald, Taylor, 2006; Al-Shami et al., 2010; Deliberalli et al., 2018). В водоемах, загрязненных Zn, Cu, Ni, Cr, As, Mo, Co, у личинок хирономид рода Chironomus встречались тяжелые деформации зубцов ментума и мандибул (Janssens de Bisthoven et al., 1998), в загрязненных ртутью – деформации антенн (Di Veroli et al., 2014).
Экспериментально доказано, что ЗВ органической природы – хлорорганические пестициды (Madden et al., 1992), сырая нефть (Cushman, 1984), ксилол (Janssens de Bisthoven et al., 1997), мевинфос (Гребенюк, Томилина, 2006) – оказывают тератогенное действие на личинок хирономид. Обнаружена связь между дефектами антенн и концентрацией дихлордифенилдихлорэтана (Hamillton, Saether, 1971).
Возникновение и тяжесть мальформаций структур ротового аппарата личинок хирономид можно использовать для оценки воздействия ЗВ на пресноводные экосистемы. Водоем считается чистым, если доля личинок хирономид с аномалиями изменяется от 3–5 (Warwick, 1985) до 8–10% (Wiederholm, 1984). В популяции Chironomus riparius Meigen, 1804 при разведении в лабораторной культуре, доля деформированных личинок выше, чем в природных популяциях, и может достигать 10–14% (Гребенюк, Томилина, 2006).
Цель работы – изучить связь токсичности донных отложений Рыбинского водохранилища с возникновением морфологических деформаций структур ротового аппарата личинок хирономид.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводили на личинках комара-звонца Ch. riparius Meigen, 1804, культивируемых в лаборатории на незагрязненном грунте (фоновым контролем служили ДО устья р. Суткa, притока Рыбинского водохранилища) и отстоянной артезианской воде. Личинок хирономид первой стадии на следующие сутки после вылупления в количестве 30 шт. помещали индивидуально в чашки Петри с ДО (Ingersoll, Nelson, 1990). Продолжительность эксперимента ~20 сут (до достижения 80% личинок стадии IV возраста). Животных в ходе опытов кормили суспензией кормовых дрожжей из расчета 0.25 мг/личинку, корм добавляли в ДО по мере выедания.
Исследовали три группы структур ротового аппарата: сильнохитинизированные (ментум, мандибулы), комплекс верхней губы (премандибулы, эпифарингс, верхнегубной гребень) и антенны (Warwick, 1985). Деформированными считали те части ротового аппарата, в которых обнаруживали любую морфологическую аномалию. Механические повреждения в результате абразии и слома деформациями не считали (Saether, 1980). Изучение проводили на постоянных препаратах головных капсул, изготовленных по общепринятой методике с использованием жидкости Фора–Берлезе (Шилова, 1976). Препараты просматривали под микроскопом “МБИ-3” (×200, ×280, ×400) и фотографировали на цифровом микроскопе “KEYENCE VHX-1000”, объектив VH-Z250R. Рассчитывали относительную численность личинок с деформациями, долю личинок с деформациями отдельных структур ротового аппарата, индексы ISAD (Warwick, 1985) и ISMMD (Warwick, 1991; Гребенюк, Томилина, 2014). Значения этих индексов у контрольных личинок находятся в пределах 0.25 ≤ ISAD ≤ 0.55 и 0.03 ≤ ISMMD ≤ 0.20 (Гребенюк, Томилина, 2014).
Для сравнения доли деформированных личинок в природных популяциях и при биотестировании ДО в лабораторных условиях на некоторых станциях однократно отбирали пробы бентоса, из которых извлекали личинок Ch. plumosus Linnaeus, 1758 и проводили биотестирование этих же проб с использованием личинок Ch. riparius.
Общее количество исследованных личинок Ch. riparius 2200 экз. (Волжский плес – 133, Главный – 1408, Шекснинский – 545, Моложский – 144), Ch. plumosus – 154 (Волжский плес – 16, Главный – 105, Шекснинский – 33).
Данные представляли в виде средних значений и их ошибок (x ± SE). Статистическую значимость различий оценивали методом дисперсионного анализа (ANOVA, LSD-тест) при р = 0.05 (Sokal, Rohlf, 1995). Если значения параметров не имели нормального распределения (Shapiro–Wilktest), использовали непараметрический коэффициент Спирмена (rs, р < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
При биотестировании ДО Рыбинского водохранилища доля личинок хирономид с патоморфологическими изменениями структур ротового аппарата за период наблюдений в среднем достигала 27.8%, что значительно выше установленных контрольных (табл. 1) и фоновых значений, указанных в работе (Warwick, 1985). Максимальная доля личинок с мальформациями отмечена при биотестировании ДО Моложского плеса (представленных одной станцией Противье), отобранных в 2008 г. – 52.5 ± 9.6, в остальные годы – 20.5–23.8%. Достоверных различий среднего количества личинок с деформациями между годами и плесами не зарегистрировано. В среднем доля личинок хирономид с патоморфологическими нарушениями по плесам за весь период наблюдений была: для Моложского плеса – 29.4 (без учета данных 2008 г. – 21.7), Центрального – 24.6, Волжского – 24.0, Шекснинского – 26.2 (контроль – 6.7%).
Таблица 1.
Средние значения морфологических показателей личинок Chironomus riparius при биотестировании донных отложений Рыбинского водохранилища за период 2006–2013 гг.
| Плес (число станций) |
Доля личинок с деформациями общего числа личинок, % | Доля деформированных структур общего количества деформаций, % | Доля личинок IV возраста общего числа личинок, % | ||
|---|---|---|---|---|---|
| ментум, мандибулы | комплекс верхней губы | антенны | |||
| 2006 г. | |||||
| Центральный (3) | 15.9 ± 3.7 | 28.3 ± 10.8 | 20.2 ± 5.7 | 29.6 ± 14.8 | – |
| Шекснинский (3) | 30.6 ± 5.6 | 40.6 ± 3.5 | 18.4 ± 6.4 | 41.1 ± 3.5 | – |
| Контроль | 6.6 ± 0.1 | 10.6 ± 0.6 | 20.6 ± 9.3 | 68.9 ± 8.9 | – |
| 2008 г. | |||||
| Моложский (1) | 52.5 ± 9.6 | 12.2 ± 8.6 | 20.3 ± 1.5 | 67.5 ± 7.1 | 100 ± 0 |
| Центральный (11) | 37.45 ± 2.39 | 4.8 ± 1.05 | 25.3 ± 1.62 | 71.1 ± 1.6 | 99.2 ± 0.40 |
| Волжский (2) | 33.9 ± 9.2 | 1.3 ± 1.25 | 26.75 ± 2.15 | 69.4 ± 1.7 | 100 ± 0 |
| Шекснинский (4) | 32.28 ± 2.81 | 5.9 ± 0.42 | 28.25 ± 3.16 | 65.9 ± 3.5 | 94.5 ± 2.27 |
| Контроль | 8.3 ± 0.9 | 7.0 ± 2.5 | 51.0 ± 8.1 | 42.0 ± 5.6 | 100 ± 0 |
| 2010 г. | |||||
| Моложский (1) | 20.5 ± 12.8 | 3.2 ± 3.2 | 40.2 ± 1.2 | 56.7 ± 2.0 | 100 ± 0 |
| Центральный (7) | 23.2 ± 1.5 | 7.3 ± 1.1 | 37.7 ± 1.6 | 55.0 ± 1.1 | 98.6 ± 1.56 |
| Волжский (3) | 20.7 ± 8.8 | 9.3 ± 9.3 | 43.6 ± 8.0 | 47.2 ± 4.1 | 100 ± 0 |
| Шекснинский (5) | 28.6 ± 3.5 | 10.1 ± 2.9 | 34.7 ± 0.8 | 55.2 ± 3.1 | 86.8 ± 6.20 |
| Контроль | 4.8 ± 4.8 | 3.0 ± 3.0 | 48.4 ± 4.6 | 48.8 ± 7.6 | 100 ± 0 |
| 2012 г. | |||||
| Моложский (1) | 20.8 ± 7.8 | 10.0 ± 3.2 | 41.5 ± 0.6 | 48.5 ± 3.8 | 100 ± 0 |
| Центральный (7) | 20.2 ± 2.8 | 7.6 ± 1.2 | 36.1 ± 1.7 | 56.3 ± 1.5 | 99.5 ± 0.37 |
| Волжский (1) | 17.5 ± 1.4 | 11.0 ± 1.0 | 41.0 ± 1.0 | 48.0 ± 2.0 | 100 ± 0 |
| Шекснинский (2) | 15.8 ± 1.7 | 6.6 ± 1.5 | 41.3 ± 1.1 | 52.2 ± 2.5 | 100 ± 0 |
| Контроль | 7.0 ± 0.7 | 2.7 ± 2.7 | 19.7 ± 3.9 | 77.8 ± 1.3 | 100 ± 0 |
| 2013 г. | |||||
| Моложский (2) | 23.8 ± 4.3 | 14.9 ± 5.2 | 26.8 ± 5.1 | 58.5 ± 0.1 | 96.9 ± 1.01 |
| Центральный (4) | 26.4 ± 1.3 | 13.4 ± 2.2 | 28.8 ± 2.7 | 57.9 ± 1.0 | 95.9 ± 1.79 |
| Шекснинский (3) | 23.9 ± 7.3 | 9.8 ± 1.9 | 29.3 ± 3.2 | 60.9 ± 3.5 | 97.5 ± 0.15 |
| Контроль | 6.7 ± 1.7 | 7.8 ± 2.2 | 13.8 ± 3.0 | 78.9 ± 1.1 | 100 ± 0 |
Изменения регистрировали для всех структур ротового аппарата личинок хирономид. Большая часть деформаций приходилась на антенны (29.6–71.1%) (табл. 1). Аномальные отклонения в строении жестких структур, мандибул и ментума, встречались постоянно за весь период наблюдений, хотя и не достигали высокого количественного уровня (3.2–14.9%). Исключение составили исследования 2006 г., когда мальформации ментума и мандибул при биотестировании ДО Центрального плеса достигали 28.3, Шекснинского – 40.6% (табл. 1). В ряде случаев относительная численность личинок с деформациями сильнохитинизированных структур равнялась или превышала таковую с деформациями антенн. Патоморфологические нарушения в строении структур комплекса верхней губы варьировали от 18.4 до 41.5% (табл. 1).
Доля личинок хирономид, достигших IV возраста за время эксперимента, достоверно не отличалась от контрольных значений, хотя в отдельных случаях была <100% (табл. 1).
Значения ISAD для всех плесов в 2008 и 2010 гг. достоверно превышали в 3–8 раз таковые в контроле, не различаясь между собой (рис. 1а). Максимальное значение 4.8 ± 0.1 зафиксировано для Моложского плеса в 2008 г., в контроле – 0.6 ± 0.1. Начиная с 2008 г., наблюдается тенденция снижения ISAD для всех плесов, за исключением Шекснинского.
Рис. 1.
Долговременные изменения ISAD (а) и ISMMD (б) Chironomus riparius в различных плесах Рыбинского водохранилища.
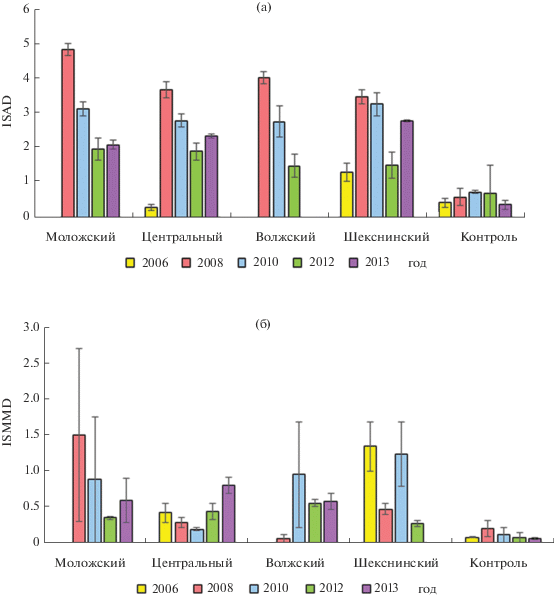
Величины ISMMD, биологического показателя загрязнения ДО органическими веществами, для Шекснинского плеса в 2006 и 2010, Моложского в 2008 и Центрального в 2013 гг. достоверно превышали в 6.5–8 раз таковые контрольных значений (рис. 1б).
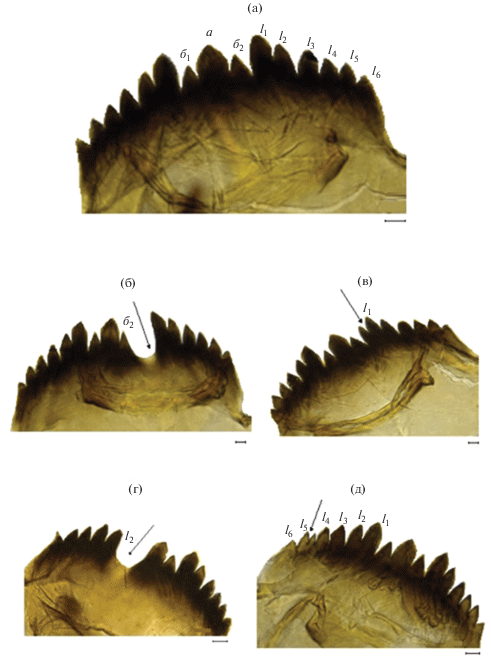
При анализе патоморфологических отклонений в строении ментума зафиксированы все типы деформаций: срединные (аномалии в строении срединного трехраздельного зубца), латеральные (уродливые боковые зубцы), смешанные (в той или иной степени деформированы срединный и латеральные зубцы) (рис. 2). Среди латеральных деформаций отмечены раздвоенный первый латеральный зубец (рис. 2в), дополнительный зубчик между четвертым и пятым латеральными зубцами (рис. 2д). Среди смешанных деформаций наблюдали число латеральных зубцов меньше обычного: отсутствовал первый латеральный слева и дополнительный зубец основного, имелась выемка с депигментированным основанием (рис. 2г). Неоднократно отмечали глубокую выемку между дополнительным и первым латеральным зубцами (рис. 2б).
Уродства мандибулы представлены большим разнообразием (рис. 3): увеличение (рис. 3б) или уменьшение числа зубцов (рис. 3в, 3г, 3е), частичная их депигментация, выемка на месте редуцированного зубца (рис. 3в, 3е), искривление дорсальной части от незначительного до очень сильного (рис. 3д).
Рис. 3.
Мандибулы личинок Chironomus riparius: а – нормальное строение, б–е – деформированные мандибулы; а1–а4 – нижние (наружные) пигментированные зубцы, б – верхние (внутренние) непигментированные зубцы.

Деформации комплекса верхней губы представлены отклонениями в строении его элементов: сокращение, увеличение или частичное слияние зубцов эпифарингса, аномальные формы многочисленных щетинок, составляющих вооружение верхней губы. Многочисленные морфологические отклонения отмечены и в строении антенн. На участке между II и III члениками, где расположен комплекс чувствительных сенсилл, чаще всего наблюдали их смещение, изменение формы, увеличение или уменьшение в размерах. Сами членики антенны были подвержены разнообразным изменениям.
Виды деформаций, встречаемые при биотестировании ДО Рыбинского водохранилища на Ch. riparius, отмечены и у личинок Ch. plumosus из природных популяций в местах отбора проб. Относительная численность личинок Ch. plumosus с деформациями колебалась от 30 до 67% (в среднем 57.5%) (табл. 2) и была выше таковой Ch. riparius, зарегистрированной при биотестировании ДО на этих же станциях. Доля личинок с деформациями сильнохитинизированных структур Ch. plumosus в 5.4 раза превышала таковую у Ch. riparius. Значения ISAD были выше для Ch. riparius, за исключением станции Мякса Шеснинского плеса, ISMMD – Ch. plumosus (в среднем в 1.7 раза) (табл. 2).
Таблица 2.
Относительная численность личинок рода Chironomus с деформациями в природных и экспериментальных популяциях (2008 г.)
| Станция | Природная популяция (Ch. plumosus) n = 154 | Экспериментальная популяция (Ch. riparius) n = 292 | ||||||
|---|---|---|---|---|---|---|---|---|
| доля личинок с деформациями общего числа личинок, % | доля личинок с деформациями сильнохитинизированных структур (ментум, манди-булы) общего числа личинок с деформациями, % | ISAD | ISMMD | доля личинок с деформациями общего числа личинок, % | доля личинок с деформациями сильнохитинизированных структур (ментум, мандибулы) общего числа личинок с деформациями, % | ISAD | ISMMD | |
| Центральный плес | ||||||||
| Волково | 41.3 | 57.1 | 2.02 | 0.78 | 37.7 ± 10.7 | 15.4 ± 5.4 | 3.38 ± 0.2 | 0.21 ± 0.2 |
| Милюшино | 66.7 | 100.0 | 2.00 | 2.67 | 37.0 ± 4.9 | 5.5 ± 5.5 | 3.93 ± 0.1 | 0.04 ± 0.04 |
| Устье р. Согожа | 57.1 | 31.3 | 2.93 | 0.93 | 41.1 ± 1.8 | 42.1 ± 11.3 | 3.04 ± 0.6 | 0.80 ± 0.2 |
| Ягорба | 55.6 | 60.0 | 3.03 | 2.44 | 41.3 ± 4.3 | 11.7 ± 1.7 | 3.02 ± 0.9 | 0.27 ± 0.0 |
| Брейтово | 61.1 | 45.5 | 2.28 | 1.22 | 40.4 ± 16.0 | 19.2 ± 8.1 | 3.51 ± 1.2 | 0.34 ± 0.3 |
| Молога | 30.0 | 33.3 | 2.86 | 0.40 | 49.3 ± 2.4 | 6.3 ± 6.3 | 4.64 ± 0.2 | 0.24 ± 0.2 |
| Cреднее | 52.0 ± 5.6 | 54.5 ± 10.3 | 2.5 ± 0.2 | 1.4 ± 0.4 | 41.1 ± 1.8 | 16.7 ± 5.5 | 3.6 ± 0.3 | 0.3 ± 0.1 |
| Волжский плес | ||||||||
| Шумаровские о-ва | 66.7 | 100.0 | 3.17 | 1.33 | 24.7 ± 1.6 | 0 | 3.35 ± 0.2 | 0 |
| Шекснинский плес | ||||||||
| Мякса | 53.8 | 57.1 | 4.38 | 2.46 | 29.5 ± 5.2 | 22.2 ± 0 | 3.06 ± 0.3 | 0.24 ± 0.09 |
У личинок Ch. plumosus представлены все типы деформаций ментума: срединные (аномалии в строении срединного трехраздельного зубца) (рис. 4а), латеральные (уродливые боковые зубцы), смешанные (в той или иной степени деформированы срединный и латеральные зубцы). Имело место и раздвоение основного зубца (рис. 4б). Наиболее часто встречаемые отклонения в строении мандибул – это прогиб дорсальной части мандибулы.
Рис. 4.
Деформированные ментум и мандибулы личинок Chironomus plumosus: а, б – деформации ментума, в – аномальное строение ментума и мандибул у одной личинки: а – основной зубец срединного трехзубчатого зубца, б1, б2 – добавочные; l1–l6 – латеральные (боковые) зубцы.
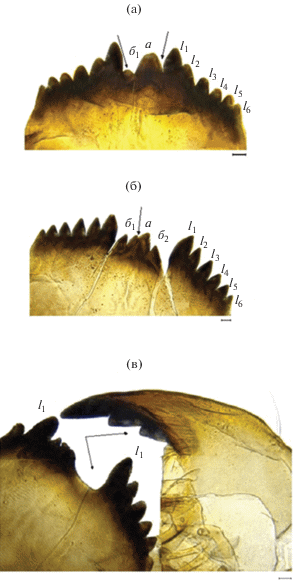
Неоднократно отмечены случаи аномального строения двух жестких структур одновременно у одной личинки (рис. 4в).
Кроме морфологических деформаций обнаружены и другие нарушения нормальной структуры головной капсулы личинок Ch. riparius и Ch. plumosus – нарушения пигментации.
Результаты корреляционного анализа показали, что повышение концентрации в ДО Cr, Ni, Cu, Zn, Pb, Mo и Cd влияли на возникновение мальформаций структур ротового аппарата личинок хирономид (табл. 3). Количество деформированных сильнохитинизированных структур (ментума и мандибул) зависело от присутствия в ДО низкохлорированных (3-ХБ, 4-ХБ) и высокохлорированнных (5-ХБ, 6-ХБ) конгенеров ПХБ. Отмечено, что содержание РЗЭ в ДО влияло на прохождение метаморфоза личинками хирономид, т.е. доля личинок, достигших IV возраста, зависела от концентрации РЗЭ в ДО (табл. 3).
Таблица 3.
Корреляции между морфологическими параметрами Chironomus riparius и концентрациями химических элементов в донных отложениях Рыбинского водохранилища*
| Параметр | Химический элемент (коэффициент корреляции по Спирмену при p < 0.5) |
|---|---|
| Доля личинок с деформациями, % | Cr (–0.485), Ni (–0.511), Cu (–0.566), Zn (–0.573), Sr (–0.557), Mo (–0.570), Cd (–0.563), Pb (–0.522) |
| Доля деформированных сильнохитинизированных структур (ментум, мандибулы) общего числа деформаций | 3-ХБ (0.588), 4-ХБ (0.596), 5-ХБ (0.611), 6-ХБ (0.427), Ce (–0.403) |
| ISAD | Ge (–0.609) |
| ISMMD | 3-ХБ (0.394), 4-ХБ (0.520), 5-ХБ (0.571), 6-ХБ (0.497), Ce (–0.394), U (–0.379) |
| Доля личинок IV возраста, % | Mn (0.537), Sm (0.388), Eu (0.396), Gd (0.380), Dy (0.406), Ho (0.387) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Морфологические деформации структур ротового аппарата, особенно ментума, личинок сем. Chironomidae считаются индикаторами раннего предупреждения ухудшения состояния ДО (Janssens de Bisthoven, 1992; Ochieng et al., 2008). Оценка фонового уровня деформаций сложный процесс и трудно установить градацию между “легким” и “тяжелым (серьезным)” токсическим эффектом. Для анализа уровня загрязнения проб разработаны пороговые значения количества деформаций (от общего количества обследованных личинок): критерий 1 – >8%, критерий 2 – >16%, критерий 3 – >32%, соответствующие хорошему, удовлетворительному и неблагополучному состоянию популяции хирономид (Deckere et al., 2000). Согласно этим критериям пробы ДО, отобранные в 2008 г. на всех плесах, следует отнести к сильнозагрязненным (табл. 1). В остальные даты наблюдений исследованные ДО по количеству морфологических деформаций структур ротового аппарата личинок хирономид относились к относительно загрязненным.
Частота встречаемости деформаций антенн, как правило, выше, чем ментума и мандибул. В настоящем исследовании на деформированные антенны приходилось 29.6–71.1% общего числа деформаций, ментум и мандибулы – 1.3–40.6% (табл. 1). Возможно, такие сенсорные структуры, как антенны, начиная с определенных концентраций токсических веществ, перестают на них реагировать, и деформации начинают проявляться на более жестких морфологических структурах (Bhattacharyay et al., 2006; Vermeulen et al., 2000). При высоких концентрациях токсикантов число деформированных антенн не увеличивается, а число деформаций ментума и мандибул – возрастает (Odume et al., 2012).
Преобладание деформированных антенн в общем количестве аномальных структур ротового аппарата личинок и высокие значения ISAD, зарегистрированные нами, могут служить основанием для предположения, что тяжелые металлы влияют на наблюдаемый тератогенный эффект. Косвенное подтверждение этого – корреляционные зависимости доли деформированных личинок от содержания тяжелых металлов в ДО (табл. 3). Почти все металлы, c которыми установлены корреляционные связи (за исключением кадмия, его биологическая роль на настоящий момент неясна), активно участвуют в биологических процессах, входят в состав многих ферментов и в микроколичествах необходимы для организма. Однако в концентрациях, превышающих предельно-допустимые, они становятся биологически опасными. В экотоксикологическом отношении требуют внимания металлы, максимально загрязняющие водоемы ввиду значительного использования в производственной деятельности и опасные вследствие их биологической активности и токсических свойств. Ранее отмечено, что ДО водохранилища не отвечают стандартам, принятым в европейских странах. Зарегистрировано превышение нормативных концентраций по Cd, Cr, Cu, Ni, Pb и Zn. Максимальная кратность превышения отмечена для Cd – 5.8, Cu – 2.2, Cr – 1.94, Pb – 1.4 и Zn – 3.6 раз (Томилина и др., 2018).
Доля деформированных сильнохитинизированных структур зависела от содержания в ДО различных конгенеров ПХБ (табл. 3). Рыбинское водохранилище активно подвергается постоянному антропогенному химическому загрязнению стойкими органическими веществами за счет водного транспорта, диффузного склонового стока с прилегающих сельскохозяйственных территорий, поступления коммунально-промышленных сточных вод из находящихся на его побережье населенных пунктов и атмосферных выпадений (Chuiko et al., 2010). Наиболее высокие уровни загрязнения наблюдаются в Шекснинском плесе в черте г. Череповец, в остальной части водохранилища они находятся в фоновых количествах. Среди СОЗ количественно преобладают ПХБ (Чуйко, Подгорная, 2018). СОЗ аккумулируются в организмах гидробионтов в более высоких концентрациях, чем ионы тяжелых металлов, накоплению которых препятствуют различные адаптивные биохимические механизмы, переводящие их в неактивную форму (Canfield et al., 1999). Можно предположить, что и негативное действие СОЗ будет более сильным, что приводит к патоморфологическим изменениям “устойчивых” жестких структур ротового аппарата личинок. Подтверждением этому служит увеличение уродств ментума и мандибул при биотестировании грунтов природных водоемов, подвергающихся длительному действию индустриальных и сельскохозяйственных стоков, в настоящем исследовании и ранее (Томилина и др., 2011) и в экспериментах с дозированным внесением органических токсикантов (Гребенюк, Томилина, 2006). Зависимость индекса ISMMD (показателя, отражающего уровень воздействия органических загрязняющих веществ на личинок хирономид) от содержания конгенеров ПХБ подтверждает данное заключение. Органические ЗВ (хлор- и фосфорсодержащие) сильнее неорганических действуют на морфогенез животных, приводя к аномальным изменениям “устойчивых” сильнохитинизированных структур и вызывая необычные формы патоморфологических отклонений.
Присутствие РЗЭ в воде и ДО влияет на изменение биологических параметров гидробионтов: стимуляция и ингибирование роста тест-организмов, стабилизация и дестабилизация цитоскелета, изменение антиоксидантной активности, блокировка нервной передачи и т.д. (Баренбойм и др., 2014). Корреляционная связь изменения линейных размеров личинок хирономид от содержания РЗЭ в донных отложениях косвенно свидетельствует об этом (Томилина и др., 2021). Доказана связь хромосомных аберраций у Allium cepa L., 1753 и частота доминантных летальных мутаций (генных, хромосомных и геномных) у Drosophila melanogaster Meigen, 1830 при действии ДО, загрязненных РЗЭ (Соловых и др., 2012). Один из основных факторов, определяющих экологическую опасность РЗЭ – их биодоступность. Механизм поглощения лантана и некоторых других РЗЭ в биологических системах сходен с таковым для кальция, что может приводить к нарушению нормального течения процесса линьки гидробионтов (Das et al., 1988). Корреляционная связь доли личинок IV возраста от содержания РЗЭ в ДО может служить подтверждением этого (табл. 3).
При сравнении доли деформированных личинок в природных популяциях и при биотестировании ДО в лабораторных условиях установлено, что относительная численность личинок с деформациями в природных популяциях выше в 1.3–2.7 раз (табл. 2). Доля личинок с деформациями сильнохитинизированных структур Сhironomus plumosus превышает таковую у Ch. riparius в 5.4 раза. Это можно объяснить несколькими причинами.
У популяций хирономид, длительно живущих в условиях антропогенного загрязнения, мальформации могут накапливаться. Выявлена связь между концентрацией кадмия и частотой возникновения аномалий структур ротового аппарата при его воздействии на яйца и личинок Ch. riparius на протяжении 7–10 поколений. При этом частота появления деформаций ментума возрастала в последних четырех поколениях и коррелировала с уровнем смертности личинок (Janssens de Bisthoven et al., 1992). В эксперименте отмечена более высокая частота встречаемости деформаций зубцов в седьмом–девятом поколениях личинок Ch. riparius при действии 9 мкг Cd/л (Janssens de Bisthoven et al., 2001).
Несмотря на то, что случаи возникновения деформаций среди родов подсемейства Chironomidae встречаются чаще, чем в других подсемействах (Bhattacharyay et al., 2006; Ochieng et al., 2008), сравнительные исследования по чувствительности различных видов хирономид к воздействию загрязняющих веществ немногочисленны. Показано, что токсичность может варьировать в зависимости от выбора тестируемых видов и характера загрязняющего вещества. Так, LC50-48 кадмия для личинок Ch. riparius составила 2.62 мкг/л, для Ch. tentans Fabricius, 1805 – 9.34 мкг/л. При увеличении экспозиции до 240 ч значения выравнивались – 0.70 и 0.74 мкг/л соответственно (Watts, Pascoe, 2000). В сравнительных исследованиях по влиянию загрязненных нефтепродуктами ДО установлено, что наибольшую устойчивость к их действию проявили личинки Ch. riparius. По мере уменьшения чувствительности используемые в эксперименте виды хирономид располагались в следующем порядке: Сh. plumosus > Ch. riparius > Сh. dorsalis Meigen, 1818 (Томилина и др., 2003).
Тем не менее, патоморфологические отклонения в строении ротовых структур личинок этого рода тождественны. Личинки рода Chironomus имеют единый план строения и очень сходную морфологию. Все это дает основания экстраполировать полученные количественные показатели по деформациям жестких структур Ch. riparius на личинок всего рода.
Искусственно вызванные деформации чаще всего слабее и количество их меньше, чем в природных популяциях из загрязненных мест (Janssens de Bisthoven et al., 1992). При этом высокий уровень смертности в большинстве экспериментов по индукции мальформаций показывает, что это нельзя объяснить снижением биодоступности ЗВ для тест-объектов (Назарова, 2002).
Важную роль в индукции деформаций может играть комбинация физических, химических и биологических параметров среды (Dickman et al., 1992). Возможно, факторы, непосредственно не связанные с загрязнением (тип донных отложений, хищничество, конкуренция за пищевой ресурс), также могут влиять на возникновение мальформаций (Bird et al., 2011). Отмечены высокие корреляции между случаями возникновения деформаций ментума и концентрациями растворенного кислорода и неорганического азота, электропроводностью и мутностью (Servia et al., 2000).
Время отбора проб также может влиять на общую картину частоты обнаружения деформаций. Если пробы отбирали после вылета хирономид, количественная оценка популяции может быть занижена. Оставшиеся особи могут представлять физиологически ослабленных членов популяции с замедленным метаморфозом, или тех, которые не способны его завершить (Назарова, 2002).
Механизм возникновения деформаций структур ротового аппарата личинок хирономид при загрязнении ДО изучен недостаточно. По некоторым данным, патоморфологические изменения структур, вероятно, являются следствием взаимодействия разрушающих эндокринную систему химических веществ, с гормонами, структурно связанными с эстрогеном, такими как экдизон. Экдизоны – гормоны, относящиеся к группе стероидов, стимулирующие линьку и метаморфоз членистоногих (He et al., 2010). Следовательно, “измененный” экдизон может влиять на процессы линьки в развитии личинок, и вызывать мальформации у хирономид (Vermeulen et al., 2000).
Тест-организмы подвергаются воздействию широкого спектра химических загрязнений в водной среде. Возможно, слишком упрощенно было бы приписывать влияние на возникновение мальформаций той или иной группе химических веществ, поскольку загрязняющие вещества находятся в природной среде не только в чистом состоянии, но и в побочных продуктах их деградации, синергетических и антагонистических процессов (Warwick, 1991). Тем не менее, морфологические деформации структур ротового аппарата личинок хирономид являются специфическим ответом на различные загрязняющие вещества и могут служить показателем для оценки степени тяжести и характера антропогенного воздействия.
ЗАКЛЮЧЕНИЕ
Экспериментально подтверждено тератогенное действие ДО Рыбинского водохранилища на возникновение патоморфологических изменений структур ротового аппарата личинок Chironomus riparius. Максимальная доля личинок с мальформациями отмечена при биотестировании ДО Моложского плеса, отобранных в 2008 г. – 52.5 ± 9.6%. В среднем доля личинок хирономид с патоморфологическими нарушениями по плесам за весь период наблюдений была для Моложского плеса – 29.4, Центрального – 24.6, Волжского – 24.0, Шекснинского – 26.2 (контроль – 6.7%).
Изменения регистрировали для всех структур ротового аппарата личинок хирономид. Большая часть деформаций приходилась на антенны (29.6–71.1%). Наиболее часто встречаемые отклонения в строении мандибул – это прогиб дорсальной части мандибулы, в строении ментума – срединные и латеральные деформации, в строении антенн – деформации в области “жгута” антенны (II–V члеников).
При невозможности измерить аналитическими методами содержание всех химических веществ, аккумулированных в ДО, количество деформаций ротового аппарата личинок хирономид может свидетельствовать о потенциальной опасности загрязнения ДО и тератогенного эффекта при проведении мониторинга экологического состояния пресноводных экосистем.
Список литературы
Баренбойм Г.М., Авандеева О.П., Коркина Д.А. 2014. Редкоземельные элементы в водных объектах (Экологические аспекты) // Вода: химия и экология. № 5. С. 42.
Гребенюк Л.П., Томилина И.И. 2006. Изменение физиологических и морфологических показателей личинок Chironomus riparius Meigen (Diptera: Chironomidae) при действии токсических веществ различной природы // Биол. внутр. вод. № 3. С. 81. https://doi.org/10.7868/S0320965214030097
Гребенюк Л.П., Томилина И.И. 2014. Морфологические деформации сильнохитинизированных структур ротового аппарата личинок рода Chironomus (Diptera, Chironomidae) как показатель органического загрязнения пресных водоемов // Биол. внутр. вод. № 3. С. 79.
Зинченко Т.Д. 2005. Биоиндикация как поиск информативных компонентов водных экосистем (на примере хирономид – Diptera, Chironomidae) // Чтения памяти Владимира Яковлевича Леванидова. Вып. 3. С. 338.
Назарова Л.Б. 2002. Морфологические деформации комаров-звонцов Diptera, Chironomidae в связи с загрязнением водоемов // Успехи соврем. биол. Т. 122. № 5. С. 516–523.
Соловых Г.Н., Голинская Л.В., Кануникова Е.А. 2012. Редкоземельные металлы как один из факторов мутагенности // Гигиена и санитария. № 3. С. 23.
Томилина И.И., Гребенюк Л.П., Чуйко Г.М. 2011. Токсикологическая и тератогенная оценка донных отложений Рыбинского водохранилища // Биол. внутр. вод. № 3. С. 78.
Томилина И.И., Гапеева М.В., Ложкина Р.А. 2018. Экотоксикологическая оценка качества воды и донных отложений // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века. Москва: РАН. С. 371. https://doi.org/10.31857/S9785907036185000001
Томилина И.И., Ложкина Р.А., Гапеева М.В. 2021. Токсичность донных отложений Рыбинского водохранилища по многолетним данным биотестирования. Сообщение 1. Токсикологические исследования // Биол. внутр. вод. № 6. С. 640–650. https://doi.org/10.31857/S0320965221060188
Томилина И.И., Михайлова Л.В., Гребенюк Л.П. и др. 2003. Влияние нефтепродуктов на личинок комаров рода Chironomus (Diptera, Chironomidae) // Биол. внутр. вод. № 2. С. 100.
Шилова А.И. 1976. Хирономиды Рыбинского водохранилища. Ленинград: Наука.
Чуйко Г.М., Подгорная В.А. 2018. Пространственное распределение органических загрязняющих веществ в экосистеме водохранилища (ретроспективный аналитический обзор) // Структура и функционирование экосистемы Рыбинского водохранилища в начале XXI века. Москва: РАН. С. 357.
https://doi.org/10.31857/S9785907036185000001
Чуйко Г.М., Законнов В.В., Морозов А.А. и др. 2010. Пространственное распределение и качественный состав полтхлорированных бифенилов (ПХБ) и хлорорганических пестицидов (ХОП) в донных отложениях и леще (Abramis brama L.) Рыбинского водохранилища // Биол. внутр. вод. № 2. С. 98.
Al-Shami S., Rawi C.S., Nor S.A. et al. 2010. Morphological deformities in Chironomus spp. (Diptera: Chironomidae) larvae as a tool for impact assessment of anthropogenic and environmental stresses on three rivers in the Juru river system, Penang, Malaysia // Environmental Entomology. V. 39(1). P. 210. https://doi.org/10.1603/EN09109
Bird G.A., Rosentreter M.J., Schwartz W.J. 2011. Deformities in the menta of chironomid larvae from the experimental lakes area Ontario // Can. J. Fish. Aquat. Sci. V. 52. P. 2290. https://doi.org/10.1139/f95-819
Bhattacharyay G., Sadhu A.M., Majumdar U. et al. 2006. Assessment of impact of heavy metals on the communities and morphological deformities of Chironomidae larvae in the River Damodar (India, West Bengal) // Supplementa and Acta Hydrobiologica. V. 8. P. 21.
Canfield T.J., Kemble N.E., Brumbaugh W.G. et al. 1994. Use of benthic in invertebrate community, structure and the sediment quality triad to evaluate metal–contaminated sediment in the upper Clark River, Montana // Environ. Toxicol. Chem. V. 13. № 12. P. 1999.
Corbi J.J., Bernegossi A.C., Moura L. et al. 2019. Chironomus sancticaroli (Diptera, Chironomidae) as a sensitive test species: Can we rely on its use after repeated generations, under laboratory conditions? // Bull. Environ. Contam. Toxicol. V. 103. P. 213. https://doi.org/0.1007/s00128-019-02644-8
Cushman R.M. 1984. Chironomid deformities as indicators of pollution from a synthetic, coal-derived oil // Freshwater Biol. V. 14. P. 179.
Das T., Sharma A., Talukder G. 1988. Effects of lanthanum in cellular systems // Biological Trace Element Research. V. 18(1). P. 201.
https://doi.org/10.1007/BF02917504
Deckere E., Cooman W., Florus M., Devroede-Vander Linder M.P. 2000. Characterizing the sediments of Flemish watercourses: a manual produced by TRIAD. Brussels: AMINAL-Department Water.
Dickman M., Brindle I., Benson M. 1992. Evidence of teratogens in sediments of the Niagara River Watershed as reflected by chironomid (Diptera: Chironomidae) deformities // J. Great Lakes Res. V. 18. P. 467.
Deliberalli W., Cansan R.L., Pereira A.A.M. et al. 2018. The effects of heavy metals on the incidence of morphological deformities in Chironomidae (Diptera) // Zoologia. V. 35. P. 1. https://doi.org/10.3897/zoologia.35.e12947
Di Veroli A., Goretti E., Leon Paumen M. et al. 2012. Mouthpart deformities in Chironomus riparius larvae exposed to toxicants // Environ. Pollut. V. 166. P. 212.
Di Veroli A., Santoro F., Pallottini M. et al. 2014. Deformities of Chironomid larvae and heavy metal pollution: From laboratory to field studies // Chemosphere. V. 11. № 2. P. 9. https://doi.org/. 2014.03.053https://doi.org/10.1016/j.chemosphere
Janssens de Bisthoven L., Huysmans C., Goemans G. et al. 1997. Field and experimental morphological response of Chironomus larvae to xylene and toluene // Neth. J. Zool. V. 47. P. 227.
Janssens de Bisthoven L., Postma J.F., Parren P. et al. 1998. Relations between heavy metals in aquatic sediments and in Chironomus larvae of Belgian lowland rivers and their morphological deformities // Can. J. Fish. Aquat. Sci. V. 55. P. 688.
https://doi.org/10.1139/f97-265
Janssens de Bisthoven L.G., Timmermans K.R., Ollevier F. 1992. The concentration of cadmium, lead, copper and zinc in Chironomus gr. thummi larvae (Diptera, Chironomidae) with deformed versus normal menta // Hydrobiologia. V. 239. P. 141.
https://doi.org/10.1007/BF00007671
Janssens de Bisthoven L.G., Postma J.F., Vermeulen A. et al. 2001. Morphological deformities in Chironomus riparius Meigen larvae after exposure to cadmium over several generations // Water, Air, and Soil Pollution. V. 129. P. 167.
Ingersoll C.G., Nelson M.K. 1990. Testing sediment toxicity with Hyalella azteca (Amphipoda) and Chironomus riparius (Diptera) // Aquat. Toxicol. and Risk Assessment. Philadelphia: Amer. Soc. Test. and Mater. V. 13. P. 93.
https://doi.org/10.1520/STP20101S
Hamillton A.C., Saether O.A. 1971. The occurrence of characteristic deformities in chironomid larvae of several Canadian lakes // Can. Entomol. V. 103. P. 363.
https://doi.org/10.4039/Ent103363-3
He H., Xi G., Lu X. 2010. Molecular cloning, characterization, and expression analysis of an ecdysone receptorhomolog in Teleogryllus emma (Orthoptera: Gryllidae) // J. Insect Sci. V. 10(188). P. 1. https://doi.org/10.1673/031.010.18801
Madden C.P., Suter P.J., Nicolson B.C., Austin A.D. 1992. Deformities in chironomid larvae as indicators of pollution (pesticide) stress // Neth. J. Aquat. Ecol. V. 26. № 2–4. P. 551. https://doi.org/10.1007/BF02255289
Martinez E.A., Moore B., Schaumloffel J., Dasgupta N. 2003. Morphological abnormalities in Chironomus tentans exposed to cadmium and copper spiked sediments // Ecotoxicol. Environ. Safety. V. 55. P. 204.
https://doi.org/10.1016/S0147-6513(02)00136-7
Meregalli G., Vermeulen A.C., Ollevier F. 2000. The Use of Chironomid Deformation in an in situ Test for Sediment Toxicity // Ecotoxicol. Environ. Safety. V. 47. P. 231. https://doi.org/10.1006/eesa.2000.1981
MacDonald E.E., Taylor B.R. 2006. Incidence of mentum deformities in midge larvae (Diptera: Chironomidae) from Northern Nova Scotia, Canada // Hydrobiologia. V. 563. P. 277. https://doi.org/10.1007/s10750-006-0012-8
Ochieng H., de Ruyter van Steveninck E.D., Wanda F.M. 2008. Mouthpart deformities in Chironomidae (Diptera) as indicators of heavy metal pollution in northern Lake Victoria, Uganda // Afr. J. Aquat. Sci. № 33(2). P. 135. https://doi.org/10.2989/AJAS.2008.33.2.4.501
Odume O.N., Muller W.J., Palmer C.G., Arimoro F.O. 2012. Mentum deformities in Chironomidae communities as indicators of anthropogenic impacts in Swartkops River // Physics and Chemistry of the Earth. V. 50–52. P. 140.
https://doi.org/10.1016/j.pce.2012.08.005
Saether O.A. 1980. Glossary of chironomid morphology terminology (Diptera: Chironomidae) // Entomol. Scand. Suppl. № 14. P. 1.
Servia M., Coba F., Gonzalez M.A. 2000. Seasonal and inter annual variation in the frequency and severity of deformities in larvae of Chironomus riparius (Meigen, 1804) and Prodiamesa olivacea (Meigen, 1818) (Diptera, Chironomidae) collected in polluted site // Environ. Monit. Assess. V. 64. № 3. P. 617.
https://doi.org/10.1023/A:1006333808107
Sokal R.R., Rohlf F.J. 1995. Biometry. The principals and practice of statistics in biological research. New York: W.H. Freeman and Co.
Vermeulen A.C., Liberloo G., Dumont P. et al. 2000. Exposure of Chironomus riparius larvae (Diptera) to lead, mercury and beta-sitosterol: effects on mouthpart deformation and moulting // Chemosphere. V. 41. P. 1581.
https://doi.org/10.1016/S0045-6535(00)00033-3
Warwick W.F. 1985. Morphological abnormalities in Chironomidae (Diptera) larvae as measures of toxic stress in freshwater ecosystems: indexing antennal deformities in Chironomus meigen // Can. J. Fish. Aquat. Sci. V. 42. P. 1881. https://doi.org/10.1139/f85-236
Warwick W.F. 1991. Indexing deformities in ligula and antennae of Procladius larvae (Diptera: Chironomidae): application to contaminant stressed environments // Can. J. Fish. Aquat. Sci. V. 48. P. 1151. https://doi.org/10.1139/f91-139
Watts M.M., Pascoe D.A. 2000. Comparative Study of Chironomus riparius Meigen and Chironomus tentans Fabricius (Diptera: Chironomidae) in Aquatic Toxicity Tests // Arch. Environ. Contam. Toxicol. V. 39. P. 299. https://doi.org/10.1007/s002440010108
Wiederholm T. 1984. Incidence of deformed chironomid larvae (Diptera: Chironomidae) in Swedish lakes // Hydrobiologia. V. 109. P. 243. https://doi.org/10.1007/BF00007742
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод