Биология внутренних вод, 2022, № 2, стр. 170-179
Трофические отношения между аборигенной мальмой Salvelinus malma Walb. и интродуцированной неркой Oncorhynchus nerka Walb. в оз. Сево (п-ов Камчатка)
О. Ю. Бусарова a, *, Е. В. Есин b, **, Г. Н. Маркевич c
a Дальневосточный государственный технический рыбохозяйственный университет
Владивосток, Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
c Кроноцкий государственный природный биосферный заповедник
Елизово, Россия
* E-mail: olesyabusarova@mail.ru
** E-mail: esinevgeniy@yandex.ru
Поступила в редакцию 17.09.2019
После доработки 09.06.2021
Принята к публикации 01.10.2021
- EDN: LVYELP
- DOI: 10.31857/S0320965222020048
Аннотация
Интродукции с целью повышения рыбопродуктивности водоемов опасны привнесением новых болезней и дестабилизацией трофических сетей. В 1986 г. в изолированное камчатское оз. Сево, где обитал голец Salvelinus malma, подселили жилую форму Oncorhynchus nerka из оз. Кроноцкое. Спустя 30 лет проанализировали содержимое желудков, соотношение стабильных изотопов азота/углерода и фракций липидов в мышцах, а также паразитофауну рыб для оценки трофических взаимоотношений двух видов. Обнаружено, что O. nerka заняла нишу планктофага; разделения на трофические формы в зависимости от числа жаберных тычинок, как в родительской популяции, не произошло. Аборигенная Salvelinus malma – бентофаг, представленный тремя трофическими группами. Зрелые карликовые особи, как и молодь, потребляют личинки насекомых на озерном склоне, крупные рыбы питаются амфиподами в тех же местообитаниях, 10% старших особей начинают охотиться на рыбу. Хищники подвержены гиперинвазии Diphyllobothrium sp., плероцеркоидов паразита они получают при питании Oncorhynchus nerka. Паразитофауна интродуцированной O. nerka на 3/4 беднее, чем в родительской популяции, часть видов паразитов O. nerka оз. Сево приобрела от Salvelinus malma.
ВВЕДЕНИЕ
В 1970–1980-х гг. на Камчатке проводились широкомасштабные работы по интродукции нерки-кокани Oncorhynchus nerka Walb. из оз. Кроноцкое в не имеющие промыслового значения водоемы с целью увеличения их рыбопродуктивности (Погодаев, Куренков, 2007). Известно об успешной натурализации жилой кокани в небольших озерах Ключевое, Сево и Демидовское и в крупнейшем на п-ове Камчатка Толмачевском водохранилище (Бугаев, Кириченко, 2008; Маркевич, 2008). Опросные сведения подтвердили натурализацию в оз. Хангар.
Озеро Сево отличается от прочих водоемов, где вселение прошло успешно, тем, что на момент интродукции кокани в 1986 и 1987 гг. оно не было безрыбным – здесь обитала жилая популяция мальмы Salvelinus malma Walb. (Погодаев, Куренков, 2007). По данным 2007 г. популяция кокани оз. Сево достигла высокой численности. В качестве факторов, определивших благополучную натурализацию, обсуждались обильная кормовая база и наличие хищных гольцов (Погодаев, Куренков, 2007). Влияние самой нерки-кокани на экосистему оз. Сево не оценивали. Также, ни до начала эксперимента, ни после него не проводили исследование фауны паразитов водоема. При этом интродукцию рассматривают как одну из важнейших причин снижения биологического разнообразия (Vitousek et al., 1997; Olden et al., 2004), поскольку вместе с интродуцентами в озера и реки заносятся опасные паразиты и распространяются эпизоотии (Johnsen, Jensen, 2006; Boys et al., 2012; Lymbery et al., 2014), происходит перераспределение ресурсов и изменяется трофическая структура экосистем (Baxter et al., 2004; Eby et al., 2006; Amundsen et al., 2013; Столбунов и др., 2021). Особо уязвимой к вселению чужеродных видов считается фауна небольших внутренних водоемов (Gherardi, 2007; Vitule et al., 2009).
Показательна история интродукций лососевых рыб (Aprahamian et al., 2003; Crawford, Muir, 2008; Markevich, Esin, 2019), многократно заканчивающихся катастрофой для реципиентных экосистем и нативных видов (Buoro et al., 2016). Вселение Salmo spp. в реки тихоокеанского побережья Америки привело к масштабной гибели аборигенных Oncorhynchus spp. от вибриоза (Ginetz, 2002). Попытки реинтродукции Salmo salar L. в скандинавские реки привели к гибели местных популяций от паразита Gyrodactylus salaris (Bakkel et al., 1992). В других случаях интродуценты вытесняли местные виды лососевых из их пищевых ниш (Eloranta et al., 2015; Nasegava, 2020). Вселение лососевых в изолированные экосистемы со специализированной эндемичной фауной чаще всего приводило к вымиранию последней (Маркевич и др., 2019).
Вышеописанная ситуация обусловила цель настоящего исследования – определение трофических связей между аборигенной мальмой и интродуцированной неркой по составу пищи, стабильных изотопов и паразитофауны.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Озеро Сево расположено в отрогах Валагинского хребта на центральной Камчатке (54.479372′ c.ш., 158.673444′ в.д.) на высоте 620 м над уровнем моря. Водоем подпрудного типа, бессточный; длина 3.5 км, средняя ширина 0.7 км, максимальная глубина 100 м (Есин, Маркевич, 2017).
Материал собирали в августе 2015 г. Рыб отловили жаберными сетями (шаг ячеи 20–35 мм) по всей литорали озера; двух крупных погибающих мальм собрали с поверхности воды. Всего по стандартному протоколу изучено 65 экз. мальмы и 52 экз. нерки (на мальму приходилось 45% уловов рыб). У каждой свежепойманной рыбы измеряли FL (см), Q (г), СЗ (баллы) (Мурза, Христофоров, 1991). У нерки дополнительно подсчитывали число тычинок на первой жаберной дуге.
Питание рыб анализировали по содержимому желудков (Amundsen et al., 1996). Рассчитывали частоту встречаемости групп пищевых объектов – отношение числа рыб с данным видом пищи к числу рыб в выборке (%), а также среднее число пищевых объектов каждой группы, приходящееся на одну рыбу в выборке (экз.). Общность пищевых ниш оценили с помощью индекса Мориситы в модификации Хорна (Horn, 1966), долю групп в питании определяли по числу жертв.
Поскольку для гольцов в летний период возможен кратковременный переход к питанию массовыми жертвами (Tveiten et al., 1996; Jorgensen, Johnsen, 2014), дополнительно проводили ретроспективную оценку трофических ниш. Для этого рыб на 3–4 стадии зрелости гонад сравнили по соотношению стабильных изотопов азота 14N/15N и углерода 12C/13C в мышечной ткани (Peterson, Fry 1987), по липидному составу мышц (Богдан и др., 2001) и по составу паразитов (Knudsen et al., 2004).
Для изотопного анализа образцы мышечной ткани вырезали из-под заднего края спинного плавника и высушивали до постоянной массы. Масс-cпектрометрический анализ проб проводили в Центре коллективного пользования “Инструментальные методы в экологии” Института проблем экологии и эволюции РАН на приборе “Thermo Finnigan Delta V Plus” с анализатором Flash 1112. Изотопный состав представили в тысячных долях отклонения (‰) от стандартов (атмосферный азот и образец белемнита “PDB”). Поскольку значения δ13C изменялись в пределах 10‰, нормализацию по липидному составу не проводили (Post et al., 2007).
Содержание основных фракций липидов в мышцах оценивали спектрофотометрически на приборе “Hatch DR2400”. Экстракцию (Folch et al., 1957) проводили из фрагментов ткани массой 0.4 ± 0.001 г с последующей промывкой в 1%-ном растворе KCl. Валовую концентрацию липидов определяли по реакции с фосфованилином в 10%-ной H2SO4; оптическую плотность – при длине волны 520 нм (Knicht et al., 1972). Содержание триацилглицеридов и фосфолипидов определяли ферментативно-фотометрически при длине волны 505 нм, используя готовые наборы реактивов Spinreact в соответствии с инструкциями. Полученные значения выражали в % массы образцов ткани.
Паразитологический анализ рыб проводили с помощью неполного паразитологического вскрытия (Быховская-Павловская, 1985). Рыб обследовали на наличие паразитов на поверхности тела, в ротовой и жаберной полостях, в глазах (во внутренней среде и хрусталиках), в полости тела, на поверхности сердца, в плавательном пузыре, в мочеточниках, на стенках и в полости желудка и кишечника. Рыб не обследовали на наличие простейших, миксоспоридий (кроме Henneguya zschokkеi (Gurley, 1894)) и моногеней. Большинство паразитов идентифицировали до видов (Определитель…, 1985, 1987). Использовали традиционные показатели зараженности: экстенсивность инвазии – доля зараженных рыб в выборке, % и индекс обилия – среднее число особей паразитов, приходящееся на одну рыбу в выборке, экз.
Для оценки статистической достоверности различий между группами рыб в питании, изотопном и липидном составе, и инвазии паразитами применяли непараметрический критерий Манна–Уитни после подтверждения наличия различий тестом Краскелла–Уоллиса (Conover, 1999). Значимость размерных трендов изменения доли пищевых объектов в желудках, соотношения изотопов и липидов в мышцах и зараженности паразитами определяли методом наименьших квадратов (Плохинский, 1970). Математическую обработку данных проводили в программе Statsoft Statistica v.13.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Биологические характеристики рыб. В наших уловах мальма была представлена молодью на второй СЗ гонад (17 экз., FL 10–20 см, Q 10–70 г), взрослыми особями обоих полов на 4+ стадии зрелости (11 экз.), так называемыми “карликами” с FL 14–20 (в среднем 17.2 ± 4.28) cм и Q 32–60 (43.7 ± 3.01) г, а также крупными взрослыми особями обоих полов на третьей–четвертой СЗ гонад (37 экз.) с FL 20–42 (27.3 ± 8.90) cм и Q 68–580 (208.9 ± 19.94) г.
Пойманная нерка с FL 14–29 (19.9 ± 3.36) см при Q 20–110 (53.3 ± 2.40) г имела гонады на четвертой СЗ. В родительской популяции оз. Кроноцкое нерка дифференцирована на две группы – малотычинковых (<39) бентофагов и многотычинковых (≥39) планктофагов, которые различаются размерами тела (Куренков, 1977). В оз. Сево (как и в другие камчатские озера) зарыбляли многотычинковую нерку-планктофага. В 2015 г. выборка из оз. Сево включала рыб с <39 тычинок (11 экз.) и ≥39 тычинок (41 экз.). Такие особи не различались (t-тест р = 0.281) размерами тела.
Различия в питании рыб. В желудках исследованных рыб обнаружено восемь групп пищевых объектов (табл. 1). Молодь и “карлики” мальмы преимущественно питались личинками хирономид и не различались по количеству жертв всех групп в желудках (U-тесты р > 0.05). Крупная мальма по питанию разделилась на бентосоядную (58 экз.) и рыбоядную (7 экз.). В желудках первой находились преимущественно гаммарусы (амфиподы), также отмечены личинки хирономид и моллюски. В желудках хищной мальмы присутствовали рыба и бентос. Хищники были крупнее “крупных” бентофагов: FL 31–42 (в среднем 35.1) см и Q 215–580 (386.8) г против FL 20–39 (26.1) см и Q 68–480 (181.3) г (t-тесты р = = 0.009 и р = 0.004 для FL и Q соответственно).
Таблица 1.
Питание Salvelinus malma и Oncorhynchus nerka в оз. Сево (Камчатка) в августе 2015 г.
| Объект питания | O. nerka | S. malma | H-тест | U-тест | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| (52 экз.) | хищники (7 экз.) |
бентофаги (58 экз.) |
||||||||
| ЧВ | n | ЧВ | n | ЧВ | n | O. nerka– S. malma, хищники | O. nerka– S. malma, бентофаги |
S. malma, хищники– S. malma, бентофаги | ||
| Chironomidae, larvae | 17 | 0.4 (5) | 14 | 0.3 (2) | 38 | 17.8 (205) | $\frac{{9.52}}{{0.009}}$ | $\frac{{152}}{{0.945}}$ | $\frac{{845}}{{0.020}}$ | $\frac{{144}}{{0.182}}$ |
| Ephemeroptera, larvae | 0 | 0.0 (0) | 0 | 0.0 | 11 | 0.8 (27) | $\frac{{6.61}}{{0.037}}$ | – | $\frac{{175}}{{0.016}}$ | $\frac{{85}}{{0.379}}$ |
| Trichoptera, larvae | 0 | 0.0 (0) | 14 | 0.2 (1) | 9 | 0.9 (31) | $\frac{{5.46}}{{0.065}}$ | $\frac{{182}}{{0.393}}$ | $\frac{{1326}}{{0.029}}$ | $\frac{{179}}{{0.043}}$ |
| Insecta, imago | 31 | 10.2 (300) | 14 | 0.7 (5) | 13 | 0.2 (5) | $\frac{{6.75}}{{0.034}}$ | $\frac{{153}}{{0.403}}$ | $\frac{{1158}}{{0.010}}$ | $\frac{{190}}{{0.820}}$ |
| Amphipoda | 10 | 10.8 (285) | 14 | 0.9 (6) | 41 | 15.8 (158) | $\frac{{13.58}}{{0.001}}$ | $\frac{{175}}{{0.754}}$ | $\frac{{1012}}{{ < 0.001}}$ | $\frac{{138}}{{0.150}}$ |
| Copepoda и Ostracoda | 92 | 167.6 (590) | 0 | 0.0 (0) | 2 | 0.1 (3) | $\frac{{80.77}}{{ < 0.001}}$ | $\frac{{21}}{{ < 0.001}}$ | $\frac{{177}}{{ < 0.001}}$ | $\frac{{186}}{{0.553}}$ |
| Pisidium sp. | 6 | 0.1 (2) | 0 | 0.0 (0) | 36 | 3.5 (51) | $\frac{{18.22}}{{ < 0.001}}$ | $\frac{{172}}{{0.538}}$ | $\frac{{995}}{{ < 0.001}}$ | $\frac{{126}}{{0.066}}$ |
| Рыба (S. malma и O. nerka) | 0 | 0.0 (0) | 100 | 1.0 (2) | 0 | 0.0 (0) | $\frac{{113.88}}{{0.000}}$ | $\frac{{950}}{{ < 0.001}}$ | – | $\frac{{1456}}{{ < 0.001}}$ |
| Наполненность желудков, % | 45.0 | 34.4 | 28.4 | $\frac{{7.66}}{{0.022}}$ | $\frac{{139}}{{0.316}}$ | $\frac{{1011}}{{0.006}}$ | $\frac{{196}}{{0.991}}$ | |||
Примечание. ЧВ – частота встречаемости групп пищевых объектов в желудках рыб, %; n – среднее число жертв, приходящееся на одну рыбу в выборке, в скобках – максимальное число жертв, экз., “–” – пищевой объект отсутствовал в обеих сравниваемых группа рыб. Здесь и в табл. 2 в числителе значение критерия, в знаменателе p.
Нерка с разным числом жаберных тычинок (<39 и ≥39) по содержимому желудков не различалась (U-тесты р > 0.05 для всех групп объектов). В августе она питалась планктонными ракообразными, гаммарусами и имаго насекомых. Нерка достоверно отличалась от “карликовой”, крупной бентосоядной и хищной мальмы высоким содержанием в желудках планктонных ракообразных (р < 0.001); от “карликовой” и бентосоядной мальмы – меньшим числом гаммарусов и моллюсков (р < 0.001), имаго насекомых (р = 0.010), личинок хирономид, подeнок и ручейников (р < 0.001). Нерка имела большую наполненность желудков по сравнению с мальмой (р = 0.006).
Пищевые ниши мальмы и нерки не перекрывались. Индекс Мориситы в парах нерка – “карликовая” мальма, нерка – “крупная” бентосоядная мальма и нерка – хищная мальма был <0.1; в паре хищная – бентосоядная мальма – 0.5. Биологическая значимость индекса Мориситы составляла 0.6 (Horn, 1966).
С увеличением размеров бентосоядной мальмы отмечена тенденция снижения в еe питании доли личинок насекомых и увеличения доли гаммарусов. Величина линейной аппроксимации R связи FL – число личинок хирономид в желудке достигала 0.66 (р = 0.037), для гаммарусов – 0.57 (р = 0.043). У нерки не выявлено изменения состава пищи по мере увеличения размера, R < 0.30 (р > 0.05).
Соотношение стабильных изотопов в мышечной ткани рыб. Взрослая бентосоядная мальма, хищная мальма и нерка образовали неперекрывающиеся области в пространстве δ13С – δ15N (рис. 1). Бентосоядная мальма отличалась от хищников и нерки большим δ13С (H2;48 = 36.22, р < 0.001; U-тесты р = 0.041 и < 0.001 соответственно). “Карлики” отличались от взрослых “крупных” бентофагов сниженным δ15N (р = 0.045). Хищная мальма превосходила бентофаги и нерку по δ15N (H2;48 = 16.67, р = 0.002; U-тесты р < 0.001). Нерка достоверно не отличалась по сигнатуре азота от бентосоядной мальмы (р = 0.322), а по углероду – от хищной мальмы (р = 0.287).
Рис. 1.
Изотопный состав углерода и азота мышечной ткани бентосоядной мальмы (рано созревающие особи (1, 1а), хищной мальмы (2) и планктоядной кокани (3) из оз. Сево. Даны средние значения (точки) и пределы варьирования (линии).
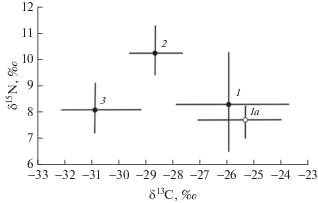
Для бентосоядной и хищной мальмы отмечена связь между ростом показателя δ15N и размером тела, R = 0.72, р = 0.035.
Липидный состав мышечной ткани рыб. Нерка отличалась от взрослой мальмы сниженной жирностью мышечной ткани (H2;48 = 26.05 р < 0.001; U-тесты р < 0.001), для трофических групп мальмы достоверные различия по валовой концентрации липидов не получены (р = 0.174) (рис. 2а). По содержанию триацилглицеридов “карлики” отличались от “крупных” бентофагов (р = 0.039) и хищников (р = 0.003), при этом “крупные” бентофаги и хищники значимо не различались (p > 0.05) (рис. 2б). По фосфолипидам нерка отличалась сниженным содержанием от “карликовой”, “крупной” бентосоядной и хищной мальмы (р = 0.021, 0.004, 0.001 соответственно), при этом у обеих групп бентосоядной мальмы этой фракции липидов было меньше, чем у хищников (р = 0.049) (рис. 2в).
Рис. 2.
Липидный состав мышечной ткани бентосоядной мальмы и планктоядной кокани из оз. Сево: а – валовая концентрация липидов, б – триацилглицериды, в – фосфолипиды. Даны средние значения (поперечные линии), ошибки среднего (прямоугольники) и пределы варьирования (вертикальные линии). Обозначения групп рыб, как на рис. 1.
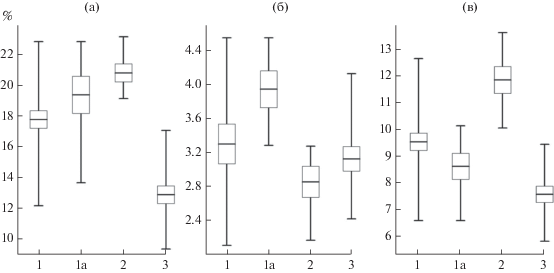
По мере роста “крупной” бентосоядной мальмы наблюдалась тенденция к повышению жирности мышечной ткани (R = 48, p = 0.05).
Состав паразитов рыб. У обследованных рыб обоих видов обнаружено девять видов паразитов (табл. 2). Salmincola edwardsii Olsson, 1869 из жаберной полости и Paracanthobdella livanowi (Epstein, 1966) с поверхности тела имеют прямое развитие. Остальные паразиты маркировали питание разными группами беспозвоночных. На поверхности тела рыб отмечены цисты миксоспоридии Henneguya zschokkеi (Gurley, 1894), основные хозяева которой – бентосные кольчатые черви (Okamura et al., 2015). Во внутренней среде глаз рыб присутствовали метацеркарии Diplostomum sp., которые заражают рыб при контакте с лeгочными моллюсками (Судариков и др., 2002). В кишечнике рыб присутствовал Crepidostomum farionis Muller, 1874, промежуточным хозяином для которого служат личинки подeнок (Crawford, 1943). В плавательном пузыре отмечена Cystidicola farionis Fisher, 1798, а в кишечнике – Echinorhynchus salmonis Muller, 1780, для которых промежуточными хозяевами являются амфиподы (Black, Lankester, 1980; Measures, Bosse, 1993). В стенках желудка и на поверхности внутренних органов рыб присутствовали плероцеркоиды Diphyllobothrium sp., промежуточными хозяевами которых являются планктонные ракообразные (Делямуре и др., 1985). Proteocephalus longicollis Zeder, 1800 обнаружен в кишечнике рыб, его промежуточные хозяева – циклопы и диаптомусы (Willemse, 1969).
Таблица 2.
Показатели заражeнности паразитами Salvelinus malma и Oncorhynchus nerka оз. Сево (Камчатка) в августе 2015
| Паразит | O. nerka (52 экз.) |
S. malma | H-тест | U-тест | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| хищники (7 экз.) |
бентофаги (58 экз.) |
|||||||||
| ЭИ | ИО | ЭИ | ИО | ЭИ | ИО | O. nerka – S. malma, хищники | O. nerka – S. malma, бентофаги | S. malma, хищники– S. malma, бентофаги | ||
| Myxosporеа | ||||||||||
| Henneguya zschokkеi | + | – | + | – | + | – | – | – | – | – |
| Тrematoda | ||||||||||
| Diplostomum sp. | 50.0 | 0.9 | 7 из 7 | 13.1 | 100.0 | 30.0 | $\frac{{77.62}}{{ < 0.001}}$ | $\frac{{11}}{{ < 0.001}}$ | $\frac{{77}}{{ < 0.001}}$ | $\frac{{140}}{{0.220}}$ |
| Crepidostomum farionis | 36.5 | 0.6 | 6 из 7 | 0.4 | 32.1 | 10.1 | $\frac{{1.56}}{{0.450}}$ | $\frac{{156}}{{0.751}}$ | $\frac{{349}}{{0.432}}$ | $\frac{{155}}{{0.45}}$ |
| Cestoda | ||||||||||
| Diphyllobothrium sp. | 94.2 | 8.1 | 6 из 7 | 119.1 | 7.1 | 0.1 | $\frac{{75.85}}{{ < 0.001}}$ | $\frac{{103}}{{0.070}}$ | $\frac{{143}}{{ < 0.001}}$ | $\frac{{60}}{{ < 0.001}}$ |
| Proteocephalus longicollis | 3.9 | 0.04 | 1 из 7 | 1.1 | 30.4 | 3.6 | $\frac{{14.05}}{{ < 0.001}}$ | $\frac{{162}}{{0.23}}$ | $\frac{{1054}}{{ < 0.001}}$ | $\frac{{164}}{{0.38}}$ |
| Chromadorea | ||||||||||
| Cystidicola farionis | 34.6 | 0.7 | 6 из 7 | 119.0 | 91.1 | 80.7 | $\frac{{56.82}}{{ < 0.001}}$ | $\frac{{41}}{{ < 0.001}}$ | $\frac{{292}}{{ < 0.001}}$ | $\frac{{169}}{{0.552}}$ |
| Acantocephala | ||||||||||
| Echinorhynchus salmonis | 88.5 | 30.0 | 6 из 7 | 845.6 | 94. 6 | 420.8 | $\frac{{25.57}}{{ < 0.001}}$ | $\frac{{71}}{{0.009}}$ | $\frac{{686}}{{ < 0.001}}$ | $\frac{{128}}{{0.140}}$ |
| Crustacea | ||||||||||
| Salmincola edwardsii | 0.0 | – | 6 из 7 | 3.4 | 14.3 | 1.2 | 16.07 | $\frac{{104}}{{ < 0.001}}$ | $\frac{{1248}}{{0.005}}$ | $\frac{{137}}{{0.053}}$ |
| Hirudinea | ||||||||||
| Paracanthobdella livanowi | + | – | + | – | + | – | – | – | – | – |
Бентосоядная мальма, хищная мальма и нерка различались по показателям заражeнности паразитами. Первая отличалась от хищной мальмы и нерки низким обилием Diphyllobothrium sp. (U-тесты р < 0.001). При этом “карлики” отличались от “крупных” бентофагов большим обилием Proteocephalus longicollis (p = 0.008) и меньшей инвазией Echinorhynchus salmonis и Cystidicola farionis (p < < 0.001). Хищная мальма отличалась экстремально высокой заражeнностью Diphyllobothrium sp. (до 524 экз./рыба). Нерка характеризовалась достоверно низкой инвазией Diplostomum sp., Cystidicola farionis и Echinorhynchus salmonis (р < 0.001), а также отсутствием Salmincola edwardsii.
У мальмы всех трофических групп с ростом наблюдалось увеличение числа Echinorhynchus salmonis (R = 0.87, p = 0.001) и Cystidicola farionis (R = 0.77, p = = 0.003) на фоне снижения числа Proteocephalus longicollis (R = 0.65, p = 0.013).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исследование показало, что мальма из оз. Сево полиморфна по своей экологии. Молодь в основном питается личинками насекомых. С возрастом пищевой спектр расширяется, в питание включаются гаммарусы и моллюски. Взрослые особи >20 см питаются почти одними гаммарусами. При этом часть мальмы (~10%) созревает в размерном диапазоне молоди (самцы FL ≥13 см, самки ≥15 см) и продолжает питаться личинками насекомых, не переходя на гаммарусов. Такие рыбы отличаются от потребителей гаммарусов низкой сигнатурой по азоту, поскольку амфиподы сами являются потребителями бентоса и обогащают крупную мальму тяжелым изотопом (MacNeil et al., 1997). Несмотря на очевидно более высокую калорийность гаммарусов по сравнению с личинками хирономид, “карлики” запасают липиды эффективнее, чем “крупные” бентофаги.
Состав паразитов мальмы свидетельствует о ее питание бентосом у дна. Пять из семи видов паразитов заражают рыб либо при поедании бентосных организмов (Crepidostomum farionis, Cystidicola farionis, Echinorhynchus salmonis), либо при контакте с ними (Diplostomum spр., Henneguya zschokkеi). Лишь Proteocephalus longicollis и Diphyllobothrium sp. заражают мальму при питании планктоном. “Крупная” бентосоядная мальма сильно заражена Cystidicola farionis и Echinorhynchus salmonis, что связано с еe питанием гаммарусами.
Около 10% старших и уже созревших рыб становятся рыбоядными и ускоряются в росте. Данное явление характерно для гольцов в изолированных озерах Камчатки (Esin, Markevich, 2019) и в целом по ареалу рода (Reist et al., 2013; Есин, Маркевич, 2017). Питаясь собственной молодью и неркой, хищная мальма реинвазируется Cystidicola farionis, Echinorhynchus salmonis и Diphyllobothrium sp., а также приобретает более высокие значения δ15N (Minagawa, Wada, 1984). Специфический липидный состав хищников указывает на хорошую обеспеченность кормом и повышенный уровень метаболизма по сравнению с бентофагами (Houlihan еt al., 1993).
Нерка-кокани в оз. Сево однородна по питанию, рыбы с различным числом жаберных тычинок (<39 и ≥39) в основном питаются планктонными ракообразными (в среднем 168 экз./рыба). Состав паразитов подтверждает преимущественное питание нерки планктоном; по сравнению с бентосоядной мальмой нерка более инвазирована Diphyllobothrium sp., заражающим рыб при питании циклопами, и менее – Diplostomum sp., Cystidicola farionis и Echinorhynchus salmonis, передающихся рыбам через моллюсков и амфипод.
Таким образом, по прошествии 30 лет после вселения нерки (около восьми поколений) в экосистеме оз. Сево наблюдается устойчивая пищевая сегрегация между аборигенной мальмой и интродуцентом. В отличиe от других лососевых озeр, например, Инариярви (Inariarvi) в Финляндии, вытеснения аборигенного вида из его трофической ниши не произошло (Eloranta et al., 2015). Пищевые ниши мальмы и нерки, согласно результатам индекса Мориситы, не перекрываются. Виды разделяются по изотопной сигнатуре, демонстрируя сегрегацию трофических ниш в течение нескольких месяцев, т.е. всего весенне-летнего периода нагула (Peterson, Fry, 1987), а судя по разнице в заражeнности Cystidicola farionis и Echinorhynchus salmonis – в течение как минимум последних двух лет (Black, Lankester, 1980; Михайлова, 2015). Пониженный δ13C кокани связан с еe вовлечением в цикл вторичного круговорота органического вещества в гиполимнионе (Wada, 2009). Несмотря на более активное питание в августе, нерка отличалась пониженной жирностью, что может указывать на худшие условия кормления по сравнению с бентосоядной мальмой (Богдан и др., 2001; Houlihan еt al., 1993).
Нерка оз. Сево отличается от родительской многотычинковой популяции из оз. Кроноцкое. В отличие от последней, в оз. Сево появились особи с числом жаберных тычинок <39, что типично для малотычинковой кроноцкой кокани (Маркевич, 2008). При этом между много- и малотычинковыми особями в оз. Сево не обнаружены различия по питанию, зараженности паразитами, биологическим показателям и стадиям зрелости гонад. Таким образом, в оз. Сево не реализовался сценарий образования самостоятельных экологических форм у нерки.
Помимо нерки из оз. Сево были изучены питание и паразитофауна нерки-кокани, интродуцированной в Толмачeвское вдхр. (Бусарова, Есин, 2017). Эта дочерняя популяция также отличается от родительской (табл. 3). Как и нерка из оз. Сево, она имеет сравнительно меньшие размеры и массу тела и не дифференцируется по питанию, несмотря на то, что треть особей имеет число жаберных тычинок <39. При этом в Толмачевском вдхр. нерка заняла нишу бентофага. В оз. Сево этого не произошло, поскольку аборигенная мальма, для которой характерно питание со дна (Есин, Маркевич, 2017), имеет конкурентные преимущества перед неркой-бентофагом.
Таблица 3.
Сравнительная характеристика жилой формы Oncorhynchus nerka из водоемов Камчатки
| Признаки | оз. Кроноцкое | оз. Сево | Толмачевское вдхр. | |
|---|---|---|---|---|
| 29–38 тычинок, бентофаги | 39–47 тычинок, планктофаги |
36–46 тычинок, планктофаги | 35–45 тычинок, бентофаги |
|
| FL, среднее (min–max), мм | 253 (205–313) | 233 (215–250) | 199 (140–290) | 189.5 (161–270) |
| Q, среднее (min–max), г | 185 (83–350) | 125 (63–236) | 53.3 (20–110) | 82.8 (56–158) |
| ♀ : ♂ | 1 : 1.5 | 1 : 2.6 | 1 : 1 | 1 : 1.6 |
| Преобладающие объекты питания | Личинки и куколки хирономид | Зоопланктон | Зоопланктон, имаго насекомых |
Гаммарусы, личинки и куколки хирономид |
| Число видов паразитов | 16 | 16 | 8 (неполное вскрытие) | 2 |
| Преобладающие виды гельминтов (ЭИ, ИО) | Crepidostomum metoecus (93.3, 146.5); Crepidostomum farionis (96.7, 23.9) |
Neoechinorhynchus salmonis (100, 306); Proteocephalus longicollis (90, 60.5); Eubothrium salvelini (76.7, 19); Diphyllobothrium sp. (96.7, 14.6) |
Echinorhynchus salmonis (88.5, 30); Diphyllobothrium sp. (94.2, 8.1) |
Diplostomum sp. (100, 23.7) |
Для обеих дочерних популяций нерки характерен обедненный состав паразитофауны. В оз. Кроноцкое у многотычинковой нерки было отмечено 17 видов паразитов (Бусарова и др., 2016), которые вместе с производителями нерки должны были попасть в реципиентные озера. Однако к 2015 г. в дочерних популяциях сохранились не все виды паразитов. Так, у нерки из оз. Сево, с учетом неполного паразитологического вскрытия, были обнаружены восемь видов паразитов, из которых лишь пять видов общие с неркой из оз. Кроноцкое (Crepidostomum farionis, Diplostomum sp., Diphyllobothrium sp., Proteocephalus longicollis, Cystidicola farionis), а три вида (Henneguya zschokkеi, Echinorhynchus salmonis, Paracanthobdella livanowi) отсутствовали в родительской популяции, т.е. были приобретены от аборигенной мальмы. У нерки Толмачевского вдхр. было отмечено лишь два вида паразитов, здесь нерка утратила >90% разнообразия своей паразитофауны (Бусарова, Есин, 2017). При этом и в оз. Сево, и в Толмачевском вдхр. обитают беспозвоночные, которые могли бы служить звеньями в паразитарных циклах.
Среди последствий вселения нерки в оз. Сево следует отметить гиперинвазию хищных особей мальмы Diphyllobothrium sp. Известно, что высокая зараженность Diphyllobothrium sp. приводит к множественным функциональным нарушениям у рыб и их гибели (Пронин и др., 1991; Knudsen, Klemetsen, 1994). Погибшая мальма, обнаруженная в оз. Сево, была экстремально сильно заражена этим паразитом (200–524 экз./рыба). Хищная мальма аккумулирует дифиллоботриид при питании неркой – в среднем одна нерка в выборке содержала 8.1 экз. Diphyllobothrium sp. Молодь мальмы, которая также служит пищей хищникам, минимально заражена дифиллоботриидами. Личинки Diphyllobothrium sp. у хищников находились не только в стенках желудка, но и на кишечнике, стенках брюшной полости, на печени и в ее ткани. Другие особи хищной мальмы также имели высокую инвазию Diphyllobothrium sp. (интенсивность инвазии 19–56 экз./рыба).
Выводы. По нашим данным, вселение жилой нерки в изолированное оз. Сево, в котором уже обитала мальма, не привело к смене пищевых стратегий этих видов. Мальма продолжила использовать бентическую трофическую сеть. Этот аборигенный вид не однороден по питанию: мелкие особи в основном потребляют личинок хирономид, по мере роста переходят на питание гаммарусами, незначительная часть рыб в старшем возрасте начинает хищничать, охотясь за собственной молодью и неркой. Отмечена элиминация хищных особей в результате аккумуляции Diphyllobothrium sp., получаемых от нерки. Нерка оз. Сево отличается от родительской популяции из оз. Кроноцкое меньшими размерами и меньшим разнообразием паразитофауны у нее по сравнению с родительской популяцией снизилось.
Список литературы
Богдан В.В., Сидоров В.С., Зекина Л.М. 2001. Липиды рыб при адаптации к различным экологическим условиям // Экологические проблемы онтогенеза рыб: физиолого-биохимические аспекты. Москва: МГУ. С. 188.
Бугаев В.Ф., Кириченко В.Е. 2008. Нагульно-нерестовые озера азиатской нерки. Петропавловск-Камчатский: Камчатпресс.
Бусарова О.Ю., Есин Е.В. 2017. Паразиты и питание кокани Oncorhynchus nerka Walb. Толмачевского водохранилища, Камчатка // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. Вып. 44. С. 39. https://doi.org/10.15853/2072-8212.2017.44.39-43
Бусарова О.Ю., Буторина Т.Е., Маркевич Г.Н., Анисимова Л.А. 2016. Паразитофауна кокани Oncorhynchus nerka озера Кроноцкое (Камчатка) // Паразитология. Т. 50. Вып. 3. С. 212.
Быховская-Павловская И.Е. 1985. Паразиты рыб. Руководство по изучению. Ленинград: Наука.
Делямуре С.Л., Скрябин А.С., Сердюков А.М. 1985. Основы цестодологии. Т. XI. Дифиллоботрииды – ленточные гельминты человека, млекопитающих и птиц. Москва: Наука.
Есин Е.В., Маркевич Г.Н. 2017. Гольцы рода Salvelinus азиатской части Северной Пацифики: происхождение, эволюция и современное разнообразие. Петропавловск-Камчатский: Камчатпресс.
Куренков С.И. 1977. Две репродуктивно изолированные группы жилой нерки Oncorhynchus nerka kennerlyi (Suckley) Кроноцкого озера // Вопр. ихтиологии. Т. 17. № 4. С. 597.
Маркевич Г.Н. 2008. Интродукция жилой формы нерки Oncorhynchus nerka Walb. в безрыбные водоемы Камчатки: Автореф. дис. … канд. биол. наук. Москва.
Маркевич Г.Н., Есин Е.В., Леман В.Н. и др. 2019. Перспективы рыбохозяйственного освоения озера Кроноцкое, полуостров Камчатка // Вопр. рыболовства. Т. 20. № 1. С. 5.
Михайлова Е.И. 2015. Скребни рода Neoechinorhynchus (Acanthocephales: Neoechinorhynchidae) северо-восточной Азии (таксономия, зоогеография, экология): Автореф. дис. … канд. биол. наук. Cанкт-Петербург.
Мурза И.Г., Христофоров О.Л. 1991. Определение степени зрелости гонад и прогнозирование возраста достижения половой зрелости у атлантического лосося и кумжи. Методические указания. Ленинград: ГосНИИ озер. и реч. рыб. хоз-ва.
Определитель паразитов пресноводных рыб фауны СССР. 1984. Т. 1: Паразитические простейшие. Ленинград: Наука.
Определитель паразитов пресноводных рыб фауны СССР. 1987. Т. 3: Паразитические многоклеточные. Ч. 2. Ленинград: Наука.
Плохинский Н.А. 1970. Биометрия. Москва: Высш. шк.
Погодаев Е.Г., Куренков С.И. 2007. Интродукция кокани Oncorhynchus nerka kennerlyi (Suckley) в озера Камчатки // Вопр. рыболовства. Т. 8. № 3. С. 394.
Пронин Н.М., Жалцанова Д.-С.Д., Пронина С.В. и др. 1991. Динамика зараженности животных гельминтами. Улан-Удэ: Бурятский науч. центр СО АН СССР. С. 3.
Столбунов И.А., Гусаков В.А., Зьен Ч.Д., Тхань Н.Т.Х. 2021. Спектр питания, трофические и размерно-массовые характеристики чужеродных кольчужных сомов Pterygoplichthys spp. (Loricaridae) Вьетнама // Биология внутр. вод. № 5. С. 518. https://doi.org/10.31857/S0320965221050211
Судариков В.Е., Шигин А.А., Курочкин Ю.В. и др. 2002. Метацеркарии трематод – паразиты пресноводных гидробионтов Центральной России. Т. 1. Москва: Наука.
Amundsen P.-A., Gabler H.-M., Staldvik F.J. 1996. A new approach to graphical analyses of feeding strategy from stomach contents data – modification of the Costello (1990) method // J. Biol. V. 48. № 4. P. 607. https://doi.org/10.1111/1095-8649.1996.tb01455.x
Amundsen P.-A., Lafferty K.D., Knudsen R., et al. 2013. New parasites and predators follow the introduction of two fish species to a subarctic lake: implications for food-web structure and functioning // Oecologia. V. 171. № 4. P. 993.
Aprahamian M.W., Martin-Smith K.M., Mcginnity P. 2003. Restocking of salmonids –opportunities and limitations // Fisheries Res. V. 62. № 2. P. 211. https://doi.org/10.1016/S0165-7836(02)00163-7
Bakkel T.A., Harris P.D., Jansenl P.A., Hansen L.P. 1992. Host specificity and dispersal strategy in Gyrodactylid monogeneans, with particular reference to Gyrodactylus salaris (Platyhelminthes, Monogenea) // Dis. Aquat. Org. V. 13. P. 63.
Baxter C.V., Fausch K D., Murakami M., Chapman P.L. 2004. Fish invasion restructures stream and forest food webs by interrupting reciprocal prey subsidies // Ecology. V. 85. № 10. P. 2656. https://doi.org/10.1890/04-138
Black G.A., Lankester M.W. 1980. Migration and development of swim-bladder nematodes, Cystidicola spp. (Habronematoidea), in their definitive hosts // Can. J. Zoology. V. 58. № 11. P. 1997. https://doi.org/10.1139/z80-275
Boys C.A., Rowland S.J., Gabor M. et al. 2012. Emergence of epizootic ulcerative syndrome in native fish of the Murray-Darling River System, Australia: hosts, distribution and possible vectors // PLoS ONE. V. 7. № 4. P. e35568. https://doi.org/10.1371/journal.pone.0035568
Buoro M., Olden J.D., Cucherousset J. 2016. Global Salmonidae introductions reveal stronger ecological effects of changing intraspecific compared to interspecific diversity // Ecology Letters. V. 19. № 11. P. 1363. https://doi.org/10.1111/ele.12673
Conover W.J. 1999. Practical Nonparameteric Statistics (Third ed.). N-Y: Wiley. P. 396–406.
Crawford S.S., Muir A.M. 2008. Global introductions of salmon and trout in the genus Oncorhynchus: 1870–2007 // Reviews in Fish Biology and Fisheries. V. 18. № 3. P. 313. https://doi.org/10.1007/s11160-007-9079-1
Crawford W.W. 1943. Colorado trematodes studies. I. A further contribution to the life history of Crepidostomum farionis (Muller) // J. Parasitol. V. 29. № 6. P. 379.
Eby L.A., Roach W.J., Crowder L.B., Stanford J.A. 2006. Effects of stocking-up freshwater food webs // Trends in Ecology and Evolution. V. 21. № 10. P. 576. https://doi.org/10.1016/j.tree.2006.06.016
Eloranta A.P., Nieminen P., Kahilainen K. 2015. Trophic interactions between introduced lake trout (Salvelinus namaycush) and native Arctic charr (S. alpinus) in a large Fennoscandian subarctic lake // Ecol. Freshw. Fish. V. 24. № 2. P. 181. https://doi.org/10.1111/eff.12132
Esin E.V., Markevich G.N. 2019. Parallel late ontogeny transformations in contrasting landlocked phenotypes of Salvelinus malma (Salmonidae) from small volcanic lakes // Ecol. Freshw. Fish. V. 28. № 4. P. 624. https://doi.org/10.1111/eff.12480
Folch J., Lees M., Sloan-Stanley G.H. 1957. A simple method for the isolation and purification of total lipides from animal tissues // J. Biol. Chemistry. V. 226. № 1. P. 497.
Gherardi F. 2007. Biological invasions in inland waters: An overview // Biological invaders in inland waters: Profiles, distribution, and threats. V. 2. Amsterdam: Springer. P. 3. https://doi.org/10.1007/978-1-4020-6029-8_1
Ginetz R.M.J. 2002. On the risk of colonization by Atlantic salmon in BC waters. New Westminster, BC: BC Salmon farmers Assoc.
Horn H.S. 1966. Measurement of “overlap” in comparative ecological studies // The American Naturalist. V. 100. № 914. P. 419. https://doi.org/10.1086/282436
Houlihan D.F., Mathers E.M., Foster A. 1993. Biochemical correlates of growth rate in fish // Fish ecophysiology. London: Chapman and Hall. P. 45.
Johnsen B.O., Jensen A.J. 2006. Introduction and establishment of Gyrodactylus salaris Malmberg, 1957, on Atlantic salmon, Salmo salar L., fry and parr in the River Vefsna, northern Norway // J. Fish Dis. V. 11. № 1. P. 35. https://doi.org/10.1111/j.1365-2761.1988.tb00521.x
Jorgensen E.H., Johnsen H.K. 2014. Rhytmic life of the Arctic charr: Adaptations to life at the age // Mar. Genomics. V. 14. P. 71. https://doi.org/10.1016/j.margen.2013.10.005
Knicht J.A., Anderson S., Rawle J.M. 1972. Chemical basis of the sulfo-phospho-vanillin reaction for estimating total serum lipids // Clin. Chemistry. V. 18. № 3. P. 199.
Knudsen R., Klemetsen A. 1994. Infections of Diphyllobothrium dendriticum, D. ditremum (Cestoda), and Cystidicola farionis (Nematoda) in a north Norwegian population of Arctic charr (Salvelinus alpinus) during winter // Can. J. Zool. V. 72. № 11. P. 1922. https://doi.org/10.1139/z94-261
Knudsen R., Curtis M.A., Kristoffersen R. 2004. Aggregation of helminths: the role of feeding behavior of fish hosts // J. Parasitol. V. 90. № 1. P. 1. https://doi.org/10.1645/GE-3184
Lymbery A.J., Morine M., Kanania H.G., et al. 2014. Co-invaders: The effects of alien parasites on native hosts// International Journal for Parasitology: Parasites and Wildlife. V. 3. № 2. https://doi.org/10.1016/j.ijppaw.2014.04.002
MacNeil C., Dick J.T., Elwood R.W. 1997. The trophic ecology of freshwater Gammarus spp. (Crustacea: Amphipoda): Problems and perspectives concerning the functional feeding group concept // Biol. Reviews. V. 72. № 3. P. 349. https://doi.org/10.1111/j.1469-185X.1997.tb00017.x
Markevich G.N., Esin E.V. 2019. Trout and char of Russia // Trout and char of the World. Bethesda, MD: Amer. Fish. Soc. P. 603.
Measures L., Bosse L. 1993. Gammarus lawrencianus (Amphipoda) as intermediate host of Echinorhynchus salmonis (Acanthocephala) in an estuarine environment // Can. J. Fish. Aquat. Sci. V. 50. № 10. P. 2182. https://doi.org/10.1139/f93-244
Minagawa M., Wada E. 1984. Stepwise enrichment of 15N along food chains: Further evidence and the relation between δ15N and animal age // Geochimica et Cosmochimica Acta. V. 48. № 5. P. 1135. https://doi.org/10.1016/0016-7037(84)90204-7
Nasegava K. 2020. Invasions of rainbow trout and brown trout in Japan: A comparison of invasiveness and impact on native species // Ecology of Freshwater Fish. V. 29. № 3. P. 419. https://doi.org/10.1111/eff.12534
Okamura B., Gruhl A., Bartholomew J.L. 2015. Myxozoan evolution, ecology and development. Switzerland: Springer. https://doi.org/10.1007/978-3-319-14753-6
Olden J.D., Poff N.L., Douglas M.R. et al. 2004. Ecological and evolutionary consequences of biotic homogenization // Trends in Ecology & Evolution. V. 19. № 1. P. 18. https://doi.org/10.1016/j.tree.2003.09.010
Peterson B.J., Fry B. 1987. Stable isotopes in ecosystem studies. Annual Review of Ecology // Evolution and Systematics. V. 18. № 1. P. 293. https://doi.org/10.1146/annurev.ecolsys.18.1.293
Post D.M., Layman C.A., Arrington D.A. et al. 2007. Getting to the fat of the matter: Models, methods and assumptions for dealing with lipids in stable isotope analyses // Oecologia. V. 152. № 1. P. 179. https://doi.org/10.1007/s00442-006-0630-x
Reist J.D., Pover M., Dempson B. 2013. Arctic charr (Salvelinus alpinus): a case study of the importance of understanding biodiversity and taxonomic issues in northern fishes // Biodiversity. V. 14. № 1. P. 45. https://doi.org/10.1080/14888386.2012.725338
Tveiten H., Johnsen H.K., Jobling M. 1996. Influence of the maturity status on the annual cycles of feeding and growth in Arctic charr reared at contrast temperature // J. Fish Biol. V. 48. № 5. P. 910. https://doi.org/10.1111/j.1095-8649.1996.tb01486.x
Vitousek P.M., Mooney H.A., Lubchenco J., Melillo J.M. 1997. Human domination of Earth’s ecosystems // Science. V. 277. № 5325. P. 494. https://doi.org/10.1007/978-0-387-73412-5_1
Vitule J.R.S., Freire C.A., Simberloff D. 2009. Introduction of non-native freshwater fish can certainly be bad // Fish and Fisheries. V. 10. № 1. P. 98. https://doi.org/10.1111/j.1467-2979.2008.00312.x
Wada E. 2009. Stable δ15N and δ13C isotope ratios in aquatic ecosystems // Proceedings of the Japan Academy, Ser. B. Physiol. Biol. Sci. V. 85. № 3. P. 98. https://doi.org/10.2183/pjab.85.98
Willemse J.J. 1969. The Genus Proteocephalus in the Netherlands // J. Helminthol. V. 43. № 1. P. 207. https://doi.org/10.1017/S0022149X00004041
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


