Биология внутренних вод, 2022, № 3, стр. 212-221
Морфологическая изменчивость и особенности биологии анабаса Anabas testudineus в водных объектах разного типа
К. Ю. Самойлов a, *, Чан Дык Зьен b
a Московский государственный университет им. М.В. Ломоносова
Москва, Россия
b Приморское отделение Российско-Вьетнамского Тропического научно-исследовательского
и технологического центра
Нячанг, Вьетнам
* E-mail: bioluh@mail.ru
Поступила в редакцию 17.02.2021
После доработки 17.03.2021
Принята к публикации 11.06.2021
- EDN: LAXFKM
- DOI: 10.31857/S0320965222020127
Аннотация
Исследована морфологическая изменчивость анабаса Anabas testudineus (Bloch, 1792) в трех водных объектах провинции Кханьхоа, Вьетнам: р. Кай, пруд на рисовых плантациях и пересыхающий пруд. Определен размерный, возрастной, половой состав выборок анабаса, выявлены спектры его питания. Анализ по 16 пластическим и 10 меристическим характеристикам показал отличия речных рыб по признакам, связанным с локомоцией (меньшие значения высоты спинного, анального, брюшных и грудных плавников, меньшая длина головы) и со строением челюстного аппарата (наибольшие из трех выборок длина челюстей, а также высота головы и длина рыла). Выявлен высокий уровень паратипической изменчивости вида по совокупности признаков морфологии. Наиболее обособлена выборка из пересыхающего пруда из-за обитания в неблагоприятных условиях. Установлено, что в р. Кай для анабаса важную роль играет относительно крупная пища животного происхождения. Высокая экологическая пластичность вида позволяет выживать в широком спектре условий среды, включая антропогенную нагрузку и прессинг со стороны инвазионных видов.
ВВЕДЕНИЕ
Анабас или рыба-ползун Anabas testudineus (Bloch, 1792) относится к семейству анабасовые Anabantidae и обитает преимущественно в тропической зоне Азии (So et al., 2019). Типичные места обитания вида – неглубокие водоемы со спокойной водой и обилием растительности (Thakur, Das, 1986; Binoy, Prasanth, 2016). Анабас способен существовать в широком диапазоне факторов внешней среды, таких как температура воды, количество растворенного в ней кислорода, антропогенное загрязнение (Marimuthu et al., 2009; Khatun et al., 2019). Благодаря наличию наджаберного органа при необходимости этот вид способен перемещаться по суше (Davenport, Matin, 1990). Почти по всему ареалу анабас служит объектом аквакультуры благодаря неприхотливости, способности выживать длительное время в малых объемах воды, а также высоким пищевым качествам мяса (Зворыкин, 2012; Zalina et al., 2012). Анабас широко распространен во Вьетнаме, является объектом рыболовства и аквакультуры (Kottelat, 2001; Зворыкин, 2014). Несмотря на высокое хозяйственное значение, вид остается слабо изученным, а имеющиеся данные по его биологическим особенностям порой противоречивы и нуждаются в дополнении (Bernal et al., 2015; Ramos et al., 2016; Uddin et al., 2017).
Цель работы – исследование морфологической изменчивости и биологии анабаса в водных объектах разного типа.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
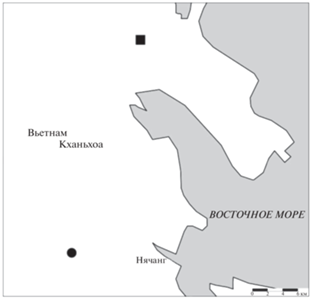
Анабаса отлавливали в провинции Кханьхоа на трех водных объектах: ПОС у г. Ниньхоа ПП в 500 м от ПОС и нижнее течение р. Кай (у г. Нячанг, ~30 км от ПОС и ПП) (рис. 1). Первый этап работ проведен в феврале–марте 2018 г., второй – в январе–феврале 2020 г. В качестве орудий лова использовали набор жаберных сетей с ячеей 20 и 30 мм, сачки и ставные ловушки. В каждом водном объекте с помощью портативного прибора TDS-3, тестов Sera Aqua Test Box и шеста-линейки оценивали параметры среды: температуру, глубину, тип донного субстрата и ряд гидрохимических свойств. Значения гидрохимических параметров представлены в табл. 1.
Таблица 1.
Значения гидрохимических показателей в исследованных водных объектах
| Водный объект | TDS, ppm | pH | GH, °dGH | KH, °dKH | NH3/N${\text{H}}_{4}^{ + }$ | N${\text{O}}_{2}^{ - }$ | N${\text{O}}_{3}^{ - }$ | P${\text{O}}_{4}^{{3 - }}$ | Fe |
|---|---|---|---|---|---|---|---|---|---|
| мг/л | |||||||||
| р. Кай | 22.0 | 6.5 | 1.0 | 1.0 | 0.0 | 0.0 | 0.0 | 0.5 | 0.5 |
| ПОС | 140.0 | 7.0 | 15.0 | 4.0 | 1.0 | 0.0 | 0.0 | 1.0 | >1.0 |
| ПП | – | 7.5 | 22.0 | 13.0 | 1.0 | 0.2 | 10.0 | 0.0 | 1.0 |
ПОС – искусственный водоем площадью ~400 м2, соединяемый при необходимости с каналами оросительной системы. Дно илистое, с большим количеством остатков водных растений. Глубина в местах отлова 0.2–1.1 м, температура воды 27–28°С. Помимо анабаса обнаружены представители следующих родов рыб: Oreochromis, Trichopodus, Trichopsis, Rasbora, Pterygoplichthys, Notopterus, Channa.
ПП располагался в ~500 м от ПОС и не имел с ним ни прямого, ни опосредованного соединения. Глубина пруда ≤20 см, площадь – ~4 м2, илистое дно, температура воды 28°С.
Водоем опоясывала зона влажного ила, что свидетельствует о прогрессировавшем процессе его осушения на момент сбора материала. Кроме анабаса (40 экз.) встречены представители родов Esomus, Oreochromis, Rasbora, Trichopodus, Trichopsis, а также три вида карповых рыб подсем. Barbinae. Наиболее многочисленными были анабас и пятнистый гурами Trichopodus trichopterus (Pallas, 1770).
Выбранный участок р. Кай расположен у г. Нячанг. Глубина в местах лова 1.5–2.5 м, скорость течения 0.3–0.7 м/с, температура воды – 25–26°С. Дно реки глинисто-песчаное, с большим количеством древесного и бытового мусора. В 2018 г. поймано 20 особей анабаса, в 2020 г. на том же участке – еще 30.
Отловленных рыб подвергали эвтаназии в растворе MS-222 и фиксировали в 6%-ном растворе формальдегида. Проводили биоанализ каждой особи: измеряли полную TL и стандартную SL длины тела, массу тела Q и массу порки q (без внутренних органов брюшной полости), визуально определяли пол и стадию зрелости гонад. Инструментальный морфометрический анализ включал измерение 18 пластических и просчет 10 меристических признаков (рис. 2, табл. 2).
Рис. 2.
Схема измерения пластических признаков анабаса. TL – полная длина тела, SL – стандартная длина тела, Uj, Lj – длины верхней и нижней челюстей соответственно, aO – предглазничное расстояние, О – продольный диаметр глаза, OP – заглазничное расстояние, C и HC – длина и высота головы соответственно, H и h – наибольшая и наименьшая высота тела соответственно, LD – длина основания спинного плавника, HD – высота четвертого колючего луча спинного плавника, LP, HP – длина основания и максимальная длина левого грудного плавника соответственно, HV – высота левого брюшного плавника, HA, LA – высота четвертого колючего луча и длина основания анального плавника соответственно.
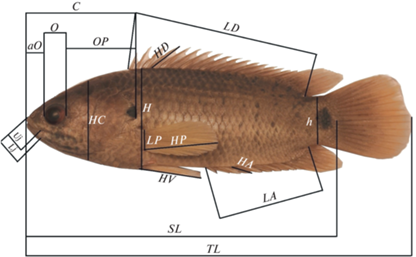
Таблица 2.
Морфометрическая характеристика половозрелых особей анабаса в исследованных водных объектах
| Признак | р. Кай (n =39) | ПОС (n = 76) | ПП (n = 39) | F | |||
|---|---|---|---|---|---|---|---|
| $\frac{{M \pm m}}{{\min - \max }}$ | Cv, % | $\frac{{M \pm m}}{{\min - \max }}$ | Cv, % | $\frac{{M \pm m}}{{\min - \max }}$ | Cv, % | ||
| TL*, мм | $\frac{{97.0 \pm 3.9}}{{62.0 - 193.0}}$ | 28.6 | $\frac{{109.3 \pm 2.1}}{{62.0 - 148}}$ | 16.8 | $\frac{{64.1 \pm 1.9}}{{42.0 - 95.0}}$ | 17.2 | 66.6 |
| SL*, мм | $\frac{{79.3 \pm 3.2}}{{51.0 - 155.0}}$ | 28.4 | $\frac{{88.7 \pm 1.7}}{{50.0 - 122.0}}$ | 16.8 | $\frac{{50.2 \pm 1.5}}{{35.0 - 76.0}}$ | 17.3 | 74.0 |
| Q*, г | $\frac{{23.0 \pm 3.6}}{{4.6 - 142.8}}$ | 110.5 | $\frac{{27.3 \pm 1.5}}{{4.6 - 62.3}}$ | 49.1 | $\frac{{4.4 \pm 0.4}}{{1.1 - 15.8}}$ | 60.8 | 27.4 |
| q*, г | $\frac{{20.7 \pm 3.3}}{{4.2 - 133.7}}$ | 113.4 | $\frac{{24.7 \pm 1.4}}{{4.3 - 57.3}}$ | 48.6 | $\frac{{3.9 \pm 0.4}}{{1.0 - 13.9}}$ | 60.7 | 26.9 |
| % C | |||||||
| aO* | $\frac{{24.8 \pm 0.2}}{{21.4 - 28.0}}$ | 7.1 | $\frac{{22.9 \pm 0.2}}{{17.9 - 27.3}}$ | 9.4 | $\frac{{23.2 \pm 0.4}}{{17.6 - 26.7}}$ | 10.0 | 10.4 |
| O* | $\frac{{21.9 \pm 0.6}}{{15.4 - 28.6}}$ | 18.9 | $\frac{{19.7 \pm 0.2}}{{15.0 - 23.1}}$ | 8.3 | $\frac{{24.2 \pm 0.5}}{{18.5 - 31.3}}$ | 13.0 | 29.1 |
| OP* | $\frac{{56.7 \pm 0.6}}{{50 - 64.5}}$ | 7.2 | $\frac{{60.6 \pm 0.3}}{{52.6 - 67.5}}$ | 4.4 | $\frac{{54.7 \pm 0.8}}{{31.8 - 61.5}}$ | 9.4 | 28.7 |
| HC* | $\frac{{83.9 \pm 0.9}}{{74.1 - 100.0}}$ | 7.2 | $\frac{{77.0 \pm 0.6}}{{64.0 - 86.8}}$ | 6.4 | $\frac{{74.1 \pm 0.5}}{{69.2 - 81.3}}$ | 4.5 | 42.8 |
| Uj* | $\frac{{34.1 \pm 0.5}}{{27.9 - 42.1}}$ | 10.0 | $\frac{{32.6 \pm 0.2}}{{28.2 - 39.3}}$ | 6.5 | $\frac{{32.4 \pm 0.4}}{{28.6 - 40.0}}$ | 8.2 | 5.4 |
| Lj* | $\frac{{39.0 \pm 0.5}}{{32.6 - 47.4}}$ | 9.9 | $\frac{{36.4 \pm 0.3}}{{29.4 - 42.1}}$ | 6.3 | $\frac{{37.6 \pm 0.4}}{{33.3 - 43.8}}$ | 7.1 | 11.0 |
| % SL | |||||||
| C* | $\frac{{33.8 \pm 0.2}}{{28.7 - 36.7}}$ | 4.6 | $\frac{{35.2 \pm 0.2}}{{31.0 - 41.5}}$ | 5.0 | $\frac{{39.7 \pm 0.3}}{{35.2 - 46.2}}$ | 5.4 | 101.3 |
| H* | $\frac{{33.1 \pm 0.3}}{{27.1 - 36.8}}$ | 6.8 | $\frac{{33.7 \pm 0.3}}{{29.0 - 40.0}}$ | 7.3 | $\frac{{31.5 \pm 0.3}}{{27.7 - 34.6}}$ | 5.7 | 15.8 |
| h | $\frac{{15.5 \pm 0.1}}{{13.6 - 18.1}}$ | 6.4 | $\frac{{15.5 \pm 0.1}}{{12.8 - 17.3}}$ | 5.9 | $\frac{{15.6 \pm 0.2}}{{13.2 - 19.2}}$ | 7.8 | 0.2 |
| HD* | $\frac{{10.3 \pm 0.2}}{{7.5 - 12.6}}$ | 12.0 | $\frac{{11.8 \pm 0.1}}{{8.6 - 14.3}}$ | 9.7 | $\frac{{11.9 \pm 0.2}}{{9.1 - 15.4}}$ | 12.0 | 22.1 |
| LD* | $\frac{{56.8 \pm 0.2}}{{54.5 - 60.7}}$ | 2.4 | $\frac{{57.5 \pm 0.2}}{{52.2 - 62.3}}$ | 3.7 | $\frac{{55.3 \pm 0.4}}{{51.1 - 63.5}}$ | 4.3 | 12.4 |
| HP* | $\frac{{22.9 \pm 0.3}}{{19.7 - 31.3}}$ | 9.2 | $\frac{{23.3 \pm 0.3}}{{18.7 - 28.3}}$ | 9.8 | $\frac{{26.6 \pm 0.4}}{{17.7 - 30.8}}$ | 9.8 | 56.2 |
| LP* | $\frac{{7.8 \pm 0.1}}{{6.3 - 9.5}}$ | 10.1 | $\frac{{7.5 \pm 0.1}}{{5.6 - 9.4}}$ | 9.5 | $\frac{{8.1 \pm 0.1}}{{5.6 - 10.3}}$ | 10.5 | 49.8 |
| HV* | $\frac{{18.4 \pm 0.2}}{{15.9 - 21.5}}$ | 7.0 | $\frac{{19.7 \pm 0.2}}{{16.7 - 22.7}}$ | 7.0 | $\frac{{21.3 \pm 0.2}}{{18.9 - 25.0}}$ | 5.8 | 48.1 |
| HA* | $\frac{{7.5 \pm 0.1}}{{5.6 - 8.9}}$ | 10.3 | $\frac{{9.4 \pm 0.1}}{{7.1 - 11.8}}$ | 10.7 | $\frac{{9.8 \pm 0.2}}{{6.4 - 13.0}}$ | 15.1 | 47.5 |
| LA* | $\frac{{35.2 \pm 0.2}}{{31.6 - 37.6}}$ | 4.7 | $\frac{{35.1 \pm 0.2}}{{30.8 - 39.0}}$ | 5.0 | $\frac{{36.5 \pm 0.4}}{{31.7 - 42.3}}$ | 6.4 | 7.8 |
| Меристические признаки | |||||||
| Ds* | $\frac{{17.1 \pm 0.1}}{{16.0 - 18.0}}$ | 3.3 | $\frac{{17.3 \pm 0.1}}{{17.0 - 18.0}}$ | 2.7 | $\frac{{17.4 \pm 0.1}}{{16.0 - 18.0}}$ | 3.7 | 4.9 |
| Dr* | $\frac{{9.6 \pm 0.1}}{{8.0 - 11.0}}$ | 6.7 | $\frac{{9.3 \pm 0.1}}{{6.0 - 10.0}}$ | 7.2 | $\frac{{8.9 \pm 0.1}}{{7.0 - 10.0}}$ | 7.2 | 10.3 |
| P* | $\frac{{14.8 \pm 0.1}}{{13.0 - 17.0}}$ | 6.2 | $\frac{{14.7 \pm 0.1}}{{13.0 - 16.0}}$ | 5.0 | $\frac{{14.4 \pm 0.1}}{{13.0 - 15.0}}$ | 4.1 | 3.9 |
| Vs | $\frac{{1.0 \pm 0.0}}{{1.0 - 1.0}}$ | 0.0 | $\frac{{1.0 \pm 0.0}}{{1.0 - 1.0}}$ | 0.0 | $\frac{{1.0 \pm 0.0}}{{1.0 - 1.0}}$ | 0.0 | – |
| Vr | $\frac{{5.0 \pm 0.0}}{{5.0 - 5.0}}$ | 0.0 | $\frac{{5.0 \pm 0.0}}{{5.0 - 5.0}}$ | 0.0 | $\frac{{4.9 \pm 0.01}}{{4.0 - 5.0}}$ | 6.4 | – |
| As | $\frac{{9.3 \pm 0.1}}{{8.0 - 10.0}}$ | 5.6 | $\frac{{9.5 \pm 0.1}}{{9.0 - 11.0}}$ | 6.1 | $\frac{{9.6 \pm 0.1}}{{8.0 - 11.0}}$ | 6.8 | 2.4 |
| Ar* | $\frac{{10.0 \pm 0.1}}{{8.0 - 11.0}}$ | 7.1 | $\frac{{9.8 \pm 0.1}}{{9.0 - 11.0}}$ | 6.7 | $\frac{{9.4 \pm 0.1}}{{8.0 - 11.0}}$ | 8.5 | 7.0 |
| CF* | $\frac{{15.9 \pm 0.1}}{{14.0 - 17.0}}$ | 3.3 | $\frac{{17.0 \pm 0.11}}{{4.0 - 18.0}}$ | 6.2 | $\frac{{16.8 \pm 0.2}}{{16.0 - 18.0}}$ | 5.9 | 18.4 |
| l.l.* | $\frac{{27.7 \pm 0.25}}{{25.0 - 31.0}}$ | 5.7 | $\frac{{27.9 \pm 0.2}}{{21.0 - 30.0}}$ | 5.9 | $\frac{{24.2 \pm 0.4}}{{19.0 - 28.0}}$ | 10.1 | 42.7 |
| vert.* | $\frac{{26.0 \pm 0.1}}{{24.0 - 28.0}}$ | 3.5 | $\frac{{26.7 \pm 0.1}}{{25.0 - 29.0}}$ | 3.2 | $\frac{{26.4 \pm 0.1}}{{25.0 - 28.0}}$ | 3.1 | 8.6 |
Примечание. M – среднее значение, m – ошибка среднего, min, max – пределы варьирования, n – количество исследованных особей, Cv – коэффициент вариации, F – значение критерия Фишера в ANOVA. Q – масса тела, q – масса порки. Ds, Dr – число колючих и мягких лучей в спинном плавнике соответственно; P – число лучей в грудном плавнике; Vs, Vr – число колючих и мягких лучей в левом брюшном плавнике соответственно; As, Ar – колючих и мягких лучей в анальном плавнике соответственно; CF – число лучей в хвостовом плавнике; l.l. – число прободенных чешуй боковой линии; vert. – количество позвонков. “*” – достоверно различающиеся признаки (p < 0.05).
Использовали, главным образом, признаки, применявшиеся другими авторами в исследованиях по морфологии анабаса (Alam et al., 2007; Hossen et al., 2017). Коэффициенты упитанности рыб рассчитывали по формулам Фультона (Kf) и Кларк (Kk):
Kf = Q × 100/SL3; Kk = q × 100/SL3,
где Q – масса тела, q – масса порки, SL – стандартная длина тела, выраженная в сантиметрах.
Для выявления спектров питания изучено содержимое 80 желудков рыб из ПОС, 20 из р. Кай и 40 из ПП. Для определения возраста использовали чешую (взятую под колючей частью спинного плавника над боковой линией), отолиты, крышечную кость и позвонки туловищного отдела позвоночника. Чешуя и отолиты были основными регистрирующими структурами (Habib, Hoque, 2015; Nargis, 2010). В работе использовали согласованные оценки возраста по всем использованным регистрирующим структурам.
Статистическую обработку результатов проводили в пакете STATISTICA 10. Нормальность распределений проверяли с помощью критерия Шапиро–Уилка. Для сравнения выборок по параметрам, распределение которых отличалось от нормального, применяли непараметрические критерии (U-Манна–Уитни, Краскела–Уоллиса). Для выявления морфологических различий трех выборок использовали дискриминантный анализ (DFA), дисперсионный анализ ANOVA и Тьюки post-hoc тест для неравных выборок. Различия считали достоверными при p < 0.05. Выборки из р. Кай за 2018 и 2020 гг. не различались достоверно по подавляющему большинству признаков, поэтому в работе использовали обобщенную выборку. Межвыборочное сравнение по морфологии проводили без разделения по полу, поскольку внешний половой диморфизм анабаса в период сбора материала оказался почти не выражен (критерий Манна–Уитни, p > 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
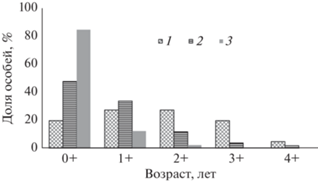
Возрастной состав выборок анабаса оказался неоднородным. В р. Кай и ПОС обнаружено по пять возрастных классов (от 0+ до 4+), в ПП – 3 (от 0+ до 2+) (рис. 3). В р. Кай и ПП преобладали сеголетки, в ПОС – двух- и трехлетки. Во всех выборках наименьшая доля приходилась на старшие возрастные классы. Наибольшие средние значения SL и q сеголеток и двухлеток отмечены у рыб из ПОС, трех-, четырех- и пятилеток – из р. Кай. Наименьшие средние размеры во всех возрастных классах отмечены для анабаса из ПП (табл. 3).
Таблица 3.
Стандартная длина тела и масса порки анабаса в разном возрасте из исследованных водных объектов
| Возраст, лет | р. Кай | ПОС | ПП | |||
|---|---|---|---|---|---|---|
| SL, мм | q, г | SL, мм | q, г | SL, мм | q, г | |
| 0+ | $\frac{{57.8 \pm 2.0}}{{41.0 - 63.0}}$ | $\frac{{6.6 \pm 0.8}}{{3.4 - 9.0}}$ | $\frac{{61.4 \pm 3.0}}{{50.0 - 67.0}}$ | $\frac{{8.1 \pm 1.0}}{{4.3 - 9.8}}$ | $\frac{{47.1 \pm 1.1}}{{35.0 - 63.0}}$ | $\frac{{3.0 \pm 0.2}}{{1.0 - 5.6}}$ |
| 1+ | $\frac{{76.9 \pm 2.9}}{{64.0 - 92.0}}$ | $\frac{{15.5 \pm 1.7}}{{8.3 - 25.0}}$ | $\frac{{82.6 \pm 1.6}}{{66.0 - 99.0}}$ | $\frac{{18.4 \pm 1.0}}{{9.7 - 27.2}}$ | $\frac{{62.0 \pm 3.8}}{{52.0 - 70.0}}$ | $\frac{{8.5 \pm 1.4}}{{5.9 - 8.1}}$ |
| 2+ | $\frac{{94.8 \pm 4.1}}{{89.0 - 97.0}}$ | $\frac{{29.5 \pm 4.0}}{{20.8 - 32.2}}$ | $\frac{{93.4 \pm 1.2}}{{83.0 - 105.0}}$ | $\frac{{26.8 \pm 1.1}}{{18.9 - 35.2}}$ | $\frac{{73.0 \pm 3.0}}{{70.0 - 76.0}}$ | $\frac{{11.6 \pm 2.35}}{{9.2 - 13.9}}$ |
| 3+ | $\frac{{124.5 \pm 13.5}}{{111.0 - 138.0}}$ | $\frac{{61.3 \pm 16.2}}{{45.1 - 77.5}}$ | $\frac{{101.9 \pm 2.3}}{{86.0 - 107.0}}$ | $\frac{{36.7 \pm 2.6}}{{22.4 - 46.0}}$ | – | – |
| 4+ | $\frac{{155.0 \pm 0.0}}{{155.0 - 155.0}}$ | $\frac{{133.7 \pm 0.0}}{{133.7 - 133.7}}$ | $\frac{{111.8 \pm 4.0}}{{101.0 - 122.0}}$ | $\frac{{45.6 \pm 4.2}}{{39.0 - 57.3}}$ | – | – |
Средние значения коэффициентов упитанности минимальны у анабаса из ПП в каждом возрастном классе и в среднем по выборке (Kf = 3.1; Kk = 2.8). У рыб из ПОС и р. Кай значения оказались сходными (табл. 4). У 51% особей из ПОС и 25% рыб из р. Кай отмечены жировые отложения на внутренних органах. У анабаса из ПП подобных отложений не обнаружено.
Таблица 4.
Коэффициенты упитанности анабаса Anabas testudineus разных возрастов из водных объектов разного типа
| Возраст | р. Кай | ПОС | ПП | |||
|---|---|---|---|---|---|---|
| Kf | Kk | Kf | Kk | Kf | Kk | |
| 0+ | 3.5 ± 0.1 | 3.2 ± 0.1 | 3.4 ± 0.1 | 3.1 ± 0.1 | 3.1 ± 0.1 | 2.8 ± 0.1 |
| 1+ | 3.6 ± 0.1 | 3.2 ± 0.1 | 3.6 ± 0.1 | 3.2 ± 0.1 | 3.5 ± 0.6 | 3.1 ± 0.5 |
| 2+ | 3.8 ± 0.1 | 3.4 ± 0.1 | 3.6 ± 0.1 | 3.3 ± 0.1 | 3.2 ± 0.4 | 2.9 ± 0.2 |
| 3+ | 3.6 ± 0.4 | 3.1 ± 0.2 | 3.8 ± 0.1 | 3.4 ± 0.1 | – | – |
| 4+ | 3.8 ± 0.0 | 3.6 ± 0.0 | 3.6 ± 0.2 | 3.3 ± 0.2 | – | – |
Половой состав и стадии зрелости гонад. Соотношение самцов и самок в выборке ПОС составило 1 : 1. Доли самцов в ПП и р. Кай достигали 62 и 54% соответственно. Гонады исследованных рыб находились на стадиях развития от II до VI (VI – только в ПОС, что говорит о недавнем нересте). В ПОС и ПП доли самцов с гонадами на разных стадиях сопоставимы (табл. 5). И самцы, и самки анабаса в р. Кай имели гонады преимущественно на II и IV стадиях зрелости. Гонады большинства самок из ПОС находились на IV, а из ПП – на II стадии зрелости.
Таблица 5.
Половой состав (%) по состоянию гонад анабаса из исследованных водных объектов (январь–февраль 2018 и 2020 гг.)
| Стадия зрелости гонад | р. Кай (n = 39) | ПОС (n = 76) | ПП (n = 38) | |||
|---|---|---|---|---|---|---|
| самки | самцы | cамки | cамцы | самки | самцы | |
| II | 41.7 | 48.1 | 10.5 | 28.9 | 60.0 | 30.4 |
| III | 0.0 | 18.5 | 15.8 | 39.5 | 20.0 | 34.8 |
| IV | 50.0 | 33.4 | 55.3 | 28.9 | 20.0 | 34.8 |
| V | 8.3 | 0.0 | 0.0 | 0.0 | 0.0 | 0.0 |
| VI | 0.0 | 0.0 | 18.4 | 2.6 | 0.0 | 0.0 |
Анабас в исследованных водных объектах достигает половой зрелости в конце первого или на втором году жизни, при достижении TL 60–80 мм. Так, среди сеголетков доля рыб с гонадами на III стадии развития была от 19% (ПОС) до 47% (ПП), а среди двухлеток – от 65% (р. Кай) до 100% (ПП).
Морфология анабаса. Морфометрическая характеристика половозрелых особей анабаса из исследуемых водных объектов представлена в табл. 2.
Три выборки анабаса достоверно различаются друг от друга (p < 0.05, df = 2) по всем признакам, кроме h, Vs, As и Vr. HSD тест Тьюки для неравных выборок показал (p < 0.05), что различия по наибольшему числу признаков обнаружены между анабасом из р. Кай и ПП. Из 26 признаков они не различаются лишь по пяти (OP, Lj, h, LP, vert.). В паре ПП–ПОС достоверные различия (p < 0.05) выявлены по 15 признакам (кроме aO, Uj, Lj, h, HD, HA, Ds, P, Cf, vert.). Наиболее схожими по признакам морфологии оказались анабасы из р. Кай и ПОС. Не выявлено достоверных различий (p < 0.05) по 11 признакам из 26: H, h, LD, HP, LP, LA, Ds, Dr, P, Ar, l.l.
Питание. Во всех выборках доли пустых желудков превышали 50%. Наибольшее разнообразие кормовых объектов зарегистрировано у анабаса из р. Кай (табл. 6): нитчатые водоросли, высшие растения, личинки насекомых, рыба и, вероятно, мелкое млекопитающее (в желудке одного анабаса найдена челюсть и трубчатая кость). В желудках рыб из ПП были только водоросли, не обнаружена пища животного происхождения. Анабас из ПОС питался высшими растениями, молодью рыб и насекомыми. Анабасы из р. Кай чаще питались рыбой, в их желудках присутствовали отолиты, крупная циклоидная и ктеноидная (предположительно принадлежавшая анабасу) чешуя.
Таблица 6.
Частота встречаемости кормовых объектов в желудках анабаса из исследованных водных объектов
| Кормовые объекты | Частота встречаемости, % | ||
|---|---|---|---|
| р. Кай (n = 20) | ПОС (n = 80) | ПП (n = 40) | |
| Пустой желудок | 73.3 | 53.8 | 50.0 |
| Водоросли | 12.5 | 0.0 | 75.0 |
| Высшие растения | 37.5 | 5.4 | 0.0 |
| Рыбы | 37.5 | 5.4 | 0.0 |
| Насекомые | 25.0 | 2.7 | 0.0 |
| Неидентифицируемые остатки, слизь | 37.5 | 86.5 | 25.0 |
| Кости наземных позвоночных | 12.5 | 0.0 | 0.0 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Взаимное расположение выбранных водных объектов и отсутствие соединения между рекой и прудами позволяет заключить, что анабас из р. Кай представляет собой обособленную популяцию от обитающих в ПП и ПОС. Из-за близкого расположения последних и их возможного соединения в сезон дождей, живущие в них анабасы, по-видимому, – части единой популяции.
Различия по гидрологии и другим параметрам среды повлияли на морфологию, размерно-возрастную и половую структуру выборок анабаса. Так, в прудах отмечена относительно высокая концентрация аммиака/ионов аммония и железа. Это может быть связано с внесением удобрений в систему рисовых чеков для возделывания риса и лотоса. Известно, что попадание удобрений (например, тиомочевины) в воду может изменять поведение анабаса и ускорять созревание гонад (Павлов и др., 2018, 2019a, 2019б). Наши наблюдения подтверждают этот факт – в ПОС отмечены самцы и самки с посленерестовыми гонадами на VI стадии зрелости, тогда как естественный нерест анабаса порционный и приурочен к сезону дождей в сентябре-декабре (Зворыкин, 2012), или с марта по май и осенью (Saha et al., 2009; Ramos et al., 2016). Судя по состоянию гонад, размножение анабаса в ПОС произошло в январе–феврале. В связи с тем, что в других выборках не обнаружили посленерестовых рыб, смещение сроков нереста в ПОС могло возникнуть именно из-за воздействия удобрений.
Разные условия обитания повлияли на темпы роста и морфологию анабаса. Средняя стандартная длина и масса анабаса р. Кай в первые два года жизни меньше, чем в ПОС, а с третьего года – наоборот. Важную роль в формировании этих различий могла сыграть скорость течения. Известно, что более крупные особи разных видов рыб способны лучше противостоять течению (Павлов, 1979; Павлов, Скоробогатов, 2014), поэтому их нагульные площади в реке могут быть значительно шире, чем у молоди. Кроме того, анабас из р. Кай достоверно отличается от прудового меньшими значениями высоты спинного, анального, брюшных и грудных плавников, а также относительно меньшей длиной головы (табл. 2). Вероятно, у рыб в р. Кай изменения пропорций тела и плавников обеспечивают более эффективную локомоцию, как это описано для ряда других видов (Brinsmead, Fox, 2002; Franssen et al., 2013).
Дискриминантный анализ по совокупности пластических и меристических признаков показал, что наибольший вклад в дискриминацию (F > 2.12; p < 0.05) внесли пропорции головы (C, O, HC, OP, aO, наибольшие собственные нагрузки векторов), а также относительная высота тела H и некоторые другие признаки (HA, CF, l.l.). При этом наиболее обособлена выборка из ПП (рис. 4). Судя по выявленным различиям в пропорциях тела между рыбами из ПП и расположенного в ~500 м ПОС, анабас обитал в ПП продолжительное время. Следовательно, особенности морфологии анабаса из ПП носят паратипический характер. Об этом говорят и признаки “затянутости”: мелкий размер рыб, относительно большие голова и глазa, прогонистое тело, низкие значения коэффициентов упитанности и отсутствие жировых отложений. Также в выборке анабаса из ПП отмечены максимальные значения коэффициентов вариации по 7 из 10 меристических и по 10 из 16 пластических признаков. Вероятно, это не только следствие прямого воздействия плохих условий на темпы роста и пропорции тела анабаса, но и проявление модификационной изменчивости, направленной на выживание вида в стрессовых условиях.
Рис. 4.
Диаграмма рассеяния канонических значений по совокупности из 16 пластических и 8 меристических признаков анабаса из водных объектов разного типа в пространстве первых двух дискриминантных функций. 1 – р. Кай, 2 – ПП, 3 – ПОС.
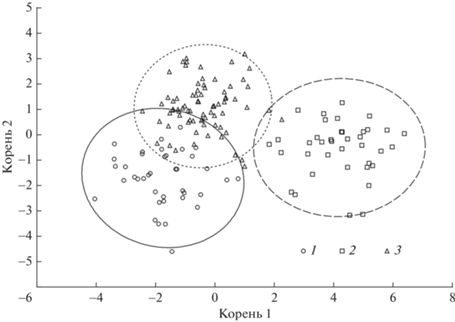
В ПП не обнаружено рыб старше двух лет. Известно, что анабас способен перемещаться между водоемами в поисках более благоприятных условий (Davenport, Matin, 1990). Возможно, более крупные особи мигрировали из пересыхающего пруда в другие водоемы, тогда как пороговые значения уровня воды и других стимулов миграции для более мелких анабасов могут быть иными.
Важный фактор, влияющий на формирование внутривидовой изменчивости морфологических характеристик и роста рыб, – кормовая база и доступность пищи (Wainwright, Richard, 1995; Дгебуадзе, 2001; Vila-Gispert et al., 2007). Растительная пища, детрит и личинки насекомых часто присутствуют в рационе анабаса в разных частях ареала, значительно реже он поедает молодь рыб; может быть выражена сезонность питания (Bhattacharjee, Chandra, 2016; Binoy, Prasanth, 2016). Всеядность способствует выживанию анабаса в сложных условиях и сосуществованию с инвазионными видами рыб (нильской тиляпией Oreochromis niloticus (Linnaeus, 1758), кольчужными сомами Pterygoplichthys spp. и т.д.) (Столбунов, Гусаков, 2015; Гусаков и др., 2018; Столбунов, Чан Дык Зьен, 2019; Столбунов и др., 2020, 2021). В выбранных нами водных объектах анабас также питался по-разному. В желудках рыб из ПП не было животной пищи, а в р. Кай частота встречаемости последней и, в частности, позвоночных, относительно высокая. Охота анабаса на относительно крупную рыбу и мелких млекопитающих представляется неправдоподобной. Более разумным объяснением может послужить питание падалью: р. Кай в местах сбора материала характеризуется сильным турбулентным течением и наличием водоворотов, где, по-видимому, концентрируются погибшие животные. В пользу этого свидетельствуют высокие средние значения длины и массы тела старшевозрастных особей из р. Кай, что может быть связано с увеличением доли животной пищи у речных рыб старше двух лет. Кроме того, у анабаса из р. Кай средние значения относительной длины челюстей (Uj, Lj), а также высоты головы (HC) и антеорбитального расстояния (aO) оказались максимальными среди исследованных выборок. Эти признаки связаны с питанием крупными объектами (Gidmark et al., 2019), что свидетельствует о высокой трофической пластичности вида.
Выводы. Выявлено, что гидрологические и гидрохимические характеристики исследованных прудов и реки повлияли на пропорции тела, размерный состав, питание и размножение анабаса. Наиболее морфологически обособленными оказались рыбы в ПП из-за продолжительного обитания в неблагоприятной среде. Из трех водных объектов наилучшие условия обитания для вида были в р. Кай. Экологическая пластичность позволила анабасу адаптироваться к жизни на течении, питанию относительно крупными объектами животного происхождения и, вероятно, падалью. Полученные результаты вносят вклад в понимание формирования внутривидовой изменчивости и биологии анабаса. Для получения более полного представления необходимо провести популяционно-генетическое исследование анабаса из водных объектов разного типа.
Список литературы
Гусаков В.А., Столбунов И.А., Чан Дык Зьен. 2018. Современное распространение кольчужных сомов (Siluriformes: Loricariidae) в Центральном Вьетнаме // Биология внутр. вод. Т. 11. № 2. С. 94.
Дгебуадзе Ю.Ю. 2001. Экологические закономерности изменчивости роста рыб. Москва: Наука.
Зворыкин Д.Д. 2014. Список рыб, населяющих внутренние водоемы Вьетнама // Экология внутренних вод Вьетнама. Москва: Товарищество науч. изданий КМК. С. 256.
Зворыкин Д.Д. 2012. Размножение и репродуктивное поведение рыбы-ползуна Anabas testudineus (Perciformes, Anabantidae) в аквариуме // Вопр. ихтиологии. Т. 52. № 4. С. 469.
Павлов Д.С. 1979. Биологические основы управления поведением рыб в потоке воды. Москва: Наука.
Павлов Д.С., Скоробогатов М.А. 2014. Миграции рыб в зарегулированных реках. Москва: Товарищество науч. изданий КМК.
Павлов Е.Д., Павлов Д.С., Ганжа Е.В. и др. 2018. Влияние тиомочевины на поведение анабаса Anabas testudineus в потоке воды // Вопр. ихтиологии. Т. 58. № 5. С. 584.
Павлов Е.Д., Ганжа Е.В., Павлов Д.С. 2019а. Влияние тиомочевины и голодания на физиолого-биохимическое состояние и репродуктивную систему анабаса Anabas testudineus // Вопр. ихтиологии. Т. 59. № 3. С. 364.
Павлов Е.Д., Звездин А.О., Павлов Д.С. 2019б. Воздействие тиомочевины на миграционную активность анабаса Anabas testudineus и потребление им корма // Вопр. ихтиологии. Т. 59. № 5. С. 606.
Столбунов И.А., Гусаков В.А. 2015. Спектр питания и особенности роста нильской тиляпии Oreochromis niloticus (Linnaeus, 1758) в нативных условиях: озера Вьетнама // Рыбное хозяйство. № 6. С. 91.
Столбунов И.А., Чан Дык Зьен. 2019. Массовые чужеродные виды в рыбном населении внутренних вод Центрального Вьетнама // Биология внутр. вод. Т. 4. № 1. С. 101.
Столбунов И.А., Чан Дык Зьен, Армбрустер Дж.В. 2020. Кольчужные сомы (Siluriformes: Loricariidae) центрального и южного Вьетнама // Биология внутр. вод. № 5. С. 502. https://doi.org/10.31857/S0320965220050125
Столбунов И.А., Гусаков В.А., Зьен Чан Дык, Тхань Нгуен Тхи Хай. 2021. Спектр питания, трофические и размерно-массовые характеристики чужеродных кольчужных сомов Pterygoplichthys spp. (Loricariidae) Вьетнама // Биология внутр. вод. № 5. С. 518. https://doi.org/10.31857/S0320965221050211
Alam M.A., Al-Minan-Noor, Rahman Khan M.M., Rahman L. 2007. Growth performance and morphological variations of local and Thai climbing perch (Anabas testudineus, Bloch) // Bangladesh J. Fish. Res. V. 11. № 2. P. 163.
Bernal R.A.D., Aya F.A., De Jesus-Ayson E.G., Garcia L.M.B. 2015. Seasonal gonad cycle of the climbing perch Anabas testudineus (Teleostei: Anabantidae) in a tropical wetland // Ichthyol. Res. V. 62. № 4. P. 389. https://doi.org/10.1007/s10228-014-0454-3
Bhattacharjee I., Chandra G. 2016. Food and feeding habits of three air-breathing fish in its natural habitat // Int. J. Fish. Aquat. Studies. V. 4. № 3. P. 586.
Binoy V.V., Prasanth P.S. 2016. Diet variation in climbing perch populations inhabiting eight different types of ecosystems // arXiv preprint arXiv:1610.03668. P. 1.
Brinsmead J., Fox M.G. 2002. Morphological variation between lake- and stream-dwelling rock bass and pumpkinseed populations // J. Fish Biol. V. 61. № 6. P. 1619. https://doi.org/10.1111/j.1095-8649.2002.tb02502.x
Davenport J., Abdul Matin A.K.M. 1990. Terrestrial locomotion in the climbing perch, Anabas testudineus (Bloch) (Anabantidea, Pisces) // J. Fish Biol. V. 37. № 1. P. 175. https://doi.org/10.1111/j.1095-8649.1990.tb05938.x
Franssen N.R., Stewart L.K., Schaefer J.F. 2013. Morphological divergence and flow-induced phenotypic plasticity in a native fish from anthropogenically altered stream habitats // Ecology and Evolution. V. 3. № 14. P. 4648. https://doi.org/10.1002/ece3.842
Gidmark N.J., Pos K., Matheson B. et al. 2019. Functional Morphology and Biomechanics of Feeding in Fishes // Feeding in Vertebrates. Evolution, Morphology, Behavior, Biomechanics. Cham: Springer. P. 297. https://doi.org/10.1007/978-3-030-13739-7_9
Habib A.S., Hoque B. 2015. Effect of age on the recruitment of oocytes in the climbing perch, Anabas testudineus (Bloch) // Bangladesh J. Zool. V. 43. № 1. P. 27. https://doi.org/10.3329/bjz.v43i1.26135
Hossen B., Sharker R., Rahman A., Hoque S. 2017. Morphometric and Meristic Variation of Indigenous and Thai Koi, Anabas testudineus Available in Coastal Region of Bangladesh // Int. J. Innov. Res. V. 2. № 1. P. 1.
Khatun D., Hossain Y., Rahman A. et al. 2019. Life-History Traits of the Climbing perch Anabas testudineus (Bloch, 1792) in a Wetland Ecosystem // Jordan J. Biol. Sci. V. 12. № 2. P. 175.
Kottelat M. 2001. Freshwater fishes of northern Vietnam. A preliminary check-list of the fishes known or expected to occur in northern Vietnam with comments on systematics and nomenclature. Washington, D.C.: The World Bank.
Marimuthu K., Arumugam J., Sandragasan D., Jegathambigai R. 2009. Studies on the fecundity of native fish climbing perch (Anabas testudineus, Bloch) in Malaysia // American-Eurasian Journal of Sustainable Agriculture. V. 3. № 3. P. 266.
Nargis A. 2010. Ageing and Growth Records of Anabas testudineus (Bloch) (Anabantidae: Perciformes) // Bangladesh J. Sci. Ind. Res. V. 45. № 3. P. 283.
Ramos G.B., Corcino R., Rivera H. et al. 2016. Some Aspects of the Reproductive Biology of Two Freshwater Fish Species, Puntius tumba and Anabas testudineus, of Lake Lanao, Philippines // Search. Proquest. Com. V. 10. № 3. P. 1.
Saha A., Kabir R.M., Ali M.M. 2009. Breeding performances of Thai Koi, Anabas testudineus (Bloch, 1792) In Different Months of The Breeding Season Under Two Sex Ratios // Bangladesh Res. Publ. J. V. 2. № 4. P. 667.
So N., Utsugi K., Shibukawa K. et al. 2019. Fishes of Cambodian Freshwater Bodies. Phnom Penh: Inland Fisheries Research and Development Institute, Fisheries Administration.
Thakur N.K., Das P. 1986. Synopsis of Biological Data on KOI, Anabas testudineus (Bloch, 1792) // CIFRI Bulletin. № 40. P. 47.
Uddin S., Hasan H., Iqbal M.M., Hossain M.A. 2017. Study on the reproductive biology of Vietnamese climbing perch (Anabas testudineus, Bloch) // Punjab University Journal of Zoology. V. 32. № 1. P. 1.
Vila-Gispert A., Fox M.G., Zamora L., Moreno-Amich R. 2007. Morphological variation in pumpkinseed Lepomis gibbosus introduced into Iberian lakes and reservoirs; adaptations to habitat type and diet? // J. Fish Biol. V. 71. № 1. P. 163. https://doi.org/10.1111/j.1095-8649.2007.01483.x
Wainwright P.C., Richard B.A. 1995. Predicting patterns of prey use from morphology of fishes // Environ. Biol. Fishes. V. 44. № 1–3. P. 97. https://doi.org/10.1007/BF00005909
Zalina I., Saad C.R., Christianus A., Harmin S.A. 2012. Induced Breeding and Embryonic Development of Climbing Perch (Anabas testudineus, Bloch) // J. Fish. and Aquat. Sci. V. 7. № 5. P. 291.https://doi.org/10.3923/jfas.2012.291.306
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод