Биология внутренних вод, 2022, № 3, стр. 222-232
Новые для флоры России виды рода Cryptomonas (Cryptophyceae)
П. В. Кулизин a, *, Н. А. Мартыненко b, Е. С. Гусев b, Д. А. Капустин b, Е. Л. Воденеева a, c, М. С. Куликовский b
a Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
b Институт физиологии растений им. К.А. Тимирязева Российской академии наук
Москва, Россия
c Нижегородский филиал “Всероссийского научно-исследовательского института рыбного хозяйства
и океанографии”
Нижний Новгород, Россия
* E-mail: KulizinPavel@yandex.ru
Поступила в редакцию 09.12.2020
После доработки 16.11.2021
Принята к публикации 05.01.2022
- EDN: MQMYXI
- DOI: 10.31857/S032096522203010X
Аннотация
Выявлены находки трех новых для альгофлоры России видов Cryptomonas loricata, C. gyropyrenoidosa и C. lundii, определенных с помощью световой микроскопии и молекулярно-генетических методов. Все виды проиллюстрированы оригинальными фотографиями. Дан обзор современного состояния систематики крупнейшего рода криптофитовых водорослей Cryptomonas. Обсуждаются проблемы идентификации видов рода, и подчеркивается необходимость применения интегративного подхода для корректной видовой идентификации.
ВВЕДЕНИЕ
Криптофитовые водоросли, или криптомонады (Cryptophyceae Fritsch), – обособленная эволюционная линия сравнительно небольших организмов, населяющих пресноводные, солоновато-водные и морские местообитания. Это преимущественно одноклеточные организмы 5–70 мкм в длину, с двумя жгутиками, с дорсовентральным строением, с бороздой и глоткой. Характерными признаками этой группы водорослей являются: эжектосомы в области глотки и в покровах клетки, трехкомпонентный перипласт, хлоропласты (1–2) в окружении четырех мембран, содержащие в перипластидном пространстве рудиментарное ядро красной водоросли (эндосимбионта) – нуклеоморф (Hoef-Emden, Archibald, 2017).
Основные фотосинтетические пигменты криптомонад – хлорофиллы а, с2, фикобилины и каротиноиды. Известно ~20 родов и >100 видов криптомонад, однако реальное разнообразие группы недооценено и гораздо выше этих оценок (Lane, Archibald, 2008; Hoef-Emden, Archibald, 2017). В частности, в последнее время описано два новых рода криптомонад (Laza-Martinez, 2012; Daugbjerg et al., 2018). Подавляющее большинство криптофит – подвижные планктонные организмы, что определяет особенности выделения клеток в культуру. Небольшие размеры у большинства видов, подвижность, плохая сохранность клеток в пробах и трудности содержания культур (требовательность к составу сред в зависимости от условий обитания, необходимость частых пересевов, неустойчивость в культуре) определяют сравнительно небольшое число видов и штаммов в коллекциях культур водорослей, даже самых крупных. Живые культуры данной группы водорослей имеются только из ограниченного числа регионов и местообитаний. Наиболее крупные коллекции пресноводных криптомонад получены при изучении водоемов Германии (Hoef-Emden, Melkonian, 2003; Hoef-Emden, 2007) и Южной Кореи (Choi et al., 2013). В систематике криптомонад для разграничения видов традиционно использовали следующие морфологические признаки: форма и размеры клетки, форма хлоропласта, количество пиреноидов, форма и строение борозды и глотки и др. (Киселев, 1954; Матвієнко, Литвиненко, 1977). Изучение ультраструктуры криптомонад с применением методов электронной микроскопии позволило выявить значительные отличия в строении и провести первые ревизии отдельных родов (Hill, Wetherbee, 1989; Hill, 1991a, 1991b). Последующая ревизия рода Cryptomonas, проведенная Hoef-Emden, Melkonian (2003) на основе изучения культур с применением молекулярно-генетических методов и параллельным исследованием морфологии клеток (световая и электронная микроскопия), выявила диморфизм у видов рода, т.е. один и тот же вид (с идентичными нуклеотидными последовательностями) может, в зависимости от стадии жизненного цикла, иметь “полигональные пластинки” (“polygonal plates”) – для него предложено название “криптоморфа” (“cryptomorph”), или цельный чехол (“irregular sheet”, “sheet-like periplast”) – “кампиломорфа” (“campylomorph”). Причeм, иногда встречались культуры, где обе формы присутствовали одновременно (“dimorphic strains”). Диморфизм криптомонад, а также то, что эти организмы имеют простую и не всегда постоянную форму клетки с небольшим количеством признаков, привели к конфликту традиционной системы, построенной только на морфологических характеристиках, с молекулярно-генетическими данными, которые выявили большое разнообразие группы (Hoef-Emden, Archibald, 2017). На мелкоклеточных представителях рода Cryptomonas показано, что часто штаммы, сходные морфологически, различаются по генетическим признакам, а организмы в пределах одного штамма и с одинаковыми нуклеотидными последовательностями генов могут иметь морфологическое строение, соответствующее различным видам по традиционной “морфологической” системе (Hoef-Emden, 2007). Есть примеры, когда кампиломорфы двух видов различны, а криптоморфы не различаются. В частности, это установлено для широко распространенных видов Cryptomonas curvata Ehrenberg emend. Hoef-Emden et Melkonian и C. pyrenoidifera Geitler emend. Hoef-Emden et Melkonian (Hoef-Emden, Melkonian, 2003). На уровне культивируемых организмов выявлены близкородственные таксоны внутри клад, неотличимые морфологически (Choi et al., 2013; Martynenko et al., 2020a). При метабаркодинговых исследованиях водоемов Европы (Boenigk et al., 2018) и оз. Байкал (Annenkova et al., 2020) также выявлено много клад некультивируемых организмов и большое разнообразие на видовом уровне внутри рода Cryptomonas. Таким образом, можно констатировать, что молекулярно-генетический подход становится единственным надежным методом идентификации криптомонад, и, в частности, видов рода Cryptomonas (Hoef-Emden, 2007).
В России специализированных исследований криптофитовых водорослей почти не проводили, большая часть информации о данной группе содержится в работах, посвященных фитопланктону. Идентификация криптомонад в таких работах вызывает большие сомнения из-за несовершенной методики сбора и фиксации проб и невозможности изучить живой материал. Недавнее исследование криптомонад с применением молекулярно-генетического подхода позволили описать новые виды рода Cryptomonas из водоемов Пермского края и Республики Коми (Martynenko et al., 2020а, 2022). Таким образом, полноценное изучение криптофитовых водорослей требует применения молекулярно-генетических методов исследований.
Цель работы – обобщить данные о находках видов рода Cryptomonas в водоемах России и дополнить список флоры страны новыми видами рода, идентифицированными с помощью молекулярно-генетических методов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Культуры криптофитовых водорослей (всего 18 штаммов), использованные в данной работе, были выделены из различных удаленных местообитаний, расположенных в Европейской части России (табл. 1). Пробы водорослей отобраны с помощью планктонной сети с размером ячеи 20 мкм.
Таблица 1.
Штаммы водорослей, выделенные в ходе исследований, и характеристика их местообитаний
| Номер штамма | Вид | Место взятия проб | Дата сбора | Темпера-тура, °С | pH | Электро- проводность, мкСм/см |
Координаты места сбора, c.ш., в.д. |
|---|---|---|---|---|---|---|---|
| NN2, NN6, NN10, NN12, NN20 | Cryptomonas lundii | Республика Мордовия, мочажина у оз. Инорки | 08.08.2017 | 19.5 | 6.44 | – | 54°33.398′, 43°51.193′ |
| NN9 | C. lundii | Республика Мордовия, оз. Пичерки, в зарослях урути | 10.08.2017 | 24 | 7.18 | – | 54°44.573′, 43°47.367′ |
| NN19 | C. lundii | Республика Мордовия, оз. Большая Вальза, выжимка из пузырчатки | 09.08.2017 | 22.6 | 6.85 | – | 54°42.498′, 43°11.678′ |
| R179 | C. lundii | Владимирская обл., Национальный парк “Мещера”, болотный водоем | 21.10.2016 | 4.2 | 6.3 | 42 | 55°35.077′, 40°26.485′ |
| NN27, NN28, NN30, NN32, NN33, NN34, NN35 | C. gyropyrenoidosa | Нижегородская обл., р. Вьюница | 19.08.2017 | 22 | 7.13 | 341 | 56°15.552′, 43°44.387′ |
| M230 | C. gyropyrenoidosa | г. Москва, Главный ботанический сад РАН, пруд | 08.07.2019 | 18.4 | 8.53 | 306 | 55°50.584′, 37°35.393′ |
| 5F, 9С | C. loricata | Мурманская обл., природный заповедник “Пасвик”, сфагновое болото на берегу р. Паз | 19.06.2019 | – | – | – | 69°23.489′, 29°45.388′ |
Регионы исследований. Семь штаммов выделены из озер Мордовского государственного природного заповедника (МГПЗ). Эта охраняемая территория занимает >40 тыс. га лесного массива и считается заповедником большого водоохранного значения. Территория заповедника расположена на лесистом правобережье р. Мокшa, площадь водосбора которой до границы заповедника 15800 км2. Водная сеть заповедника представлена малыми реками (Пуштой, Большой и Малой Черной, Аргой) и ручьями (Шавецом, Ворскляем, Нулуем) – притоками р. Мокша. Бóльшая часть территории заповедника входит в водосбор р. Пушта, впадающей в р. Сатис на границе заповедника. Наибольшая степень озерности характерна для юго-западной части заповедника. Культуры криптомонад выделены из пойменных озер Инорки, Пичерки и Большая Вальза. Наибольшая площадь (28 га) у оз. Инорки, оно более остальных вытянуто в длину (4.3 км) с более широкими (>100 м) плесами и достаточно большими глубинами (максимальная 10 м). Площадь других озер заметно меньше, максимальная ширина плеса этих озер колеблется в пределах 80 м, в его средней части находятся котловины глубиной 6.0–7.5 м. Оно наиболее удалено от современного русла р. Мокша. Озеро Пичерки, расположенное вдоль р. Пушта, представляет собой расширенный участок русла этой реки. В настоящее время сама река приобретает вид коротких протоков, соединяющих между собой цепь озер Кочеулово, Таратино, Каретное, Пичерки. Эти протоки узкие, неглубокие, сильно заросшие, местами труднопроходимые от обилия коряг, естественных плотин, образовавшихся из упавших в воду деревьев прилегающего леса. Весной все группы озер обычно сливаются в один огромный водоем, затопляющий леса и луга прилегающего пространства поймы. Только в годы очень низких паводков наблюдается объединение лишь части озер (Широкова, 2015; Широкова и др., 2015).
Один штамм (R179) получен из болотного водоема Национального парка “Мещера”, расположенного на территории Владимирской и Рязанской областей в пределах Мещерской низменности. Территория парка относится к бассейну р. Ока. Основные реки – Бужа и еe левый приток Поль. В питании рек значительную роль играют болота.
Семь штаммов выделены из малой р. Вьюница (притока второго порядка р. Ока) в Нижегородской обл. Длина реки 10 км, площадь водосборного бассейна 74.8 км2, протекает по окраине г. Нижний Новгород. Исток реки находится в болотной местности к северо-западу от пос. Горбатовка (Ресурсы…, 1966). Река имеет три искусственных прудовых расширения с замедленным течением.
Одна культура (M230) получена из пруда, расположенного у главного входа в Главный ботанический сад им. Н.В. Цицина Российской академии наук РАН. Пруд находится на особо охраняемой природной территории федерального значения, в Северо-Восточном административном округе г. Москва. Его берега укреплены бетонными плитами, в теплый период акваторию заселяют водоплавающие птицы (утки, огари, лебеди). Диаметр пруда ~200 м. В мелководной зоне произрастают роголистник и рогоз.
Два штамма рода Cryptomonas (5F и 9C) выделены из сфагнового болота на берегу р. Паз на территории Государственного природного заповедника “Пасвик” площадью 146.8 км2. Заповедник расположен в Печенгском районе Мурманской обл. между российско-норвежской государственной границей и линией инженерно-технических сооружений, простирается узкой полосой по правому берегу р. Паз от Хевoскоски ГЭС на юге до оз. Сальмиярви на севере. Река Паз общей длиной 147 км берет начало из оз. Инари в Финляндии, протекает по территории России и впадает в Баренцево море в Норвегии. Река представляет собой озерно-речную систему, поскольку имеет много крупных заливов и расширений русла (озера Хеюхенъярви, Боссояврре и др.), соединенных протоками. В 1950–1978 гг. на крупных порогах р. Паз построено пять российских (вне заповедника) и две норвежских ГЭС (в границах заповедника), после чего озера превратились в водохранилища (Боровичев, Бойчук, 2018).
Выделение в культуру и изучение морфологии клеток. Клетки изолировали с помощью микропипетки и культивировали на среде WC (Andersen еt al., 2005). Для исследований под световым микроскопом живые клетки обездвиживали путем погружения в агарозу с низкой температурой гелеобразования и изучали с помощью дифференциального интерференционного контраста (ДИК) с масляным иммерсионным объективом (Plan-Apochromat 100x/1.4 Oil DIC M27; микроскоп Zeiss AxioScope A1). Исследовали форму и размеры клеток, расположение борозды и глотки, хлоропласты (≥25 клеток). Для описания использовали номенклатуру в работе (Hoef-Emden, Melkonian, 2003). Световые микрофотографии получены с помощью камеры AxioCam ERc 5s Rev.2.
После первоначальной идентификации на основе ITS2 рДНК количество штаммов для анализа сокращали за счет удаления дублирующих штаммов, выделенных из одного местообитания.
Выделение и амплификация ДНК. ДНК выделяли из моноклональных штаммов с помощью раствора для выделения ДНК InstaGene фирмы BioRad (USA), согласно методике производителя. Амплификацию фрагментов рибосомального оперона (18S, 28S и ITS2 рДНК), а также хлоропластного гена psbA проводили с помощью ПЦР. Реакционную смесь для проведения ПЦР подготавливали с помощью готовой смеси реактивов ScreenMix (“Евроген”, Россия). Для амплификации фрагмента ядерного гена малой рибосомальной субъединицы рДНК (18S, 1533 н.) использовали следующие праймеры: 18S_CrN1F, 18S_826F, 18S_956R, 18S_BRK. Фрагмент гена большой субъединицы рДНК (28S, 946 н.) амплифицировали с помощью праймеров crLSU_29F и crLSU_942R, рибосомальный межгенный спейсер ITS2 (353–419 н.) – с помощью crITS_03F и crITS_05R (Choi et al., 2013). Амплификацию регионов рибосомального кластера проводили при следующих условиях: начальная денатурация – 5 мин при 95°C, далее 35 циклов денатурации при 94°C (30 с), отжига праймеров при 52°C (30 с), элонгации при 72°C (50–80 с) и финальной элонгации при 72°C (10 мин). Фрагмент хлоропластного гена psbA амплифицировали с помощью праймеров psbAF и psbAR (Choi et al., 2013) при аналогичных условиях ПЦР, за исключением температуры отжига праймеров (50°C). Контроль результатов ПЦР осуществляли путем горизонтального электрофореза продуктов ПЦР в 1.5%-ном агарозном геле в 1.5× ТАЕ буфере (Tris-acetate-EDTA), окрашивания SYBR Safe (“Bio-Rad”, USA) и фотографирования в проходящем ультрафиолетовом свете в системе гель-документации GelDoc XR (“Bio-Rad”, USA). Очистку фрагментов ДНК подготавливали с помощью ExoSAP-ITkit (Affymetrix, SantaClara, CA, USA) согласно протоколу производителя. Для реакции секвенирования применяли набор BigDye® Terminator v3.1 Cycle Sequencing Kit (“Applied Biosystems”, USA), в качестве праймеров использовали сначала прямую, затем обратную последовательности, указанные для ПЦР. Продукты реакции секвенирования очищали от непрореагировавших меченых нуклеотидов с помощью набора BigDye® XTerminator TM Purification Kit (“Applied Biosystems”, USA). Нуклеотидные последовательности определяли методом Сэнжера с двух сторон нуклеотидной последовательности при помощи прямого и обратного праймеров, указанных для ПЦР с последующим электрофорезом с использованием секвенатора Genetic Analyzer 3500 (“Applied Biosystems”, USA).
Построение деревьев. Полученные последовательности проверяли вручную и собирали в программах BioEdit v. 7.1.3 и MegaX (Kumar et al., 2018). Для выравнивания добавляли из базы данных GenBank 39 последовательностей рода Cryptomonas из различных морфологических групп. Два вида (Rhodomonas sp. штамм M1480 и Chroomonas sp. штамм SAG 980-1) добавляли в массив данных в качестве внешней группы. Последовательности выравнивали в программе MAFFTv 7 с использованием модели E-INS-i (Katoh, Toh, 2010), сложные для выравнивания регионы исключали из массива данных. Для выявления филогенетических связей среди криптомонад нами построено филогенетическое дерево, содержащее последовательно все три консервативных гена у 47 штаммов: 18S+28S рДНК + psbA хпДНК. Также построено филогенетическое дерево на основании анализа ядерного межгенного транскрибируемого спейсера 2 (ITS2 рДНК) у 45 штаммов рода Cryptomonas. Трудно выравниваемые фрагменты спейсера исключали из анализа. Филогенетический анализ методом максимального правдоподобия (ML) осуществляли в программе MEGA X, используя 1000 бутстреп-реплик, а также с помощью Байесовского подхода (BI) в программе MrBayes 3.1.2 (Ronquist, Huelsenbeck, 2003). При BI-анализе создавали 1 млн генераций цепей Маркова, отбирая пробы каждые 100 генераций. Первые 25% проб (до выхода значений -lnL на плато) исключали из анализа как “burn-in”.
Подбор модели эволюции для нуклеотидных последовательностей проводили в программе MEGAX с использованием двух критериев: информационного критерия Акаике (Akaike information criterion, AIC; Akaike, 1974) и байесовского информационного критерия (Bayesian information criterion, BIC; Schwarz, 1978). Для визуализации и редактирования деревьев использовали программы FigTree (ver 1.4.2) и Adobe Photoshop CC (19.0).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
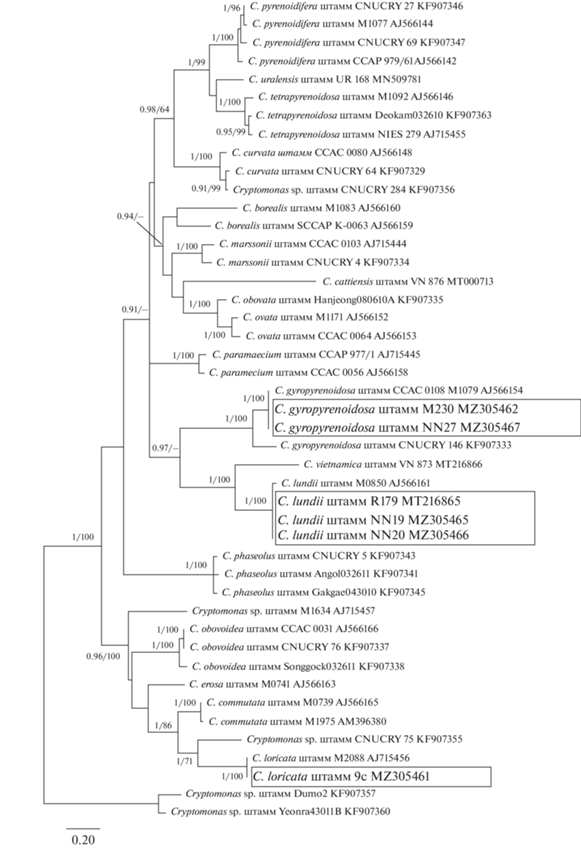
При изучении культур, выделенных из водоемов трех охраняемых природных территорий и водных объектов г. Москва, обнаружены три новых для флоры России вида: Cryptomonas loricata Chodat emend. Hoef-Emden, C. gyropyrenoidosa Hoef-Emden et Melkonian и C. lundii Hoef-Emden et Melkonian (рис. 1). Идентификация проводилась на основе ядерных молекулярных маркеров 18S рДНК, 28S рДНК, ITS2 рДНК и фрагмента хлоропластного гена psbA. На филогенетических деревьях, построенных на основании консервативных маркеров 18S рДНК, 28S рДНК и psbA (рис. 2) и изменчивого участка ITS2 рДНК (рис. 3), штаммы R179, NN19, NN20 группировались в одну кладу с типовым штаммом M0850 C. lundii. Штаммы M230 и NN27 кластеризовались вместе с типовым штаммом M1079 C. gyropyrenoidosa, штамм 9C объединялся с референтной культурой M2088 C. loricata. Ниже приведены морфологическое описание новых для флоры России видов рода Cryptomonas и данные об их распространении.
Рис. 1.
Световые микрофотографии новых для альгофлоры России видов рода Cryptomonas: а–в – C. gyropyrenoidosa, г–е – C. loricata, ж–и – C. lundii. a, б, г, ж, з – вид с вентральной стороны, в, и – сбоку, д, е – с дорсальной стороны.
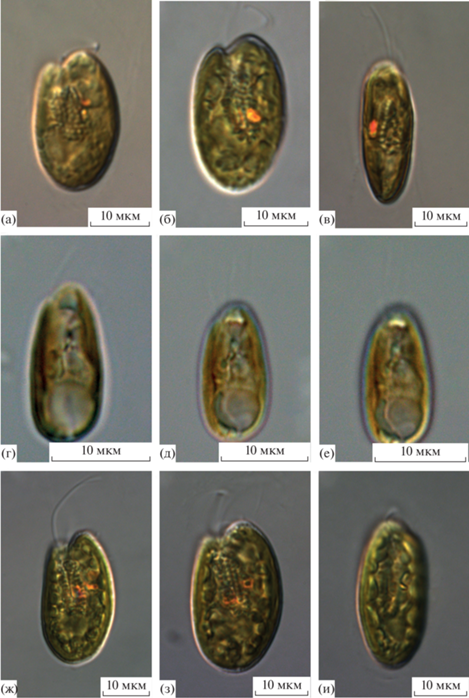
Рис. 2.
Дерево, отображающее филогенетические связи 45 представителей рода Cryptomonas. Роды Rhodomonas и Chroomonas выбраны в качестве внешней группы. Дерево построено на основании сравнения нуклеотидных последовательностей консервативных маркеров: фрагменты генов малой и большой рибосомальных субъединиц ядерной ДНК (18S и 28S рДНК) и фрагмента гена psbA хпДНК с помощью Байесовского подхода (BI) и методом максимального правдоподобия (ML). В узлах Байесовская апостериорная вероятность (слева) и величина бутстрепа ML (справа).
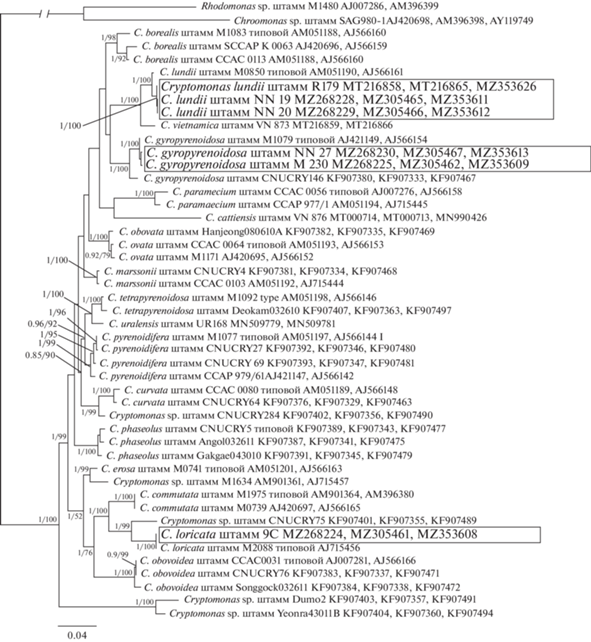
Рис. 3.
Дерево, отображающее филогенетические связи 45 представителей рода Cryptomonas, построенное на основании анализа межгенного транскрибируемого спейсера ITS2 рДНК с помощью Байесовского подхода (BI) и методом максимального правдоподобия (ML). В узлах Байесовская апостериорная вероятность (слева) и величина бутстрепа ML (справа).
Cryptomonas gyropyrenoidosa Hoef-Emden et Melkonian 2003 (рис. 1а–1в).
Клетки уплощенные, с вентральной стороны эллиптические или широко эллиптические, с небольшим выростом (носиком) в правой части апекса, в антапикальной части закругленные. При виде сбоку клетки двояковыпуклые, со скошенной вершиной со стороны вентральной части и закругленным антапексом. Хлоропласт один, закрученный вправо при виде сверху, с четырьмя пиреноидами, антериальная пара в правой и левой частях клетки, в задней части клетки пиреноиды расположены с брюшной и спинной сторон. Размеры клеток: длина 22.1–28.0 мкм, ширина 13.6–17.5 мкм, толщина 9.5–11.0 мкм.
Распространение: Германия (Hoef-Emden, Melkonian, 2003), Россия.
Cryptomonas loricata Chodat 1922 emend. Hoef-Emden 2007 (рис. 1г–1е).
Клетки удлиненно-эллипсоидные, почти круглые в поперечном сечении, с округлыми апикальным и антапикальным концами. Хлоропласт один, двулопастный с одним или двумя пиреноидами, расположенными на перемычке между лопастями. Размеры клеток: длина 16.3–16.6 мкм, ширина 8.3–8.6 мкм, толщина 7.5 мкм.
Распространение: Швейцария (Chodat, 1922), Германия (Hoef-Emden, 2007), Россия.
Cryptomonas lundii Hoef-Emden et Melkonian 2003 (рис. 1ж–1и).
Клетки уплощенные, без пиреноидов, с вентральной стороны эллиптические до яйцевидных, со скошенным влево апексом, с небольшим выростом (носиком) в правой части апекса, в антапикальной части закругленные или немного скошенные. При виде сбоку клетки двояковыпуклые, со скошенной вершиной со стороны вентральной части и закругленным антапексом. Хлоропласт один, состоит из двух соединенных частей, занимающих периферийные области с правой и левой сторон клетки, при виде сверху закручен вправо в задней части клетки. Размеры клеток: длина 24.3–29.4 мкм, ширина 13.3–17.1 мкм, толщина 9.9–12.1 мкм.
Распространение: Великобритания (Lund, 1942), Германия (Hoef-Emden, Melkonian, 2003), Россия (Gusev et al., 2020, настоящая статья).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
За время изучения рода Cryptomonas описано >100 видов, однако морские и солоновато-водные, таксоны, а также часть пресноводных переведены в другие роды, в итоге к настоящему времени известно ~70 валидно описанных таксонов рода Cryptomonas (Hoef-Emden, Melkonian, 2003) Последние ревизии рода Cryptomonas, проведенные на основе изучения штаммов, выделенных преимущественно из водоемов Европы, позволили дополнить диагнозы (а, по сути, переописать) 12 видов рода: C. borealis Skuja emend. Hoef-Emden et Melkonian, C. commutata (Pascher) Hoef-Emden, C. curvata Ehrenberg emend. Hoef-Emden et Melkonian, C. erosa Ehrenberg emend. Hoef-Emden, C. marssonii Skuja emend. Hoef-Emden et Melkonian, C. loricata Chodat emend. Hoef-Emden, C. obovoidea Pascher emend. Hoef-Emden, C. ovata Ehrenberg emend. Hoef-Emden et Melkonian, C. paramaecium (Ehrenberg) Hoef-Emden et Melkonian, C. phaseolus Skuja emend. Hoef-Emden, C. pyrenoidifera Geitler emend. Hoef-Emden et Melkonian, C. tetrapyrenoidosa Skuja emend. Hoef-Emden et Melkonian (Hoef-Emden, Melkonian, 2003, Hoef-Emden, 2007). В этих работах в синонимы к роду Cryptomonas сведены роды Chilomonas Ehrenberg, Campylomonas Hill, Pseudocryptomonas Bicudo et Tell – всего 24 таксона видового и внутривидового ранга рода Cryptomonas, также описано два новых для науки вида C. gyropyrenoidosa Hoef-Emden et Melkonian и C. lundii Hoef-Emden et Melkonian. Изучение водоемов Республики Коми и Урала добавило в этот список еще три новых для науки вида (Martynenko et al., 2020a, 2022), а исследование тропической Азии – два таксона из Вьетнама (Martynenko et al., 2020b, Gusev et al., 2020) и один из Индии (Gusev et al., 2021). Не подверглись ревизии еще >30 известных таксонов рода Cryptomonas. Как справедливо отмечают Hoef-Emden, Melkonian (2003), подход, при котором эпитипом выбирают штамм, сходный по морфологии со сделанным ранее описанием, довольно субъективен из-за установленной изменчивости криптомонад. Однако просто “забыть” описанные ранее организмы и начать описывать новые на основе новых методических подходов тоже достаточно сомнительный выход, поскольку оставит без внимания и ревизии десятки уже описанных видов. Эта ситуация осложняет ревизию рода Cryptomonas и анализ флоры различных регионов.
В России ранее было отмечено 32 вида рода Cryptomonas (Киселев, 1954; Бондаренко, Щур, 2008; Науменко, 2014; Корнева, 2015; Martynenko et al., 2020a, 2022), из них два вида, описанные из соленых водоемов Крыма (Cryptomonas salina Wisłouch и C. stigmatica Wisłouch), переведены в род Rhodomonas (Hill, Wetherbee, 1989; Hill, 1991b). Оставшиеся таксоны можно разделить на три группы. Первую группу представляют девять видов (Cryptomonas borealis, C. curvata, C. erosa, C. marssonii, C. obovoidea, C. ovata, C. phaseolus, C. pyrenoidifera, C. paramaecium (как Chilomonas paramaecium Ehrenberg), вошедшие в последнюю ревизию рода Cryptomonas (Hoef-Emden, Melkonian, 2003; Hoef-Emden, 2007), однако их находки на территории России не подтверждены молекулярно-генетическими данными. Вторая группа – виды, сведенные в синонимы при последней ревизии рода: Cryptomonas lucens Skuja (=C. obovoidea), C. ozolinii Skuja (=C. pyrenoidifera), C. reflexa Skuja (=C. curvata). Третья группа – 15 таксонов, которые не подверглись ревизии, и для большинства из них отсутствуют культуры и молекулярно-генетические данные: Cryptomonas brevis Schiller, C. caudata Schiller, C. compressa Pascher, C. cylindrica Ehrenberg, C. czosnowskii Kisselev, C. gracilis Skuja, C. incurva Matvienko, C. lobata Korshikov, C. nasuta Pasher, C. obovata Skuja, C. parapyrenoidifera Skuja, C. platyuris Skuja, C. rufescens Skuja, C. spinifera Ettl, C. woloszynskae Czosnowski. Таким образом, ревизия разнообразия рода Cryptomonas (как и других родов криптомонад) России требует применения молекулярно-генетических методов для подтверждения ранее сделанных находок. Для этого необходимо выделение и изучение культур данной группы или применение метабаркодинга – подхода, при котором секвенируется тотальная ДНК образца воды и затем проводится идентификация полученных коротких нуклеотидных последовательностей по выбранному маркерному региону ДНК на основе сравнения с базами данных. При этом необходима дополнительная работа по ревизии уже описанных ранее таксонов и выявлению новых видов криптомонад.
В настоящей работе приведены данные о трех новых для флоры России видов из рода Cryptomonas.
Cryptomonas loricata описан из оз. Шампекс (Швейцария), где он обитал среди сфагнума (Chodat, 1922). Автор отмечал сходство этого вида с C. nasuta Pascher, от которого он отличается неравными жгутиками, формой апикального конца клетки, а также слегка перетянутой оболочкой в задней части клетки (Chodat, 1922). Справедливо считая C. loricata весьма неполно описанным видом, И.А. Киселев (1954) не включил его в свой определитель, а лишь упомянул в примечании к C. nasuta. К. Хоеф-Эмден (Hoef-Emden, 2007) существенно дополнила диагноз вида, предложила эпитип и молекулярную подпись. Она отмечала, что наличие перетяжки в оболочке не может служить надежным таксономическим признаком, поскольку такие перетяжки иногда встречаются и у других видов Cryptomonas в культуре (Hoef-Emden, 2007). Размеры, которые приводит Хоеф-Эмден для этого вида (длина 16–20 мкм, ширина 9 мкм, толщина 8.3 мкм), сопоставимы с размерами нашего штамма.
В России Cryptomonas loricata найден в сфагновом болоте на берегу р. Паз на территории природного заповедника “Пасвик” (Мурманская обл.). В пробе вместе с C. loricata массового развития достигала золотистая водоросль Chrysastrella paradoxa Chodat. Есть все основания полагать, что Cryptomonas loricata – довольно обычный вид в сфагновых болотах, который из-за неполного описания неверно определяли, а значит, ареал его может быть существенно шире.
Находки C. lundii и C. gyropyrenoidosa – первые после первоописаний из Германии.
Вид, морфологически сходный с C. lundii, под названием Cryptomonas “B” ранее проиллюстрирован Дж. Ландом (Lund, 1942) из пруда в Ричмонд парке (Великобритания). Типовой штамм этого вида выделен из пруда в г. Кeльн (Hoef-Emden, Melkonian, 2003). Авторы приводят следующие размеры: длина 19–30 мкм, ширина 12–16 мкм, толщина 11–15 мкм. В России вид впервые отмечен в Национальном парке Мещера (Gusev et al., 2020), в настоящей работе нами представлены новые данные по его распространению в водоемах Мордовского государственного природного заповедника. Размеры клеток штаммов из России соответствуют указанным выше.
Cryptomonas gyropyrenoidosa описан и до настоящего времени зарегистрирован только в трех водоемах в окрестностях г. Кельн, Германия (Hoef-Emden, Melkonian, 2003). Интересный и пока уникальный для этого вида признак – расположение пиреноидов в разных плоскостях, перпендикулярных друг к другу. У трех других видов, имеющих четыре пиреноида (C. tetrapyrenoidosa Skuja emend. Hoef-Emden et Melkonian, C. parapyrenoidifera Skuja и C. uralensis Martynenko, Gusev, Kulizin et Guseva), эти структуры расположены в одной плоскости по бокам клетки (Hoef-Emden, Melkonian, 2003; Martynenko et al., 2020а). Также характерным для этого вида является рассеченный закрученный хлоропласт, присущий лишь для очень ограниченного числа таксонов рода. В России C. gyropyrenoidosa обнаружен в р. Вьюница (Нижегородская обл.) и пруду Государственного ботанического сада РАН (г. Москва). Размеры клеток наших штаммов сопоставимы с приведенными в работе (Hoef-Emden, Melkonian, 2003): длина 19–27 мкм, ширина 12–17 мкм, толщина 10–14 мкм.
Основываясь на находках C. lundii и C. gyropyrenoidosa в достаточно удаленных друг от друга местообитаниях, можно предположить, что они имеют широкий ареал в умеренной зоне. Этот вывод подтверждают разные температурные условия и рН среды, при которых они обнаружены. Следует отметить, что молекулярно-генетические данные свидетельствуют о наличии у этих видов близкородственных таксонов из других регионов (рис. 2, рис. 3). В частности, из Вьетнама недавно описан Cryptomonas vietnamica Gusev, Podunay, Martynenko, Shkurina et M. Kulikovskiy, объединяющийся в одну кладу с C. lundii (Gusev et al., 2020), из Южной Кореи известен штамм из клады C. gyropyrenoidosa, по-видимому, представляющий новый для науки вид (Choi et al., 2013). Cryptomonas loricata, считается довольно обычным видом, однако из-за неполного описания он не включен в отечественные определители. Вероятно, ранее его могли регистрировать в сфагновых болотах России, но под другим названием, либо оставлять неидентифицированным. Следует отметить, что два из трех новых для флоры России видов описаны из бассейна Средней Волги – ее левобережных и правобережных притоков. Ранее в этом малоисследованном с использованием современных подходов регионе изучена флора чешуйчатых золотистых водорослей, выявлены новые для флоры России и редкие виды (Gusev, 2013; Gusev et al., 2019; Kulizin et al., 2021). Регион включает большое число заболоченных территорий, малых озер и рек, которые требуют дальнейшего изучения (Кулизин и др., 2021).
Выводы. С учетом литературных данных и наших новых находок, в водоемах России отмечено 33 вида рода Cryptomonas. Лишь незначительная часть находок подтверждена молекулярно-генетическими методами. У половины зарегистрированных в России видов рода Cryptomonas не проведена современная таксономическая ревизия. Корректная идентификация криптофитовых водорослей при традиционных гидробиологических и альгофлористических исследованиях невозможна, поскольку необходимо применение интегративного подхода, включающего, помимо изучения морфологии, молекулярно-генетические методы изучения.
Список литературы
Бондаренко Н.А., Щур Л.А. 2008. Cryptophyta водоемов и водотоков Восточной Сибири (Россия) // Альгология. Т. 18(4). С. 408.
Боровичев Е.А., Бойчук М.А. 2018. Мохообразные заповедника “Пасвик”. Петрозаводск: Карельск. науч. центр РАН.
Киселев И.А. 1954. Пирофитовые водоросли // Определитель пресноводных водорослей СССР. Вып. 6.
Корнева Л.Г. 2015. Фитопланктон водохранилищ бассейна Волги. Кострома: Костромской дом печати.
Кулизин П.В., Воденеева Е.Л., Охапкин А.Г. 2021. Фитопланктон некоторых рек юга подзоны хвойно-широколиственных лесов бассейна Средней Волги в многолетнем аспекте // Самар. науч. вестн. Т. 10. № 2. С. 45. https://doi.org/10.17816/snv2021102106
Матвієнко О.М., Литвиненко Р.М. 1977. Пірофітові водорості – Pyrrophyta // Визначник прісноводних водоростей Української РСР. Т. 3. Ч. 2. Киев: Наукова думка.
Науменко Ю.В. 2014. Криптофитовые водоросли в водотоках и водоемах Западной Сибири // Растительный мир Азиатской России. № 1(13). С. 3.
Ресурсы поверхностных вод СССР: гидрографическая изученность. Т. 10. Верхне-Волжский район. 1966. Ленинград: Гидрометеоиздат.
Широкова В.И. 2015. Материалы к гидробиологии водоемов Мордовского государственного заповедника // Труды МГПЗ им. П.Г. Смидовича. Вып. 13. С. 300.
Широкова В.И., Чубинская К.М., Орехова К.Т. и др. 2015. Физико-химические условия водоемов Мордовского государственного заповедника // Труды МГПЗ им. П.Г. Смидовича. Вып. 13. С. 233.
Akaike H. 1974. A new look at the statistical model identification // IEEE transactions on automatic control. V. 19(6). P. 716. https://doi.org/10.1109/TAC.1974.1100705
Andersen R.A., Berges J.A., Harrison P.J., Watanabe M.M. 2005. Recipes for freshwater and seawater media // Algal culturing techniques. Oxford; New York, USA: Elsevier Academic Press.
Annenkova N.V., Giner C.R., Logares R. 2020. Tracing the Origin of Planktonic Protists in an Ancient Lake // Microorganisms. V. 8. P. 543. https://doi.org/10.3390/microorganisms8040543
Boenigk J., Wodniok S., Bock C. et al. 2018. Geographic distance and mountain range’s structure freshwater protist communities on a European scale // Metabarcoding and Metagenomics. V. 2. e21519. https://doi.org/10.3897/mbmg.2.21519
Chodat R. 1922. Matériaux pour l’histoire des Algues de la Suisse // Bulletin de la Société Botanique de Genève. V. 13. P. 66.
Choi B., Son M., Kim J.I., Shin W. 2013. Taxonomy and phylogeny of the genus Cryptomonas (Cryptophyceae, Cryptophyta) from Korea // Algae. V. 28. № 4. P. 307. https://doi.org/10.4490/algae.2013.28.4.307
Daugbjerg N., Norlin A., Lovejoy C. 2018. Baffinella frigidus gen. et sp. nov. (Baffinellaceae fam. nov., Cryptophyceae) from Baffin Bay: Morphology, pigment profile, phylogeny, and growth rate response to three abiotic factors // J. Phycol. V. 54. № 5. P. 665. https://doi.org/10.1111/jpy.12766
Gusev E.S. 2013. Silica-scaled chrysophytes from karst lakes in Central Russia // Nova Hedwigia. Beih. V. 142. P. 17.
Gusev E.S., Perminova O.S., Guseva E.E., Startseva N.A. 2019. The genus Mallomonas in small urban rivers in Nizhniy Novgorod (Russia) // Nova Hedwigia. Beih. V. 148. P. 77.
Gusev E., Podunay Y., Martynenko N. et al. 2020. Taxonomic studies of Cryptomonas lundii clade (Cryptophyta: Cryptophyceae) with description of a new species from Vietnam // Fottea, Olomouc. V. 20(2). P. 137. https://doi.org/10.5507/fot.2020.004
Gusev E., Karthick B., Martynenko N. et al. 2021. Cryptomonas indica sp. nov. (Cryptophyceae: Cryptomonadales), a new species described from the Western Ghats, India // Phytotaxa. V. 518. P. 261. https://doi.org/10.11646/phytotaxa.518.4.3
Hill D.R.A. 1991a. Chroomonas and other blue-green cryptomonads // J. Phycol. V. 27. P. 133. https://doi.org/10.1111/j.0022-3646.1991.00133.x
Hill D.R.A. 1991b. A revised circumscription of Cryptomonas (Cryptophyceae) based on examination of Australian strain // Phycologia. V. 30. P. 170. https://doi.org/10.2216/i0031-8884-30-2-170.1
Hill D.R.A., Wetherbee R. 1989. A reappraisal of the genus Rhodomonas (Cryptophyceae) // Phycologia. V. 28. P. 143. https://doi.org/10.2216/i0031-8884-28-2-143.1
Hoef-Emden K. 2007. Revision of the genus Cryptomonas (Cryptophyceae) II: Incongruences between classical morphospecies concept and molecular phylogeny in smaller pyrenoid-less cells // Phycologia. V. 46(4). P. 402. https://doi.org/10.2216/06-83.1
Hoef-Emden K., Melkonian M., 2003. Revision of the genus Cryptomonas (Cryptophyceae): a combination of molecular phylogeny and morphology provides insights into a long-hidden dimorphism. Protist. V. 154(3–4), P. 371. https://doi.org/10.1078/143446103322454130
Hoef-Emden K., Archibald J.M. 2017. Cryptophyta (Cryptomonads) // Handbook of the Protists. Cham: Springer International Publishing. P. 851.
Katoh K., Toh H. 2010. Parallelization of the MAFFT multiple sequence alignment program // Bioinformatics. V. 26. P. 1899. https://doi.org/10.1093/bioinformatics/btq224
Kulizin P.V., Gusev E.S., Vodeneeva E.L., Okhapkin A.G. 2021. Silica-scaled chrysophytes of some left-bank tributaries of the Cheboksary reservoir // Inland Water Biology. № 4. V. 14. P. 357. https://doi.org/10.31857/S0320965221030098
Kumar S., Stecher G., Li M. et al. 2018. MEGA X: Molecular evolutionary genetics analysis across computing platforms. Molecular Biology and Evolution V. 35. P. 1547. https://doi.org/10.1093/molbev/msy096
Lane C.E., Archibald J.M. 2008. New marine members of the genus Hemiselmis (Cryptomonadales, Cryptophyceae) // J. Phycol. V. 44(2). P. 439. https://doi.org/10.1111/j.1529-8817.2008.00486.x
Laza-Martínez A. 2012. Urgorri complanatus gen. et sp. nov. (Cryptophyceae), a red-tide-forming species in brackish waters // J. Phycol. V. 48. P. 423. https://doi.org/10.1111/j.1529-8817.2012.01130.x
Lund J.W.G. 1942. Contributions to our knowledge of British algae VIII // J. Bot. V. 80. P. 57.
Martynenko N.A., Gusev E.S., Kulizin P.V. et al. 2020a. A new species of Cryptomonas (Cryptophyceae) from the Western Urals (Russia) // Eur. J. Taxon. V. 649. P. 1. https://doi.org/10.5852/ejt.2020.649
Martynenko N.A., Gusev E.S., Kapustin D.A. et al. 2020b. Cryptomonas cattiensis sp. nov. (Cryptophyceae: Cryptomonadales), a new species described from Vietnam // Phytotaxa. V. 454(2). P. 127. https://doi.org/10.11646/phytotaxa.454.2.4
Martynenko N.A., Gusev E.S., Sterlyagova I.N., Kulikovskiy M.S. 2022. Revealing hidden diversity in the Cryptomonas erosa clade (Cryptophyceae), with the description of two new species from acidic habitats // Phycologia. (In press).https://doi.org/10.1080/00318884.2022.2025727
Ronquist F., Huelsenbeck J.P. 2003. 2001. MrBayes 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. V. 19. P. 1572. https://doi.org/10.1093/bioinformatics/btg180
Schwarz G. 1978. Estimating the dimension of a model // The annals of statistics. V. 6(2). P. 461. https://doi.org/10.1214/aos/1176344136
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


