Биология внутренних вод, 2022, № 6, стр. 702-710
Пространственно-временное распределение планктонных сообществ (фито- и зоопланктона) в нижнем течении р. Северная Двина
А. П. Новоселов a, *, Е. Н. Имант a, Ю. В. Новикова a, Н. Ю. Матвеев a, Н. В. Климовский a, С. Н. Артемьев a
a Федеральный исследовательский центр комплексного изучения Арктики им. академика Н.П. Лаверова
Уральского отделения Российской академии наук
Архангельск, Россия
* E-mail: alexander.novoselov@rambler.ru
Поступила в редакцию 11.04.2022
После доработки 16.06.2022
Принята к публикации 21.06.2022
- EDN: MGBHSG
- DOI: 10.31857/S0320965222060171
Аннотация
Проанализирована трехлетняя (2019–2021 гг.) динамика качественного и количественного состава планктонных сообществ нижнего течения р. Северная Двина. Приведены результаты анализа видового богатства и таксономического состава зоопланктона, а также пространственно-временного распределения количественных показателей фито- и зоопланктона. Выявлено, что среднегодовые значения биомассы фитопланктона и концентрации хлорофилла а изменялись в пределах от 0.42 г/м3 и 1.04 мкг/л на участках предустьевого взморья в 2021 г. до 2.16 г/м3 и 5.41 мкг/л соответственно в протоке Кузнечиха в 2020 г. Видовой перечень зоопланктона за исследуемый период включал 79 видов, их количество в пробах варьировало от 33 в 2020–2021 гг. до 75 в 2019 г. Во временном аспекте наиболее высокие количественные показатели зоопланктона выявлены в 2021 г., в пространственном – в протоках Кузнечиха и Маймакса во все годы исследований. Основной вклад в численность и биомассу зоопланктона вносили виды родов Bosmina и Eurytemora.
ВВЕДЕНИЕ
Планктонные сообщества играют огромную роль в состоянии, функционировании и оценке качества вод, поскольку любые изменения условий существования гидробионтов отражаются на их видовом составе, структуре популяций и количественных показателях (Крылов, 2005; Алимов, 2010). Фитопланктон служит доминирующим первичным продуцентом в водной среде, запускающим тем самым большинство пищевых сетей, и производит огромное количество кислорода для живых существ (Yongzhen et al., 2012). Зоопланктон играет ключевую роль в формировании биоразнообразия, оказывая таким образом решающее воздействие на процессы, происходящие в водных экосистемах. Эти организмы, будучи неотъемлемой частью функционирования водных пищевых сетей, – основное звено для передачи энергии между фитопланктоном, первичными продуцентами, высшими видами и далее хищниками. Кроме того, зоопланктон может относительно быстро реагировать на увеличение численности фитопланктона, например, во время весеннего цветения (Jinhuo, 2013; Song et al., 2021). Соответственно, информация о сообществах и разнообразии планктона – важный аспект понимания процессов, происходящих в водных экосистемах.
Урбанизация больших территорий может оказывать многофакторное негативное воздействие на состояние водных объектов, что вызывает необходимость непрерывного комплексного мониторинга происходящих изменений (Song et al., 2021). Планктонные сообщества служат составляющими компонентами в системе биологического мониторинга водных экосистем, поскольку они во многом определяют экологическое состояние и качество вод. Изучение изменений пигментных характеристик фитопланктона в пространственно-временном аспекте и выявление функциональных связей между биотическими и абиотическими факторами водной среды позволяют получить информацию о состоянии автотрофного звена водных экосистем. Концентрация Хл а фитопланктона – один из основных показателей обилия и фотосинтетической активности альгоценозов (Бульон, 1983; Минеева, 2021). Исследование видового состава и количественных характеристик зоопланктона считается необходимым условием при изучении пресноводных экосистем, поскольку они определяют состояние кормовой базы для молоди всех видов рыб и рыб-планктофагов, следовательно, и уровень состояния запасов промысловых видов рыб.
Цель работы – дать анализ пространственно-временной динамики фитопланктона (биомассы, концентрации Хл а) и зоопланктона (таксономического состава, количественных показателей) в нижнем течении р. Северная Двина в 2019–2021 гг.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
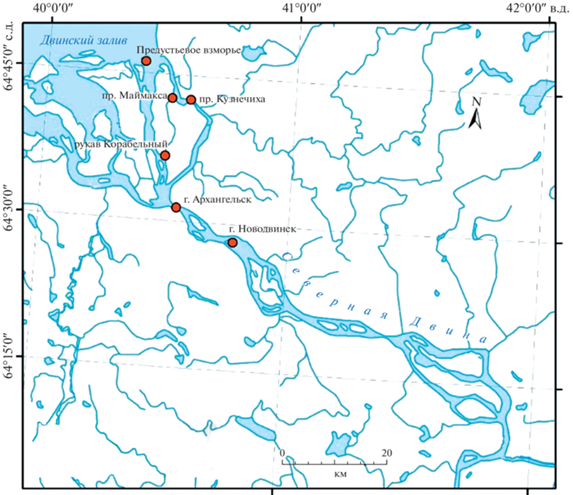
Гидробиологические исследования проводили в период с марта по октябрь в 2019–2021 гг. в дельтовой части р. Северная Двина (рис. 1).
Пробы фитопланктона отбирали батометром объемом 5 л с поверхностного горизонта в соответствии с руководством (Руководство…, 1992). Всего отобрано и обработано 140 проб. Мероприятия по отбору проводились (Абакумов, 1992). В лабораторных условиях с помощью вакуумной установки фитопланктон осаждали на мембранные фильтры Владисарт (диаметр пор 0.65 мкм), покрытые MgCO3 диаметром 47 мм. Экстрагирование осадка, спектрофотометрирование экстракта, расчет концентрации Хл а (мкг/л) проводили согласно ГОСТу 17.1.4.02-90. Общую биомассу (г/м3) фитопланктона в единице объема воды выражали через концентрацию Хл а (Руководство…, 1992).
Пробы зоопланктона отбирали с поверхностного горизонта, процеживая 100 л воды через планктонную сеть с размером ячеи 0.072 мм с последующей их фиксацией 4%-ным формалином и обработкой в камеральных условиях. Всего за период исследований отобрано 140 проб. Сбор и обработку зоопланктонных проб проводили по руководству (Руководство …, 1992). Численность зоопланктона пересчитывали на 1 м3; биомассу вычисляли с использованием размерно-массовых зависимостей (Кононова, 2018); видовую принадлежность беспозвоночных устанавливали при помощи определителей зоопланктона (Определитель …, 1977; Определитель…, 2010). Зоопланктон характеризовали по видовому и таксономическому составу, количеству видов, численности (N) и биомассе (B). Доминантные виды в сообществах выделяли по относительной численности при нижнем уровне доминирования ≥10%.
Статистическую обработку результатов (средняя арифметическая и ее ошибка) проводили в программном продукте по обработке аналитической информации SPSS Statistics.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Фитопланктон. Биомасса фитопланктона и концентрация Хл а исследуемой акватории за весь период наблюдений изменялись в достаточно широком диапазоне (табл. 1). Минимальные их значения отмечены в период зимней межени в 2019 г. в Корабельном рукаве (биомасса 0.1 г/м3, концентрация Хл а 0.26 мкг/л) и в 2021 г. в протоке Кузнечиха (соответственно 0.1 г/м3 и 0.24 мкг/л). Максимальные значения зарегистрированы в осенний период в 2020 г. в протоке Кузнечиха (биомасса 2.46 г/м3, концентрация Хл а 6.15 мкг/л). Среднегодовые значения биомассы и концентрации Хл а изменялись от 0.42 г/м3 и 1.04 мкг/л в предустьевом взморье 2021 г. до 2.16 г/м3 и 5.41 мкг/л соответственно в протоке Кузнечиха 2020 г.
Таблица 1.
Пространственно-временная динамика значений биомассы (B, г/м3) и концентрации Хл а (мкг/л) фитопланктона в нижнем течении р. Северная Двина в 2019–2021 г.
| Станция отбора проб | Показатель | Год | Зимняя межень | Весеннее половодье | Летняя межень | Осенний период | В среднем за год |
|---|---|---|---|---|---|---|---|
| В черте г. Новодвинск | B | 2019 | 0.21 ± 0.12 | 1.00 ± 0.21 | 1.78 ± 0.29 | 1.44 ± 0.31 | 1.11 ± 0.16 |
| 2020 | – | – | 1.30 ± 0.39 | – | – | ||
| 2021 | 0.15 ± 0.02 | 0.34 ± 0.02 | 0.9 ± 0.04 | 0.32 ± 0.04 | 0.43 ± 0.09 | ||
| Хл а | 2019 | 0.52 ± 0.29 | 2.50 ± 0.53 | 4.45 ± 0.73 | 3.59 ± 0.77 | 2.76 ± 0.41 | |
| 2020 | – | – | 3.28 ± 0.98 | – | – | ||
| 2021 | 0.36 ± 0.06 | 0.85 ± 0.04 | 2.25 ± 0.11 | 0.79 ± 0.1 | 1.06 ± 0.22 | ||
| В черте г. Архангельск у ж/д моста |
B | 2019 | – | 0.66 ± 0.30 | 2.10 ± 0.67 | 2.27 ± 2.23 | 1.68 ± 0.48 |
| 2020 | 0.30 | – | 1.54 ± 0.77 | 0.86 | 0.91 ± 0.42 | ||
| 2021 | 0.16 | 0.59 ± 0.09 | 1.06 ± 0.32 | 0.32 ± 0.07 | 0.53 ± 0.36 | ||
| Хл а | 2019 | – | 1.66 ± 0.74 | 5.26 ± 1.67 | 5.69 ± 5.57 | 4.2 ± 1.21 | |
| 2020 | 0.83 | – | 3.85 ± 1.9 | 2.17 | 2.28 ± 1.03 | ||
| 2021 | 0.41 | 1.47 ± 0.23 | 2.65 ± 0.8 | 0.81 ± 0.17 | 1.34 ± 0.89 | ||
| Рукав Корабельный | B | 2019 | 0.10 ± 0.01 | 0.88 ± 0.25 | 1.64 ± 0.43 | 0.82 ± 0.14 | 0.86 ± 0.17 |
| 2020 | – | – | 2.17 ± 0.19 | 0.88 ± 0.002 | 1.53 ± 0.27 | ||
| 2021 | 0.13 ± 0.04 | 0.48 ± 0.04 | 1.09 ± 0.1 | 0.49 ± 0.1 | 0.55 ± 0.11 | ||
| Хл а | 2019 | 0.26 ± 0.01 | 2.19 ± 0.64 | 4.10 ± 1.08 | 2.04 ± 0.36 | 2.15 ± 0.41 | |
| 2020 | – | – | 4.95 ± 0.46 | 2.21 ± 0.005 | 3.58 ± 0.27 | ||
| 2021 | 0.33 ± 0.11 | 1.19 ± 0.1 | 2.72 ± 0.25 | 1.24 ± 0.26 | 1.37 ± 0.29 | ||
| Протока Кузнечиха | B | 2019 | – | 0.85 ± 0.21 | 1.65 ± 0.4 | 0.55 ± 0.47 | 1.02 ± 0.19 |
| 2020 | – | – | 1.86 | 2.46 | 2.16 ± 0.58 | ||
| 2021 | 0.10 ± 0.02 | 0.38 ± 0.01 | 1.24 ± 0.2 | 0.57 ± 0.02 | 0.57 ± 0.17 | ||
| Хл а | 2019 | – | 2.12 ± 0.53 | 4.13 ± 1.01 | 1.36 ± 1.17 | 2.54 ± 0.48 | |
| 2020 | – | – | 4.66 | 6.15 | 5.41 ± 1.44 | ||
| 2021 | 0.24 ± 0.06 | 0.96 ± 0.03 | 3.9 ± 0.5 | 1.42 ± 0.04 | 1.63 ± 0.43 | ||
| Предустьевое взморье | B | 2019 | – | 0.98 ± 0.40 | 1.33 ± 0.44 | 0.71 ± 0.7 | 1.01 ± 0.24 |
| 2020 | – | – | 1.7 ± 0.291 | – | – | ||
| 2021 | 0.11 | 0.59 ± 0.08 | 0.55 ± 0.39 | – | 0.42 ± 0.14 | ||
| Хл а | 2019 | – | 2.45 ± 1.01 | 3.34 ± 1.11 | 1.78 ± 1.77 | 2.52 ± 0.6 | |
| 2020 | – | – | 4.30 ± 0.73 | – | – | ||
| 2021 | 0.27 | 1.46 ± 0.20 | 1,.8 ± 0.98 | – | 1.04 ± 0.36 |
Известно, что массовое развитие фитопланктона в водотоках происходит после вскрытия льда под влиянием комплекса метеорологических, гидрологических и гидрохимических факторов. Минимальные значения биомассы фитопланктона и концентрации Хл а исследуемой акватории за весь период наблюдений отмечены в период зимней межени. Сезонная динамика фитопланктона в 2019 г. характеризовалась весенним пиком развития на всей обследованной акватории. В 2020 и 2021 гг. фитопланктон достигал максимального развития в летний период, кроме станции в протоке Кузнечиха, на которой биомасса и концентрация Хл а увеличивались в осенний период (табл. 1).
Зоопланктон нижнего течения р. Северная Двина в 2019–2021 гг. был представлен тремя крупными таксономическими группами микро- и мезозоопланктона – Rotifera, Cladocera и Copepoda. За весь период исследований идентифицировано 79 видов, среди которых 26.6% видов относятся к типу Rotifera, 40.5% к надотряду Cladocera и 32.9% к подклассу Copepoda. Количество видов варьировало от 33 в 2020–2021 гг. до 75 в 2019 г., наибольшего развития во все годы наблюдений достигали ветвистоусые ракообразные (табл. 2).
Таблица 2.
Таксономический состав и экологическая характеристика зоопланктона в нижнем течении р. Северная Двина в 2019–2021 г.
| Таксон | Экотип, распространение, трофическая группа, зона, (индекс сапробности) | 2019 г. | 2020 г. | 2021 г. |
|---|---|---|---|---|
| Тип Rotifera | ||||
| Asplanchna priodonta Gosse, 1850 A. herricki Guerne, 1888 Asplanchna sp. |
Пл, К, Хв–вс, β–о, (1.55) Пл, К, Хв–вс, о, (1.0) |
+ + + |
+ + – |
+ + – |
| Brachionus calyciflorus calyciflorus Pallas, 1776 | Пл, К, В, β–α, (2.5) | + | + | + |
| B. diversicornis (Daday, 1883) | Пл, К, В, β, (2.0) | – | + | – |
| B. sp. Kellicottia longispina (Kellicott, 1879) |
Пл, П, В, о–β, (1.25) | + + |
– – |
– + |
| Keratella cochlearis (Gosse, 1851) | Пл, К, В, о–β, (1.15) | + | – | + |
| K. quadrata (O.F. Müller, 1786) | Пл, К, В, β–о, (1.55) | + | – | + |
| Notholca acuminata (Ehrenberg, 1832) | Пл, К, В | – | – | + |
| Euchlanis dilatata Ehrenberg, 1832 | Пл, К, В, β–о, (1.5) | + | – | + |
| Lecane sp. | + | – | – | |
| Lepadella sp. Ploesoma hudsoni (Imhof, 1891) |
Пл, Хв–вс, о, (1.0) | + + |
– – |
– – |
| P. sp. Polyarthra vulgaris Carlin, 1943 |
Пл, Г, В, β–о, (1.8) | + + |
– – |
– + |
| P. dolichoptera Idelson, 1925 | Пл, П, В, о–β, (1.1) | + | – | – |
| Synchaeta sp. | + | – | + | |
| Trichocerca sp. Conochilus unicornis Rousselet, 1892 |
Пл, К, о, (1.3) | + + |
– – |
– – |
| Filinia longiseta (Ehrenberg, 1834) | Пл, К, В, β, (2.35) | + | – | – |
| Надотряд Cladocera | ||||
| Acroperus harpae (Baird, 1834) | Г, Ф, о–β, (1.4) | + | + | + |
| Alona affinis (Lydig, 1860) | М, П, Ф, о–β, (1.1) | + | – | – |
| A. quadrangularis (O.F. Müller, 1776) | М, Ф, о–β, (1.4) | + | + | + |
| Alona sp. | + | – | – | |
| Alonopsis elongatus G.O. Sars, 1862 | М, П, Ф, о, (0.8) | + | – | – |
| Chydorus sphaericus (O.F. Müller, 1785) | Пл, К, Ф, β–о, (1.75) | + | + | + |
| Coronatella rectangula (G.O. Sars, 1862) | М, П, Ф, о–β, (1.3) | + | + | – |
| Disparalona rostrata (Koch, 1841) | М, П, Ф, о, (1.3) | + | + | + |
| Disparalona sp. | + | – | – | |
| Peracantha truncata (O.F. Müller, 1785) | М, П, Ф о, (1.3) | + | – | – |
| Leydigia leydigi (Schödler, 1863) | М, Г, С, β, (2.0) | + | – | – |
| Pleuroxus uncinatus (Baird, 1850) | М, Г, Ф, о–β, (1.4) | + | + | – |
| Pleuroxus aduncus (Jurine, 1820) | М, П, Ф, о, (1.2) | + | – | – |
| Bosmina (Eubosmina) coregoni Baird, 1857 | Пл, К, Ф, о, (0.95) | + | + | + |
| B. (Bosmina) longirostris (O.F. Müller, 1785) | Пл, К, Ф, о–β, (1.55) | + | + | + |
| Bosminopsis sp. | – | + | – | |
| Ceriodaphnia pulchella G.O. Sars, 1862 | Ф, о–β, (1.40) | – | + | + |
| C. quadrangula (O.F. Müller, 1785) | К, Ф, о, (1.15) | + | – | + |
| Ceriodaphnia sp. | + | + | + | |
| Daphnia (Daphnia) cucullata G.O. Sars, 1862 | Пл, П, Ф, β–о, (1.75) | + | – | + |
| D. (D.) cristata G.O. Sars, 1862 | Пл, П, Ф | + | – | – |
| D. (D.) longispina (O.F. Müller, 1776) | Пл, К, Ф, β, (2.0) | + | – | – |
| Daphnia sp. | + | – | – | |
| Alonella nana (Baird, 1843) | М, Ф, о–β, (1.4) | + | + | – |
| Scapholeberis mucronata (O.F. Müller, 1776) | Ф, β, (2.0) | + | – | – |
| Ilyocryptus acutifrons G.O. Sars, 1862 | Г, С, β–α, (2.1) | + | – | – |
| Macrothrix laticornis (Jurine, 1820) | М, К, С, β, (1.7) | – | + | – |
| M. hirsuticornis Norman & Brady, 1867 Polyphemus pediculus (Linnaeus, 1761) |
Г, Хв, о–β, (1.3) | + + |
– – |
– – |
| Sida crystallina (O.F. Müller, 1776) | Пл, П, Ф, о–β, (1.3) | + | + | + |
| Diaphanosoma brachyurum (Lievin, 1848) | о, (1.4) | + | + | + |
| Limnosida frontosa G.O. Sars, 1862 | Ф, о, (1.3) | – | – | + |
| Подкласс Copepoda | ||||
| Acanthocyclops vernalis vernalis (Fischer, 1853) | М, П, Хв, β–о, (1.85) | + | + | + |
| A. sp. | + | + | – | |
| Cyclops scutifer scutifer Sars G.O., 1863 | Пл, П, Хв | + | + | + |
| C. strenuus strenuus Fischer, 1851 | М, П, Хв, β–α, (2.25) | + | + | + |
| C. vicinus vicinus Uljanin, 1875 | Пл, П, Хв, β–α, (2.15) | + | – | – |
| Cyclops sp. | + | – | – | |
| Diacyclops bicuspidatus (Claus, 1857) | + | – | – | |
| Diacyclops sp. | + | – | – | |
| Eucyclops serrulatus serrulatus (Fischer, 1851) | М, К, С, β–о, (1.85) | + | + | – |
| Megacyclops viridis viridis (Jurine, 1820) | П, К, Хв, β–о, (1.65) | + | + | + |
| Mesocyclops leuckarti leuckarti (Claus, 1857) | М, К, Хв, о–β, (1.25) | + | + | + |
| Macrocyclops albidus albidus (Jurine, 1820) | Хв, β, (2.0) | + | – | – |
| Paracyclops affinis (Sars G.O., 1863) | М, К, С, о, (1.0) | + | + | – |
| P. fimbriatus fimbriatus (Fischer, 1853) | К | + | + | + |
| Paracyclops sp. | + | – | – | |
| Platycyclops phaleratus (Koch, 1838) | П, β–о, (1.5) | + | + | – |
| Thermocyclops crassus crassus (Fischer, 1853) | Пл, К, Хв | + | – | – |
| Th. oithonoides (Sars G.O., 1863) | Пл, К, Хв, о–β, (1.3) | + | + | + |
| Harpacticoida sp. | + | – | + | |
| Ectinosoma sp. | + | – | – | |
| Eudiaptomus gracilis (Sars G.O., 1863) | + | – | – | |
| E. graciloides (Lilljeborg, 1888) | + | – | – | |
| E. sp. | + | – | – | |
| Eurytemora affinis (Poppe, 1880) | Пл, Г, Ф | + | + | + |
| E. gracilis (Sars G.O., 1898) | Пл, Г, Ф | + | + | – |
| E. lacustris (Poppe, 1887) | Пл, Г, Ф | + | + | – |
| Rotifera | 19 | 4 | 11 | |
| Cladocera | 30 | 15 | 13 | |
| Copepoda | 26 | 14 | 9 | |
| Итого | 75 | 33 | 33 | |
Максимальное видовое богатство зоопланктона в 2019 г. могло быть связано с бόльшим количеством проб, отобранных в этот год, по сравнению с 2020 и 2021 гг. Снижение роли коловраток в видовом составе зоопланктона реки в 2020 г. объясняется сложностями с отбором проб в период весеннего половодья, когда коловратки достигают максимального развития.
Среди Rotifera наибольшим таксономическим богатством представлены два семейства – Brachionidae (4 рода) и Synchaetidae (3 рода), среди Cladocera – семейство Chydoridae (9 родов), среди Copepoda – семейство Cyclopidae (10 родов).
В исследуемый период основной экологический фон зоопланктонной фауны образовал комплекс широко распространенных палеарктических эвритермных и эвритопных видов. При этом, зоопланктон представляли организмы, принадлежащие к различным экологическим группам, что объясняется, прежде всего, гидрохимической особенностью вод, в том числе поступлением соленых морских вод Белого моря и их последующим смешением с пресными водами устья реки. Так, в составе зоопланктона присутствовали солоновато-водные виды рода Eurytemora, которые количественно превалировали в протоках реки в летний период (Imant, Novoselov, 2021).
На основании объединенных трофических и топических классификаций, А.В. Крылов (Крылов, 2005) выделил обособленные экологические группы зоопланктеров (табл. 3).
Таблица 3.
Трофическая структура руководящего комплекса зоопланктонных организмов лотической системы Северной Двины
| Трофическая группа | Экологическая подгруппа по способу питания и передвижения | Вид |
|---|---|---|
| Организмы, добывающие пищу из толщи воды | ||
| Хвататели-всасыватели | Плавание/захват + всасывание | Asplanchna priodonta |
| Фильтраторы первичные | Плавание/первичная фильтрация | Bosmina coregoni |
| Bosmina longirostris | ||
| Фильтраторы | Плавание/фильтрация + захват | Eurytemora affinis |
| Eurytemora gracilis | ||
| Организмы, добывающие пищу с поверхности субстрата | ||
| Вертикаторы | Плавание + ползание/вертикация | Brachionus calyciflorus |
Используя эту классификацию гидробионтов, выявлено, что в нижнем течении р. Северная Двина преобладают организмы, добывающие пищу из толщи воды и с поверхности субстрата. По способу питания и перемещению в пространстве доминируют плавающие первичные фильтраторы, представленные преимущественно эврибионтным видом Bosmina (В. longirostris) – показателем загрязнения среды обитания, а также плавающими фильтраторами Eurytemora.
Установлено (Алимов, 2000), что в водоемах существуют преемственность и взаимодействие между зоопланктоном на разных подсистемах (участках), однако в водотоках, по мнению некоторых ученых (Маргалеф, 1992), она отсутствует. При этом предполагается, что жизнедеятельность реофильного планктона представляет собой направленный процесс из-за “слабых” взаимодействий между организмами в результате нестабильных гидрологических и химических условий обитания гидробионтов (Крылов, 2005).
Тем не менее, на каждом конкретном участке реки немаловажное значение имеют взаимодействия гидробионтов, осуществляемые за счет обильного дрифта организмов. Благодаря этому, в определенной точке водотока плотность особей, несмотря на интенсивный дрифт, может продолжительное время оставаться стабильной (Алимов, 2010). Соответственно, возникает вопрос относительно стабильности и вариабельности качественного состава и количественных характеристик зоопланктона лотических систем. Для зоопланктона реки характерно значительное разнообразие, связанное не только с дрифтом, а также с множеством экологических факторов и/или их различных комбинаций.
В период проведения исследования численность зоопланктона изменялась от 809 в 2019 г. до 2063 экз./м3 в 2021 г., биомасса – от 14.41 до 52.44 мг/м3 соответственно (табл. 4). В трехлетней динамике наиболее высокие показатели обилия зоопланктона наблюдали в 2021 г., вероятно, вследствие благоприятного комбинированного эффекта воздействия факторов на развитие планктонных животных. Наибольшего количественного развития достигали Copepoda; общими для всех трех лет исследований были ракообразные рода Eurytemora, способные обитать в солоноватых водах. В видовой структуре зоопланктона в 2019 г. наблюдали перестройку, выраженную в смене доминантного вида Eurytemora affinis (Poppe, 1880) и, в целом, таксономической группы зоопланктона. Численным ядром планктона в этот год оказался эврибионтный вид, имеющий всесветное распространение и являющийся показателем эвтрофных условий – Bosmina (B.) longirostris (Imant, Novoselov, 2021).
Таблица 4.
Пространственное распределение количественных показателей зоопланктона в нижнем течении р. Северная Двина
| Показатели | Станция отбора проб | В среднем по реке |
||||
|---|---|---|---|---|---|---|
| в черте г. Новодвинск | в черте
г. Архангельск у ж/д моста |
протока Кузнечиха |
рукав Корабельный | протока Маймакса | ||
| 2019 г. | ||||||
| N | 678 ± 322 | 450 ± 240 | 2004 ± 1281 | 180 ± 143 | 734 ± 506 | 809 ± 314 |
| B | 10.56 ± 6.28 | 7.63 ± 4.34 | 40.87 ± 28.82 | 2.23 ± 1.76 | 10.77 ± 6.50 | 14.41 ± 6.79 |
| 2020 г. | ||||||
| N | 516 ± 411 | 351 ± 299 | 2413 ± 1543 | 233 ± 151 | 1509 ± 1418 | 1004 ± 418 |
| B | 5.99 ± 2.99 | 6.02 ± 4.57 | 132.65 ± 86.57 | 4.87 ± 4.41 | 61.06 ± 60.08 | 42.12 ± 25.05 |
| 2021 г. | ||||||
| N | 1970 ± 819 | 2289 ± 1811 | 2700 ± 1199 | 1305 ± 702 | 2051 ± 645 | 2063 ± 228 |
| B | 46.89 ± 25.73 | 62.31 ± 51.11 | 82.71 ± 37.03 | 23.41 ± 16.61 | 46.87 ± 19.85 | 52.44 ± 9.79 |
В пространственном аспекте количественные показатели организмов на станциях в черте г. Новодвинск и г. Архангельск у ж/д моста в 2020 г. были снижены по сравнению с 2019 и 2021 гг. В протоках Кузнечиха и Маймакса во все годы исследований зафиксированы наибольшие значения показателей. В этих протоках основной вклад в численность и биомассу вносили эврибионтные первичные фильтраторы – виды рода Bosmina и солоновато-водные фильтраторы – виды рода Eurytemora. В протоке Маймакса доминировали преимущественно Bosmina, которые способны переносить незначительные колебания солености; в протоке Кузнечиха – виды рода Eurytemora, что указывает на значительное влияние прибрежных вод на речную систему в этих протоках. С другой стороны, эти протоки отличаются по морфометрическим характеристикам по сравнению с крупными рукавами реки, и в них создается благоприятный термический режим в период летней межени, что положительно сказывается на количественном развитии вышеперечисленных организмов (Новоселов и др., 2022).
Индикаторные виды зоопланктона обследованной акватории достигали 60.8% общего числа видов, из них 44.3% – показатели β-мезосапробных условий и переходных о–β-, β–о-, β–α-мезосапробных зон, оставшиеся 16.5% – олигосапробной зоны.
Выводы. Трехлетний мониторинг планктонных сообществ нижнего течения р. Северная Двина, проведенный в период 2019–2021 гг. позволил выявить основные характеристики их современного состояния. Содержание Хл а и количество биомассы фитопланктона представлены диапазоном величин, типичных для соответствующего периода сезонного цикла фитопланктона. Массовое развитие водорослей начиналось в период весеннего половодья, достигая максимума в летнюю межень с последующим снижением количественных показателей в осенний период. В то же время, интенсивность развития фитопланктона имела различия в межгодовом аспекте. В 2019 г. в черте г. Архангельск у ж/д моста после летнего скачка развития фитопланктона не происходило снижения биомассы, и в осенний период отмечались высокие значения количественных показателей. В 2021 г. в районе предустьевого взморья отмечены наиболее низкие значения биомассы фитопланктона и концентрации хлорофилла а на протяжении всего вегетационного периода. Невысокий продукционный потенциал альгоценозов планктона мог быть обусловлен как сезонной сукцессией (сменой групп, доминирующих в летнем планктоне, на осенний комплекс), так и поступлением загрязняющих веществ, снижающих скорость роста и фотосинтетическую активность фитопланктона.
Видовой перечень зоопланктона нижнего течения р. Северная Двина в период исследования был достаточно широк и включал в общей сложности 79 видов, наибольшего видового богатства достигали ветвистоусые ракообразные. Индикаторные виды зоопланктона исследуемого участка реки составляли более половины общего числа, виды-индикаторы полисапробных вод не обнаружены. В трехлетней динамике наиболее высокие показатели обилия зоопланктона наблюдали в 2021 г. Основной количественный фон планктона – копеподный, общими для всех лет исследований были ракообразные рода Eurytemora, способные обитать в солоноватых водах. В 2019 г. происходила перестройка в структуре зоопланктона. Наиболее продуктивные по количественным показателям зоопланктона – связанные между собой водообменом протоки Кузнечиха и Маймакса (Пидгайко и др., 1968), что позволяет отнести их к районам с наиболее благоприятной кормовой базой для откорма молоди рыб независимо от их дальнейшей трофической специализации.
Состояние биотической части экосистемы (фито-, зоопланктон) по качественному (видовой состав и таксономическое разнообразие) и по количественному (численность и биомасса) составу можно считать удовлетворительным. Пространственная (различные участки нижнего течения реки) и сезонно-временная динамика количественных показателей находятся в соответствии с климатическими и экологическими особенностями региона.
Список литературы
Алимов А.Ф. 2000. Элементы теории функционирования водных экосистем. Санкт-Петербург: Наука.
Алимов А.Ф. 2010. Изменения структуры сообществ животных при эвтрофировании и загрязнении водных экосистем // Докл. РАН. Т. 433. № 2. С. 1.
Бульон В.В. 1983. Первичная продукция планктона внутренних водоемов. Ленинград: Наука.
Кононова О.Н. 2018. Методическое руководство по определению размерно-весовых характеристик организмов зоопланктона Европейского Севера России. Сыктывкар: Коми Науч. центр УрО РАН.
Крылов А.В. 2005. Зоопланктон равнинных малых рек. Москва: Наука.
Маргалеф Р. 1992. Облик биосферы. Москва: Наука.
Минеева Н.М. 2021. Многолетняя динамика хлорофилла в планктоне различных участков крупного равнинного водохранилища // Биология внутр. вод. № 6. С. 574. https://doi.org/10.31857/S0320965221060127
Новоселов А.П., Имант Е.Н., Артемьев С.Н. и др. 2022. Современное состояние планктонных и бентосных сообществ устьевой области реки Северная Двина // Экология. № 3. С. 1. https://doi.org/10.31857/S0367059722030088
Определитель зоопланктона и зообентоса пресных вод Европейской России. 2010. Т. 1. Зоопланктон. Москва: Товарищество науч. изданий КМК.
Определитель пресноводных беспозвоночных Европейской части СССР. 1977. Ленинград: Гидрометеоиздат.
Пидгайко М.Л., Александров Б.М., Иоффе Ц.И. и др. 1968. Краткая биолого-продукционная характеристика водоемов Северо-Запада СССР // Изв. ГосНИОРХ. Т. 67. С. 205.
Руководство по гидробиологическому мониторингу пресноводных экосистем. 1992. Санкт-Петербург: Гидрометеоиздат.
Imant E.N., Novoselov A.P. 2021. Dynamics of Zooplankton Composition in the Lower Northern Dvina River and Some Factors Determining Zooplankton Abundance // Russ. J. Ecol. V. 52. № 1. P. 59. https://doi.org/10.1134/S1067413621010045
Jinhuo Luo. 2013, Phytoplankton–zooplankton dynamics in periodic environments taking into account eutrophication // Math. Biosci. V. 245. Iss. 2. P. 126. https://doi.org/10.1016/j.mbs.2013.06.002
Song Cu., Choi H., Jeon MS. et al. 2021. Zooplankton diversity monitoring strategy for the urban coastal region using metabarcoding analysis // Sci. Rep. V. 11. P. 24339. https://doi.org/10.1038/s41598-021-03656-3
Yongzhen Pei, Yunfei Lv., Changguo Li. 2012. Evolutionary consequences of harvesting for a two-zooplankton one-phytoplankton system // Appl. Math. Model. V. 36. Iss. 4. P. 1752. https://doi.org/10.1016/j.apm.2011.09.015
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод