Биология внутренних вод, 2022, № 6, стр. 818-832
Эколого-морфологические характеристики и особенности питания окуня (Percа fluviatilus) в осенне-зимний период в дистрофном и олиготрофном озерах Северной Карелии (Россия)
П. М. Терентьев a, Н. А. Березина b, *
a Институт проблем промышленной экологии Севера, Кольский научный центр Российской академии наук
Апатиты, Россия
b Зоологический институт Российской академии наук
Санкт-Петербург, Россия
* E-mail: nadezhda.berezina@zin.ru
Поступила в редакцию 16.05.2022
После доработки 19.06.2022
Принята к публикации 21.06.2022
- EDN: VUDSTA
- DOI: 10.31857/S0320965222060183
Аннотация
Исследованы биологические особенности (размерно-массовые характеристики, возрастная структура) и состав пищи популяций речного окуня Perca fluviatilis L., 1758 в малых озерах северной Карелии (дистрофном оз. Круглое и олиготрофном оз. Кривое) в осенне-зимний период. Между популяциями окуня изученных озер выявлены значимые различия в темпах роста, а также по ряду морфологических признаков: диаметру глаза, длине головы и ее заглазничного отдела; высоте головы у затылка, наибольшей и наименьшей высоте тела, антедорсальном и антевентральном расстояниях, а также длине хвостового стебля и нижней челюсти. У окуня оз. Круглое (с высокой цветностью и малой прозрачностью вод) размеры глаза в пропорциях тела и головы заметно больше, чем у рыб из светловодного оз. Кривое. По типу питания окунь обоих озер – эврифаг с высокой долей бентосных беспозвоночных (81–83% по индексу относительной значимости) и низкой долей рыб в питании (<1% в оз. Круглое и 5.6% (20% при длине тела >22 см) в оз. Кривое). В зимний период в рационе окуня обоих озер преобладали (>50%) личинки крупных поденок Ephemera vulgatа. Субдоминантами (>10%) в питании окуня были планктонные и бентосные ракообразные, личинки ручейников (в оз. Кривое) и хирономид (в оз. Круглое). Темп массового роста окуня в олиготрофном озере в более двух раз превышает таковой в дистрофном, однако в целом значительно ниже, чем в более крупных озерах Карелии (Сямозеро, Онежское, Ладожское). По-видимому, это связано с низким уровнем ихтиофагии окуня в условиях малопродуктивных северных озер.
ВВЕДЕНИЕ
В условиях меняющегося климата зимний период – наиболее критический сезон для многих озер. Получение данных о росте и питании рыб в подледный период считается трудоемкой, но важной и актуальной задачей гидробиологии, особенно в озерах северных широт, где этот период длится более шести месяцев в году. Рыбы, физиологически приспособленные к низким температурам, в зимние холода остаются активными (McMeans et al., 2020), продолжают расти и питаться (Пономарев, 2019). Физические процессы (перемешивание воды, температура и уровень кислорода в толще воды) влияют на их поведение в подледный период (Jansen et al., 2021). Некоторые данные свидетельствуют, что рыбы выбирают определенные глубины озер и местообитания с наиболее благоприятными температурами воды (4°С) для оптимизации своих метаболических затрат (Harrison et al., 2016). Мелкие рыбы, которые имеют меньшую емкость для накопления энергии и более высокий риск зимнего голодания, должны с большей активностью добывать корм зимой по сравнению с более крупными особями (Byström et al., 2006). Меньший снежный покров на поверхности льда озер и большее проникновение света в толщу воды могут способствовать более активному и успешному питанию рыб (Varpe et al., 2015), поскольку рыбы относятся к визуальным хищникам и свет им необходим, чтобы обнаружить и успешно поймать добычу (Blanchfield et al., 2009). Кроме того, закрытие озера ледяным покровом приводит к постепенному истощению кислорода в воде (Deshpande et al., 2017) и это, вместе с другими перечисленными факторами, может заставить рыбу выбирать зимой особые места обитания с наиболее благоприятной температурой и кислородом (Hasler et al., 2009). Аноксия зимой действует как сильный фильтр, определяющий активность и выживаемость рыб. Таким образом, уровень потребления рыбами беспозвоночных и их влияние на трофические сети в озерах подо льдом могут отличаться от таковых в летний период и зависеть от многих причин.
В озерах Карелии речной окунь Perca fluviatilis L. – один из самых распространенных видов рыб (Стерлигова и др., 2016). Он заселил большое количество озер и в некоторых малых водоемах северной Карелии является единственным представителем ихтиофауны. В пределах одного водоема окунь может быть представлен двумя формами – медленно- и быстрорастущей, различающимися по темпу роста, поведению и характеру питания (Дгебуадзе, 2001; Дятлов, 2002). Несмотря на большое количество работ по его образу жизни (Решетников и др., 1982; Попова, Ассман, 1993), рост и сезонная динамика пищевого спектра остаются мало исследованными, особенно в полярных районах (Стерлигова и др., 2016; Березина и др., 2021) и крайне мало данных по этим показателям окуня в холодный подледный период (Пономарев, 2019). В водных экосистемах Севера интенсивность роста рыб ожидаемо ниже, чем в экосистемах более низких широт. Но и в озерах одного региона, разных по трофическому статусу, характер роста и линейно-массовые характеристики окуня могут значительно варьировать.
Ранее рацион окуня в субарктических озерах европейской части России изучали только в период открытой воды, летом и осенью, не затрагивая период ледостава (Иванова и др., 2006; Berezina et al., 2018; Березина и др., 2021; Зубова и др., 2021). Результаты этих работ показали низкий уровень потребления окунем рыб. Именно бентосные беспозвоночные размером 8–16 мм (ракообразные, личинки насекомых, моллюски) служили основным пищевым ресурсом окуня разных размерных групп (от 2+), а сезонная смена доминирующих форм в питании окуня определялась динамикой биомассы и размеров этих видов животных в озерах.
Цель работы – изучение эколого-морфологических характеристик речного окуня в дистрофном и олиготрофном озерах Северной Карелии, темпов его роста и особенностей питания в подледный период.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Характеристика озер. Малые субарктические озера Кривое (66°3435 с.ш., 33°6375 в.д.) и Круглое (66°3429 с.ш., 33°6119 в.д.) расположены на берегу Кандалакшского залива Белого моря в Северной Карелии (рис. 1), в 30 км к югу от Полярного круга. Рядом с озерами находится круглогодичная Беломорская биостанция “Картеш” Зоологического института РАН. Основные физико-химические показатели этих озер представлены в табл. 1. Озера характеризуются холодноводностью и низким содержанием питательных веществ. С конца ноября по конец мая они покрыты льдом. К концу периода ледостава (в апреле) в придонных слоях оз. Круглое формируются гипоксийные условия (1–2.7 мг О2/л) продолжительностью до 20–30 сут. Низкие концентрации кислорода отмечены и в оз. Кривое, но только в самой глубоководной части (на глубине 30 м) с конца марта по начало мая, они колеблются от 0 до 2.5 мг О2/л.
Таблица 1.
Основные физико-химические параметры исследованных озер
| Показатель | оз. Кривое | оз. Круглое |
|---|---|---|
| Площадь, км2 | 0.5 | 0.1 |
| Средняя (максимальная) глубина, м | 12 (32) | 2 (4) |
| Прозрачность воды, м | 4.5–4.8 | 1.2 |
| Цветность воды, Pt-Co | 25−30 | 150–160 |
| Минерализация, мг/л: | 72–88 | 27–50 |
| Ca2+ HC${\text{O}}_{3}^{ - }$ |
5.8–7.4 28.6–31.2 |
2.4–3.9 11.6–25.5 |
| Содержание кислорода, мг/л: | ||
| на поверхности на дне |
8.6–12.1 0–12.0 |
7.8–11.2 1.0–7.4 |
| рН | 6.6–7.7 | 5.9–6.7 |
| Гуминовые кислоты, мг/л | 0.03 | 0.15–0.21 |
| Общее содержание, мг/л: | ||
| углерода азота фосфора железа |
6.4 1860–4110 14–74 4–280 |
22.6 1620–4430 18–162 76–500 |
| Хлорофилл a фитопланктона, мг/м3 | 0.2–3.0 | 0.18–1.00 |
Для светловодного глубокого оз. Кривое характерны высокая прозрачность воды (4.3–4.7 м) и низкая продукция фитопланктона (<100 мг С/(м2 сут)) и хлорофилла а (0.2–3.0 мкг/л). Мелководное оз. Круглое – дистрофный водоем с бурой водой из-за высокого содержания гумусовых веществ (табл. 1).
Сбор и обработка материала. Исследование рыб проводили в феврале, в апреле и в сентябре 2019–2021 гг. Рыб отлавливали на двух–трех станциях в каждом озере, расположенных в мелководной и глубоководной (центральной) части озер. Всего собрано и обработано 561 экз. рыб (биологический анализ), для размерного состава и темпа массового роста – 481 экз., морфометрического анализа – 107 экз., анализ питания – 670 экз.
Рыб отлавливали стандартными наборами ставных жаберных сетей из монофиламента. Сети длиной 30 м, высотой 1.5 м и размером ячеи 15, 16, 17,18, 20, 24, 27, 33, 35, 40 мм устанавливали вблизи станций отбора гидробиологических проб, использованных ранее (Винберг, 1975), на глубинах 3–25 м. В зимний период также ловили с помощью удочки.
Рыб обрабатывали по стандартным методам (Правдин, 1966; Методы …, 2019). Массу рыб определяли с точностью до 1 г, длину (общую (AB), по Смиту (АС) и промысловую (АД) – от вершины рыла до начала хвостового плавника) измеряли с точностью до 1 мм. Возраст рыб определяли по жаберной крышечной кости под бинокуляром МБС-10 при поляризованном освещении (Чугунова, 1959). Для морфометрического анализа рыб фотографировали цифровым фотоаппаратом Nikon Coolpix W300 с объектовом Nikkor на штативе. По полученным фотографиям с помощью программы ImageJ измеряли основные пластические признаки. Определение размерно-возрастного состава популяции было основано на расчете взвешенного возрастного состава выборки и определения по длине рыб относительного распределения их возрастных классов.
Содержимое желудка рыб определяли в лаборатории под микроскопом. После измерений и взвешивания тела рыб, желудок рыб удаляли из полости тела и сразу анализировали или фиксировали 4%-ным раствором формалина. Наполненность желудка оценивали по пятибалльной шкале. Для анализа отбирали желудки с наполнением пищей >60% (наполненность III–V) – ≥20 желудков окуня в один период исследования для каждого озера. Содержимое желудка взвешивали, затем переносили в чашку Петри. Под бинокулярным стереомикроскопом МБ-10 все пищевые компоненты идентифицировались (по возможности до вида) и разделяли на группы по таксономическим классам. Подсчитывали количество экземпляров и определяли их суммарную массу в каждой группе. По вкладу различных групп пищевых объектов в общую численность (N) и массу (W) компонентов пищевого комка (%) и по частоте встречаемости (FO, %) компонента у проанализированных рыб рассчитывали индекс относительной значимости компонента питания (Hyslop, 1980) по формуле:
RI = 100(%FO + %N + %W)/∑1…n(%FO + %N + %W).
Все показатели выражали как среднее арифметическое значение с определением стандартного отклонения (SD) и стандартной ошибки (SE). Различия в изучаемых параметрах между годами, сезонами и группами проанализировали с помощью метода главных компонент (ANOVA) и t-тестов парного сравнения в пакете Statistica-10.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Эколого-морфологические характеристики окуня
В оз. Кривое зарегистрировано три вида рыб: окунь Perca fluviatilis, ряпушка Coregonus albula (L.) и девятииглая колюшка Pungitius pungitius (L.), в оз. Круглое – только окунь. Окунь в структуре рыбной части сообщества оз. Кривое – доминирующий вид. В оз. Круглое в уловах, помимо окуня, обнаружен узкопалый рак Pontastacus leptodactylus (Eschscholtz).
Размерно-массовая и возрастная структуры окуня. Исследования показали, что окунь в изученных водоемах, расположенных в непосредственной близости друг от друга, различается по показателям роста (рис. 2, рис. 3).
Рис. 2.
Возрастная (а), массовая (б, в) и размерная (г, д) структуры самцов (б, г) и самок (в, д) окуня оз. Круглое. Здесь и на рис. 3 АД – промысловая длина (от вершины рыла до начала хвостового плавника.

Рис. 3.
Возрастная (а), массовая (б, в) и размерная (г, д) структуры самцов (б, г) и самок (в, д) окуня оз. Кривое.
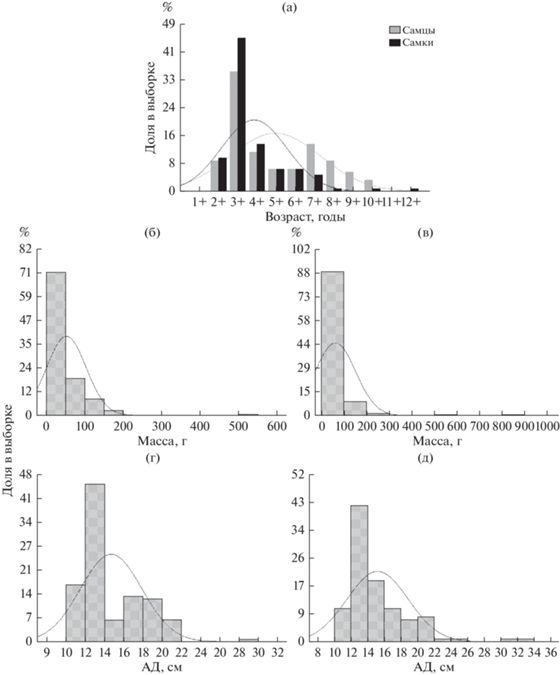
В оз. Круглое возрастную структуру рыб в период исследования представляли особи восьми возрастных групп (рис. 2). В уловах отсутствовали рыбы младше 3+, единично отмечены экземпляры 9+ и 11+ лет. В основе выборки были рыбы в возрасте 4+ …6+, причем преобладали особи массой 20–40 г, причем у самок этой выборки размеры тела (12–14 см) были выше, чем у самцов (11–13 см). Указанная закономерность касается и средних размерно-массовых показателей в отдельных возрастных группах (табл. 2). И по массе, и по показателям линейных размеров в выборке рыб оз. Круглое не выявлено четкой бимодальной структуры распределения, характерной для водоемов, где могут обитать разные формы окуня (рис. 2). В то же время в уловах присутствовали и относительно крупные особи длиной тела >15 см и массой > 60 г.
Таблица 2.
Размерно-возрастные показатели окуня оз. Круглое
| Показатель | Возраст, лет | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| 3+ n = 19 |
4+ n = 77 |
5+ n = 71 |
6+ n = 55 |
7+ n = 15 |
8+ n = 4 |
9+ n = 4 |
10+ – |
11+ n = 1 |
|
| Масса, г: | Самцы (Σn = 93) | ||||||||
| М ± SD | 22 ± 4.6 | 26 ± 4.4 | 28 ± 6.3 | 31 ± 7.1 | 49 ± 1.1 | – | 88 ± 17.5 | – | – |
| min–max | 17–34 | 19–35 | 20–45 | 22–49 | 47–50 | – | 70–105 | – | – |
| Длина (АД), см: | |||||||||
| М ± SD | 1.4 ± 0.5 | 12.0 ± 0.7 | 12.3 ± 0.8 | 12.9 ± 0.9 | 14.2 ± 0.6 | – | 17.2 ± 0.7 | – | – |
| min–max | 10.6–12.1 | 10.4–13.2 | 10.8–13.6 | 11.1–15.1 | 13.3–14.8 | – | 16.5–17.9 | – | – |
| Масса, г: | Самки (Σn = 153) | ||||||||
| М ± SD | 25 ± 6.1 | 29 ± 5.7 | 31 ± 6.4 | 38 ± 8.7 | 55 ± 23.4 | 53 ± 8.9 | 67 ± 7.5 | – | 149 |
| min–max | 18–37 | 18–43 | 22–57 | 25–56 | 27–98 | 40–65 | 59–74 | – | – |
| Длина (АД), см: | |||||||||
| М ± SD | 12.0 ± 0.6 | 12.4 ± 0.7 | 12.9 ± 0.6 | 13.7 ± 0.9 | 15.0 ± 1.4 | 15.4 ± 0.8 | 17.8 ± 0.6 | – | 21.4 |
| min–max | 10.9–12.8 | 10.9–14.3 | 11.7–14.1 | 12.0–15.6 | 13.0–17.2 | 14.2–16.5 | 17.2–18.4 | – | – |
Окунь оз. Кривое представлен в выборке десятью возрастными группами (рис. 3). Максимальный возраст зарегистрирован у самки (12+). Однако наибольшие размерно-массовые показатели были у самки в возрасте 10+ (33.5 см и 829 г) с высокими темпами роста (табл. 3). Основу уловов оз. Кривое представляли рыбы двух возрастных групп (3+ и 4+ лет). В отличие от оз. Круглое, здесь самки были более многочисленны у рыб возраста от 2+ до 4+ лет, в возрастных группах старше восьми лет (7+) численность самцов была выше, чем самок (рис. 4). На окуня массой до 100 г приходилось 88% всей выборки. В распределении рыб по длине тела выделены три группы. Наиболее многочисленной частью популяции были окуни длиной от 12 до 16 см, далее следует группа в 16–24 см. Доля крупных особей (>30 см) достигала лишь ~3.5% выборки.
Таблица 3.
Размерно-возрастные показатели окуня оз. Кривое
| Показатель | Возраст, лет | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 2+ n = 23 |
3+ n = 99 |
4+ n = 32 |
5+ n = 16 |
6+ n = 16 |
7+ n = 23 |
8+ n = 13 |
9+ n = 7 |
10+ n = 5 |
11+ n = 1 |
12+ n =1 |
|
| Масса, г: | Самцы (Σn = 123) | ||||||||||
| М ± SD | 28 ± 5.7 | 30 ± 5.7 | 36 ± 9.6 | 42 ± 17.8 | 78 ± 28.1 | 94 ± 26.8 | 106 ± 24.9 | 102 ± 11.2 | – | – | |
| min–max | 18–39 | 15–46 | 18–56 | 22–77 | 35–137 | 50–151 | 75–151 | 86–125 | 99–167 | – | – |
| АД, см: | |||||||||||
| М ± SD | 12.4 ± 0.5 | 12.60 ± 0.7 | 13.4 ± 0.8 | 14.0 ± 0.9 | 17.2 | 17.9 ± 0.6 | 18.9 | 19.0 ± 0.7 | 19.8 | – | – |
| min–max | 11.1–14.1 | 10.8–14.5 | 10.7–15.4 | 12.1–17.4 | 14.3–19.5 | 13.3–14.8 | 16.6–20.9 | 17.9–20.1 | 18.2–21.2 | – | – |
| Масса, г: | Самки (Σn = 109) | ||||||||||
| М ± SD | 29 ± 7.6 | 39 ± 13.2 | 51 ± 25.2 | 104 ± 48.0 | 105 ± 47.5 | 149 ± 71.4 | 257 | – | 829 | – | 527 |
| min–max | 19–38 | 19–88 | 22–93 | 34–193 | 40–186 | 34–280 | – | – | – | – | – |
| АД, см: | |||||||||||
| М ± SD | 12.5 ± 13.78 | 13.8 ± 19.1 | 14.7 ± 18.8 | 18.2 ± 21.7 | 18.2 ± 21.5 | 20.2 ± 21.5 | 22.7 | – | 33.5 | – | 30.2 |
| min–max | 11.1–13.7 | 11.3–19.1 | 11.5–18.8 | 13.7–21.7 | 14.7–21.5 | 13.7–25.1 | – | – | – | – | – |
Примечание. Обозначения, как в табл. 2.
Рис. 4.
Массово-возрастная (a, в) и размерно-возрастная (б, г) структура самок (а, б) и самцов (в, г) окуня в озерах Круглое (1) и Кривое (2).
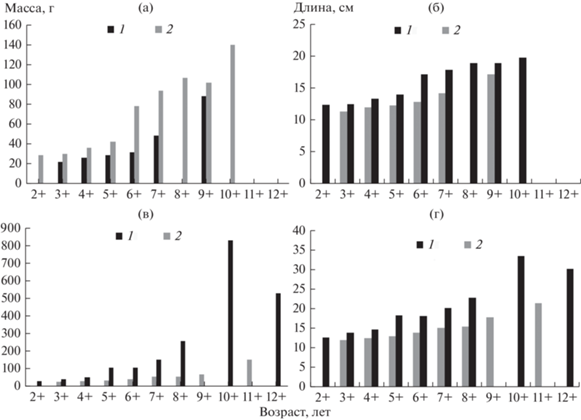
Сравнение размерно-массовых показателей окуня в рассматриваемых озерах показало, что темп роста массы рыб в более крупном и глубоководном оз. Кривое выше, чем в мелководном дистрофном оз. Круглое (рис. 5). Отмечено значительное варьирование предельных показателей массы и линейных размеров в отдельных возрастных группах окуня исследованных озер (табл. 2, 3). Степень варьирования и распределение рыб по длине в пределах каждой возрастной группы (от 2+ до 9+) указывает на наличие и медленно, и быстрорастущих рыб. По средним показателям длины рыб всех возрастов, прослеживается значительные различия в интенсивности роста рыб в пределах одного водоема (табл. 4). Интенсивность роста в течение года неоднородна, заметно снижаясь в зимний период. Окунь обоих озер более интенсивно растет в первые три года жизни.
Рис. 5.
Темп нарастания массы окуня с возрастом в озерах Кривое и Круглое в сравнении с таковым окуня из других озер Карелии (по: (Стерлигова и др., 2016)). Озера: 1 – Круглое, 2 – Кривое, 3 – Суоярви, 4 – Керетьозеро, 5 – Онежское, 6 – Сямозеро, 7 – Ладожское. R2 – коэффициент детерминации.
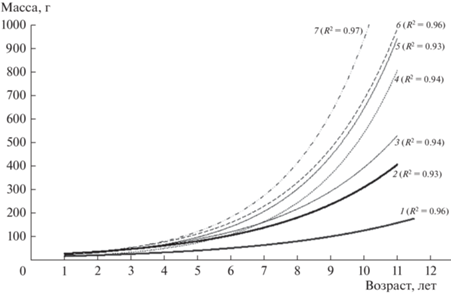
Таблица 4.
Средняя длина тела АД (см) медленнорастущих и быстрорастущих форм окуня в отдельных возрастных группах
| Возраст | Медленнорастущий | Быстрорастущий | ||
|---|---|---|---|---|
| оз. Круглое | оз. Кривое | оз. Круглое | оз. Кривое | |
| 2+ | – | 11.8 | – | 13.5 |
| 3+ | 10.8 | 11.5 | 12.1 | 15.0 |
| 4+ | 11.0 | 12.1 | 13.3 | 16.6 |
| 5+ | 11.5 | 14.6 | 13.5 | 19.6 |
| 6+ | 12.5 | 16.0 | 14.8 | 20.0 |
| 7+ | 13.3 | 15.5 | 16.0 | 22.2 |
| 8+ | 14.6 | 17.5 | 16.0 | 19.8 |
| 9+ | 16.8 | 18.4 | 18.1 | 19.7 |
Половая структура. Соотношение самцов и самок в возрастных группах окуня оз. Круглое характеризовалось доминированием самок почти во всех возрастных классах и в подледный, и в осенний периоды. Общее соотношение самцов и самок было 1 : 1.6. Для оз. Кривое в половой структуре окуня отмечено почти равное соотношение особей, однако, среди рыб старших возрастов (7+...10+) преобладали самцы. В оз. Кривое окунь достигает половой зрелости в возрасте 2+ при длине 11–13 см и массе 19–24 г. В оз. Круглое, несмотря на отсутствие в пробах рыб в возрасте 2+, созревание наступает при аналогичных размерах. Особи со зрелыми гонадами в апреле имели длину тела 10.8 см при массе 19 г.
Анализ морфологических показателей окуня. Для окуня оз. Круглое характеристики плавников были следующими спинных: (D1) XIII–XV и (D2) I–III – 13–16; брюшного (V) I – 4–5 и анального плавника (A) II – 8–10. Для рыб оз. Кривое эти показатели также варьировали: (D1) XIV–XVI, (D2) I–III – 13–16; (V) I 4–5; (A) II – 7–9. У окуня из обоих озер было 22–29 жаберных тычинок на первой жаберной дуге, от 62 до 73 чешуй в боковой линии и от 38 до 43 позвонков. По указанным меристическим признакам окуни озер Круглое и Кривое значимо не различались (р > 0.05).
Для пластических признаков окуня выявлены значимые различия между самцами и самками в оз. Круглое, в частности для вертикального диаметра глаза np (t = 2.89, p < 0.05), антедорсального расстояния aq (t = 2.04, p < 0.05) и наибольшей высоты ID tu (t = 2.28, p < 0.05). Аналогичные половые различия окуня оз. Кривое касались лишь вертикального диаметра глаза np (t = 5.66, p < 0.05). В обоих озерах более высокие значения этих признаков были у самцов.
Сравнение пластических признаков окуня из разных озер показало ряд значимых различий (табл. 5). В частности, диаметр глаза, заглазничный отдел, длина и высота головы, антеанальное и антевентральное расстояние, длина хвостового стебля, выраженные в % длины тела (АД), у окуня из оз. Круглое были значимо выше, чем из оз. Кривое. Однако, длина нижней челюсти, высота тела и наименьшая высота тела были выше у окуня из оз. Кривое. Окунь оз. Круглое также отличался особым строением глаза от окуня оз. Кривое (рис. 6).
Таблица 5.
Пределы варьирования и средние величины (%) пластических признаков окуня в исследованных озерах
| Признак | Min–max | M ± SE | t-критерий | ||
|---|---|---|---|---|---|
| оз. Круглое | оз. Кривое | оз. Круглое | оз. Кривое | ||
| АД, см | 11.2–21.4 | 11.1–33.5 | 13.6 ± 0.28 | 16.4 ± 0.69 | p > 0.05 |
| od | 63.6–75.8 | 56.3–78.1 | 70.4 ± 0.31 | 71.0 ± 0.47 | p > 0.05 |
| an | 5.2–9.2 | 6.1–11.0 | 7.2 ± 0.13 | 7.4 ± 0.12 | p > 0.05 |
| np | 5.4–9.6 | 4.3–9.3 | 7.7 ± 0.13 | 6.0 ± 0.13 | 7.21* |
| po | 13.2–17.9 | 10.8–18.1 | 16.0 ± 0.14 | 14.9 ± 0.14 | 5.68* |
| ao | 25.6–34.2 | 23.1–37.7 | 30.9 ± 0.29 | 28.2 ± 0.30 | 5.81* |
| lm | 17.4–24.0 | 15.4–24.2 | 20.9 ± 0.17 | 19.5 ± 0.21 | 6.72* |
| gh | 22.4–31.0 | 19.2–32.9 | 26.0 ± 0.33 | 27.1 ± 0.27 | –5.18* |
| ik | 6.4–8.1 | 5.6–8.2 | 7.2 ± 0.05 | 7.4 ± 0.06 | 3.08* |
| aq | 27.2–34.5 | 24.1–36.8 | 31.9 ± 0.22 | 30.2 ± 0.25 | –3.26* |
| az | 28.5–37.1 | 27.0–41.2 | 33.6 ± 0.24 | 32.5 ± 0.28 | 3.9* |
| ay | 61.2–70.9 | 52.7–78.4 | 67.9 ± 0.31 | 67.3 ± 0.49 | p > 0.05 |
| fd | 19.8–27.5 | 16.1–25.5 | 22.8 ± 0.22 | 20.9 ± 0.25 | 2.99* |
| tu | 13.6–17.3 | 11.4–18.1 | 15.5 ± 0.12 | 15.4 ± 0.15 | p > 0.05 |
| t1u1 | 9.1–13.7 | 8.3–12.7 | 11.0 ± 0.11 | 11.1 ± 0.14 | p > 0.05 |
| ej | 11.7–15.8 | 11.0–16.2 | 14.0 ± 0.11 | 13.9 ± 0.12 | p > 0.05 |
| an1 | 18.5–27.9 | 23.0–29.2 | 23.4 ± 0.26 | 26.1 ± 0.24 | p > 0.05 |
| np1 | 18.9–28.4 | 15.6–26.8 | 25.0 ± 0.31 | 21.2 ± 0.33 | p > 0.05 |
| po1 | 47.0–58.9 | 46.8–61.3 | 51.9 ± 0.40 | 53.0 ± 0.43 | p > 0.05 |
| a1a2 | 29.5–48.3 | 31.6–41.8 | 35.3 ± 0.42 | 36.7 ± 0.33 | p > 0.05 |
| n1m1 | 4.9–11.1 | 6.9–13.8 | 8.6 ± 0.17 | 9.8 ± 0.19 | p > 0.05 |
| k1l1 | 17.1–44.1 | 32.3–58.3 | 32.3 ± 0.69 | 42.6 ± 0.94 | 4.3* |
Примечание. Даны средние величины и стандартная ошибка (M ± SE). Признаки (% АД): od – длина туловища, an – длина рыла, пр –диаметр глаза (горизонтально), ро – заглазничный отдел головы, ао – длина головы, lm – высота головы у затылка, gh – наибольшая высота тела, ik – наименьшая высота тела, aq – антедорсальное расстояние, аz – антевентральное расстояние, ау – антеанальное расстояние, fd – длина хвостового стебля, tu – наибольшая высота спинного плавника D1; t1u1 – наибольшая высота спинного плавника D2, ej – наибольшая высота A. Признаки (% длины головы): an1 – длина рыла, np1– диаметр глаза, po1– заглазничный отдел головы, a1a2– длина верхнечелюстной кости, n1m1 – ширина верхнечелюстной кости, k1l1 – длина нижней челюсти.
Особенности питания окуня в озерах
В период исследования спектр питания окуня в озерах Кривое и Круглое включал 10 групп беспозвоночных, объединяющих 25 видов и форм, а также рыб. Вклад основных объектов по индексу относительной значимости для рыб с разной АД показан на рис. 7. Значимые различия были обнаружены между вкладом различных компонентов в питание (оз. Круглое F (6, 41) = 3.85, р = 0.005 и оз. Кривое F (6, 48) = 16.4, р <0.001), но их не было обнаружено между разными размерными группами окуня (р > 0.05).
Рис. 7.
Индекс относительной значимости основных компонентов пищи окуня разных размерных групп озер Круглое (a) и Кривое (б). Компоненты пищи для оз. Круглое (a): 1 – Cladocera, 2 – Copepoda; для оз. Кривое (б): 1 – Cladocera, 2 – Amphipoda; для обоих озер: 3 – моллюски Sphaeriidae, 4 – личинки водных насекомых (ручейников, поденок, вислокрылок, жуков и др.), 5 – личинки Chironomidae (+Chaoboridae для (а)), 6 – рыба и 7 – прочие.
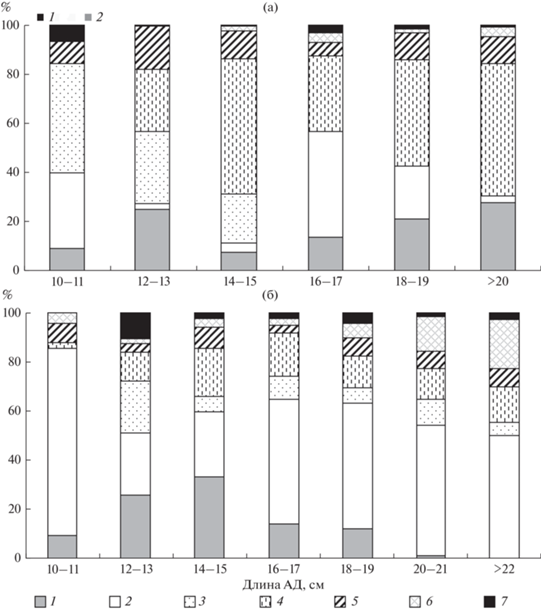
Основу осеннего питания окуня в оз. Круглое представляли личинки водных насекомых, включая ручейников, поденок, вислокрылок, жуков, стрекоз (рис. 8) – в среднем, 35% по индексу относительной значимости. Эта группа была доминирующей в питании окуня и в зимний период (до 80% по массе и до 65% по индексу относительной значимости). В оз. Кривое в пище рыб доминировали ракообразные: амфиподы Gammarus lacustris, Gammaracanthus loricatus и Monoporeia affinis (в среднем 47.4%), на личинок водных насекомых приходилось в среднем лишь 13%. Также в обоих озерах был существенен вклад в питание окуня планктонных ракообразных и мелких шаровок сем. Sphaeriidae: в оз. Круглое – 35 и 15.6%, в оз. Кривое – 14 и 8% соответственно. Уровень сходства рациона окуня между озерами достигала ~30%, разница между озерами во вкладе в питание общих компонентов была значима только в случае потребления личинок хирономид (t = –2.4, p = = 0.03), для остальных компонентов пищи (поденок Ephemera vulgata, ручейников Phryganeidae, моллюсков) эта разница недостоверна (р > 0.05).
Рис. 8.
Массовая доля (М, %) и индекс относительной значимости (RI, %) основных компонентов пищи в разные периоды года (II, IV, IX – месяц) в озерах Круглое (a) и Кривое (б). Для (а) 1 – Cladocera, 2 – Copepoda, 3 – Pontastacus leptodactylus, 4 – Ephemeroptera, 5 – Trichoptera, 6 – Chironomidae, 7 – Chaoboridae, 8 – рыбы, 9 – прочие; для (б) 1 – Gammarus lacustris, 2 – Monoporeia affinis, 3 – Gammaracanthus loricatus, 4 – Ephemeroptera, 5 – Trichoptera, 6 – Chironomidae, 7 – планктонные ракообразные, 8 – рыбы/эмбрионы рыб, 9 – прочие.

Различия во вкладе разных групп в питание окуня между осенним и зимним периодом для обоих озер были недостоверны. В феврале и в апреле характер питания окуня в оз. Круглое и Кривое в целом был сходен с осенним: личинки поденок по-прежнему доминировали (>50%), превышая существенно по вкладу в рацион все остальные объекты питания (F (8, 26) = 9.8, p < 0.0001; t-тест, все p < 0.001). В оз. Кривое в зимний период снизилась роль прибрежных амфипод, однако доля крупных глубоководных (>20 м) амфипод Gammaracantus loricatus оставалась высокой, что может свидетельствовать о преимущественной локализации популяции окуня на больших глубинах с благоприятным температурным режимом. Субдоминантами (>10%) в питании окуня были планктонные ракообразные и личинки ручейников в оз. Кривое и личинки хирономид в оз. Круглое (рис. 8).
Доля рыб в питании окуня оз. Кривое варьировала в среднем от 1 до 9%, достигая 20% по индексу относительной значимости только у крупных (АД > 22 см) особей (рис. 7). Доля рыб в питании окуня оз. Круглое была очень низкой (в среднем <1%).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Характер роста рыб в значительной степени обусловлен межорганизменными отношениями в популяции и влиянием факторов среды обитания (Дгебуадзе, 2001). Установлено, что интенсивность роста окуня в водоемах Карелии определяется кормовой базой, ее доступностью и трофическим статусом, показывая снижение при эвтрофировании озер (Стерлигова и др., 2016). Согласно материалам предыдущих исследований 1950–1960-х гг., окунь оз. Кривое в пятилетнем возрасте был на третьем месте по массе среди окуня из водоемов северо-западной части России. Темпы его роста совпадали с показателями окуня оз. Ильмень (Берг, 1949; Винберг, 1975).
В изученный период по темпам размерно-массового роста окунь оз. Круглое до пятилетнего возраста был сравним с окунем Онежского озера, Суоярви, Тулос, а окунь оз. Кривое – с таковыми Ладожского озера и оз. Койвас. Однако в обоих исследованных озерах темп роста окуня старше пяти лет оказался значительно ниже по сравнению с окунем из многих других озер Карелии (рис. 5). В крупных и олиготрофных озерах (Онежское и Ладожское) темп роста окуня старше 4 лет наиболее высок, что совпадает с переходом окуня с планктонного и бентосного питания на питание рыбами. Вклад рыб в питание окуня достигал 20% в оз. Кривое и был крайне низким в оз. Круглое (где окунь – единственный представитель рыб). По-видимому, с этим связаны низкие показатели ростовых характеристик окуня изученных озер.
Известно, что окуни начинают переходить к хищному питанию рыбами при длине 8–10 см (Попова, Ассман, 1993). В оз. Кривое рыбы отмечены в пище всех исследованных размерных групп (АД 10–22 см), однако 13–20% по вкладу отмечено только у самых крупных особей >20% (рис. 7). В летний период активное питание рыбой отмечено исследователями при достижении общей длины тела 16 cм (Березина и др., 2021). Таким образом, переход окуня на активное питание рыбой в оз. Кривое происходит значительно позже (в возрасте 7–8+), чем в других озерах (Попова, Ассман, 1993; Haakana et al., 2007; Yazıcıoğlu et al., 2016). Время наступления рыбоядной стадии в питании окуня зависит от плотности и размерных характеристик других рыб, и задержка перехода в оз. Кривое и фактическое отсутствие рыбы в рационе окуня оз. Круглое, по-видимому, связано с недостаточным количеством рыб подходящего для потребления размера. Ранее (1968–1969 гг.) в рационе окуня оз. Кривое существенную роль играла трехиглая колюшка (у 75% исследованных рыб), однако, к настоящему времени эта колюшка в озере исчезла. Вместе с тем, крупные окуни охотно употребляли в пищу девятииглую колюшку и ряпушку как в летний период (Березина и др., 2021), так и в осенне-зимний.
Возрастная структура и продолжительность жизни особей в популяции окуня согласуется с таковыми в других озерах северо-западной части России (Макарова, 1982; Тропин, 2008; Дворянкин, 2021). Поскольку масса и размеры тела окуня в отдельных возрастных группах из изученных озер варьировали достаточно широко (табл. 2, 3), можно предположить наличие в них медленно- и быстрорастущих группировок рыб. В водоемах Карелии окунь характеризуется экологической пластичностью и, как правило, формирует хорошо обособленные группы: прибрежную (особи от 10 до 20 см) и глубоководную (30–45 см). В малых лесных ламбах встречен карликовый окунь размером 6–9 см (Стерлигова и др., 2016).
Разнотипность изученных водоемов обусловила и морфометрические различия между популяциями окуня, определяемые особенностями питания и интенсивностью ростовых процессов рыб, а также формированием нескольких экологических форм. Такие показатели как цветность и прозрачность вод способствовали формированию морфометрических особенностей рыб в популяции из гумифицированного оз. Круглое. Одно из наиболее отчетливых различий, отмечаемых визуально, – показатель вертикального диаметра глаза (рис. 6). У рыб оз. Круглое размеры глаза в пропорциях тела и головы заметно больше, чем у окуня из светловодного оз. Кривое. Очевидно, это обусловлено высокой цветностью и малой прозрачностью вод озера (табл. 1). Надо сказать, что отмеченная особенность встречается не у всех обследованных особей, а у ~71% особей в выборке.
Различия в характере питания окуня двух озер, выражающееся главным образом в однообразном рационе (в основном, поденками) и очень низком вкладе рыб (<1%) в питание окуня в дистрофном оз. Круглое, по-видимому, определяет и более прогонистую форму его тела и закономерно бóльшие величины отделов головы и тела по сравнению с более упитанными рыбами олиготрофного водоема, где основу питания круглый год составляют ракообразные.
Выводы. В осенне-зимний период выявлены биологические особенности популяций речного окуня Perca fluviatilis в малых озерах северной Карелии (дистрофном оз. Круглое и олиготрофном оз. Кривое). Показано, что, несмотря на закономерное снижение темпов роста в зимний период подо льдом, рыбы достаточно активно питались. По типу питания окунь в условиях обоих озер – эврифаг с высокой долей бентосных беспозвоночных (личинок насекомых и ракообразных) и низкой долей рыб в питании. Установлено, что окунь глубоководного олиготрофного водоема, характеризующегося большим разнообразием условий обитания и кормовых ресурсов, обладает более высокими темпами линейного и массового роста и продолжительностью жизни. В мелководном дистрофном озере, в отсутствии других видов рыб, характер роста окуня, в основном, равномерен для всех особей популяции. Темп роста массы окуня в олиготрофном озере в >2 раза выше по сравнению с таковым у рыб в дистрофном водоеме, однако, значительно ниже, чем в других озерах Карелии (в том числе, Сямозеро, Онежское, Ладожское и др.). Возможно, это связано с низким уровнем ихтиофагии окуня в условиях северных озер. В отличие от оз. Кривое, в оз. Круглое происходит формирование своеобразной группировки окуня по ряду морфометрических показателей головы и тела, что, по-видимому, является одной из реакций приспособления к условиям малой прозрачности и высокой цветности этого озера.
Список литературы
Берг Л.С. 1949. Рыбы пресных вод СССР и сопредельных стран. Т. 1–3. Москва: Изд-во АН СССР.
Березина Н.А., Литвинчук Л.Ф., Максимов А.А. 2021. Связь пищевого спектра рыб с составом зоопланктона и зообентоса в субарктическом озере // Биология внутр. вод. № 4. P. 406.https://doi.org/10.31857/S0320965221040069
Винберг Г.Г. 1975. Биологическая продуктивность северных озер. 1. Озера Кривое и Круглое // Тр. Зоол. ин-та. Т. 56.
Дворянкин Г.А. 2021. Биология, экология и рыбохозяйственное значение речного окуня Perca fluviatilis (L.) Кенозерского национального парка // Вестник Астраханского государственного технического университета. Серия: Рыбное хозяйство. № 1. С. 24. https://doi.org/10.24143/2073-5529-2021-1-24-30
Дгебуадзе Ю.Ю. 2001. Экологические закономерности изменчивости роста рыб. Москва: Наука.
Дятлов М.А. 2002. Рыбы Ладожского озера (распространение, морфометрия, экология, промышленное использование). Петрозаводск: Карельск. науч. центр РАН.
Зубова Е.М., Терентьев П.М., Постнова С.В. 2021. Новые данные о видовом составе и биологических характеристиках рыб озер г. Мурманск // Тр. Ферсмановской науч. сессии Геологического ин-та Кольского науч. центра РАН. Т. 18. С. 183.
Иванова Т.С., Березина Н.А., Мовчан Е.А., Шатских Е.В. 2006. Питание окуня (Perça fluviatilis L.) в прибрежной зоне озера Кривое (Карельский берег Белого моря) // Вест. СПб ун-та. Сер. 3. Биология. № 4. С. 79.
Макарова Н.П. 1982. Окунь Сямозера // Изменение структуры рыбного населения эвтрофируемого водоема. Москва: Наука. С. 206.
Методы экологических исследований водоемов Арктики. 2019. Мурманск: Мурманский государственный технический университет. Мурманск: Мурманский гос. тех. ун-т.
Пономарев В.И. 2019. Зимнее распределение окуня в горной озерно-речной системе // Вест. Ин-та биол. Коми науч. центра Ур. отд. РАН. № 4(211). С. 20. https://doi.org/10.31140/j.vestnikib.2019.4(211).3
Попова О.А., Ассман А.В. 1993. Питание молоди окуня и ерша в прибрежной зоне Сямозера // Биология речного окуня. Москва: Наука. С. 113.
Правдин И.Ф. 1966. Руководство по изучению рыб. Москва: Пищ. пром-сть.
Решетников Ю.С., Попова О.А., Стерлигова О.П. и др. 1982. Изменение структуры рыбного населения эвтрофируемого водоема. Москва: Наука.
Стерлигова О.П., Ильмаст Н.В., Савосин Д.С. 2016. Окунь Perca fluviatilis (Percidae) разнотипных водоемов Карелии // Уч. записки Петрозав. гос. ун-та. № 2(155). С. 57.
Тропин Н.Ю. 2008. Окунь в крупных водоемах Вологодской области // Рыб-во и рыбное хоз-во. № 10. С. 29.
Чугунова Н.И. 1959. Руководство по изучению возраста и роста рыб. Москва: Изд-во АН СССР.
Berezina N.A., Strelnikova A.P., Maximov A.A. 2018. The benthos as the basis of vendace and perch diets in an oligotrophic subarctic lake // Polar Biol. V. 41. P. 1789.
Blanchfield P.J., Tate L.S., Plumb J.M. et al. 2009. Seasonal habitat selection by lake trout (Salvelinus namaycush) in a small Canadian Shield lake: Constraints imposed by winter conditions // Aquatic Ecol. V. 43. P. 777. https://doi.org/10.1007/s10452-009-9266-3
Byström P., Andersson J., Kiessling A., Eriksson L.-O. 2006. Size and temperature dependent foraging capacities and metabolism: Consequences for winter starvation mortality in fish // Oikos. V. 115. P. 43. https://doi.org/10.1111/j.2006.0030-1299.15014.x
Deshpande B.N., Maps F., Matveev A., Vincent W.F. 2017. Oxygen depletion in subarctic peatland thaw lakes // Arctic Sci. V. 3. P. 406. https://doi.org/10.1139/as-2016-0048
Haakana H., Huuskonen H., Karjalainen J. 2007. Predation of perch on vendace larvae: diet composition in an oligotrophic lake and digestion time of the larvae // J. Fish. Biol. V. 70. P. 1171. https://doi.org/10.1111/j.1095-8649.2007.01383.x
Harrison P.M., Gutowsky L.F.G., Martins E.G. et al. 2016. Temporal plasticity in thermal-habitat selection of burbot Lota lota a diel-migrating winter-specialist // J. Fish Biol. V. 88. P. 2111. https://doi.org/10.1111/jfb.12990
Hasler C.T., Suski C.D., Hanson K.C. et al. 2009. The influence of dissolved oxygen on winter habitat selection by largemouth bass: An integration of field biotelemetry studies and laboratory experiments // Physiol. Biochem. Zool. V. 82. P. 143. https://doi.org/10.1086/591806
Hyslop E.J. 1980. Stomach contents analysis – a review of methods and their application // J. Fish Biol. V. 17. P. 411.
Jansen J., MacIntyre S., Barrett D.C. et al. 2021. Winter limnology: How do hydrodynamics and biogeochemistry shape ecosystems under ice? // J. Geophysical Research: Biogeosciences. V. 126. e2020JG006237. https://doi.org/10.1029/2020JG006237
McMeans B.C., McCann K.S., Guzzo M. et al. 2020. Winter in water: Differential responses and the maintenance of biodiversity // Ecol. Let. V. 23. P. 922. https://doi.org/10.1111/ele.13504
Varpe Ø., Daase M., Kristiansen T. 2015. A fish-eye view on the new Arctic lightscape // ICES J. Mar. Sci. V. 72. P. 2532. https://doi.org/10.1093/icesjms/fsv129
Yazıcıoğlu O., Yılmaz S., Yazıcı R. et al. 2016. Feeding ecology and prey selection of European perch Perca fluviatilis inhabiting a eutrophic lake in northern Turkey // J. Fresh. Ecol. V. 31. P. 641. https://doi.org/10.1080/02705060.2016.1220432
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод