Биология внутренних вод, 2022, № 6, стр. 803-817
Распределение пескороек Eudontomyzon sp. (Petromyzontiformes, Petromyzontidae) и разнообразие их местообитаний в малой равнинной реке бассейна Балтийского моря
А. В. Колотей a, *, Н. В. Полякова a, А. В. Кучерявый a, А. О. Звездин a, А. С. Демчук b, В. Р. Хохряков c, Д. С. Павлов a
a Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
b Санкт-Петербургский государственный университет
Санкт-Петербург, Россия
c Национальный парк “Смоленское Поозерье”
пос. Пржевальское, Демидовский р-н, Смоленская обл., Россия
* E-mail: a.v.kolotey@yandex.ru
Поступила в редакцию 17.05.2022
После доработки 06.06.2022
Принята к публикации 17.06.2022
- EDN: AZEMHD
- DOI: 10.31857/S0320965222060109
Аннотация
В р. Ильжица (водосборный бассейн р. Западная Двина) обитает резидентная непаразитическая минога Eudontomyzon sp., которая отличается от единственного известного в Балтийском бассейне вида этого рода – украинской миноги E. mariae (Berg, 1931). В ходе исследования были собраны личинки Eudontomyzon sp. и выявлены условия их обитания в летнюю межень. Изучены абиотические и биотические характеристики местообитаний. Результаты морфологического анализа речного русла позволили выделить пять типов биотопов: наносы в ямах на излучинах реки (I), песчаное дно на прямых участках реки (II), наносы в трубах под мостом (III), песчано-гравийное нерестилище (IV) и наносы в устье реки (V). Исследование плотности поселения личинок миноги позволило выделить наиболее (I) и наименее (I, II, V) заселенные типы биотопов. Анализ данных о бентосных сообществах показал, что наиболее типичные представители в биотопах – хирономиды. Полученные сведения дополняют знания о местообитаниях личинок миноги информацией о донных сообществах в них и расширяют существующие классификации местообитаний.
ВВЕДЕНИЕ
Исследование местообитаний и распределения водных организмов в речной системе может дать представление о численности их популяций, а долговременный мониторинг – о динамике состояния в меняющихся условиях. Распределение и особенности экологии таких организмов, в том числе личинок миног (пескороек), принято рассматривать на разных уровнях: макроуровне (региональном), мезоуровне (уровне водосбора) и микроуровне (уровне отдельных местообитаний) (Goodwin et al., 2008). Факторы окружающей среды, действующие на более крупных уровнях, могут оказывать модифицирующее влияние на факторы, действующие на уровнях меньшего масштаба и наоборот, поэтому в последнее время распространены исследования, рассматривающие обилие и распределение пескороек одновременно на уровнях разных масштабов (Goodwin et al., 2008; Dawson et al., 2015).
Для каждого уровня характерен свой набор параметров окружающей среды, влияющий на распределение личинок миног. В обзоре Доусон с соавт. (Dawson et al., 2015) установлено, что на микроуровне наибольшее влияние на распределение, независимо от вида, имеют фракционный состав грунта, скорость течения и морфология русла. Помимо этих характеристик исследователи придают значение глубине расположения местообитаний (Kelso, Todd, 1993; Torgersen, Close, 2004; Taverny et al., 2012), потенциальной возможности зарываться в грунт и самой глубине зарывания (Sugiyama, Goto, 2002; Quintella et al., 2007; Goodwin et al., 2008; Smith et al., 2012), содержанию органического вещества в субстрате (Malmqvist, 1980; Potter et al., 1986; Shirakawa et al., 2009; Smith et al., 2011), степени и динамике затенения местообитаний (Potter, Rogers, 1972; Hardisty, 1979; Potter et al., 1986; Jellyman, Glova, 2002; Claire et al., 2007), химическому составу воды (Hardisty, Potter, 1971; Young et al., 1990; Goodwin et al., 2008). Однако авторы часто приходят к разным оценкам влияния перечисленных факторов на плотность поселения пескороек (Dawson et al., 2015).
Личинки миног считаются частью донных ценозов, поскольку проводят в грунте в среднем 4–5 лет и образуют массовые скопления с высокими показателями обилия (Лабай, 2007; Nazarov et al., 2016; Aronsuu et al., 2019). Они могут доминировать в общей биомассе бентоса и играть существенную роль в энергетических потоках (Гриценко, 2002; Shirakawa et al., 2013). Несмотря на это, при описании местообитаний личинок миног исследователи обычно обходят вопрос биотических отношений – крайне мало публикаций, в которых бы уделяли внимание сообществам зообентоса в местообитаниях пескороек. С другой стороны, при изучении макрозообентоса либо полностью игнорируют присутствие пескороек в реке, либо лишь упоминают их наличие. Некоторые сведения о роли личинок миног в донных сообществах приведены в работе (Лабай, 2007).
Водные экосистемы, на которые антропогенное воздействие минимально, служат удобными полигонами для проведения популяционных исследований. Особо охраняемая природная территория Национальный парк “Смоленское Поозерье” обладает густой озерно-речной сетью ледникового происхождения с сохранившимся естественным гидрологическим режимом. Ее основные водные артерии – реки Ельша, Ильжица, Василевка, Половья – не зарегулированы. Водные объекты Национального парка (реки, ручьи и 35 ледниковых озер), относятся к водосборному бассейну Балтийского моря. Рядом с юго-восточной границей этой территории находится граница Азово-черноморского водосборного бассейна (рис. 1а).
Рис. 1.
Район проведения исследований и точки отбора проб: а ‒ на карте Европы (черная рамка территория проведения исследований); б ‒ на схеме Национального парка “Смоленское Поозерье”; в ‒ участок в нижнем течении р. Ильжица в Национальном парке “Смоленское Поозерье”. Диагональная штриховка – Балтийский водосборный бассейн; точечная штриховка – Азово-черноморский водосборный бассейн; стрелки – направление течения, 1–3 – места отбора выборки пескороек для анализа их размерных характеристик.

Водные объекты Национального парка “Смоленское Поозерье” населены миногами двух видов – резидентной формой речной миноги Lampetra fluviatilis (L., 1758) и резидентной миногой Eudontomyzon sp. (Zvezdin et al., 2021). В ходе наших исследований (2018–2021 гг.) в одних реках обнаружены оба вида (р. Половья, р. Сенокосица), в других – только особи Eudontomyzon sp. (р. Ильжица, р. Велицкая) (Звездин и др., 2020).
Наличие одного вида миног в малой равнинной р. Ильжица делает еe удобным модельным полигоном для изучения особенностей обитания пескороек на микроуровне.
Цель работы – анализ распределения личинок Eudontomyzon sp. в реке и оценка разнообразия их местообитаний, основанное на гидрогеоморфологических характеристиках и данных по структуре сообществ зообентоса.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Река Ильжица – приток р. Западная Двина третьего порядка, относится к водосборному бассейну Балтийского моря. Берет начало в оз. Дго и впадает в р. Ельша с левого берега, длина реки – 16.3 км. В верхнем течении река заболочена (на протяжении ~2 км от истока). В летнюю межень в среднем и нижнем течениях реки глубины небольшие – от нескольких сантиметров на перекатах и до 60 см в омутах, ширина – 1–6 м, скорость течения низкая (≤0.34 м/с); в среднем течении грунты преимущественно каменистые, в нижнем – каменисто-песчаные. Ихтиофауна бедная, представлена, в основном, молодью рыб, обитающих в оз. Дго – плотвой Rutilus rutilus (L., 1758), лещом Abramis brama (L., 1758), щукой Esox lucius (L., 1758), обыкновенным гольяном Phoxinus phoxinus (L., 1758).
Исследования проводили в мае–сентябре 2019–2021 гг. в верхнем, среднем и нижнем течениях р. Ильжица (рис. 1). Исток реки из оз. Дго и прилегающую к нему литоральную часть озера обследовали в июне 2019 г., участок в среднем течении – в сентябре 2021 г. Поиск пригодных для нереста миног участков в среднем и нижнем течении реки проводили в мае 2019 г., августе 2020 г. и сентябре 2021 г., работу по типизации биотопов, в которых обитают пескоройки, – с 5 по 7 августа 2020 г. в нижнем течении.
Поиск и описание местообитаний пескороек. В верхнем течении р. Ильжица поиск местообитаний проводили на литорали оз. Дго у истока реки и на ее прилегающем заболоченном участке. Методика и результаты поиска местообитаний пескороек в верхнем течении р. Ильжица были подробно описаны ранее (Zvezdin et al., 2021). В среднем и нижнем течениях реки поиск местообитаний и мест, пригодных для нереста миног, проводили на участках длиной 2 и 2.5 км соответственно. Участки проходили в направлении против течения. Координаты границ участка в среднем течении: начало – 55.61677° с.ш., 31.829925° в.д., конец – 55.617233° с.ш., 31.814891° в.д. Координаты границ участка в нижнем течении: начало – 55.628308° с.ш., 31.872077° в.д.; конец – 55.627951° с.ш., 31.896563° в.д.
В среднем течении изучали плотность поселения и размерно-массовые характеристики пескороек (табл. 1). Работы в нижнем течении реки (рис. 1в) включали в себя картирование реки; в местах обитания миног – отбор проб для определения плотности поселения и размерно-массовых характеристик особей, измерение абиотических характеристик местообитаний и определение состава сообществ зообентоса.
Таблица 1.
Объeм собранного материала и изучаемые характеристики местообитаний пескороек в р. Ильжица
| Исследованные характеристики | Количество исследованных станций | Количество проб/измерений |
|---|---|---|
| Верхнее течение | ||
| Плотность поселения пескороек, экз./м2 | 7 | 20 |
| Среднее течение | ||
| Плотность поселения пескороек, экз./м2 | 4 | 7 |
| Размерные группы пескороек | 4 | 7 |
| Нижнее течение | ||
| Плотность поселения пескороек, экз./м2 | 21 | 28 |
| Скорость течения, м/с | 14 | 14 |
| Глубина, см | 14 | 14 |
| Фракционный состав грунта | 16 | 32 |
| Содержание органического вещества в грунте, % | 16 | 32 |
| Состав сообществ зообентоса | 21/14* | 38 |
| Размерные группы пескороек | 13 | 13 |
На участке в нижнем течении реки обследовали 21 станцию, на каждой отбирали пробы (табл. 1). Всего за время проведения работ в среднем и нижнем течении поймано 597 пескороек.
Абиотические характеристики местообитаний. При описании местообитаний пескороек учитывали скорость течения на участке реки, глубину расположения мест обитания, фракционный состав грунта, содержание органического вещества в грунте.
Скорость течения определяли поплавковым методом. Глубину расположения местообитаний (высоту водного столба над местообитанием) измеряли с помощью мерной рейки. В местах обитания пескороек закладывали поперечный профиль глубин. Пробы грунта объeмом 100 мл отбирали в двух повторностях и высушивали для дальнейшей обработки. Анализ гранулометрического состава грунта проводили с помощью системы почвенных сит. Отдельные фракции взвешивали на весах Ohaus Adventurer Pro (Eleftheriou, 2013).
Классификацию фракций грунта приводили по (Безруков, Лисицын, 1960). Оценку содержания органического вещества в грунте проводили методом сжигания в муфельной печи при 485°С (Eleftheriou, 2013).
Для оценки связи плотности поселения пескороек с абиотическими показателями (глубиной, количеством органического вещества в грунте, течением) рассчитывали коэффициенты корреляции Спирмена.
Для оценки изменения характеристик местообитаний по длине реки проводили картирование обследованного участка с нанесением на схему исследованных характеристик. Привязку к местности осуществляли с помощью GPS-навигатора Garmin eTrex 30x.
Структура сообществ зообентоса в местах обитания личинок. Качественный состав макрозообентоса оценивали визуально при разборе проб для учета плотности поселения пескороек. Количественный состав зообентоса изучали на 14 станциях из 21. Пробы отбирали пробоотборником площадью 1/180 м2 в двух повторностях и промывали через сито с ячеей 0.25 мм. Материал фиксировали 4%-ным формалином. Идентификацию организмов проводили до уровня семейства, используя бинокуляр и световой микроскоп Микромед-3 (Определитель…, 2016). Для определения биомассы беспозвоночных взвешивали с помощью портативных весов ML-CF3. Дополнительно рассчитывали комплексную величину обилия зообентоса как корень отношения суммарной численности к суммарной биомассе зообентоса на станции. При изучении структуры сообществ зообентоса личинок миног количественно не учитывали.
Оценку вклада факторов среды в различия между отдельными станциями проводили многомерным тестом SIMPER (Similarity Percentage), на основании которого выделяли наиболее значимые абиотические показатели и характеристики донных сообществ. Эти показатели включали в последующий анализ, для проведения которого к данным применяли трансформацию:
где х – значения характеристик донных ценозов.
Для предварительной оценки количества групп станций использовали кластерный анализ, кластеризацию проводили методом Варда. Мерой сходства выбрано расстояние Евклида. На основании кластеризации группы станций проанализированы методом главных компонент PCA (Principal component analysis) для выяснения факторных нагрузок и визуализации результата.
Определение плотности поселения пескороек. Поиск и сбор пескороек осуществляли с помощью сети Киналева (0.5 × 0.7 м, кут из дели с размером ячеи 3 мм), которой облавливали дно реки площадью 1 м2 и подсчитывали особей, попавших в сеть. В случае, когда площадь, обловленная сетью Киналева за одну повторность, была <1 м2, проводили перерасчет. Для анализа плотности поселения пескороек использовали данные об обитании 301 особи в возрасте 1+ и старше.
Систематическая принадлежность и характеристика пескороек. У пойманных особей анализировали основные диагностические признаки (форму хвостового плавника и его пигментацию, форму центральной ворсинки и пигментацию полей возле центрального тяжа, число туловищных миомеров), измеряли длину TL (мм) и массу W (г) тела. Размерный состав пескороек анализировали на выборке из 356 особей. Большая часть пескороек (81%) собрана в нижнем течении в точках 1–3 (рис. 1в), остальная – на 10 станциях из 21 на участке в нижнем (15.7%) и на семи станциях в среднем течении р. Ильжица (3.3%).
Размерные группы пескороек выделяли методом частотного анализа. Для оценки зависимости массы от длины отбирали личинок с TL ≥ 70 мм (n = 48), так как использование данных о пескоройках с TL < 70 мм приводит к снижению достоверности регрессионной модели, в связи с бόльшим разбросом индивидуальных показателей массы.
Расчеты и статистическую обработку данных проводили в программах STATISTICA, MS Excel и Past 4. Достоверными считали различия при p < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Систематическая принадлежность. В результате проведенных в 2019–2021 гг. работ в р. Ильжица отловлены производители и личинки миног Eudontomyzon sp. Ни один производитель не принадлежал к виду речная минога (Zvezdin et al., 2021). Их принадлежность к роду Зубатые миноги (Eudontomyzon) по признакам (число рядов верхнегубных зубов, число туловищных миомеров, размер зубов на нижнечелюстной пластинке), используемым в определительной таблице (Renaud, 2011), не вызывала сомнений, однако, по своим характеристикам производители отличались от единственного известного в Балтийском бассейне вида этого рода – украинской миноги Eudontomyzon mariae (Berg, 1931) (расстояние от конца рыла до первого жаберного отверстия, горизонтальный диаметр глаза, длина рыла, особенности окраски, озубления и другие (см. для сравнения Fig. 5, р. 80 в Zvezdin et al., 2021)).
Пескоройки из р. Ильжица (рис. 2) отличаются рядом признаков от личинок из рек, например, Ленинградской обл., где принадлежность к роду Lampetra не вызывает сомнений. Хвостовой плавник пескороек из р. Ильжица более заострен, сильнее пигментирован, форма центральной ворсинки (треугольная) соответствует форме ворсинки миног рода Eudontomyzon, поля возле эластичного тяжа не пигментированы, туловищных миомеров 56–66.
Размерный состав пескороек. Длина TL метаморфных особей (с явными признаками превращения из пескоройки во взрослую особь) достигала 126–151 мм. Принято, что этот диапазон соответствует последнему году личиночной фазы. Длина пескороек в момент или вскоре после выхода из гнезда известна для небольшого числа видов – 7–9 мм (Kucheryavyy et al., 2007; Kirillova et al., 2011; Renaud, 2011; Павлов и др., 2014; Звездин и др., 2017). Во время проведения работ личинки таких размеров не обнаружены. Размерный класс с минимальными значениями TL был 10–29 мм. Всего выделено пять размерных классов (рис. 3а). Зависимость массы от длины тела пескороек на модельном участке описывается регрессионной моделью в 95% случаев (рис. 3б).
Рис. 3.
Распределение личинок Eudontomyzon sp. в среднем и нижнем течениях р. Ильжица по размерным группам (а) и зависимость массы тела от его длины (б).

Распределение размерных групп пескороек в реке. В среднем течении обнаружены личинки всех размерных групп, преобладала группа размером 30–54 мм (42%). В нижнем течении в точках 1–3 (рис. 2) преимущественно встречались пескоройки 30–54 и 55–89 мм (от 82 до 93%). Особи 10–29 мм отмечены в точке 1 – самой удаленной от устья реки и в некоторых станциях ближе к устью (27%). Пескоройки > 120 мм обнаружены в точках 2 и 3, а также в некоторых станциях, расположенных между ними (45.5%). Доля особей этой размерной группы была 6.7%, из них 29% находились в процессе метаморфоза.
Абиотические характеристики местообитаний и типизация биотопов на их основе. Исследованный участок реки в нижнем течении по абиотическим характеристикам, в основном, однороден. Скорости течения в местах обитания пескороек низкие – от 0 (затишные зоны) до 0.34 м/с (в среднем 0.14 ± 0.07 м/с). Глубины в местах обитания в межень небольшие – 7–61 см (28.5 ± 11.25 см). Гранулометрический анализ показал, что на исследованном участке реки преобладают мелкие и средние пески (фракции 0.5–0.1 мм), их доля 46–89% грунта. Алевриты и пелиты (фракции <0.1 мм) играли заметную роль на трех станциях (30–37%), мелкий и средний гравий (крупные фракции, >1 мм) – на шести станциях, составив 19–38%.
Содержание органических веществ в грунте в местах обитания пескороек варьировало от 0.28 до 3.42% (в среднем 1.42 ± 0.59%). На некоторых из исследованных станций по фракционному составу грунта и содержанию органических веществ в нем была сильно выражена микромозаичность – на 1 м2 отмечены разные условия обитания.
На основании морфологических характеристик речного русла выделены пять основных (повторяющихся) типов биотопов (I–V) (рис. 4, табл. 2).
Рис. 4.
Схемы выделенных биотопов личинок Eudontomyzon sp. в р. Ильжица: a – наносы в ямах на излучинах реки (I тип); б – песчаное дно на прямых участках реки (II тип); в – наносы в трубах под мостом (III тип); г – песчано-гравийное нерестилище (IV тип); д – наносы в устье реки (V тип). Стрелки – направление течения; заштрихованные области – места обитания личинок, сплошные прямые линии – завалы.
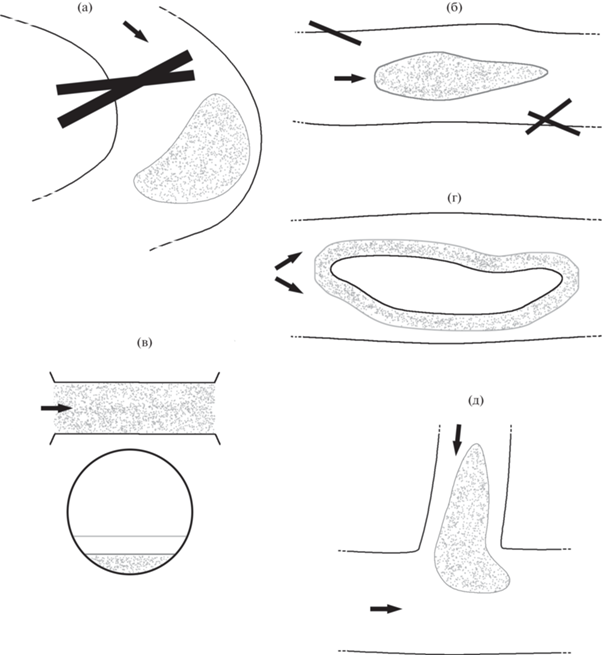
Таблица 2.
Типы биотопов р. Ильжица, в которых обитают пескоройки Eudontomyzon sp., и их характеристика
| Типы биотопов | Характеристика биотопов | |||||
|---|---|---|---|---|---|---|
| N, % | v, м/с | h, см | преобладающие фракции грунта, мм | содержание ОВ в грунте, % | P, экз./м2 | |
| I. Наносы в ямах на излучинах реки | 52.4 | $\frac{{0 - 0.22}}{{0.095 \pm 0.06}}$ | $\frac{{10 - 61}}{{35.39 \pm 12.75}}$ | Пески средние (0.5–0.25) и мелкие (0.25–0.1)* | $\frac{{0.28 - 6.25}}{{1.74 \pm 1.5}}$ | $\frac{{1 - 123}}{{24.63 \pm 30.5}}$ |
| II. Песчаное дно на прямых участках реки | 23.81 | 0.33 | 7 | Пески средние (0.5–0.25) и крупные (1–0.5)* | $\frac{{0.64 - 2.26}}{{1.74 \pm 0.79}}$ | $\frac{{1 - 9}}{{5 \pm 2.89}}$ |
| III. Наносы в трубах под мостом | 4.76 | $\frac{{0.018 - 0.05}}{{0.034 \pm 0.02}}$ | $\frac{{6.5 - 20}}{{12.83 \pm 9.6}}$ | Пески средние (0.5–0.25) и крупные (1–0.5)* | 1.4 | $\frac{{3 - 7}}{{4.67 \pm 2}}$ |
| IV. Песчано-гравийное нерестилище | 9.52 | $\frac{{0.2 - 0.34}}{{0.27 \pm 0.1}}$ | $\frac{{10 - 11}}{{10.5 \pm 0.71}}$ | Пески средние (0.5–0.25) и гравий средний (5–2) | $\frac{{0.35 - 0.39}}{{0.37 \pm 0.03}}$ | $\frac{{4 - 12}}{{8 \pm 5.67}}$ |
| V. Наносы в устье реки | 9.52 | 0.037 | $\frac{{25 - 60}}{{43.75 \pm 17.5}}$ | Пески средние (0.5–0.25) и мелкие (0.25–0.1) | 0.38 | $\frac{{1 - 26}}{{9.2 \pm 10.8}}$ |
Примечание. I–V – типы биотопов. N – доля от числа исследованных станций, %; v – скорость течения; h – глубина; P – плотность поселения пескороек. Над чертой – min–maх под чертой – среднее арифметическое ± стандартное отклонение (M ± SE); * – над грунтом находился слой органического мусора растительного происхождения.
При оценке связи плотности поселения пескороек и абиотических показателей сильных достоверных корреляций не выявлено. Слабая достоверная корреляция присутствует между такими показателями как плотность поселения пескороек и глубина (r = 0.59), и содержание органического вещества (r = 0.53). Корреляции между плотностью поселения и скоростью течения не отмечено (r = 0.3). Коэффициент корреляции между глубиной и содержанием органического вещества составил 0.58. Коэффициент корреляции между глубиной и процентным массовым содержанием самой мелкой фракции грунта (<0.1 мм) – 0.6.
Пространственное распределение пескороек в реке. Гравийно-песчаные участки реки, пригодные для нерестилищ, были обнаружены в среднем и нижнем течениях р. Ильжица. В среднем течении обследованный в сентябре 2021 г. участок длиной 2 км практически на всем своем протяжении подходит для нереста миног. В нижнем течении обнаружено 5 участков, на которых грунты пригодны для нереста (рис. 1в). В мае 2019 и 2021 гг. на четырех из них был отмечен массовый нерест производителей Eudontomyzon sp. Установлено, что пескоройки не обитают в истоке и в прилегающей к истоку литоральной части оз. Дго, наличие подходящих для нереста грунтов здесь не выявлено (Zvezdin et al., 2021).
Пескоройки обнаружены на всех исследованных участках среднего и нижнего течения и во всех типах биотопов. Ряд значений плотности их поселения с помощью частотного анализа разбили на пять категорий (табл. 3).
Таблица 3.
Плотность поселения пескороек Eudontomyzon sp. в различных типах биотопов на обследованном участке в нижнем течении р. Ильжица
| Плотность поселения | Диапазон значений плотности поселения, экз./м2 | Доля проб, % | Типы биотопов |
|---|---|---|---|
| Очень низкая | 0–2 | 250 | I, II, V |
| Низкая | 3–7 | 46.43 | I, II, III, IV, V |
| Средняя | 8–20 | 14.29 | I, II, IV |
| Высокая | 21–54 | 3.57 | V |
| Очень высокая | >54 | 10.7 | I |
Примечание. Типы биотопов см. табл. 2.
В среднем течении реки плотность поселения была очень низкой или низкой (71 и 29% станций), в нижнем – низкой; высокая и очень высокая плотности поселения были отмечены редко. Биотопы I, II и V типов, вероятно, являются наиболее плотно заселенными.
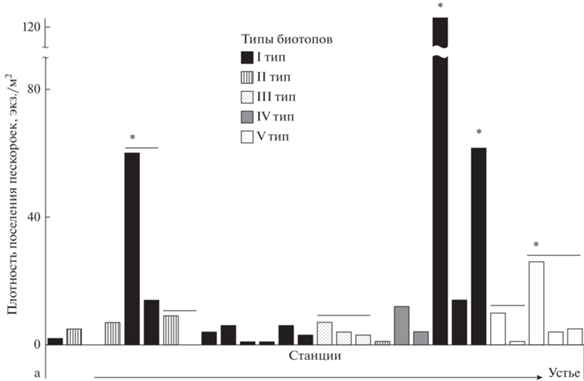
На участке в нижнем течении реки отметили четыре станции, на которых плотность поселения личинок была выше средней: две из них расположены ниже известных нерестилищ, одна – яма на излучине реки у устья и одна – наносы в р. Ельша (рис. 5).
Рис. 5.
Распределение плотности поселения пескороек Eudontomyzon sp. на продольном профиле участка в нижнем течении р. Ильжица. * – станции, на которых плотность поселения пескороек была выше средней. Под чертой помещены пробы, относящиеся к одной станции, а - точка 1 на рис. 1в.
Сообщества зообентоса в местообитаниях пескороек. Зообентос реки представлен следующими группами: мшанки (Bryozoa), губки (Porifera), олигохеты (Oligochaeta), пиявки (Hirudinea), брюхоногие (Gastropoda: Valvatidae, Planorbidae, Lymnaeidae) и двустворчатые (Bivalvia: Sphaeriidae) моллюски; двукрылые (Diptera: Chironomidae, Ceratopoganidae и др.), поденки (Ephemeroptera), жесткокрылые (Coleoptera), вислокрылые (Megaloptera), стрекозы (Odonata), ручейники (Trichoptera), клопы (Heteroptera). В составе сообществ зообентоса отмечены представители 20 семейств и 10 отрядов. На станциях чаще всего встречались личинки хирономид (100% проб) и малощетинковых червей (86%), также личинки стрекоз (67%), жуков (62%) и двустворчатые моллюски (62%).
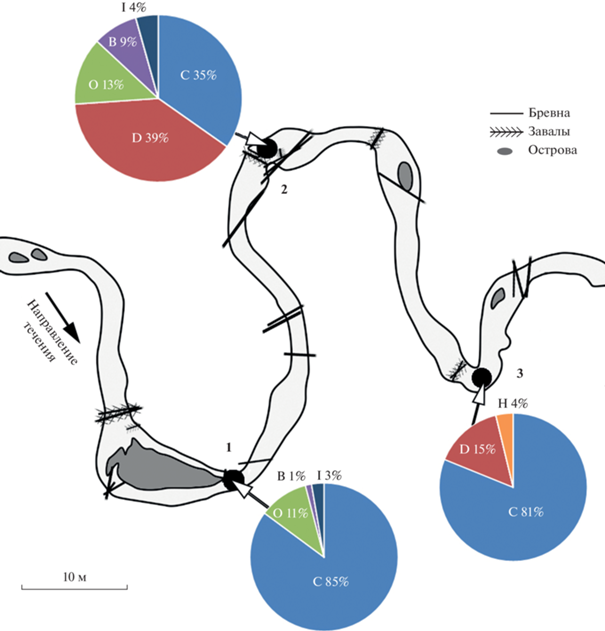
Численность организмов в сообществах зообентоса варьировала в пределах 1638–15925 экз./м2 (в среднем 5324 ± 3113 экз./м2). Минимальная численность отмечена в биотопе I типа, максимальная – III типа. Основу сообществ зообентоса по численности представляла группа хирономид, ее относительное обилие на станциях достигало 35–100%. Только на одной станции представители этой группы не преобладали (рис. 6): в биотопе I типа (в омуте) относительное обилие других двукрылых было 39%, хирономид – 35%.
Рис. 6.
Примеры соотношения численности систематических групп сообществ зообентоса в местах обитания личинок Eudontomyzon sp. в нижнем течении р. Ильжица. 1 и 3 – типичные и 2 – нетипичное сообщества зообентоса. B – Bivalvia, С – Chironomidae, D – прочие Diptera, H – Hirudinea, I – Insecta, O – Oligochaeta. Точка 1 – биотоп IV типа, точки 2 и 3 – биотопы I типа.
Обилие макрозообентоса по биомассе изменялось от 3.9 до 61.3 г/м2 (в среднем 15.2 ± ± 13.2 г/м2). Минимальная и максимальная биомассы отмечены в биотопах I типа. Преобладание хирономид по биомассе отмечено на 36% всех станций, двустворчатых моллюсков – на 26% станций, прочих двукрылых и насекомых – на 14% станций, пиявок – на 7% станций.
Результаты проведенного анализа SIMPER демонстрируют вклад отдельных факторов среды в различия между станциями. Наиболее важные показатели, вносившие ≥ 10% и суммарно объясняющие 77% всех пространственных различий, – глубина, фракции грунта с диаметром частиц 0.5–0.25, 0.25–0.1 и < 0.1 мм, а также сама плотность поселения пескороек. Общий уровень гетерогенности станций достигал 39%. Эти показатели, вместе с общей численностью, биомассой зообентоса и комплексной величиной обилия зообентоса, были включены в последующий кластерный анализ. По его результатам все станции разделились на 3 кластера. Первый включал только станции с биотопом I типа (наносы в ямах на излучинах реки), второй – был разнородным и включал в себя биотопы I, II, IV и V типов, третий – биотопы I и III типов (рис. 7).
Рис. 7.
Дендрограмма сходства станций по основным характеристикам донных ценозов. I–V – типы биотопов, 1–3 – номера кластеров.

Методом главных компонент выделены основные факторные нагрузки, обусловившие различия между группами станций, выделенными на основании кластерного анализа (рис. 8). Максимальные положительные нагрузки по первой компоненте, обусловившие основное расхождение станций по оси абсцисс, имели глубина, фракции грунта < 0.25 мм и плотность поселения пескороек на станции. Отрицательные нагрузки были у численности зообентоса и фракции грунта 0.5–0.25 мм. Биомасса зообентоса (без личинок миног) и комплексная величина обилия зообентоса вносили наибольший вклад в распределение станций вдоль второй главной компоненты (ось ординат).
Рис. 8.
Расположение станций в системе главных компонент. 1–3 – номера кластеров (соответствуют рис. 7). А – фракции грунта 0.5–0.25 мм, Б – численность зообентоса, В – комплексная величина обилия зообентоса, Г – биомасса зообентоса, Д – плотность поселения пескороек, Е – глубина, Ж – фракции грунта < 0.1 мм, З – фракции грунта 0.25–0.1 мм.
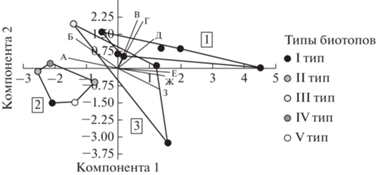
Первая компонента показала распределение станций по глубине от наиболее мелких, с преобладанием средних песков (слева по оси абсцисс) до относительно глубоких с преобладанием самых мелких фракций грунта (справа по оси абсцисс). Вторая компонента распределила станции относительно обилия на них организмов зообентоса (комплексной величины обилия зообентоса и общей биомассы зообентоса).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Река Ильжица в своем среднем и нижнем течении почти повсеместно заселена миногами, что позволило использовать ее как модельный объект и провести типизацию местообитаний пескороек. По комплексу абиотических и биотических характеристик реку можно считать состоящей из повторяющихся основных типов биотопов и их гидрогеоморфологических вариаций (за исключением верхнего течения).
Состав грунта на исследованном участке относительно однороден (рис. 9). Но на станциях с бóльшими глубинами воды и с замедленным течением (биотопы I типа) происходит накопление самых мелких фракций (алевритовых илов). В устье реки (биотоп V типа) состав грунта схож с таковым в биотопах I типа, но отличается меньшим содержанием фракций диаметром < 0.1 мм, что, вероятно, связано с влиянием гидрологического режима более крупной р. Ельша – сильное течение вымывает мелкие фракции. Доля крупных песков и гравия увеличивается на прямых участках с небольшими глубинами и более быстрым течением (биотопы II и IV).
Анализ распределения личинок Eudontomyzon sp. показал, что в нижнем течении реки они обитают преимущественно в песчаных грунтах, в которых преобладают фракции 0.5–0.25 и 0.25–0.1 мм. Наибольшие плотности поселения пескороек отмечены при увеличении в грунте доли частиц размером < 0.25 мм (рис. 9). Грунты со сходными размерами частиц предпочитают пескоройки морской миноги Petromyzon marinus (L., 1758) (Taverny et al., 2012), австралийской миноги Geotria australis (Gray, 1851) (Potter et al., 1986), американской речной миноги Lethenteron appendix (DeKay, 1842) (Beamish, Lowartz, 1996) и малой ручьевой миноги Lampetra aepyptera (Abbott, 1860) (Smith et al., 2011). Личинки украинской миноги избегают фракций 0.5–0.25 мм и предпочитают крупные алевриты (0.125–0.063 мм) (Jazdzewski et al., 2016).
Скорости течения в местообитаниях пескороек Eudontomyzon sp. не превышали 0.34 м/с, что согласуется с данными, приведенными у других авторов. В местах обитания личинок речной, тихоокеанской Lethenteron camtschaticum (Tilesius, 1811) (Nazarov et al., 2016) и украинской миног (Jazdzewski et al., 2016) скорости течения варьировали в пределах 0.1–0.3 м/с. По данным (Thomas, 1962), максимальные скорости течения, при которых могут обитать пескоройки морской миноги достигают 0.8 м/с. Следует отметить, что на прямых участках и на гравийных плесах (II и IV типы биотопов) скорость течения выше, чем в остальных биотопах.
Хотя в изученных местообитаниях пескоройки Eudontomyzon sp. живут в типичных для личинок миног условиях, выраженная связь между плотностью поселения и значениями факторов среды не была обнаружена. Полученные низкие значения коэффициентов корреляции могут быть связаны с небольшим объемом выборки или узким диапазоном значений параметров, поэтому на настоящий момент можно говорить лишь о тенденциях и необходимости дальнейшего, более детального изучения данного вопроса.
Макрозообентос в изученных точках был представлен типично реофильными формами, характерными для плесов и затишных участков рек (Лабай, 2007; Богатов, Федоровский, 2017; Барышев, 2019). Его обилие по численности и биомассе в р. Ильжица хорошо согласуется с таковыми в других малых реках разных регионов (Зинченко, Головатюк, 2000; Заика, Молодцов, 2013; Зинченко и др., 2016; Барышев, 2019). Поскольку в р. Ильжица отсутствуют выраженные заросли макрофитов, таксономический состав бентоса беден. Донные сообщества плесов отличаются высоким обилием первичноводных животных – олигохет и двустворчатых моллюсков (Барышев, 2019), встречаемость организмов этих групп на исследованных точках была 86% и 62%. Однако абсолютным доминантом по целому ряду показателей и в сообществах рек (Балушкина, 1987), и в сообществе р. Ильжица являются личинки хирономид. Таким образом, биотопы, в которых обитают личинки Eudontomyzon sp., в нижнем течении р. Ильжица относятся к хирономидным местообитаниям.
Статистический анализ комплекса данных показал, что различия между отдельными станциями в первую очередь обусловлены фракционным составом грунта, глубиной, содержанием органического вещества, обилием макрозообентоса. Хорошо выделяется только биотоп I типа, где увеличение глубин и замедление течения способствуют накоплению органического вещества, соответственно увеличивается обилие и макробеспозвоночных, и пескороек. Присутствие станций с биотопом I типа в других кластерах (рис. 7) наиболее вероятно связано с большой вариативностью его показателей (табл. 2).
Участок в нижнем течении реки состоит, главным образом, из трех чередующихся типов местообитаний: наносы в ямах на излучинах, песчаные наносы на прямых участках реки и песчано-гравийные нерестилища (биотопы I, II, IV типов). Они, а также наносы в устье реки (V тип), относятся к естественным структурным повторяющимся элементам малых равнинных рек. Тип биотопа наносы в трубах под мостом (III тип) можно рассматривать как биотоп антропогенного происхождения. Бетонное основание труб не позволяет ему развиваться вглубь и закрепляться, наносы органического мусора в таком канальном биотопе периодически смываются и образуются снова, соответственно, и его население характеризуется меньшим постоянством, но имеющиеся результаты позволяют сделать вывод о его пригодности для обитания пескороек.
Выделенные типы биотопов в целом соответствуют описанным у (Nazarov et al., 2016) типичным местообитаниям личинок тихоокеанской, речной и малой Lethenteron ninae (Naseka, Tuniyev & Renaud, 2009) миног Евразии: наносы в ямах на излучинах реки (I тип) соответствуют крутому склону дна реки (steep river bank), песчаное дно на прямых участках реки (II тип) – пологому дну реки на участках с замедленным течением (inclined riverbank on low-velocity stream reaches), песчано-гравийное нерестилище (IV тип) – песчаной косе в русле реки (riverbed sandbar), наносы в устье реки (V тип) – наносам в устьях ручьев (delta at the mouth of a brook). Таким образом, наши результаты подтвердили, что пескоройки Eudontomyzon sp. предпочитают такие же типы биотопов, что и пескоройки других видов.
Возможно также сопоставление выделенных в р. Ильжица биотопов с более общей классификацией, широко используемой при исследовании популяций миног (Slade et al., 2003; Yap, Bowen, 2003). Она основана на качественной оценке состава грунтов, в ней выделяют три категории местообитаний: I категория – предпочтительные – расположены в зонах осадконакопления, состоят из смеси песка и мелкодисперсного органического вещества, плотность поселения пескороек в них высока; II – пригодные – обычно состоят из подвижного песка, который может содержать некоторое количество гравия, плотность поселения пескороек заметно ниже; III – неприемлемые – состоят из неподходящих для зарывания пескороек субстратов: плотный гравий, твердый слой глины или коренная порода. В р. Ильжица к предпочтительным местообитаниям можно отнести наносы в ямах на излучинах реки и наносы в устье реки, т.е. биотопы, располагающиеся в зонах аккумуляции донных отложений; к пригодным местообитаниям – песчано-гравийное нерестилище, наносы в трубах под мостом и песчаное дно на прямых участках реки, т.е. биотопы в зонах транспортировки песков. Наносы в трубах под мостом, вероятно, не могут обеспечить продолжительное существование в них пескороек, поскольку подвержены более частому разрушению в результате смыва, чем другие биотопы, в которых происходит осадконакопление – они временно пригодны.
Незаселенные пескоройками верховья р. Ильжица представляют собой заболоченные местообитания с неблагоприятным гидрохимическим режимом, мягкими илистыми отложениями большой мощности и высокой степенью зарастания водной и околоводной растительностью. Формально по качественному составу грунта они могут быть отнесены к I категории, но фактически верховья реки являются неприемлемыми местообитаниями. В связи с этим, целесообразно относить к III категории (неприемлемые) не только местообитания с неподходящими для зарывания грунтами, но и заболоченные территории без выраженного течения.
Река Ильжица почти на всем своем протяжении представлена предпочтительными и пригодными местообитаниями, однако существуют факторы, негативно влияющие на популяцию миног. В жаркие засушливые периоды здесь, в связи с понижением уровня воды, возможно образование отшнуровывающихся водоемов, схожих с енисейскими ваннами, описанными в работе (Nazarov et al., 2016), но меньшего размера. Постоянное обитание пескороек на подобных участках маловероятно, поскольку при продолжительном жарком периоде вода сильно прогревается. Также в засушливые периоды русло р. Ильжица может частично обсыхать, обнажая перекаты с нерестовыми участками и приводя к гибели икры и личинок, как это, вероятно, произошло в 2019 г. (неопубликованные данные авторов). Другой негативный фактор – потенциальные хищники – гольяны, выедающие икру на нерестилищах, и щуки, которые могут охотиться на миног (Renaud, 2011).
Пескоройки всех размерных групп обнаружены в среднем и в нижнем течении р. Ильжица, т.е. условия в реке пригодны для обитания личинок всех возрастов и формирования взрослых особей. Низкую долю пескороек размерной группы 10–29 мм в реке можно объяснить двумя причинами: селективностью орудия лова и неблагоприятными условиями инкубации икры (обсыхание нерестилищ и аномальное повышение температуры воды), которые привели к массовой гибели поколения миног 2019 г. (неопубликованные данные авторов). Низкое количество крупных пескороек, предметаморфных и метаморфных особей в реке, вероятно, связано с тем, что основная часть личинок при достижении размера > 120 мм скатывается в более крупную р. Ельша или погибает. Уравнение кривой зависимости массы от длины пескороек (рис. 3б) не подтверждает предположение о недостаточности кормовых ресурсов в р. Ильжица, как одной из возможных причин их гибели или ската из реки, поскольку относительная масса тела только увеличивается.
Полученные результаты не согласуются с мнением, что пескоройки ведут малоподвижный образ жизни (Pirtle et al., 2003; Torgensen, Close, 2004; Cochnauer et al., 2006). Напротив, наблюдаемое распределение размерных групп пескороек в р. Ильжица свидетельствует о миграционной активности, которая, вероятно, схожа с таковой пескороек в других реках. Ряд авторов (White, Harvey, 2003; Close et al., 2009; Kirillova et al., 2011) показали, что миграция происходит, главным образом, вниз по течению, и, кроме того, возможны перемещения крупных особей вверх по течению.
Выводы. Установлено, что малая равнинная р. Ильжица, в целом, однородна по своим геоморфологическим характеристикам и состоит из определенного набора биотопов. Она заселена личинками миног на всем своем протяжении, за исключением заболоченных верховьев. Однако распределение пескороек по длине реки неравномерно – их плотность поселения в нижнем течении выше, чем в среднем; а в наносах в ямах на излучинах и в наносах в устье реки выше, чем в остальных типах местообитаний.
При сравнении различных биотопов показано, что мозаичность распределения личинок Eudontomyzon sp. в р. Ильжица связана с расположением предпочтительных местообитаний. Последние приурочены к зонам аккумуляции донных отложений – затишным участкам с грунтами, сложенными мелким и средним песком. Сообщества зообентоса в местообитаниях пескороек представлены реофильными видами, среди которых доминируют личинки хирономид.
Список литературы
Балушкина Е.В. 1987. Функциональное значение личинок хирономид в континентальных водоемах. Ленинград: Наука.
Барышев И.А. 2019. Макрозообентос рек Восточной Фенноскандии: Автореф. дис. … докт. биол. наук: 03.02.10 – Гидробиология. Петрозаводск: КарНЦ РАН. 46 с.
Безруков П.Л., Лисицын А.Н. 1960. Классификация осадков современных морских водоемов // Труды института океанологии. Т. 32. С. 3.
Богатов В.В., Федоровский А.С. 2017. Основы речной гидрологии и гидробиологии. Владивосток: Дальнаука.
Гриценко О.Ф. 2002. Проходные рыбы острова Сахалин (систематика, экология, промысел). Москва: Изд-во ВНИРО.
Заика В.В., Молодцов В.В. 2013. Распределение реофильного бентоса в горных реках Тувы с субаэральными дельтами // Сиб. экол. журн. Т. 20. № 3. С. 361.
Звездин А.О., Павлов Д.С., Кучерявый А.В., Цимбалов И.А. 2017. Экспериментальное изучение миграционного поведения речной миноги Lampetra fluviatilis в период первичного расселения // Биология внутр. вод. № 2. С. 94. https://doi.org/10.7868/S032096521702019X
Звездин А.О., Полякова Н.В., Кучерявый А.В., Хохряков В.Р. 2020. Особенности биологии непаразитической миноги Eudontomyzon sp. в национальном парке “Смоленское поозерье” // Мониторинг состояния и методы сохранения природных комплексов национального парка. Летопись природы. Кн. 14. П. Пржевальское: Национальный парк “Смоленское Поозерье”. С. 163.
Зинченко Т.Д., Головатюк Л.В. 2000. Изменение состояния бентоса малых рек бассейна Средней Волги // Изв. Самарск. науч. центра РАН. Т. 2. № 2. С. 257.
Зинченко Т.Д., Головатюк Л.В., Абросимова Э.В., Промахова Е.В. 2016. Применение биотических идентификаторов для оценки качества поверхностных вод (на примере малых рек бассейна нижней Волги) // Астраханский вестник экологического образования. № 3(37). С. 61.
Лабай В.С. 2007. Распределение бентоса в нижней ритрали р. Поронай под воздействием некоторых абиотических факторов среды // Тр. СахНИРО. Т. 9. С. 184.
Определитель зоопланктона и зообентоса пресных вод Европейской России. Т. 2. Зообентос. Москва: Тов-во науч. изданий КМК. 2016.
Павлов Д.С., Назаров Д.Ю., Звездин А.О., Кучерявый А.В. 2014. Покатная миграция ранних личинок европейской речной миноги Lampetra fluviatilis // Доклады академии наук. Т. 459. № 2. С. 248. https://doi.org/10.7868/S0869565214320231
Aronsuu K., Vikström R., Marjomäki T.J. et al. 2019. Rehabilitation of two northern river lamprey (Lampetra fluviatilis) populations impacted by various anthropogenic pressures: lessons learnt in the past three decades. Proceedings of the department of biological and environmental science, University of Jyväskylä. V. 2. P. 53.
Beamish F.W.H., Lowartz S. 1996. Larval habitat of American brook lamprey // Can. J. Fish Aquat. Sci. V. 53. P. 693. https://doi.org/10.1139/f95-232
Claire C.W., Cochnauer T.G., LaBar G.W. 2007. Pacific lamprey ammocoete habitat utilization in Red River, Idaho. Status, distribution, and conservation of freshwater fishes of western North America: a symposium proceedings. American Fisheries Society, Symposium 53, Bethesda. P. 151.
Close D.A., Currens K.P., Jackson A. et al. 2009. Lessons from the reintroduction of a noncharismatic, migratory fish: Pacific lamprey in the Upper Umatilla River, Oregon // Am. Fish. Soc. Symp. 72. P. 1–21.
Cochnauer T., Claire C., Putnam S. 2006. Evaluate status of Pacific lamprey in the Clearwater River and Salmon River drainages, Idaho. 2005 Annual Report, Project No. 200002800, 92 electronic pages, (BPA Report DOE/BP-00020623-1).
Dawson H.A., Quintella B.R., Almeida P.R. et al. 2015. The ecology of larval and metamorphosing lampreys // Lampreys: Biology, Conservation and Control, Fish & Fisheries Series 37. P. 75.
Eleftheriou A. 2013. Methods for the study of marine benthos. Chichester: John Wiley & Sons.
Goodwin C.E., Dick J.T.A., Rogowski D.L., Elwood R.W. 2008. Lamprey (Lampetra fluviatilis and Lampetra planeri) ammocoete habitat associations at regional, catchment and microhabitat scales in Northern Ireland // Ecol. Freshwater Fish. V. 17. P. 542. https://doi.org/10.1111/j.1600-0633.2008.00305.x
Hardisty M.W. 1979. Biology of the cyclostomes. London: Chapman and Hall.
Hardisty M.W., Potter I.C. 1971. The behavior, ecology and growth of larval lampreys // The biology of lampreys. V. 1. London: Academic Press. P. 85.
Jazdzewski M., Marszal L., Przybylski M. 2016. Habitat preferences of Ukrainian brook lamprey Eudontomyzon mariae ammocoetes in the lowland rivers of Central Europe // J. Fish Biol. V. 88. P. 477. https://doi.org/10.1111/jfb.12806
Jellyman D.H., Glova G.J. 2002. Habitat use by juvenile lampreys (Geotria australis) in a large New Zealand river // New Zeland J. Marine Freshwater Res. V. 36. P. 503.
Kelso J.R.M., Todd P.R. 1993. Instream size segregation and density of Geotria australis ammocoetes in two New Zealand streams // Ecol. Freshwater Fish. V. 2. P. 108. https://doi.org/10.1111/j.1600-0633.1993.tb00090.x
Kirillova E.A., Kirillov P.I., Kucheryavyy A.V., Pavlov D.S. 2011. Downstream migration in ammocoetes of the Arctic lamprey in some Kamchatka rivers // J. Ichthyol. V. 51. № 11. P. 1117. https://doi.org/10.1134/S0032945211110051
Kucheryavyy A.V., Savvaitova K.A., Pavlov D.S. et al. 2007. Variations of life history strategy of the arctic lamprey Lethenteron camtschaticum from the Utkholok River (Western Kamchatka) // J. Ichthyol. V. 47. P. 37. https://doi.org/10.1134/S0032945207010055
Malmqvist B. 1980. Habitat selection of larval brook lampreys (Lampetra planeri, Bloch) in a south Swedish stream // Oecologia 45. P. 35. https://doi.org/10.1007/BF00346704
Nazarov D.Yu., Kucheryavyy A.A., Pavlov D.S. 2016. Distribution and habitat types of the lamprey larvae in rivers across Eurasia // Jawless fishes of the World. V. 1. Cambridge: Cambridge Scholars Publisher. P. 280.
Pirtle J., Stone J., Barndt S. 2003. Evaluate habitat use and population dynamics of lampreys in Cedar Creek // In: Annual report 2002. Project No. 2000-01400: Bonneville Power Administration, Portland. P. 34.
Potter I.C., Hilliard R.W., Bradley J.S., McKay R.J. 1986. The influence of environmental variables on the density of larval lampreys in different seasons // Oecologia. V. 70. P. 433. https://doi.org/10.1007/BF00379508
Potter I.C., Rogers M.J. 1972. Oxygen consumption in burrowed and unburrowed ammocoetes of Lampetra planeri // Comp. Biochem. Physiol. 41. P. 427. https://doi.org/10.1016/0300-9629(72)90073-4
Quintella B.R., Andrade N.O., Dias N.M., Almeida P.R. 2007. Laboratory assessment of sea lamprey larvae burrowing performance // Ecol. Freshwater Fish 16. P. 177. https://doi.org/10.1111/j.1600-0633.2006.00209.x
Renaud C.B. 2011. Lampreys of the World. An illustrated catalogue of lamprey species known todate. FAO species catalogue for fishery purposes 5. Rome: FAO. P. 109.
Shirakawa H., Yanai S., Goto A. 2013. Lamprey larvae as ecosystem engineers: physical and geochemical impact on the streambed by their burrowing behavior // Hydrobiologia. V. 701. P. 313. https://doi.org/10.1007/s10750-012-1293-8
Shirakawa H., Yanai S., Kouchi K. 2009. Habitat selection of fluvial lamprey larvae Lethenteron japonicum change with growth stage // Ecol. Civil. Eng. V. 12. P. 87. https://doi.org/10.3825/ece.12.87
Slade J.W., Adams J.V., Christie G.C. et al. 2003. Techniques and methods for estimating abundance of larval and metamorphosed sea lampreys in Great Lakes tributaries, 1995 to 2001 // J. Great Lakes Res. 29 (Suppl. 1). P. 137. https://doi.org/10.1016/S0380-1330(03)70483-3
Smith D.M., Welsh S.A., Turk P.J. 2011. Selection and preference of benthic habitat by small and large ammocoetes of the least brook lamprey (Lampetra aepyptera) // Environ. Biol. Fish. V. 91. P. 421. https://doi.org/10.1007/s10641-011-9800-8
Smith D.M., Welsh S.A., Turk P.J. 2012. Available benthic habitat type may influence predation risk in larval lampreys // Ecol. Freshwater Fish. V. 21. P. 160. https://doi.org/10.1111/j.1600-0633.2011.00532.x
Sugiyama H., Goto A. 2002. Habitat selection by larvae of a fluvial lamprey, Lethenteron reissneri, in a small stream and an experimental aquarium // Ichthyol. Res. V. 49. P. 62. https://doi.org/10.1007/s102280200006
Taverny C., Lassalle G., Ortusi I. et al. 2012. From shallow to deep waters: habitats used by larval lampreys (genus Petromyzon and Lampetra) over a western European basin // Ecol. Freshwater Fish. V. 21. P. 87–99. https://doi.org/10.1111/j.1600-0633.2011.00526.x
Thomas M.L.H. 1962. Observations on the ecology of ammocoetes of Petromyzon marinus L. and Entosphenus (Lampetra) lamottei (LeSueur) in the Great Lakes watershed // MSc thesis, University of Toronto, ON.
Torgersen C.E., Close D.A. 2004. Influence of habitat heterogeneity on the distribution of larval Pacific lamprey (Lampetra tridentata) at two spatial scales // Freshwater Biol. V. 49. P. 614. https://doi.org/10.1111/j.1365-2427.2004.01215.x
White J.L., Harvey B.C. 2003. Basin-scale patterns in the drift of embryonic and larval fishes and lamprey ammocoetes in two coastal rivers // Environ. Biol. Fish. V. 67. P. 369. https://doi.org/10.1023/A:1025891216345
Yap M.R., Bowen S.H. 2003. Feeding by northern brook lamprey (Ichthyomyzon fossor) on sestonic biofilm fragments: habitat selection results in ingestion of a higher quality diet // J. Great Lakes Res. V. 29 (Suppl. 1). P. 15. https://doi.org/10.1016/S0380-1330(03)70475-4
Young R.J., Kelso J.R.M., Weise J.G. 1990. Occurrence, relative abundance, and size of landlocked sea lamprey (Petromyzon marinus) ammocoetes in relation to stream characteristics in the Great Lakes // Can. J. Fish and Aquat. Sci. V. 47. P. 1773. https://doi.org/10.1139/f90-201
Zvezdin A.O., Polyakova N.V., Kucheryavyy A.V. et al. 2021. Discovery of Eudontomyzon sp. (Petromyzontidae) larvae in lakes and a characterisation of their habitats // Nature Conservation Res. V. 6(3). P. 73. https://doi.org/10.24189/ncr.2021.039
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод




