Биология внутренних вод, 2023, № 1, стр. 35-43
Состав и структура альгоценозов бентали крупной эвтрофированной реки (на примере р. Ока, Россия). Сообщение 2. Показатели обилия и видовое разнообразие сообществ
Т. Хедаириа a, *, А. Г. Охапкин a, В. Н. Якимов a
a Институт биологии и биомедицины, Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: khedairia.ta@gmail.com
Поступила в редакцию 28.03.2022
После доработки 06.05.2022
Принята к публикации 06.09.2022
- EDN: KSFLFY
- DOI: 10.31857/S0320965223010072
Аннотация
Охарактеризовано количественное (численность, биомасса) развитие и пространственная неоднородность видовой структуры (видовое разнообразие, выровненность, доминирование) альгоценозов бентали устья крупной эвтрофно-гипертрофной реки после спада половодья. Продемонстрировано сходство и различие видовой структуры в разных типах сообществ бентали с более сложной организацией эпилитона и эпифитона на начальной стадии колонизации субстрата. Выявлены связи этих показателей с определяющими факторами среды обитания в условиях отсутствия биогенного лимитирования.
ВВЕДЕНИЕ
Альгоценозы бентали – важнейший компонент водных экосистем, определяющий их разнообразие и продуктивность. Важнейшие характеристики любых биотических сообществ – их видовое богатство и видовое разнообразие (Maguarran, 2004), определяющие через показатели обилия и продуцирования органического вещества устойчивость водных сообществ (Алимов, 2017), а также способность водоемов поддерживать тот или иной уровень продуктивности и через динамику функциональных характеристик биоценозов – качество воды и экологическое состояние водных объектов. Изучение структурных особенностей видового разнообразия при взаимодействии со средой обитания – фундаментальная задача водной экологии. Закономерности формирования и поддержания разнообразия сообществ привлекают внимание исследователей со второй половины XX в., в том числе и при изучении альгоценозов бентали (Ács, Kiss, 1993; Sabater, 2000; Щербак, Козийчук, 2016). Мониторинг экологического состояния водных объектов невозможен без определения базовых характеристик водных сообществ, в том числе и биоценозов дна, на основе которых можно выделить антропогенную составляющую общей изменчивости их структурных и функциональных показателей. Альгоценозы бентали крупнейшего водотока Европейской части России – р. Окa до сих пор находятся на начальной стадии изучения, поскольку основное внимание при исследовании водорослей уделяли фитопланктону (Rivers…, 2021). Для устьевого участка реки имеются сведения о составе и индикационных свойствах диатомовых микрофитобентоса, перифитона и прибрежно-водных растений (Охапкин, Хедаириа, 2019; Хедаириа, 2019, 2021; Хедаириа, Охапкин, 2020, 2021; Хедаириа и др., 2022a). Динамика состава, обилия, и их связи с факторами внешней среды не изучены.
Цель работы – охарактеризовать количественные параметры и основные компоненты видовой структуры альгоценозов, оценить пространственную неоднородность этих показателей в устьевом участке эвтрофно-гипретрофной р. Окa в мае 2019 г. в зависимости от факторов среды.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Пробы фитобентоса (66) отбирали на 10 станциях, расположенных в рипали устьевого участка р. Ока в пределах г. Нижний Новгород в третьей декаде мая 2019 г. Станции 1–5 располагались вдоль правого берега на расстоянии 4.0 км от впадения реки в р. Волга, остальные – вдоль левого берега на расстоянии 6.6 км. Методические подходы к отбору и обработке проб приведены ранее (Охапкин и др., 2019). В период отбора проб температура воды (Temp) колебалась от 17.5 до 21.8°С, прозрачность (Transp) была стабильно низкой (0.4–0.8 м), электропроводность (Elect) изменялась в пределах 522–568 μS/cm, а рН варьировала от 8.3 до 8.7.
Грунты изученного участка рипали р. Ока представлены в основном илами и сильно заиленными песками с вкраплением каменистого субстрата, сформированного преимущественно известняками. Высшая водная и прибрежно-водная растительность весной была развита слабо и сформирована отдельными экземплярами стрелолиста и немногочисленными особями кубышки и рдеста.
Подходы к отбору проб и их камеральной обработке приведены ранее (Хедаириа и др., 2022a, 2022б). Численность (N) фитобентоса подсчитывали в камере Учинская высотой 0.1 мм и выражали в млн клеток на 10 см2, рассчитывая по формуле:
N = ((AV0 × 40)/(V1nS)) × 10,
где A – общее количество подсчитанных при количественном учете клеток; n – число просчитанных полос камеры; V0 – начальный объем образца, образованного из водорослей (мл); V1 – объем просмотренной пробы; S – общая поверхность субстрата, обработанного при взятии пробы.
Биомассу (мг/10 см2) подсчитывали счетно-объемным методом по работам (Комулайнен, 2003; Метелевa, 2013). Доминирующими считали таксоны, биомасса или численность которых превышала или была равна 10% суммарных величин.
Для оценки структурного разнообразие альгоценозов использовали индексы видового разнообразия Шеннона–Уивера (Hb), доминирования Симпсона (D) и выровненности Пиелу (E) (Одум, 1975; Песенко, 1982; Шитиков и др., 2003). Полученные данные обрабатывали в среде R – открытой программной среде для статистических вычислений и моделирования (R Core Team, 2019).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Численность альгофлоры бентали устьевого р. Окa на различных субстратах изменялась от 0.23 до 280.8 млн кл./10 см2, биомасса – от 0.23 мг до 379.1 мг/10 см2. Наибольшие средние показатели количественного развития отмечены для эпипелона, наименьшие – для эпифитона. Интенсивность развития обрастаний эпилитона была ниже по численности в среднем в 2.5 раза, по биомассе – в 7.3 раз, чем эпипелона (табл. 1).
Таблица 1.
Общая численность (N, млн кл./10 см2) и биомасса (B, мг/10 см2) различных альгоценозов бентали
| Показатель обилия | Тип альгоценоза | Ст. 1–5 | Ст. 6–10 | Все станции | |||
|---|---|---|---|---|---|---|---|
| N | B | N | B | N | B | ||
| Min | Эпипелон | 22.1 | 7.47 | 39.9 | 32.8 | 22.1 | 7.47 |
| Эпилитон | 18.8 | 1.38 | 14.9 | 1.58 | 14.9 | 1.38 | |
| Эпифитон | 0.37 | 0.23 | 0.23 | 0.31 | 0.23 | 0.23 | |
| Max | Эпипелон | 196.5 | 96.7 | 280.8 | 379.1 | 280.8 | 379.1 |
| Эпилитон | 153.2 | 30.9 | 70.8 | 31.8 | 154.2 | 31.8 | |
| Эпифитон | 1.38 | 1.45 | 8.29 | 4.92 | 8.29 | 4.92 | |
| Mean | Эпипелон |
$\frac{{69.7 \pm 32.6~}}{{105}}$ |
$\frac{{33.03 \pm 16.3}}{{111}}$ |
$\frac{{162.8 \pm 46.7}}{{64}}$ |
$\frac{{142.2 \pm 62.8}}{9}$ |
$\frac{{116.2 \pm 31.0}}{{84}}$ |
$\frac{{87.6 \pm 35.5}}{{128}}$ |
| Эпилитон |
$\frac{{~61.3 \pm 24.2}}{{90}}$ |
$\frac{{~11 \pm 5.1}}{{105}}$ |
$\frac{{~33.6 \pm 9.8}}{{65}}$ |
$\frac{{12.9 \pm 5.7}}{{98}}$ |
$\frac{{~47.4 \pm 13.3}}{{89}}$ |
$\frac{{~11.9 \pm 3.6}}{{96}}$ |
|
| Эпифитон |
$\frac{{~0.91 \pm 0.2}}{{43}}$ |
$\frac{{~0.94 \pm 0.2}}{{54}}$ |
$\frac{{~2.65 \pm 1.4}}{{123}}$ |
$\frac{{~1.68 \pm 0.8}}{{112}}$ |
$\frac{{~1.78 \pm 1.06}}{{134}}$ |
$\frac{{~1.31 \pm 0.61}}{{104}}$ |
|
| Median | Эпипелон | 40.2 | 19.4 | 202.8 | 127.6 | 65.6 | 36.4 |
| Эпилитон | 46.8 | 6.66 | 24.8 | 10.3 | 29.4 | 8.26 | |
| Эпифитон | 0.98 | 0.87 | 1.07 | 1.04 | 1.07 | 0.95 | |
Примечание. Здесь и в табл. 2 над чертой ‒ среднее по станциям значение и его ошибка; под чертой – коэффициент вариации, %.
Плотность водорослей эпипелона значительно превышала таковую в альгоценозах, развивающихся на левом берегу (162.7 ± 46.7 млн/10 см2), чем на правом (69.7 ± 32.6), хотя ее различия между типами субстратов по берегам (TukeyHSD, p > 0.05) не были статистически значимыми. Средний показатель биомассы на правом берегу (33.0 ± 16.3 мг/10 см2) был достоверно ниже, чем на левом 142.1 ± 62.8 (p < 0.05). Для эпилитона наблюдали противоположную тенденцию. Численность сообществ на левом берегу реки (33.6 ± ± 9.8 млн/10 см2) в среднем была меньше, чем на правом (61.2 ± 24.5), однако биомасса оказалась почти одинакова (12.9 ± 5.7 и 11.0 ± 5.1 мг/10 см2 соответственно). По числу клеток и биомассе (0.91 ± 0.18 млн/10 см2, 0.94 ± 0.22 мг/10 см2) правобережные альгоценозы эпифитона уступали левобережным (2.65 ± 1.40 и 1.68 ± 0.84 соответственно). Таким образом, для эпипелона зарегистрированы достоверные различия показателей количественного развития вдоль берегов, а для эпилитона и эпифитона они не выявлены (TukeyHSD, p > 0.05).
Численность диатомовых и зеленых водорослей была выше в эпипелоне и эпилитоне, чем в эпифитоне. Цианопрокариоты численно лидировали на камнях, особенно на правобережных станциях, в эпипелоне они уступали диатомовым и зеленым (рис. 1). Динамика биомассы диатомовых и зеленых была сходна и повторяла таковую для общих показателей обилия. Биомасса цианопрокариот, максимальная в сообществах эпилитона правобережья, оказалась много ниже таковой диатомовых, а для эпипелона и эпифитона – и зеленых водорослей.
Рис. 1.
Общая (млн кл./10 см2 и относительная (%) численность (а, б) и биомасса, мг/10 см2 (б, г) альгоценозов бентали: а – Cyanoprokaryota, б – Bacillariophyta, в – Chlorophyta; 1–3 – эпилитон; 4–6 – эпипелон; 7–9 – эпифитон; 1, 4, 7 – ст. 1–5; 2, 5, 8 – ст. 6–10; 3, 6, 9 – ст. 1–10.
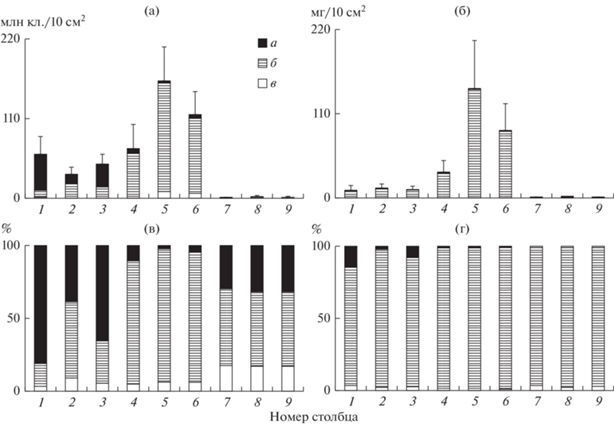
Оценка структурного разнообразия альгоценозов бентали (табл. 2) показала, что наиболее просто организованы сообщества эпипелона левобережных станций реки, продемонстрировавшие минимальные величины индекса Шеннона, более высокие показатели доминирования при пониженной выровненности видов в сообществах по обилию. Эпифитон в структурном отношении отличался низкими величинами доминирования и максимальными выровненности и видового разнообразия, особенно в левобережной зоне рипали реки. Сообщества эпилитона незначительно отличались от таковых эпифитона, и, как правило, их биоценотические характеристики статистически не различались. Для каменистого и растительного субстратов биоценотическая организация альгоценозов была более сложной в левобережье реки, а для эпипелона – наоборот, что свидетельствует о неоднородности средовых факторов формирования структуры сообществ и ее заметном воздействии на различные компоненты биоценозов бентали.
Таблица 2.
Средние значения показателей разнообразия Шеннона (H), Симпсона (D) и Пиелу (Е) по численности (N) и биомассе (B) фитобентоса естественных субстратов левобережных и правобережных участков р. Ока
| Тип адьгоценоза | HN | HB | DN | DB | EN | EB |
|---|---|---|---|---|---|---|
| Станции 1–5 | ||||||
| Эпипелон |
$\frac{{2.19 \pm 0.20}}{{26}}$ |
$\frac{{2.28 \pm 0.10}}{{12}}$ |
$\frac{{2.41 \pm 0.10}}{{\begin{array}{*{20}{l}} {29} \end{array}}}$ |
$\frac{{0.35 \pm 0.02}}{{\begin{array}{*{20}{l}} {18} \end{array}}}$ |
$\frac{{0.42 \pm 0.04}}{{\begin{array}{*{20}{l}} {24} \end{array}}}$ |
$\frac{{0.49 \pm 0.02}}{{\begin{array}{*{20}{l}} {11} \end{array}}}$ |
| Эпилитон |
$\frac{{1.91 \pm 0.10}}{{\begin{array}{*{20}{l}} {35} \end{array}}}$ |
$\frac{{2.91 \pm 0.13}}{{\begin{array}{*{20}{l}} {14} \end{array}}}$ |
$\frac{{0.45 \pm 0.06}}{{\begin{array}{*{20}{l}} {44} \end{array}}}$ |
$\frac{{0.20 \pm 0.02}}{{\begin{array}{*{20}{l}} {31} \end{array}}}$ |
$\frac{{0.42 \pm 0.05}}{{35}}$ |
$\frac{{0.64 \pm 0.02}}{{\begin{array}{*{20}{l}} {13} \end{array}}}$ |
| Эпифитон |
$\frac{{3.02 \pm 0.13}}{{18}}$ |
$\frac{{2.29 \pm 0.20}}{5}$ |
$\frac{{0.21 \pm 0.02}}{{46}}$ |
$\frac{{0.34 \pm 0.05}}{{60}}$ |
$\frac{{0.69 \pm 0.02}}{{14}}$ |
$\frac{{0.51 \pm 0.03}}{{29}}$ |
| Станции 6–10 | ||||||
| Эпипелон |
$\frac{{1.79 \pm 0.35}}{{64}}$ |
$\frac{{1.34 \pm 0.30}}{{72}}$ |
$\frac{{0.57 \pm 0.09}}{{48}}$ |
$\frac{{0.67 \pm 0.07}}{{34}}$ |
$\frac{{0.33 \pm 0.06}}{{62}}$ |
$\frac{{0.25 \pm 0.05}}{{68}}$ |
| Эпилитон |
$\frac{{2.98 \pm 0.25}}{{27}}$ |
$\frac{{3.01 \pm 0.18}}{{19}}$ |
$\frac{{0.23 \pm 0.04}}{{57}}$ |
$\frac{{0.21 \pm 0.03}}{{43}}$ |
$\frac{{0.61 \pm 0.04}}{{22}}$ |
$\frac{{0.62 \pm 0.03}}{{15}}$ |
| Эпифитон |
$\frac{{3.33 \pm 0.11}}{{11}}$ |
$\frac{{2.97 \pm 0.12}}{{12}}$ |
$\frac{{0.17 \pm 0.02}}{{30}}$ |
$\frac{{0.21 \pm 0.02}}{{32}}$ |
$\frac{{0.70 \pm 0.02}}{{10}}$ |
$\frac{{0.63 \pm 0.02}}{{12}}$ |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Заметные различия в составе, обилии и биоценотических показателях альгоценозов небольшого по протяженности участка устья реки (~7 км от места впадения в р. Волгa) отразили его четко выраженную биотопическую неоднородность. Эти различия определяются неоднородностью распределения основных средовых факторов, влияющих на структурные и продукционные показатели альгоценозов бентали, – температуры, гидродинамики, рельефа дна, субстрата, выедания травоядными животными и др.) (Allan, Castillo, 2007). К важнейшим лимитирующим факторам, определяющим обилие и сложность организации биотических сообществ, относятся частота и сила внешних нарушений среды, оцениваемая динамикой расхода воды (Ács, Kiss, 1993; Biggs, Smith, 2002). Ранее неоднократно отмечали, что именно расход воды часто контролирует пространственно-временные изменения состава и структуры альгоценозов бентали в водотоках, как в целом, так и отдельных их таксоценозов, например, диатомовых водорослей (Martínez de Fabricius et al., 2003; Комулайнен, 2005; Boix et al., 2010; Tang, Dudgeon, 2013).
Левобережные станции (6–8), расположенные в протоке, отделенной от основного русла островом (Гребневские пески), защищены от влияния высоких скоростей течения, интенсивного волнения и ветрового перемешивания водных масс. Кроме того, известно, что в рипали скорость потока много меньше, чем в медиали (Левадная, 1986). В этой части исследованной акватории устья наблюдается стагнация циркуляции водных масс, что оптимизирует среду обитания. В период отбора проб скорость течения и волнение на этих станциях не определяли, а температура воды (20.94 ± 0.29°С) и ее прозрачность (75.0 ± 2.24 см) были выше, чем на правобережных (18.38 ± 0.46°С и 62.5 ± 8.4 см соответственно). При этом, судя по коэффициентам вариации (Cv), температура и электропроводность воды оказались более выравненными у правого берега (Cv = 6 и 11%), чем у левого (31 и 19% соответственно), а прозрачность и активная реакция среды – наоборот (30 и 27% и 7 и 24% соответственно).
Увеличение прозрачности и температуры воды при снижении циркуляции водных масс привели к заметному росту обилия эпипелона (численности в среднем в 2.3 раза, биомассы в 4.3 раза) и увеличению доли планктонной составляющей (до 88 и 85% соответственно) в левобережье по сравнению с правобережными станциями. Все это, несомненно, свидетельствует о преимущественно планктоногенном происхождении эпипелона рипали реки в начале вегетационного сезона (последняя декада мая). В этот период в р. Окa наблюдается бурное развитие фитопланктона за счет вегетации Centrophyceae, особенно Stephanodiscus hantzschii (Okhapkin et al., 2014), который был отмечен и в составе доминантов донных альгоценозов. Автохтонная составляющая в микрофитобентосе (истинно донные и донно-планктонные компоненты альгофлоры) сильно уступала (в среднем на 9–16% численности и 15–31% биомассы) аллохтонной, особенно у левого берега. Роль автохтонной (связанной с субстратом) составляющей в структуре эпипелона оказалась минимальной по сравнению с эпилитоном (88–93% средних значений численности и 87–88% биомассы) и эпифитоном (70–73 и 78–80% соответственно). При этом относительные показатели обилия (доля той или иной группы водорослей в общей численности и общей биомассе) для эпипелона и эпифитона были сильно выровнены вдоль берегов (рис. 1). Для эпилитона эти различия четче проявились по численности в отличие от биомассы, средние значения которой вдоль берегов были почти одинаковы (табл. 1). Это связано с неоднородностью структуры количественных показателей альгоценозов эпилитона с участием цианобактерий, абсолютные и относительные показатели значимости которых в сообществах, формирующихся на каменистом субстрате, сильно варьировали.
Роль планктона в формировании альгоценозов бентали отмечают все исследователи перифитона и микрофитобентоса (Волга…, 1978; Макаревич, 2003; Комулайнен, 2005; Касперовичене, Каросене, 2005; Rusanov et al., 2009, 2012; Клоченко и др., 2013; Метелева, 2013 и др.). Так, Левадная (1986) при характеристике микрофитобентоса р. Енисей указывает максимальную численность сообщества для псаммореофильных группировок (11 985.0 млрд кл./м2), причем на 92% ее формировали осевшие планктонные диатомеи.
Более низкие значения численности и биомассы сообществ обрастателей водных макрофитов по сравнению с каменистым субстратом зарегистрированы и для альгоценозов бентали р. Ствиги (Корнейчук, Киричук, 2017), что характерно для начальных стадий первичной сукцессии перифитона. Время существования этого фитоперифитона к моменту отбора проб (примерно 3–4 нед) было много меньше, чем у сообществ эпилитона и эпипелона. Минимальная роль планктонных водорослей в формировании эпилитона может быть следствием воздействия придонных гидродинамических явлений, способствующих их смыву, a также из-за особенностей растительного субстрата. В отличие от поверхности камней, листовая поверхность растений покрыта выделяемой ими слизью, к которой, по-видимому, могут лучше “приклеиваться” организмы планктона.
Обилие и видовое разнообразие эпифитона имели недостоверно выраженную тенденцию к росту у левого берега, где четче проявилась пространственная неоднородность численности и биомассы (табл. 1), в то время как видовое разнообразие варьировало меньше (табл. 2). Для эпилитона проявилась аналогичная тенденция, но пространственная неоднородность количественных характеристик оказалась несколько выше на ст. 1–5, тогда как варьирование индексов разнообразия, оцененное по разным показателям обилия, не проявило четких различий вдоль берегов. Для эпипелона, как и эпилитона, различия обилия между станциями более четко выражены в правобережной рипали при достоверном росте численности и биомассы в застойной левобережной части устья. Видовое разнообразие левобережных сообществ мягких грунтов при этом изменялось сильнее, чем в сообществах вдоль правого берега.
Меньшее варьирование количественных характеристик населения неживых субстратов (мягкие грунты и камни) на левобережных станциях (Cv = 64–65% численность и 98–99% биомасса) может быть показателем более благоприятных условий обитания в сравнении с правобережьем (90–105 и 105–111% соответственно). В отличие от неживых субстратов, первые стадии сукцессии фитоперифитона характеризовались большей неоднородностью показателей обилия водорослей (Cv =112–123% в левобережье против 43–54% на ст. 1–5) при снижении интенсивности внешних нарушений, что можно связать со спецификой растения как поверхности для обитания перифитона и наличием биотических взаимоотношений, четче выраженных в более стабильной среде. Известно (Шевченко и др., 2009; Корнейчук, Киричук, 2017), что на разных видах водных растений в одном водоеме формируются разные по составу и продуктивности сообщества эпифитона, что связано со степенью сформированности водной растительности, а также может являться следствием биотических взаимодействий водоросль – растение-форофит.
Видовая структура биотических сообществ – фундаментальная характеристика, которая, наряду с обилием, служит чутким индикатором степени благоприятствования среды обитания, мерилом их устойчивости, наличия и степени влияния негативных факторов (Magurran, 2004; Алимов, 2017). Компоненты видовой структуры сообществ (видовое богатство, видовое разнообразие) отразили разрушающее воздействие режима паводков на сообщества фитоперифитона р. Дунай (Ács, Kiss, 1993) и небольших олиготрофных низкотемпературных водотоков Новой Зеландии (Biggs, Smith, 2002), продемонстрировали заметную связь микрофитобентоса водоемов Килийской дельты р. Дунай с типом донных отложений, скоростью течения и соленостью воды (Щербак, Козийчук, 2016). Видовое разнообразие и выровненность в сообществах альгоценозов бентали четче других показателей продемонстрировали воздействие тяжелых металлов (Cu, Pb, Zn и др.) на экосистему р. Гуадамар (Испания) (Sabater, 2000). Оценка качества воды и экологического состояния небольшого притока р. Волга (Тверская обл.) охарактеризовала определяющее влияние гидрохимических параметров (электропроводности, рН и цветности) на основные параметры видовой структуры таксоценозов Bacillariophyta (Schletterer et al., 2011).
Корреляционный анализ связи основных биоценотических показателей сообществ с обилием и некоторыми факторами среды обитания (табл. 3) показал, что численность и биомасса альгоценозов бентали сильно коррелируют друг с другом, хотя у сообществ эпилитона (r = 0.69) и эпипелона (0.76) левобережных станций эта связь менее тесная, чем в правобережных (0.93 и 0.99 соответственно). Это косвенно свидетельствует о более сложной размерной структуре исследованных сообществ в более застойных условиях среды. Оба показателя достаточно слабо связаны с видовым богатством в целом (r = 0.40–0.48), и с числом доминирующих видов (–(0.46–0.47)), хотя для эпипелона и эпилитона отрицательная связь с разнообразием доминантов выражена четче (–(0.52–0.71)). Для фитобентоса мягких грунтов и обрастаний каменистых субстратов в отдельно взятых районах вдоль берегов выявлены отрицательная средняя связь обилия с электропроводностью (r = (–0.64–0.78), ст. 1–5) и положительная с pH (0.71) и прозрачностью (0.73) воды (ст. 6–10). Биомасса эпифитона, слабо (r = 0.39) связанная с общим видовым богатством сообществ, имела тенденцию к росту в более стабильной и прогретой части левобережья (коэффициенты корреляции численности и биомассы с температурой воды были 0.64 для обоих показателей). С ростом биомассы сообществ формировалась слабо выраженная тенденция снижения разнообразия и упрощение структуры альгоценозов при доминировании немногочисленных видов водорослей.
Таблица 3.
Значимые (p < 0.05) коэффициенты корреляции некоторых биоценотических характеристик альгоценозов бентали и факторов водной среды
| N | B | S | Sd | Hb | D | E |
|---|---|---|---|---|---|---|
| Эпипелон | ||||||
| B (0.81) Sd (–0.71) S (0.58) Temp (0.47) |
N (0.81) Sd (–0.52) D (0.78) E (–0.77) |
N (0.58) Temp (0.61) Transp (0.62) |
N (–0.71) B (–0.52) Hb (0.56) D (–0.67) E (0.62) Temp (0.59) Elect (–0.51) |
B (–0.73) Sd (0.56) Elect (0.65) |
B (0.78) Sd (–0.67) Elect (0.72) Temp (0.52) |
B (–0.77) Sd (0.62) Temp (0.51) Elect (–0.70) |
| Эпилитон | ||||||
| B (0.77) | N (0.77) Sd (–0.59) Transp (0.47) |
Hb (0.58) Transp (0.47) |
B (–0.59) D (–0.65) E (0.55) |
S (0.58) | Sd (–0.65) | Sd (0.55) |
| Эпифитон | ||||||
| – | S (0.39) | B (0.39) Hb (0.68) D (–0.55) E (0.40) Temp (0.56) |
Hb (0.73) D (–0.77) E (0.76) |
Sd (0.73) S (0.68) Temp (0.61) |
Sd (–0.77) S (–0.55) Temp (0.50) |
Sd (0.76) S (0.40) Temp (0.54) |
| Всеальгоценозы | ||||||
| B (0.80) Sd (–0.46) S (0.48) |
N (0.80) Hb (–0.57) D (0.67) E (–0.64) Sd (–0.47) S (0.40) |
N (0.48) B (0.40) Transp (0.26) Temp (0.55) Elect (0.26) |
N (–0.46) B (–0.42) Hb (0.68) D (–0.73) E (0.73) рН (0.27) |
B (–0.57) Sd (0.68) |
B (0.67) Sd (–0.73) |
B (–0.64) Sd (0.73) |
Параметры видовой структуры сообществ прикрепленных водорослей (видовое разнообразие, выровненность) отрицательно коррелировали с биомассой и определялись, главным образом, числом доминирующих видов (табл. 3). В олиго-полидоминантных альгоценозах уровень количественного развития и показатели доминирования снижаются, а выровненность видов растет (Одум, 1975). Для эпифитона и эпипелона более значимы параметры видового богатства (число доминантов и общее количество видов), зависимость сложности организации сообществ с биомассой очень четко прослеживалась только для эпипелона (табл. 3). Для этой группы альгоценозов связь видового разнообразия с числом ценозообразующих таксонов в сравнении с другими сообществами выражена несколько слабее. Среди факторов внешней среды у эпипелона и эпифитона проявилась зависимость от электропроводности (первого типа альгоценозов) и температуры воды (у обоих типов).
Таким образом, параметры видовой структуры альгоценозов бентали в условиях, формирующихся после окончания половодья при прогрессирующем прогревании водных масс и отсутствии биогенного лимитирования, определялись величинами их биомассы и числом доминирующих видов и, в меньше степени, зависели от общего их видового богатства. При отсутствии сильно выраженных нарушений среды обитания сложность организации сообществ, как правило, возрастала с ростом температуры и электропроводности (минерализации), а в правобережье – рН водных масс. Таким образом, высокие разнообразие состава, показатели количественного развития альгоценозов бентали, их значимые индикационные свойства дают основания для получения надежных и адекватных оценок экологического состояния и качества воды исследованной водной экосистемы.
Выводы. Видовое богатство и количественное развитие альгоценозов бентали определяют диатомовые и зеленые водоросли; в эпилитоне правобережья заметнее численное развитие цианопрокариот. Снижение интенсивности внешних нарушений (гидродинамика) на фоне роста температуры и прозрачности воды при достаточном количестве элементов минерального питания способствует увеличению не только видового богатства бентосных альгоценозов, но и росту их продуктивности и усложнению структуры сообществ, что приводило к их заметным пространственным различиям вдоль берегов. Эта неоднородность четче выражена для индексов видового разнообразия и более сглажена для показателей обилия (больше для численности, чем для биомассы). В начале вегетационного периода (весна) ценозы микрофитобентоса почти полностью определяются структурой планктона и его количественным развитием, доля автохтонных компонентов (истинно бентосных, планктонно-бентосных и обрастателей) не превышает 12–22% показателей обилия. Первые стадии сукцесии эпифитона при высоком видовом богатстве альгоценозов (131 вид, из них 21 преобладают по обилию) отличались самыми низкими величинами численности и биомассы и незначительным уровнем доминирования. Минимальные значения количественного развития эпифитона по сравнению с эпилитоном определялись меньшим на момент исследования временем его существования (возрастом), а высокие показатели разнообразия и видового богатства – активной миграцией водорослей из микрофитобентоса и планктона и сильной конкуренции за ресурсы (биогены, площадь субстрата). Обилие (численность, биомасса), в основном, общим видовым богатством донных альгоценозов и снижалось с увеличением количества доминант, а для отдельных типов сообществ – прозрачностью, температурой и электропроводностью. Параметры видовой структуры в первую очередь зависели от величины биомассы альгоцеозов и числа доминирующих в них видов и, в меньшей степени, от видового богатства. Сложность организации сообществ возрастала с ростом температуры и минерализации (электропроводности), а в правобережье – рH водных масс.
Список литературы
Алимов А.Ф. 2017. Стабильность и устойчивость водных экосистем // Гидробиол. журн. Т. 53. № 1. С. 3.
Волга и ее жизнь. 1978. Ленинград: Наука.
Касперовичене Ю., Каросене Ю. 2005. Структурно-функциональная характеристика эпифитона и фитопланктона литоральной зоны оз. Спера (Литва) // Вестн. Тюмен. гос. ун-та. № 5. С. 70.
Клоченко П.Д., Шевченко Т.Ф., Харченко Г.В. 2013. Структурная организация фитопланктона и фитоэпифитона озер г. Киева // Гидробиол. журн. Т. 49. № 2. С. 50.
Комулайнен С.Ф. 2003. Методические рекомендации по изучению фитоперифитона в малых реках. Петрозаводск: Карельск. науч. центр РАН.
Комулайнен С.Ф. 2005.Структура и функционирование фитоперифитона в малых реках Восточной Фенноскандии: Дис. … докт. биол. наук. Санкт-Петербург. 257 с.
Корнейчук Н.Н., Киричук Г.Е. 2017. Структурно-функциональная организация фитомикроперифитона трансграничной р. Ствиги // Гидробиол. журн. Т. 53. № 5. С. 3.
Левадная Г.Д. 1986. Микрофитобентос реки Енисей. Новосибирск: Наука.
Макаревич Т. А. 2003. Таксономическая структура альгофлоры планктона и перифитона небольшого димиктического озера // Озерные экосистемы: биологические процессы, антропогенная трансформация, качество воды: Матер. II Междунар. конф. Минск, Нарочь, 22–26 сентября. 2003 г. Минск: Изд-во Белорус. ун-та. С. 305.
Метелева Н.Ю. 2013. Структура и продуктивность фитоперифитона водоемов бассейна Верхней Волги: Автореф. дис. … канд. биол. наук. Борок.
Одум Ю. 1975. Основы экологии. Москва: Мир. (Odum E.P., Odum H.T. 1959. Fundamentals of Ecology. London: Saunders.)
Охапкин А.Г., Воденеева Е.Л., Старцева Н.А., Хедаириа Т. 2019. Экологический мониторинг. Методы изучения фитобентоса пресных водоемов пособие. Нижний Новгород: Нижегород. гос. ун-т.
Охапкин А.Г., Хедаириа Т. 2019. Диатомовые водоросли как компонент донных альгоценозов устьевого участка реки Оки // Вопросы современной альгологии. № 2(20). С. 60.
Хедаириа Т. 2019. К характеристике фитобентоса реки Оки // Биосистемы. Нижний Новгород: Нижегород гос. ун-т. С. 235.
Хедаириа Т. 2021. Экологическая характеристика состава диатомовых водорослей бентосных альгоценозов устья р. Оки // Вопросы современной альгологии. № 1(25). С. 131. URL: http://algology.ru/1650
Хедаириа Т., Охапкин А.Г. 2020. Состав диатомовых водорослей устьевого участка реки Оки // Биосистемы. Нижний Новгород: Нижегородский гос. университет. С. 218.
Хедаириа Т.М., Охапкин А.Г. 2021. Диатомовые водоросли альгоценозов бентали как показатели качества воды устья р. Оки (Россия) // Принципы экологии. № 3. С. 99.
Хедаириа Т., Охапкин А.Г., Генкал С.И. и др. 2022a. Состав и экологическая характеристика диатомовых водорослей альгоценозов бентали устья крупной эвтрофно-гипертрофной реки (р. Ока, Россия) // Биология внутр. вод. № 4. С. 372.https://doi.org/10.1134/S1995082922040320
Хедаириа Т., Охапкин А.Г., Фукина Д.Г. 2022б. Состав и структура альгоценозов бентали крупной эфтрофированной реки (р. Ока, Россия). Сообщение 1. Таксономическая характеристика и доминирующие виды сообществ // Биология внутр. вод. № 5. С. 493. https://doi.org/10.31857/S0320965222050151 https://doi.org/10.1134/S1995082922050121
Песенко И.А. 1982. Принципы и методы количественного анализа в фаунистических исследованиях. Москва: Наука.
Шевченко Т.Ф., Харченко С.В., Клоченко П.Д. 2009. Ценологический анализ фитоэпифитона водоемов г. Киева // Гидробиол. журн. Т. 45. № 5. С. 47.
Шитиков В.К., Розенберг Г.С., Зинченко Т.Д. 2003. Количественная гидроэкология: методы системной идентификации. Тольятти: Ин-т экологии Волжск. бассейна РАН.
Щербак В.И., Козийчук Э.Ш. 2016. Динамика микрофитобентоса разнотипных водных объектов Килийской дельты Дуная в зависимости от некоторых экологических факторов // Гидробиол. журн. Т. 53. № 1. С. 3.
Ács É., Kiss K. 1993. Effects of water discharge on periphyton abundance and diversity in a large river, River Danube, Hangary // Hydrobiologia. V. 249. P. 125.
Allan J.D., Castillo M.M. 2007. Stream Ecology: Structure and Function of Running Waters. New York: Chapman and Hall. https://doi.org/10.1007/978-1-4020-5583-6
Biggs B.G.F., Smith R. 2002. Taxonomic richness of stream benthic algae: Effects of flood disturbance and nutrients // Limnol., Oceanogr. V. 47. № 4. P. 1175.
Boix D., Garcia-Berthou E., Gascon S. et al. 2010. Response of community structure to sustained drought in Mediterranean rivers // J. Hydrol. V. 383. P. 135.
Magurran A.E. 2004. Measuring biological diversity. Oxford: Blackwell Publishing.
Martinez de Fabricius A.L., Maidana N., Gomez N., Sabater S. 2003. Distribution patterns of benthic diatoms in a Pampean river exposed to seasonal floods: the Cuarto River (Argentina) // Biodiversity and Conservation. V. 12. P. 2443.
Okhapkin A.G., Genkal S.I., Sharagina E.M., Vodeneeva E.L. 2014. Structure and dynamics of phytoplankton in the Oka river mouth at the beginning of the 21th century // Inland Water Biol. V. 7. № 4. P. 357. https://doi.org/10.1134/S1995082914040142
R Core Team. 2020. R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria. URL https://www.R-project.org.
Rivers of Europe. 2021. Netherlands: Elsevier.
Rusanov A.G., Stanislavskaya E.V., Ács É. 2009. Distribution of periphytic diatoms in the rivers of the Lake Ladoga basin (Northwestern Russia) // Acta Botanica Croatica. V. 68. P. 301.
Rusanov A.G., Stanislavskaya E.V., Ács É. 2012. Periphytic algal assemblages along environmental gradients in the rivers of the Lake Ladoga basin, Northwestern Russia: implication for the water quality assessment // Hydrobiologia. V. 695. P. 305.
Sabater S. 2000. Diatom communities as indicators of environmental stress in the Guadiamar River, S-W. Spain, following a major mine tailings spill // J. Appl. Phycol. V. 12. P. 113.
Schletterer M., Schӧnhuber M., Füreder L. 2011. Biodiversity of diatoms and macroinvertebrates in an east European lowland river, the Tudovka River (Tver Region, Russia) // Boreal Environment Research. V. 16. P. 79.
Tang T.S., Niu S.Q., Dudgeon D. 2013. Responses of epibenthic algal assemblages to water abstraction in Hong Kong streams // Hydrobiologia. V. 703. P. 225.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


