Биология внутренних вод, 2023, № 1, стр. 92-105
Ядерно-цитоплазматический конфликт у гибридов плотвы Rutilus rutilus и леща Abramis brama как следствие дивергенции видов по размерам тела и генома
В. В. Столбунова a, *, Ю. В. Кодухова a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл, Россия
* E-mail: vvsto@mail.ru
Поступила в редакцию 29.04.2022
После доработки 02.06.2022
Принята к публикации 06.06.2022
- EDN: KTIRWA
- DOI: 10.31857/S0320965223010187
Аннотация
Дивергенция видов по размеру тела часто связана с изменениями размера генома и скорости эволюции митохондриальной ДНК (мтДНК). В ходе гибридизации видов с разным размером тела эти различия могут вести к проблемам ядерно-цитоплазматической совместимости и активации эмбрионального генома, которые проявляются у гибридов аномалиями развития и снижением приспособленности. Лещ Abramis brama (L.) больше плотвы Rutilus rutilus (L.) по размерам тела и генома. В первом поколении гибридов по ITS1 региону рибосомной ДНК ранее установлено изменение донорного генома самца к уровню материнского вида, что, предположительно, может влиять на наследование морфологических признаков от отцовского вида и, в частности, размера тела. Измерены длина и высота тела, ряд диагностических морфологических признаков и проведено генотипирование (ITS1 рДНК и cyt b мтДНК) сеголетков и половозрелых особей леща, плотвы, гибридов F1 и сеголетков бэккроссов. Половозрелые гибриды обоих направлений скрещивания по длине тела были близки к R. rutilus, что свидетельствует о нарушении отцовского эффекта при наследовании длины тела более крупного вида – леща. Нарушение наследования длины тела A. brama у гибридов скрещивания R. rutilus × A. brama (♀R < ♂A) рассматривается как отклонение в развитии и, очевидно, может влиять на адаптацию гибридов, что обусловливает редкость данного варианта в природе. При этом аллоплазматические бэккроссы ARR восстанавливают длину тела леща даже в присутствии ядерного генома плотвы, что свидетельствует о влиянии митохондриальных генов на наследование данного признака. Наблюдаемое отклонение в развитии гибридов RA с мтДНК плотвы мы связываем с недостаточным уровнем транскрипции рибосомных генов из-за сокращения числа и вариабельности копий донорной рДНК леща. Кроме того, высокий уровень полиморфизма мтДНК плотвы указывает на субоптимальное митохондриально-ядерное соответствие дыхательных комплексов в гибридах RA, что негативно влияет на ключевые физиологические процессы, включая рост и развитие большого размера тела. Предположительно, развитие большого размера тела, как сложного признака с высокой аэробной потребностью, блокируется у гибридов RA по энергетическим причинам. Показано, что различия семейств повторяющихся последовательностей рДНК и мтДНК по числу и вариабельности копий в геномах R. rutilus и A. brama могут вести к регуляторной ядерно-цитоплазматической несовместимости геномов у гибридов F1.
ВВЕДЕНИЕ
Межвидовая гибридизация широко распространена в животном и растительном мире и представляет собой механизм горизонтального переноса адаптивных генов и генных комплексов от одного вида к другому. В результате нередко наблюдаются эффекты интрогрессии митохондриальной ДНК (мтДНК) и генной коэволюции, проявляющейся в форме параллельной дивергенции взаимодействующих генов (Dowling, DeMarais, 1993; Burke, Arnold, 2001). Чаще всего генетические обмены не взаимны, т.е. устанавливается интрогрессивная гибридизация, когда гены только одного вида способны встраиваться в геном другого (Mayr, 1963), не нарушая при этом целостность вида (Патрушев, 2004). Обзор более 80 известных случаев гибридизации животных показал, что в 50 из них интрогрессия мтДНК была строго асимметрична или однонаправлена (Wirtz, 1999).
Исследования однонаправленной гибридизации рыб показывают, что интрогрессия мтДНК происходит гораздо легче, чем ядерных генов в том случае, когда между видами существуют презиготические барьеры для потока генов (Chan, Levin, 2005). Это могут быть различия по размеру тела и его окраске, влияющие на выбор партнера (Boughman, 2001; McKinnon et al., 2004) и вероятность спаривания. При расселении вида в зонах вторичного контакта иммигранты редки по сравнению с аборигенным видом (Wirtz, 1999) и, как правило, представлены самцами, что также определяет направление скрещивания (Формозов, 2007).
Филогенетические исследования пресноводных рыб семейств Centrarchidae и Cyprinidae, в частности, плотвы Rutilus rutilus (L.) и леща Abramis brama (L.), показывают, что дивергенция видов по размеру тела сопровождается неравной скоростью накопления замен в мтДНК (Bolnick et al., 2008; Hayden et al., 2011). Высокий уровень различий генов мтДНК служит основной причиной ядерно-цитоплазматической несовместимости геномов и постзиготической репродуктивной изоляции (Столбунова, 2017). При этом выявлена тенденция, что высокая скорость накопления мутаций в мтДНК обнаруживалась у более мелкого по размеру тела вида из пары, и этот вид был худшим материнским родителем (Bolnick et al., 2006; Scharder et al., 2013). Предполагается, что дивергенция видов по размеру тела может указывать направление фиксации несовместимости Добжанского-Меллера (Orr, Turelli, 2001). Однако неравная скорость накопления мутаций в мтДНК в таксонах с системой определения пола XY, к которым принадлежат лещ и плотва, ведет к снижению жизнеспособности гибридов только во втором поколении (Hill, Johnson, 2013), и не объясняет несовместимость чужеродных геномов у гибридов первого поколения (F1). Поэтому дивергенция видов по размеру тела, если она имеет генетическую основу, может представлять собой дополнительный механизм постзиготической репродуктивной изоляции. В настоящее время относительно мало внимания уделяется вопросу: каким образом морфологические различия видов могут быть связаны с генетическими факторами. В данном случае межвидовые и возвратные скрещивания видов со значительными различиями по размеру тела и скорости замен в мтДНК являются относительно простой системой, в которой может быть изучена взаимосвязь между молекулярной и морфологической эволюцией.
В европейских водоемах широко распространена асимметричная гибридизация R. rutilus и A. brama (Economidis, Wheeler, 1989), которая происходит в направлении (♀A > ♂R), т.е. самка более крупного по размеру тела леща × самец более мелкой плотвы (Hayden et al., 2010). У леща показана самая низкая скорость накопления мутаций в мтДНК среди рыб семейства карповых (Hayden et al., 2011), превышение размера генома по сравнению с плотвой в 1.3 раза при одинаковом количестве хромосом (Гинатулин, 1984; Gregory, 2013) и вариабельности ITS региона мультигенной рибосомной ДНК (рДНК) на 12.6% (Wyatt et al., 2006; Луданный, 2008). Известно, что увеличение избыточности генетического материала в процессе коэволюционных взаимоотношений симпатрических видов использует более примитивный вид (Голубовский, 2000), что минимизирует рекомбинацию в кодирующих участках и способствует разнообразию повторов (Pierce, Milton, 1980; Flavell, 1982). Обратная корреляция между количеством ДНК и уровнем гетерозиготности, которая наблюдается у плотвы и леща, свидетельствует о различии регуляторных систем родительских геномов и степени их специализации, что является важнейшим молекулярным барьером, ограничивающим гибридизацию (Wilson et al., 1974; Pierce, Mitton, 1980).
Ранее в потомстве бэккроссов (Fb) выявлены признаки низкой совместимости между мтДНК плотвы и ядерным геномом леща, что, по-видимому, связано с высоким уровнем дивергенции по генам цитохром с-оксидазы (Stolbunova et al., 2020), который достигает 11.4% по COXI, 6.2% по COХII и 24.9% по COXIII (Луданный, 2008). Согласно классической модели межгеномного конфликта (Bateson, 1909; Dobzhansky, 1937; Muller, 1942), несовместимость по генам цитохром с-оксидазы (COXI, COXIII), субъединицы которой кодируются как ядерными, так и митохондриальными генами, ведет к нарушению транспорта электронов, повышению активных форм кислорода, снижению выработки энергии путем окислительного фосфорилирования и потере жизнеспособности бэккроссов (Ellison, Burton, 2006).
В F1 влияние ядерно-цитоплазматических взаимодействий установлено на основании сходства реципрокных гибридов RA и AR с материнским видом и различий между собой по скорости морфогенеза, экспрессии ферментов и уровню полиморфизма ITS1 региона рДНК (Крыжановский, 1968; Лапушкина, 2002; Луданный, 2008), что указывает на изменение у гибридов донорной рДНК самца. В литературе данный эффект описан как доминирование рибосомных генов одного из родителей, при этом показано, что донор по отцовской линии в большей степени уязвим к генетическим изменениям (Gill, 1991; Gangloff et al., 1996; Fujiwara et al., 1997). Нарушение кодоминантного наследования ядерного маркера ITS1 рДНК и фиксация видоспецифического фрагмента самки в раннем онтогенезе у гибридов плотвы и леща, по-видимому, является следствием этих изменений (Столбунова, Кодухова, 2021). Очевидно, различия реципрокных гибридов плотвы и леща обусловлены дивергенцией видов по количеству избыточной ДНК, которое положительно коррелирует с числом и вариабельностью копий рДНК, и связано с размером тела, скоростью развития, скоростью метаболизма и степенью специализации вида (Hinegardner, 1968; Pierce, Mitton, 1980; Olmo, 2003; Vinogradov, Anatskaya, 2006). В раннем развитии снижение жизнеспособности гибридов не установлено (Слынько Е.Е., Слынько Ю.В., 2010), однако в природных условиях частота встречаемости гибридного варианта RA составляет всего 3%, что свидетельствует об их низкой приспособленности (Hayden et al., 2010).
Цель работы – изучить последствия генетических изменений донорного генома самца у реципрокных гибридов RA и AR на основании анализа ряда морфологических признаков, включая длину и высоту тела, а также генотипирования по маркерам ядерного (ITS1 рДНК) и митохондриального (cyt b мтДНК) геномов сеголетков и половозрелых особей плотвы, леща, реципрокных гибридов F1 и сеголетков бэккроссов.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Получение гибридов F1 и Fb. Для проведения межвидовых, внутривидовых и возвратных скрещиваний плотву и леща отлавливали на разных нерестилищах в Рыбинском водохранилище (Ярославская обл., Россия). Видовой статус устанавливали до скрещивания по морфологическим признакам (Атлас…, 2003) и подтверждали в ходе молекулярно-генетического анализа. Гибридных самок и самцов получали при межвидовых скрещиваниях плотвы и леща (AR – ♀A. brama × ♂R. rutilus и RA – ♀R. rutilus × ♂A. brama) и выращивали до половозрелости (V стадия зрелости гонад, возраст 4+) на базе прудового хозяйства Института биологии внутренних вод им. И.Д. Папанина РАН. При оплодотворении использовали сухой метод (Рябов, 1981). Для проведения возвратных скрещиваний половые продукты каждой самки AR и RA разделяли на две части: одну часть смешивали со спермой самца плотвы, другую часть со спермой самца леща. После отбора половых продуктов производителей нумеровали и усыпляли, далее хранили в морозильных камерах при –20°С.
Оплодотворенную икру помещали в отдельные кристаллизаторы (диаметр 50 см, высота 15 cм) с водой из пруда, по 2500–3000 икринок в каждом. Средняя температура воды во время инкубации эмбрионов была 17.5 ± 1.5°С и соответствовала температурным условиям природного водоема. Икру инкубировали в условиях постоянного водообмена (смена воды 3 раза в сутки), контроля концентрации кислорода, кислотности и температуры воды. Смертность эмбрионов и динамику вылупления определяли во время раннего развития с использованием счетных сеток на дне сосудов. После вылупления личинок высаживали в отдельные кристаллизаторы, где выдерживали до полного рассасывания желточного мешка. Со стадии перехода к смешанному типу питания личинок подкармливали планктоном из естественных водоемов. После завершения этой стадии личинок пересаживали в открытые выростные пруды с предварительной акклимацией к температурным условиям (по 600 экз. на 600 м2 площади пруда). Потомство каждого скрещивания содержали в отдельном пруду до возраста 6 мес (с мая по октябрь). Из каждого пруда было получено и заморожено ≥200 cеголетков (0+). Для шести производителей (♀RA, ♀AR, ♂A, ♂A1, ♂R, ♂R1) и 190 бэккроссов (46–48 в каждом скрещивании) проведен молекулярно-генетический анализ.
Молекулярно-генетический анализ. ДНК выделяли из скелетных мышц производителей и сеголетков гибридов с использованием набора Diatom Prep 100 (“Изоген”, Москва). Предварительный анализ потомства проводили по трем микросателлитным локусам – CypG53, CypG48, CypG24 (Baerwald, May, 2004), чтобы подтвердить родство и исключить занос генетического материала, поскольку гибридов содержали в открытых прудах. Для дальнейшей работы отбирали только особей с материнскими и отцовскими аллелями.
Ядерный (ITS1 рДНК) и митохондриальный (cyt b мтДНК) маркеры использовали для определения генотипа гибридов. Условия локус-специфической ПЦР для каждого типа маркера описаны в работе Wyatt et al. (2006). Амплификацию видоспецифических фрагментов ITS1 рДНК A. brama (длина 147–152 пар нуклеотидов (п.н.)) и R. rutilus (385–386 п.н.) проводили с двух прямых праймеров (для A. brama – Abi: 5'-CCATGCCTCGGTTGTGTCT-3', для R. rutilus – Rbi: 5'-AGGTCCCAGGAACAAAACAAC-3') и одного обратного праймера, универсального для обоих видов (ITR:5'-AGTGTCGATGATCAATGTGTCCTG-3'). Видоспецифические фрагменты гена cyt b A. brama (672 п.н.) и R. rutilus (450 п.н.) амплифицировали с двух прямых праймеров (для A. brama – Abb: 5'-TGTTTATTACCCAA ATCCTCACG-3', для R. rutilus – Rbb: 5'-AACATTGTGTGGTTCTATTCCTC-3') и одного обратного праймера (Ubb: 5'-CACGAGTGGGTTTGCTGG-3'). Реакционная смесь для ПЦР объемом 25 мкл содержала готовый 10× буфер (“Fermentas”, Литва); 2.0 мМ МgCl2; 200 мкМ каждого дезоксирибонуклеотида; по 3.2 пмоль прямого и обратного праймеров; 0.9 ед. Taq-полимеразы (“Бионем”, Москва); 50 нг клеточной ДНК. Программа ПЦР для обеих маркеров включала денатурацию ДНК при 94°С в течение 5 мин. Далее следовали 30 циклов синтеза фрагмента для ITS1 рДНК и 35 циклов – для cyt b мтДНК, состоящие из денатурации при 94°С – 45 c, отжига праймеров при 64°С (cyt b) и при 67°С (ITS1 рДНК) – 80 с, элонгации при 72°С – 60 с. Завершала программу конечная элонгация при 72°С – 5 мин. ПЦР продукты cyt b и ITS1 фракционировали гель-электрофорезом в 1.5%-ном агарозном геле, содержащем бромид этидия, и визуализировали в УФ-излучении с ДНК-маркером 100 п.н. (“Fermentas”, Литва).
При генотипировании потомства учитывали, что первый внутренний транскрибируемый спейсер ITS1 рДНК у плотвы и леща расположен в области ядрышкового организатора на концах одной хромосомной пары (Bianco et al., 2004). В связи с разобщением гаплоидных геномов у межродовых гибридов (Беннетт, 1986), видоспецифический фрагмент ITS1 рДНК является маркером гаплоидного генома родительского вида и имеет кодоминантный тип наследования. Гибриды F1 имеют оба родительских фрагмента ITS1 рДНК. В потомстве возвратного скрещивания формируются два генотипических класса: с одним ITS1 рДНК, что свидетельствует о восстановлении ядерного генома плотвы (RR) или леща (АА), и с двумя ITS1 рДНК, т.е. гибридным ядерным геномом (RA, AR). От каждой самки получено по два потомства. Одно в скрещивании, где мтДНК самки и самца совпадали по видовому статусу – AR × A1, RA × R (конгруэнтное скрещивание, самка на первом месте), другое – в условиях межгеномного конфликта, когда родительские особи имели мтДНК разных видов – AR × R1, RA × A (инконгруэнтное скрещивание). В потомстве инконгруэнтных скрещиваний регистрируется класс аллоплазматических бэккроссов (ARR и RAA), которые сочетают мтДНК одного вида и ядерный геном другого родительского вида.
Морфологический анализ. Проведены измерения размеров тела и подсчет основных диагностических признаков у экспериментальных сеголетков A. brama (A × A, численность выборки, n = 40), R. rutilus (R × R, n = 40), реципрокных гибридов F1 (самка × × самец: A × R, n = 50 и R × A, n = 29) и 190 бэккроссов (46–48 в каждом из четырех скрещиваний), а также у половозрелых экспериментальных гибридов F1 в возрасте четырех–восьми лет (A × R, n = 23 и R × A, n =16) и природных производителей леща (n = 29, 8–15+) и плотвы (n = 32, 4–10+). Изучены следующие диагностические признаки: стандартная длина тела (LS), наибольшая высота тела в процентах от стандартной длины тела (H, LS), общее число позвонков (Vert), число позвонков в грудном (Vа) и хвостовом (Vc) отделах, число лучей в анальном (Ab) плавнике, число чешуй в боковой линии (l.l.) (Правдин, 1966). Проведен анализ соотношения количества позвонков между грудным и хвостовым отделами: согласно работе (Кодухова, 2010), соотношение Va ≥ Vc определяется как “плотвиный” тип; Va < Vc – как “лещовый” тип. Гибридный индекс рассчитывали, как среднее для всех признаков гибридов и родительских видов, используя формулу (Hubbs, Kuronuma, 1942):
HI = 100/(Hi – Mi1)/(Mi2 – Mi1),
где H – среднее значение признака i у гибридов, Mi1 – среднее значение признака i для женского родителя, Mi2 – среднее значение признака i для мужского родителя. Интерпретация значений HI: от 45 до 55 – промежуточное значение признака между двумя видами; <45 – значение признака близко к женскому родителю; >55 – к мужскому родителю. Зависимость длины тела реципрокных гибридов F1 и Fb на стадии сеголетка и взрослых особей от видовой принадлежности самца и самки протестировано с помощью one-way ANOVA. Попарные сравнения оценивали с помощью post hoc Тьюки HSD тестов. Статистическую обработку проводили с использованием программного пакета STATISTICA 8.0 (StatSoft Inc., USA).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
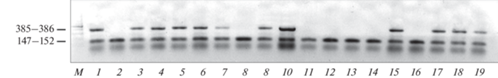
Результаты генотипирования родительских особей плотвы, леща, гибридов F1 и их морфологические характеристики. У природных производителей (самцов и самок) леща (n = 29) и плотвы (n = 32), включая самцов (♂A, ♂A1, ♂R, ♂R1) для получения бэккроссов (табл. 1), установлено по одному видоспецифическому фрагменту каждого из двух маркеров – ITS1 рДНК и cyt b мтДНК (рис. 1, дорожка 2). Морфологические характеристики самцов плотвы и леща находились в диапазоне видовых значений. У половозрелых экспериментальных гибридов A × R (n = 23) и R × A (n = 16), включая гибридных самок ♀AR и ♀RA, показано оба родительских фрагмента ITS1 рДНК (рис. 1, дорожка 1), и один фрагмент cyt b материнского вида. Гибридные самки ♀AR и ♀RA имели промежуточные значения диагностических признаков, характерные для реципрокных гибридов (A × R и R × A) (табл. 1) и осевой скелет лещового типа (Va < Vc).
Таблица 1.
Длина тела и диагностические признаки в экспериментальных выборках R. rutilus, A. brama, гибридов F1, бэккроссов и у родительских особей (♀F1, ♂R, ♂A)
| Особи/выборка | LS | H | l.l. | Аb | Va | Vc | Vert |
|---|---|---|---|---|---|---|---|
| Родительские особи | |||||||
| ♀AR | 255.5 | 39.6 | 48 | 17 | 15 | 16 | 41 |
| ♀RA | 206.3 | 36.7 | 48 | 15 | 15 | 16 | 42 |
| ♂R | 190.9 | 27.2 | 42 | 10 | 16 | 14 | 40 |
| ♂R1 | 181 | 29.9 | 43 | 11 | 16 | 14 | 40 |
| ♂A | 362 | 39.1 | 58 | 25 | 14 | 18 | 44 |
| ♂A1 | 419.3 | 40.4 | 54 | 27 | 15 | 18 | 44 |
| Гибриды R × A и A × R, A. brama (A × A), R. rutilus (R × R) | |||||||
| R × R | $\frac{{54.1 \pm 0.51}}{{49 - 60}}$ | $\frac{{24.8 \pm 0.18}}{{23 - 27}}$ | $\frac{{42.9 \pm 0.11}}{{39 - 44}}$ | $\frac{{10.3 \pm 0.08}}{{9 - 11}}$ | $\frac{{16.5 \pm 0.11}}{{15 - 18}}$ | $\frac{{14.6 \pm 0.12}}{{14 - 16}}$ | $\frac{{41.3 \pm 0.13}}{{39 - 42}}$ |
| R × A | $\frac{{56.8 \pm 0.54}}{{49 - 63/{\mathbf{11}}}}$ | $\frac{{26.0 \pm 0.22}}{{23 - 30/{\mathbf{15}}}}$ | $\frac{{49.1 \pm 0.36}}{{47 - 53/{\mathbf{48}}}}$ | $\frac{{16.2 \pm 0.18}}{{15 - 18/{\mathbf{38}}}}$ | $\frac{{15.6 \pm 0.11}}{{14 - 16/ - }}$ | $\frac{{16.8 \pm 0.08}}{{16 - 17/ - }}$ | $\frac{{42.7 \pm 0.10~}}{{41 - 43/{\mathbf{63}}}}$ |
| A × R | $\frac{{69.8 \pm 0.56}}{{61 - 78/{\mathbf{51}}}}$ | $\frac{{27.9 \pm 0.17}}{{27 - 34/{\mathbf{61}}}}$ | $\frac{{46.5 \pm 0.23}}{{44 - 52/{\mathbf{71}}}}$ | $\frac{{14.8 \pm 0.12}}{{13 - 17/{\mathbf{71}}}}$ | $\frac{{14.7 \pm 0.07}}{{14 - 16/ - }}$ | $\frac{{16.3 \pm 0.09}}{{15 - 18/ - }}$ | $\frac{{41.3 \pm 0.11}}{{40 - 43/{\mathbf{98}}}}$ |
| A × A | $\frac{{79.4 \pm 0.59}}{{70 - 84}}$ | $\frac{{33.0 \pm 0.19}}{{31 - 35}}$ | $\frac{{55.6 \pm 0.21}}{{50 - 56}}$ | $\frac{{25.8 \pm 0.14}}{{21 - 28}}$ | $\frac{{14.4 \pm 0.07}}{{14 - 15}}$ | $\frac{{18.8 \pm 0.09}}{{18 - 20}}$ | $\frac{{43.5 \pm 0.08}}{{43 - 45}}$ |
| Гибриды Fb | |||||||
| RA × R | $\frac{{52.1 \pm 0.56}}{{45 - 60}}$ | $\frac{{26.9 \pm 0.19}}{{23 - 30}}$ | $\frac{{44.9 \pm 0.23}}{{42 - 49}}$ | $\frac{{11.8 \pm 0.14}}{{9 - 14}}$ | $\frac{{15.3 \pm 0.10}}{{14 - 17}}$ | $\frac{{14.7 \pm 0.09}}{{13 - 16}}$ | $\frac{{40.7 \pm 0.12}}{{39 - 42}}$ |
| AR × R1 | $\frac{{76.2 \pm 0.59}}{{64 - 87}}$ | $\frac{{27.8 \pm 0.26~}}{{24 - 34}}$ | $\frac{{44.3 \pm 0.25}}{{42 - 48}}$ | $\frac{{12.6 \pm 0.11}}{{11 - 14}}$ | $\frac{{15.6 \pm 0.13}}{{13 - 18}}$ | $\frac{{14.4 \pm 0.10}}{{13 - 16}}$ | $\frac{{40.6 \pm 0.15}}{{37 - 42}}$ |
| RA × A | $\frac{{52.6 \pm 0.66}}{{44 - 64}}$ | $\frac{{27.3 \pm 0.25}}{{24 - 34}}$ | $\frac{{47.5 \pm 0.29}}{{45 - 51}}$ | $\frac{{18.0 \pm 0.16}}{{15 - 21}}$ | $\frac{{15.1 \pm 0.09}}{{14 - 17}}$ | $\frac{{17.1 \pm 0.08}}{{16 - 18}}$ | $\frac{{43.1 \pm 0.10}}{{42 - 45}}$ |
| AR × A1 | $\frac{{77.5 \pm 0.51}}{{69 - 86}}$ | $\frac{{30.2 \pm 0.23}}{{27 - 34}}$ | $\frac{{51.4 \pm 0.33}}{{47 - 58}}$ | $\frac{{19.1 \pm 0.22}}{{16 - 22}}$ | $\frac{{14.8 \pm 0.11}}{{13 - 16}}$ | $\frac{{16.6 \pm 0.11}}{{15 - 18}}$ | $\frac{{42.6 \pm 0.16}}{{41 - 45}}$ |
Примечание. LS — длина тела, % H — высота тела; l.l. — число чешуй в боковой линии; Vert — общее число позвонков; Vа, Vc — число позвонков в грудном и хвостовом отделах соответственно; Ab — число лучей в анальном плавнике; М ± m – среднее значение признака ± стандартная ошибка среднего (даны над чертой), min‒max/HI — диапазон вариации (для удобства использованы округленные значения этого показателя) и гибридный индекс, % (даны под чертой).
Рис. 1.
Электрофоретические паттерны ITS1 рДНК в потомстве бэккроссов RA × A1. Дорожки: 1 – гибридная самка ♀ RA, 2 – самец леща ♂А1, 3–7, 9, 10, 15, 17–19 – бэккроссы класса RA с мтДНК плотвы и гибридным ITS1 рДНК, 8, 11–14, 16 – бэккроссы класса RAA с мтДНК плотвы и ITS1 рДНК леща; М – ДНК маркер 100 п.н. Слева указаны длины фрагментов ITS1 леща (147–152 п.н.) и плотвы (385–386 п.н.).
Анализ длины тела и ряда диагностических признаков у плотвы, леща, гибридов F1 и бэккроссов. Межвидовые различия R. rutilus и A. brama по длине (LS) и высоте тела (H), общему числу позвонков (Vert) и другим диагностическим признакам были статистически значимы на стадии сеголетка и производителей (Tukey HSD, р < 0.05) (табл. 1, рис. 2).
Рис. 2.
Сравнение длины (Ls) и высоты тела (H) R. rutilus, A. brama, гибридов AR, RA и бэккроссов: а – показаны три диапазона вариации высоты тела у сеголетков плотвы, леща, гибридов F1 и Fb с данными длины тела; б – длина тела у половозрелых особей A. brama значительно отличается от R. rutilus, и их реципрокных гибридов (Tukey HSD, р < 0.05, n.s. – нет различий).
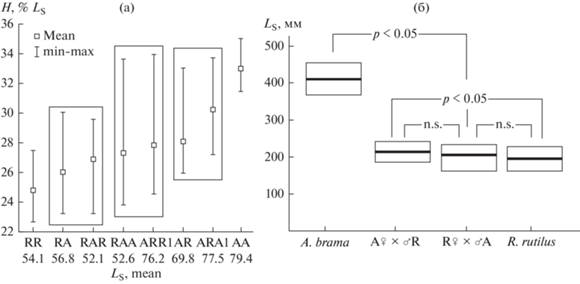
В скрещивании ♀R × ♂A, где самка меньше самца по размеру тела (♀ < ♂), на стадии сеголетка гибриды по средним значениям и диапазону вариации длины и высоты тела были сходны с материнским, меньшим видом из пары – R. rutilus (Tukey HSD, р > 0.05) (рис. 2а, 2б). Значения гибридного индекса по LS, H и числу лучей в анальном плавнике подтверждают сходство гибридов RA с материнским видом. По общему числу позвонков и типу осевого скелета (Va < Vc) гибриды RA сходны с лещом.
В скрещивании A × R (♀ > ♂) на стадии сеголетка по LS гибриды отличались от выборок R × A, R × R и A × A (Tukey HSD, р < 0.05) и имели промежуточные значения между родительскими видами (HI = 51), что может быть связано с большей скоростью роста, наследуемой от леща. По высоте тела и другим диагностическим признакам показано значительное отклонение гибридов AR к отцовскому виду (табл. 1). Это свидетельствует о наличии общей тенденции в проявлении комплекса признаков, когда все диагностические признаки демонстрируют сходство с одним родительским видом, что указывает на устойчивую траекторию развития. У гибридов RA отсутствует общая тенденция в проявлении диагностических признаков: имеются как промежуточные значения HI (по l.l.), так и сходные с самкой (по LS, H, Ab) и самцом (по Vert), т.е. наблюдается неустойчивая траектория развития гибридов. Сходство между реципрокными гибридами выявлено в проявлении отцовского эффекта в отношении числа позвонков и типа осевого скелета.
По средним значениям и диапазону вариации длины тела, а также значениям гибридного индекса в выборках производителей показано, что гибриды A × R (223.74 ± 4.67; 181–260 мм, HI = 85) и R × A (208.82 ± 7.76; 165–263 мм, HI = 8) имеют большее сходство с меньшим видом из пары – R. rutilus (192 ± 4.28; 152–250 мм), чем с A. brama (403.42 ± 5.77; 354–463 мм). Следует отметить, что при отсутствии статистических различий между реципрокными гибридами, различия наблюдаются между выборками гибридов A × R и плотвы (Tukey HSD, р < 0.05) (рис. 2б). Эти данные свидетельствуют, что даже самые крупные гибридные особи с длиной тела 255–263 мм (10% выборки) находятся в диапазоне изменчивости R. rutilus и не достигают ни промежуточных значений с выборкой леща (298 мм), ни минимальных значений длины тела, выявленных у леща (354 мм).
Учитывая отсутствие различий по размерам тела между гибридами RA и AR (Tukey HSD, р < 0.05), в поглотительном скрещивании AR × R1 размеры тела самца и самки будут одинаковы (♀ = ♂), а в скрещивании RA × A самка меньше самца по размеру тела, как и при межвидовом скрещивании R × A (рис. 3). На рис. 1 в потомстве возвратного скрещивания RA × A1 показаны два класса бэккроссов с одним и двумя фрагментами ITS1 рДНК. Один фрагмент ITS1 рДНК леща идентифицирует класс аллоплазматических бэккроссов RAA с ядерным геномом A. brama и мтДНК R. rutilus; два фрагмента ITS1 рДНК указывают на бэккроссов RA с гибридным ядерным геномом. Между особями двух генотипов ITS1 рДНК в потомстве по морфологическим признакам различий не установлено.
Рис. 3.
Различие размеров тела самки и самца в межвидовых реципрокных скрещиваниях ♀A × ♂R и ♀R × ♂A, а также сравнение скрещиваний с интрогрессией мтДНК R. rutilus ♀RA × ♂A и A. brama ♀AR × ♂R, как результат нарушения отцовского эффекта в отношении размеров тела (LS, H) у гибридов R × A.
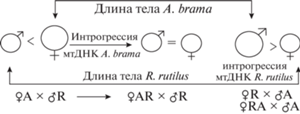
Длина тела – единственный признак, по которому два потомства одной гибридной самки (полусибсы) сходны друг с другом и материнским видом по средним значениям и диапазону вариации признака (Tukey HSD, р > 0.05), хотя между выборками бэккроссов AR × R1 и леща (А × А) сходство недостоверное (Tukey HSD, р < 0.05). Соответственно, аллоплазматические бэккроссы RAA (RA × A) и ARR (AR × R1), с восстановленным ядерным геномом одного вида имеют длину тела другого родительского вида (табл. 1, рис. 1, рис. 2). По-видимому, наследование длины тела в возвратных скрещиваниях с участием гибридных самок происходит под влиянием митохондриальных генов. Диапазоны вариации высоты тела в потомствах обратных конгруэнтных скрещиваний AR × A1 (27–34% длины тела) и RA × R (23–30%) совпадают с реципрокными гибридами AR и RA соответственно (рис. 2а). В потомствах инконгруэнтных скрещиваний RA × A и AR × R1 по высоте тела формируется третий интервал 24–34%, включающий все вариации данного признака у родительских видов. При этом по средним значениям оба потомства близки к выборке R. rutilus.
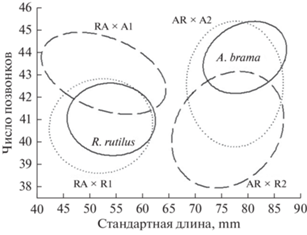
Число позвонков (Vert) у плотвы и леща имеет положительную корреляцию с длиной тела и наследуется в потомстве Fb патроклинно, от самца (табл. 1, рис. 4). Отсутствие различий по числу позвонков и типу осевого скелета между выборкой A. brama и бэккроссами RA × A (с мтДНК плотвы), а также между выборкой R. rutilus и бэккроссами AR × R1 (с мтДНК леща) (Tukey HSD, р > 0.05) свидетельствует о сохранении контроля ядерными генами в отношении данных признаков, в отличие от длины тела. В связи с различиями характера наследования LS и Vert, в потомствах инконгруэнтных скрещиваний RA × A и AR × R1 происходит формирование двух новых комбинаций данных признаков, которые отличаются от обоих родительских видов и друг от друга (рис. 4). При этом бэккроссы потомства RA × A наследуют меньший размер тела R. rutilus, большее число позвонков и осевой скелет A. brama (табл. 1), что может указывать на проблемы при движении. Бэккроссы AR × R1 наследуют меньшее число позвонков плотвы и восстанавливают большую длину тела A. brama, чего не наблюдается в первом поколении гибридов.
Рис. 4.
Отношения между стандартной длиной (LS) и числом позвонков (Vert) у R. rutilus, A. brama и бэккроссов (показаны эллипсами с доверительной вероятностью 95%): положительная корреляция LS и Vert у родительских видов (сплошные линии) и у гибридов конгруэнтных скрещиваний (RA × R1, AR × A2) (пунктирные линии). У гибридов инконгруэнтных скрещиваний (RA × A1, AR × R2) (штриховые линии) показана отрицательная связь LS и Vert с образованием двух новых сочетаний признаков. AR, RA-реципрокные гибридные самки F1, R – самец R. rutilus, A – самец A. brama.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Наследование размеров тела у гибридов плотвы и леща в реципрокных направлениях скрещивания. Размер тела считается количественной характеристикой, находящейся под эволюционным контролем, поскольку связана со многими физиологическими параметрами – скоростью метаболизма, температурной регуляцией, передвижением, скоростью роста, плодовитостью, временем созревания гонад и т.д. (Purdom, 1979; Озернюк, 1985; McLain, 1993; Blanckenhorn, 2000). Как известно из селекционной практики, по всем хозяйственно-полезным признакам у гибридов должен существовать “отцовский эффект” – некоторое доминирование признака отцовской породы (Максимовский, 1988; Геодакян, 2012). Согласно эволюционной теории пола, по длине тела (LS) и общему числу позвонков (Vert) вклад отца должен быть больше. При гибридизации плотвы и язя (Leuciscus idus L.) показано, что в отношении достижения половой зрелости и длины тела гибриды подобны родительским видам по мужской линии (Kopiejewska et al., 2003). Соответственно, доминирование одной родительской формы над другой у реципрокных гибридов F1 (отсутствие реципрокного эффекта), когда один из них не наследует признак (длину тела) самца (нарушение отцовского эффекта), может рассматриваться как отклонение от нормальной траектории развития из-за нарушения интегрированности генома (Кирпичников, 1987), что сопровождается снижением взаимосвязей между признаками и может влиять на адаптацию гибридов.
Полученные данные позволяют сделать вывод, что длина тела более крупного вида из пары (Abramis brama) не наследуется в F1, что указывает на отклонение в развитии гибридов RA. По числу позвонков гибриды RA менее сходны с самцом леща (HI = 63), чем гибриды AR с самцом плотвы (HI = 98) (табл. 1). Аналогичный результат получен в эксперименте c этими видами рыб в работе (Matondo et al., 2008) и при сравнении массы тела у гибридов плотоядных мышей рода Onychomys (Shipley et al., 2016). Во всех случаях реципрокные гибриды по размерам и массе тела находились в диапазоне изменчивости меньшего родительского вида. Значительное отклонение к Rutilus rutilus по длине тела (Konopinski, 2018) и скорости роста (Кодухова, 2008) показано у естественных гибридов. Учитывая, что 97% природных гибридов имеет мтДНК леща (Hayden et al., 2010), их сходство по длине тела с плотвой согласуется с результатами данного исследования. Таким образом, нарушение наследования длины тела регистрируется у гибридов RA с низкой приспособленностью в природе (3%) и показано в скрещивании с участием самки более мелкого вида из пары с высоким уровнем замен в мтДНК, что совпадает с направлением межгеномного конфликта в потомстве бэккроссов плотвы и леща (Столбунова, 2017) и у пресноводных рыб Centrarchidae (Bolnick et al., 2006).
При естественной гибридизации у рептилий и рыб, включая плотву и леща (Bolnick et al., 2006; Hayden et al., 2010; López et al., 2018), самка крупнее по размеру тела, чем самец (♀A > ♂R) и имеет низкую скорость накопления замен в мтДНК. Интересно, что по данным эксперимента гибрид AR наследует длину тела самца R. rutilus и в поглотительном скрещивании оба родителя имеют длину тела меньшего вида из пары ♀AR × ♂R (рис. 3, ♀ = ♂), а потомство данного скрещивания – бэккроссы ARR с ядерным геномом плотвы наследуют большую длину тела A. brama, чего не наблюдается в F1. Длина тела материнского вида у бэккроссов ARR и RAA с восстановленным ядерным геномом самца свидетельствует о влиянии митохондриальных генов на наследование данного признака (рис. 4).
Механизм нарушения ядерно-цитоплазматической совместимости геномов плотвы и леща в первом поколении гибридов. Выявленные различия между реципрокными гибридами указывают на влияние ядерно-цитоплазматических взаимодействий, нарушение которых наблюдается у гибридов с мтДНК плотвы уже в F1. Высокий уровень дивергенции R. rutilus и A. brama по генам дыхательной цепи митохондрий считался основной причиной конфликта между мтДНК плотвы и ядерным геномом A. brama (более подробное описание дано в (Stolbunova et al., 2020). В F1 данный механизм не может быть использован для объяснения межгеномного конфликта, поскольку один из гаплоидных геномов совместим с мтДНК. Поэтому здесь в качестве эндогенного фактора низкой совместимости геномов в F1 мы рассматриваем проблемы при активации эмбрионального генома, связанные с различиями R. rutilus и A. brama по размеру генома, положительно коррелирующего с числом и вариабельностью копий рДНК (Гинатулин, 1984; Prokopowich et al., 2003; Луданный, 2008) и размером тела. Связь между вариабельностью региона ITS рДНК и массой тела показана также у мышей рода Onychomys (Allard, Honeycutt, 1991). Одно из объяснений этой связи – большее число РНК-кодирующих генов способствует синтезу большего числа рибосом и может вести к увеличению трансляционной активности в клетке (Честков, 2018).
Известно, что с увеличением количества ДНК в ядре возрастает продолжительность митотического цикла (Беннетт, 1986). Так, увеличение размера генома леща в 1.3 раза по сравнению с плотвой замедляет развитие в раннем эмбриогенезе на пять часов (Лапушкина, 2002). Сходство реципрокных гибридов RA, AR с материнским видом по скорости развития и уровню вариабельности ITS региона рДНК предполагает изменение донорной рДНК самца (Столбунова, Кодухова, 2021), что отмечено и в других работах (Gangloff et al., 1996; Fujiwara et al., 1997). Путем вставок или делеции повторов в гибридном зародыше происходит подгонка длительности митотических циклов (Рис и др., 1986), при этом донор по отцовской линии более уязвим к генетическим изменениям (Gill, 1991), что может указывать на влияние ядерно-цитоплазматических взаимодействий (Skalická et al., 2003). Данный эффект установлен в раннем эмбриогенезе гибридов и описан как доминирование рибосомных генов одного из родителей в результате конкуренции между неравным числом регуляторных элементов (Reeder, 1985).
В гибридах RA, у которых донорный гаплоидный геном самца A. brama больше по количеству ДНК, по-видимому, происходит сокращение числа повторов рДНК к уровню материнского вида за счет механизма генной конверсии, что снижает копийность донорной рДНК. Любая мутация в геноме реализуется на фоне определенного уровня синтеза белка, поэтому недостаточная копийность и, как следствие, уровень транскрипции рибосомных генов критичны для нормального роста и развития (Larson, 1991). Транскрипция рДНК строго регулируется со стороны митохондрий, которые обеспечивают изменение энергетических потребностей в разные периоды роста (Coelho et al., 2002). Участие мтДНК в биогенезе рибосом (транскрипции рРНК) и ретроградной регуляции экспрессии ядерных генов (Fujii, Toriyama, 2008) подтверждает важную роль ядерно-цитоплазматических взаимодействий в F1, а метаболический фенотип в гибридах может лежать в основе низкой совместимости чужеродных геномов, приводящей к репродуктивной изоляции (Shipley et al., 2016), когда возникает несоответствие между спросом донорного генома самца и предложением митохондриального генома самки (Schrader et al., 2013).
Изменчивость митохондриального генома проявляется не только накоплением нуклеотидных замен (скорость которых отличается у разных видов и в 10 раз выше, чем ядерных генов), но и изменением числа копий мтДНК на клетку, которое сильно варьирует в зависимости от типа клеток, тканей и метаболического состояния (Rocher et al., 2008). Окислительное фосфорилирование находится под жестким контролем количества митохондрий, благодаря которым стало возможным увеличение размера генома у эукариот (Lane, Martin, 2010). О важной роли рДНК как повторяющегося элемента, а не как кодирующего гена указано в работе (Prokopowich et al., 2003). Недавно показано, что в геноме человека число копий рДНК отрицательно коррелирует с числом копий мтДНК, а изменение этого соотношения ведет к скоординированным изменениям генной экспрессии (Gibbons et al., 2014). В частности, увеличение числа копий рДНК и мтДНК было ассоциировано с шизофренией (Честков, 2018).
Показано, что число копий мтДНК имеет линейную зависимость со скоростью метаболизма (Rocher et al., 2008), а скорость метаболизма отрицательно связана с размером генома (Vinogradov, Anatskaya, 2006) и размером тела (Озернюк, 1985). При этом сформулирована концепция о независимом влиянии размера тела и генома на уровень метаболического обмена животных. Скорость метаболизма и утечка свободных радикалов влияют на соответствие митохондриально-ядерных дыхательных комплексов, субоптимальное соответствие будет иметь негативное влияние на ключевые физиологические процессы, включая рост, развитие и фертильность (Lane, 2011).
В большем по размеру геноме A. brama показано большее число и вариабельность копий рДНК на 12.6%, а уровень накопления замен в мтДНК и скорость метаболизма ниже, чем у R. rutilus. В соответствии с исследованиями (Koonin, Wolf, 2006; Rocher et al., 2008; Lane, 2011) это значит, что у леща меньше митохондрий на клетку, ниже утечка свободных радикалов и выше экспрессия генов энергетического обмена, чем у плотвы. Вероятно, в ходе эволюции A. brama отбор был направлен на снижение скорости замен в мтДНК и точное митохондриально-ядерное соответствие дыхательных компонентов, что позволило виду иметь большой размер тела, который у рыб, как и яркая окраска перьев у самцов птиц, может служить сигналом о высокой эффективности дыхательных комплексов (Hill, Johnson, 2013). Соответственно, у A. brama (число митохондрий меньше числа копий рДНК) и R. rutilus (число митохондрий больше числа копий рДНК) наблюдаются прямо противоположные системы с обратным отношением между числом и вариабельностью копий мтДНК и рДНК. Это указывает на неравную скорость эволюции мтДНК и рДНК плотвы и леща не только, как структурных генов, но и как повторяющихся элементов. В реципрокных гибридах формируются новые функциональные отношения между повторами мтДНК и донорной рДНК, так как уровень метаболизма и мтДНК гибриды наследуют по материнской линии (Shipley et al., 2016). Как и при патологии человека, у гибридов RA происходит объединение высококопийных и высоковариабельных донорной рДНК леща и мтДНК плотвы. Высокая скорость мутаций мтДНК плотвы свидетельствует о низкой экспрессии генов энергетического обмена, низком соответствии митохондриально-ядерных дыхательных компонентов и высокой утечке свободных радикалов, а митохондриальный биогенез в ответ на сокращение числа и вариабельности копий донорной рДНК у гибридов RA, вероятно, не способен оптимизировать клеточное дыхание под потребности донорного генома самца леща. Если затраты энергии на развитие признака не могут быть предоставлены, признак блокируется по энергетическим причинам (Lane, Martin, 2010).
Исследования на Drosophila показали, что экспрессия генов мтДНК реагирует на сконструированные делеции повторов рДНК (Gibbons et al., 2014), а изменение метаболизма может влиять на изменение признаков (Marckmann, 1954). Наличие подобных функциональных отношений между мтДНК и рДНК связывает синтез белка и выработку энергии, и позволяет предполагать о коэволюции этих сложных мультигенных комплексов (Coelho et al., 2002; Rand et al., 2004; Gibbons et al., 2014). Однако, если для функции дыхания и выработки энергии важна совместимость мтДНК и яДНК по генам дыхательной цепи, то для биогенеза рибосом важным условием является поддержание определенного соотношения между числом копий мтДНК и ядерной рДНК, что в зависимости от разных потребностей позволяет клеткам динамично корректировать выработку энергии для экспрессии сотен генов. Поэтому различия видов по размеру генома и в семействах повторяющихся последовательностей, которые коррелируют с фенотипической изменчивостью и социальным поведением животных (Richard et al., 2008), могут рассматриваться в качестве причины нарушения регуляторной совместимости чужеродных геномов и приводить к снижению приспособленности гибридов (Flavell, 1982). Негативные эффекты таких различий обнаружены нами при сокращении избыточной ДНК самца у гибридов RA, что может указывать на важную роль повторов в структуре генома и адаптивной эволюции. Соответственно, репродуктивная изоляция при гибридизации R. rutilus и A. brama обеспечивается не только за счет высокого уровня дивергенции структурных генов по модели межгеномного конфликта Добжанского-Меллера, проявляющаяся лишь во втором поколении гибридов (Столбунова, 2017), но и за счет неравной скорости эволюции повторяющейся ДНК, что имеет более быстрые последствия, поскольку нарушения происходят уже в первом поколении гибридов.
Ответом на вопрос, почему высокая скорость накопления мутаций в мтДНК обнаруживалась у более мелкого по размеру тела вида из пары, может быть более высокая степень его специализации. Одна из характерных черт эволюции во многих группах животных, включая телеостов, – тенденция, что более развитые виды теряют части (например, кости) и демонстрируют специализацию оставшихся частей (Rensch, 1959, глава VI). Это часто сопровождается изменениями формы тела (Hinegardner, 1968). Такие виды имеют меньше ДНК и высокую изменчивость структурных генов (Pierce, Mitton, 1980). По мнению В.А. Бердникова (1991), это снижает их эволюционный потенциал, поскольку видообразовательные события связаны не с изменением в структурных генах, а с изменением их онтогенетической регуляции через эффект положения, гетерохронии и новые генные конструкции.
Выводы. В потомстве скрещивания R. rutilus × × A. brama (♀R <♂A), где самец леща имеет низкую скорость накопления замен в мтДНК и бóльшие размеры тела, чем самка, выявлено нарушение отцовского эффекта при наследовании длины тела, что свидетельствует об отклонении в развитии и объясняет редкость этого варианта в природе. Нарушение наследования длины тела у гибридов RA совпадает с направлением межгеномного конфликта в потомстве бэккроссов плотвы и леща (Столбунова, 2017) и у пресноводных рыб Centrarchidae (Bolnick et al., 2006). Предложенный механизм репродуктивной изоляции в F1 связан с различиями R. rutilus и A. brama по скорости эволюции некодирующей избыточной ДНК и размеру генома (Гинатулин, 1984), который положительно связан с размером тела. У крупного по размеру тела и генома леща высокое число и вариабельность копий рДНК, которое положительно коррелирует с размером генома (Prokopowich et al., 2003), сочетается с низкой скоростью накопления замен в мтДНК и низким числом митохондрий на клетку. У плотвы наоборот. Соотношение между числом повтором рДНК и митохондрий на клетку важно для транскрипции рибосомных генов и обеспечения энергией в разные периоды роста. В реципрокных гибридах формируются новые соотношения между повторами рДНК и мтДНК, так как мтДНК они наследуют от самки, а донорный ядерный геном от самца. При этом для прохождения митоза в гибридном геноме происходит выравнивание повторов донорной рДНК к уровню материнского вида (Луданный, 2008). Предположительно, сокращение повторов у гибридов RA ведет к недостаточной копийности и уровню транскрипции рибосомных генов, что оказывает негативное влияние на их развитие. Кроме того, высокая скорость замен в мтДНК и большое число митохондрий на клетку у R. rutilus указывают на субоптимальное митохондриально-ядерное соответствие дыхательных комплексов у гибридов RA, что подавляет развитие признака с высокой аэробной приспособленностью, такого как большой размер тела. Неспособность материнского генома оптимизировать клеточное дыхание (за счет изменения количества митохондрий на клетку) под потребности донорного генома блокирует развитие сложного признака (большого размера тела) у гибридов RA и по энергетическим причинам. Таким образом, дивергенция R. rutilus и A. brama по количеству избыточной ДНК (числу копий рДНК), скорости эволюции мтДНК (включая число копий) и размеру тела ведет к различиям видов по количеству регуляторных элементов и механизмам регулирования геномов, что нарушает совместимость геномов при интрогрессии мтДНК плотвы уже в F1.
Список литературы
Атлас пресноводных рыб России. 2003. Москва: Наука.
Беннетт M.Д. 1986. Нуклеотипическая основа пространственной упорядоченности хромосом эукариот и ее значение для эволюции генома и фенотипической изменчивости // Эволюция генома. Москва: Мир. С. 234.
Бердников В.А. 1991. Эволюция и прогресс. Новосибирск: Наука.
Геодакян В.А. 2012. Два пола. Зачем и почему? Эволюционная теория пола. Москва: эл. издание. ISBN: 978-0-9856620-0-4
Гинатулин А.А. 1984. Структура, организация и эволюция генома позвоночных. Москва: Наука.
Голубовский М.Д. 2000. Век генетики: эволюция идей и понятий. Санкт-Петербург: Борей Арт.
Кирпичников В.С. 1987. Генетика и селекция рыб. Ленинград: Наука.
Кодухова Ю.В. 2008. Морфологические и экологические особенности гибридов первого поколения леща Abramis brama L. и плотвы Rutilus rutilus L. (Cyprinidae): Автореф. дис…. канд. биол. наук. Борок: Ин-т биологии внутр. вод РАН.
Кодухова Ю.В. 2010. Морфологическая характеристика потомства от гибридов первого поколения леща (Abramis brama L.) и плотвы (Rutilus rutilus L.) при бэккросссировании. Матер. IV шк.-конф. молодых ученых. Борок. С. 56.
Крыжановский С.Г. 1968. Закономерности развития гибридов рыб различных систематических категорий. Москва: Наука.
Лапушкина Е.Е. 2002. Эколого-генетический анализ раннего развития отдаленных гибридов F1 леща (Abramis brama L.), плотвы (Rutilus rutilus L.) и синца (Abramis ballerus L.): Дис. … канд. биол. наук. Борок: Ин-т биологии внутр. вод РАН.
Луданный Р.И. 2008. Генетическая идентификация и дифференциация представителей семейства Карповых (Cyprinidae): Автореф. дис. … канд. биол. наук. Москва: Ин-т биологии гена РАН.
Максимовский Л.Ф. 1988. Возможности направленного воздействия на формирование соотношения полов потомства млекопитающих // Сельскохозяйственная биология. Т. 1. С. 10.
Озернюк Н.Д. 1985. Энергетический обмен в раннем онтогенезе рыб. Москва: Наука.
Патрушев Л.И. 2004. Искусственные генетические системы. Т. 1. Москва: Наука.
Правдин И.Ф. 1966. Руководство по изучению рыб (преимущественно пресноводных). Москва: Пищ. пром-сть.
Рис Г., Дженкинс Д., Сил А.Д. и др. 1986. О фенотипических эффектах изменений количества ДНК // Эволюция генома. Москва: Мир. С. 281.
Рябов И.Н. 1981. Методы гибридизации рыб на примере семейства карповых // Исследование размножения и развития рыб. Москва: Наука. С. 195.
Слынько Е.Е., Слынько Ю.В. 2010. Жизнеспособность гибридов первого поколения плотвы (Rutilus rutilus L.), леща (Abramis brama L.) и синца (Abramis ballerus L.) на ранних стадиях развития // Биология внутр. вод. № 2. С. 57.
Столбунова В.В. 2017. Межгеномный конфликт при отдаленной гибридизации плотвы (Rutilus rutilus L.) и леща (Abramis brama L.) // Успехи соврем. биологии. Т. 137. № 4. С. 361. https://doi.org/10.7868/S0042132417040044
Столбунова В.В., Кодухова Ю.В. 2021. Наследование ITS1 рДНК у реципрокных гибридов плотвы Rutilus rutilus (L.) и леща Abramis brama (L.) в раннем онтогенезе // Успехи соврем. биологии. Т. 141. № 1. С. 66. https://doi.org/10.31857/S0042132421010233
Формозов Н.А. 2007. Интрогресcия чужеродных митотипов как следствие гипотезы “передового края” Годфрея Хьюитта: влияние гетерогаметности самцов или самок и соотношения полов в расселяющих популяциях: Матер. конф. “Современные проблемы биологической эволюции”, к 100-летию Государственного Дарвинского музея. Москва, 17–20 сентября 2007. Москва: ГДМ. С. 155.
Честков И.В. 2018. Исследование вариабельности числа копий рРНК-кодирующих генов и митохондриальной ДНК в геноме пациентов с шизофренией: Автореф. дис. … канд. биол. наук. Москва: Мед.-генетич. науч. центр.
Allard M.W., Honeycutt R.L. 1991. Ribosomal DNA Variation Within and Between Species of Rodents, with Emphasis on the Genus Onychomys // Mol. Biol. Evol. V. 8. № 1. P. 71. https://doi.org/10.1093/oxfordjournals.molbev.a040637
Baerwald M., May B. 2004. Characterization of microsatellite loci for five members of the minnow family Cyprinidae found in the Sacramento-San Joaquin Delta and its tributaries // Mol. Ecol. Notes. № 4. P. 385.
Bateson W. 1909. Heredity and variation in modern lights // Danvin and Modmz Science. Cambridge: Cambridge Univ. Press. P. 85.
Bianco P.G., Aprea G., Balletto E. et al. 2004. The karyology of the cyprinid genera Scardinius and Rutilus in southern Europe // Ichthyol. Res. V. 51. P. 274.
Blankenhorn W.U. 2000. The evolution of body size: What keeps organisms small? // Q. Rev. Biol. V. 75. P. 385.
Bolnick D.I., Near T.J., Wainwright P.C. 2006. Body size divergence promotes post-zygotic reproductive isolation in centrarchids // Evol. Ecol. Res. V. 8. P. 903.
Bolnick D.I., Turelli M., López-Fernández H. et al. 2008. Accelerated Mitochondrial Evolution and “Darwin’s Corollary”: Asymmetric Viability of Reciprocal F1 Hybrids in Centrarchid Fishes // Genetics. V. 178. № 2. P. 1037. https://doi.org/10.1534
Boughman J.W. 2001. Divergent sexual selection enhances reproductive isolation in sticklebacks // Nature. V. 411. P. 944. https://doi.org/10.1038/35082064
Burke J.M., Arnold M.L. 2001. Genetics and the fitness of hybrids // Annu. Rev. Genet. V. 35. P. 31. https://doi.org/10.1146/annurev.genet.35.102401.085719
Coelho P.S.R., Bryan A.C., Kumar A. et al. 2002. A novel mitochondrial protein, Tar1p, is encoded on the antisense strand of the nuclear 25S rDNA // Genes & Development. V. 16. P. 2755. https://doi.org/10.1101/gad.1035002
Chan Kai M.A., Levin S.A. 2005. Leaky prezygotic isolation and porous genomes: rapid introgression of maternally inherited DNA // Evolution. V. 59. № 4. P. 720. https://www.jstor.org/stable/3449021
Dobzhansky T. 1937. Studies on Hybrid Sterility. I. Spermatogenesis in pure and hybrid Drosophila pseudoobscura // Zeitschrift für Zellforschung und mikroskopische Anatomie. V. 21. № 2. P. 169. https://doi.org/10.1007/bf00374056
Dowling T.E., DeMarais B.D. 1993. Evolutionary significance of introgressive hybridization in cyprinid fishes // Nature. V. 362. P. 444.
Economidis P.S., Wheeler A. 1989. Hybrids of Abramis brama with Scardinius erythrophthalmus and Rutilus rutilus from Lake Volvi, Macedonia, Greece // J. Fish Biol. V. 35. № 2. P. 295. https://doi.org/10.1111/j.1095-8649.1989.tb02978.x
Flavell R.B. 1982. Sequence amplification, deletion and rearrangement: major sources of variation during species divergence // Genome Evolution. L.: Acad. Press. P. 301.
Ellison Ch.K., Burton R.S. 2006. Disruption of mitochondrial function in interpopulation hybrids of Tigriopus californicus // Evolution. V. 60. № 7. P. 1382.
Fujii S., Toriyama K. 2008. Genome barriers between nuclei and mitochondria exemplified by cytoplasmic male sterility // Plant and Cell Physiology. V. 49. № 10. P. 1484. https://doi.org/10.1093/pcp/pcn102
Fujiwara A., Abe S., Yamaha E. et al. 1997. Uniparental chromosome elimination in the early embryogenesis of the inviable salmonid hybrids between masu salmon female and rainbow trout male // Chromosoma. V. 106. P. 44.
Gangloff S., Zou H., Rothstein R. 1996. Gene conversion plays the major role in controlling the stability of large tandem repeats in yeast // EMBO J. V. 15. P. 1715.
Gibbons J.G., Branco A.T., Yu S., Lemos B. 2014. Ribosomal DNA copy number is coupled with gene expression variation and mitochondrial abundance in humans // Nat. Commun. V. 5. P. 4850. https://doi.org/10.1038/ncomms5850
Gill B.S. 1991. Nucleocytoplasmic interactions (NCI) hypothesis of genome evolution and speciation in polyploid plants // Proceedings of the Kihara Memorial International Symposium on cytoplasmis engineering in wheat. Japan: Yokohama. P. 48.
Gregory T.R. 2013. Animal genome size database. https://www.genomesize.com
Hayden B., Pulcini D., Kelly-Quinn M. et al. 2010. Hybridisation between two cyprinid fishes in a novel habitat: genetics, morphology and life-history traits // Evol. Biol. V. 10. P. 169.
Hayden B., Coscia I., Mariani S. 2011. Low cytochrome b variation in bream Abramis brama // J. Fish Biol. V. 78. P. 1579. https://doi.org/10.1111/j.1095-8649.2011.02941.x
Hill G.E., Johnson J.D. 2013. The mitonuclear compatibility hypothesis of sexual selection // Proc. Biol. Sci. 2013280:20131314. https://doi.org/10.1098/rspb.2013.1314
Hinegardner R. 1968. Evolution of Cellular DNA Content in Teleost Fishes // The American Naturalist. V. 102. № 928. P. 517. https://doi.org/10.1086/282564
Hubbs C.L., Kuronuma K. 1942. Hybridization in nature between two genera of flounders in Japan // Papers Michigan Acad. Sci., Arts and Letters. V. 27. P. 267.
Kopiejewska W., Terlecki J., Chybowski L. 2003. Varied somatic growth and sex cell development in reciprocal hybrids of roach Rutilus rutilus (L.) and ide Leuciscus idus (L.) // Arch. Polish Fisheries. V. 11. № 1. P. 33. https://doi.org/10.3750/AIP2004.34.1.05
Konopinski M.K., Amirowicz A. 2018. Genetic composition of a population of natural common bream Abramis brama × roach Rutilus rutilus hybrids and their morphological characteristics in comparison with parent species // J. Fish Biol. V. 92. № 2. P. 365. https://doi.org/10.1111/jfb.13506
Koonin E.V., Wolf Y.I. 2006. Evolutionary Systems Biology: Links Between Gene Evolution and Function // Curr. Opin. Biotechnol. V. 17. P. 481.
Lane N. 2011. Mitonuclear match: optimizing fitness and fertility over generations drives ageing within generations // Bioessays. V. 33. P. 860. https://doi.org/10.1002/bies.201100051
Lane N., Martin W. 2010. The energetics of genome complexity // Nature. V. 467. P. 929.
Larson D.E., Zahradka P., Sells B.H. 1991. Control points in eucaryotic ribosome biogenesis // Biochem. Cell. Biol. V. 69. P. 5. https://doi.org/10.1139/o91-002
López G.J., Chiaraviglio M., Cardozo G. 2018. Macroevolution of sexual size dimorphism and reproduction-related phenotypic traits in lizards of the Chaco Domain // Evol. Biology. V. 18. P. 186. https://doi.org/10.1186/s12862-018-1299-6
Marckmann K. 1954. Is there any correlation between metabolism, and number of vertebrae (and other meristic characters) in the sea trout (Salmo trutta trutta L.) // Medd. Dan. fisk.-og havUnders. V. 1. № 3. P. 1.
Matondo B.N., Ovidio M., Poncin P. et al. 2008. Morphological recognition of artificial F1 hybrids between three common European cyprinid species: Rutilus rutilus, Blicca bjoerkna and Abramis brama // Acta Zool. Sin. V. 54. № 1. P. 144.
Mayr E. 1963. Animal species and evolution. Cambridge, MA: Harvard Univ. Press.
McKinnon J.S., Mori S., Blackman B.K. et al. Evidence for ecology’s role in speciation // Nature. 2004. V. 429. P. 294. https://doi.org/10.1038/nature02556
McLain D.K. 1993. Cope’s rules, sexual selection, and the loss of ecological plasticity // Oikos. V. 68. P. 490. https://doi.org/10.2307/3544917
Olmo E. 2003. Reptiles: a group of transition in the evolution of genome size and of the nucleotypic effect // Cytogenet Genome Res. V. 101. P. 166. https://doi.org/10.1159/000074174
Orr H.A., Turelli M. 2001. The evolution of postzygotic isolation: accumulating Dobzhansky-Muller incompatibilities // Evolution. V. 55. P. 10854. https://doi.org/10.1111/j.0014-3820.2001.tb00628.x
Muller H.J. 1942. Isolating mechanisms, evolution and temperature // Biol. Symp. V. 6. P. 71.
Pierce B.A., Mitton J.B. 1980. The relationship between genome size and genetic variation // Am. Nat. V. 116. P. 850.
Prokopowich C.D., Gregory T.R., Crease T.J. 2003. The correlation between rDNA copy number and genome size in eukaryotes // Genome. V. 46. P. 48.
Purdom C.E. 1979. Genetics of growth and reproduction in teleosts. Fish phenology: anabolic adaptiveness in teleosts. London; New York: Acad. Press. P. 207.
Rand D.M., Haney R.A., Fry A.J. 2004. Cytonuclear coevolution: the genomics of cooperation // Trends Ecol. Evol. V. 19. P. 645. https://doi.org/10.1016/j.tree.2004.10.003
Reeder R.H. 1985. Mechanisms of nucleolar dominance in animals and plants // J. Cell Biol. V. 101. P. 2013.
Rensch B. 1959. Evolution above the species level. New York: Columbia Univ. Press.
Richard G.F., Kerrest A., Dujon B. 2008. Comparative genomics and molecular dynamics of DNA repeats in eukaryotes // Microbiol. Mol. Biol. Rev. V. 72. № 4. P. 686. https://doi.org/10.1128/MMBR.00011-08
Rocher C., Taanman J.-W., Pierron D. et al. 2008. Influence of mitochondrial DNA level on cellular energy metabolism: implications for mitochondrial diseases // J. Bioenerg. Biomembr. V. 40. P. 59.
Schrader M., Fuller R.C., Travis J. 2013. Differences in offspring size predict the direction of isolation asymmetry between populations of a placental fish // Biology Letters. V. 9. № 55. P. 20130327. https://doi.org/10.1098/rsbl.2013.0327
Shipley J.R., Campbell P., Searle J.B., Pasch B. 2016. Asymmetric energetic costs in reciprocal-cross hybrids between carnivorous mice (Onychomys) // J. Exp. Biology. V. 219. P. 3803. https://doi.org/10.1242/jeb.148890
Skaliská K., Lim K.Y., Matyásek R. et al. 2003. Rapid evolution of parental rDNA in a synthetic tobacco allotetraploid line // Am. J. Bot. V. 90. № 7. P. 988. https://doi.org/10.3732/ajb.90.7.988
Stolbunova V.V., Pavlova V.V., Kodukhova Y.V. 2020. Asymmetric hybridization of roach Rutilus rutilus L. and common bream Abramis brama L. in controlled backcrosses: Genetic and morphological patterns // Biosyst. Divers. V. 28. № 4. P. 35. https://doi.org/10.15421/012048
Vinogradov A. E., Anatskaya O.V. 2006. Genome size and metabolic intensity in tetrapods: a tale of two lines // Proc. R. Soc. B. V. 273. P. 27. https://doi.org/10.1098/rspb.2005.3266
Wilson A.C., Maxson L.R., Sarish V.M. 1974. Two types of molecular evolution evidence from studies of interspecific hybridization // Proc. Nat. Acad. Sci. USA. V. 71. № 7. P. 2843. https://doi.org/10.1073/pnas.71.7.2843
Wirtz P. 1999. Mother species-father species: unidirectional hybridization in animals with female choice // Anim. Behav. V. 58. № 1. P. 1. https://doi.org/10.1006/anbe.1999.1144
Wyatt P.M.W., Pitts C.S., Butlin R.K. 2006. A molecular approach to detect hybridization between bream Abramis brama, roach Rutilus rutilus and rudd Scardinius erythrophthalmus // J. Fish Biol. V. 69. P. 52. https://doi.org/10.1111/j.1095-8649.2006.01104.x
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


