Биология внутренних вод, 2023, № 1, стр. 106-114
Паразиты рыб гиперприливного эстуария р. Пенжина (бассейн Охотского моря)
Т. Е. Буторина a, *, О. Ю. Бусарова a, М. В. Коваль b
a Дальневосточный государственный технический рыбохозяйственный университет
Владивосток, Россия
b Kaмчатский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии
Петропавловск-Камчатский, Россия
* E-mail: boutorina@mail.ru
Поступила в редакцию 15.04.2022
После доработки 02.06.2022
Принята к публикации 06.09.2022
- EDN: KSAKFP
- DOI: 10.31857/S0320965223010047
Аннотация
Изучен видовой состав паразитов рыб эстуария р. Пенжина (114 видов). Показано влияние специфических условий эстуария на паразитофауну. Высокие скорости течения, перемешивание пресных и морских вод, обилие органики определяют преобладание видов паразитов с морфологическими адаптациями для надежной фиксации на рыбах, толерантных к изменениям солености и связанных в жизненном цикле с бентосом. Отмечены переходы паразитов на нетипичных хозяев. Компонентные сообщества паразитов большинства видов рыб характеризуются высокими индексами разнообразия и выравненности и низкими – доминирования. В краевых популяциях щуки и сиговых рыб они сильно обеднены с выраженными доминантами и их сменой в онтогенезе. Арктические и тихоокеанские элементы в ихтиопаразитофауне свидетельствуют о влиянии на ее формирование Северного Ледовитого и Тихого океанов.
ВВЕДЕНИЕ
Одним из ключевых элементов любой экосистемы считаются паразиты, которые регулируют численность ее компонентов и поддерживают баланс (Hudson, 2005; Dougherty et al., 2016). Состав паразитов – удобный биологический индикатор (Бакай, 2021; Bakay, 2020), отражающий состояние экосистемы в целом (Lansberg et al., 1998; Palm, 2011).
Эстуарии крупных рек представляют собой высокопродуктивные переходные экосистемы (Elliott, Whitfield, 2011; Kолпаков, 2015), для которых характерен широкий диапазон изменения солености и температуры (Martino, Able, 2003; Harrison, Whitfield, 2006; Nicolas et al., 2010). Русловые эстуарии, к которым относится устье р. Пенжина, отличают высокая мутность воды и сильные течения (Harrison, Whitfield, 2006; Elliott, Whitfield, 2011; Мочек, Павлов, 2021) в сочетании с небольшой глубиной. Периодическая смена направления течения влияет на состав биоты (Горин и др., 2015; Коваль и др., 2018). Гидробионты адаптированы к экстремальным гидрологическим условиям и их изменениям (Peterson, Ross, 1991; Elliott et al., 2007; Elliott, Whitfield, 2011).
Паразитофауна рыб определяется спецификой конкретного эстуария (Snigirov et al., 2019). Река Пенжина уникальна для Дальнего Востока по разнообразию и составу ихтиофауны: в отличие от других рек Дальнего Востока, где доминируют проходные лососевые, в ней преобладает пресноводный комплекс рыб (сиговые, щука Esox lucius (Linnaeus), тонкохвостый налим Lota lota leptura Hubbs, Schulz, речной гольян Phoxinus phoxinus (Linnaeus), колымский подкаменщик Cottus kolymensis Sideleva et Goto и др.) (Коваль и др., 2015, 2018). Для эстуария р. Пенжина характерны гиперприливы, достигающие ≥13.0 м (Гидрометеорология…, 1998), самые высокие на тихоокеанском побережье России. Река Пенжина имеет очень своеобразную, протяженную устьевую область, границы между пресноводной, эстуарной и неритической зонами изменяются из-за периодических мощных приливно-отливных явлений. Пресноводные рыбы и их молодь заносятся в эстуарий и Пенжинскую губу, а солоноватоводные рыбы и ракообразные – вверх по р. Пенжина до 30 км, в отлив граница перемешивания вод эстуарной и неритической зон сдвигается в открытую часть Пенжинской губы до 20 км (Коваль и др., 2018). Вместе с тем, р. Пенжина изучена гораздо слабее других рек из-за труднодоступности и сложной проходимости. Ранее анализ ихтиопаразитофауны реки не проводили, за исключением паразитов отдельных видов рыб в устьевой области, информация о них разбросана по старым труднодоступным источникам.
Цель работы – исследовать видовое богатство паразитов рыб, сложившееся в нижнем течении р. Пенжина под влиянием гиперприливного эстуария. Для этого авторы получили новые данные о паразитофауне рыб, в том числе неисследованных ранее (Бусарова, Коваль, 2017; Boutorina et al., 2017; Буторина и др., 2018; Бусарова и др., 2019; Буторина, Коваль, 2019) и изучили состав паразитов рыб в целом, для его объективной оценки, объединив собственные и разрозненные литературные данные о паразитах рыб эстуария р. Пенжины (Boutorina et al., 2021).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
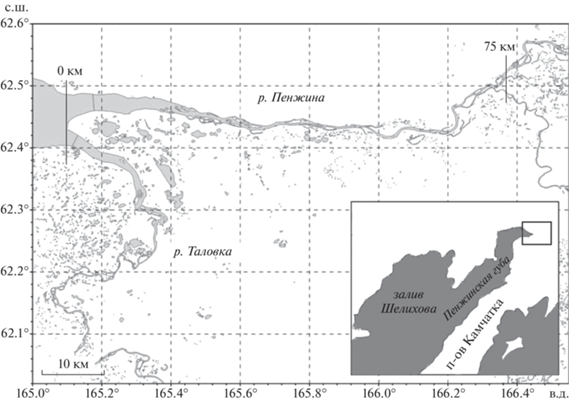
Река Пенжина – самая большая в Камчатской обл. по площади водосбора (73.5 тыс. км2), длиной 713 км (Горин и др., 2015). Берет начало на Колымском нагорье на высоте 740 м над уровнем моря, протекает между Колымским и Корякским нагорьями и Анадырским плоскогорьем и впадает в Пенжинскую губу Охотского моря (рис. 1). Две крупные реки Пенжина и Таловка образуют общую эстуарную область (рис. 1). В бассейне р. Пенжина обитает 21 вид рыб и круглоротых (Коваль и др., 2015).
Рыбы для исследования пойманы мальковым неводом размером 3 × 8 м с ячеей 4 мм и жаберными сетями в нижнем течении р. Пенжина на расстоянии 0–75 км от устьевого створа в июле 2015 г. (рис. 1). Их поместили в холодильник и доставили в лабораторию, где проводили дальнейшее исследование. У лососеобразных рыб определяли длину тела по Смитту (FL), у остальных – длину без хвостового плавника (SL) (табл. 1). Рыб обследовали на зараженность паразитами методом полного паразитологического вскрытия (Быховская-Павловская, 1985), рассчитывали стандартные показатели заражения: экстенсивность инвазии (ЭИ), % и индекс обилия (ИО) каждого вида паразитов. Для идентификации паразитов использовали определители, каталоги (Определитель…, 1984, 1985, 1987; Пугачев, 2001) и оригинальные работы (Коновалов, 1971; Nagasawa, Egusa, 1981; Пугачев, 1983; Moravec, 1994; Судариков и др., 2002; Mikhailova, Atrashkevich, 2008).
Таблица 1.
Размерно-массовые показатели исследованных видов рыб эстуария р. Пенжина
| Вид рыб | Длина тела, см | Масса тела, г | N, экз. |
|---|---|---|---|
| Phoxinus phoxinus | 5.6 ± 0.3 (4.1–7.0) | 1.7 ± 0.2 (0.65–2.85) | 30 |
| Pungitius pungitius | 5.8 ± 0.4 (4.8–6.7) | 1.34 ± 0.01 (0.85–2.10) | 20 |
| Thymallus arcticus mertensii Valenciennes, juv. | 14.9 ± 1.0 (7.5–25.4) | 54.3 ± 9.7 (4.1–205.0) | 25 |
| Cottus kolymensis | 6.3 ± 0.1 (3.9–11.0) | 5.1 ± 4.6 (1.4–26.4) | 32 |
| Prosopium cylindraceum, juv. | 14.7 ± 0.8 (9.0–23.0) | 42.9 ± 7.7 (7.2–139.5) | 25 |
| Coregonus pidschian (Gmelin), juv. | 11.5 ± 0.9 (8.0–22.0) | 33.0 ± 10.0 (6.8–177.4) | 19 |
| С. sardinella, juv. | 10.9 ± 1.8 (6.0–29.0) | 11.9 ± 10.5 (1.7–32.9) | 10 |
| C. subautumnalis, juv. | 7.8 ± 0.7 (5.0–18.0) | 11.1 ± 3.9 (1.4–70.3) | 22 |
Для изучения структуры компонентных сообществ паразитов конкретных видов рыб использовали индексы разнообразия Шеннона (H'), выравненности видов (E) по обилию и доминирования Бергера–Паркера (d) по числу особей (Мэгарран, 1992). К доминантным относили виды паразитов с наибольшим индексом обилия. Для оценки сходства сообществ паразитов использовали индекс Чекановского–Серенсена для качественных признаков.
Для анализа состава паразитов рыб использовали, кроме наших, опубликованные данные о паразитах рыб эстуария р. Пенжина (Трофименко, 1962; Скрябина, 1963; Казаков, 1967; Коновалов, 1967, 1971).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Видовой состав паразитов рыб эстуария р. Пенжина. У рыб в эстуарии р. Пенжина отмечено 114 видов паразитов, 81.1% пресноводных и 18.9% – морских. Наиболее богатую фауну паразитов имеют речной гольян (34 вида), тонкохвостый налим (23), камчатский хариус (22), молодь щуки (20), подкаменщик (19), наиболее бедную – молодь сибирской ряпушки Coregonus sardinella (Valenciennes) (четыре) и пенжинского омуля Coregonus subautumnalis Kaganowsky in Berg (шесть).
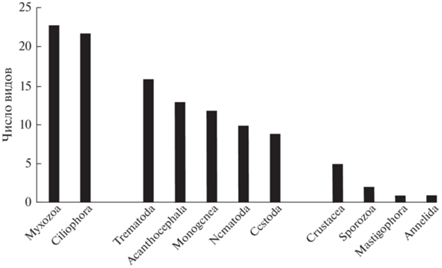
Большинство паразитов представлено миксоспоридиями и инфузориями, гельминты имеют промежуточное число видов; прочие группы – малое число видов (рис. 2). Миксоспоридии составляют 20.2% всего видового состава паразитов, на их долю приходится у Pungitius pungitius (Linnaeus) 45.5% видов, у подкаменщика – 26.3%, у сеголетков щуки – 23.8%, у гольяна – 18.8%. Инфузории – следующая по числу видов группа паразитов (19.3% видов). К ним относятся подвижные кругоресничные (11 видов) и сидячие формы рода Apiosoma (10 видов), один вид сосущих Capriniana piscium (Bütschli). Инфузории наиболее богато представлены у сеголетков щуки (50% видов), гольяна (43.8%) и подкаменщика (36.8%). Трематоды составили третью по числу видов группу (14.0%): морские преобладали среди половозрелых сосальщиков (66.7%), пресноводные представлены в основном личинками родов Diplostomum и Ichthyocotylurus (62.5%). Последние составляли 25.0–35.7% видов паразитов сиговых рыб, половозрелые морские чаще встречались (23.1–27.3% фауны) у проходных рыб – зубастой корюшки Osmerus dentex Steindachner et Kner и гольца Леванидова Salvelinus levanidovi Chereshnev, Skopetz et Gudkov.
Влияние специфических условий эстуария на состав паразитов
Высокие скорости течения. В устье р. Пенжина скорость течения летом достигает ≥1.5–2.0 м/c. Этот фактор определяет преобладание групп паразитов, морфологические особенности которых позволяют им удерживаться на рыбах. Сидячие инфузории рода Apiosoma, в отличие от других родов семейства, утратили стебель, снабжены подошвой для прикрепления и имеют относительно низкое тело в форме бочонка (Apiosoma incertum Pugachev) или широкого укороченного цилиндра (A. compacta Scheubel), у некоторых есть короткая толстая ножка (A. peculiforme (Zhukov), A. phoxini Lom, A. robusta (Zhukov)). Кругоресничные инфузории используют адоральный диск с развитым венчиком зубцов для прикрепления к плавникам и жабрам рыб. Сидячие и кругоресничные инфузории преобладают в паразитофауне рыб эстуария р. Пенжина, группы инфузорий со слабыми органами фиксации отсутствуют.
Обилие органики. Эстуарная область р. Пенжина характеризуется большим количеством органики, образующейся в результате мощного речного стока с огромной площади водосборного бассейна, приливно-отливные процессы вызывают размывание и взмучивание глинистых донных отложений. Избыток органики в воде создает благоприятные условия для определенных групп паразитов (инфузорий, миксоспоридий), высокую численность имеют виды, связанные с бентосом. Благодаря органике, бентос хорошо развит, планктон малочислен из-за постоянного сноса течениями.
Большинство исследованных видов рыб (71.4%) питается бентосом: личинками и куколками амфибиотических насекомых, амфиподами и олигохетами. По нашим данным, разные виды рыб специализируются на питании определенной группой, планктон в питании рыб отмечен единично. Рыбы инвазированы гельминтами Raphidascaris acus (Bloch), Neoechinorhynchus beringianus Mikhailova et Atrashkevich, Echinorhynchus cotti Yamaguti, метацеркариями родов Diplostomum и Ichthyocotylurus, промежуточные (или транспортные) хозяева которых – донные организмы.
В паразитофауне рыб слабо представлены виды, связанные с планктоном (например, цестоды). Видовой состав пресноводных цестод в реке беден (пять видов), интенсивность инвазии рыб единична (кроме специфичных паразитов щуки Triaenophorus nodulosus (Pallas) и T. crassus Forel), также заметна обедненность фауны моногеней (рис. 2), особенно у гольяна (два вида).
Переход паразитов на нехарактерных хозяев. В эстуарии р. Пенжина часты случаи перехода морских паразитов на пресноводных рыб и пресноводных на морских хозяев. Так, морские трематоды Prosorhynchoides gracilescens s. lato (Rudolphi) найдены у щуки, Podocotyle atomon (Rudolphi) – у гольяна, Pronoprymna petrowi (Layman) – у молоди сибирской ряпушки и пенжинского омуля, Brachyphallus crenatus (Rudolphi) – у налима, личинки морских скребней Corynosoma spp. – у щуки и налима. Скребень Echinorhynchus сotti в эстуарии р. Пенжина паразитирует у широкого круга рыб. При этом типичный хозяин колымский подкаменщик заражен E. сotti слабее (ЭИ = 9.4%; ИО = 0.4), чем нехарактерные: хариус (96%; 33.0) и пыжьян (84.2%; 5.9). Скребень Neoechinorhynchus beringianus обнаружен нами в эстуарии р. Пенжина и у девятииглой колюшки (20.0%; ИО = 0.4), и у гольяна (6.7%; ИО = 0.1). Eimeria gasterostei (Thelohan) и Diplostomum pungitii Shigin, также отмеченные нами у девятииглой колюшки в эстуарии р. Пенжина, заражают гольяна и подкаменщика. Нематода Pseudocapillaria salvelini (Polyansky) – гельминт лососеобразных рыб, в р. Пенжина встречается у подкаменщика.
Оценка компонентных сообществ паразитов рыб по экологическим индексам
Изучение компонентных сообществ паразитов рыб показало (табл. 2), что большое разнообразие и выравненность обилий видов характерны для гольяна, подкаменщика, хариуса, налима, в то время как низкие значения индекса разнообразия Шеннона отмечены у сиговых рыб, половозрелой щуки и молоди хариуса. Наиболее заметно обеднена фауна паразитов у сиговых рыб (сибирской ряпушки, пенжинского омуля, пыжьяна, валька) и половозрелой щуки.
Таблица 2.
Экологическая характеристика компонентных сообществ паразитов рыб эстуария р. Пенжина
| Вид ( Nп/N ) | H′ | E | d | Доминантные виды паразитов по численности |
|---|---|---|---|---|
| Phoxinus phoxinus (34/30) | 2.61 | 0.74 | 0.26 | Diplostomum phoxini |
| Cottus kolymensis (19/32) | 2.15 | 0.73 | 0.38 | Trichodina tumefaciens |
| Pungitius pungitius (11/20) | 2.04 | 0.85 | 0.36 | Neoechinorhynchus beringianus |
| Thymallus arcticus mertensii juv. (9/25) | 0.75 | 0.34 | 0.83 | Echinorhynchus cotti |
| T. arcticus mertensii половозр. (18/15) | 2.28 | 0.79 | 0.30 | Tetraonchus borealis |
| Coregonus sardinella juv. (4/10) | 1.08 | 0.78 | 0.59 | Pseudocapillaria salvelini |
| Coregonus subautumnalis juv. (6/22) | 1.44 | 0.81 | 0.47 | Echinorhynchus cotti |
| Coregonus pidschian juv. (6/19) | 0.82 | 0.46 | 0.73 | Echinorhynchus cotti |
| C. pidschian половозр. (6/15) | 0.70 | 0.39 | 0.76 | Proteocephalus longicollis |
| Prosopium cylindraceum juv. (4/25) | 1.29 | 0.93 | 0.38 | Echinorhynchus cotti |
| P. cylindraceum половозр. (7/15) | 1.06 | 0.54 | 0.68 | Ichthyocotylurus erraticus |
| Coregonus nasus (12/15) | 1.33 | 0.53 | 0.57 | Gyrodactylus lavareti |
| Lota lota leptura (23/15) | 2.39 | 0.76 | 0.44 | Triaenophorus nodulosus pl. |
| Esox lucius juv. (20/15) | 2.66 | 0.89 | 0.17 | Нет |
| E. lucius половозр. (11/15) | 0.94 | 0.39 | 0.66 | Triaenophorus monenteron |
| Salvelinus leucomaenis (10/5) | 1.83 | 0.63 | 0.34 | Brachyphallus crenatus |
| Salvelinus levanidovi (11/5) | 1.56 | 0.65 | 0.40 | Brachyphallus crenatus |
В компонентных сообществах паразитов разных видов рыб доминируют специфичные для них паразиты: Diplostomum phoxini (Faust) – у гольяна, Trichodina tumefaciens Davis – у подкаменщика, Gyrodactylus lavareti – у чира Coregonus nasus (Pallas), Tetraonchus monenteron (Wagener) – у щуки, у девятииглой колюшки – наиболее характерный для нее Neoechinorhynchus beringianus. У налима слабо выражено доминирование личинок щучьего паразита Triaenophorus nodulosus при высоком разнообразии паразитов (табл. 2).
В компонентном сообществе паразитов хариуса по мере увеличения размеров и созревания рыб происходит смена доминанта с Echinorhynchus сotti у молоди на Tetraonchus borealis (Ollson) у половозрелых рыб, расширяется видовой состав паразитов, растет разнообразие и выравненность обилий видов, снижается относительная значимость доминирующего вида (табл. 2). Обратная картина (сужение видового состава, снижение индексов H′, E и рост d наблюдается у щуки: у половозрелых рыб доминирует специфичный T. monenteron, сеголетки щуки заражаются паразитами других рыб при отсутствии доминанта (табл. 2). В сообществах паразитов пыжьяна Coregonus pidschian (Gmelin) и валька Prosopium cylindraceum (Penant) в онтогенезе также происходит смена доминанта, фоновый для эстуария р. Пенжина Echinorhynchus cotti (у молоди) замещается на Proteocephalus longicollis (Zeder) у пыжьяна и Ichthyocotylurus erraticus (Rudolphi) у валька с возрастом без увеличения видового разнообразия сообщества паразитов.
Оценка сходства видового состава паразитов рыб эстуария р. Пенжина
Наибольшее сходство состава паразитов отмечается между молодью сибирской ряпушки и пенжинского омуля, а также молодью пенжинского омуля и пыжьяна (на уровне 80.0%), для валька и пыжьяна индекс общности достигает 57.1%, у остальных рыб уровень сходства низок (≤40.8%), что не позволяет выделить в составном сообществе паразитов рыб какие-либо группы.
Среди паразитов рыб эстуария р. Пенжина по числу видов определяющее положение занимают группы паразитов, которые нуждаются в органике (сидячие инфузории и триходиниды) или используют организмы бентоса в качестве хозяев (диплостомиды – брюхоногих моллюсков, миксоспоридии и капиллярииды – олигохет). Вторая черта паразитофауны – частые находки пресноводных гельминтов массовых видов рыб р. Пенжина у нехарактерных для них хозяев. Это паразиты щуки (Triaenophorus nodulosus и Raphidascaris acus), девятииглой колюшки (Diplostomum pungitii и Neoechinorhynchus beringianus), которые инвазируют молодь пресноводных рыб. Третья особенность – обнаружение морских видов у пресноводных рыб. Почти всем исследованным видам рыб присуще питание в основном бентосом и заражение паразитами через бентосные трофические цепи.
Фаунистические комплексы паразитов рыб эстуария р. Пенжина
В фауне паразитов рыб устьевой области р. Пенжина представлены арктические (~61%) и тихоокеанские (39%) элементы. Основой фауны пресноводных паразитов служат представители бореального равнинного (28.3%) и арктического пресноводного (24.8%) фаунистических комплексов. В составе ихтиофауны к арктической группе отнесены Coregonus sardinella, Coregonus pidschian, Coregonus nasus, Prosopium cylindraceum, Phoxinus phoxinus, Esox lucius, Thymallus arcticus mertensii, Lota lota leptura, Cottus kolymensis. Тихоокеанская фауна представлена Oncorhynchus keta (Walbaum), Oncorhynchus gorbuscha (Walbaum), Oncorhynchus kisutch (Walbaum), Salvelinus malma (Walbaum), Salvelinus leucomaenis, Hypomesus olidus (Pallas), Osmerus dentex, Pungitius pungitius, Gasterosteus aculeatus Linnaeus, соотношение арктической и тихоокеанской групп рыб примерно равное.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Высокая скорость течения – один из механизмов отбора в сообществе паразитов рыб эстуария р. Пенжина, что проявляется в преобладании паразитов с развитыми органами фиксации (инфузории) и связанных с бентосными цепями питания, бедностью видов, легко сносимых течением (моногенеи) либо использующих планктонные организмы в качестве хозяев (цестоды и ряд других). Обеднение фауны моногеней в эстуарии р. Пенжина особенно наглядно при сравнении гольяна из р. Пенжина и других рек Дальнего Востока. В паразитофауне гольянов на моногеней приходится от 18.9% (р. Унгра, Якутия) до 43.8% всех видов (р. Колыма, Чукотка) (Пугачев, 1984; наши данные) в эстуарии р. Пенжина – лишь 6.3%. Сильные течения и частое перемешивание донных отложений (Романенко, 2015) способствуют заражению рыб паразитами, промежуточными хозяевами которых служат организмы бентоса.
Обилие автохтонной и аллохтонной органики в устьевой области р. Пенжина создает благоприятные условия для сидячих и кругоресничных инфузорий, достигающих высокой численности в местообитаниях с высоким содержанием органики, способствует высокой численности паразитов, жизненные циклы которых связаны с бентосом. Брюхоногие моллюски служат промежуточными хозяевами трематод сем. Strigeidae (Судариков и др., 2002), в олигохетах происходит развитие миксоспоридий (Okamura et al., 2015) и личинок нематод Pseudocapillaria salvelini (Ломакин, Трофименко, 1982), в амфиподах – скребней Echinorhynchus cotti (Nagasawa, Egusa, 1981), в бентосных остракодах рода Candona – скребней Neoechinorhynchus beringianus (Mikhailova, Atrashkevich, 2008). Личинки нематод Raphidascaris acus также аккумулируются в донных беспозвоночных: олигохетах, брюхоногих моллюсках, ракообразных, личинках водных насекомых (Smith, 1984; Moravec, 1994). Избыток органики во многом определяет преобладание в паразитарном сообществе рыб эстуария р. Пенжина инфузорий, миксоспоридий, личинок пресноводных трематод, нематод и скребней.
Заражение пресноводных рыб морскими паразитами происходит во время приливов, когда морские организмы заносятся в устье реки и вверх по течению, либо во время отливов, когда мелкие рыбы уносятся течением в солоновато-водную Пенжинскую губу. При этом увеличивается число контактов между морскими и пресноводными гидробионтами, растет вероятность поедания пресноводными рыбами эстуарных промежуточных хозяев и заражения пресноводных рыб морскими паразитами. Занесенные течениями пресноводные и морские виды временно становятся компонентами общей эстуарной системы, в которой происходит обмен паразитами.
Мелкие нехищные рыбы и молодь приобретают паразитов, характерных для массовых, фоновых видов рыб (Ермоленко, 1992; Amin et al., 2007; Атрашкевич и др., 2016), в нижнем течении р. Пенжина к ним относятся сиговые рыбы, хариус, девятииглая колюшка, налим, подкаменщик и щука; их паразиты чаще всего присутствуют у нетипичных хозяев.
Для большинства видов рыб эстуария р. Пенжина компонентные сообщества паразитов можно охарактеризовать как богатые по числу видов, выравненные по обилию и невысоким значениям доминирования видов, специфичных или характерных для рыб. Только у рыб из краевых популяций на границе ареала вида (щука, сиговые рыбы) компонентные сообщества паразитов характеризуются низкими значениями индексов разнообразия, выравненности обилий видов, высоким уровнем доминирования широко распространенных видов паразитов и сменой доминантов в онтогенезе.
В пресноводном компоненте паразитофауны рыб эстуария р. Пенжина преобладают представители арктического пресноводного и бореального равнинного комплексов, что характерно для сибирской фауны паразитов, становление которой происходило под определяющим влиянием Северного Ледовитого океана (Пугачев, 1984). Бассейн р. Пенжинa в разное историческое время был связан с бассейнами рек Анадырь и Колыма (Черешнев, 1996, 1998; Коваль и др., 2018), это отразилось на видовом составе рыб и их паразитов, вселение которых в р. Пенжинa происходило неоднократно через общие водоразделы рек Колыма и Пенжина, Пенжина и Анадырь. Паразитологические данные служат подтверждением формирования биоты р. Пенжина под влиянием Арктического и Тихого океанов.
Выводы. Основной фактор, определяющий состав фауны паразитов рыб в эстуарии р. Пенжина, – сильные приливно-отливные течения и связанные с ними явления. Среди паразитов рыб преобладают виды, имеющие морфологические адаптации для закрепления на теле рыб и связанные в жизненном цикле с организмами бентоса. Изменения направления течения, перемещения водных масс способствуют обмену паразитами между морскими и пресноводными рыбами и переходу паразитов на нетипичных хозяев. Сообщества паразитов массовых видов рыб характеризуются высоким видовым разнообразием и выравненностью, сообщества паразитов щуки и сиговых рыб в краевых популяциях имеют обедненный видовой состав. Фауна рыб и их паразитов в эстуарии р. Пенжина сложилась под влиянием Северного Ледовитого и Тихого океанов.
Список литературы
Атрашкевич Г.И., Михайлова E.И., Орловская O.M., Пoспехов В.В. 2016. Биоразнообразие скребней рыб пресных вод Азиатской Субарктики // Паразитология. Т. 50. Вып. 4. С. 263.
Бакай Ю.И. 2021. Сообщества паразитов как индикаторы экологии, внутривидовой и надвидовой структуры морских окуней рода Sebastes (Scorpaeniformes: Sebastidae) Атлантического и Северного Ледовитого океанов // Автореф. дис. … докт. биол. наук. Москва: Всерос. науч.-иссл. ин-т рыбн. хоз-ва и океаногр.
Бусарова О.Ю., Коваль М.В. 2017. О разнообразии паразитов камчатского хариуса (Thymallus arcticus mertensii) реки Пенжина, бассейн Охотского моря // Дальневосточные моря и их бассейны: биоразнообразие, ресурсы, экологические проблемы: Матер. 2 Всерос. конф. с межд. уч., приуроч. к году экологии в России. Владивосток: Дальневосточный федеральный ун-т. С. 20.
Бусарова О.Ю., Коваль М.В., Есин E.В., Maркевич Г.Н. 2019. Разделение трофических ниш молоди лососеобразных рыб в нижнем течении реки Пенжина (Камчатский край, Россия) // Заповедная наука. Вып. 4. № 2. С. 83. https://doi.org/10.24189/ncr.2019.018
Буторина Т.Е., Бусарова O.Ю., Коваль М.В. 2018. Паразитофауна полупроходной девятииглой колюшки Pungitius pungitius нижнего течения реки Пенжина // Паразитология. Т. 52. Вып. 3. С. 214.
Буторина Т.Е., Коваль М.В. 2019. Фауна паразитов обыкновенного гольяна Phoxinus phoxinus нижнего течения рек Пенжина и Таловка // Паразитология. Т. 53. Вып. 1. С. 61. https://doi.org/10.1134/S003118471901006X
Быховская-Павловская И.E. 1985. Паразиты рыб. Руководство по изучению. Ленинград: Наука.
Гидрометеорология и гидрохимия морей. Т. IX. Охотское море. № 1. Гидрометеорологические условия. 1998. Санкт-Петербург: Гидрометеоиздат.
Горин С.Л., Коваль M.B., Сазонов A.A., Teрский П.Н. 2015. Современный гидрологический режим нижнего течения реки Пенжина и первые сведения о гидрологических процессах в ее эстуарии (по материалам экспедиции 2014 г.) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 37. С. 33. https://doi.org/10.15853/2072-8212.2015.37.33-52
Ермоленко А.В. 1992. Паразиты рыб пресноводных водоемов континентальной части бассейна Японского моря. Владивосток: Дальневосточное отделение РАН.
Казаков Б.E. 1967. Новые данные о гельминтах корюшки и краткий экологический анализ ее гельминтофауны // Сборник работ по гельминтофауне рыб и птиц. Москва. Деп. № 162-67. С. 18.
Колпаков Н.В. 2015. Продукция макрозообентоса в эстуариях Приморья // Изв. ТИНРО. Т. 182. С. 197.
Коваль М.В., Есин Е.В., Бугаев А.В. и др. 2015. Пресноводная ихтиофауна рек Пенжина и Таловка (Северо-Западная Камчатка) // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 37. С. 53. https://doi.org/10.15853/2072-8212.2015.37.53-145
Коваль М.В., Есин Е.В., Горин С.Л. и др. 2018. Видовое разнообразие, распространение и расселение рыб в реках бассейна Пенжинской губы // Вопр. ихтиологии. Т. 58. № 5. С. 1. https://doi.org/10.1134/S0042875218050132
Коновалов С.М. 1967. Особенности паразитофауны щуки р. Пенжины // Паразитология. Т. 1. Вып. 6. С. 539.
Коновалов С.М. 1971. Дифференциация локальных стад нерки Oncorhynchus nerka (Walbaum). Ленинград: Наука.
Ломакин В.В., Tрофименко В.Я. 1982. Капиллярииды (Nematoda: Carpillariidae) пресноводных рыб фауны СССР // Тр. Гельминт. лаб. АН СССР. Т. 31. С. 60.
Мочек А.Д., Павлов Д.С. 2021. Сравнительный анализ распределения рыб в лимнических и лотических водных объектах (обзор) // Биология внутр. вод. № 2. С. 179. https://doi.org/10.31857/S032096522102011X
Мэгарран Э. 1992. Экологическое разнообразие и его измерение. Москва: Мир. (Magurran A.E. 1983. Ecological Diversity and its measurement. London: Croom Helm Royal Soc. Univ. Res. Fellow Univ. College of North Wales).
Определитель паразитов пресноводных рыб фауны СССР. 1984. Т. 1. Паразитические простейшие. Ленинград: Наука.
Определитель паразитов пресноводных рыб фауны СССР. 1985. Т. 2. Паразитические многоклеточные (Coelenterata and Monogenea). Ленинград: Наука.
Определитель паразитов пресноводных рыб фауны СССР. 1987. Т. 3. Паразитические многоклеточные (Вторая чaсть). Ленинград: Наука.
Пугачев O.Н. 1983. Паразитические простейшие пресноводных рыб Северо-Востока СССР // Паразитол. сб. Т. 31. С. 158.
Пугачев O.Н. 1984. Паразиты пресноводных рыб Северо-Востока Азии. Ленинград: Зоол. ин-т АН СССР.
Пугачев O.Н. 2001. Каталог паразитов пресноводных рыб Северной Азии. Простейшие. Санкт-Петербург: Зоол. ин-т РАН.
Романенко Ф.A. 2015. Рельеф и рыхлые отложения нижнего течения реки Пенжины и прилегающей части Пенжинской губы // Исследования водных биологических ресурсов Камчатки и северо-западной части Тихого океана. № 37. С. 7.https://doi.org/10.15853/2072-8212.2015.37
Скрябина E.С. 1963. К гельминтофауне морских рыб Камчатки // Тр. Гельминт. лаб. АН СССР. Т. 13. С. 313.
Судариков В.E., Шигин A.A., Kурочкин Ю.В. и др. 2002. Метацеркарии трематод – паразиты пресноводных гидробионтов центральной России. Москва: Наука.
Трофименко В.Я. 1962. Материалы по гельминтофауне пресноводных и проходных рыб Камчатки // Тр. Гельминт. лаб. АН СССР. Т. 12. С. 232.
Черешнев И.А. 1996. Биологическое разнообразие пресноводной ихтиофауны Северо-Востока России. Владивосток: Дальнаука.
Черешнев И.А. 1998. Биогеография пресноводных рыб Дальнего Востока России. Владивосток: Дальнаука.
Amin O.M., Nagasawa K., Grygier M.J. 2007. Host and Seasonal Distribution of Fish Acanthocephalans from the Lake Biwa Basin, Japan // Comparative Parasitol. V. 74. № 2. P. 244. https://doi.org/10.1654/4283.1
Bakay Y.I. 2020. Ecological and Population features of beaked redfish Sebastes mentella (Sebastidae) in the Northwest Atlantic based on the analysis of its parasite fauna // J. Ichthyol. V. 60. P. 475. https://doi.org/10.1134/S0032945220030030
Boutorina T.E., Aseeva N.L., Koval M.V., Nguyen C.C. 2017. Parasite fauna of the bullhead Cottus kolymensis from downstreams of the Penzhina and Talovka rivers (North-East Asia) // Advances in Biology & Earth Sciences. V. 2. № 1. P. 92.
Boutorina T., Busarova O., Koval M. 2021. Data: Diversity of Fish parasites of the Penzhina River (Kamchatka Krai, Russia) // Dryad, Dataset. https://doi.org/10.5061/dryad.69p8cz92j
Dougherty E.R., Carlson C.J., Bueno V.M. et al. 2016. Paradigms for parasite conservation // Conserv. Biol. V. 30. № 4. P. 724.
Elliott M., Whitfield A.K., Potter I.C. et al. 2007. The guild approach to categorizing estuarine fish assemblages: a global review // Fish and Fisheries. V. 8. P. 241.
Elliott M., Whitfield A.K. 2011. Challenging paradigms in estuarine ecology and management // Estuarine, Coastal and Shelf Science. V. 94. P. 306. https://doi.org/10.1016/j.ecss.2011.06.016
Harrison T.D., Whitfield A.K. 2006. Estuarine typology and the structuring of fish communities in South Africa // Environ. Biol. Fishes. V. 75. P. 269. https://doi.org/10.1007/s10641-006-0028-y
Hudson P. 2005. Parasites, diversity, and the ecosystem // Parasitism and ecosystems. Oxford: Oxford University Press. P. 1.
Landsberg J., Blakesley B., Reese R. et al. 1998. Parasites of Fish as Indicators of Environmental Stress // Environ. Monit. Assess. V. 51. P. 211.
Martino E.J., Able K.W. 2003. Fish assemblages across the marine to low salinity transition zone of a temperate estuary // Estuarine, Coastal and Shelf Science. V. 56. P. 969.
Mikhailova E.I., Atrashkevich G.I. 2008. Description and morphological variability of Neoechinorhynchus beringianus n.sp. (Acanthocephala: Neoechinorhynchidae) from North-Eastern Asia // Syst. Parasitol. V. 71. P. 41. https://doi.org/10.1007/s11230-008-9145-7
Moravec F. 1994. Parasitic nematodes of freshwater fishes of Europe. Prague: Academia Press.
Nagasawa K., Egusa S. 1981. Echinorhynchus cotti Yamaguti, 1935 (Acanthocephala: Echinorhynchidae) in fish of the Kanita River, with a note on the life cycle // Jap. J. Parasitol. V. 30. P. 45.
Nicolas D., Lobry J., Le Pape O., Boet P. 2010. Functional diversity in European estuaries: relating the compositions of fish assemblages to the abiotic environment // Estuarine, Coastal and Shelf Science. V. 88. P. 329. https://doi.org/10.1016/j.ecss.2009.11.006
Okamura B., Gruhl A., Bartholomew J.L. 2015. Myxozoan evolution, ecology and development. Switzerland: Springer. https://doi.org/10.1007/978-3-319-14753-6
Palm H.W. 2011. Fish Parasites as Biological Indicators in a Changing World: can we monitor Environmental Impact and Climate Change? // Progress in Parasitology, Research Monographs. V. 2. P. 223.
Peterson M.S., Ross S.T. 1991. Dynamics of Littoral Fishes and Decapods along a Coastal River-Estuarine Gradient // Estuarine, Coastal and Shelf Science. V. 33. P. 467.
Smith J.D. 1984. Development of Raphidascaris acus (Nematoda: Anisakidae) in paratenic, intermediate, and definitive hosts // Can. J. Zool. V. 62. № 7. P. 1378.
Snigirov S., Kvach Y., Goncharov O. et al. 2019. Hydrology and parasites: What divides the fish community of the lower Dniester and Dniester estuary into three? // Estuarine, Coastal and Shelf Science. V. 217. P. 120. https://doi.org/10.1016/j.ecss.2018.11.022
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод