Биология внутренних вод, 2023, № 1, стр. 115-124
Факторы, влияющие на распределение Azygia lucii в популяции дефинитивного хозяина
А. Е. Жохов a, *, М. Н. Пугачева a
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Ярославская обл., Некоузский р-н, Россия
* E-mail: zhokhov@ibiw.ru
Поступила в редакцию 23.03.2022
После доработки 23.05.2022
Принята к публикации 08.09.2022
- EDN: KTZWOZ
- DOI: 10.31857/S0320965223010205
Аннотация
Изучено соотношение длины тела трематод Azygia lucii (Müller, 1776) и длины тела щук в популяции Рыбинского водохранилища. Материал собирали в сентябре–октябре с 2018 по 2021 гг. Всего исследовано 386 щук, разделенных на семь размерных классов по длине тела (диапазон 4.7–83 см). Встречаемость A. lucii увеличивалась с 14.2% у сеголетков до 46.2% у щук в возрасте 9+. Распределение трематод по всем размерным классам было агрегированным. Во всех классах обычной интенсивностью инвазии была 1–3 трематоды, доля рыб с такой интенсивностью изменялась от 62.5 до 83.3%. Измерено 259 червей, длина их тела колебалась от 0.49 до 3.5 см. Средняя длина A. lucii увеличивалась с размером хозяина от 1.39 см у сеголетков до 2.39 см у старых щук. Самые длинные трематоды (3–3.5 см) встречались у наиболее крупных щук. Распределение/перераспределение трематод в популяции щуки происходит вследствие каннибализма щук, в результате этого у крупных щук формируется группировка трематод, состоящая из червей разного возраста и размера. Важную роль в формировании таких группировок трематод играют паратенические хозяева, значение которых определяется их зараженностью и ролью в питании щуки в конкретном водоеме. Особенности биологии A. lucii (большие размеры трематод и непродолжительный контакт трематод с моллюсками) предполагают большую продолжительность жизни марит, в течение которой они могут несколько раз реализовать возможность заразить моллюсков.
ВВЕДЕНИЕ
Трематода Azygia lucii (Müller, 1776) – типовой вид немногочисленного рода Azygia, паразитирующего у пресноводных хищных рыб, имеет двуххозяинный жизненный цикл. Дефинитивным хозяином служит щука, у которой трематоды локализуются в желудке и пищеводе. В качестве паратенических хозяев A. lucii, в которых трематоды, как правило, не достигают половой зрелости, отмечены рыбы различных семейств (окуневые, лососевидные, карповые и др.). Роль первого промежуточного хозяина червей выполняют брюхоногие моллюски сем. Planorbiidae (Odening, 1976). Из моллюсков в воду выходят церкарии, похожие внешним видом и поведением на личинок комаров-кулицид. Церкарий поедают мальки щуки (Odening, Bockhardt, 1976). Так происходит первичная инвазия щук. Вторичная инвазия осуществляется путем передачи взрослых трематод от щуки к щуке в результате каннибализма и от паратенических хозяев в любом возрасте. Сезонно ограничено только первичное заражение сеголетков – происходит только летом, взрослые щуки заражаются круглый год. Зрелые трематоды A. lucii имеют крупные размеры, длина их тела может достигать 60 мм (Скрябин, 1958; Быховская-Павловская, Кулакова, 1987). Таким образом, поступление новых трематод в популяцию щуки происходит в основном через щук-сеголетков, дальнейшее распределение/перераспределение червей в половозрелой части популяции щук связано с их каннибализмом и с передачей от паратенических хозяев. Определенное значение в этом процессе играет продолжительность жизни трематод, превышающая год и, вероятно, более (Маркова, 1958; Odening, Bockhardt, 1976).
Цель работы – рассмотрение распределения трематоды A. lucii в популяции щуки как проявление каннибализма щук и способ увеличения продолжительности жизни трематод.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Щук ловили сетями и неводом в Волжском плесе Рыбинского водохранилища в период с 2018 по 2021 гг. Основное количество щук и все сеголетки пойманы в сентябре–октябре. У рыб измеряли стандартную длину тела (SL). Извлеченных из желудков трематод помещали в физиологический раствор и умертвляли горячей водой. У расслабленных таким способом трематод измеряли длину тела. Из A. lucii, собранных у сеголетков щук, делали тотальные препараты для выявления степени их созревания. Всего исследовано 386 щук. Для изучения размерной динамики зараженности щук их разделяли на семь размерных классов (табл. 1). Зараженность щук оценивали по: экстенсивности инвазии (prevalence, %), индексу обилия (mean abundance) и интенсивности инвазии как минимальное и максимальное значения (invasion intensity, range). Возраст щук оценивали по данным для Рыбинского водохранилища (Пермитин, 1959; Иванова, Свирская, 2002) (табл. 1). Связь между длиной щук и длиной трематод оценивали с помощью рангового коэффициента корреляции Спирмена. Различия в экстенсивности инвазии анализировали с помощью критерия Фишера, частотное распределение интенсивности инвазии – с помощью критерия Крускала–Уоллиса, при сравнении двух выборок использовали Манна–Уитни U-test. Для сравнения длины A. lucii с длиной щук применяли параметрический критерий Стьюдента. Степень агрегированности трематод рассчитывали как отношение дисперсии выборки к ее среднему. Для статистической обработки данных использовали программы Quantitative Parasitology (QP 3.0) (Rózsa et al., 2000) и Statistica version 10.
Таблица 1.
Статистические данные щук и их зараженности трематодой A. lucii с разбивкой по размерным классам в Рыбинском водохранилище
| Показатель | Размерный класс | ||||||
|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| n, рыб | 134 | 68 | 56 | 50 | 39 | 21 | 18 |
| Стандартная длина рыб, см | 4.7–19 | 20–29 | 30–39 | 40–49 | 50–59 | 60–69 | 70–100 |
| средняя ± SD | 12.5 ± 4.3 | 24.2 ± 3 | 34.6 ± 3 | 44.2 ± 2.9 | 53.9 ± 2.9 | 64.2 ± 2.8 | 76.9 ± 7 |
| медиана | 12 | 24 | 35 | 44 | 54 | 64 | 75 |
| Возраст щук* | 1 (0+) | 1–2 | 3–4 | 3–5 | 4–6 | 5–8 | 8–10 |
| Экстенсивность инвазии, % | 14.2 | 20.6 | 19.6 | 16 | 38.5 | 42.9 | 46.2 |
| Индекс обилия ± SE | 0.41 ± 0.18 | 0.57 ± 0.25 | 1.4 ± 0.93 | 0.45 ± 0.25 | 1.74 ± 0.6 | 0.65 ± 0.23 | 4.44 ± 2.13 |
| Средняя интенсивность инвазии ± SE | 3.06 ± 1.2 | 2.9 ± 1.1 | 7.7 ± 4.8 | 3.14 ± 1.4 | 4.71 ± 1.3 | 1.63 ± 0.38 | 10.1 ± 4.36 |
| Максимальная интенсивность инвазии | 21 | 15 | 50 | 11 | 17 | 4 | 37 |
| n, трематод | 57 | 39 | 81 | 26 | 68 | 14 | 113 |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Возрастная динамика зараженности щук. Данные о зараженности щук по размерным классам приведены в табл. 1. Экстенсивность инвазии щук A. lucii с возрастом увеличивалась. При этом экстенсивность инвазии щук с первого по четвертый размерные классы не превышала 20%; значительных различий между сеголетками и рыбами второго–четвертого классов не было (критерий Фишера P = 0.314–0.816). Экстенсивность инвазии крупных щук (пятый–седьмой классы) резко возрастала до 40–50% и также не различалась между классами (P = 0.612–1.0), но достоверно отличалась от экстенсивности инвазии сеголетков (P = 0.001–0.02). Статистически значимые изменения в экстенсивности инвазии наблюдали в большинстве случаев и между остальными классами (2–4 и 5–7) (P < 0.05).
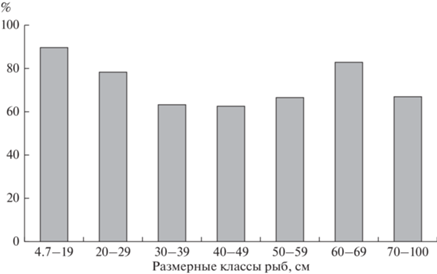
Частотное распределение интенсивности инвазии между размерными классами показало отсутствие различий между всеми классами (критерий Крускала–Уоллиса χ2 = 10.26, Н = 9.22, P = 0.161). Во всех классах наиболее частой была интенсивность инвазии одна–три трематоды. Доля рыб с такой интенсивностью инвазии изменялась от 62.5 до 83.3% (рис. 1), показывая лишь незначительную тенденцию к снижению по мере увеличения размера щук, значимых различий между классами не было (χ2 = 10.17, Н = 10.11, P = 0.12). При сравнении щук–сеголетков с каждым последующим возрастным классом различия также отсутствовали (Манна–Уитни U-test, P > 0.05), за исключением первого и пятого классов (U = 81, Z = –2.12, P = 0.034). Между длиной щук и интенсивностью инвазии в совокупной выборке корреляция отсутствовала (R = 0.14, P = 0.2).
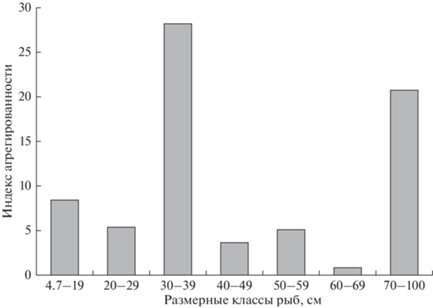
Распределение трематод в щуках всех размерных классов было агрегировано и соответствовало отрицательному биномиальному распределению. Индекс агрегированности D имел наибольшее значение в третьем и седьмом размерных классах и имел тенденцию роста с возрастом рыб (рис. 2). Даже среди сеголетков щук были две особи с интенсивностью инвазии 12 и 21 трематода. У крупных щук интенсивность инвазии достигала 37–50 трематод (табл. 1).
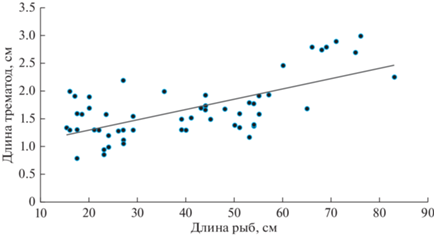
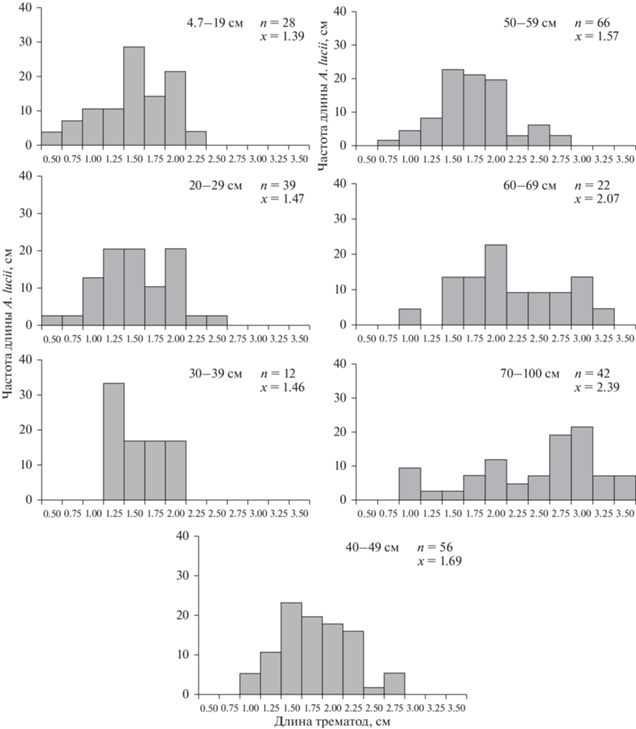
Рост и размер трематод. Всего было собрано и измерено 259 особей A. lucii из 55 щук всех размерных классов. У щук-сеголетков к концу сентября черви достигали в среднем 1.39 см длины (0.49–2.05 см). Значительная часть трематод уже содержала яйца в матке. С увеличением размера щук увеличивалась средняя длина паразитирующих у них трематод (рис. 3). Распределение длины A. lucii различалось между размерными классами рыб. Черви <0.5 см встречались только у рыб первого и второго размерных классов, черви длиной >3 см – только у крупных рыб шестого и седьмого классов (рис. 4). Наиболее крупные особи A. lucii (3.5 см) найдены у самой крупной (83 см) из исследованных щук. Средняя длина червей между размерными классами значительно различалась (P < 0.001) и постепенно увеличивалась от 1.39 см у сеголетков до 2.39 см у старых щук (рис. 4). Обнаружено, что в сентябре у одних щук-сеголетков все найденные A. lucii имели равную или почти равную длину, у других рыб длина A. lucii была больше в 2–3 раза (например, 0.49 и 1.65 см). Эти различия указывают на разное время заражения сеголетков в течение лета. Связь между средней длиной A. lucii и интенсивностью инвазии отсутствовала в каждом размерном классе и во всей выборке зараженных щук (R = 0.18, P = 0.19).
Сравнение средней длины A. lucii у сеголетков (n = 8) и крупных рыб пятого–седьмого классов (n = 13) показало, что при интенсивности инвазии 1–3 трематоды у крупных щук трематоды (n = 23) в среднем крупнее (2.15 ± 0.67), чем трематоды (n = = 18) у сеголетков (1.46 ± 0.47) (t = 2.02; P < 0.001). При этом отношение максимальной к минимальной длине трематод у сеголетков и крупных рыб было одинаковым – 2.9 и 2.8 соответственно. Иначе выглядел разброс длины A. lucii у крупных щук пятого–седьмого классов (n = 5) с высокой интенсивностью инвазии (13–34 экз.). Черви (n = 98) сильно отличались по длине (от 0.61 до 3.5 см), отношение максимума к минимуму длины достигало 5.74.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Предыдущие немногочисленные исследования возрастных изменений зараженности щук A. lucii показывали рост зараженности с возрастом рыб, достигающий максимума у самых старых рыб. В Кончозере щуки-годовики были заражены на 19%, крупные щуки (5+–11+) – на 93.4% (Горбунова, 1936). В нашей работе резкий скачок встречаемости A. lucii (до 38%) произошел у четырех–шестилетних щук, в Кончозере аналогичный скачок (до 59%) наблюдали у трехлетних щук (Горбунова, 1936). Средняя интенсивность инвазии в обоих исследованиях так же возрастала до максимума у самых старых рыб. В Кончозере у щук была отмечена высокая агрегированность трематод. Встречались щуки с интенсивностью инвазии 57, 78, 116 и 132 особи A. lucii (Петрушевский, Быховская-Павловская, 1935; Горбунова, 1936). В р. Тобол распределение трематод также было агрегированным, максимальная интенсивность инвазии щук в возрасте 4+, 5+ и 6+ была 120, 51 и 94 экз. соответственно (Либерман, Козлов, 2018). По-видимому, высокая агрегированность свойственна этому виду трематод. Щуки с интенсивностью инвазии 90 и 132 червя найдены в реках Обь и Ока (Петрушевский и др., 1948; Маркова, 1958). Каким образом формируется столь высокая интенсивность инвазии отдельных рыб, если новые трематоды поступают в популяцию щук через сеголетков щук и с паратеническими хозяевами? При этом интенсивность инвазии сеголетков щук и мальков других видов рыб низкая. По нашим данным, у сеголетков щук чаще всего встречалось по 1–3 трематоды. Такую же интенсивность инвазии наблюдали в озерах Карелии, где трематоды впервые появлялись у щук в возрасте 1+ (Горбунова, 1936; Полянский, Шульман, 1956). В других водоемах у сеголетков щуки, судака, окуня, язя и плотвы A. lucii встречалась также в единичных экземплярах (Кулемина, 1969; Комарова, 1982).
Важную роль каннибализма в передаче трематод от щуки к щуке отмечена в работе (Odening, Bockhardt, 1976). Питание щуки в различных водоемах и водотоках изучено очень подробно и везде ихтиологи отмечают каннибализм щук. Однако специальные исследования количественной оценки каннибализма щук с учетом влияния различных факторов отсутствуют. Очевидно, чаще всего объектом каннибализма становятся молодые щуки – сеголетки и годовики (Фортунатов, Попова, 1973). Каннибализм проявляется очень рано, и, будучи сеголетками, щуки способны поедать себе подобных. В Сямозере каннибализм годовиков 1+ (2%) был выше, чем у рыб в возрасте 2+, 3+, 4+, 5+, 6+ (0.4, 1.0, 0.5, 0.5, 0% соответственно) (Балагурова, 1967). В процентном отношении питание щуки себе подобными сравнимо с питанием другими немассовыми видами жертв. Отмечается также, что с возрастом доля каннибализма в питании щуки снижается и крупные особи совсем не питаются особями своего вида. Например, в р. Печора каннибализм щуки достигал в среднем 3.3% по встречаемости (Теплова, Теплов, 1953; Новоселов, 2021), в Сямозере он был в среднем 1.1% и с возрастом снижался до нуля у старых рыб (Балагурова, 1967). В Рыбинском водохранилище процент каннибализма у сеголетков щуки был невелик – 1–3.5% (Макковеева, 1956). Там же каннибализм крупной щуки (>80 см) достигал в среднем 5.7%, средней щуки (>60 см) – 7.2%, а в среднем каннибализм не превышал 6.8% (Задульская, 1960). По другим данным, в Рыбинском водохранилище каннибализм крупной щуки (>70 см) был лишь 0.4–0.9% (Иванова, 1959). Каннибализм щук имел некоторые сезонные особенности. В р. Печора он чаще проявлялся в мае (2.8%) и сентябре (3%), чем в другие месяцы (Теплова, Теплов, 1953).
Приведенные примеры высокой интенсивности инвазии щук A. lucii позволяют предположить, что отдельные щуки в результате частого каннибализма накапливают с возрастом значительное количество трематод. Процесс этот может быть растянут во времени, поскольку не каждая съеденная щука заражена A. lucii. Кроме того, съеденными могут быть и сеголетки с мелкими молодыми трематодами, и более крупные рыбы со зрелыми червями. В итоге сформировавшаяся в крупной щуке группировка трематод может состоять из червей разного возраста и размера. Действительно, у крупных щук с высокой интенсивностью инвазии встречались трематоды с длиной тела от 0.61 до 3.5 см. Такая группировка трематод сформировалась в результате добавления к уже паразитирующим в щуке старым трематодам очень молодых трематод, полученных в результате поедания зараженных сеголетков щук, более старших щук, а также паратенических хозяев.
Анализ длины трематод из щук-сеголетков и рыб в возрасте 5–10 лет с интенсивностью инвазии 1–3 червя показал, что у старых рыб трематоды в два раза длиннее, чем у сеголетков. Вполне возможно, что такая низкая интенсивность у старых щук сохранилась с момента их заражения церкариями в возрасте 0+, а увеличение размеров свидетельствует о росте трематод и, косвенно, о большой продолжительности их жизни.
В паратенических хозяевах трематоды почти не растут и не достигают половой зрелости. По данным (Петрушевский, Быховская-Павловская, 1935), длина червей из взрослых окуней была лишь 0.18–0.4 см, из налима – 0.7 см, что меньше или сопоставимо с длиной червей из сеголетков щук. Оценивая важность паратенических хозяев в передаче A. lucii щуке, в первую очередь следует учитывать их различную зараженность в разных водоемах. Также необходимо знать какую долю в питании щуки занимает тот или иной вид рыбы в данном водоеме. Хотя потенциальный круг паратенических хозяев A. lucii в ареале щуки очень широкий (Быховская-Павловская, Кулакова, 1987), в отдельных водоемах он может быть очень узок. В качестве примеров нами использованы лишь те водоемы, в которых с наибольшей вероятностью обитает только A. lucii. Так, в Чудском озере из 16 исследованных видов рыб A. lucii найдена только у судака (20%, 1–7 экз.) (Когтева, 1957), в оз. Выртсъярв из 11 видов рыб – тоже у судака (6.6%, 1) (Шляпникова, 1957), в оз. Сивер из 11 видов рыб – у окуня (6.6%, 1) (Рейнсоне, 1955), в оз. Дривяты из 19 видов рыб – у судака (Петрушевский и др., 1957). В оз. Селигер азигия найдена у взрослых судаков (58.6%, 1–8) и окуней (26.6%, 1–8), у щук азигия встречалась реже (20%, 1–2), чем у паратенических хозяев (Шульман, Чернышева, 1969). У мальков в этом озере азигия в единичных экземплярах найдена у щуки (33%), окуня (6.6%), язя (1.3%) и плотвы (6.6%, 2) (Кулемина, 1969). В Кременчугском водохранилище азигия в единичных экземплярах встречалась у мальков щуки (6.6%), судака (5.5%) и язя (0.2%) (Комарова, 1982). В небольшом оз. Святое (Дарвинский заповедник), ихтиоценоз которого состоял из щуки, ерша и окуня, азигия встречалась у окуня (40%, 1–3) и ерша (13%, 1–4), по щуке данные отсутствуют (Жохов, Тютин, 1994). Очевидно, в этом озере окунь и ерш были основным рационом щуки. Из приведенных данных видно, что паратеническими хозяевами A. lucii в разных водоемах чаще всего бывают судак и окунь, реже – ерш и налим, т.е. рыбы, имеющие желудок. Карповые рыбы – это случайные хозяева, которые заражаются только на стадии личинки или малька. Кроме того, трематоды встречаются у сеголетков и взрослых рыб – паратенических хозяев, и зараженность последних с возрастом увеличивается. Последнее обстоятельство показывает, что паратенические хозяева могут сохранять и накапливать в себе трематод.
В Рыбинском водохранилище паратенические хозяева A. lucii были представлены пятью видами рыб: ерш (4%, 1), судак (возраст 7+, 7.7–29.6%, 2–4), окунь (8+, 10–23.7%, 1–2), налим (30–49.4%, 2–36), чехонь (7+, 7%, 1) (Изюмова, 1958, 1959а, 1959б). При такой высокой зараженности эти виды рыб могли играть заметную роль в пополнении группировки A. lucii у щук, тем более, что в составе пищи щуки (данные 1953–1963 гг.) окунь достигал 31.6% от общего количества заглоченных рыб, судак 1.1%, ерш 12.4%, налим 0.2%, чехонь 0.7% (Герасимов и др., 2015). Позднее зараженность азигией некоторых паратенических хозяев в водохранилище снизилась. У ерша A. lucii отсутствовала (Жохов и др., 2006), зараженность взрослого окуня снизилась (наши данные за 2016 г.: 3+, 2.8%, 1). Изменился и состав пищи щуки (данные 2005–2012 гг.): окунь 15.3%, судак 6.1%, ерш 4.6%, налим 1.5%, чехонь 0% (Герасимов и др., 2015). Высокая зараженность азигией взрослых судаков и окуней служит причиной передачи червей крупным щукам, поскольку крупные щуки питаются более крупной рыбой (Иванова, 1959). В результате к крупным щукам попадают мелкие незрелые трематоды. Это приводит к формированию у крупных щук с высокой интенсивностью инвазии неоднородной по размеру группировки трематод, состоящей из мелких червей, полученных от паратенических хозяев, и из крупных червей, полученных в результате каннибализма или выросших в щуке со времени заражения церкариями. Приведенные примеры свидетельствуют, что в отдельных водоемах паратенические хозяева A. lucii играют важную роль в динамике ее численности, в других – их значение невелико. Рассуждая о значении паратенических хозяев для A. lucii, следует отметить, что в некоторых водоемах азигии в паратенических хозяевах достигают полой зрелости и фактически становятся дефинитивными хозяевами. Половозрелых A. lucii находили у окуня (Петрушевский, Быховская-Павловская, 1935), налима и окуня (Kozicka, 1959), но, несмотря на половозрелость, трематоды из этих рыб всегда имели меньшие размеры, чем трематоды из щуки.
Хотя мариты A. lucii имеют высокую плодовитость, зараженность моллюсков всегда очень низкая. В озерах Карелии Anisus vortex (L., 1758) был заражен церкариями A. lucii на 0.83–1.76% (Фролова, 1975), в Киевском водохранилище Planorbis planorbis – на 0.49% (Черногоренко, 1983), в водоемах Казахстана – на 0.1–0.4% (Белякова, 1975). Следует учесть, что размеры самих моллюсков небольшие (диаметр раковины 11–19 мм), а размеры выходящих из них церкарий A. lucii, наоборот, очень крупные (1.5–2 мм длины с камерой). Это говорит об очень низкой плодовитости партенит в моллюске. Поедание церкарий мальками щуки – важный и критический момент в жизненном цикле A. lucii, благодаря которому в популяцию щуки поступает новое поколение трематод.
Трематоды в щуках быстро растут и созревают. Длина тела церкарий A. lucii (Cercaria splendens Szidat) достигает 0.085–0.093 см (Оденинг, 1975; Черногоренко, 1983). У исследованных нами сеголеток щук (SL 15–20 см, n = 11) в конце сентября мариты A. lucii имели очень разную длину – от 0.49 до 2.05 см. По данным (Odening, Bockhardt, 1976), мальки щуки поедают церкарий A. lucii будучи ≤1.2–3 см. В Рыбинском водохранилище мальки щуки достигают такого размера в начале июня (Иванова, Свирская, 2009). С переходом к хищничеству процесс заражения церкариями прекращается. Сеголетки щуки становятся каннибалами уже при общей длине тела 10–11 см и их жертвы лишь немного уступают им по длине (9.0–9.5 см), а первые проявления каннибализма происходят при длине тела 1.9–2.1 см (Иванова, Свирская, 2013). Количество корма, которое получали за один удачный бросок сеголетки-каннибалы (52–64% массы тела), было в 2–3 раза больше, чем суточный рацион остальных сеголетков, питавшихся молодью карповых рыб. Ранний каннибализм давал сеголеткам преимущество в росте и, как следствие, они достигли бóльших размеров (Иванова, Свирская, 2013). Возможно, что ускорение роста происходит и у трематод, паразитирующих у сеголетков–каннибалов. Этим, вероятно, можно объяснить наблюдаемый осенью у трематод из сеголетков щук большой разброс по длине тела, когда крупные черви длиннее мелких в 4 раза.
В литературе очень мало данных о продолжительности жизни трематод. Принято считать, что большинство рыбных трематод в умеренных широтах живут один год (Moravec, 1982; Тютин, 1996), менее года (Стенько, 1976; Pojmanska, 1985), и только у некоторых видов продолжительность жизни превышает год – 930 сут (Margolis, Boyce, 1969). О продолжительности жизни марит A. lucii нет информации, но, учитывая размер трематод, можно предположительно отнести их к долгожителям среди трематод. Исследована связь продолжительности жизни и длины тела эукариот. Установлено, что с увеличением размеров тела продолжительность жизни увеличивается (Шмидт-Ниельсен, 1987; Метельский, 1995). По сравнению со многими другими рыбными трематодами, мариты A. lucii выглядят гигантами по размеру и, вероятно, лидируют по продолжительности жизни. По всей видимости, продолжительность жизни A. lucii может достигать нескольких лет. Оденинг и Бокхардт (Odening, Bockhardt, 1976) также считали, что продолжительность жизни A. lucii значительно больше одного года.
Основанием для такого предположения служат особенности экологии A. lucii. Моллюски сем. Planorbiidae (первый промежуточный хозяин A. lucii) обитают в самой прибрежной части водоемов на глубинах 0–30 см, редко превышающих 50 см (Березкина, Старобогатов, 1988). Весной эти биотопы заливаются водой, и здесь нерестится щука. Чтобы реализовать свой репродуктивный потенциал и заразить моллюсков, трематоды должны именно в период нереста щуки массово откладывать яйца. После нереста щуки покидают нерестилища и откочевывают в более глубокие участки водоема, где моллюски-планорбиды отсутствуют. Самые мелкие щуки (SL 10–30 см) с весны до конца лета обитают в прибрежной зоне в диапазоне глубин 1–4 м. Впервые созревающие особи (SL 30–40 см) весной встречаются преимущественно на мелководье и на глубине <3–4 м. Крупные особи (SL 40–70 см) в конце мая–начале июня уходят на участки с глубинами >10 м (Герасимов и др., 2018). Следующий массовый контакт между трематодами и моллюсками возможен только через год. Возможно, только мелкие щуки дольше других имеют контакт с моллюсками, но их зараженность невелика. Такая стратегия размножения, когда контакт трематод с моллюсками длится непродолжительное время, предполагает большую продолжительность жизни, в течение которой трематоды могут несколько раз реализовать возможность заразить моллюсков.
Выводы. Распределение трематоды A. lucii в популяциях щук в большей степени связано с каннибализмом щук и с большой продолжительностью жизни трематод. Агрегированность распределения трематод обусловлена высокой степенью каннибализма, свойственной, по-видимому, только отдельным особям щук. Паратенические хозяева имеют важное значение в динамике численности A. lucii, особенно в отдельных водоемах, формируя у крупных щук неоднородную по размеру и возрасту группировку трематод. Особенность жизненного цикла, при которой время контакта трематод с моллюсками непродолжительно, предполагает продолжительность жизни марит A. lucii, значительно превышающую один год.
Список литературы
Балагурова М.В. 1967. Материалы по питанию щуки // Изв. ВНИИОРХ. Т. 62. С. 195.
Белякова Ю.В. 1975. Зараженность пресноводных моллюсков Казахстана личинками трематод, паразитирующих у рыб // Экология паразитов водных животных. Алма-Ата: “Наука” Казахской ССР. С. 173.
Березкина Г.В., Старобогатов Я.И. 1988. Экология размножения и кладки яиц пресноводных легочных моллюсков // Тр. Зоол. ин-та АН СССР. Т. 174. Ленинград.
Быховская-Павловская И.Е., Кулакова А.П. 1987. Класс Трематоды – Trematoda. Определитель паразитов пресноводных рыб фауны СССР. Т. 3. Паразитические многоклеточные. Ленинград: Изд-во “Наука”. С. 77.
Герасимов Ю.В., Иванова М.Н., Свирская А.Н. 2015. Щука // Рыбы Рыбинского водохранилища: популяционная динамика и экология. Ярославль: Филигрань. С. 184.
Герасимов Ю.В., Иванова М.Н., Свирская А.Н. 2018. Пространственное распределение и структура популяции щуки Esox lucius Рыбинского водохранилища в период потепления климата // Вопр. ихтиологии. Т. 58. № 1. С. 31. https://doi.org/10.7868/S0042875218010058
Горбунова М.Н. 1936. Возрастные изменения паразитофауны щуки и плотвы // Уч. записки Ленинград. гос. ун-та. № 7. Cер. биол. 3. С. 5.
Жохов А.Е., Пугачева М.Н., Молодожникова Н.М., Мироновский А.Н. 2006. Гельминтофауна ерша Gymnocephalus cernuus L. (Perciformes, Percidae) Рыбинского водохранилища: восстановление после депрессии численности хозяина // Вопр. ихтиологии. Т. 46. № 5. С. 702.
Жохов А.Е., Тютин А.В. 1994. Паразитофауна рыб в условиях ацидификации озер // Структура и функционирование экосистем ацидных озер // Тр. Ин-та биологии внутр. вод РАН. Вып. 70(73). Санкт-Петербург: Наука. С. 186.
Задульская Е.С. 1960. Питание и пищевые взаимоотношения хищных рыб северной части Рыбинского водохранилища // Тр. Дарвинского гос. заповед. Вып. VI. С. 345.
Иванова М.Н. 1959. О питании щуки Рыбинского водохранилища // Тр. VI совещ. по проблемам биологии внутр. вод. Москва: Изд-во АН СССР. С. 311.
Иванова М.Н., Свирская А.Н. 2002. Изменчивость числа позвонков, длины и массы тела сеголеток щуки Esox lucius в зависимости от условий обитания родителей // Вопр. ихтиологии. Т. 42. № 4. С. 503.
Иванова М.Н., Свирская А.Н. 2009. О проявлении компенсационного роста у молоди щуки Esox lucius // Биологические ресурсы Белого моря и внутренних водоемов Европейского Севера: Матер. XXVIII Междунар. конф. 5–8 октября 2009 г. г. Петрозаводск, Республика Карелия, Россия. Петрозаводск: Карельск. науч. центр РАН. С. 240.
Иванова М.Н., Свирская А.Н. 2013. О размерной иерархии у молоди щуки Esox lucius // Вопр. ихтиологии. Т. 53. № 3. С. 327. https://doi.org/10.7868/S0042875213030041.
Изюмова Н.А. 1958. Сезонная динамика паразитофауны рыб Рыбинского водохранилища (лещ, чехонь, судак, окунь) // Тр. биол. ст. “Борок”. Вып. 3. С. 384.
Изюмова Н.А. 1959а. К вопросу о динамике паразитофауны рыб Рыбинского водохранилища // Тр. ИБВВ АН СССР. Вып. 2(5). С. 174.
Изюмова Н.А. 1959б. Сезонная динамика паразитофауны рыб Рыбинского водохранилища (плотва, ерш) // Тр. ИБВВ АН СССР. Вып. 1(4). С. 332.
Когтева Е.П. 1957. Паразиты рыб Псковско-Чудского водоема // Изв. ВНИИОРХ. Т. 42. С. 243.
Комарова Т.И. 1982. Паразиты молоди рыб Кременчугского водохранилища и их влияние на организм хозяев. Киев: Наукова думка.
Кулемина И.В. 1969. Возрастные изменения паразитофауны некоторых рыб озера Селигер // Эколого-паразитологические исследования на озере Селигер. Ленинград: Изд-во Ленинград. гос. ун-та. С. 87.
Либерман Е.Л., Козлов С.А. 2018. Особенности паразитофауны Esox lucius (Linnaeus, 1758) реки Тобол в зимний период жизненного цикла // Изв. Самар. науч. центра РАН. Т. 20. № 2. С. 124.
Макковеева И.И. 1956. Питание молоди щуки Рыбинского водохранилища // Вопр. ихтиологии. Вып. 7. С. 60.
Маркова Т.Г. 1958. Сезонные изменения паразитофауны щуки // Зоол. журн. Т. 37. Вып. 12. С. 1801.
Метельский С. Т. 1995. Связь продолжительности жизни эукариот (животных и растений) с некоторыми их физическими характеристиками // Журн. общей биологии. Т. 56. № 6. С. 723.
Новоселов А. П. 2021. Видовое и экологическое разнообразие ихтиофауны бассейна р. Печоры // Биология внутр. вод. № 3. С. 261. https://doi.org/10.31857/S0320965221030116
Оденинг К. 1975. Cercaria splendens Szidat – личинка трематоды Azygia lucii Looss // Паразитология. Т. 9. Вып. 3. С. 232.
Пермитин И.Е. 1959. Возраст и темп роста щуки Рыбинского водохранилища // Тр. Ин-та биологии водохранилищ. № 2(5). Москва: Изд-во АН СССР. С. 148.
Петрушевский Г.К., Быховская-Павловская И.Е. 1935. Материалы по паразитологии рыб Карелии. Паразиты рыб района Кончозера // Тр. Бородинской биол. станции в Карелии. Т. 8(1). С. 15.
Петрушевский Г.К., Мосевич М.В., Щупаков И.Г. 1948. Фауна паразитов рыб рек Оби и Иртыша // Изв. ВНИИОРХ. Т. 27. С. 67.
Петрушевский Г.К., Позднякова М.Н., Шульман С.С. 1957. Паразиты рыб Браславских озер Белоруссии // Изв. ВНИИОРХ. Т. 42. С. 337.
Полянский Ю.И., Шульман С.С. 1956. Возрастные изменения паразитофауны рыб // Тр. Карело-Финского филиала АН СССР. Петрозаводск: Гос. изд-во Карело-Финской ССР. С. 3.
Рейнсоне А.Д. 1955. Материалы по паразитофауне рыб оз. Сивер // Тр. Ин-та биологии АН ЛатвССР. Т. 2. Вып. 1. С. 191.
Скрябин К.И. 1958. Трематоды животных и человека. Основы трематодологии. Москва: Изд-во АН СССР. Т. 14. С. 670.
Стенько Р.П. 1976. Жизненный цикл трематоды Crowcrocaecum skrjabini (Ivanitzky, 1928) (Allocreadiata, Opecoelidae) // Паразитология. Т. 10. Вып. 1. С. 9.
Теплова Е.Н., Теплов В.П. 1953. Питание щуки в бассейне Верхней Печоры // Вопр. ихтиологии. Вып. 1. С. 94.
Тютин А.В. 1996. Сезонная динамика зараженности окуневых рыб трематодой Bunodera luciopercae в условиях Рыбинского водохранилища // Биология внутр. вод. № 1. С. 73.
Фортунатов К.Р., Попова О.А. 1973. Питание и пищевые взаимоотношения хищных рыб в дельте Волги. Москва: Изд-во “Наука”.
Фролова Е.Н. 1975. Личинки трематод в моллюсках Южной Карелии. Ленинград: Изд-во “Наука”.
Черногоренко М.И. 1983. Личинки трематод в моллюсках Днепра и его водохранилищ. Киев: Наукова думка.
Шляпникова Р.Л. 1957. Материалы к паразитофауне рыб озера Выртсъярв // Изв. ВНИИОРХ. Т. 42. С. 270.
Шмидт-Ниельсен К. 1987. Размеры животных: почему они так важны? Москва: Мир. (Knut Schmidt-Nielsen. 1984. Why is animal size so important? Cambridge University Press).
Шульман Р.Е., Чернышева Н.Б. 1969. Паразитофауна отдельных видов рыб озера Селигер // Эколого-паразитологические исследования на озере Селигер. Ленинград: Изд-во Ленинград. гос. ун-та. С. 59.
Kozicka J. 1959. Parasites of fishes of Druzno Lake // Acata Parasitologica Polonica. V. 7. P. 1.
Margolis L., Boyce N.P. 1969. Life span, maturation, and growth of two hemiurid trematodes, Tubulovesicula lindbergi and Lecithaster gibbosus, in Pacific salmon (genus Oncorhynchus) // J. Fish. Res. Board Can. V. 26. P. 893.
Moravec F. 1982. A contribution to the bionomics of Crepidostomum metoecus (Trematoda: Allocreadiidae) // Vĕst. čs. Společ. Zool. V. 46. P. 15.
Odening K. 1976. Der Lebenzyklus von Azygia lucii (Trematoda) – Untersuchungen im Gebiet der DDR // Biologisches Zentralblatt. V. 95. № 1. S. 57.
Odening K., Bockhardt I. 1976. On the seasonal occurrence of Azygia lucii (Trematoda) in Esox lucius (Pisces) // Zoologischer Anzeiger. V. 196. № 3/4. P. 182.
Pojmanska T. 1985. An analysis of seasonality of incidence and maturation of some fish parasites, with regard to thermal factor. V. Digeneans of the genus Sphaerostoma Rudolphi, 1809. General conclusion // Acta Parasitol. Polonica. V. 30. P. 35.
Rózsa L., Reiczigel J., Majoros G. 2000. Quantifying parasites in samples of hosts // J. Parasitol. V. 86. P. 228.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод