Биология внутренних вод, 2023, № 2, стр. 252-263
Структура рыбного населения дельты р. Меконг – возможный показатель проникновения морских вод вглубь континента
М. И. Малин a, b, *, И. П. Малина a, Чыонг Ба Хай c, Ку Нгуен Динь c, Ле Куанг Ман c, Зыонг Тхи Ким Чи c
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
b Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
c Южное отделение Совместного Российско-Вьетнамского Тропического научно-исследовательского
и технологического центра
Хошимин, Вьетнам
* E-mail: mishuk@ibiw.ru
Поступила в редакцию 27.03.2022
После доработки 06.07.2022
Принята к публикации 08.08.2022
- EDN: BTSRNT
- DOI: 10.31857/S0320965223020171
Аннотация
Проблема проникновения морских вод в дельту р. Меконг является актуальной темой исследований разных отраслей науки. Среди причин этого явления – поднятие уровня Мирового океана, а также зарегулирование естественного стока р. Меконг в результате строительства гидросооружений. Масштабы дельты и динамичность ее водных масс усложняют организацию инструментальных наблюдений, в то время как сообщества живых организмов могут служить надежными индикаторами разнокачественности среды. Проанализирована пространственная изменчивость структуры рыбного населения дельты р. Меконг в качестве показателя проникновения морских вод вглубь континента. Состав рыбного населения на разных участках дельты определяли по уловам разноглубинного трала в январе и апреле 2021 г. В результате 74 тралений отловили и проанализировали ~15 тыс. экз. рыб. Анализ данных основан на гипотезе, что рыбное население дельты р. Меконг представлено тремя таксономическими комплексами, которые приурочены к верхнему (пресноводному), нижнему (солоновато-водному) и среднему (зоне контакта пресных и солоноватых вод) участкам течения дельты. Таксономический состав пресноводного комплекса наиболее беден и представлен девятью семействами, в то время как в маргинальный (населяющий зону контакта) и солоновато-водный входят 26 и 23 семейства, соответственно. Представители семейств Cobitidae, Eleotridae, Plotosidae и Siluridae, обнаруженных только в зоне контакта пресных и солоноватых вод, могут быть рассмотрены в качестве видов-индикаторов ее положения. Оценка значений солености, соответствующих границам маргинального комплекса, – задача дальнейших исследований. Положение границ пресноводного и солоновато-водного комплексов имеет биологический аспект и может выступать в качестве показателя проникновения морских вод вглубь дельты р. Меконг.
ВВЕДЕНИЕ
Проблема проникновения морских вод в дельту р. Меконг (ДМ) – крупнейший сельскохозяйственный и рыбодобывающий регион юго-восточной Азии – ставит под угрозу благополучие ~17.5 млн местных жителей (Thang et al., 2020; Binh et al., 2020) и является актуальной темой исследований разных отраслей науки. Среди причин этого явления указывают поднятие уровня Мирового океана в связи с изменением климата, а также зарегулирование естественного стока р. Меконг в результате строительства гидросооружений (Tuan, Chinvanno, 2011; Thang et al., 2020). Поднятие уровня моря ведет не только к затоплению территории, но в первую очередь к засолению плодородных почв, прудов аквакультуры и источников пресной воды (Tan et al., 2020), а вероятные изменения структуры сообществ гидробионтов неизбежно отразятся на рыбодобывающей отрасли (Nuon et al., 2020).
Детальные инструментальные исследования проникновения соленых вод, проводимые в масштабе всей дельты, до настоящего времени были ограничены, а выявляемые тенденции связывались с глобальным повышением уровня Мирового океана. Некоторые оценки темпов проникновения соленых вод в ДМ выполнены методом математического моделирования (Nguen et al., 2008; Eslami et al., 2021). Предложений по использованию структуры сообществ гидробионтов в качестве биологического индикатора продвижения морских вод вглубь ДМ до настоящего времени не было. Масштабы дельты и динамичность ее водных масс (приливно-отливные явления на фоне сезонной и многолетней динамики стока р. Меконг и уровня Мирового океана) усложняют организацию прямых инструментальных наблюдений, в то время как сообщества живых организмов могут служить надежными индикаторами разнокачественности среды.
Сообщества гидробионтов интегрально реагируют на комплекс факторов среды, включающий множество характеристик. Наиболее оперативно такие реакции проявляет рыбное население (Das, Chakrabarty, 2007; Chea et al., 2017; Huang et al., 2019; Zhang et al., 2021), поскольку рыбы, в отличие от бентосных организмов или растительности, подвижны, а в отличие от планктона – способны противостоять перемещению водных масс и распределяться на тех участках водоема, где в данный момент времени сложилось оптимальное сочетание факторов. Таксономический состав рыбного населения дельты р. Меконг очень разнообразен и представлен как эвригалинными, так и типично пресноводными или морскими видами (Rainboth, 1996; Valbo-Jorgensen et al., 2009). Имеющиеся сведения о пространственном распределении рыбного населения дельты р. Меконг указывают на его выраженную пространственную изменчивость (Болтачев и др., 2018; Karpova et al., 2021). Такие жизненно важные для рыб характеристики среды, как температура воды и концентрация растворенного кислорода, в дельте варьируют слабо (Sharov et al., 2020). Справедливо предположить, что наблюдаемые неравномерности распределения рыбного населения связаны с соленостью, следовательно, могут выступать в качестве индикатора проникновения морских вод вглубь континента при организации долгосрочного мониторинга.
Цель работы – проанализировать пространственную изменчивость структуры рыбного населения дельты р. Меконг в качестве показателя проникновения морских вод вглубь континента.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Район исследований. Дельта р. Меконг (рис. 1) сформирована двумя его рукавами: реками Хау (Бассак) и Тиен (Меконг), которые втекают на территорию Южного Вьетнама с севера и распадаются на более мелкие рукава и протоки перед впадением в Восточное море (Nguyen et al., 2008). Протяженность дельты от границы с Камбоджей до морского побережья составляет 210 км, площадь – ~39 тыс. км2, средняя высота над уровнем моря 0.7–1.2 м (Binh et al., 2020). Проникновение морских вод в ДМ связано с динамикой уровня воды и зависит от приливов, сезонных изменений расходов р. Меконг, а также количества локальных атмосферных осадков. Приливы в ДМ смешанного суточного и полусуточного типа с периодом 12.25 ч, обычно в сутки наблюдаются две полные и две малые воды, высота которых варьирует на протяжении лунного цикла, а диапазон может достигать 2.5–3.5 м (Nguyen et al., 2008; Tri et al., 2014).
Рис. 1.
Схема расположения мест лова разноглубинным тралом в дельте р. Меконг: 1 – в январе; 2 – в апреле.
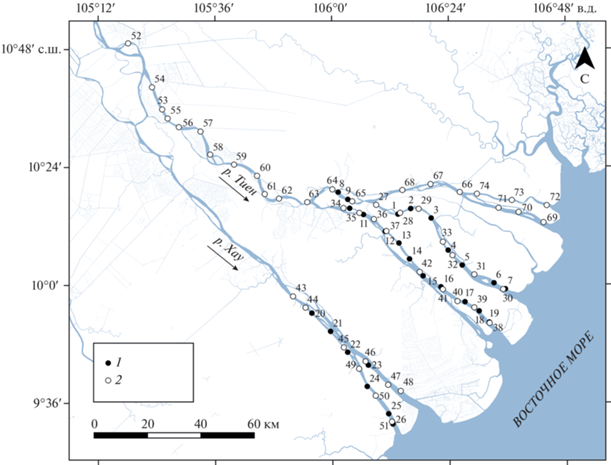
Климат в ДМ субэкваториального типа, с хорошо выраженными сухим (ноябрь–апрель) и влажным (май–октябрь) сезонами. В сухой сезон локальные атмосферные осадки не оказывают влияния на уровень воды в ДМ (Tri et al., 2014). Расходы р. Меконг варьируют от 1.5 до 45 тыс. м3/с в сухой и влажный сезоны соответственно. Ежегодно в марте–апреле водные массы с соленостью ~4 г/л проникают на 40–50 км вглубь ДМ, однако в засушливые годы глубина их проникновения может быть на 20–25 км выше (Binh et al., 2020).
Отлов рыб. Состав рыбного населения на разных участках ДМ определяли по траловым уловам, материал собирали в январе и апреле 2021 г. Траления проводили с борта арендованного судна разноглубинным тралом (горизонтальное раскрытие 12 м, ячея в кутке 8 мм), который вывешивали в толще воды на плавучестях, закрепленных поводцами к траловым доскам. Горизонт траления регулировали, изменяя длину поводцов от 1 до 7 м. По показаниям эхолота “Simrad EK80” глубина в местах тралений колебалась в пределах 7–27, 3–24 и 4–16 м в верхнем, среднем и нижнем течении дельты, соответственно. Параметры тралений (географические координаты начала и окончания, траекторию и скорость судна) определяли по спутниковому навигационному приемнику. Длительность одного траления составляла ~20 мин. Рыб отлавливали в светлое время суток, что позволило исключить возможное влияние суточных изменений освещенности водной толщи на их распределение, поведение, а следовательно, и состав уловов. Улов сортировали, определяли количество рыб и их систематическую принадлежность до семейства (Rainboth, 1996; Tran et al., 2013). В результате 74 тралений отловили ~15 тыс. экз. рыб. Отловленную рыбу по возможности в живом виде возвращали в естественную среду, сохраняли в качестве коммерческого улова в пользу владельца судна, использовали в пищу, часть образцов фиксировали для уточнения таксономической принадлежности в лаборатории.
Анализ данных. Для оценки относительной численности таксона рассчитывали показатель улова на усилие (CPUE – catch per unit effort, экз./ч). Встречаемость таксона определяли как долю уловов, в которых он представлен. Пространственные изменения структуры рыбного населения оценивали методом кластерного анализа (оценивали евклидово расстояние, объединение производили методом Варда), анализировали данные о присутствии/отсутствии таксона в улове (Lasne et al., 2007; Liu et al., 2020). Анализ данных выполняли в программной среде R версии 3.6.3 (R Core Team, 2020), картографировали в геоинформационной системе Quantum GIS (QGIS) версии 3.22.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Класс лучеперых рыб в уловах разноглубинного трала в ДМ представлен 32 семействами, относящимися к девяти отрядам. Наиболее часто в уловах были обнаружены представители семейств Engraulidae, Polynemidae, Ariidae, Sciaenidae и Ambassidae. Относительно редки Sillaginidae, Cobitidae, Bregmacerotidae, Stromateidae, Loricariidae и Tetraodontidae, встреченные лишь в одном–двух уловах. Наиболее плотные скопления образуют Polynemidae, Ariidae, Clupeidae, Pangasiidae, Sciaenidae и Engraulidae – величина CPUE представителей этих таксонов в некоторых уловах превышает 400 экз./ч, для остальных семейств этот показатель не достигает значения 180 экз./ч (табл. 1). Дальнейший анализ данных основан на гипотезе, что рыбное население ДМ, характеризующейся значительными пространственными градиентами солености, представлено тремя таксономическими комплексами: пресноводным (ПК), солоновато-водным (СК), а также населяющим зону контакта пресных и солоноватых вод маргинальным (МК), которые приурочены к верхнему (пресноводному), нижнему (солоновато-водному) и среднему течению дельты соответственно. Применение термина “морской комплекс” взамен “солоновато-водный комплекс” по отношению к таксономической группе рыб, населяющей нижнее течение ДМ, некорректно. Концентрация солей на этом участке ниже, чем в морской воде, что связано с разбавлением речными водами, следовательно, состав рыбного населения отличается от типичного морского, но включает в себя некоторые из таксонов, характерных последнему.
Таблица 1.
Таксономический состав рыб в уловах разноглубинного трала в дельте р. Меконг
| Отряд | Семейство | Частота встречаемости, % | CPUE, экз./ч | |
|---|---|---|---|---|
| min‒max | M ± SD | |||
| Clupeiformes | Engraulidae | 81.1 | 2.0–421.3 | 62.4 ± 83.3 |
| Perciformes | Polynemidae | 70.3 | 2.0–7700.0 | 295.9 ± 1149.2 |
| Siluriformes | Ariidae | 64.9 | 1.5–3602.0 | 161.1 ± 518.7 |
| Perciformes | Sciaenidae | 52.7 | 1.9–693.8 | 58.4 ± 114.4 |
| Perciformes | Ambassidae | 50.0 | 2.0–172.7 | 16.6 ± 30.0 |
| Siluriformes | Pangasiidae | 41.9 | 1.9–1054.9 | 97.3 ± 236.3 |
| Cypriniformes | Cyprinidae | 39.2 | 1.9–45.5 | 8.2 ± 9.3 |
| Clupeiformes | Clupeidae | 32.4 | 1.9–1753.2 | 208.8 ± 389.0 |
| Perciformes | Callionymidae | 29.7 | 2.0–94.2 | 20.9 ± 28.0 |
| Perciformes | Gobiidae | 24.3 | 2.0–15.4 | 5.3 ± 3.6 |
| Pleuronectiformes | Cynoglossidae | 24.3 | 2.0–53.1 | 9.4 ± 13.4 |
| Pleuronectiformes | Soleidae | 18.9 | 2.0–25.0 | 5.7 ± 6.4 |
| Siluriformes | Plotosidae | 14.9 | 2.0–12.5 | 6.1 ± 3.5 |
| Siluriformes | Akysidae | 9.5 | 2.1–6.3 | 4.6 ± 1.7 |
| Siluriformes | Siluridae | 9.5 | 2.1–105.3 | 19.6 ± 38.0 |
| Perciformes | Carangidae | 8.1 | 1.4–37.5 | 9.4 ± 13.9 |
| Perciformes | Lobotidae | 8.1 | 2.0–4.8 | 2.9 ± 1.1 |
| Perciformes | Trichiuridae | 8.1 | 2.1–6.3 | 3.7 ± 2.0 |
| Batrachoidiformes | Batrahoididae | 6.8 | 3.1–12.5 | 5.8 ± 4.0 |
| Clupeiformes | Pristigasteridae | 6.8 | 2.1–4.2 | 2.9 ± 0.9 |
| Perciformes | Eleotridae | 6.8 | 2.4–62.5 | 17.3 ± 25.9 |
| Perciformes | Scatophagidae | 6.8 | 2.0–6.3 | 3.1 ± 1.8 |
| Perciformes | Siganidae | 6.8 | 2.7–6.1 | 3.9 ± 1.4 |
| Anguilliformes | Muraenesocidae | 5.4 | 2.1–6.1 | 3.6 ± 1.8 |
| Mugiliformes | Mugilidae | 5.4 | 2.1–16.7 | 5.8 ± 7.3 |
| Perciformes | Scorpaenidae | 5.4 | 2.9–25.0 | 9.3 ± 10.6 |
| Perciformes | Sillaginidae | 2.7 | 2.1–2.1 | 2.1 |
| Cypriniformes | Cobitidae | 1.4 | 2.0 | – |
| Gadiformes | Bregmacerotidae | 1.4 | 3.0 | – |
| Perciformes | Stromateidae | 1.4 | 3.1 | – |
| Siluriformes | Loricariidae | 1.4 | 2.0 | – |
| Tetraodontiformes | Tetraodontidae | 1.4 | 9.4 | – |
Согласно проверяемой гипотезе, на дендрограмме, отражающей сходство таксономического состава уловов, выявлены три группы наблюдений (рис. 2). Различия между группами хорошо выражены, межкластерное расстояние превышает 10 единиц. Наблюдения из первой группы пространственно распределены в верхнем (подгруппа 1B) и нижнем (подгруппа 1A, кроме уловов 54, 55) течении дельты и почти не представлены в средней ее части, за исключением уловов 11 и 43 (рис. 3). Вторая группа уловов приурочена к нижнему течению дельты и не представлена в ее верхней и средней части. Третья группа распределена ниже по течению относительно той части первой группы, которая приурочена к верховьям дельты (исключение – улов 61), и частично перекрывается с наблюдениями второй группы в нижней ее части.
Рис. 2.
Сходство таксономического состава рыб в уловах разноглубинного трала на разных участках дельты р. Меконг. Рамками выделены ветви дендрограммы, соответствующие трем группам уловов (1‒3). В 1-й группе уловов прямоугольниками обозначены подгруппы (1A, 1B), звездочкой отмечены номера “выбросов”. По оси ординат – расстояние объединения.

Рис. 3.
Пространственное распределение уловов разных групп (1A, 1B, 2, 3) в дельте р. Меконг. Цифрами отмечены номера уловов, обсуждаемые в тексте как “выбросы”.

Характер пространственного распределения наблюдений разных групп позволяет определить их принадлежность к одному из трех таксономических комплексов, наличие которых в ДМ предполагается проверяемой гипотезой. Так, солоновато-водный комплекс представлен второй группой уловов, а также частью уловов первой группы (подгруппа 1A). Наблюдения третьей группы соответствуют маргинальному комплексу, а уловы подгруппы 1B – пресноводному.
Пространственное положение уловов 11, 43, 54, 55 и 61 противоречит их классификации, выполненной по результатам кластерного анализа, в связи с чем эти наблюдения отнесены к “выбросам”. В составе таких уловов обнаружены от 1 до 199 экз. рыб, относящихся к одному–семи семействам (табл. 2). Таксономический и количественный состав уловов 54 и 55 сходен, их основу составляют Clupeidae, относительная численность которых достигает высоких значений 213–440 экз./ч. Состав уловов 11 и 61 более разнообразен, относительная численность рыб – низкая. Улов 43 состоит из 1 экз. Ambassiidae.
Таблица 2.
Состав уловов разноглубинного трала в дельте р. Меконг, обсуждаемых в тексте как “выбросы”
| Семейство | Номер траления | ||||
|---|---|---|---|---|---|
| 11 | 43 | 54 | 55 | 61 | |
| Ambassidae | $\frac{2}{{4.2}}$ | $\frac{1}{{3.0}}$ | – | – | $\frac{{10}}{{28.6}}$ |
| Clupeidae | $\frac{1}{{2.1}}$ | – | $\frac{{68}}{{212.5}}$ | $\frac{{198}}{{440.0}}$ | – |
| Cynoglossidae | $\frac{3}{{6.3}}$ | – | – | – | – |
| Cyprinidae | $\frac{1}{{2.1}}$ | – | – | – | $\frac{4}{{11.4}}$ |
| Engraulidae | $\frac{2}{{4.2}}$ | – | $\frac{1}{{3.1}}$ | $\frac{1}{{2.2}}$ | – |
| Mugilidae | $\frac{1}{{2.1}}$ | – | – | – | – |
| Pangasiidae | $\frac{2}{{4.2}}$ | – | – | – | $\frac{5}{{14.3}}$ |
| Polynemidae | – | – | $\frac{1}{{3.1}}$ | – | $\frac{1}{{2.9}}$ |
Принадлежность “выбросов” к таксономическим комплексам была пересмотрена на основании их пространственного положения в дельте, а также согласно результатов классификации соседних наблюдений: уловы 54, 55 и 61 отнесены к пресноводному комплексу, а 11 и 43 – к маргинальному.
Таксономический состав пресноводного комплекса наиболее беден и представлен девятью семействами (табл. 3). Наиболее часто встречаются Clupeidae и Cyprinidae, представители этих таксонов обнаружены в 92 и 85% уловов соответственно. Семейства Ambassidae и Engraulidae также широко распространены в уловах ПК, они отмечены более чем в половине наблюдений. Доминирующие в общей совокупности уловов разноглубинного трала в ДМ таксоны Ariidae и Sciaenidae (табл. 1) отсутствуют в ПК, а представители широко распространенного семейства Polynemidae отмечены лишь в 23% наблюдений.
Таблица 3.
Частота встречаемости (%) семейств рыб в уловах пресноводного, маргинального и солоновато-водного комплексов дельты р. Меконг
| Семейство | Пресноводный (подгруппа 1B) | Маргинальный (группа 3) |
Солоновато-водный | |
|---|---|---|---|---|
| (группа 2) | (подгруппа 1A) | |||
| Akysidae | 7.69 | 16.67 | – | – |
| Ambassidae | 61.54 | 72.22 | 15.79 | – |
| Ariidae | – | 80.56 | 100.00 | – |
| Batrahoididae* | – | 11.11 | 5.26 | – |
| Bregmacerotidae* | – | – | 5.26 | – |
| Callionymidae | 7.69 | 52.78 | 10.53 | – |
| Carangidae* | – | 5.56 | 21.05 | – |
| Clupeidae | 92.31 | 27.78 | 5.26 | 16.67 |
| Cobitidae | – | 2.78 | – | – |
| Cynoglossidae | 7.69 | 38.89 | 15.79 | – |
| Cyprinidae | 84.62 | 44.44 | 10.53 | – |
| Eleotridae | – | 13.89 | – | – |
| Engraulidae | 61.54 | 88.89 | 84.21 | 66.67 |
| Gobiidae | – | 30.56 | 36.84 | – |
| Lobotidae | – | 13.89 | 5.26 | – |
| Loricariidae | – | 2.78 | – | – |
| Mugilidae* | – | 2.78 | 15.79 | – |
| Muraenesocidae* | – | – | 21.05 | – |
| Pangasiidae | 38.46 | 69.44 | 5.26 | – |
| Plotosidae | – | 30.56 | – | – |
| Polynemidae | 23.08 | 86.11 | 89.47 | 16.67 |
| Pristigasteridae* | – | – | 21.05 | 16.67 |
| Scatophagidae* | – | 5.56 | 15.79 | – |
| Sciaenidae | – | 47.22 | 100.00 | 50.00 |
| Scorpaenidae* | – | – | 21.05 | – |
| Siganidae* | – | – | 26.32 | – |
| Sillaginidae* | – | 5.56 | – | – |
| Siluridae | – | 19.44 | – | – |
| Soleidae | – | 27.78 | 21.05 | – |
| Stromateidae* | – | 2.78 | – | – |
| Tetraodontidae* | – | 2.78 | – | – |
| Trichiuridae* | – | – | 26.32 | 16.67 |
Наиболее богат таксономический состав маргинального комплекса, в который входят 26 семейств рыб (табл. 3). Роль представителей Clupeidae и Cyprinidae, преобладающих в ПК, уменьшается – среди уловов МК эти семейства встречаются в два–три раза реже. Обычные для ПК Ambassidae и Engraulidae здесь также широко представлены, а частота встречаемости Callionymidae, Polynemidae и Pangasiidae возрастает в несколько раз. Представители семейств Ariidae и Sciaenidae, отсутствующих в ПК, в составе МК становятся обычными и даже массовыми. По мере продвижения к морской границе дельты, эти семейства займут доминирующее положение и будут встречаться в каждом улове группы 2 в составе СК. Частота встречаемости семейств Cobitidae, Eleotridae, Plotosidae и Siluridae невысока, но их представители отмечены только в составе МК. К группе таких таксонов можно отнести и Akysidae, поскольку в составе ПК это семейство представлено одним экземпляром в улове 64, полученном вблизи условной границы между ПК и МК (рис. 1, рис. 3).
В состав солоновато-водного комплекса входят 23 семейства, в группе 2 представлены все эти таксоны, а в подгруппе 1A – лишь 6 из них (табл. 3). В уловах этого комплекса уменьшается роль Ambassidae, Clupeidae, Cyprinidae и Pangasiidae, типичных для ПК и МК. Семейства Engraulidae и Polynemidae представлены более чем в 80% наблюдений группы 2, как и в уловах МК (группа 3). Представители Ariidae и Sciaenidae присутствуют во всех уловах группы 2. В составе подгруппы 1A наиболее часто встречаются Engraulidae и Sciaenidae. Представители семейств Bregmacerotidae, Muraenesocidae, Pristigasteridae, Scorpaenidae, Siganidae и Trichiuridae встречаются только в составе солоновато-водного комплекса.
Наблюдения СК и МК частично перекрываются в нижнем течении ДМ, в то время как ПК и МК пространственно разделены (рис. 4). Положение условной границы между ПК и МК достаточно однозначно, поскольку она разделяет две неперекрывающиеся группы наблюдений. Граница, отделяющая СК от МК, проходит немного выше по течению относительно наблюдений СК, наиболее удаленных от морского края дельты. По результатам наблюдений, выполненных на протяжении сухого сезона 2021 г., расстояние от морского края ДМ до границ СК и ПК было 34 и 78 км, соответственно. Примечательно, что изогалина 4 г/л, положение которой принимают в качестве индикатора проникновения морских вод вглубь континента (Binh et al., 2020), во время сухого сезона 2016 г. была расположена между текущими границами ПК и СК, а ее форма отчасти сходна с последней (рис. 4). Возможность определения положения границ ПК и СК описываемым методом создает предпосылки для районирования ДМ по признаку сходства таксономического состава рыбного населения, определяемого по уловам разноглубинного трала.
Рис. 4.
Схема районирования дельты Меконга по признаку сходства таксономического сходства уловов разноглубинного трала по состоянию на январь–апрель 2021 г. Таксономический комплекс: 1 – пресноводный; 2 – солоновато-водный; 3 – маргинальный. Условная граница: I – морской край дельты; II – граница солоновато-водного комплекса; III – граница пресноводного комплекса; IV – изогалина 4 г/л по состоянию на 2016 г. (по: Binh et al., 2020).

ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Паттерны таксономического и количественного состава рыбного населения, наблюдаемые вдоль течения крупных тропических рек, связаны с закономерным изменением условий среды обитания по мере продвижения от истока к устью, в том числе с наличием градиентов соответствующих факторов, таких как скорость течения, температура, состав и концентрация растворенных веществ, характер донного рельефа и грунта, морфологические особенности водотока, высота над уровнем моря и др. (Wu et al., 2011; Liu et al., 2020; Miranda et al., 2022). В ДМ наиболее значимым для биоты градиентом, наблюдаемым на протяжении десятков километров, является изменение солености (Cyrus, Blaber, 1992; Yuan et al., 2020), а колебания таких критических для гидробионтов факторов, как температура воды и концентрация растворенного кислорода, незначительны (Binh et al., 2020; Sharov et al., 2020). Градиент солености – важнейший фактор, формирующий пространственную структуру рыбного населения ДМ. Так, в ее верхнем течении доминируют пресноводные представители семейств Cyprinidae и Clupeidae, которые в этой части дельты представлены борнейским речным шпротом Clupeoides borneensis Bleeker. В то же время Batrahoididae, Bregmacerotidae, Carangidae, Mugilidae, Muraenesocidae, Pristigasteridae, Scatophagidae, Scorpaenidae, Siganidae, Sillaginidae, Stromateidae, Tetraodontidae и Trichiuridae, относящиеся к морской фауне (Rainboth, 1996), отмечены в нижнем течении дельты в составе СК, а также в той части наблюдений МК, которая пространственно перекрывается с СК. Сравнительно редкие Cobitidae, Eleotridae, Plotosidae и Siluridae обнаружены только в составе МК, в среднем течении, в то время как эвригалинные и массовые Ambassidae, Engraulidae и Polynemidae присутствуют на всех участках дельты, поскольку обитают в широком диапазоне концентраций растворенных солей (табл. 1, табл. 3). Описываемый паттерн пространственного распределения рыбного населения не противоречит и согласуется с гипотезой, предполагающей наличие трех таксономических комплексов (ПК, СК и МК), которые приурочены к верхнему (пресноводному), нижнему (солоновато-водному) и среднему течению ДМ соответственно.
Причина разделения отнесенных к СК наблюдений на две части (группу 2 и подгруппу 1A) связана с особенностью работы разноглубинного трала в условиях ДМ. В состав группы 2 входит богатый перечень таксонов, представители которых ведут пелагический и придонный образ жизни, в составе уловов подгруппы 1A, полученных в той же части ДМ, придонные рыбы (Ariidae, Gobiidae и Soleidae) отсутствуют. Особенности рельефа дна и недостаточная глубина на некоторых участках дельты приводят к тому, что на протяжении всего траления или его части разноглубинный трал работает как донный и улавливает не только пелагических, но и донных рыб. В таких случаях в улове в значительном количестве присутствует мусор естественного и антропогенного происхождения, что подтверждает контакт орудия лова с грунтом. Описываемая особенность работы орудия лова не является его недостатком, однако должна учитываться при интерпретации результатов: часть уловов характеризует пелагическую и донную составляющую рыбного населения, остальные – только пелагическую часть. Глубины в верхнем течении ДМ больше, чем в средней и нижней ее части, поэтому уловы ПК отражают пелагическую составляющую рыбного населения этого участка, что очевидно служит причиной отсутствия в них массового эвригалинного сем. Ariidae. Таксономическое сходство уловов ПК (подгруппа 1B) и части уловов СК (подгруппа 1A), ставшее причиной их объединения в группу 1 (рис. 2), объясняется отсутствием в их составе рыб, ведущих придонный образ жизни. Таким образом, донный рельеф, разнокачественность которого в пределах ДМ косвенно показана в настоящей работе, влияет на состав уловов разноглубинного трала, однако его роль в формировании пространственного паттерна структуры рыбного населения – задача дальнейших исследований.
В состав рыбного населения ДМ входят широко распространенные и многочисленные эвригалинные представители семейств Engraulidae, Polynemidae, Ambassidae и др. (табл. 1). Их пространственное распределение слабо связано с соленостью среды, соответственно паттерн распределения этих рыб мало пригоден для мониторинга проникновения соленых вод вглубь континента. В то же время ряд таксонов локализован в строго определенной части дельты, что вероятно связано с оптимальными избираемыми диапазонами солености. Наибольший интерес вызывают обнаруженные в зоне контакта пресных и солоноватых вод сем. Cobitidae, Eleotridae, Plotosidae и Siluridae, представители которых могут быть рассмотрены в качестве видов-индикаторов ее положения, как это сделано в ряде работ на примере других эстуарных систем (Whitfield, Elliot, 2002; Steichen, Quigg, 2018). Однако относительная численность этих таксонов мала (табл. 1), и попытка районирования ДМ только лишь на основании сведений об их распределении потребует кратного увеличения объемов собираемого материала, либо проведения экспериментальных работ по выявлению их пластичности. В целом стоит признать удачным предлагаемый комплексный подход, комбинирующий результаты анализа таксономического состава уловов, отражающих пелагическую и придонную составляющую рыбного населения, с особенностями пространственного распределения выявленных групп наблюдений.
В рамках данной работы не проводили измерения концентрации растворенных солей в местах лова, поэтому не представляется возможным указать диапазоны солености, в которых обитают представители описанных таксономических комплексов. Изогалина 4 г/л (принятый рядом авторов показатель проникновения морских вод вглубь ДМ), равноудалена от текущих границ ПК и СК. Указанное на рис. 4 положение изогалины определено в засушливом 2016 г. (Binh et al., 2020), и в настоящее время она может располагаться существенно ближе к границе СК или ПК. Имеющие биологический смысл границы ПК и СК могут выступать в качестве более надежного показателя проникновения морских вод вглубь ДМ по сравнению с инструментальными методами, применение которых зачастую не позволяет выявить кратковременные колебания солености, вызванные сочетанием ряда случайных факторов, воздействующих на расход и уровень воды в дельте. От живых систем ожидаема толерантность и устойчивость к кратковременному нарушению оптимальных условий обитания, в то же время рыбы обладают достаточной мобильностью для перемещения из неблагоприятных участков в случае перманентности негативного воздействия факторов. Определение значений солености, соответствующих границам ПК и СК, – задача дальнейших исследований, выполнение которой необходимо для сопоставления с результатами ранее проведенных инструментальных наблюдений.
Выводы. Комплексный подход, основанный на оценке сходства таксономического состава рыбного населения по уловам разноглубинного трала, выявлении пресноводного, маргинального и солоновато-водного комплексов в совокупности с анализом их пространственного распределения в дельте р. Меконг, – перспективный и обоснованный способ наблюдения за динамикой проникновения морских вод вглубь континента, и может быть применим при организации долгосрочного мониторинга. В условиях дельты р. Меконг разноглубинный трал является орудием лова, предоставляющим достаточную информацию для исследований предлагаемым методом.
Список литературы
Болтачев А.Р., Карпова Е.П., Статкевич С.В. и др. 2018. Особенности количественного распределения рыб и десятиногих ракообразных в дельте реки Меконг в меженный период 2018 г. // Мор. биол. журн. Т. 3. № 4. С. 14. https://doi.org/10.21072/mbj.2018.03.4.02
Binh D.V., Kantoush S.A., Saber M. et al. 2020. Long-term alterations of flow regimes of the Mekong River and adaptation strategies for the Vietnamese Mekong Delta // J. Hydrology: Regional Studies. V. 32. P. 100 742. https://doi.org/10.1016/j.ejrh.2020.100742
Chea R., Lek S., Ngor P., Grenouillet G. 2017. Large-scale patterns of fish diversity and assemblage structure in the longest tropical river in Asia // Ecol. Freshwater Fish. V. 26. № 4. P. 575. https://doi.org/10.1111/eff.12301
Cyrus D.P., Blaber S.J.M. 1992. Turbidity and salinity in a tropical northern Australian estuary and their influence on fish distribution // Estuar. Coast. Shelf Sci. V. 35. № 6. P. 545. https://doi.org/10.1016/S0272-7714(05)80038-1
Das S.K., Chakrabarty D. 2007. The use of fish community structure as a measure of ecological degradation: A case study in two tropical rivers of India // BioSystems. V. 90. № 1. P. 188. https://doi.org/10.1016/j.biosystems.2006.08.003
Eslami S., Hoekstra P., Kernkamp H.W.J. et al. 2021. Dynamics of salt intrusion in the Mekong Delta: results of field observations and integrated coastal–inland modelling // Earth Surf. Dynam. V. 9. № 4. P. 953. https://doi.org/10.5194/esurf-9-953-2021
Huang J., Huang L., Wu Z. et al. 2019. Correlation of fish assemblages with habitat and environmental variables in a headwater stream section of Lijiang River, China // Sustainability. V. 11. № 4. P. 1135. https://doi.org/10.3390/su11041135
Karpova E.P., Boltachev A.R., Ablyazov E.R. et al. 2021. Spatial variations in fish abundance in the Mekong Delta // Russ. J. Ecol. V. 52. № 2. P. 146. https://doi.org/10.1134/S1067413620050082
Lasne E., Bergerot B., Lek S., Laffaille P. 2007. Fish zonation and indicator species for the evaluation of the ecological status of rivers: example of the Loire basin (France) // River Res. Appl. V. 23. № 8. P. 877. https://doi.org/10.1002/rra.1030
Liu F., Wang J., Zhang F.-B. et al. 2020. Spatial organisation of fish assemblages in the Chishui River, the last free-flowing tributary of the upper Yangtze River, China // Ecol. Freshwater Fish. V. 30. № 1. P. 48. https://doi.org/https://doi.org/10.1111/eff.12562
Miranda R., Rios-Touma B., Falconi-Lopez A. et al. 2022. Evaluating the influence of environmental variables on fish assemblages along Tropical Andes: considerations from ecology to conservation // Hydrobiologia. V. 849. № 20. P. 4569. https://doi.org/10.1007/s10750-021-04726-3
Nguyen A.D., Savenije H.H.G., Pham D.N., Tang D.T. 2008. Using salt intrusion measurements to determine the freshwater discharge distribution over the branches of a multi-channel estuary: The Mekong Delta case // Estuarine, Coastal Shelf Sci. V. 77. № 3. P. 433. https://doi.org/10.1016/j.ecss.2007.10.010
Nuon V., Lek S., Ngor P.B. et al. 2020. Fish community responses to human-induced stresses in the Lower Mekong Basin // Water. V. 12. № 12. P. 3522. https://doi.org/10.3390/w12123522
R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. URL https://www.R-project.org/.
Rainboth W.J. 1996. Fishes of the Cambodian Mekong. FAO species identification field guide for fishery purposes. Rome: FAO.
Sharov A.N., Tsvetkov A.I., Korneva L.G., Dinh C.N. 2020. Phytoplankton of the delta of the Mekong River during the dry season // Biosystems Diversity. V. 28. № 3. P. 329. https://doi.org/10.15421/012041
Steichen J.L., Quigg A. 2018. Fish species as indicators of freshwater inflow within a subtropical estuary in the Gulf of Mexico // Ecol. Indic. V. 85. Suppl. A. P. 180. https://doi.org/10.1016/j.ecolind.2017.10.018
Tan L.V., Tran T., Loc H.H. 2020. Soil and water quality indicators of diversified farming systems in a saline region of the Mekong Delta, Vietnam // Agriculture (Basel, Switz.). V. 10. № 2. P. 38. https://doi.org/10.3390/agriculture10020038
Thang N.C., Ngoc H.H., Tuet T.T. 2020. Climate change adaptation policies of Vietnam in the Mekong Delta // Russ. J. Vietnam Stud. Series 2. № 3. P. 36. https://doi.org/10.24411/2618-9453-2020-10023
Tri D.Q., Don N.C., Ching C.Y., Mishura P.K. 2014. Modeling the influence of river flow and salinity intrusion in the Mekong River Estuary, Vietnam // Lowland Technol. Int. V. 16. № 1. P. 14. https://doi.org/10.14247/lti.16.1_14
Tran D.D., Shibukawa K., Nguyen P.T. et al. 2013. Fishes of the Mekong Delta, Vietnam. Can Tho: Can Tho University Publishing House.
Tuan L.A., Chinvanno S. 2011. Climate change in the Mekong River Delta and key concerns on future climate threats // Environmental Change and Agricultural Sustainability in the Mekong Delta. Dordrecht: Springer. P. 207. https://doi.org/10.1007/978-94-007-0934-8_12
Valbo-Jorgensen J., Coates D., Hortle K. 2009. Chapter 8 – Fish diversity in the Mekong River basin // The Mekong: Biophysical environment of an International river basin. Amsterdam: Elsevier Publishers. P. 161. https://doi.org/10.1016/B978-0-12-374026-7.00008-5
Whitfield A.K., Elliott M. 2002. Fishes as indicators of environmental and ecological changes within estuaries: a review of progress and some suggestions for the future // J. Fish Biol. V. 61. P. 229. https://doi.org/10.1111/j.1095-8649.2002.tb01773.x
Wu J., Wang J., He Y., Cao W. 2011. Fish assemblage structure in the Chishui River, a protected tributary of the Yangtze River // Knowl. Manag. Aquat. Ecosyst. V. 400. № 11. https://doi.org/10.1051/kmae/2011023
Yuan D., Chen L., Luan L. et al. 2020. Effect of salinity on the zooplankton community in the Pearl river estuary // J. Ocean Univ. China. V. 19. № 6. P. 1389. https://doi.org/10.1007/s11802-020-4449-6
Zhang C., Zhu R., Sui X. et al. 2021. Understanding patterns of taxonomic diversity, functional diversity, and ecological drivers of fish fauna in the Mekong River // Global Ecol. Conserv. V. 28. e01711. https://doi.org/10.1016/j.gecco.2021.e01711
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


