Биология внутренних вод, 2023, № 2, стр. 243-251
Зависимость распространения чужеродных видов макрозообентоса от типа и состава грунта в волжских и камских водохранилищах
Е. М. Курина a, *, Д. Г. Селезнев b, Н. Г. Шерышева c, d
a Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
Москва, Россия
b Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
пос. Борок, Некоузский р-н, Ярославская обл., Россия
c Самарский федеральный исследовательский центр Российской академии наук
Тольятти, Россия
d Тольяттинский государственный университет
Тольятти, Россия
* E-mail: ekaterina_kurina@mail.ru
Поступила в редакцию 23.03.2022
После доработки 06.04.2022
Принята к публикации 16.06.2022
- EDN: BTQTVI
- DOI: 10.31857/S032096522302016X
Аннотация
В результате исследований макрозообентоса в водохранилищах Волжского и Камского каскадов проведена оценка степени биотопической приуроченности чужеродных видов. Выявлена достоверно значимая зависимость численности полихеты Hypania invalida (Grube, 1860), моллюска Dreissena bugensis (Andrusov, 1897) и амфиподы Dikerogammarus haemobaphes (Eichwald, 1841) от фракционного состава донных отложений. Показана зависимость распространения вселенцев (представителей разных трофических групп от типа биотопа).
ВВЕДЕНИЕ
До зарегулирования рек Волга и Кама состав донных организмов был типичным для равнинной реки, однако в отличие от водоемов других бассейнов, чужеродные виды (в основном представители понто-каспийской фауны) местами образовывали специфические биоценозы (Волга…, 1978). В связи со значительными площадями песчанистых отложений, занимавших до 90% дна, в реках Волга и Кама преобладал псаммофильный биоценоз, состоящий из олигохет и нескольких форм личинок хирономид, а также понто-каспийских ракообразных, среди которых доминировала зарывающаяся гаммарида Pontogammarus sarsi (Sowinsky, 1898) (Жадин, 1940). С образованием водохранилищ произошла перестройка речных биоценозов из-за заиления биотопов. Прежде всего, чрезвычайно широко расселился моллюск Dreissena polymorpha (Pallas, 1771), также большинство типично псаммофильных амфипод были вытеснены пелофильными видами ракообразных (Волга…, 1978). Резкий рост числа видов-вселенцев начался с 1980–1990 гг. (Зинченко и др., 2007). По литературным и собственным данным за тридцатилетний период исследований в водохранилищах рек Волга и Кама зарегистрировано >50 чужеродных видов – представителей понто-каспийской, понто-азовской и байкальской фауны (Зинченко и др., 2007; Алексевнина, Истомина, 2008; Филинова и др., 2008; Щербина, 2009; Яковлева, 2010; Истомина, 2017; Курина, Селезнев, 2019; Перова, 2020; Курина и др., 2021).
В настоящее время водохранилища Волжского и Камского каскадов отличаются большим разнообразием биотопов, соответственно особое значение приобретает высокая эвритопность видов макрозообентоса при вселении их в новые местообитания. При этом, если два и более вида характеризуются близкими требованиями к условиям среды (например, к типу грунта), может происходить перекрытие экологических ниш у популяций этих видов (May, Mac Arthur, 1972).
В большинстве публикаций, посвященных изучению чужеродных видов макрозообентоса, авторы приводят отрывочные сведения, касающиеся их биотопической приуроченности в том или ином водоеме (Зинченко и др., 2007; Алексевнина, Истомина, 2008; Филинова и др., 2008; Курина, Селезнев, 2019 и др.). В центре внимания большинства исследователей традиционно остаются данные о динамике популяций вселенцев, ее структуре, а также их количественных характеристиках.
Цель работы – дать оценку распространения чужеродных видов донных сообществ в зависимости от типа грунта в водоемах Средней и Нижней Волги и в водохранилищах Камского каскада.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалом исследований послужили пробы макрозообентоса глубоководных участков (>8 м), свала глубин (3−8 м) и мелководной зоны (<3.0 м) водоемов Средней и Нижней Волги и водохранилищ Камского каскада. Пробы отбирали на незарегулированном участке р. Волга (от г. Волгоград до г. Астрахань) в 2016 г. на 15 станциях (число проб n = 16), в Волгоградском водохранилище − в 2005, 2011 и 2016 гг. на 24 станциях (n = 40), в Саратовском – в 2009−2016 гг. на 45 станциях (n = 108), в Куйбышевском – в 2009−2016 гг. на 40 станциях (n = 113), в Чебоксарском – в 2016 г. на 14 станциях (n = 20), в Горьковском в 2016 г. – на 18 станциях (n = 35), в Камском в 2016 г. − на 15 станциях (n = 20), в Воткинском в 2016 г. − на 14 станциях (n = 17), в Нижнекамском в 2016 г. − на 14 станциях (n = 18). Всего отобрано 387 проб макрозообентоса.
Количественные пробы отбирали дночерпателями Экмана–Берджа с площадью захвата 250 и 400 см2 по два подъема на станции, качественные пробы – гидробиологическим скребком с длиной ножа 20 см и драгой с длиной ножа 40 см (размер ячеи 0.23 мм). Сбор и обработку материала проводили с использованием стандартных гидробиологических методов (Руководство…, 1992; Баканов, 2000).
Во время исследований измеряли глубину, описывали состав грунта и определяли тип биотопа по методике (Зинченко, 2002). В настоящей работе не рассмотрен “ракушечный” грунт, поскольку приуроченность чужеродных видов и моллюсков рода Dreissena в водохранилищах рек Волга и Кама приведена в (Курина, Селезнев, 2019; Курина и др., 2021).
Гранулометрический состав грунта в 108 пробах определяли комбинированным методом (влажным ситовым и фракциометрическим) с выделением размерных фракций крупного песка >1.0 мм, среднего и мелкого песка – 1.0–0.1 мм, алеврита – 0.09–0.01 мм и пелита <0.01 мм (Кузяхметов и др., 2004; Законнов и др., 2018).
Для оценки избирательности типа грунта чужеродными видами использовали показатель степени биотопической приуроченности (Fij), предложенный Ю.Н. Песенко (1982):
Этот показатель учитывает долю вида в структуре сообществ разных мест обитания и не требует равного объема исследований в разных местообитаниях. Если вид встречен только в одном биотопе (показатель Fij = 1) или отдавал явное предпочтение одному биотопу (>0.7) при отрицательном или безразличном (Fij, близком к нулю) отношении к другим биотопам, то вид относили к стенотопным. Если показатели биотопической приуроченности во всех исследованных пробах были равны нулю или незначительно (±0.3) отклонялись от него, то вид относили к эвритопным. Промежуточное положение занимали виды, обладающие достаточной экологической пластичностью, чтобы освоить несколько биотопов.
Для выделения трофических групп гидробионтов за основу использовали классификацию, предложенную А.С. Константиновым (1986) и Э.И. Извековой (1975). Выделено семь трофических групп донных животных по способу и характеру питания: фитодетритофаги–собиратели (моллюски Theodoxus astrachanicus (Starobogatov in Starobogatov, Filchakov, Antonova et Pirogov, 1994), Lithoglyphus naticoides (Preiffer, 1828)); детритофаги–собиратели + грунтозаглатыватели (полихеты, олигохеты Potamothrix vejdovskyi Hrabĕ, 1941); всеядные собиратели + хвататели (большинство амфипод, кумовых ракообразных, мизид); хищники–хвататели (пиявки); сестонофаги + детритофаги–фильтраторы (моллюски Dreissena bugensis (Andrusov, 1897) и D. polymorpha), детритофаги–собиратели + фильтраторы (амфиподы рода Chelicorophium, Dikerogammarus haemobaphes (Eichwald, 1841)).
Перекрытие ниш (niche overlap) популяций чужеродных видов на различных типах донных отложений анализировали с помощью индекса Пианки (Pianka, 1974), сходного с коэффициентом конкуренции α в уравнении Лотки–Вольтерры, и перестановочной нуль-модели с 10 000 перестановками.11 Ординационную диаграмму строили методом анализа избыточности (Redundancy Analysis, RDA) (Rao, 1964) – методом прямой ординации, отображающим изменение видового состава вдоль градиента факторов среды, в нашем случае фракции грунта. Зависимость численности гидробионтов от процентного содержания фракции грунта исследовали с помощью точной перестановочной линейной модели.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В период исследований 2009−2016 гг. в водохранилищах Волжского и Камского каскадов обнаружено 39 чужеродных видов, их состав и частота встречаемости приведены в работах (Курина, Селезнев, 2019; Курина и др., 2021).
Для оценки избирательности распространенных чужеродных видов (частота вcтречаемости R > 5%) в зависимости от типа грунта рассчитан показатель степени биотопической приуроченности, на основании которого выделено три группы видов: стенотопные, эвритопные и освоившие два и более биотопов (табл. 1). Большинство чужеродных видов макрозообентоса (13) характеризуются достаточной экологической пластичностью, чтобы освоить несколько типов биотопов. Среди стенотопных видов можно выделить несколько групп: псаммофильные (6 видов), литофильные (3), пелофильные (2), аргиллофильные − (1), фитофильные (2). Нами отмечен единственный вид, который в водохранилищах Волги и Камы может быть отнесен к эвритопным − Dreissena bugensis.
Таблица 1.
Показатель степени биотопической приуроченности (Fij), частота встречаемости (R) в зарослях высших водных растений (ВВР), экологические группы по приуроченности к типам донных отложений распространенных чужеродных видов в волжских и камских водохранилищах
| Вид | Сокращение | Fij на различных биотопах | R на грунтах с ВВР | Группа по типу грунта | ||||
|---|---|---|---|---|---|---|---|---|
| I | II | III | IV | V | ||||
| Potamothrix vejdovskyi | Ptmv | –0.6 | –0.7 | 0.0 | 0.9 | 0.6 | 18 | П |
| Hypania invalida (Grube, 1860) | Hypi | –0.5 | 0.5 | 0.2 | 0.2 | 0.6 | 29 | П |
| Archaeobdella esmonti Grimm, 1876 | Arce | –0.6 | 0.0 | –0.6 | 0.2 | 0.7 | 47 | А |
| Paramysis lacustris (Czerniavsky, 1882) | Prml | –0.9 | 0.6 | –0.2 | 0.0 | –1.0 | 64 | П |
| P. ullskyi Czerniavsky, 1882 | Prmu | –0.5 | 0.8 | –1.0 | –0.2 | –1.0 | 50 | ПС |
| Katamysis warpachowskyi Sars, 1893 | Ktsw | –0.3 | 0.1 | –1.0 | 0.7 | –1.0 | 67 | ПЛ |
| Pterocuma rostrata (Sars, 1894) | Ptrr | 0.8 | –0.9 | –0.8 | 0.2 | –1.0 | 63 | Л |
| P. sowinskyi (Sars, 1894) | Ptrs | –0.7 | 0.6 | –0.7 | 0.8 | –1.0 | 48 | П |
| Pseudocuma cercaroides Sars, 1894 | Psdc | –0.3 | –0.2 | –1.0 | 0.8 | –0.8 | 62 | ПЛ |
| Dikerogammarus villosus (Sowinsky, 1894) | Dkv | –1.0 | 1.0 | –1.0 | –1.0 | –1.0 | 100 | Ф |
| D. haemobaphes | Dkrh | 0.3 | –0.4 | 0.4 | –0.5 | –0.1 | 52 | П |
| D. сaspius (Pallas, 1771) | Dkc | 0.1 | 0.7 | –1.0 | –0.5 | –1.0 | 100 | Ф |
| Pontogammarus robustoides (Sars, 1894) | Pntr | –0.8 | 0.4 | –1.0 | 0.4 | 0.3 | 50 | П |
| P. maeoticus (Sowinsky, 1894) | Pntm | –0.5 | 0.9 | –1.0 | –1.0 | –1.0 | 20 | ПС |
| Obesogammarus obesus (Sars, 1896) | Obso | 0.9 | –0.6 | –0.9 | –0.8 | –1.0 | 56 | Л |
| Stenogammarus dzjubani Mordukhay-Boltovskoy et Ljakhov, 1972 | Stnd | –0.3 | 0.8 | –0.8 | –0.3 | –1.0 | 30 | ПС |
| Pandorites platycheir (Sars, 1896) | Pndp | –1.0 | 1.0 | –1.0 | –1.0 | –1.0 | 28 | ПС |
| Shablogammarus chablensis (Carausu, 1943) | Shbc | 0.3 | –1.0 | 0.4 | –0.3 | 0.0 | 22 | П |
| Chaetogammarus warpachowskyi (Sars, 1894) | Chtw | 0.8 | –0.7 | –1.0 | 0.0 | –1.0 | 79 | Л |
| Gmelinoides fasciatus (Stebbing, 1899) | Gmlf | –0.7 | 1.0 | –1.0 | –1.0 | –1.0 | 40 | ПС |
| Chelicorophium curvispinum Sars, 1895 | Chlc | –0.9 | –0.1 | 0.4 | 0.3 | –1.0 | 38 | П |
| Ch. sowinskyi Martynov, 1924 | Chls | –1.0 | 0.7 | 0.2 | –1.0 | –1.0 | 48 | ПС |
| Jaera sarsi Valkanov, 1936 | Jars | 0.7 | –1.0 | –0.8 | –0.1 | 0.4 | 67 | П |
| Dreissena bugensis | Drsb | 0.1 | –0.2 | 0.0 | 0.0 | 0.1 | 29 | Э |
| D. polymorpha | Drsp | 0.0 | 0.5 | –0.1 | –0.6 | –0.2 | 52 | П |
| Monodacna colorata (Eichwald, 1829) | Mndc | 0.3 | 0.4 | –1.0 | 0.1 | –1.0 | 15 | П |
| Theodoxus astrachanicus | Thda | 0.6 | 0.4 | –1.0 | –0.7 | –0.6 | 55 | П |
| Lithoglyphus naticoides | Lthn | –0.7 | 0.5 | –0.8 | 0.4 | –1.0 | 47 | П |
Примечание. Биотопы: I – камни + гравий; II – песок; III – серый ил; IV – почва + ил + растительные остатки; V – глина + почва. Экологические группы чужеродных видов по приуроченности к типу грунта: ПС − псаммофильные, ПЛ – пелофильные, А – аргиллофильные, Л − литофильные, Ф − фитофильные, Э – эврибионтные, П − виды, освоившие два и более биотопа.
В изученных водоемах чужеродные виды донных сообществ в большинстве случаев предпочитают пески с наличием высшей водной растительности и избегают биотопы с серыми и глинистыми илами (табл. 1).
Анализ перекрытия ниш (niche overlap) на полных данных показал, что значение индекса Пианки 0.66 значимо отличается (p < 0.0001) от среднего смоделированного значения 0.43. В изученных водоемах перекрытие ниш у чужеродных видов макрозообентоса происходит на песчаных грунтах. Анализ по группам видов, приуроченных к другим типам донных отложений, не показал отличий индекса от случайного.
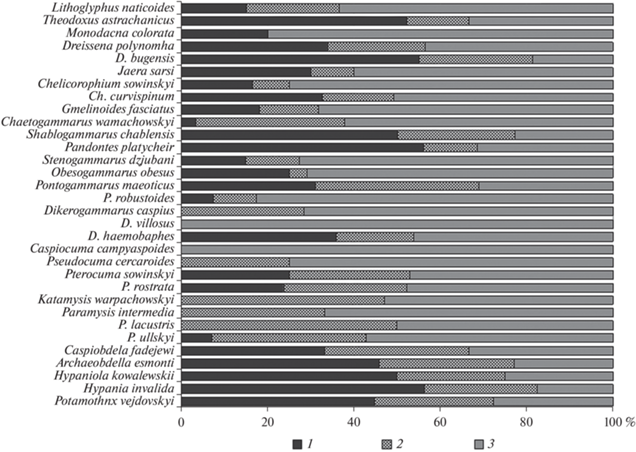
Подавляющее большинство чужеродных видов обитает и на глубоководных, и на прибрежных биотопах, а также на свале глубин ≤8 м (рис. 1). Исключение – ракообразные сем. Mysidae, встречающиеся на русловых участках водоемов крайне редко, амфиподы Dikerogammarus villosus и D. caspius, приуроченные исключительно к зарослям макрофитов, а также прибрежные виды кумовых раков Caspiocuma campylaspoides и Pseudocuma cercaroides. Выявлено также более широкое расселение некоторых видов ракообразных (Chelicorophium curvispinum, Pandorites platycheir, Pontogammarus robustoides, Pterocuma rostrata) по глубинам акватории водохранилищ по сравнению с водоемом–донором (Каспийским морем) (Атлас…, 1968).
Рис. 1.
Соотношение встречаемости чужеродных видов на различных глубинах водохранилищ Волжского и Камского каскадов (2009–2020 гг.). 1 – глубоководные станции, 2 – свал глубин, 3 – прибрежные станции.
Анализ ординационной диаграммы взаимосвязи размера фракций грунта и состава чужеродных видов макрозообентоса в водохранилищах рек Волга и Кама (рис. 2) показал, что наибольшее количество видов приурочено к грунтам размерной фракции 1.0–0.1 мм (средний и мелкий песок), а наименьшее − к размерной фракции >1.0 мм (крупный песок). Представители трофических групп всеядные собиратели + хвататели и фитодетритофаги–собиратели обитают преимущественно на средних и мелких песках, детритофаги (детритофаги–собиратели + фильтраторы, детритофаги–собиратели + грунтозаглатыватели, сестонофаги + детритофаги–фильтраторы) – на алевритовых и пелитовых илах.
Рис. 2.
Ординационная диаграмма RDA взаимосвязи размерных фракций грунта и состава чужеродных видов макрозообентоса в водохранилищах рек Волга и Кама. Размерные фракции грунта: АА − >1.0 мм, А – 1.0–0.1 мм, а – 0.09–0.01 мм, аа − <0.01 мм. Hypk − Hypaniola kowalewskii (Grimm, 1877), Cspf – Caspiobdela fadejewi (Epstein, 1961), остальные обозначения видов даны в табл. 1. 1 – детритофаги-собиратели + грунтозахватыватели, 2 – хищники-хвататели, 3 – всеядные собиратели + хвататели, 4 – детритофаги-собиратели + фильтраторы, 5 – сестонофаги + детритофаги-фильтраторы, 6 – фитодетритофаги-собиратели.

В изученных водохранилищах выявлена достоверно значимая зависимость численности полихет Hypania invalida (уровень значимости модели p = = 0.007), моллюска Dreissena bugensis (p = 0.014) и амфиподы Dikerogammarus haemobaphes (p = 0.025) от процентного содержания в механическом составе грунта пелитовой фракции размером <0.01 мм.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В водохранилищах рек Волга и Кама почти половина чужеродных видов (46%), имеющих частоту встречаемости >5%, зарегистрирована на двух и более типах грунтов. Можно предположить, что успешность распространения и натурализации видов понто-каспийского и понто-азовского комплексов в изученных водоемах в большой степени связана со значительной экологической пластичностью в выборе заселяемого субстрата, позволяющей им освоить несколько типов биотопов. Один из самых массовых видов с такими характеристиками в изученных водоемах – моллюск Dreissena polymorpha, расселившийся вверх по р. Волга еще до сооружения каскада водохранилищ (Волга…, 1978). Известно, что в Каспийском море этот вид в основном безразличен к фракционному составу донных отложений (Сейдалиева и др., 2016). В исследованных нами водоемах D. polymorpha также освоила большинство биотопов, предпочитая пески (табл. 1).
После сооружения на р. Волга каскада водохранилищ и заиления биотопов произошли вселение и натурализация моллюска Dreissena bugensis (Зинченко и др., 2007), в настоящее время вид освоил все исследованные типы грунтов в водохранилищах (т.е. эвритопный) (табл. 1). Показано продолжающееся вытеснение Dreissena polymorpha полиморфной видом Dreissena bugensis на глубоководных участках водохранилищ Средней и Нижней Волги (Курина, Селезнев, 2019). Вероятно, значительная псаммофильность D. polymorpha при отрицательном отношении к илистым отложениям не позволяет моллюску конкурировать с D. bugensis на сильно заиленных биотопах водохранилищ.
Почти для всех изученных водоемов наблюдали закономерную положительную связь моллюска D. bugensis и полихет Hypania invalida, а также Dreissena bugensis и амфиподы Dikerogammarus haemobaphes на глубоководных биотопах водоемов, где продукты жизнедеятельности моллюсков-эдификаторов служат источником пищи для отмеченных детритофагов (Курина, Селезнев, 2019). Также отмечена достоверно значимая зависимость численности этих видов от процентного содержания в грунте пелитовой фракции (<0.01 мм). Возможно, приуроченность видов Hypania invalida − Dreissena bugensis − Dikerogammarus haemobaphes связана не только с трофическими взаимодействиями этих видов, но и топическими (приуроченность к тонкодисперсным илам).
Понто-каспийские ракообразные Paramysis ullskyi, Pontogammarus maeoticus, Stenogammarus dzjubani (вид не описан для Каспийского моря, но, вероятно, близок с Stenogammarus macrurus (Мордухай-Болтовской, Ляхов, 1972)), Pandorites platycheir в изученных водохранилищах, как и в водоеме-доноре (Атлас.., 1968), приурочен к песчаным грунтам (табл. 1). В отличие от большинства ракообразных, отмеченные амфиподы имеют относительно низкую встречаемость в зарослях макрофитов (табл. 1), т.е. могут быть отнесены к типично псаммофильным видам.
Байкальский бокоплав Gmelinodes fasciatus – один из наиболее изученных видов-вселенцев в пресноводных экосистемах России (Березина, 2012; Биологические…, 2004). В водоеме-доноре вид принадлежит группе настоящих эврибионтов – обитает на разнообразных грунтах: каменистых, песчаных, населяет прибрежные растительные биоценозы (Кожов, 1947). В изученных водоемах вид предпочитает песчаные грунты прибрежной зоны водоемов (табл. 1, рис. 1), что согласуется с литературными данными по распространению бокоплава за пределами исторического ареала (Панов, 1994; Матафонов, 2003; Биологические…, 2004 и др.; Березина, 2012).
Chelicorophium curvispinum считается одним из самых распространенных видов понто-каспийского комплекса в водоемах Голарктики, его инвазионная активность объясняется особенностями биологии и экологических характеристик вида, важнейшая из которых – способность обитать в широком диапазоне экологических факторов (Rajagopal et al., 1998; Lee, Bell, 1999; Vanderploeg et al., 2002; Литоральная…, 2011 и др.). В последние десятилетия вид относительно редок в водоемах Нижней Волги (средняя частота встречаемости R ≤ 10%), однако массово обитает в водохранилищах Средней Волги (R 29%) и Камы (R 54%), а также по литературным данным широко распространен в Волго-Ахтубинской пойме (Даирова, Тарасова, 2017). Chelicorophium curvispinum в изученных водохранилищах обитает преимущественно на заиленных и песчаных биотопах глубоководных и прибрежных участков (табл. 1, рис. 1). Понто-азовский вид Ch. sowinskyi до образования водохранилищ обитал на плотных грунтах в бентосе, но не в обрастаниях (Мордухай-Болтовской, 1960). Наши исследования показали, что C. sowinskyi – вид более псаммофильный по сравнению с С. curvispinum, соответственно реже встречается на илистых биотопах водохранилищ Средней Волги (R 22%), Нижней Волги (R 6%) и Камы (R 31%).
Каменистые (в основном прибрежные) биотопы изученных водохранилищ характеризуются значительным содержанием крупно- и мелкозернистого песка, а также иловых частиц. В связи с этим, к каменисто-галечным грунтам в водохранилищах приурочены мелкие виды ракообразных (Obesogammarus obesus, Сhaetogammarus warpachowskyi, Pterocuma rostrata), обитающие в Каспийском море на песчаных и илисто-песчаных биотопах. Камни и галька с примесью песка покрыты водорослевыми и бактериальными обрастаниями, а также могут служить укрытием от хищников.
Понто-каспийская мизида Katamysis warpachowskyi – часто встречающийся вид в водоемах Европы (Daneliya et al., 2012), обитающий преимущественно на камнях, песках и илах. В Каспийском море мизида встречается на жестких грунтах (скалистых, песчаных) (Атлас…, 1968), в водохранилищах Волжского каскада – преимущественно на илах с растительными остатками (табл. 1). По-видимому, высокая пластичность вида при выборе субстрата – одна из ведущих причин его широкого распространения в разнотипных водоемах Голарктики.
В наших исследованиях (Курина, Селезнев, 2019) в водохранилищах Средней и Нижней Волги выявлена высокая совместная встречаемость отмеченной мизиды K. warpachowskyi, кумовых ракообразных Pseudocuma cercaroides и Pterocuma sowinskyi. Анализ биотопических предпочтений этих видов показал, что образуемые ими ценотические комплексы основаны, вероятно, на непрямых межвидовых отношениях, а именно, на общности занимаемых типов грунтов (илы с незначительным содержанием песка и растительных остатков).
Амфиподы Dikerogammarus haemobaphes и Pontogammarus robustoides – одни из немногих понто-каспийских видов, обитавших в р. Волга и нижнем течении р. Кама еще до зарегулирования этих рек и ставших широко распространенными и массовыми после сооружения каскадов водохранилищ (Волга…, 1978). В Каспийском море амфиподы указаны как стенобионтные виды − обитатели жестких грунтов (Атлас..., 1968). Однако в условиях водохранилищ рек Волга и Кама эти виды демонстрируют высокую экологическую пластичность, чтобы освоить разные (в том числе малонаселенные глинистые) типы грунта (табл. 1). Следует отметить, что P. robustoides расширил распространение по глубинам акватории водохранилищ по сравнению с водоемом-донором – в Каспийском море вид обитает в зоне заплеска воды (Сейдалиева и др., 2016), в волжских водохранилищах отмечен на различных глубинах ≤26 м.
Известно о нахождении инвазионно активных и потенциально хищных амфипод Dikrogammarus villosus на широком спектре субстратов: крупных камнях, гравии, глине с друзами дрейссены, корягах и макрофитах (Kinzler et al., 2009; Макаренко, Вежновец, 2018). В наших исследованиях амфиподы встречались относительно редко (R 5%), обитали исключительно в зарослях макрофитов (преимущественно рдеста и во влагалищах листьев тростника) и не отмечены на других типах субстратов. Бокоплав D. caspius встречен на свале глубин и на мелководье исключительно в зарослях макрофитов, что позволяет отнести его к группе фитофильных видов, это согласуется с литературными данными (Филинова и др., 2008).
Анализ ординационной диаграммы (рис. 2) показал, что в водохранилищах волжского и камского каскада по фракционному составу грунтового комплекса можно выделить два преимущественных типа биотопа, заселенных чужеродными видами: песчаный и илистый. Песчаный биотоп представлен средними и мелкими песками (1.0–0.1 мм), илистый – алевритовыми (0.09–0.01 мм) и пелитовыми (<0.01 мм) илами. Песчаные биотопы предпочитают всеядные собиратели + + хвататели, в основном, зарывающиеся в песок, и фитодетритофаги-собиратели, передвигающиеся по поверхности песка и собирающие с него бактериальные и водорослевые обрастания. Вместе с тем существует мнение, что на распределение амфипод влияет не размер частиц грунта, а состав органического вещества, его покрывающего (Монаков, 1998). Перекрытие ниш популяций чужеродных видов на песчаных грунтах можно интерпретировать как повышенную конкуренцию за пищевые ресурсы на биотопах данного типа, что требует дополнительных исследований. Детритофаги предпочитают второй тип биотопов (илистый), содержащий максимальное количество детрита.
Выводы. В водохранилищах Волжского и Камского каскадов по показателю степени биотопической приуроченности выделено три группы чужеродных видов макрозообентоса: освоившие несколько типов биотопов (13 видов); эвритопные (единственный вид Dreissena bugensis); стенотопные (14 видов, из них псаммофильных – 6, литофильных – 3, пелофильных – 2, аргиллофильных – 1, фитофильных – 2). Все массовые чужеродные виды отмечены на биотопах с высшей водной растительностью; большинство видов освоило и прибрежные, и глубоководные биотопы. Наибольшее количество чужеродных видов макрозообентоса приурочено к размерной фракции грунта 1.0−0.1 мм (средний и мелкий песок), наименьшее − к фракции >1.0 мм (крупный песок). Представители трофических групп всеядные собиратели+хвататели и фитодетритофаги–собиратели обитают преимущественно на средне- и мелкозернистых песках, детритофаги – на мелкодисперсных илах. Выявлена достоверно значимая зависимость численности полихеты Hypania invalida, моллюска Dreissena bugensis и амфиподы Dikerogammarus haemobaphes от процентного содержания в механическом составе грунта размерной фракции <0.01 мм.
Список литературы
Алексевнина М.С., Истомина А.М. 2008. Макробеспозвоночные каспийские вселенцы в камских водохранилищах и реках бассейна р. Камы // Биология внутр. вод. № 3. С. 61.
Атлас беспозвоночных. 1968. Москва: Пищ. пром-сть.
Баканов А.И. 2000. Использование зообентоса для мониторинга пресноводных водоемов // Биология внутр. вод. № 1. С. 68.
Березина Н.А. 2012. Распространение чужеродных видов Malacostraca и их место в трофических сетях континентальных водоемов Северо-Запада России // Динамика биологического разнообразия и биоресурсов континентальных водоемов. Санкт-Петербург: Наука. С. 200.
Биологические инвазии в водных и наземных экосистемах. 2004. Москва; Санкт-Петербург: Товарищество науч. изданий КМК.
Волга и ее жизнь. 1978. Ленинград: Наука.
Даирова Д.С., Тарасова О.Г. 2017. Биоразнообразие и пространственное распределение макрозообентоса в водотоках Волго-Ахтубинской поймы как объекта особо охраняемых природных территорий России // Самарская Лука: пробл. регион. и глоб. экологии. Т. 26. № 3. С. 137.
Жадин В.И. 1940. Фауна рек и водохранилищ // Тр. ЗИН АН СССР. Т. 5. Вып. 3–4. С. 519.
Законнов В.В., Законнова А.В., Цветков А.И., Шерышева Н.Г. 2018. Гидродинамические процессы и их роль в формировании донных осадков водохранилищ Волжско-Камского каскада // Труды Вып. 81(84). Борок: Ин-т биологии внутр. вод им. И.Д. Папанина РАН. С. 35.
Зинченко Т.Д. 2002. Биоиндикация поверхностных вод бассейна Средней и Нижней Волги (Самарская область). Эколого-фаунистический обзор. Самара: Ин-т экологии волжск. бассейна РАН.
Зинченко Т.Д., Головатюк Л.В., Загорская Е.П., Антонов П.И. 2007. Распределение инвазионных видов в составе донных сообществ Куйбышевского водохранилища: анализ многолетних исследований // Изв. Самарск. науч. центра РАН. Т. 10. № 2. С. 547.
Извекова Э.И. 1975. Питание и пищевые связи личинок массовых видов хирономид Учинского водохранилища: Автореф. дис. … канд. биол. наук. Москва.
Истомина А.М. 2017. Cовременное состояние макрозообентоса Камского и Воткинского водохранилищ // Вестн. Пермск. ун-та. Серия: Биология. № 3. С. 279.
Кожов, М.М. 1947. Животный мир Байкала. Иркутск: Иркут. обл. изд-во.
Константинов А.С. 1986. Общая гидробиология. Москва: Высш. шк.
Кузяхметов Г.Г., Мифтахова А.М., Киреева Н.А., Новоселова Е.И. 2004. Практикум по почвоведению // Учебное пособие. Уфа: РИО БашГУ. 120 с.
Курина Е.М., Селезнев Д.Г. 2019. Анализ закономерностей организации комплексов видов макрозообентоса понто-каспийского и понто-азовского происхождения в водохранилищах Средней и Нижней Волги // Экология. № 1. С. 62. https://doi.org/10.1134/S1067413619010053
Курина Е.М., Селезнев Д.Г., Шерышева Н.Г. 2021. Распространение чужеродных видов макрозообентоса и их ценотические комплексы в камских водохранилищах // Рос. журн. биол. инвазий. № 4. С. 1. https://doi.org/10.35885/1996-1499-2021-14-4-85-96
Литоральная зона Ладожского озера. 2011. Санкт-Петербург: Нестор-История.
Макаренко А.И., Вежновец В.В. 2018. Биотопическая приуроченность чужеродных и нативных видов разноногих ракообразных (Amphipoda, Crustacea) в условиях водоемов Беларуси // Журн. Белорус. гос. ун-та. Экология. № 4. С. 29.
Матафонов Д.В. 2003. Сравнительная экология бокоплавов: Gmelinoides fasciatus (Stebbing, 1899) и Gammarus lacustris (Sars, 1863) в Ивано-Арахлейских озерах: Автореф. дис. … канд. биол. наук. Улан-Удэ.
Монаков А.В. 1998. Питание пресноводных беспозвоночных. Москва.
Мордухай-Болтовской Ф.Д. 1960. Каспийская фауна в Азово-Черноморском бассейне. Москва; Ленинград: Изд-во АН СССР.
Мордухай-Болтовской Ф.Д., Ляхов С.М. 1972. Новый вид амфипод рода Stenogammarus (Gammaridae) в бассейне Волги // Зоол. журн. Т. 51. Вып. 1. С. 21.
Панов В.Е. 1994. Байкальская эндемичная амфипода Gmelinoides fasciatus Stebb. в Ладожском озере // Докл. Акад. наук. Т. 336. № 2. С. 279.
Перова С.Н. 2020. Расширение ареала каспийского вселенца пиявки Archaeobdella esmonti (Annelida: Clitellata: Hirudinida) в бассейне Верхней Волги // Биол. внутр. вод. № 2. С. 198. https://doi.org/10.31857/S0320965220010155
Песенко Ю.Н. 1982. Принципы и методы количественного анализа в фаунистических исследованиях. Москва: Наука.
Руководство по гидробиологическому мониторингу пресноводных экосистем. 1992. Санкт-Петербург: Гидрометеоиздат.
Сейдалиева Л.К., Волкова И.В., Егорова В.И., Сокольский А.Ф. 2016. Соленость и характер грунта как факторы, определяющие состояние бентоса Северного Каспия // Современные проблемы науки и образования. № 5. С. 300.
Филинова Е.И., Малинина Ю.А., Шляхтин Г.В. 2008. Биоинвазии в макрозообентосе Волгоградского водохранилища // Экология. № 3. С. 206. https://doi.org/10.1134/S1067413608030077
Щербина Г.Х. 2009. Изменение видового состава и структурно-функциональных характеристик макрозообентоса водных экосистем Северо-запада России под влиянием природных и антропогенных факторов: Автореф. дис. … докт. биол. наук. Санкт-Петербург. 49 с.
Яковлева А.В. 2010. Фауна и экология бентосных вселенцев верхней части Куйбышевского водохранилища: Автореф. дис. … канд. биол. наук. Казань.
Daneliya M.E., Petryashev V.V., Väinölä R. 2012. Continental mysid crustaceans of northern Eurasia // Матер. лекций и докл. Междунар. шк.-конф. “Актуальные проблемы изучения ракообразных континентальных вод”. Ин-т биологии внутр. вод им. И.Д. Папанина РАН, Борок. Кострома: ООО “Костромской печатный дом”. С. 21.
Kinzler W., Kley A., Mayer G. et al. 2009. Mutual predation between and cannibalism within several freshwater gammarids: Dikerogammarus villosus versus one native and three invasives // Aquat. Ecol. V. 43 (2). P. 457. https://doi.org/10.1007/s10452-008-9206-7
Lee C.E., Bell M.A. 1999. Causes and consequences of recent freshwater invasions by saltwater animals // Trends in Ecology & Evolution. V. 14 (7). P. 284.
May R.M, Mac Arthur R.H. 1972. Niche overlap as a function of environmental variability // Proc. Nat. Acad. Sci. USA. V. 69 (5). May 1972. P. 1109. https://doi.org/10.1073/pnas.69.5.1109
Pianka E.R. 1974. Niche overlap and diffuse competition // Proc. Nat. Acad. Sci. USA. May 1, V. 71 (5). P. 2141. https://doi.org/10.1073/pnas.71.5.2141
Rajagopal S., Van der Velde G., Pfaffen B.G.P., Bij de Vaate A. 1998. Growth and production of Corophium curvispinum G.O. Sars, 1895 (Amphipoda), an invader in the Lower Rhine // The biodiversity crisis and Crustacea. Rotterdam. P. 3.
Rao C.R. 1964. The use and interpretation of principal component analysis in applied research. Sankhyā. Ser. A. V. 26. № 4. P. 239.
Vanderploeg H.A., Nalepa T.F., Jude D.J. et al. 2002. Dispersal and emerging ecological impacts of Ponto-Caspian species in the Laurentian Great Lakes // Can. J. Fish Aquat. Sci. V. 59. № 7. P. 1209. https://doi.org/10.1139/f02-087
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод


