Биология внутренних вод, 2023, № 2, стр. 174-184
Влияние абиотических факторов на структурные и функциональные характеристики диатомовой водоросли Cerataulina pelagicа (Сleve) Hendey
Л. В. Стельмах *
Институт биологии южных морей им. А.О. Ковалевского Российской академии наук
Севастополь, Россия
* E-mail: lustelm@mail.ru
Поступила в редакцию 11.05.2022
После доработки 01.08.2022
Принята к публикации 22.09.2022
- EDN: BUKTGK
- DOI: 10.31857/S0320965223020237
Аннотация
С помощью метода электронной микроскопии подтверждена видовая принадлежность диатомовой водоросли Cerataulina pelagica, выделенной в чистую культуру из прибрежных вод Черного моря в сентябре 2021 г. Выявлен диапазон оптимальных значений температуры для развития вида. Исследовано влияние света и биогенных веществ на его основные структурные и функциональные характеристики. Акклимация C. pelagica к различной интенсивности света осуществлялась за счет изменения эффективности работы фотосистемы II, отношения С/Хл а и удельной скорости роста. Морфометрические параметры клеток (объем, площадь поверхности и удельная поверхность) почти не изменялись в исследованном световом диапазоне – 8.5–510 мкЭ/(м2 с). Перенос клеток C. pelagica, имеющих максимальный внутриклеточный пул биогенных веществ, в морскую воду, обедненную по биогенным веществам, вызвал быстрое повышение отношения С/Хл а, а также снижение эффективности работы фотосистемы II, относительной скорости электронного транспорта и удельной скорости роста. Показана высокая степень токсичности ионов меди в низких концентрациях по отношению к исследуемому виду.
ВВЕДЕНИЕ
Диатомовые водоросли – один из главных компонентов почти всех морских экосистем. По многим показателям (видовое разнообразие, численность, первичная продукция, участие в круговороте веществ) они занимают лидирующие позиции среди различных групп микроводорослей. Существуют разные оценки, но даже по самым осторожным из них, эта группа водорослей продуцирует почти пятую часть мировой первичной продукции, внося существенный вклад в глобальный круговорот элементов, прежде всего, углерода, кислорода и кремния (Mann, 1999; Smetacek, 1999). Диатомовые водоросли служат важным источником пищи для мезозоопланктона и простейших, в первую очередь, для гетеротрофных флагеллят (Sherr E.B., Sherr B.F., 2007).
В планктоне Черного моря диатомовые водоросли вместе с динофитовыми создают основную численность и биомассу суммарного нано- и микрофитопланктона (Moncheva et al., 2001; Stelmakh, Georgieva, 2014; Mikaelyan et al., 2018). Среди них следует отметить массовый неритический вид Cerataulina pelagica (Сleve) Hendey, объем клеток которого находится, как правило, в диапазоне 2–20 тыс. мкм3. Эта водоросль в прибрежных водах Черного моря, включая район г. Севастополь, в конце прошлого столетия и в начале нынешнего вызывала интенсивное осеннее “цветение воды” (Moncheva et al., 2001; Stelmakh, Georgieva, 2014). Вместе с тем, в течение последнего десятилетия численность вида в севастопольских бухтах существенно сократилась (Финенко и др., 2017; Stelmakh, Kovrigina, 2021). Причины такого явления пока не ясны. Однако исследования, проведенные нами в данном районе (Stelmakh, Kovrigina, 2021), позволяют предположить, что это может быть обусловлено как прямым, так и косвенным отрицательным антропогенным воздействием на морскую среду, а также особенностями структурных и функциональных характеристик C. pelagica. Поэтому этот вид водорослей не может, вероятно, доминировать в фитопланктоне в современных экологических условиях.
В качестве эколого-физиологической основы для понимания изменений, происходящих в последние годы в фитопланктоне прибрежных вод Черного моря, могут служить исследования по оценке влияния абиотических факторов среды, включая токсические вещества, на культуры отдельных видов микроводорослей в контролируемых условиях.
Цель работы – исследовать действие света, биогенных веществ и меди как токсиканта на изменчивость основных структурных и функциональных характеристик C. рelagica в условиях культуры и выявить оптимальную температуру для ее роста.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования была альгологически чистая культура диатомовых водорослей Cerataulina pelagicа (Cl.) Hend. (синоним Cerataulina bergonii Perag.), выделенная нами из планктона прибрежных вод Черного моря в конце сентября 2021 г. при температуре воды 17–18°С. Вид идентифицировали с помощью методов световой и электронной микроскопии. В первом случае использовали световой микроскоп Olympus CX 33, во втором – сканирующий электронный микроскоп Hitachi SU3500 (Япония).
C целью выбора оптимальной температуры для роста данного вида водорослей 250-миллилитровую колбу с культурой, содержащейся на среде f/2 (Guillard, Rither, 1962), экспонировали при трех температурных режимах: 15–16, 17–18 и 19–20°С и интенсивности света 100 мкЭ/(м2 · с). Длительность экспериментов была пять суток.
Для исследования светозависимого роста клеток C. pelagica экспоненциально растущую культуру содержали при 10 различных интенсивностях непрерывного света в диапазоне 8.5–510 мкЭ/(м2 · с). Водоросли акклимированы к каждой интенсивности в течение трех–четырех суток. Интенсивность света измеряли с помощью автоматического регистрирующего устройства LI-1500 (LI-COR), оснащенного квантовым датчиком LI-190R (США).
Влияние различного уровня биогенной обеспеченности на структурные и функциональные характеристики С. pelagica исследовали при оптимальных для роста световых условиях (100 мкЭ/(м2 · с)) и температуре воды 17–18°С. Клетки культуры, находившиеся в фазе экспоненциального роста, сгущали до объема 20 мл и переносили в колбы с пастеризованной морской водой без дополнительных добавок биогенных веществ, а также в колбы с биогенными веществами. В первом варианте опытов использовали среду f/2, во втором – f/2 без нитратов, в третьем – f/2 без кремния, в четвертом – f/2 без фосфатов. В пятом варианте морскую воду не обогащали биогенными веществами. Эксперименты продолжались в течение 7 сут.
Для оценки влияния ионов меди на рост C. pelagica в колбы объемом 250 мл вносили культуру, к которой добавляли водный раствор сульфата меди с концентрацией в пересчете на медь 1 и 5 мкг/л. Водоросли экспонировали при оптимальных для роста световых и температурных условиях в течение трех суток.
В ходе экспериментов из колб с культурой ежесуточно отбирали аликвоты для оценки линейных размеров клеток, концентрации Хл а и Феоф а, OD750, а также Fv/Fm и ETR.
Для определения концентрации пигментов использовали пробы объемом 10–15 мл в трех повторностях, профильтрованные через мембранные фильтры GF/C (Whatman). Пигменты экстрагировали в 90%-ном водном растворе ацетона в течение 12 ч при температуре 8°С. Концентрацию Хл а и Феоф а определяли флуориметрическим методом с применением лабораторного флуориметра Trilogy Turner Designs (США), калибровку которого осуществляли по чистому Хл а (Protocols for JGOFS, 1994). Относительная ошибка определений не превышала 10%.
Содержание углерода в клетках C. pelagica рассчитывали на основе измерений оптической плотности OD750 с помощью КФК-3 с последующим пересчетом ее значений в единицы органического углерода (мг/л). В основе расчетов лежит калибровочный график (рис. 1а), связывающий OD750 с концентрацией органического углерода, измеренного прямым методом (Kvíderová, Lukavský, 2003). Концентрацию органического углерода в клетках водорослей определяли методом мокрого сжигания проб в хромовой смеси (Бергер и др., 2016). Относительная ошибка определений была 5–10%.
Рис. 1.
Зависимость между концентрацией органического углерода в культуре Cerataulina pelagica и оптической плотностью суспензии ее клеток (а) и динамика прироста органического углерода в культуре при различных температурах (б). С – концентрация органического углерода, ОD750 – оптическая плотность на длине волны 750 нм. 1 – 15–16°С, 2 – 17–18°С, 3 – 19–20°С. Значения на графике (б) – среднее арифметическое ± стандартное отклонение.

Линейные размеры клеток измеряли с помощью светового микроскопа Olympus CX 33 в 30 повторностях при общем увеличении ×400. Объем клеток и полную площадь поверхности вычисляли по методике (Брянцева и др., 2005).
Суточную удельную скорость роста культуры оценивали по приросту органического углерода в пробах по уравнению, представленному в работе (Стельмах, 2022).
Измерения Fv/Fm, а также $F_{{\text{v}}}^{'}/F_{{\text{m}}}^{'}$ при семи различных интенсивностях света в диапазоне 10–500 мкЭ/(м2 · с) осуществляли на ПАМ флуориметре Aqua Pen-C AP 110 (Чешская Республика). Относительная погрешность определений показателей не превышала 5%. Значения ETR в относительных единицах рассчитывали на основе произведения $F_{{\text{v}}}^{'}/F_{{\text{m}}}^{'}$ и соответствующей интенсивности света (Cruz, Serôdio, 2008). Зависимость ETR от интенсивности света описана с помощью экспоненциальной функции:
(1)
${\text{ETR}} = {\text{ET}}{{{\text{R}}}_{{\text{s}}}}(1 - \exp ( - \alpha I/{\text{ET}}{{{\text{R}}}_{{\text{s}}}})),$Обработку данных проводили в программе Excel 2007 для Windows. Рассчитывали среднеарифметические значения исследуемых параметров и стандартное отклонение. Статистическая значимость различий между вариантами определялась по t-критерию Стьюдента. Построение графиков осуществляли с помощью программы Grafer 3.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
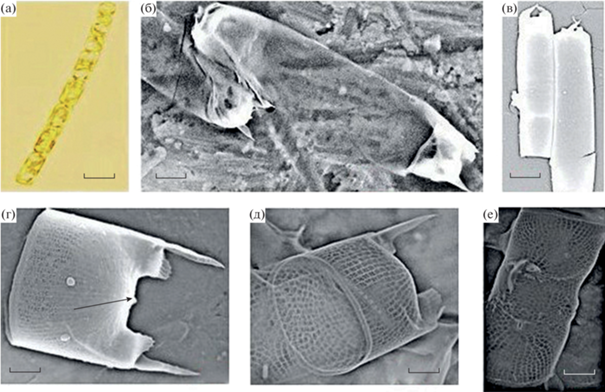
Идентификация C. pelagica. Выполненные исследования подтверждают предыдущие описания вида, основанные на использовании методов световой и электронной микроскопии (Tomas, 1997; Hernández-Becerril, 2020), включая различные морфологические детали: форма клеток и цепочек, высота клеток, форма створок и их размеры, связи между родственными створками, ареоляция поверхности створки, выступы из ее полюсов, представляющие собой реберные глазки, которые могут быть крылатыми и иметь шип на конце, одиночная римопортула в центре створки (рис. 2а–2е).
Рис. 2.
Микрофотографии Cerataulina pelagica: а – световая микроскопия, б–е – сканирующая электронная микроскопия (б, в – панцирь с двумя концевыми шипами; г – вид створки с двумя концевыми шипами, римопортула в центре створки показана стрелкой; д – расположение ареол на створке; е – расположение ареол на панцире). Размер масштабной линейки: а – 10 мкм, б – 3 мкм, в – 6 мкм, г, д – 0.5 мкм, е – 1 мкм.
Динамика роста C. pelagica при различных температурах. При оптимальных световых условиях и достаточном количестве биогенных веществ прирост концентрации органического углерода в накопительной культуре C. pelagica при трех температурных режимах в течение первых двух суток был почти одинаков в диапазоне 1.0–2.8 мг/л (рис. 1б). На третьи сутки концентрация органического углерода при температурах 15–16 и 17–18°С возросла до 5.35 и 5.81 мг/л, а к концу пятых суток достигла 16.51 и 17.09 мг/л, соответственно. Статистически значимые различия между результатами прироста биомассы при этих двух температурных режимах не были выявлены (р > 0.05). При температуре 19–20°С в течение третьих–пятых суток прирост органического углерода отсутствовал.
Зависимость структурных и функциональных параметров C. pelagicа от интенсивности света. При оптимальных температурных условиях (17–18°С) и высоком содержании биогенных веществ в среде зависимость удельной скорости роста (µ) от света следует разделить на три участка или диапазона. В пределах первого (8.6–119.0 мкЭ/(м2 · с)) свет лимитировал рост водорослей (рис. 3а). На втором участке световые условия (119–340 мкЭ/(м2 · с)) были оптимальными для роста C. pelagicа. При более высоких интенсивностях света в результате угнетающего его действия скорость роста снижалась. Полученная зависимость скорости роста (µ) от интенсивности света (I) на ее восходящем участке и плато представлена в виде экспоненциальной функции, хорошо описываемой уравнением Пуассона (MacIntyre et al., 2002):
где µмакс – максимальная удельная скорость роста (сут–1), Ik – интенсивность света, при которой скорость роста достигает 65% максимальной. Из уравнения получено, что максимальная скорость роста была 1.1 сут–1, а Ik – 30 мкЭ/(м2 · с).Рис. 3.
Влияние света на структурные и функциональные параметры Cerataulina pelagica: а – удельная скорость роста (1) и величина Fv/Fm (2); б – С/Хл а (1) и объем клеток, V (2); в – площадь поверхности, S (1) и удельная поверхность, S/V (2). Значения здесь и на рис. 4, рис. 5 – среднее арифметическое ± стандартное отклонение.
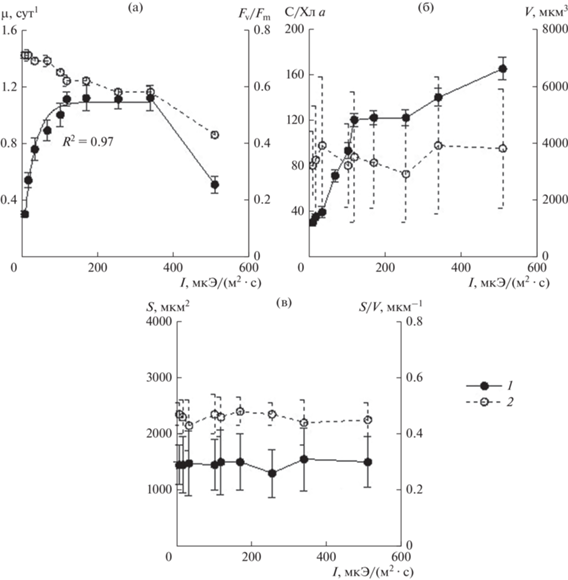
Отношение Fv/Fm при интенсивностях света 8.6–34.0 мкЭ/(м2 · с) было максимальным – 0.69–0.71. В диапазоне световых интенсивностей 34–510 мкЭ/(м2 · с) этот показатель постепенно снижался до 0.43 (рис. 3а). Причем на световом участке, где удельная скорость роста была максимальна, значения Fv/Fm достигали 0.58–0.61.
При всех интенсивностях света объем клеток культуры достоверно не различался (р > 0.05) и был в среднем 3200–3900 мкм3 (рис. 3б). Площадь поверхности клеток находилась в интервале значений 1450–1500 мкм2, удельная поверхность – 0.43–0.48 мкм–1 (рис. 3в). На участке значений интенсивности света 8.6–119 мкЭ/(м2 · с) отношение между органическим углеродом и Хл а (С/Хл а) увеличивалось от 30 до 120, а при дальнейшем усилении света до 255 мкЭ/(м2 · с) не изменялось (рис. 3б). Более высокие значения световой интенсивности приводили к резкому росту С/Хл а. При этом продукт распада Хл а – Феоф а в этих условиях был незначительным (≤2% суммы этих пигментов).
Рост C. pelagicа при различных по биогенным веществам условиях. В культуре C. pelagicа, находившейся в экспоненциальной фазе роста, а затем перенесенной в свежую питательную среду f/2, наблюдали прирост органического углерода на протяжении всего 7-суточного эксперимента (рис. 4а). За этот период его количество возросло от 2 до 54 мг/л. Скорость прироста органического углерода была максимальна на вторые сутки (0.78 сут–1), к концу эксперимента она снизилась на порядок. Всего за 7 сут C. pelagicа поделилась 4.8 раза.
Рис. 4.
Динамика структурных и функциональных параметров Cerataulina pelagica при различных биогенных условиях: а – органический углерод, б – удельная поверхность клеток, S/V, в – С/Хл а, г – Fv/Fm, д – ETR на четвертые сутки. 1 – среда f/2; 2 – f/2 без фосфатов; 3 – f/2 без кремния; 4 – f/2 без нитратов; 5 – морская вода, обедненная по биогенным веществам.

В культуре, помещенной в среду f/2 без фосфора, прирост ее биомассы в течение первых трех суток совпадал с контрольными значениями, затем незначительно замедлялся. Поэтому биомасса водорослей на седьмые сутки была лишь на 16% меньше, чем на полной среде f/2.
В опыте без кремния в среде C. pelagicа в течение первых двух суток прирастала с такой же скоростью, как и в контроле. Затем рост замедлялся, в результате биомасса культуры на седьмые сутки была на 25% меньше относительно контроля.
В культуре, росшей без нитратов в среде, биомасса водорослей на третьи сутки совпадала с контрольными значениями. После ее прирост был незначительным. В конце эксперимента этот показатель был почти в 2 раза ниже, чем в контроле.
На морской воде C. pelagicа росла, главным образом, в течение первых двух суток. В период с третьих по седьмые сутки прирост биомассы водорослей существенно замедлялся. К концу эксперимента биомасса водорослей была в 3.5 раза ниже относительно контроля.
Таким образом, за семь суток культура, росшая без кремния в среде f/2, поделилась 4.4 раза, без нитратов – 3.8 раза, а на морской воде, обедненной по всем основным биогенным веществам, осуществила 3 деления. Средние значения биомассы за 7 сут в культурах, росших на средах, обедненных по азоту, кремнию или фосфору, а также на морской воде без биогенных веществ, были достоверно ниже, чем в контроле (p ≤ 0.05).
В течение семи суток во всех вариантах опыта достоверных изменений удельной поверхности клеток C. pelagicа не выявлено (р > 0.05). Ее средние значения были в диапазоне 0.60–0.75 мкм–1 (рис. 4б). Величина отношения С/Хл а за 7 сут эксперимента в контроле увеличилось лишь от 120 до 160, в опыте без кремния и фосфора – до 140–150 (рис. 4в), тогда как в культуре, росшей без нитратов, этот показатель возрос до 330, а без всех основных биогенных веществ – до 440. Следовательно, клетки исследуемого вида водорослей в условиях максимального дефицита биогенных веществ в среде характеризовались самым низким удельным содержанием Хл а, которое к концу эксперимента было в 2.8 раза ниже, чем в контроле.
Значения максимальной эффективности работы фотосистемы II в течение первых двух–трех суток эксперимента были в диапазоне 0.61–0.67 для всех вариантов эксперимента (рис. 4г). Затем происходило постепенное падение данной величины. Однако в культуре, росшей на полной среде f/2 или без кремния, эти процессы были значительно слабее, чем в других вариантах опыта. Например, на седьмые сутки отношение Fv/Fm снизилось в контроле и в варианте без кремния в среде до 0.40. Тогда как в культуре, росшей в среде без фосфатов, этот показатель упал до 0.31, без нитратов – до 0.22, а на морской воде без биогенных веществ – до 0.14.
Графики зависимости ETR от интенсивности света (I) для водорослей, росших при различных биогенных условиях, на четвертые сутки экспозиции даны на рис. 4д. Они представлены в виде экспоненциальной функции с высоким коэффициентом детерминации (R2 = 0.95–0.99). Видно, что самые высокие значения ETR получены для культуры, росшей на среде f/2. Отсутствие кремния в среде вызывало снижение ETR при высоких интенсивностях света на 30–40%, а недостаток фосфора приводил к снижению ETR почти в 2 раза. Самые низкие значения этого параметра выявлены для культуры, росшей в среде без нитратов или на обедненной морской воде. В этом случае различия между опытными пробами и контролем были в 2.6–3.2 раза. На основе полученных экспоненциальных зависимостей рассчитаны максимальная скорость ETRs и ее световое насыщение (Ik). Наибольшие значения этих параметров получены для культуры, росшей на среде f/2, наименьшие – на морской воде, обедненной по биогенным веществам (табл. 1).
Таблица 1.
Основные параметры зависимости относительной скорости электронного транспорта от интенсивности света на четвертые сутки экспозиции Cerataulina pelagica при различных по биогенным веществам условиях
|
Среда культивирования |
ETRs |
α, мкЭ/(м2 · с) |
Ik, мкЭ/(м2 · с) |
|---|---|---|---|
|
f/2 |
85.4 ± 5.1 |
0.468 ± 0.021 |
182.5 ± 8.5 |
|
f/2–Si |
58.3 ± 3.2 |
0.479 ± 0.017 |
121.7 ± 5.3 |
|
f/2–PO4 |
41.7 ± 2.1 |
0.416 ± 0.015 |
100.2 ± 4.2 |
|
f/2 –NO3 |
28.8 ± 1.5 |
0.419 ± 0.018 |
68.7 ± 2.1 |
|
Без биогенных веществ |
24.8 ± 1.3 |
0.422 ± 0.014 |
58.8 ± 3.3 |
Примечание. f/2 – полная среда, f/2–Si – среда без кремния, f/2–PO4 – среда без фосфатов, f/2–NO3 – среда без нитратов; ETRs – максимальная скорость электронного транспорта в относительных единицах, ɑ – частное от деления ETR на соответствующую интенсивность света на начальном линейном участке зависимости, Ik – световое насыщение скорости электронного транспорта.
Следовательно, в результате дефицита биогенных веществ во внешней среде, а затем и в клетках функциональная активность C. pelagicа снижалась, что выражалось в замедлении роста водорослей, понижении величины Fv/Fm и параметров, характеризующих скорость электронного транспорта, а также удельного содержания Хл а. Однако величина удельной поверхности не изменялась.
Исследования влияния ионов меди на рост C. pelagicа показали, что при начальной концентрации меди в среде 1 мкг/л на вторые и третьи сутки эксперимента отмечено снижение прироста органического углерода в культуре и величины Fv/Fm на 30–33% относительно контроля (рис. 5). Повышение концентрации меди в среде в 5 раз привело к прекращению роста водорослей и снижению Fv/Fm до 0.1 уже в первые сутки. На вторые и третьи сутки наблюдали незначительное снижение биомассы водорослей по сравнению с ее исходным значением, а также понижение Fv/Fm до 0.06, что свидетельствует о начале отмирания клеток культуры.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что к основным факторам, регулирующим рост микроводорослей, относятся свет, температура и биогенные вещества. Если значения какого-либо из этих факторов отклоняются от оптимальных, рост водорослей замедляется, а в случаях их приближения к границам толерантности, он прекращается.
Проведенные нами исследования показали, что при оптимальном температурном режиме и достаточном количестве питательных веществ максимальные значения скорости роста C. pelagicа (1.0–1.1 сут–1) были в довольно широком световом диапазоне (100–350 мкЭ/(м2 · с)), что соответствует суточным значениям суммарной ФАР, равным 9–30 Э/(м2 · сут). В период с середины сентября до середины октября, когда C. pelagicа достигает наибольшего развития в прибрежных водах Черного моря, интенсивность ФАР у морской поверхности обычно достигает 20–30 Э/(м2 · сут) (Stelmakh, Georgieva, 2014; Финенко и др., 2017), а значит оптимальна для роста этого вида.
Однако C. pelagicа крайне чувствительна к повышению температуры. Оказалось, что ее оптимальные значения для роста исследуемого вида находились в диапазоне 15–18°С, тогда как увеличение температуры до 19–20°С вызывало угнетение роста культуры уже на третьи сутки экспозиции. Показано (Akimov, Solomonova, 2019), что у диатомовых водорослей при температурах, превышающих оптимальные значения на 2–3°С, происходит постепенная деградация клеток и последующая их гибель. Вместе с тем, длительное стрессовое воздействие низких положительных температур (4–6°С) на водоросли имеет в большинстве случаев обратимый характер, а восстановление скорости роста наблюдается сразу после восстановления температуры до оптимальной. В этой связи следует отметить, что в последние годы температура поверхностного слоя прибрежных вод Черного моря в районе г. Севастополь повысилась не только за летний период, но и за осенний по сравнению с началом этого столетия. В сентябре–октябре она на два–три градуса выше, чем ранее, и достигает 19–24°С (Финенко и др., 2017; Stelmakh, Kovrigina, 2021), что превышает температурный оптимум для роста C. pelagicа. Вероятно, это – одна из основных причин снижения численности и биомассы данного вида в фитопланктоне. В то же время доля толерантного к высоким температурам крупноклеточного вида диатомовых водорослей Pseudosolenia calcar-avis (Schultze) B.G. Sundström существенно возросла. Этот вид начинает интенсивно развиваться в фитопланктоне прибрежных вод Черного моря в районе г. Севастополь в июле–августе при температуре воды 25°С (Stelmakh, Kovrigina, 2021). Смена видов в фитопланктоне в результате потепления выявлена и в других районах Мирового океана. Результаты многолетних исследований в водах Тихого океана, проведенных у берегов Австралии в районе г. Сидней, показали, что здесь с 1931 по 2019 г. температура поверхностного слоя вод увеличилась на ~1.8°С, в результате чего доля холодолюбивых видов диатомовых водорослей сократилась, а теплолюбивых возросла (Ajani et al., 2020).
Температура может оказывать не только прямое влияние на рост водорослей, но и опосредованное. По нашему мнению, в результате повышения температуры воды и усиления ее температурного расслоения в последние годы в осенний период споры Cеrataulina pelagicа, которые обычно покоятся за пределами освещенной зоны, не могут в большом количестве подняться в эту зону и дать вспышку “цветения”.
Одной из причин слабого развития C. pelagicа в прибрежных водах Черного моря в районе г. Севастополь, может быть постоянно растущее антропогенное загрязнение вод, в результате которого угнетается не только рост фитопланктона, но и сокращается его доля, потребленная микрозоопланктоном (Stelmakh, Kovrigina, 2021). Среди многочисленных загрязняющих веществ следует отметить ионную форму меди. Концентрация последней в прибрежных водах Черного моря в 2000–2019 гг. была в диапазоне 1–125 мкг/л (Кораблина и др., 2021). При концентрации этого токсиканта 5 мкг/л в среде рост C. pelagicа полностью подавлялся. В то же время, мелкоклеточный вид диатомовых водорослей Phaeodactylum tricornutum Bohlin с такой же начальной биомассой, как и у C. pelagicа, был намного устойчивее к воздействию меди. В течение всего трехсуточного эксперимента при концентрации меди 10 мкг/л прирост клеток данного вида не отличался от такового в контроле и лишь при концентрации 90 мкг/л полностью прекращался (Morreno-Garrido et al., 2000). Высокая чувствительность C. pelagicа к действию ионов меди может быть обусловлена наличием относительно крупной вакуоли в ее клетках, которая способствует активному движению цитоплазмы по периферии клеточной мембраны. Это увеличивает скорость транспорта в клетку не только биогенных веществ (Raven, 1987), но и токсикантов, способных накапливаться в большом количестве внутри вакуоли.
Следует отметить, что “цветение воды”, вызванное C. pelagicа, происходило в прибрежных водах Черного моря не только при высоком уровне биогенных веществ (Стельмах и др., 2004), но и при их низком содержании в воде. Так, в сентябре–октябре 2005 г. зарегистрирована завершающая стадия “цветения воды”, вызванного данным видом в водах у берегов Турции. При этом концентрация нитратов в среде была низкой – в среднем 0.10 мкМ (Stelmakh, Georgieva, 2014). Поддержание функциональной активности фитопланктона в этих условиях обеспечивал, вероятно, внутриклеточный пул биогенных веществ. Для разных видов водорослей он неодинаков. Чем крупнее внутриклеточная вакуоль, тем больше запас биогенных веществ в клетке, а значит больше разница между максимальной и минимальной внутриклеточной квотой питательных веществ (Edwards et al., 2011; Marañón et al., 2013). По расчетам некоторых авторов (Marañón et al., 2013; Sommer et al., 2017), богатая азотом материнская клетка объемом 10 мкм3 может поддерживать только одно клеточное деление без нового поглощения этого элемента. Для клетки >23 тыс. мкм3 внутриклеточный пул азота может обеспечить два последовательных клеточных деления. На основе лабораторных исследований установлено, что клетки диатомовой водоросли Phaeodactylum tricornutum Bohlin со средним объемом 80–100 мкм3 за счет внутриклеточного пула азота поделились 1 раз (Шоман, 2015). У этого вида внутриклеточная вакуоль небольшая и не превышает 30% клеточного объема (Schreiber et al., 2017). Культура крупноклеточного вида Pseudosolenia calcar-avis с объемом клеток 100 тыс. мкм3 и большой внутриклеточной вакуолью, занимающей ~80% объема клетки, за счет азота, содержащегося в ней, делилась пять раз (Стельмах, 2022). В настоящей работе культура C. pelagicа, объем клетки которой был ~4000 мкм3, за счет внутриклеточного пула азота поделилась 3.8 раза. Тогда как в условиях почти полного отсутствия всех биогенных веществ в среде этот вид водорослей осуществил три клеточных деления; и до конца семисуточного эксперимента культура сохраняла свою функциональную активность на низком уровне, при котором возможно ее полное восстановление в случае появления внешнего источника биогенных веществ. В Черном море в осенний период таким источником служат питательные вещества, проникающие в зону фотосинтеза в результате ослабления температурной стратификации вод и увеличения их динамической активности в результате усиления ветров.
Таким образом, слабое развитие C. pelagicа в прибрежных водах Черного моря в районе г. Севастополь в последние годы обусловлено, вероятно, повышением температуры поверхностного слоя вод, а также высокой чувствительностью вида к действию загрязняющих веществ, которые поступают в воду с берега в большом количестве и могут быть токсичны для него.
Выводы. Диапазон оптимальных значений температуры для роста диатомовой водоросли C. рelagica находился в пределах 15–18°С. Интенсивность света в интервале величин 119–340 мкЭ/(м2 · с) была оптимальна для исследуемого вида: удельная скорость роста достигала 1.0–1.1 сут–1, отношение Fv/Fm – 0.58–0.61. Более высокие значения этого параметра вызывали угнетение скорости роста водорослей и эффективности работы фотосистемы II. При акклимации C. рelagica к различным световым условиям (от 8.6 до 500 мкЭ/(м2 · с)) достоверных изменений средних значений объема ее клеток, площади поверхности и удельной поверхности не выявлено, что свидетельствует о низкой структурной пластичности данного вида. Перенос клеток культуры C. pelagicа, имеющей максимальный внутриклеточный пул биогенных веществ, в морскую воду, обедненную по биогенным веществам, вызвал достоверное снижение величин Fv/Fm, ETR, удельной скорости роста водоросли и повышение отношения С/Хл а на третьи–четвертые сутки эксперимента. За счет внутриклеточного пула питательных веществ исследуемый вид осуществил лишь три клеточных деления. Показана высокая чувствительность культуры C. рelagica к действию меди в ионной форме, которая в концентрации 1 мкг/л в среде вызывала частичное угнетение ее роста, а при концентрации в 5 раз выше полностью подавляла.
Список литературы
Бергер В.Я., Митяев М.В., Сухотин А.А. 2016. Опыт использования метода мокрого сжигания для определения концентрации взвешенных органических веществ в морской воде // Океанология. Т. 56. № 2. С. 328. https://doi.org/10.7868/S0030157416020015
Брянцева Ю.В., Лях А.М., Сергеева А.В. 2005. Расчет объемов и площадей поверхности одноклеточных водорослей Черного моря. Севастополь. (Препринт, Ин-т биол. южных морей).
Кораблина И.В., Барабашин Т.О., Геворкян Ж.В. и др. 2021. Динамика распределения тяжелых металлов в водной толще северо-восточной части Черного моря после 2000 г. // Тр. ВНИРО. Т. 183. С. 96. https://doi.org/10.36038/2307-3497-2021-183-96-112
Стельмах Л.В., Губанов В.И., Бабич И.И. 2004. Сезонные изменения скорости роста и лимитирование фитопланктона питательными веществами в прибрежных водах Черного моря в районе Севастополя // Мор. экол. журн. Т. 3. № 4. С. 55.
Стельмах Л.В. 2022. Особенности структурных и функциональных характеристик диатомовой водоросли Pseudosolenia calcar-avis // Биология внутр. вод. № 3. С. 300. https://doi.org/10.31857/S0320965222030184
Финенко З.З., Стельмах Л.В., Мансурова И.М. и др. 2017. Сезонная динамика структурных и функциональных показателей фитопланктонного сообщества в Cевастопольской бухте // Системы контроля окружающей среды. Вып. 29. С. 73. https://doi.org/10.33075/2220-5861-2017-3-73-82
Шоман Н.Ю. 2015. Динамика внутриклеточного содержания углерода, азота и хлорофилла a в условиях накопительного роста диатомовой водоросли Phaeodactylum tricornutum (Bohlin, 1897) при разной интенсивности света // Биология моря. Т. 41. № 5. С. 324. https://elibrary.ru/item.asp?id=24862972
Ajani P.A., Davies C.H., Eriksen R.S. et al. 2020. Global Warming Impacts Micro-Phytoplankton at a Long-Term Pacific Ocean Coastal Station // Front. Mar. Sci. V. 7: 576011. https://doi.org/10.3389/fmars.2020.576011
Akimov A.I., Solomonova E.S. 2019. Characteristics of growth and fluorescence of certain types of algae during acclimation to different temperatures under culture conditions // Oceanology. V. 59. Iss. 3. P. 316. https://doi.org/10.1134/S0001437019030019
Cruz S., Serôdio J. 2008. Relationship of rapid light curves of variable fluorescence to photoacclimation and non-photochemical quenching in a benthic diatom // Aquat. Bot. V. 88. P. 256.
Edwards K.F., Klausmeier C.A., Litchman E. 2011. Evidence for a three-way trade-off between nitrogen and phosphorus competitive abilities and cell size in phytoplankton // Ecology. V. 92. P. 2085. https://doi.org/10.1890/11-0395.1
Guillard R.R.L., Ryther J.H. 1962. Studies of marine planktonic diatoms. I. Cyclotella nana Hustedt and Detonula confervacea Cleve // Can. J. Microbiol. V. 8. P. 229.
Hernández-Becerril D.U. 2020. Morphology of two species of the marine planktonic diatom genus Cerataulina H. Peragallo ex Schütt (Bacillariophyta) from the Tropical Mexican Pacific, including a new record for the area // Bol. Inst. Oceanogr. V. 59(01). P. 9.
Kvíderová J., Lukavský J. 2003. The cultivation of Phaeodactylum tricornutum in crossed gradients of temperature and light // Algol. Stud. V. 110(1). P. 67. https://doi.org/10.1127/1864-1318/2003/0110-0067
MacIntyre H.L., Kana T.M., Anning T. et al. 2002. Photoacclimation of photosynthesis irradiance response curves and photosynthetic pigments in microalgae and cyanobacteria // J. Phycol. V. 38. P. 17.
Mann D.G. 1999. The species concept in diatoms // Phycologia. V. 38. Iss. 6. P. 437. https://doi.org/10.2216/i0031-8884-38-6-437.1
Marañón E., Cermeño P., Lopez-Sandoval D.C. et al. 2013. Unimodal size scaling of phytoplankton growth and the size dependence of nutrient uptake and use // Ecol. Lett. V. 16. P. 371. https://doi.org/10.1111/ele.12052
Mikaelyan A.S., Kubryakov A.A., Silkin V.A. et al. 2018. Regional climate and patterns of phytoplankton annual succession in the open waters of the Black Sea // Deep Sea Res. Pt. I. V. 142. P. 44. https://doi.org/10.1016/j.dsr.2018.08.00
Moncheva S., Gotsis-Skretas O., Pagou K. et al. 2001. Phytoplankton Blooms in Black Sea and Mediterranean Coastal Ecosystems Subjected to Anthropogenic Eutrophication: Similarities and Differences // Estuarine, Coastal and Shelf Science. V. 53. P. 281. https://doi.org/10.1006/ecss.2001.0767
Moreno-Garrido I., Lubián L.M., Soares A.M.V.M. 2000. Influence of Cellular Density on Determination of EC50 in Microalgal Growth Inhibition Tests // Ecotoxicol. Environ. Saf. V. 47. P. 112116. https://doi.org/10.1006/eesa.2000.1953
Protocols for the Joint Global Ocean Flux Study (JGOFS) Core Measurements. JGOFS Report Nr. 19, vi+170 pp. Reprint of the IOC Manuals and Guides No. 29. UNESCO. 1994. https://hdl.handle.net/11329/220
Raven J.A. 1987. The role of vacuoles // New Phytologist. V. 106. Iss. 3. P. 357.
Schreiber V., Dersch J., Puzik K. et al. 2017. The Central Vacuole of the Diatom Phaeodactylum tricornutum: Identification of New Vacuolar Membrane Proteins and of a Functional Di-leucine-based Targeting Motif // Protist. V. 168. Iss. 3. P. 271. https://doi.org/10.1016/j.protis.2017.03.001
Sherr E.B., Sherr B.F. 2007. Heterotrophic dinoflagellates: a significant component of microzooplankton biomass and major grazers of diatoms in the sea // Mar. Ecol. Prog. Ser. V. 352. P. 187. https://doi.org/10.3354/meps07161
Smetacek V. 1999. Diatoms and the ocean carbon cycle // Protist. V. 150. Iss. 1. P. 25. https://doi.org/10.1016/S1434-4610(99)70006-4
Sommer U., Charalampous E., Genitsaris S. et al. 2017. Costs, benefits and taxonomic distribution of phytoplankton body size // J. Plankton Res. V. 39. P. 494. https://doi.org/10.1093/plankt/fbw071
Stelmakh L.V., Georgieva E.Yu. 2014. Microzooplankton: The Trophic Role and Involvement in the Phytoplankton Loss and Bloom-Formation in the Black Sea // Turkish J. Fish. Aquat. Sci. V. 14. P. 955. https://doi.org/10.4194/1303-2712-v14_4_15
Stelmakh L., Kovrigina N. 2021. Phytoplankton Growth Rate and Microzooplankton Grazing under Conditions of Climatic Changes and Anthropogenic Pollution in the Coastal Waters of the Black Sea (Sevastopol Region) // Water. V. 13. Iss. 22. Article № 3230. 13 p. https://doi.org/10.3390/w13223230
Tomas C.R. 1997. Identifying Marine Diatoms and Dinoflagellates. New York: Acad. Press.
Дополнительные материалы отсутствуют.
Инструменты
Биология внутренних вод



