Биология внутренних вод, 2023, № 5, стр. 660-670
Сравнение структуры обонятельных сенсилл у литоральных и глубоководных амфипод (Amphipoda, Crustacea) Байкальского региона
Ю. А. Широкова a, *, А. Е. Саранчина a, Ж. М. Шатилина a, b, Н. Д. Кащук a, М. А. Тимофеев a, b
a Научно-исследовательский институт биологии Иркутского государственного университета
Иркутск, Россия
b Байкальский исследовательский центр
Иркутск, Россия
* E-mail: yuliashirokova2501@gmail.com
Поступила в редакцию 03.10.2022
После доработки 24.04.2023
Принята к публикации 26.04.2023
- EDN: FAAEHM
- DOI: 10.31857/S0320965223050145
Аннотация
Проведено сравнение структуры обонятельных сенсилл у амфипод Байкальского региона – девяти наиболее распространенных в оз. Байкал видов (Ommatogammarus carneolus melanophthalmus Bazikalova, 1945, O. flavus (Dybowsky, 1874), O. albinus (Dybowsky, 1874), Eulimnogammarus verrucosus (Gerstfeldt, 1858), E. vittatus (Dybowsky, 1874), E. cyaneus (Dybowsky, 1874), Acanthogammarus godlewskii (Dybowsky, 1874), Pallasea cancelloides (Gerstfeldt, 1858) и Gmelinoides fasciatus (Stebbing, 1899)) и голарктического Gammarus lacustris Sars, 1863. Результаты исследования впервые демонстрируют сравнение длины и количества эстетасков у байкальских амфипод и изображения эстетасков байкальских амфипод, полученных с помощью СЭМ, а также подтверждают и дополняют полученные ранее данные о количестве эстетасков на сегмент у трех глубоководных видов байкальских амфипод рода Ommatogammarus. Из этих амфипод, различающихся по диапазону глубины обитания, у наиболее глубоководного вида O. albinus выявлено наибольшее количество эстетасков. Размер и количество эстетасков у самок и самцов у литорального Eulimnogammarus verrucosus и глубоководных видов не различались. У литоральных амфипод показано более высокое оснащение механорецепторами на антеннах I, чем у глубоководных.
ВВЕДЕНИЕ
Водные организмы получают информацию о наличии пищи и партнеров для спаривания, анализируя химический состав среды (Watling, Thiel, 2013; Derby, Thiel, 2014; Kamio, Derby, 2017). Ракообразные покрыты хитиновым экзоскелетом, не пропускающим воду и растворенные в ней вещества. Они улавливают химические сигналы с помощью хеморецепторных сенсилл – кутикулярных выростов, играющих роль сенсоров (Breithaupt, Thiel, 2011). Хеморецепторные сенсиллы подразделяют на обонятельные и распределенные (Kaufmann, 1994; Kamio, Derby, 2017) (Доп. мат. рис. S1). Обонятельные сенсиллы являются унимодальными, содержат только один тип сенсорных клеток и чувствительны только к химическим стимулам. Распределенные сенсиллы бимодальные, помимо хемосенсорных клеток содержат механосенсорные, которые воспринимают механические раздражители (Schmidt, Gnatzy, 1984; Laverack, 1988).
Эстетаски, одни из наиболее распространенных у ракообразных обонятельных сенсилл, располагаются на сегментах медиальной стороны основного жгута первой пары антенн, которую также называют антеннами I (Watling, Thiel, 2013). На некоторых сегментах антенн I эстетаски могут отсутствовать, а их общая сумма и количество на единичном сегменте могут различаться у разных видов (Механикова, 2002; Breithaupt, Thiel, 2011; Сидоров, 2012; Urbschat, Scholtz, 2019). Длина эстетасков зависит от размера организма. Самые длинные эстетаски (600–1400 мкм) обнаружены у крупных декапод, таких как крабы и лобстеры (Breithaupt, Thiel, 2011). Представители надотряда перакариды (Crustacea, Peracarida), к которым относятся амфиподы, изоподы, мизиды и др., меньше по размеру, чем декаподы, длина их эстетасков достигает 120–400 мкм (Hallberg et al., 1992).
Кроме эстетасков, антенны ракообразных несут другие типы унимодальных сенсилл. Скопления эстетасков у некоторых ракообразных образуют сенсорный орган каллинофор, который встречается cреди эвкарид и перакарид (развиты у Amphipoda) (Механикова, 2021). Ряд амфипод на обеих парах антенн либо только на второй паре несут кальцеолы – сложноорганизованные поверхностные рецепторы. Предположительно, они обладают свойствами хемо- или механорецепторов (возможно наличие обоих модальностей) и задействованы в поиске партнера для спаривания (Механикова, 2021). У некоторых видов мизид и амфипод у самцов на базальной части антенн I либо рядом с эстетасками были обнаружены самец-специфичные сенсиллы (Johansson, Hallberg, 1992).
Бимодальные сенсиллы, напротив, располагаются неравномерно по всему телу ракообразных, откуда произошло их название “распределенные”. При этом они образуют плотные скопления на антеннах, на ротовой области, первой паре переопод и других конечностях (Schmidt, Gnatzy, 1984; Watling, Thiel, 2013). Существуют тактильные и гидродинамические механорецепторы, активирующиеся одновременно с химическими сенсорами (Derby, Thiel, 2014; Pravin et al., 2015).
Амфиподы (Amphipoda, Crustacea) – многочисленный отряд (~10 тыс. видов) (Arfianti, 2020), удивляющий своими адаптивными способностями. Они приспособились к обитанию в морской и пресной воде, где населяют многочисленные типы субстратов; существуют и наземные виды. Можно предположить, что и сенсиллы (их количество и структура) у амфипод из разных сред обитания будут различаться. В работе (Urbschat, Scholtz, 2019) исследована внешняя морфология эстетасков у трех видов амфипод, обитающих при разных условиях среды, с использованием сканирующей электронной микроскопии (СЭМ). У морских амфипод Gammarus salinus Spooner, 1947, пресноводного подземного вида Niphargus puteanus (Koch, 1836) и у наземного Cryptorchestia garbinii Ruffo, Tarocco & Latella, 2014 сравнивали размеры, число и форму обонятельных сенсилл. Среди этих видов наиболее длинные и широкие эстетаски с наибольшей поверхностью тонкой проницаемой кутикулы были у морского вида Gammarus salinus. Авторы связывают эту особенность с эвтрофностью населяемого данным видом водоема и с необходимостью детектировать одоранты среди большого разнообразия химических веществ (Urbschat, Scholtz, 2019).
Глубоководные организмы адаптированы к высокому гидростатическому давлению, низкой температуре воды, отсутствию освещения и слабой обеспеченности пищей (Jamieson et al., 2010). В этих условиях у глубоководных видов могла развиться высокочувствительная система хеморецепторов, способных почувствовать добычу на большом расстоянии. Например, некоторые амфиподы могут уловить молекулы, выделяемые разлагающимися животными, на дистанции до 2 км (Sainte-Marie, Hargrave, 1987). Большое число эстетасков (8–10) на одном сегменте обнаружено у средиземноморской амфиподы Bathymedon longirostris Jaume и Cartes & Sorbe, 1998, распространенной на глубине 1000 м (Jaume et al., 1998).
Единственный пресноводный водоем, в котором амфиподы обитают на большой глубине, – оз. Байкал. Амфиподы оз. Байкал представлены >350 видами и подвидами, населяющими все глубины озера. Обонятельные сенсиллы байкальских амфипод изучала И.В. Механикова (2002, 2021). Ею показано, что в оз. Байкал у литоральных амфипод на сегментах антенн I присутствует по одному эстетаску. Антенны I небольшой зарывающейся амфиподы Homocerisca perla (Dybowsky, 1874) несут парные эстетаски. Особи этого вида обитают преимущественно на глубине 40–50 м на песчаном грунте и питаются детритом (Механикова, 2002). По два эстетаска на сегмент встречаются у единственной пелагической амфиподы оз. Байкал Macrohectopus branickii (Dybowsky, 1874). В отличие от Homocerisca perla, у Macrohectopus branickii эстетаски находятся на расстоянии друг от друга – один на дистальной части сегмента, второй посередине (такое расположение встречается реже) (Механикова, 2002). Отмечено, что факультативный некрофаг Ommatogammarus carneolus melanophthalmus Bazikalova, 1945 (предпочитаемые глубины 200–300 м) имеет одиночные эстетаски на сегментах, тогда как у облигатных глубоководных некрофагов присутствует по два–три (иногда четыре) эстетаска на сегмент у O. flavus (Dybowsky, 1874) (предпочитаемые глубины 100–600 м) или по два–пять эстетасков у O. albinus (Dybowsky, 1874) (предпочитаемые глубины 200–1637 м) (Базикалова, 1945; Механикова, 2002). Однако неизвестно, различается ли у данных видов общее число эстетасков с увеличением их числа на сегмент, и может ли это быть одним из способов усилить эффективность обнаружения запахов как адаптации к обитанию в глубоководной зоне. Нет данных и о том, как варьируют размеры эстетасков у литоральных и глубоководных байкальских амфипод, и есть ли какие-то принципиальные различия в морфологии обонятельных сенсилл у видов с разными экологическими характеристиками.
С помощью современных методик и технологий авторы решили проверить гипотезу, что в процессе эволюции при заселении амфиподами глубоководной зоны оз. Байкал у них могли произойти адаптивные изменения структур хеморецепторной системы.
Цель работы – провести морфометрическое сравнение сенсилл у ряда близкородственных амфипод Байкальского региона, обитающих в различных экологических условиях и на разных глубинах.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектами исследования были наиболее распространенные в оз. Байкал амфиподы: три глубоководных вида – O. carneolus melanophthalmus, O. flavus и O. albinus, четыре литоральных вида – Eulimnogammarus verrucosus (Gerstfeldt, 1858), E. vittatus (Dybowsky, 1874), E. cyaneus (Dybowsky, 1874), Acanthogammarus godlewskii (Dybowsky, 1874). Также исследовали байкальские виды Pallasea cancelloides (Gerstfeldt, 1858) и Gmelinoides fasciatus (Stebbing, 1899), пойманные в р. Ангара в г. Иркутск. Эти два вида – представители байкальской литорали, частично заселившие заводи р. Ангара, вытекающей из оз. Байкал. Дополнительно в работе представлена голарктическая амфипода Gammarus lacustris Sars, 1863, близкородственная фауне байкальских амфипод. По данным молекулярной систематики, все исследованные виды входят в морфологический род Gammarus (Naumenko et al., 2017). Литоральные виды амфипод отлавливали с использованием гидробиологического сачка. Для отлова глубоководных амфипод со льда оз. Байкал на дно озера устанавливали ловушки с помещенной внутрь приманкой (несвежая мертвая рыба). Сведения о местах вылова амфипод для различных анализов представлены в табл. 1.
Таблица 1.
Данные о местонахождении амфипод для различных анализов
| Вид | Место пробоотбора | Глубина, м | Координаты | |
|---|---|---|---|---|
| c.ш. | в.д. | |||
| Обзор внешнего вида эстетасков с помощью CELENA S | ||||
| Ommatogammarus carneolus melanophthalmus | оз. Байкал, пос. Большое Голоустное | 300 | 52°01′34.5″ | 105°26′21.5″ |
| O. flavus | оз. Байкал, пос. Большие Коты | 750 | 51°53′25.5″ | 105°04′28.2″ |
| O. albinus | оз. Байкал, пос. Большие Коты | 1000 | 51°53′25.5″ | 105°04′28.2″ |
| Eulimnogammarus verrucosus | оз. Байкал, пос. Листвянка | 0–0.5 | 51°52′14.07″ | 104°49′41.78″ |
| E. vittatus | оз. Байкал, пос. Листвянка | 0–0.5 | 51°52′14.07″ | 104°49′41.78″ |
| E. cyaneus | оз. Байкал, пос. Листвянка | 0–0.5 | 51°52′14.07″ | 104°49′41.78″ |
| Acanthogammarus godlewskii | оз. Байкал, пос. Большое Голоустное | 20 | 52°01′10.3″ | 105°23′08.0″ |
| Pallasea cancelloides | р. Ангара, г. Иркутск | 0–0.5 | 52°17′20.0″ | 104°15′45.3″ |
| Gmelinoides fasciatus | р. Ангара, г. Иркутск | 0–0.5 | 52°16′58.6″ | 104°16′14.7″ |
| Gammarus lacustris | р. Ангара, г. Иркутск | 0–0.5 | 52°16′06.1″ | 104°17′16.0″ |
| Обзор внешнего вида эстетасков с помощью СЭМ | ||||
| Ommatogammarus carneolus melanophthalmus | оз. Байкал, пос. Большие Коты | 200 | 51°53′25.5″ | 105°04′28.2″ |
| O. flavus | оз. Байкал, пос. Большие Коты | 300 | 51°53′25.5″ | 105°04′28.2″ |
| O. albinus | оз. Байкал, пос. Большие Коты | 750 | 51°53′25.5″ | 105°04′28.2″ |
| Eulimnogammarus verrucosus | оз. Байкал, пос. Листвянка | 0–0.5 | 51°52′14.07″ | 104°49′41.78″ |
| E. vittatus | оз. Байкал, пос. Листвянка | 0–0.5 | 51°52′14.07″ | 104°49′41.78″ |
| Измерение длины эстетасков | ||||
| Ommatogammarus albinus | оз. Байкал, пос. Большие Коты | 750 | 51°53′25.5″ | 105°04′28.2″ |
| Eulimnogammarus verrucosus | оз. Байкал, пос. Листвянка | 0–0.5 | 51°52′14.07″ | 104°49′41.78″ |
| Ommatogammarus carneolus melanophthalmus | оз. Байкал, пос. Большое Голоустное | 300 | 52°01′34.5″ | 105°26′21.5″ |
| O. flavus | оз. Байкал, пос. Большие Коты | 750 | 51°53′25.5″ | 105°04′28.2″ |
| O. albinus | оз. Байкал, пос. Большие Коты | 750 | 51°53′25.5″ | 105°04′28.2″ |
| Определение последовательности цитохром-c-оксидазы | ||||
| O. carneolus melanophthalmus | оз. Байкал, пос. Большое Голоустное | 300 | 52°01′34.5″ | 105°26′21.5″ |
| O. flavus | оз. Байкал, пос. Большие Коты | 50, 500 | 51°53′25.5″ | 105°04′28.2″ |
| O. albinus | оз. Байкал, пос. Большие Коты | 500, 1000 | 51°53′25.5″ | 105°04′28.2″ |
Изучение структуры эстетасков проводили с применением световой микроскопии (инвертированный микроскоп CELENA S и флуоресцентный микроскоп Leica DC 300). Для работы использовали свежие образцы тканей амфипод, а также зафиксированные в этаноле или формалине (для последующего окрашивания образцов). Живых амфипод анестезировали в гвоздичном масле в концентрациях, соответствующих их размерам: 0.01%-ная для Eulimnogammarus vittatus, Pallasea cancelloides и Gmelinoides fasciatus и 0.04%-ная для более крупного Eulimnogammarus verrucosus. Антенны I исследуемых амфипод удаляли и помещали на предметное стекло. Для поддержания хеморецепторов в раскрытом состоянии на стекло наносили 30 мкл воды. Наблюдения неокрашенных эстетасков проводили в световом поле (рис. 1). Для более детального изучения эстетасков применяли фазовый контраст. Для исследования объемных пучков эстетасков применяли Z-стэкинг с последующей сшивкой послойных фотографий в программе ImageJ (Schneider et al., 2012).
Рис. 1.
Эстетаски амфипод Байкальского региона: а – Eulimnogammarus verrucosus; б – E. cyaneus; в – Pallasea cancelloides из р. Ангара; г – Gmelinoides fasciatus из р. Ангара; д – Gammarus lacustris; е – Acanthogammarus godlewskii; ж – Ommatogammarus carneolus melanophthalmus; з – O. flavus; и – O. albinus; а, в, г, ж–и – результат фокус-стэкинга послойных изображений.

У байкальских амфипод E. verrucosus, Ommatogammarus albinus, O. flavus и O. carneolus melanophthalmus определяли пол, длину тела, размер антенн I. Длину эстетасков измеряли у наиболее массовых амфипод с контрастной глубиной и местом обитания – литорального Eulimnogammarus verrucosus (n = 5) и глубоководного Ommatogammarus albinus (n = 5) – с использованием встроенного в CELENA S программного обеспечения. У трех видов эврибатных амфипод O. albinus, O. flavus и O. carneolus melanophthalmus (n = 7 для каждого вида) считали общее число эстетасков и их число на единичный сегмент. Измерения и подсчет эстетасков проводили при увеличении ×40 при фазовом контрасте. Количественные данные обрабатывали в среде программирования R (R Core Team, 2022) с использованием пакетов ggplot2 (Wickham, 2016) и ggpubr (Kassambara, 2020). Статистическую обработку данных проводили с помощью критерия Манна–Уитни с поправкой Хольма на множественные сравнения.
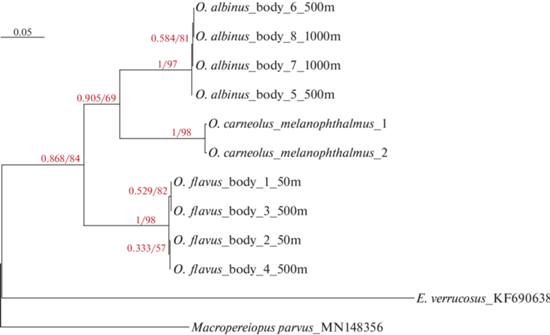
Для определения частичной последовательности цитохром-c-оксидазы из целых животных выделяли ДНК с помощью набора реактивов ДНК-Сорб-М (Синтол, Россия), амплифицировали нужный фрагмент с помощью полимеразной цепной реакции (Доп. мат. табл. S1) и очищали коммерческим набором Cleanup Standard (Евроген, Россия). Далее продукт секвенировали по методу Сэнгера с использованием прибора Нанофор-05 (Институт аналитического приборостроения). Полученные последовательности выравнивали в программе UGENE (Okonechnikov et al., 2012) с помощью алгоритма mafft (Katoh, Stadley, 2013) и вручную обрезали по самой короткой последовательности (Доп. мат. Suppl. S2). Длина проанализированных фрагментов – 628 пар нуклеотидов. Филогенетическое древо строили методом максимального правдоподобия в IQ-TREE2 (Mihn et al., 2020); устойчивость топологии оценивали с помощью методов ультрабыстрого бутстрепа (ultrafast bootstrap) и байесовской постериорной вероятности. В качестве внешних групп использовали последовательности из Eulimnogammarus verrucosus (Rivarola-Duarte et al., 2014) и Macropereiopus parvus Bazikalova, 1945 (Moskalenko et al., 2020). Филогению визуализировали с помощью пакета ggtree (Yu et al., 2017) для R.
Для исследования на СЭМ амфипод фиксировали в 70%-ном этаноле. Животных вынимали из спирта, удаляли антенны I и просушивали при комнатной температуре. Затем антенны I переносили на держатели образцов, где их располагали на дорсальной стороне. Подготовленные антенны покрывали платиной, после чего анализировали на СЭМ.
Часть образцов окрашивали йодистым пропидием в концентрации 1 мкг/мл для определения местоположения ядер хеморецепторных клеток, после чего изображения эстетасков визуализировали в красном флуоресцентном канале RFP (#10103) микроскопа CELENA-S. Некоторые образцы антенн I окрашивали красителем эозин метиленовый синий по Май-Грюнвальду (прокрашивает протоплазму клеток). Удаленные антенны I фиксировали в течение 1 сут в формалине, затем переносили в краситель на 30 мин и промывали водой. После окрашивания хеморецепторы амфипод визуализировали с использованием флуоресцентного и инвертированного микроскопов (Доп. мат. рис. S2).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
У разных видов амфипод Байкальского региона внешний вид эстетасков был схожим, но имелись и некоторые различия (рис. 1). У Eulimnogammarus cyaneus, Gmelinoides fasciatus и Gammarus lacustris сужения в базальной части эстетасков были более выражены. На некоторых образцах примерно на середине длины эстетасков можно различить перетяжку (рис. 1б, 1д). Особенно хорошо эта перетяжка видна на окрашенных образцах (Доп. мат. рис. S2d). При применении фазового контраста (Доп. мат. рис. S2a) базальная область эстетаска и его верхушка подсвечены белым, а дистальная область эстетаска затемнена. Белое свечение может быть связано с большей плотностью из-за наличия в базальной части эстетаска мембранных структур. В этой же области в красном флуоресцентном канале зарегистрировано красное свечение, что может указывать на расположение ядер клеток обонятельных нейронов.
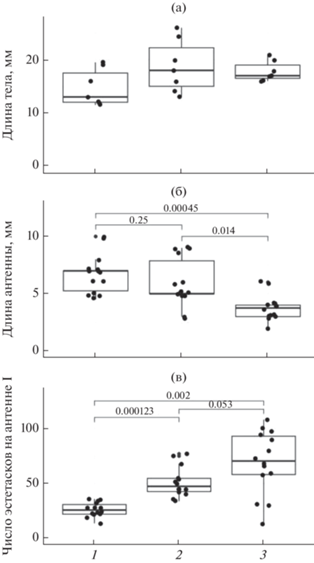
Для всех исследованных размерных характеристик эстетасков не обнаружено их зависимости от половой принадлежности. Медианная длина эстетасков у литорального Eulimnogammarus verrucosus (71.1 ± 33.66 мкм) была статистически значимо выше (критерий Манна–Уитни, p < 0.001), чем у глубоководных Ommatogammarus albinus (61.5 ± ± 16.29 мкм) (рис. 2а). Установлено, что длина эстетасков исследуемых видов не коррелирует с длиной антенн I и длиной тела (рис. 2б, 2в). У всех исследованных литоральных амфипод и у глубоководного O. carneolus melanophthalmus зарегистрировано наличие только одного эстетаска на сегмент (табл. 2; рис. 1а–1ж; рис. 3а). У глубоководных O. flavus и O. albinus в начале антенн I находится одиночный эстетаск в средней части сегмента. На сегментах O. flavus максимальное количество эстетасков достигает четырех на сегмент (табл. 2; рис. 1з), у O. albinus – семи (табл. 2; рис. 1и). На рис. 3а показано распределение числа сегментов с разным набором эстетасков у трех видов Ommatogammarus. У O. flavus (рис. 3б) больше всего было сегментов с двумя эстетасками (168 из 353 проанализированных сегментов). Число сегментов с одним и тремя эстетасками было равно 91 и 86 из 353 соответственно, наиболее редкими были сегменты с четырьмя эстетасками (8 сегментов из 353). У O. albinus (рис. 3в) чаще всего встречались сегменты с пучками по три и четыре (58 и 55 сегментов из 260 соответственно) эстетаска, редко – с семью эстетасками (7 сегментов из 260). Медианные значения длины тела глубоководных O. carneolus melanophthalmus, O. flavus и O. albinus достигали 13 ± 3.05, 17 ± 4.75 и 17 ± 1.95 мм соответственно (рис. 4а). Выявлено, что длина тела у этих трех видов статистически значимо не различалась. Длина антенн I была 7 ± 1.66 мм у O. carneolus melanophthalmus, 5 ± 2.05 мм у O. flavus и 4 ± 1.17 мм у O. albinus (рис. 4б). По сравнению с O. carneolus melanophthalmus и O. flavus, антенны I O. albinus были статистически значимо короче (критерий Манна–Уитни с поправкой Хольма, p < 0.05). Однако у данного вида обнаружено статистически значимо большее число эстетасков (141 ± 52.18), чем у O. carneolus melanophthalmus (56 ± 12.41) и O. flavus (100 ± 25.20) (критерий Манна–Уитни с поправкой Хольма, p < 0.05) (рис. 4в).
Рис. 2.
Сравнительная характеристика медианной длины эстетасков у литорального Eulimnogammarus verrucosus и глубоководного Ommatogammarus albinus (n = 5): а – длина эстетасков, б – отношение длины эстетасков к длине антенн I, в – отношение длины эстетасков к длине тела. Точками обозначены индивидуальные значения длины эстетасков (а), индивидуальные значения медианной длины эстетасков (б, в).
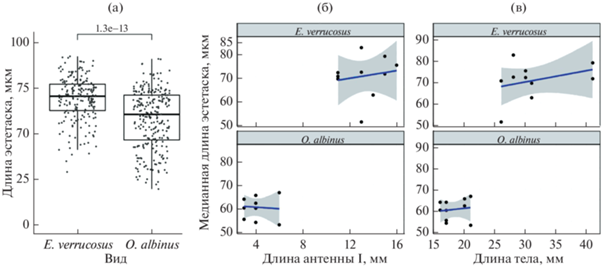
Таблица 2.
Число эстетасков на сегмент у амфипод Байкальского региона
| Вид | Число эстетасков |
|---|---|
| Ommatogammarus albinus | 1–7 (1–5) |
| O. flavus | 1–4 (2–4) |
| O. carneolus melanophthalmus | 1 (1) |
| Acanthogammarus godlewskii | 1 |
| Eulimnogammarus verrucosus | 1 |
| E. vittatus | 1 |
| E. cyaneus | 1 |
| Pallasea cancelloides | 1 |
| Gmelinoides fasciatus | 1 |
| Gammarus lacustris | 1 |
Рис. 3.
Распределение числа сегментов с разным набором эстетасков у O. carneolus melanophthalmus (а), O. flavus (б), O. albinus (в).
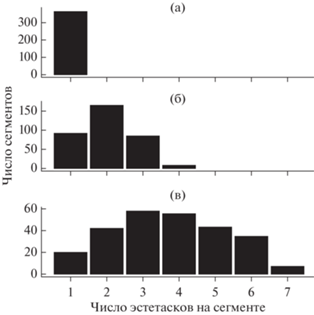
Рис. 4.
Морфометрические показатели Ommatogammarus carneolus melanophthalmus, O. flavus и O. albinus: а – длина тела; б – длина антенн I; в – общее число эстетасков на антенне I. По оси абсцисс: 1 – Ommatogammarus carneolus melanophthalmus; 2 – O. flavus; 3 – O. albinus.
В строении эстетасков литорального Eulimnogammarus verrucosus и глубоководного Ommatogammarus carneolus melanophthalmus отмечено разделение на более гладкий стебелек и на сморщенную головку (рис. 5б, 5в). У Eulimnogammarus verrucosus длина головки примерно в 2 раза больше длины стебелька, у Ommatogammarus carneolus melanophthalmus – в 2–3 раза. Разделение на стебелек и головку слабо различимо для эстетасков литорального Eulimnogammarus vittatus (рис. 5а) и глубоководных Ommatogammarus flavus и O. albinus (рис. 5г, 5д). При этом головка эстетасков у глубоководных видов примерно в 4 раза длиннее стебелька.
Рис. 5.
СЭМ микрофотографии эстетасков байкальских эндемичных амфипод: а – 10-й сегмент левой антенны I литорального Eulimnogammarus vittatus с эстетаском, окруженным механорецепторными щетинками; б – 22-й сегмент правой антенны I литорального E. verrucosus с эстетаском, видны механорецепторные щетинки; в – эстетаск глубоководного Ommatogammarus carneolus melanophthalmus в окружении механорецепторных сенсилл; г – 33-й сегмент левой антенны I глубоководного O. flavus с двумя эстетасками, окруженными четырьмя механорецепторными сенсиллами; д – 21-й сегмент левой антенны I глубоководного O. albinus.
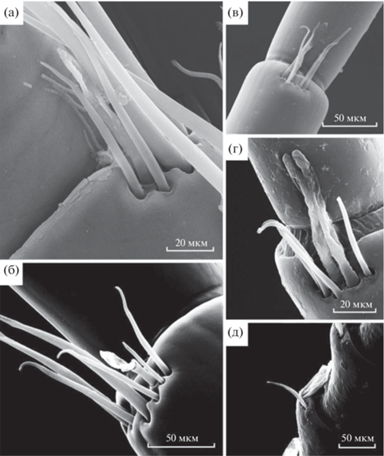
Было обнаружено, что литоральные амфиподы Eulimnogammarus verrucosus, E. vittatus, E. cyaneus и Gаmmarus lacustris более оснащены механорецепторными сенсиллами по сравнению с исследованными глубоководными видами. Их антенны I оснащены разнообразными щетинками, большинство из них гладкие, некоторые имеют сегментированную поверхность. Антенны I литоральных фитофагов Pallasea cancelloides покрыты слоем небольших щетинок, более густым в базальной части. У Eulimnogammarus verrucosus на дистальной части первого сегмента антенн I имеются механорецепторы и шипики различного размера (Доп. мат. рис. S3a–3г). Вторая и третья пары сегментов на вентральной стороне несут ряды из длинных и коротких щетинок. В середине каждого ряда расположены более длинные и тонкие щетинки, по краям от них находятся короткие широкие шипики. Такое же оснащение механорецепторами на первых сегментах выявлено и у E. vittatus. У исследованных глубоководных видов первые сегменты антенн I короче, чем у литоральных видов из оз. Байкал. Самые короткие первые сегменты зарегистрированы у Ommatogammarus albinus (Доп. материалы рис. S3д–3з). Кроме того, механорецепторных сенсилл на первых сегментах антенн I у глубоководных амфипод меньше, они короче и тоньше, чем у литоральных видов
По результатам филогенетического анализа представителей рода Ommatogammarus все три вида образуют обособленные группы (рис. 6). Виды O. albinus и O. carneolus melanophthalmus являются сестринскими, O. flavus образует внешнюю ветвь. Различий внутри групп в зависимости от глубины вылова не обнаружено. Высокие значения поддержки топологии бутстрепа и байесовской постериорной вероятности говорят об устойчивости топологии.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Эстетаски разных амфипод похожи и узнаваемы за счет своей вздутой цилиндрической формы и полупрозрачности. На изображениях, полученных с помощью СЭМ, видно разделение эстетасков на стебелек и головку (данные авторов; Urbschat, Scholtz, 2019). Выявленное морфологическое разделение в строении эстетасков может быть связано с деформацией кутикулы во время обсушивания антенн I и напыления на них платины. Возможно, более вздутая верхняя часть эстетасков с порой на верхушке имеет более тонкую и более проницаемую для молекул запахов кутикулу и, соответственно, больше деформируется при обсушивании. По данным (Schmidt, Gnatzy, 1984; Derby et al., 2016), в выступающую область эстетасков отходят разветвленные дендритные сегменты, которые принимают и передают сигнал от одорантов в обонятельный отдел дейтоцеребрума. Полученные результаты подтверждают, что общий вид и расположение эстетасков имеют небольшие различия у разных видов амфипод. В работе (Urbschat, Scholtz, 2019) у трех видов амфипод с разными экологическими характеристиками длина эстетасков различалась. В нашем исследовании выявлено, что длина эстетасков у амфипод из литоральной зоны оз. Байкал (Eulimnogammarus verrucosus) (Доп. мат. рис. S4) больше, чем из глубоководной (Ommatogammarus albinus) (Доп. мат. рис. S5). Вероятно, размерные характеристики эстетасков не связаны с эффективностью распознавания запахов, а зависят от размера и стадии развития организма (Hallberg et al., 1992). Также у некоторых видов отмечено необычное расположение эстетасков – на последнем сегменте антенн I у литорального Eulimnogammarus cyaneus и в середине сегмента в базальной части антенн I у глубоководных Ommatogammarus flavus и O. albinus.
Ранее И.В. Механикова (2002) обратила внимание, что количество эстетасков на единичном сегменте различается у представителей глубоководного рода байкальских амфипод Ommatogammarus. Было обнаружено, что у O. albinus даже по семь эстетасков в одном пучке. Кроме этого, сравнение общего количества эстетасков и распределения сегментов с разным набором эстетасков у O. carneolus melanophthalmus, O. flavus и O. albinus показало, что хотя данные виды генетически близкие (см. выше), общее количество эстетасков и их число на сегмент различаются, причем они увеличиваются с возрастанием максимальной глубины в диапазоне обитания вида. Следует отметить, что длина антенн I, напротив, короче у исследованных видов, населяющих большие глубины. Возможно, более короткие антенны меньше повреждаются при массовых скоплениях облигатных некрофагов на падали. Множественные эстетаски встречаются у глубоководных видов O. flavus, O. albinus и Bathymedon longirostris (Jaume et al., 1998). Причина увеличения оснащенности обонятельными хеморецепторами может быть связана с необходимостью усилить вероятность обнаружения пищи и половых партнеров с меньшими энергетическими затратами в таких условиях окружающей среды, где для осуществления данной цели могут возникнуть препятствия. На большой глубине эти виды могут сталкиваться как с дефицитом пищи, так и со слабым проникновением света или его полным отсутствием.
Было выявлено, что у исследованных литоральных видов антенны I более оснащены механорецепторными сенсиллами, чем глубоководные виды. Возможно, большое количество и крупные размеры механорецепторов у литоральных амфипод связано с различными гидродинамическим и температурным режимами, более изменчивыми в литорали оз. Байкал (Русинек и др., 2012; Бедулина и др., 2018). Механорецепторы могут быть задействованы в детекции изменения гидродинамических процессов, за счет чего животные способны отслеживать приближение хищников и более эффективно ориентироваться в пространстве (Breithaupt, Thiel, 2011). По данным (Механикова, 2002), эстетаски всегда ассоциированы с щетинками, которые могут выполнять защитные функции. В работе (Urbschat, Scholtz, 2019) выявлены различия в расположении этих щетинок у разных видов амфипод; обрамление щетинками эстетасков может различаться и в пределах особи. В основном, эти щетинки тоньше, чем эстетаски, могут быть длиннее эстетасков или равными им по размеру.
Сопоставление результатов анализа филогении и данных по числу эстетасков позволяет предположить, что в ходе эволюции O. carneolus melanophthalmus утратил дополнительные эстетаски на сегментах.
Выводы. Внешняя морфология эстетасков у исследованных литоральных видов амфипод Байкальского региона не имеет существенных различий. У байкальских глубоководных амфипод рода Ommatogammarus эффективность детекции запахов могла быть увеличена за счет увеличения числа эстетасков. Выявлено, что литоральные байкальские амфиподы обладают более оснащенной системой механорецепции антенн I, чем глубоководные. У некоторых видов отмечено необычное расположение эстетасков: на последнем сегменте антенн I – у литорального Eulimnogammarus cyaneus и на середине сегмента в базальной части антенн I – у глубоководных Ommatogammarus flavus и O. albinus. Не зарегистрировано различий по числу эстетасков у самцов и самок исследованных амфипод.
Список литературы
Базикалова А.Я. 1945. Амфиподы озера Байкал // Тр. Байкал. лимнол. ст. Т. 11. С. 1.
Бедулина Д.С., Шатилина Ж.М., Гурков А.Н. 2018. Физиологические и биохимические маркеры стресс-ответа эндемичных байкальских амфипод: современное состояние и перспективы исследований // Изв. Иркутск. гос. ун-та. Серия: Биология. Экология. Т. 23. С. 3.
Механикова И.В. 2002. О расположении эстетасков – антеннальных сенсорных органов у некоторых видов байкальских амфипод (Crustacea, Amphipoda) // Экологические, физиологические и паразитологические исследования пресноводных амфипод. Сб. научн. трудов. Иркутск: Иркут. ун-т. С. 83.
Механикова И.В. 2021. Кальцеолы – антеннальные сенсорные органы амфипод (Crustacea, Amphipoda, Gammaridea) озера Байкал // Зоол. журн. Т. 100. № 2. С. 134.
Русинек О.Т., Тахтеев В.В., Гладкочуб Д.П. и др. 2012. Байкаловедение. Новосибирск. Наука. Т. 2.
Сидоров Д.А. 2012. Pseudocrangonyx kseniae, новый вид амфипод (Crustacea, Pseudocrangonyctidae) из подземных вод южного приморья // Зоол. журн. Т. 91. № 1. С. 30.
Arfianti T. 2020. Biodiversity and biogeography of Amphipod Crustaceans // Doctoral dissertation. ResearchSpace. Auckland. Электронный ресурс [URL: https://researchspace.auckland.ac.nz/handle/2292/ 53402].
Breithaupt T., Thiel M. 2011. Chemical Communication in Crustaceans // Springer Science and Business Media. New York.
Derby C.D., Kozma M.T., Senatore A., Schmidt M. 2016. Molecular mechanisms of reception and perireception in crustacean chemoreception: a comparative review // Chemical Senses. V. 41. № 5. P. 381. https://doi.org/10.1093/chemse/bjw057
Derby C., Thiel M. 2014. The Natural History of the Crustacea. V. 3. Nervous systems and control of behavior. USA: Oxford Univ. Press. P. 263.
Gurkov A., Rivarola-Duarte L., Bedulina D. et al. 2019. Indication of ongoing amphipod speciation in Lake Baikal by genetic structures within endemic species // BMC Evolution. Biol. V. 19. P. 1. https://doi.org/10.1186/s12862-019-1470-8
Hallberg E., Johansson K.U.I., Elofsson R. 1992. The aesthetasc concept: structural vatiations of putative olfactory receptor cell complexes in Crustacea // Microscopy Res. Tech. V. 22. № 4. P. 325. https://doi.org/10.1002/jemt.1070220403
Jamieson A.J., Fujii T., Mayor D.J. et al. 2010. Hadal trenches: the ecology of the deepest places on Earth // Trends in Ecol. and Evol. V. 25. № 3. P. 190. https://doi.org/10.1016/j.tree.2009.09.009
Jaume D., Cartes J.E., Sorbe J.C. 1998. A new species of Bathymedon Sars, 1892 (Amphipoda: Oedicerotidae) from the western Mediterranean bathyal floor // Sci. Mar. V. 62. № 4. P. 341.
Johansson K.U.I., Hallberg E. 1992. Male-specific structures in the olfactory system of mysids (Mysidacea; Crustacea) // Cell and Tissue Res. V. 268. № 2. P. 359.
Kamio M., Derby C.D. 2017. Finding food: how marine invertebrates use chemical cues to track and select food // Natural Product Reports. V. 34. № 5. P. 514. https://doi.org/10.1039/C6NP00121A
Kassambara A. 2020. ggpubr: ‘ggplot2’ based Publication Ready Plots // R Package Version 0.4.0. 2020. [URL: https://CRAN.R-project.org/package=ggpubr].
Katoh K., Standley D.M. 2013. MAFFT multiple sequence alignment software version 7: improvements in performance and usability // Mol. Biol. and Evol. V. 30. № 4. P. 772. https://doi.org/10.1093/molbev/mst010
Kaufmann R.S. 1994. Structure and function of chemoreceptors in scavenging lysianassoid amphipods // J. Crustacean Biol. V. 14. № 1. P. 54. https://doi.org/10.1163/193724094X00470
Laverack M.S. 1988. The diversity of chemoreceptors // Sensory biology of aquatic animals. New York: Springer. P. 287. https://doi.org/10.1007/978-1-4612-3714-3_11
Minh B.Q., Schmidt H.A., Chernomor O. et al. 2020. IQ-TREE 2: new models and efficient methods for phylogenetic inference in the genomic era // Mol. Biol. and Evol. V. 37. № 5. P. 1530. https://doi.org/10.1093/molbev/msaa015
Moskalenko V.N., Neretina T.V., Yampolsky L.Y. 2020. To the origin of lake baikal endemic gammarid radiations, with description of two new Eulimnogammarus spp. // Zootaxa. V. 4766. № 3. P. 457. https://doi.org/10.11646/zootaxa.4766.3.5
Naumenko S.A., Logacheva M.D., Popova N.V. 2017. Transcriptome-based phylogeny of endemic Lake Baikal amphipod species flock: fast speciation accompanied by frequent episodes of positive selection // Mol. Ecol. V. 26. № 2. P. 536. https://doi.org/10.1111/mec.13927
Okonechnikov K., Golosova O., Fursov M., Team U. 2012. Unipro UGENE: a unified bioinformatics toolkit // Bioinformatics. V. 28. № 8. P. 1166. https://doi.org/10.1093/bioinformatics/bts091
Pravin S., Mellon D., Berger E.J., Reidenbach M.A. 2015. Effects of sensilla morphology on mechanosensory sensitivity in the crayfish // Bioinspir. Biomim. V. 10. № 3. P. 1. https://doi.org/10.1088/1748-3190/10/3/036006
R Core Team. 2022. R: A language and environment for statistical computing // R Foundation for Statistical Computing. Vienna. Austria.
Rivarola-Duarte L., Otto C., Jühling F. et al. 2014. A first glimpse at the genome of the Baikalian amphipod Eulimnogammarus verrucosus // J. Exp. Zool. Part B: Mol. and Develop. Evol. V. 322. № 3. P. 177. https://doi.org/10.1002/jez.b.22560
Sainte-Marie B., Hargrave B.T. 1987. Estimation of scavenger abundance and distance of attraction to bait // Mar. Biol. V. 94. № 3. P. 431. https://doi.org/10.1007/BF00428250
Schmidt M., Gnatzy W. 1984. Are the funnel-canal organs the ‘campaniform sensilla’ of the shore crab, Carcinus maenas (Decapoda, Crustacea)? // Cell and Tissue Res. V. 237. № 1. P. 81. https://doi.org/10.1007/BF00229202
Schneider C.A., Rasband W.S., Eliceiri K.W. 2012. NIH Image to ImageJ: 25 years of image analysis // Nat. Meth. V. 9. № 7. P. 671. https://doi.org/10.1038/nmeth.2089
Urbschat N., Scholtz G. 2019. Comparative analysis of the antennae of three amphipod species with different lifestyles // Arthropod Struct. and Develop. V. 53. P. 1. https://doi.org/10.1016/j.asd.2019.100886
Vrijenhoek R. 1994. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates // Mol. Mar. Biol. Biotechnol. V. 3. P. 294.
Watling L., Thiel M. 2013. The Natural History of the Crustacea. V. 1. Functional morphology and diversity. USA: Oxford Univ. Press.
Wickham H. 2016. ggplot2: Elegant Graphics for Data Analysis. Berlin: Springer.
Yu G., Smith D.K., Zhu H. et al. 2017. ggtree: an R package for visualization and annotation of phylogenetic trees with their covariates and other associated data // Methods in Ecol. and Evol. V. 8. № 1. P. 28. https://doi.org/10.1111/2041-210X.12628
Дополнительные материалы
- скачать ESM.zip
- Доп. материал. S1.
Рис. S1. - Рис. S5.
Таблица S1. Праймеры, использованные для амплификации фрагмента цитохром-c-оксидазы и идентификаторы полученных последовательностей
Доп. материал. S2.
Выравнивание частичных последовательностей цитохром-c-оксидазы, использованных для восстановления филогении.
Инструменты
Биология внутренних вод