Ботанический журнал, 2019, T. 104, № 4, стр. 569-586
ИЗМЕНЕНИЕ РАЗНООБРАЗИЯ ЦИАНОПРОКАРИОТ И ВОДОРОСЛЕЙ ПРИ ЗАРАСТАНИИ ПЯТЕН-МЕДАЛЬОНОВ ГОРНО-ТУНДРОВЫХ СООБЩЕСТВ СЕВЕРНОГО УРАЛА
И. В. Новаковская 1, *, Е. Н. Патова 1, **, Е. Е. Кулюгина 1
1 Институт биологии Коми НЦ УрО РАН
167928 г. Сыктывкар, ул. Коммунистическая, 28, Россия
* E-mail: novakovskaya@ib.komisc.ru
** E-mail: patova@ib.komisc.ru
Поступила в редакцию 07.03.2019
После доработки 05.04.2019
Принята к публикации 09.04.2019
Аннотация
Рассмотрены особенности зарастания пятен-медальонов в горно-тундровых сообществах Северного Урала цианопрокариотами и эукариотическими водорослями с формированием биологических почвенных корочек. Всего выявлено 57 видов из пяти отделов. Выделены комплексы видов цианопрокариот и водорослей на разных стадиях зарастания пятен-медальонов: дисперсные из нитчатых азотфиксирующих цианопрокариот и одноклеточных водорослей на голом субстрате → первичные корочки, образованные цианопрокариотами и водорослями с нитчатой и колониальной формой таллома → биологические почвенные корочки с участием водорослей, образующих многотрихальные талломы и обильные слизистые агрегаты. Видовое разнообразие цианопрокариот и водорослей определяют стадию зарастания пятна и влажность почвы.
Почвенные водоросли являются важным фототрофным компонентом наземных экосистем. Они совместно с другими споровыми организмами – цианопрокариотами, лишайниками, бактериями, микроскопическими грибами и мхами – одними из первых поселяются на поверхности голого субстрата и формируют биологические почвенные корочки (БПК). В горных тундрах на пятнах-медальонах, лишенных растительности, формирование БПК происходит в условиях короткого периода вегетации, повышенной солнечной инсоляции, резких колебаний влажности и температуры (Getsen, 1985; Karsten, Holzinger, 2014). Они участвуют в защите почвы от водной и ветровой эрозии, регуляции водного обмена, накоплении органического вещества, а также в круговороте элементов, что определяет их важное экологическое значение в освоении оголенных субстратов (Schulz et al., 2016; Borchhardt et al., 2017). Разнообразие структуры и морфологии БПК обусловлено составом организмов, возрастом, а также экологическими условиями мест их формирования (Büdel et al., 2009). Цианобактерии и водоросли являются наиболее многочисленной и разнообразной группой споровых организмов в БПК (Schulz et al., 2016; Patova et al., 2018). В настоящее время активно исследуются эти группы организмов почвенных корочек и их роль в процессах зарастания голого грунта различных континентов с широким спектром климатических условий (Karsten, Holzinger, 2014; Schulz et al., 2016; Borchhardt et al., 2017; Davidov, Patova, 2018). Многолетние исследования почвенных водорослей горных тундр проводятся и в северных районах Уральской горной страны (Getsen, 1985; Stenina et al., 2001; Andreeva, Chaplygina, 2007; Novakovskaya et al., 2012; Novakovskaya, Patova, 2013). Наиболее хорошо изучена альгофлора Приполярного (Novakovskaya et al., 2012; Patova et al., 2016) и Полярного Урала (Andreeva, Chaplygina, 2007; Novakovskaya, Patova, 2013), сведения о разнообразии альгогруппировок Северного Урала практически отсутствуют (Patova, Novakovskaya, 2018).
Цель работы – изучить разнообразие и структуру сообществ водорослей и цианопрокариот биологических почвенных корочек, формирующихся на разных стадиях зарастания пятен-медальонов, на примере горно-тундровых сообществ Северного Урала.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проведены в конце июля 2016 г. в национальном парке “Югыд ва” в окрестностях г. Пеленер (63°23′ с.ш.; 58°54′ в.д.; высота 800–1053 м над ур. м.) на Северном Урале (рис. 1).
Рис. 1.
Карта-схема района исследования. Черным кругом отмечен район сборов.
Fig. 1. Map of the study area. The black circle marks the sampling site.
Было отобрано восемь почвенно-альгологических проб БПК в двух вариантах пятнистых горно-тундровых сообществ: кустарничково-алекториевых и осоково-мохово-лишайниковых (рис. 1, табл. 1). Пробы отбирали на пятнах-медальонах в пределах одного фитоценоза с участка площадью 25 м2. При сборе почвенно-альгологических проб учитывали морфологические особенности криптогамных корочек. По многолетним наблюдениям в горно-тундровых сообществах при зарастании голого грунта на пятнах формируются корочки, отличающиеся по цвету, размеру и форме. В зависимости от стадии зарастания на пятнах выделяют голые участки почвы – полностью лишенные растительности, а также участки – заросшие корочками серого (серо-коричневого) и черного цвета (рис. 2).
Таблица 1.
Характеристика мест сбора биологических почвенных корочек на Северном Урале Table 1. Sites of sampling biological soil crusts in the Northern Urals
| Местоположение Location | Растительное сообщество Plant community | Высота, м над ур. м. Elevation, m a. s. l. |
|---|---|---|
| Окрестности г. Пеленер, ЮВ склон / Near Pelener mountain, SE slope | пятнистое кустарничково-алекториевое/ spotty-shrub-lichen | 800 |
| корочки черного цвета/black crusts | ||
| корочки серого цвета/gray crusts | ||
| голый грунт/bare soils | ||
| г. Пеленер, В склон / Pelener mountain, E slope | пятнистое осоково-мохово-лишайниковое/ spotty-sedge-moss-lichen | 1053 |
| корочки черного цвета/black crusts | ||
| корочки серого цвета/gray crusts | ||
| голый грунт/bare soils |
Рис. 2.
Биологические почвенные корочки, формирующиеся при зарастании голого субстрата в горно-тундровых сообществах. 1 – голый грунт, 2 – корочки серого цвета, 3 – корочки черного цвета.
Fig. 2. Biological soil crusts growing on bare spots in mountain tundra communities. 1 – bare soils, 2 – gray crusts, 3 – black crusts.

Корочки отбирали в бумажные пакеты ножом с соблюдением условий стерильности (Andersen, 2005). Каждая проба содержит пять индивидуальных образцов площадью 3–5 см2 и толщиной 2 см. Сразу после отбора проб в полевых условиях с использованием микроскопа Биолам Д-11 определяли активно вегетирующие и доминантные виды. Для хранения образцы почвы высушивали в стерильных условиях до воздушно-сухого состояния. В лабораторных условиях изучали разнообразие цианопрокариот и водорослей в накопительных и монокультурах с использованием почвенной вытяжки, жидких и агаризованных сред 3N BBM, Bg 11. Использование двух приемов (микроскопирование свежесобранных проб и культурального материала) позволяет наиболее полно выявить видовое разнообразие. К сожалению, часть видов, которые формируют массовые разрастания на пятнах, не культивируются на питательных средах в лабораторных условиях. Для получения альгологически чистых культур использовали метод посева штрихом и изоляцию с помощью микропипетки (Andersen, 2005). Двадцать штаммов были изолированы в альгологически чистые культуры, которые поддерживаются в коллекции водорослей Института биологии (SYKOA).
Водоросли определяли на микроскопе Nikon Eclipse80i при увеличении до ×1000, оборудованного системой дифференциального интерференционного контраста и видеофиксации изображений. Идентификация видов проведена с привлечением отечественных и зарубежных определителей (Andreeva, 1998; Komárek, Anagnostidis, 1998, 2005; Komárek, 2013; Ettl, Gärtner, 2014).
Для характеристики физико-химических свойств почв исследованных пятен, отобраны образцы верхних горизонтов оголенных субстратов на глубине 0–10 см по стандартным методам (ГОСТ 17.4.3.01-83). Химический анализ выполнен в Экоаналитической лаборатории Института биологии Коми НЦ УрО РАН. Использованы следующие методы: рН водный и солевой – потенциометрически (ГОСТ 26423-85 и ГОСТ 26483-85 соответственно); валовое содержание органического углерода и азота – на CHNS-элементном анализаторе ЕА 1110 (Carlo Erba, Италия); подвижные формы фосфора и калия – по Кирсанову в модификации ЦИНАО; обменные катионы – по Гедройцу с вытеснением 1н NH4Cl и последующим атомно-эмиссионным определением на ICP Spectro Ciros CCD. Количественное определение химических элементов проведено на SPECTRO CIROS ICP (Германия). Подвижные формы элементов из почвенных образцов извлекали в ацетатно-аммонийном буфере (рН+4.8) и выделением в кислотной вытяжке (1N НС1).
Отбор почвенно-альгологических образцов для измерения влажности почвы на пятнах был проведен при сходных погодных условиях (в период без осадков) в 10‑кратной повторности. Влажность почвы определяли по объемному содержанию воды (%) с помощью почвенного влагомера Field Scout TDR-100 (Spectrum Technologies, США).
Экологический анализ выполнен с учетом жизненных форм (Shtina, Gollerbakh, 1976). Фитогеографические характеристики приведены по определителям, базам данных (Guiry, Guiry, 2019) и списку водорослей-индикаторов (Barinova et al., 2006).
Сходство видового состава оценивали по коэффициенту Серенсена, который рассчитывали при помощи программы ExStatR (Novakovkiy, 2016). Для визуализации полученных результатов использовали представления в виде графов – плеяды Терентьева.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В северных районах Уральской горной страны на высоте выше 600 м над ур. м. распространены пятнистые ерниковые, кустарничковые, моховые и лишайниковые тундры (Bioraznoobraziye…, 2010). Пятнистые кустарничково-алекториевые и осоково-мохово-лишайниковые сообщества, в которых были отобраны альгологические пробы, занимают значительные площади в горно-тундровом поясе района исследований.
Пятнистые кустарничково-алекториевые сообщества (тип сообществ Arctous alpina-Alectoria ochroleuca) встречаются на высоте 750–810 м над ур. м. Видовое богатство сообществ составляет 22–41 вид. Общее проективное покрытие (ОПП) варьирует в диапазоне 75–80%. Для этих сообществ характерны пятна-медальоны, занимающие 5–25% поверхности. Сообщества не имеют четко выраженной вертикальной структуры, все растения находятся примерно в одном ярусе высотой до 10–20 см. Доминирующий комплекс включает следующие виды: Alectoria ochroleuca (Hoffm.) A. Massal., Cladonia arbuscula (Wallr.) Flot., Cladonia rangiferina (L.) F.H. Wigg., Betula nana L., Vaccinium uliginosum L.
Пятнистые осоково-мохово-лишайниковые сообщества (тип сообществ Carex arctisibirica-Flavocetraria cucullata) расположены на высотах 700–1065 м над ур. м., занимают нагорные плато. Видовой состав их достаточно разнообразен, 24–33 вида на пробную площадь. ОПП составляет 60–95%, остальная поверхность занята каменистыми россыпями и до 2% приходится на пятна-медальоны. Вертикальная структура включает два яруса: разреженный (20–60%) травяно-кустарничковый высотой до 30 см и сомкнутый мохово-лишайниковый до 4–10 см. В первом обильны травы: Carex arctisibirica (Jurtzev) Czerep., Bistorta major Gray, во втором – лишайники Cladonia arbuscula, Cetraria islandica (L.) Ach., Flavocetraria cucullata (L.) Kärnefelt & A. Thell и мхи из рода Polytrichum Hedw., а также Pleurosium schreberi (Brid.) Mitt., Dicranum elongatum Schleich. ex Schwägr.
Анализ почв пятен в исследованных сообществах показал, что они имеют сходный химический состав (табл. 2). Почвы пятен кислые, с низкой степенью насыщенности основаниями, низким содержанием азота, фосфора и других важных биогенных элементов, что определяется особенностями почвообразующих пород Северного Урала (Pochvy…, 2013). В период исследований отмечена низкая влажность почв пятен (табл. 3), как на голом грунте, так и на участках с водорослевыми корочками.
Таблица 2.
Химический состав верхних горизонтов почв пятен-медальонов Северного Урала Table 2. Chemical composition of the upper soil horizons of bare spots in the Northern Urals
| Сообщество Community | P2O5, mg/kg | K2O, mg/kg | рН (H2O) | рН (KCl) | N, % | C, % | Mn, mg/kg | Al, mg/kg | Fe, mg/kg | Обменные катионы, смоль (экв)/кг Exchangeable cations, cmolc/kg | Pb, mg/kg | Cd, mg/kg | Zn, mg/kg | Ni, mg/kg | Co, mg/kg | Cu, mg/kg | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ca2+ | Mg2+ | ||||||||||||||||
| ω ±Δ |
ω ±Δ |
pH ±Δ |
pH ±Δ |
ω ±Δ |
ω ±Δ |
ω ±Δ |
ω ±Δ |
ω ±Δ |
n ±Δ |
n ±Δ |
ω ±Δ |
ω ±Δ |
ω ±Δ |
ω ±Δ |
ω ±Δ |
ω ±Δ |
|
| Пятнистое кустарничково-алекториевое/ Spotty-shrub-lichen | 31 6 |
60 12 |
4.960.10 | 3.900.10 | 0.090 0.018 |
0.93 0.21 |
12 3 |
196 29 |
1050160 | 0.67 0.11 | 0.22 0.04 |
14 4 |
<0.10 – |
41 8 |
197 | 7.0 2.8 |
0.860.22 |
| Пятнистое осоково-мохово-лишайниковое/ Spotty-sedge-moss-lichen | 85 17 |
40 8 |
5.060.10 | 3.910.10 | 0.093 0.019 |
0.850.20 | 6.5 1.6 |
240 40 |
1190180 | 0.62 0.11 |
0.19 0.04 |
15 4 |
<0.10 – |
44 9 |
166 | 6.2 2.5 |
0.510.15 |
Таблица 3.
Показатели влажности почвы пятен в исследованных сообществах для разных вариантов БПК Table 3. Indicators of soil moisture at the bare spots in the studied communities for different variants of biological soil crusts
| Вариант БПК Variant BSC | Влажность почвы на пятнах, %/Soil moisture at the spots, % | |
|---|---|---|
| Пятнистое кустарничково-алекториевое Spotty-shrub-lichen |
Пятнистое осоково-мохово-лишайниковое Spotty-sedge-moss-lichen |
|
| Черного цвета Black crusts | 18.8 | 2.7 |
| Серого цвета Gray crusts | 13 | 2.2 |
| Голый грунт Bare soils | 0.8 | 11.8 |
Всего в БПК исследованных пятен было выявлено 57 видов водорослей и цианопрокариот из пяти отделов, семи классов, 15 порядков, 32 семейств и 44 родов (табл. 4). Доминировали таксоны из отделов Cyanoprokaryota – 23 и Chlorophyta – 26, а также обнаружены представители Bacillariophyta – 2, Ochrophyta – 1, Streptophyta – 5. Выявленное разнообразие дополняет сведения об альгофлоре северных регионов Урала (Patova, Novakovskaya, 2018). К ведущим порядкам относятся: Chlamydomonadales, Nostocales, Sphaeropleales. Преобладают виды из семейств: Chlamydomonadaceae, Chroococcaceae, Leptolyngbyaceae, Mesotaeniaceae, Nostocaceae, Oscillatoriaceae, Radiococcaceae, Trebouxiaceae. Наибольшее число видов выявлено из родов: Chlamydomonas Ehrenb., Leptolyngbya Anagn. & Komárek и Phormidium Kütz. ex Gomont.
Таблица 4.
Почвенные водоросли БПК исследованных пятен Северного Урала Table 4. Soil algae in the biological soil crusts at the sites under study
| Таксон Taxon | Сообщество/Community | |||||
|---|---|---|---|---|---|---|
| пятнисто-кустарничково-лишайниковое/spotty-shrub-lichen | пятнисто-осоково-мохово-лишайниковое/spotty-sedge-moss-lichen | |||||
| 1 | 2 | 3 | 1 | 2 | 3 | |
| Cyanoprokaryota | ||||||
| Anabaena sp. | + | + | ||||
| Aphanocapsa muscicola (Menegh.) Wille | + | + | + | + | + | |
| Aphanothece saxicola Nägeli | + | + | ||||
| Calothrix sp. | + | |||||
| Chroococcus pallidus Nägeli | + | |||||
| Desmonostoc muscorum (C. Agardh ex Bornet & Flahault) Hrouzek & Ventura | + | + | + | + | ||
| Fischerella muscicola Gomont | + | + | ||||
| Gloeocapsopsis dvorakii (Novácek) Komárek & Anagn. ex Komárek | + | |||||
| Gloeocapsopsis magma (Bréb.) Komárek & Anagn. ex Komárek | + | + | ||||
| Leptolyngbya foveolara (Gomont) Anagn. & Komárek | + | + | ||||
| Leptolyngbya notata (Schmidle) Anagn. & Komárek | + | |||||
| Leptolyngbya boryana (Gomont) Anagn. & Komárek | + | |||||
| Leptolyngbya sp. | + | + | + | + | ||
| Microcoleus paludosus Gomont | + | + | + | + | + | |
| Nostoc sp. | + | + | + | |||
| Phormidium corium Gomont ex Gomont | + | + | ||||
| Phormidium puteale (Mont. ex Gomont) Anagn. & Komárek | + | |||||
| Scytonema hofmanii C. Agardh ex Bornet & Flahault | + | + | + | |||
| Stenomitos frigidus (F.E. Fritsch) Miscoe & J.R. Johans | + | |||||
| Stigonema minutum Hassall ex Bornet & Flahault | + | + | + | |||
| Stigonema ocellatum Thur. ex Bornet & Flahault | + | |||||
| Synechococcus elongatus (Nägeli) Nägeli | + | + | + | + | ||
| Tolypothrix tenuis Kütz. ex Bornet & Flahault | + | + | + | |||
| Ochrophyta | ||||||
| Eustigmatos magnus (J.B. Petersen) D.J. Hibberd | + | + | + | |||
| Bacillariophyta | ||||||
| Navicula spp. | + | + | ||||
| Pinnularia spp. | + | + | ||||
| Chlorophyta | ||||||
| Borodinellopsis cf. texensis Dykstra | + | + | ||||
| Bracteacoccus grandis Bisch. & Н.С. Bold | + | |||||
| Bracteacoccus pseudominor H.W. Bisch. & Н.С. Bold | + | + | ||||
| Chlamydomonas cf. asymmetrica Korshikov | + | |||||
| Chlamydomonas cf. reisiglii H. Ettl | + | + | + | |||
| Chlamydomonas spp. | + | + | + | |||
| Chlamydocapsa lobata Broady | + | + | ||||
| Chloromonas reticulata (Gorozh.) Gobi | + | + | ||||
| Chloroidium saccharophilum (W. Krüger) Darienko, Gustavs, Mudimu, Menendez, Schumann, Karsten, Friedl & Proschold | + | |||||
| Coelastrella terrestris (Reisigl) Hegewald & N. Hanagata | + | + | ||||
| Coenochloris signiensis (Broady) Hindák | + | |||||
| Dictyosphaerium chlorelloides (Nauman) Komárek & Perman | + | |||||
| Elliptochloris bilobata Tscherm.-Woess | + | |||||
| Elliptochloris subsphaerica (Reisigl) Ettl & Gärtner | + | + | + | + | + | |
| Mychonastes homosphaera (Skuja) Kalina & Puncoch. | + | |||||
| Myrmeciabisecta Reisigl | + | + | + | + | ||
| Myrmeciaincisa Reisigl | + | |||||
| Neocystis curvata (Broady) Kostikov, Darienko, Lukesová & L. Hoffm. | + | |||||
| Parietochloris bilobata (Vinatzer) V.M. Andreeva | + | + | ||||
| Pleurastrum terricola (Bristol) D.M. John | + | + | ||||
| Pseudococcomyxa cf. pringsheimii (Jaag) Kostikov, Darienko & L. Hoffm. | + | |||||
| Pseudococcomyxa simplex (Mainx) Fott | + | + | + | + | + | |
| Tetracystis tetraspora (Arce & Bold) R.M. Brown & Bold | + | |||||
| Trebouxia sp. | + | |||||
| Scenedesmus rubescens (P.J.L. Dang.) E.E. Kessler, M. Schäf., Hümmer, Kloboucek & V.Huss | + | + | ||||
| Sporotetras polydermatica (Kütz.) Kostikov, Darienko, Lukesová & L. Hoffm. | + | + | + | |||
| Streptophyta | ||||||
| Cosmarium spp. | + | |||||
| Cylindrocystis sp. | + | + | ||||
| Klebsormidium flaccidum (Kütz.) P.C. Silva, Mattox & W.H. Blackwell | + | + | ||||
| Mesotaenium macrococcum (Kütz. ex Kütz.) J. Roy & Bisset | + | |||||
| Mesotaenium sp. | + | + | + | + | ||
| Всего таксонов | 11 | 22 | 29 | 24 | 17 | 19 |
В пятнистых осоково-мохово-лишайниковых тундрах, расположенных выше по высотному градиенту, выявлено 34, а в пятнистых кустарничково-алекториевых – 43 вида водорослей. Состав водорослей, обнаруженных в БПК исследованных сообществ, довольно сходен. Отличия по числу видов и таксономическому составу альгогруппировок отмечены для корочек, формирующихся на разных стадиях зарастания пятен.
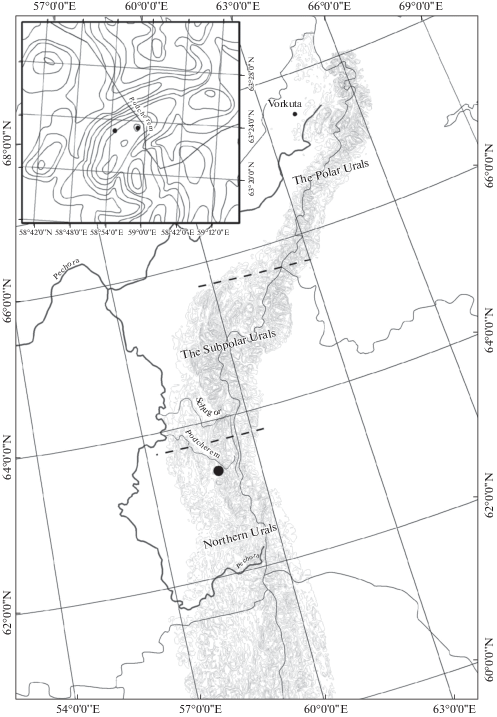
На оголенном грунте исследованных пятен выявлено от 11 до 24 видов (табл. 4). Это местообитание представляет собой открытый участок пятна, полностью лишенный растительности. Здесь создаются благоприятные условия для прорастания семян и спор, в том числе водорослей, вследствие отсутствия конкуренции. В суровых горно-тундровых условиях только небольшая часть из них прорастает и выживает. Среди водорослей это в основном широкораспространенные таксоны, которые формируют дисперсные разрастания на поверхности пятен. С высокой частотой встречаемости были отмечены виды-азотфиксаторы Anabaena sp., Scytonema hofmanii (рис. 3), которые благодаря способности связывать атмосферный азот, необходимый для жизнедеятельности организмов, создают благоприятные условия для развития других видов. В формировании альгогруппировок оголенных субстратов чаще других водорослей также участвовали виды из родов Bracteacoccus Tereg, Chlamydomonas и Leptolyngbya.
Рис. 3.
Водоросли, обитающие на поверхности голого грунта. 1 – Scytonema hofmanii, 2 – Bracteacoccus pseudominor, 3 – Anabaena sp., 4 – Chlamydomonas sp.
Fig. 3. Algae living on the surface of bare soils. 1 – Scytonema hofmanii, 2 – Bracteacoccus pseudominor, 3 – Anabaena sp., 4 – Chlamydomonas sp.
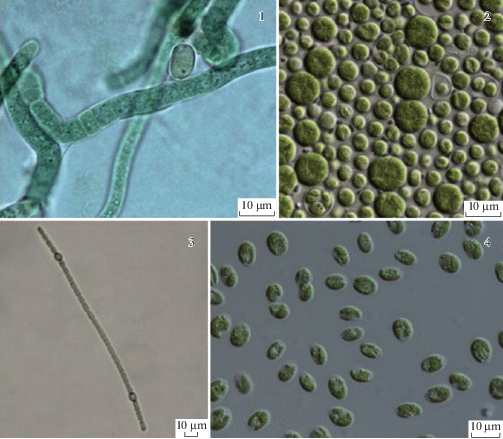
Серые, серо-коричневые корочки представляют собой переходную группу между голым грунтом и корочками черного цвета. На поверхности почвы формируются первичные корочки и биопленки. В них отмечено от 17 до 22 таксонов (табл. 4), преобладают по разнообразию представители порядка Nostocales. Ведущий комплекс видов сформирован: Aphanocapsa muscicola, Desmonostoc muscorum, Elliptochloris subsphaerica, Microcoleus paludosus, Myrmecia bisecta, Pseudococcomyxa simplex, Synechococcus elongatus, Tolypothrix tenuis и представителями рода Leptolyngbya (рис. 4).
Рис. 4.
Ведущий комплекс видов водорослей серых корочек. 1 – Microcoleus paludosus, 2 – Pseudococcomyxa simplex, 3 – Myrmecia bisecta, 4 – Elliptochloris subsphaerica.
Fig. 4. Leading complex of algal species forming gray crusts. 1 – Microcoleus paludosus, 2 – Pseudococcomyxa simplex, 3 – Myrmecia bisecta, 4 – Elliptochloris subsphaerica.
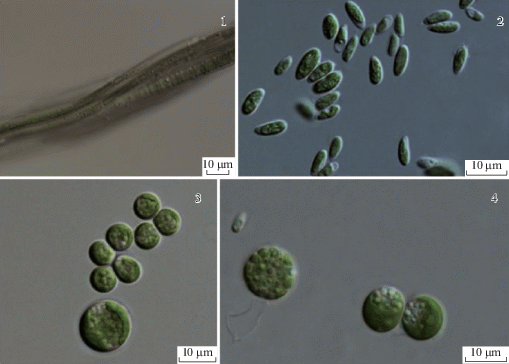
Черные корочки – хорошо сформированные сомкнутые БПК, где помимо водорослей присутствуют бактерии, лишайники, грибные гифы и протонема мхов. В черных корочках обнаружено от 19 до 29 видов (табл. 4). Массовыми видами для этого типа корочек являются: Aphanocapsa muscicola, Chlamydocapsa lobata, Elliptochloris subsphaerica, Microcoleus paludosus, Pseudococcomyxa simplex, Sporotetras polydermatica, Stigonema minutum, Tolypothrix tenuis, а также виды из родов Gloeocapsopsis Geitler ex Komárek и Mesotaenium Nägeli (рис. 5).
Рис. 5.
Ведущий комплекс видов водорослей корочек черного цвета. 1 – Stigonema minutum, 2 – Gloeocapsopsis dvorakii, 3 – Mesotaenium macrococcum, 4 – Tolypothrix tenuis.
Fig. 5. Leading complex of algal species forming black crusts. 1 – Stigonema minutum, 2 – Gloeocapsopsis dvorakii, 3 – Mesotaenium macrococcum, 4 – Tolypothrix tenuis.
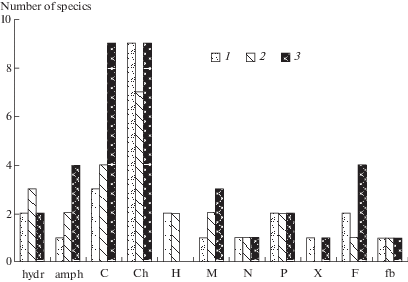
Во всех типах корочек превалируют космополитные эдафофильные виды с Ch- жизненной формой (рис. 6, 7). К этой форме относят устойчивые к неблагоприятным условиям водоросли, обитающие в толще почвы. Представители этой формы при благоприятных условиях способны разрастаться и на поверхности субстратов (Shtina, Hollerbach, 1976). В черных корочках увеличивается доля арктических, монтанных и арктомонтанных таксонов (рис. 6). Высокий процент здесь занимают виды с С-формой, которая объединяет теневыносливые одноклеточные, колониальные и нитчатые цианопрокариоты и водоросли, способные образовывать обильную слизь. Также возрастает число таксонов с М-формой, которая включает цианопрокариоты со слизистыми нитями, образующими макроскопические корочки или дерновинки на поверхности почвы. Эти виды отличаются устойчивостью к недостатку влаги в почве и сильным колебаниям температуры (рис. 7).
Рис. 6.
Распределение водорослей в разных типах корочек по географическим элементам: ab – арктобореальные, k – космополитные, b – бореальные, a – арктические, m – монтанные, am – арктомонтанные. 1 – голый грунт, 2 – корочки серого цвета, 3 – корочки черного цвета.
Fig. 6. Distribution of algae in different types of crusts by geographical preferences: ab – arcto-boreal, k – cosmopolite, b – boreal, a – arctic, m – mountain, am – arcto-mountain. 1 – bare soils, 2 – gray crusts, 3 – black crusts.
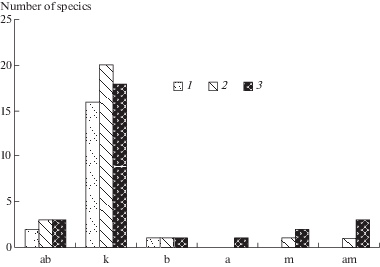
Рис. 7.
Распределение водорослей в разных типах корочек по экологическим группам: hydr – гидрофильные, amph – амфибиальные, C, Сh, H, M, N, P, Х-формы – эдафофильные (символ F обозначает способность видов формы к фиксации молекулярного азота), fb – фотобионты лишайников. 1 – голый грунт, 2 – корочки серого цвета, 3 – корочки черного цвета.
Fig. 7. Distribution of algae in the different types of crusts by ecological groups: hydr – hydrophilic, amph – amphi-bious and subaerophytic, C, Ch, H, M, N, P, X forms – edaphic algae (symbol F denotes the ability of species to fix molecular nitrogen), fb – photobionts of lichens. 1 – bare soils, 2 – gray crusts, 3 – black crusts.
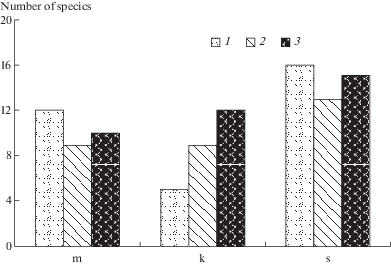
Степень зарастания пятен отражает соотношение в БПК видов с разной морфологической организацией талломов (рис. 8). На голом грунте и в корочках серого цвета преобладают коккоидные одноклеточные таксоны, доля многоклеточных и колониальных форм несколько ниже (рис. 8, 9). В хорошо сформированных черных корочках доминируют одноклеточные и колониальные виды, увеличивается доля азотфиксаторов и таксонов с многонитчатыми и разнонитчатыми талломами (рис. 7–9).
Рис. 8.
Распределение водорослей в разных типах корочек по морфологической организации таллома: c – коккоидная, f – нитчатая (mdf – разнонитчатая, mf – многонитчатая), m – монадная, s – сарциноидная. 1 – голый грунт, 2 – корочки серого цвета, 3 – корочки черного цвета.
Fig. 8. Distribution of algae in different types of crusts by morphological organization of thallus: c – coccoid, f – filamentous (mdf – morphologically different filaments, mf – multifilaments), m – monadic, s – sarcinoid. 1 – bare soils, 2 – gray crusts, 3 – black crusts.
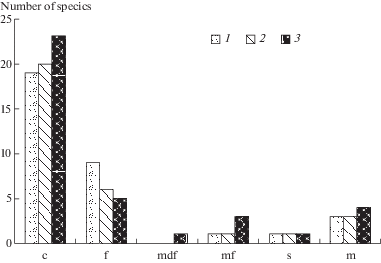
Рис. 9.
Распределение водорослей в разных типах корочек по уровню организации таллома: m – многоклеточные, k – колониальные, s – одноклеточные. 1 – голый грунт, 2 – корочки серого цвета, 3 – корочки черного цвета.
Fig. 9. Distribution of algae in different types of crusts by the level of the thallus organization: c – colonial, s – single-celled, m – multicellular. 1 – bare soils, 2 – gray crusts, 3 – black crusts.
Исследованные БПК можно охарактеризовать как достаточно хорошо сформированные сообщества со своеобразным видовым составом водорослей и комплексом доминантов, которые отражают определенную стадию зарастания пятна.
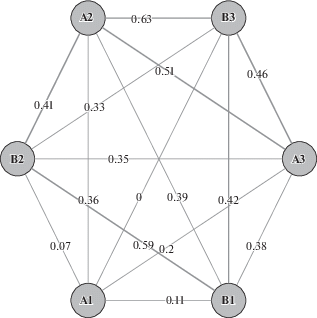
Анализ коэффициентов сходства флористического состава альгогруппировок изученных БПК показал, что наблюдается невысокое сходство между анализируемыми объектами (рис. 10). Наибольшие коэффициенты Серенсена отмечены для разных типов БПК (коэффициент сходства 42–59%), собранных из одного сообщества, а также для однотипных корочек из разных растительных группировок (41% для серых корочек, 46% – для черных). Формирование БПК определяется не только типом растительного сообщества, но и экологическими условиями местообитаний, основным из которых является влажность почвы. Известно, что этот фактор оказывает заметное влияние на скорость зарастания пятен и видовой состав водорослей (Patova et al., 2012; Borchhardt et al., 2017). В исследованных корочках с увеличением влажности субстратов растет и видовое разнообразие водорослей (табл. 3, 4).
Рис. 10.
Коэффициент сходства флористического состава водорослей, рассчитанный для разных типов корочек из пятнисто-кустарничково-лишайникового (А) и пятнисто-осоково-мохово-лишайникового сообществ (В), представленный в виде плеяды Терентьева. 1 – голый грунт, 2 – корочки серого цвета, 3 – корочки черного цвета.
Fig. 10. The similarity graph between algae communities of different soil crusts: from spotty-shrub-lichen (А) and spotty-sedge-moss-lichen communities (В) presented in the form of the Terentyev Pleiad. 1 – bare soils, 2 – gray crusts, 3 – black crusts.
ЗАКЛЮЧЕНИЕ
Получены первые сведения об особенностях зарастания пятен в горно-тундровых сообществах Северного Урала. Всего в БПК пятен выявлено 57 видов водорослей из пяти отделов, превалируют представители Cyanoprokaryota и Chlorophyta. Выявленное разнообразие относительно высокое и характерно для хорошо развитых сообществ водорослей БПК, в которых может произрастать более 100 видов (Sdobnikova, 1986; Schulz et al., 2016; Borchhardt et al., 2017). На основе проведенных исследований и анализа литературных источников (Sdobnikova, 1986; Patova et al., 2016; Williams et al., 2017; Patova et al., 2018) в зарастании оголенных субстратов тундровых и горно-тундровых сообществ можно выделить три стадии. На начальной стадии при заселении голого грунта наблюдаются рассеянные трудно различимые альгогруппировки. Одними из первых здесь поселяются азотфиксирующие виды цианопрокариот – Anabaena sp. и Scytonema hofmanii, а также одноклеточные зеленые и охрофитовые водоросли. Развитие водорослей постепенно приводит к формированию корочек серого и серо-коричневого цвета, основу которых образуют цианопрокариоты с нитчатой (Klebsormidium flaccidum, Microcoleus paludosus, Tolypothrix tenuis, виды родов Leptolyngbya, Leptosira Borzì, Phormidium) и колониальной (виды родов Aphanocapsa Nägeli, Gloeocapsopsis, Nostoc Vaucher ex Bornet & Flahault, Synechococcus Nägeli) формой таллома. Водоросли переплетаются с частицами почвы за счет слизистых выделений и закрепляются на поверхности субстрата (Shtina, Hollerbach, 1976). Далее идет частичное заселение БПК протонемой мха, слизистыми лишайниками и печеночниками (Sdobnikova, 1986), формируются плотные корочки черного цвета. На этой стадии в БПК в массе развиваются цианопрокариоты, образующие многотрихальные талломы (Fischerella muscicola, Stigonema minutum, S. ocellatum) и обильные слизистые агрегаты водорослей (Chlamydocapsa lobata, Sporotetras polydermatica и видов рода Mesotaenium). Специфика формирования альгогруппировок на пятнах-медальонах в разных типах горных тундр имеет сходные тенденции, при этом на изменчивость видового состава оказывает влияние влажность почвы и стадия зарастания пятна.
Список литературы
Andersen R.A. 2005. Algal Culturing Techniques. New York. 589 p.
[Andreeva] Андреева В.М. 1998. Почвенные и аэрофильные зеленые водоросли (Chlorophyta: Tetrasporales, Chlorococcales, Chlorosarcinales). СПб. 352 с.
[Andreeva, Chaplygina] Андреева В.М., Чаплыгина О.Я. 2007. Почвенные неподвижные зеленые микроводоросли (Chlorophyta) Полярного Урала. – Новости сист. низш. раст. 41: 15–18.
[Barinova et al.] Баринова С.С., Медведева Л.А., Анисимова О.В. 2006. Биоразнообразие водорослей-индикаторов окружающей среды. Тель-Авив. 498 с.
[Bioraznoobraziye] Биоразнообразие водных и наземных экосистем бассейна реки Кожым (северная часть национального парка “Югыд ва”). 2010. Сыктывкар. 192 с.
Borchhardt N., Baum C., Mikhailyuk T., Karsten U. 2017. Biological Soil Crusts of Arctic Svalbard – Water Availability as Potential Controlling Factor for Microalgal Biodiversity. – Front. Microbiol. 8: 1–12. https://doi.org/10.3389/fmicb.2017.01485
Borchhardt N., Schiefelbein U., Abarca N., Boy J., Mikhailyuk T., Sipman H.J.M., Karsten U. 2017. Diversity of algae and lichens in biological soil crusts of Ardley and King George islands, Antarctica. – Antarctic Science. 29 (3): 229–237. https://doi.org/10.1017/S0954102016000638
Büdel B., Darienko T., Deutschewitz K., Dojani S., Friedl T., Mohr K.I., Salisch M., Reisser W., Weber B. 2009. Southern African Biological Soil Crusts are Ubiquitous and Highly Diverse in Drylands, Being Restricted by Rainfall Frequency. – Microbial Ecology. 57: 229–247. https://doi.org/10.1007/s00248-008-9449-9
Davidov D., Patova E. 2018. The diversity of Cyanoprokaryota from freshwater and terrestrial habitats in the Eurasian Arctic and Hypoarctic. – Hydrobiologia. 811: 119–137. https://doi.org/10.1007/s10750-017-3400-3
Ettl H., Gärtner G. 2014. Syllabus der Boden-, Luft-und Flechtenalgen 2. Auflage. Berlin Heidelberg. 773 p.
[Getsen] Гецен М.В. 1985. Водоросли в экосистемах Крайнего Севера (на примере Большеземельской тундры). Л. 165 с.
Guiry M.D., Guiry G.M. 2019. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. http://www.algaebase.org (дата обращения: 25 марта 2019).
Karsten U., Holzinger A. 2014. Green algae in alpine biological soil crust communities: acclimation strategies against ultraviolet radiation and dehydration. – Biodivers Conserv. 23: 1845–1858. https://doi.org/10.1007/s10531-014-0653-2
Komárek J. 2013. Cyanoprokaryota III: Nostocales, Stigonematales / Süßwasserflora von Mitteleuropa. Berlin. Bd. 19/3. 1130 p.
Komárek J., Anagnostidis K. 1998. Cyanoprokaryota I. Teil: Chroococcales / Süßwasserflora von Mitteleuropa. Heidelberg, Berlin. Bd. 19/1. 548 p.
Komárek J., Anagnostidis K. 2005. Cyanoprokaryota II. Teil: Oscillatoriales / Süβwasserflora von Mitteleuropa. München. Bd. 19/2. 643 p.
[Novakovskaya, Patova] Новаковская И.В., Патова Е.Н. 2013. Цианопрокариоты и водоросли горно-тундровых почв северной оконечности Полярного Урала. – Бюллетень МОИП. Отделение биологии. 118 (5): 57–66.
[Novakovskaya et al.] Новаковская И.В., Патова Е.Н., Шабалина Ю.Н. 2012. Почвенные водоросли горно-тундровых сообществ Приполярного Урала (национальный парк “Югыд ва”). – Бот. журн. 97 (3): 305–320.
[Novakovkiy] Новаковский А.Б. 2016. Взаимодействие Excel и статистического пакета R для обработки данных в экологии. – Вестник ИБ Коми НЦ УрО РАН. 3: 26–33.
Patova E.N., Kulyugina E.E., Deneva S.V. 2016. Processes of natural soil and vegetation recovery on a worked-out open pit coal mine (Bolshezemelskaya tundra). – Russian Journal of Ecology. 47 (3): 228–233. .https://doi.org/10.1134/S1067413616020119
[Patova, Novakovskaya] Патова Е.Н., Новаковская И.В. 2018. Почвенные водоросли северо-востока европейской части России. – Новости сист. низш. раст. 52: 311–353. https://doi.org/10.31111/nsnr/2018.52.2.311
Patova E.N., Novakovskaya I.V., Deneva S.V. 2018. The Influence of Edaphic and Orographic Factors on Algal Diversity in Biological Soil Crusts on Bare Spots in the Polar and Subpolar Urals. – Eurasian Soil Science. 51 (3): 304–315. https://doi.org/10.1134/S1064229318030109
[Patova et al.] Патова Е.Н., Новаковская И.В., Сивков М.Д., Новаковский А.Б. 2012. Влияние экологических факторов на формирование альгогруппировок горно-тундровых почв (Приполярный Урал). – Теоретическая и прикладная экология. 2: 89–98.
[Patova et al.] Патова Е.Н., Новаковская И.В., Шабалина Ю.Н., Стенина А.С. 2016. Почвенные цианопрокариоты и эукариотные водоросли. – В кн.: Флоры, лихено- и микобиоты особо охраняемых ландшафтов бассейнов рек Косью и Большая Сыня (Приполярный Урал, национальный парк “Югыд ва”. Глава 5. Альгофлора. М. С. 317–349.
[Pochvy…] Почвы и почвенный покров Печоро-Илычского заповедника (Северный Урал). 2013. Сыктывкар. 328 с.
Schulz K., Mikhailyuk T., Dreßler M., Leinweber P., Karsten U. 2016. Biological Soil Crusts from Coastal Dunes at the Baltic Sea: Cyanobacterial and Algal Biodiversity and Related Soil Properties. – Microbial Ecology. 71 (1): 178–193. https://doi.org/10.1007/s00248-015-0691-7
[Sdobnikova] Сдобникова Н.В. 1986. Почвенные водоросли в южных тундрах Таймыра. – В кн.: Южные тундры Таймыра. Л. С. 68–79.
[Shtina, Hollerbach] Штина Э.А., Голлербах М.М. 1976. Экология почвенных водорослей. М. 144 с.
[Stenina et al.] Стенина А.С., Тетерюк Б.Ю., Патова Е.Н. 2001. Растительные сообщества прибрежных экотонов озера в долине р. Вангыр на Приполярном Урале. Ботанические исследования на охраняемых природных территориях Европейского Северо-Востока: Труды Коми научного центра УрО РАН. Сыктывкар. 165: 20–36.
Williams L., Borchhardt N., Colesie C., Baum C., Komsic-Buchmann K., Rippin M., Becker B., Karsten U., Büdel B. 2017. Biological soil crusts of Arctic Svalbard and of Livingston Island, Antarctica. – Polar Biol. 40 (2): 399–411. https://doi.org/10.1007/s00300-016-1967-1
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


