Ботанический журнал, 2019, T. 104, № 7, стр. 1001-1032
ФОРМИРОВАНИЕ СТЕНКИ МИКРОСПОРАНГИЯ ПЫЛЬНИКА И ТИПИЗАЦИЯ ТАПЕТУМА ПОКРЫТОСЕМЕННЫХ РАСТЕНИЙ
И. И. Шамров 1, 2, *, Г. М. Анисимова 2, А. А. Бабро 2
1 Российский государственный педагогический университет им. А.И. Герцена
191186 С.-Петербург, наб. р. Мойки, 48, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197376 С.-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: ivan.shamrov@gmail.com
Поступила в редакцию 20.05.2019
После доработки 27.06.2019
Принята к публикации 02.07.2019
Аннотация
В эмбриологии цветковых растений, в том числе при изучении строения и развития пыльника, существует комплекс нерешенных проблем. Они касаются, прежде всего, начальных стадий заложения микроспорангия и времени дифференциации археспория. Проведенный анализ показал, что от инициации спорангия до обособления археспория в субэпидермальном слое происходит серия процессов. Археспорий появляется лишь после того, как закончится отделение слоев стенки спорангия с его внутренней и латеральных сторон. Париетальное происхождение имеют только слои стенки микроспорангия с наружной стороны после образования спорогенных клеток из археспория. Некоторые выделенные типы формирования стенки микроспорангия являются спорными и подлежат уточнению.
Подтверждена существующая точка зрения о сопряженности в развитии эндотеция и тапетума. Рассмотрены различные классификации типов и вариаций тапетума. Обсуждены понятия, которые используются при этом. Предлагается различать 2 типа тапетума: париетальный (тапетум выстилает полость микроспорангия и такое положение сохраняется в ходе всего развития) и периплазмодиальный (образование ценоцитной структуры в результате слияния протопластов, при этом цитоплазма и ядра располагаются не только между развивающимися микроспорами и пыльцевыми зернами, но и контактируют с внутренними слоями полости). Различия между ними касаются особенностей структурно-временной реорганизации в посттетрадный период развития пыльника. Париетальному тапетуму присуща структурная реорганизация. Протопласты, образующиеся после исчезновения клеточных стенок, постепенно разрушаются либо образуют выпячивания внутрь полости микроспорангия (вариация “амебоидный тапетум”), либо отдельные протопласты сливаются (вариация “окаймляющий симпласт”). Во всех случаях тапетум сохраняет пристенное положение. В периплазмодиальном типе реорганизация затрагивает преимущественно временные параметры. Критерием для разграничения вариаций является время объединения и внедрения протопластов в полость микроспорангия.
Пыльник, входящий в состав тычинки покрытосеменных растений, изучен достаточно подробно. Некоторые его особенности, выявленные в ходе сравнительно-эмбриологических исследований, используются при решении спорных вопросов систематики и филогении. Среди них, прежде всего, типы формирования стенки микроспорангия, микроспорогенеза и формирования тетрад микроспор, строение сформированной и зрелой стенки микроспорангия, особенно эндотеция и тапетума, а также зрелого пыльцевого зерна. К настоящему времени накопился ряд эмбриологических проблем, которые не позволяют в полной мере оценить значимость многих признаков мужской репродуктивной сферы. Имеющиеся литературные данные требуют систематизации и переосмысления. Именно поэтому был проведен анализ дискуссионных проблем при изучении пыльника.
Количество тычинок, составляющих андроцей, может быть различным и часто связано с мерностью элементов цветка. Тычинка состоит из тычиночной нити и пыльника, который у многих растений 4-гнездный. Внутри тычиночной нити и связника проходит проводящий пучок. У Rhododendron в ходе морфогенеза происходит инверсия пыльника, в результате чего его апикальная часть ориентирована вниз, базальная – вверх, при этом в связнике видны две части одного дуговидного проводящего пучка (рис. 1, 1–3). Согласно наиболее распространенной точке зрения, тычинки развились из микроспорофиллов в результате значительной редукции. Исходными считаются тычинки, обнаруживающие в своем строении признаки листа. Подобные тычинки обнаружены у Nuphar lutea из сем. Nymphaeaceae (Шамров, 2015). Интрорзные пыльники у этого растения располагаются на листовидных тычиночных нитях. В направлении от околоцветника к гинецею уменьшается ширина связника, микроспорангии заворачиваются внутрь, меняя ориентации мест вскрывания от лартрозного до интрозного. В самых наружных тычинках микроспорангии могут иметь различную длину, содержать только 2 стерильных гнезда (одно гнездо в каждой теке) или пыльники вообще не формируются. Проводящие пучки имеются не только в связнике, но и в каждой теке (рис. 2, 1–4).
Рис. 1.
Андроцей и строение тычинки у Rhododendron schlippenbachii (Ericaceae).
1 – тычинки с разной длиной тычиночных нитей в цветке перед опылением; 2, 3 – инверсия пыльника, в результате чего его апикальная часть ориентирована вниз, а базальная – вверх (2), в связнике видны 2 среза одного проводящего пучка (3). an – пыльник, l sn – нижняя тычинка, m sn – средняя тычинка, sl – столбик, tc – тека, u sn – верхняя тычинка, v b – проводящий пучок.
Fig. 1. Androecium and stamen structure in Rhododendron schlippenbachii (Ericaceae).
1 – stamens with filaments of various length in flower before pollination; 2, 3 – anther inversion resulting in its apical part being directed down, and its basal part being turned up (2), and 2 sections of the same vascular bundle are seen in connective (3). an – anther, l sn – lower stamen, m sn – middle stamen, sl – style, tc – theca, u sn – upper stamen, v b – vascular bundle.
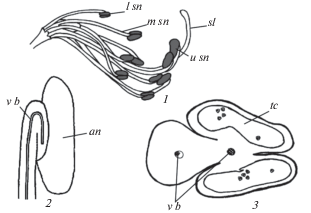
Рис. 2.
Строение пыльников Nuphar lutea (Nymphaeaceae).
1–4 – микроспорангии располагаются на листовидных тычиночных нитях: от околоцветника к гинецею уменьшается ширина связника, микроспорангии заворачиваются внутрь, меняя ориентацию мест вскрывания от лартрорзного (1–3) до интрозного (4); проводящие пучки имеются не только в связнике, но и каждой теке. cn – связник, mc – микроспорангий, v b – проводящий пучок.
Fig. 2. Anther structure in Nuphar lutea (Nymphaeaceae).
1–4 – microsporangia are located at leaf-like filaments: from perianth to gynoecium the connective width decreases, microsporangia involute, changing their dehiscence from lartrorse (1–3) to introrse (4); vascular bundles are found in both connective and each theca. cn – connective, mc – microsporangium, v b – vascular bundle.
Формирование слоев стенки микроспорангия. Важное значение для формирования тетрад гаплоидных микроспор и мужских гаметофитов (пыльцевых зерен) имеет стенка микроспорангия. В ходе развития происходят изменения в ее строении сопряженно с процессами микроспорогенеза и микрогаметогенеза. Выделены 3 стадии ее формирования (Shamrov, 2015). Первая стадия – возникновение и дифференциация слоев стенки микроспорангия (от археспория до спорогенной ткани). Вторая стадия – окончательное формирование стенки микроспорангия (микроспороциты перед мейозом или в начале мейоза); характеристика ее слоев: эпидерма, эндотеций, средние слои, тапетум (сформированная стенка микроспорангия). Третья стадия – преобразование слоев стенки микроспорангия (образование тетрад микроспор и созревание пыльцевых зерен); характеристика слоев: эпидерма, эндотеций с фиброзными утолщениями или без них (зрелая стенка микроспорангия). Стадии формирования стенки микроспорангия совпадают с премейотическим, мейотическим и постмейотическим периодами в развитии пыльника (Kamelina, 1981).
В литературе дискутируется вопрос о том, как формируются слои стенки микроспорангия. Обычно считают, что с дистальной стороны (противоположной связнику) ее слои возникают за счет деятельности клеток археспория, которые дифференцируются в субэпидермальном слое каждого микроспорангия. С боков и внутренней стороны слои образуются из клеток меристемы связника (Davis, 1966). Именно на этом основании были выделены наружный и внутренний сегменты тапетума (Periasamy, Swamy, 1966). У Anemone rivularis (Ranunculaceae), по мнению N. Bhandari (1968), доказано формирование тапетума из ткани связника с внутренней стороны микроспорангия, поскольку он возникает раньше, чем наружный тапетум и характеризуется иным строением. У Coleus scutellarioides (Lamiaceae) и Berberis vulgaris (Berberidaceae) наружный тапетум формируется из париетальных клеток, а внутренний – из клеток, прилегающих к вторичному археспорию (спорогенным клеткам) (Budell, 1964). Почти также объясняют возникновение тапетума у Helianthus ciliaris и H. tuberosus (Asteraceae). С внутренней стороны слои стенки микроспорангия формируются из париетального слоя, располагающегося под спорогенными клетками (Babro, Voronova, 2018). Другие исследователи описывают сначала деление инициальной клетки в субэпидермальном слое микроспорангия, приводящее к образованию археспориальной и лежащей под ней париетальной клеток. Деление археспориальной клетки приводит к формированию над ней также париетальной клетки, а в дальнейшем париетального слоя, из которого и образуется стенка микроспорангия с наружной стороны (Torshilova, Batygina, 2005). По мнению ряда авторов (Carniel, 1961; Batygina et al., 1963; Bhandari, Khosla, 1982), вся стенка микроспорангия, в частности тапетум, имеет париетальное происхождение.
Первая классификация типов формирования стенки микроспорангия с наружной стороны была предложена Т.Б. Батыгиной с соавторами (Batygina et al., 1963). Используя представления E. Warming (1873) о двух способах возникновения слоев стенки микроспорангия, были выделены 2 типа ее формирования из клеток первичного археспория: Solanaceae (центробежный способ) и Umbelliferae (центростремительный способ). Carniel (1961) в дальнейшем подтвердил центростремительную последовательность формирования слоев в стенке микроспорангия Zea mays. Два других типа (Poaceae и Ericaceae) из этой классификации выделены на основании того, что тапетум образуется из производных клеток вторичного археспория. В связи с тем, что у большинства изученных таксонов цветковых растений стенка микроспорангия образуется из париетального слоя, вопрос о возможности формирования тапетума из вторичного археспория остается до сих пор дискуссионным. В дальнейшем эти типы не были включены в систему типов развития стенки микроспорангия (Teryokhin et al., 1993).
В литературе широко используется классификация G. Davis (1966). В зависимости от направленности делений клеток двух исходных париетальных слоев (их называют по-разному: исходный слой, возникающий на базе археспория – первичный париетальный, а его производные – вторичные париетальные; наружный и внутренний париетальные слои) и времени дифференциации тапетума в стенке микроспорангия выделяют 4 типа. К ним относятся: основной (клетки обоих париетальных слоев делятся почти синхронно и образуют все слои стенки, кроме эпидермы), двудольный (клетки внутреннего париетального слоя дифференцируются в тапетум, а наружного – делятся многократно и образуют эндотеций и средние слои), однодольный (клетки наружного париетального слоя дифференцируются в эндотеций, а за счет деления клеток внутреннего париетального слоя образуются средние слои и тапетум) и редуцированный (внутренний париетальный слой образует тапетум, а наружный – эндотеций). Основной тип, по данным этого автора, описан в 9 семействах, а двудольный – в 43 семействах двудольных, однодольный – в 26 (10 однодольных и 16 двудольных), редуцированный – в двух семействах однодольных. О.П. Камелина (Kamelina, 1991) приводит уточненные данные на момент их анализа. По ее мнению, среди 132 семейств двудольных обнаружены 3 типа формирования стенки микроспорангия: двудольный (81), основной (36), однодольный (15); среди 33 семейств однодольных – однодольный (29), двудольный (2), редуцированный (2). Таким образом, типы двудольных и однодольных строго не приурочены к классам покрытосеменных растений. Среди типов только двудольным присущ основной, а однодольным – редуцированный (Kamelina, 2009). Но и эти данные не являются окончательными. Многие семейства цветковых растений остаются эмбриологически неисследованными. С другой стороны, изучение пыльника, как и многих других эмбриональных структур, превратилось лишь в составление характеристик для целей систематики, решения проблем биологии развития. Подробные исследования по генезису структур стали редкими и не всегда точными. Так, для объяснения направлений эволюции диэции у трех видов Echinocereus (Cactaceae) приводятся две иллюстрации, которые, по мнению авторов (Hernández-Cruz et al., 2018), свидетельствуют об однодольном типе формирования стенки микроспорангия. Однако на приведенных фотографиях хорошо видно, что первым в стенке дифференцируется тапетум, а затем средний слой и эндотеций, т.е. стенка микроспорангия развивается по двудольному типу. В классификации Davis (1966) очень спорными являются основной и редуцированный типы. При обосновании основного типа очень важно выявить синхронные деления в обоих париетальных слоях, но они крайне редки. Редуцированный тип описан у небольшого числа таксонов. По мнению Davis, он присущ видам семейств Lemnaceae и Najadaceae. Анализ литературных данных свидетельствует о том, что у видов сем. Lemnaceae (Wolffia microscopica – Maheshwari, 1954; Lemna paucicostata – Maheshwari, Kapil, 1963) клетки париетального слоя делятся только один раз. Возникают два слоя – эндотеций и тапетум. У L. gibba и L. trisulca (Lodkina, 1971) и Najas lacerata (Najadaceae – Swamy, Lakshmanan, 1962) в стенке микроспорангия формируется также средний слой, образующийся при делении внутреннего париетального слоя, т.е. у этих видов не редуцированный, а однодольный тип формирования слоев стенки микроспорангия.
Согласно другой классификации (Teryokhin et al., 1993, 2002) все разнообразие типов формирования стенки микроспорангия сведено к двум: центростремительному и центробежному. В центростремительном типе выделены 3 вариации: типовая (однодольный тип, по Davis, 1966), компликатная (основной тип, по Davis, 1966) и пролонгированная (многократные деления клеток внутреннего париетального слоя и более поздняя дифференциация тапетума). В центробежном типе также возможны 3 вариации: типовая (двудольный тип, по Davis, 1966), компликатная (многократные деления клеток наружного париетального слоя) и редуцированная (редуцированный тип, по Davis, 1966). Распределение типов среди цветковых растений, в работе, к сожалению, не показано. В связи с тем, что у большинства изученных таксонов цветковых растений стенка микроспорангия образуется из париетального слоя, вопрос о возможности формирования тапетума из вторичного археспория остается дискуссионным. Естественность вхождения основного типа в составе компликатной вариации в центростремительный тип особенно обнаруживается при анализе формирования стенки микроспорангия у Begonia manicata (Begoniaceae). Тип формирования стенки микроспорангия охарактеризован автором (Anisimova, 1983) как основной. На представленных иллюстрациях хорошо видно, что клетки наружного париетального слоя уже поделились и образовались 2 субэпидермальных слоя, а клетки внутреннего париетального слоя только делятся. Дифференциация клеток тапетума еще не произошла. Тапетум возникает самым последним в стенке микроспорангия, что позволяет интерпретировать его тип развития как центростремительный. Об этом свидетельствуют, например, данные по формированию стенки микроспорангия у Zannichellia pedunculata (Zannichelliaceae) (Kamelina, Teryokhin, 1990). У этого вида клетки внутреннего париетального слоя делятся периклинально, отделяя средний слой и тапетум, как при типовой вариации центростремительного типа. Средний слой разрушается на начальных стадиях микроспорогенеза и часто не учитывается при характеристике сформированной стенки микроспорангия. Следовательно, формирование стенки микроспорангия является центростремительным, а не центробежным. Проведенный анализ имеющихся данных свидетельствует о том, что основной и редуцированный типы (в соответствии с представлениями Davis), являются измененными вариантами центростремительного типа. Принадлежность основного типа в качестве копликатной вариации центростремительного типа вполне понятна, исходя из особенностей генезиса слоев микроспорангия. Что касается редуцированного типа, то отсутствие в стенке микроспорангия среднего слоя у одних видов, его наличие у других или непостоянство этого признака в пределах родственных Lemnaceae, Najadaceae, Zannichelliaceae и других семейств пор. Najadales c эфемерным средним слоем (Aponogetonaceae, Potamogetonaceae, Ruppiaceae, Scheuchzeriaceae) свидетельствует о тенденции к сокращению числа слоев у этих растений, что, возможно, возникло в ходе адаптации к водному образу жизни.
Следует отметить, что Е.Л. Кордюм (Kordyum, 1978) также называет двудольный тип центробежным, а однодольный – центростремительным. Вариации в типах этим автором не выделяются. Кроме того, она считает, как и Davis (1966), что все типы являются производными основного типа. С этим трудно согласиться. Поскольку синхронные деления в обоих париетальных слоях крайне редки, без выявления последовательности формирования производных слоев однодольный тип можно принять за основной. В обоих типах последним дифференцируется тапетум.
Считается, что на уровне семейств может быть только один тип формирования стенки микроспорангия (Davis, 1966). Однако изучение большого числа представителей сем. Solanaceae показало, что этот процесс представляет собой комбинацию разных последовательностей делений клеток париетальных слоев и их производных. На основании этого выявлены возможные сочетания типов (Garcia, 2003).
В значительной степени проблема возникновения слоев стенки микроспорангия сопряжена с использованием термина “археспорий”. В субэпидермальном слое формирующегося зачатка спорангия на ранних стадиях по строению выделяются клетки с более плотной цитоплазмой и крупным ядром (Warming, 1873, 1878). Эти клетки было предложено называть “археспорием” (греч. arche – начало и sporá – семя, спора) (Goebel, 1880, 1881). Стадия развития спорангия, на которой происходит дифференциация археспория, этими авторами и многими последующими исследователями не учитывалась. Все это привело к тому, что во многих работах понятия “археспорий” и “инициаль спорангия” стали отождествляться. Часто клетки, которые первыми дифференцируются в углах формирующихся микроспорангиев пыльника или примордия семязачатка, называют археспорием.
Решению этой проблемы может помочь анализ возникновения археспориальных клеток у высших растений. Их образование начинается довольно рано и происходит в особых органах спороношения – спорангиях. Формирование спорангиев может происходить двумя путями: лептоспорангиатным (из одной инициальной клетки) и эуспорангиатным (за счет нескольких инициальных клеток). Разделение спорангиев на 2 типа предложил K. Goebel (1881). У споровых растений (Bryophyta, Pteridophyta) спорангии имеют эпидермальное происхождение (из одной клетки – Osmundaceae, Marsileaceae, Polypodiaceae, некоторые Bryophyta; стенка спорангия представлена эпидермальным слоем; из нескольких инициальных клеток – Equisetaceae, Isoētaceae, Lycopodiaceae, Psilotaceae – стенка спорангия многослойная), эпидермальное либо субэпидермальное у Gymnospermae, субэпидермальное у Angiospermae (Shamrov, 2008b).
Анализируя развитие спорангия по лептоспорангиатному типу, можно сделать заключение, что от инициали спорангия до дифференциации археспория идут многочисленные деления клеток и происходит серия процессов, приводящих к формированию стенки спорангия. Археспорий в субэпидермальном слое спорангия появляется после того, как закончится отделение слоев стенки спорангия с его внутренней и латеральных сторон. Только после этого археспориальная клетка делится с образованием спорогенной (внутрь) и тапетальных, или париетальных (наружу) клеток. При формировании спорангия по эуспорангиатному типу в эпидерме создается комплекс инициальных клеток спорангия. Латеральные и внутренние клетки, занимающие разное положение внутри этого комплекса, образуют латеральную и внутреннюю часть спорангия. При делении археспория внутрь возникают спорогенные клетки и наружу отделяются эпидермальные клетки, из которых в дальнейшем создается многослойная внешняя часть стенки спорангия (Bower, 1935; Smith, 1938; Camefort et al., 1997). Следует отметить, что в границах наружного слоя создается комплекс клеток, имеющих эпидермальное происхождение, при этом влияние субэпидермальных и нижележащих клеток на его становление обычно не обсуждается.
Формирование микро- и мегаспорангиев семенных растений характеризуется наличием общих черт. В спорангиях, характеризующихся эпидермальным либо субэпидермальным происхождением у голосеменных растений (Brunkener, 1973), субэпидермальным – у покрытосеменных растений (Shamrov, 2008a, b) сначала возникают инициали всего спорангия. У цветковых растений за счет дифференцирующих делений центральных инициалей в мегаспорангии (нуцеллусе) первыми отделяются производные внутренней области (она преобразуется в базальную зону нуцеллуса), а наружу – клетки археспория. В результате деления латеральных инициалей формируется латеральная зона нуцеллуса. Археспориальные клетки (обычно в крассинуцеллятных семязачатках) также претерпевают деления на париетальные клетки наружу и спорогенные – внутрь. В формирующихся тенуинуцеллятных семязачатках, нуцеллус которых представлен только эпидермальным слоем, инициали без делений преобразуются в спорогенные клетки и в дальнейшем в мегаспороциты.
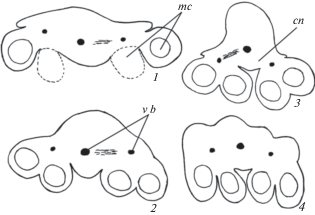
При формировании микроспорангия у покрытосеменных растений из разных семейств однодольных и двудольных в субэпидермальном слое дифференцируется группа инициальных клеток (центральная и латеральные), которые образуют как слои стенки микроспорангия, так и сам археспорий (Shamrov, 2006; Shamrov, Babro, 2008; Anisimova, 2016, 2019). После периклинального деления центральной субэпидермальной клетки наружу отделяется археспориальная клетка, а внутрь – клетка, из которой формируется проксимальная (ближайшая к связнику) часть стенки микроспорангия. Латеральные субэпидермальные инициальные клетки за счет делений образуют латеральные части стенки микроспорангия. В результате периклинальных делений археспориальных клеток возникают наружный (париетальные клетки) и внутренний (спорогенные клетки) слои. Клетки париетального слоя делятся периклинальными и антиклинальными делениями, в результате чего образуются слои, входящие в состав дистальной части стенки микроспорангиев (рис. 3, 1–8). Спорогенные клетки претерпевают ряд делений и превращаются в микроспороциты, или материнские клетки микроспор.
Рис. 3.
Начальные стадии формирования микроспорангия.
1–4 – Allium caspium (Alliaceae), 5–8 – Rhododendron schlippenbachii (Ericaceae). an – пыльник, a c – археспориальная клетка, i c mc – инициальные клетки микроспорангия, i i w mc – инициали проксимальной (внутренней) части микроспорангия, i w mc – проксимальная (внутренняя) часть микроспорангия, l i w mc – инициали латеральной части стенки микроспорангия, l w mc – латеральная часть стенки микроспорангия, o i w mc – инициали дистальной (наружной) части стенки микроспорангия, o w mc – дистальная (наружняя) часть стенки микроспорангия, p c – париетальная клетка, s c – спорогенная клетка.
Fig. 3. Early stages of microsporangium formation.
1–4 – Allium caspium (Alliaceae), 5–8 – Rhododendron schlippenbachii (Ericaceae). an – anther, a c – archesporial cell, i c mc – initial cells of microsporangium, i i w mc – inner initials of microsporangium wall, i w mc – inner part of microsporangium wall, l i w mc – lateral initials of microsporangium wall, l w mc – lateral part of microsporangium wall, o i w mc – outer initials of microsporangium wall, o w mc – outer part of microsporangium wall, p c – parietal cell, s c – sporogenous cell.

Таким образом, на основании приведенных аргументов трудно согласиться с точкой зрения о париетальном происхождении слоев стенки микроспорангия со всех его сторон. Париетальный слой не может возникнуть с боков и со стороны связника. Париетальными называют клетки, слои, ткани, возникающие при делении археспориальных клеток. Причем это относится не только к мужской, но и женской репродуктивной сфере. Визуально по характеру клеток (более густоплазменные) париетальная ткань хорошо выделяется в нуцеллусе крассинуцеллятного семязачатка. Она в форме сегмента простирается от эпидермы до мегаспороцита (или мегаспороцитов, если их несколько), а затем зародышевого мешка. Число слоев такой ткани зависит от массивности нуцеллуса, но ее ширина составляет в среднем 3–5 клеток у Paeonia lactiflora (Paeoniaceae), 3–7 у Ceratophyllum demersum (Ceratophyllaceae) (Shamrov, 2008а). Подобным образом можно идентифицировать париетальную ткань, составляющую дистальную часть стенки микроспорангия у Datisca cannabina (Datiscaceae) (Kamelina, 1983), Acer rufinerve (Aceraceae) (Alimova, 1985). Именно на особенностях формирования слоев париетальной ткани и были разработаны многие классификации типов формирования стенки микроспорангия.
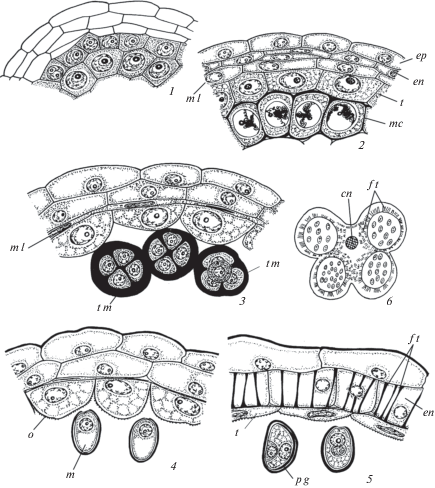
Характеристика слоев стенки микроспорангия. Слои стенки микроспорангия различаются не только особенностями генезиса, но и структурными характеристиками. Каждый слой отличается по строению клеток и выполняет определенную функцию (Dafni, 2000; Quilichini et al., 2014). Клетки эпидермы варьируют по размерам и выполняют разные функции: защитную функцию, обеспечивают газообмен и транспирацию, а также играют роль в привлечении опылителей (Goldberg et al., 1993; Rezanejad, 2008). Часто они вытягиваются, мелкие вакуоли объединяются в одну вакуоль, оттесняя ядро к периферии. Наружная тангентальная стенка утолщается и покрывается кутикулой (рис. 4, 1–5; 5, 1, 2).
Рис. 4.
Дифференциация и специализация клеток слоев стенки микроспорангия у Allium caspium (Alliaceae).
1 – стадия спорогенной ткани, 2 – микроспороциты в начале мейоза, 3 – тетрады микроспор, 4 – вакуолизированные микроспоры, 5 – зрелые пыльцевые зерна, 6 – схема пыльника перед вскрыванием. cn – связник, en – эндотеций, ep – эпидерма, f t – фиброзные утолщения, m – микроспора, mc – микроспороцит, m l – средний слой, o – орбикулы на тапетальной мембране, p g – пыльцевое зерно, t – тапетум, t m – тетрада микроспор.
Fig. 4. Cell differentiation and specialization of microsporangium wall layers in Allium caspium (Alliaceae).
1 – sporogenous tissue stage, 2 – microsporocytes at meiosis beginning, 3 – microspore tetrads, 4 – vacuolized microspores, 5 – mature pollen grains, 6 – scheme of anther before dehiscence. cn – connective, en – endothecium, ep – epidermis, f t – fibrous thickenings, m – microspore, mc – microsporocyte, m l – middle layer, o – orbicules on tapetal membrane, p g – pollen grain, t – tapetum, t m – microspore tetrad.
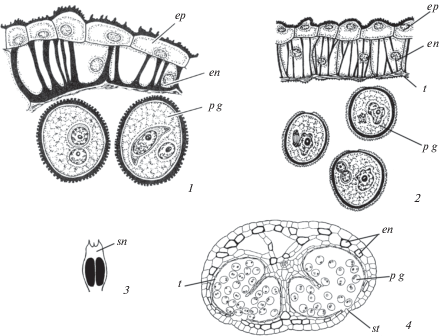
Слой клеток, лежащий непосредственно под эпидермой, т.е. самый наружный из слоев, возникающих в результате деления париетальных клеток, образует эндотеций, достигающий наибольшего развития к моменту высыпания пыльцы из пыльников (рис. 5, 1, 2). Более подробно его строение рассмотрим в связи с функционированием тапетума. Под эндотецием располагаются один и более средних слоев, состоящих из некрупных клеток, которые разрушаются, как правило, после завершения мейоза в материнских клетках микроспор. В ходе развития в клетках средних слоев может накапливаться транзиторный крахмал (Clement, Pacini, 2001).
Рис. 5.
Строение зрелого пыльника.
1, 2 – стенка зрелого пыльника у Gagea stipitata из сем. Liliaceae (1) и Hemerocallis citrina из сем. Hemerocallidaceae (2), в эндотеции фиброзные утолщения; 3, 4 – тычинка (3) и пыльник (4) Ceratophyllum platyacanthum из сем. Ceratophyllaceae, в эндотеции отсутствуют фиброзные пояски, утолщаются оболочки лишь отдельных клеток. en – эндотеций, ep – эпидерма, p g – пыльцевое зерно, sn – тычинка, st – стомиум, t – тапетум.
Fig. 5. Structure of mature anther.
1, 2 – wall of mature anther in Gagea stipitata, Liliaceae (1) and Hemerocallis citrina, Hemerocallidaceae (2), there are fibrous thickenings in endothecium; 3, 4 – stamen (3) and anther (4) of Ceratophyllum platyacanthum, Ceratophyllaceae, fibrous thickenings in endothecium are missing, only walls of separate cells are thickened. en – endothecium, ep – epidermis, p g – pollen grain, sn – stamen, st – stomium, t – tapetum.
Важную роль при формировании пыльника выполняет самый внутренний слой стенки микроспорангия – тапетум, или выстилающий слой. Его клетки часто имеют таблитчатую форму, заполнены плотной цитоплазмой и содержат одно, а иногда несколько ядер. Тапетум бывает гомоморфным (клетки сходны по строению) и гетероморфным (клетки со стороны связника часто крупнее, папилловидные, а число слоев может быть больше) (Kamelina, 1981, 2009). Главной функцией тапетальной ткани является снабжение микроспороцитов, формирующихся микроспор и пыльцевых зерен питательными веществами, среди которых важную роль играют полисахариды, ферменты, гормоны, накапливающиеся внутри полости микроспорангия (Pacini, 2010).
У некоторых растений (Gentianaceae) в премейотический и мейотический периоды развития в пыльниках возникают специфические перегородки, или трабекулы, которые проходят через полость гнезд и разделяют спорогенную ткань, а затем и микроспороциты на группы клеток. Природа трабекул обсуждается в литературе. Существуют две точки зрения: 1) трабекулы, как и тапетум, имеют спорогенное происхождение, 2) трабекулы представляют собой клетки тапетума, разрастающиеся внутрь гнезд пыльника (список работ см. Shamrov, 1986). Одним из авторов настоящей статьи подтверждается тапетальное происхождение трабекул (Shamrov, 1988). У Gentiana lutea и Swertia iberica в стенке формирующегося микроспорангия сначала формируется тапетум с внутренней стороны, а затем с латеральных сторон и из париетального слоя, возникшего в результате периклинальных делений археспориальных клеток. Особенностью развития пыльника этих видов является дугообразное расположение спорогенных клеток, при этом внутренний тапетум оказывается внутри дуги и подходит близко к наружному тапетуму. Это приводит к их смыканию и образованию в дальнейшем септированности гнезд. Возникшие трабекулы проходят радиально через полость гнезда и разделяют единую спорогенную ткань на комплексы клеток. В ходе развития клетки трабекул и тапетум разрушаются и сохраняются до стадии 2-клеточных пыльцевых зерен (зрелая пыльца – 3-клеточная). Первыми разрушаются клетки внутреннего тапетума, затем трабекулы и последними – клетки латерального и наружного тапетума (рис. 6, 1–13). Анализ литературы позволяет предположить формирование септ в пыльнике для других растений: Berberis vulgaris (Berberidaceae) (Budell, 1964), некоторых видов семейств Balsaminaceae и Onagraceae (Venkateswarlu, Lakshminarayana, 1957; Steffen, Landmann, 1958; Narayana, 1963).
Рис. 6.
Строение и развитие пыльника с трабекулами у Gentiana lutea (Gentianaceae).
1–7 – формирование стенки микроспорангия и трабекул на стадиях от археспория до микроспороцитов, 1, 6 – схемы пыльника;
Fig. 6. Structure and development of anther with trabeculae in Gentiana lutea (Gentianaceae).
1–7 – formation of microsporangium wall and trabeculae at the stages from archesporium to microsporocytes, 1, 6 – schemes of anther;
Рис. 6. Строение и развитие пыльника с трабекулами у Gentiana lutea (Gentianaceae) (продолжение).
8 – строение слоев стенки и трабекул на стадии тетрад микроспор, 9–11 – исчезновение клеточных стенок в тапетуме и изменения в его строении на стадиях вакуолизированных микроспор и 2-клеточных пыльцевых зерен, 12 – схема пыльника перед вскрыванием, 13 – стенка зрелого пыльника в области стомиума, 14–18 – стадии микроспорогенеза и образования тетрад микроспор. en – эндотеций, ep – эпидерма, f t – фиброзные утолщения, i t – внутренний тапетум, l t – латеральный тапетум, m – микроспора, mc – микроспороцит, m l – средний слой, o t – наружный тапетум, p g – пыльцевое зерно, st – стомиум, t – тапетум, t m – тетрада микроспор, tr – трабекула.
Fig. 6 (continued). Structure and development of anther with trabeculae in Gentiana lutea (Gentianaceae).
8 – structure of wall layers and trabeculae at the stage of tetrad microspore, 9–11 – disappearance of cell walls in tapetum and changes in its structure at the stages of vacuolized microspores and 2-celled pollen grains, 12 – scheme of anther before dehiscence, 13 – wall of mature anther in stomium area, 14–18 – stages of microsporogenesis and tetrad microspore formation. en – endothecium, ep – epidermis, f t – fibrous thickenings, i t – inner tapetum, l t – lateral tapetum, m – microspore, mc – microsporocyte, m l – middle layer, o t – outer tapetum, p g – pollen grain, st – stomium, t – tapetum, t m – tetrad microspore, tr – trabecula.


Одной из важных функций тапетума является секреция его клетками различных веществ: фермента каллазы для растворения каллозных оболочек вокруг тетрад микроспор; предшественников спорополленина экзины и орбикул (телец Убиша), которые обычно располагаются на внутренней мембране и контактируют с развивающимися пыльцевыми зернами; липидов и каротиноидов, входящих в состав полленкита; смеси гидрофобных и гидрофильных соединений, участвующих в образовании трифины (полленкит и трифина способствуют опылению насекомыми) (El-Ghazaly, 2002). Орбикулы представляют собой сфероидальные структуры. Они обнаружены в пыльниках как однодольных и двудольных, так и голосеменных. Участие орбикул предполагается в следующих функциях: транспортная функция по доставке спорополленина, функция гидрофобного слоя, выстилающего полость микроспорангия, за счет чего обеспечивается отделение пыльцевых зерен; рассеивание пыльцы (Pacini et al., 1985; El-Ghazaly, 1989; Pacini, 2010).
В тапетуме синтезируются вещества, ингибирующие процессы специализации клеток эндотеция в течение всего микроспорогенеза. Исследования по сопряженности в развитии эндотеция и тапетума обычно не обсуждаются в литературе, хотя многие авторы обращали внимание на появление фиброзных утолщений в эндотеции и длительность существования тапетума. Исследования в этом направлении проводятся в основном индийским ученым C. Chauhan (1977). Чтобы понять эту сопряженность в развитии, обратимся к анализу данных по строению и функционированию эндотеция. Имеющиеся данные свидетельствуют о структурном разноообразии эндотеция и его роли при вскрывании пыльника.
Эндотеций располагается под эпидермой и наибольшего развития достигает в пыльнике перед вскрыванием (рис. 5, 1, 2). От внутренних стенок его клеток отходит большое количество фиброзных поясков. Клетки эндотеция обеспечивают вскрывание пыльника в области стомиума, обычно продольными щелями в каждой теке (рис. 4, 5, 6; 6, 13). Вскрывание тек происходит обычно после разрушения в них перегородок. Однако у Paeonia lactiflora перегородки в теках образуются в результате заворачивания краев стенки микроспорангиев. В области стомиума эпидермальные слои этих краев лишь сомкнуты, а не срастаются. Поэтому в момент вскрывания края раскрываются наружу (Shamrov, неопубл.).
У Drymis winteri (Winteraceae) (Bhandari, Venkataraman, 1968), Bauera capitata (Cunoniaceae) (Prakash, McAlister, 1977) фиброзные пояски выявляются только с наружной стороны, а именно, в той области, которая формируется за счет делений клеток париетального слоя. Фиброзные утолщения могут возникать не только в субэпидермальном, но и сохраняющихся нижележащих слоях (рис. 6, 11–13). В таком случае многие авторы указывают, что они формируются не только в эндотеции, но и средних слоях. Высказано мнение о том, что только клетки с фиброзными утолщениями можно называть эндотецием. При формировании утолщений в субэпидермальном и нижележащих слоях эндотеций является многослойным. На ранних стадиях развития все слои клеток между тапетумом и эпидермой предлагается обозначать как “ткань средних слоев” и только после того, как сформируются фиброзные утолщения, определять наличие и характер эндотеция (присутствует в виде одного или нескольких слоев, или отсутствует) (Teryokhin et al., 1993). Следует подчеркнуть, что у некоторых растений фиброзные утолщения возникают также в большинстве клеток связника вокруг проводящего пучка (рис. 4, 6; 6, 12; 8, 7), однако значение таких клеток для вскрывания пыльника в литературе не обсуждается.
Фиброзные утолщения в стенке микроспорангия отсутствуют у растений с цветками, развивающимися в воде (Ceratophyllaceae, Cymodoceae, Najadaceae, Hydrocharitaceae, кроме Ottelia) (рис. 5, 3, 4), а также у видов с клейстогамными цветками. Они не образуются и у тех растений, пыльники которых вскрываются верхушечными порами (Asclepiadaceae, Ericaceae, Scrophulariaceae, Solanaceae) (рис. 7, 1, 2). Утолщения приобретают клеточные оболочки эпидермы (тогда такой слой по аналогии с эндотецием называют экзотецием), а также стенки клеток, подстилающих поры в виде валика (рис. 7, 3, 4). Особый случай описан у Chrysanthemum morifolium (Asteraceae) (Fei et al., 2016). У одного культивара со вскрывающимися пыльниками (Qx-097) эндотеций с фиброзными утолщениями, а у другого культивара (Qx-007) пыльники не вскрываются, так как в эндотеции не формируются фиброзные утолщения. Кроме того, у последнего сохраняются полностью септа в теке и стомиум, происходит увеличение размеров клеток пыльника, выявляется сильная гидратация и высокое содержание ионов K+, Ca2+, тогда как у первого культивара размеры клеток в пыльнике сохраняются, наблюдается обезвоживание, потеря содержимого клеток и снижение указанных ионов.
Рис. 7.
Вскрывание пыльника апикальной порой у Rhododendron schlippenbachii (Ericaceae).
1, 2 – вскрывшийся пыльник; 3 – клетки эпидермы утолщены (экзотеций), в эндотеции фиброзные утолщения отсутствуют; 4 – фрагмент стенки пыльника в области вскрывания апикальной порой, в клетках видны крахмальные зерна, оболочки утолщены; 5, 6 – тетрадная пыльца в пыльнике (5) и на поверхности рыльца (6). en – эндотеций, ep – эпидерма, s – крахмал, t – тапетум. Масштабная линейка, мкм: 1 – 1000, 2 – 100, 5, 6 – 10.
Fig. 7. Anther dehiscence by apical pore in Rhododendron schlippenbachii (Ericaceae).
1, 2 – dehisced anther; 3 – epidermal cells are thickened (exothecium), fibrous thickenings are missing in endothecium; 4 – part of anther wall in the area of dehiscence by apical pore, starch grains are observed in the cells, cell walls are thickened; 5, 6 – tetrad pollen in anther (5) and at stigma surface (6). en – endothecium, ep – epidermis, s – starch, t – tapetum. Scale bars, µm: 1 – 1000, 2 – 100, 5, 6 – 10.
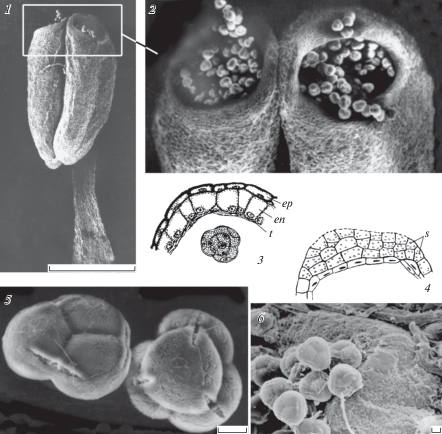
В результате изучения процессов сопряженности в развитии эндотеция и тапетума было показано, что в течение всего микроспорогенеза не происходит специализация клеток эндотеция. После завершения синтеза спорополленина в тапетуме ингибирующее действие заканчивается, и тапетум начинает разрушаться, что обычно соответствует стадии вакуолизированных микроспор. Только после этого происходит формирование утолщений в клетках эндотеция (Chauhan, 1977). При длительном существовании тапетума, особенно у растений с мужской цитоплазматической стерильностью, наблюдается абортирование пыльцы, клетки эндотеция не переходят к формированию фиброзных поясков, и пыльники не вскрываются (Chauhan, 1979; Chauhan, Gupta 2006). Подобное, вероятно, описали авторы у Chrysanthemum morifolium (Asteraceae) (Fei et al., 2016). Хотя они не пытались выявить связь между развитием тапетума и формированием фиброзных поясков в эндотеции, судя по приведенным иллюстрациям, в невскрывающихся пыльниках тапетум сохраняется до конца их существования. У некоторых растений подобные процессы происходят в норме и пыльники вскрываются. У Escallonia rubra (Escalloniaceae) (Kamelina, 1985) фиброзные утолщения в клетках 2‒3-слойного эндотеция начинают формироваться только на стадии формирования 2-клеточного пыльцевого зерна (генеративная клетка находится еще около спородермы). Зрелая пыльца у этого вида 3-клеточная. Тапетум долго сохраняется и разрушается только перед вскрыванием пыльника. Длительное существование тапетума, заканчивающееся в период формирования пыльцевых зерен, приводит к более позднему возникновению фиброзных утолщений в эндотеции некоторых видов Euphorbiaceae (Euphorbia iberica, E. petrophila, E. seguieriana, E. stepposa – Anisimova, 2019). В зрелом пыльнике клетки тапетума, как правило, не сохраняются.
Тапетум цветковых растений характеризуется значительным разнообразием. Чтобы его отразить, выделяются типы, подтипы, формы и вариации. Многие авторы внесли вклад в разработку этой проблемы, однако вопросы типизации тапетума продолжают обсуждаться, особенно после применения электронного трансмиссионного микроскопа для анализа полученных данных. Тем не менее значимость сведений, полученных с помощью светового микроскопа, трудно переоценить.
Впервые 2 типа тапетума (секреторный и амебоидный) были предложены Goebel (1905). В секреторном тапетуме клетки сохраняются, а в амебоидном типе стенки клеток разрушаются, и протопласты сливаются, формируя ценоцитный плазмодий. Ряд авторов вместо амебоидного предлагают различать периплазмодиальный тип (Tischler, 1915; Claussen, 1927; Echlin, 1971). Выделяют настоящий и ложный подтипы периплазмодия (Tischler, 1915). В зависимости от времени проникновения периплазмодия в полость микроспорангия различают 4 варианта: 1, 2 – формируется во время первого (Sparganium – 1) или второго (Triglochin – 2) деления мейоза между делящимися микроспороцитами, 3 – на стадии тетрад (Butomus), 4 – после распада тетрад между микроспорами (Sagittaria) (Claussen, 1927). Carniel (1961, 1963) подразделял тапетум на целлюлярный одноядерный, целлюлярный многоядерный и плазмодиальный с большим числом ядер. У Zea mays тапетум, по данным автора, развивается как целлюлярный многоядерный. Также выделяют третий промежуточный тип тапетума – инвазивный, или несинцитиальный. У видов Canna после разрушения стенок в клетках тапетума образуются протопласты. На поздних стадиях микроспорогенеза протопласты формируют амебоидные выросты, но при этом они не сливаются (Tiwari, Gunning, 1986). Некоторые авторы предлагают называть секреторный тапетум париетальным, а периплазмодиальный – амебоидным. Типы различаются временем слияния клеток, контактом цитоплазмы тапетума с наружной поверхностью пыльцевых зерен, временем существования в полости микроспорангия. Внутри каждого типа выделяются вариации (всего до 12) (Pacini et al., 1985; Pacini, 1997, 2010).
Значительный интерес представляет классификация тапетума, предложенная Камелиной (Kamelina, 1981, 1994, 2002, 2009). Она построена не только на структурных особенностях, но и временных характеристиках (на них обратил внимание еще Carniel, 1963) в ходе развития клеток тапетума. Выделяются также два типа тапетума: клеточный (секреторный) и периплазмодиальный.
Особенностью развития тапетума является разрушение клеточных стенок в ходе развития. При периплазмодиальном типе стенки исчезают до или во время микроспорогенеза. Подобное происходит и в клеточном тапетуме, однако его стенки обычно разрушаются на стадии тетрад или одиночных микроспор (рис. 4, 4; 8, 5). В пыльнике с трабекулами со стадии вакуолизированных микроспор стенки между клетками тапетума и трабекул не выявляются даже с помощью особых методик окрашивания. Возникшие протопласты четко отграничены друг от друга и существуют в таком состоянии еще на стадии 2-клеточных пыльцевых зерен (рис. 6, 9, 10).
По мнению Камелиной (Kamelina, 1994), в клеточном тапетуме первичная оболочка в клетках сохраняется до стадии тетрад микроспор. Вслед за ее растворением происходит образование “вторичной оболочки”, содержащей спорополленин, а во многих случаях на внутренней и радиальных сторонах ее формируются орбикулы. У многих растений строение тапетума в дальнейшем не изменяется и сопровождается лишь лизисом содержимого протопластов. В зрелом пыльнике сохраняется лишь спорополлениновая тапетальная пленка с орбикулами. Эта форма клеточного тапетума без реорганизации отмечена в 229 семействах двудольных и 38 семействах однодольных растений.
В литературе предложены и другие понятия для обозначения оболочки, которая окружает каждый протопласт после разрушения клеточных стенок тапетума: “тапетальная пленка”, “орбикулярная пленка”, “пелликула”. Название “тапетальная мембрана” впервые появилось в работах по тапетуму голосеменных (Pettit, 1964) и некоторых злаков (Banerjee, 1966). В.Ф. Огородникова (Ogorodnikova, 1986, 1990) предлагала обозначать ее как “спорополлениновая оболочка”. В дальнейшем она (Ogorodnikova, 1994), как и многие авторы, также стала использовать понятие “тапетальная мембрана” для описания оболочки, окружающей в посттетрадный период целиком каждую клетку тапетума секреторного типа. Кроме этого выделяют экстратапетальную, или перитапетальную мембрану на границе периплазмодиального тапетума и среднего слоя (Heslop-Harrison, 1969; Dickinson, 1970).
Таким образом, в литературе используются различные понятия для описания процессов появления новой оболочки вокруг тапетума после разрушения клеточных стенок. По мнению Bhandari (1984), в этом случае лучше использовать термин “тапетальная мембрана”. Чтобы отразить специфику мембран, следует указывать стороны протопласта, которые обращены друг к другу (радиальные мембраны), внутрь к полости микроспорангия (внутренние мембраны) либо к среднему слою (наружные мембраны). У растений с клеточным тапетумом выделены 4 типа строения тапетальной мембраны: I. Pinaceae-тип (представлена фибриллярным материалом, в который на внутренней мембране включены орбикулы) – Pinaceae, Alliaceae, Chenopodiaceae, Moraceae, Ruscaceae, Schisandraceae, Simmondsiaceae. II. Rosaceae-тип (орбикулы в фибриллярном материале отсутствуют) – Rosaceae, Fabaceae, Linaceae, Polygonaceae. III. Solanaceae-тип (тапетальная мембрана сетчатая в виде тяжей, орбикулы на внутренней мембране) – Solanaceae. IV. Poaceae–тип (тапетальная мембрана состоит из продырявленного слоя и сетчатого переплетения тяжей; орбикулы располагаются на 1/3 поверхности радиальных мембран, ближе к полости микроспорангия; радиальная часть мембраны частично заходит на наружную, представленную фибриллярным материалом) – Poaceae (Ogorodnikova, 1994).
Применильно к клеточному тапетуму для отражения многообразия его форм введено понятие “реорганизация тапетума” (Kamelina, 1981, 1994). Последнее означает структурно-функциональную перестройку клеточного тапетума, происходящую в начале постмейотического периода развития пыльника. На основании особенностей реорганизации выделяют 4 формы клеточного тапетума: синцитий (Pacini et al., 1985) (ранее эта форма была названа ложным периплазмодием – Carniel, 1952, 1963; Kamelina, 1981) – протопласты тапетума объединяются и заполняют все пространство полости (Asteraceae, Caprifoliaceae, Malvaceae, Rubiaceae, Winteraceae, Valerianaceae); амебоидный (по Budell, 1964) – протопласты разрастаются, но при этом не объединяются (Asteraceae, Berberidaceae, Papaveraceae, Rubiaceae); окаймляющий симпласт (по Budell, 1964) – отдельные протопласты объединяются, оставаясь в пристенном слое (Berberidaceae); тапетальная ткань (по Kamelina, 1981) – сначала все происходит как при амебоидной форме, но затем образуются вторичные оболочки и тапетум снова становится клеточным. Спорополленин и орбикулы во всех этих формах, по мнению автора (Kamelina, 1981, 1994), отсутствуют.
В исследовании Анисимовой (Anisimova, 2019) было обнаружено, что у четырех изученных видов Euphorbia тапетум в премейотическом и мейотическом периодах характеризуется клеточной структурой. Однако уже на стадии тетрад микроспор у E. seguieriana, распада тетрад и образования микроспор у E. stepposa, одиночных микроспор у E. iberica и E. petrophila стенки между клетками тапетума начинают разрушаться. Процесс исчезновения клеточных стенок сопровождается выпячиванием образующихся протопластов внутрь полости микроспорангия. Происходит реорганизация клеточного тапетума в амебоидный. Протопласты клеток тапетума остаются в пристенном положении, где разрушаются, причем их остатки с ядрами сохраняются почти до созревания пыльника. Тапетум в виде густоплазменного слоя сохраняется вплоть до объединения микроспорангиев в теках. Цитоплазма вакуолизируется, протопласты постепенно уменьшаются в размерах, а их содержимое лизирует. После разрушения стенок тапетума вокруг каждого протопласта образуется тапетальная мембрана. Выявлены различия в локализации орбикул на тапетальной мембране. Они образуются обычно на внутренней тангентальной, а у E. seguieriana и на 1/3 поверхности смежных радиальных мембран тапетума. Подобным образом формируется амебоидный тапетум у Allium caspium (Alliaceae) и Veratrum lobelianum (Melanthiaceae). На стадии тетрады микроспор начинается разрастание клеток тапетума внутрь полости микроспорангия и на внутренних и частично радиальных мембранах на стадии микроспор происходит образование орбикул (рис. 4, 3, 4; 8, 4, 5) (Shamrov, неопубл.).
Секреторный тапетум, как наиболее часто встречающийся у цветковых растений, изучен многими исследователями (Echlin, Godwin, 1968; Hoefert, 1971; Сhristensen et al., 1972; Steer, 1977). Анализ ультраструктуры клеток тапетума у Helleborus foetidus (Ranunculaceae) (Echlin, Godwin, 1968) и Avena sativa (Poaceae) (Steer, 1977) показал, что клеточные стенки в начале мейоза становятся тоньше и во время метафазы I на радиальных стенках сохраняется лишь срединная пластинка. Клеточная оболочка частично утрачивает свою электронную плотность, демонстрируя волокнистое строение. На заключительной стадии растворения оболочек тапетума на внутренней тапетальной мембране формируются проорбикулярные тела, покрытые слоем спорополленина и ассоциированные с эндоплазматическим ретикулулом протопласта.
Эти данные совпадают с результатами других авторов. У злаков Avena sativa, Secale cereale и Triticum aestivum на стадии средних тетрад микроспор начинают разрушаться клеточные стенки в тапетуме, затем они разрыхляются. На стадии поздних тетрад стенки дегенерируют, но еще сохраняются вещества на внутренней тангентальной стенке. После растворения каллозы вокруг тетрад и образования одиночных микроспор стенки полностью исчезают и начинается образование тапетальной мембраны с орбикулами (Ogorodnikova, 1986, 1990). А.А. Чеботарь (Chebotaru, 1994) выделил 5 фаз в развитии тапетума кукурузы: 1 – дифференциация тапетума, 2 – деления ядер, их полиплоидизация, 3 – усиление физиолого-биохимической активности, 4 – наступление литической волны, начало деструкции тапетума, секреция предшественников спорополленина (плазмалемма хорошо прослеживается, содержит множество пиноцитозных инвагинаций), 5 – “периплазмоидизация” клеток тапетума, реорганизация структур органелл. Фазы 1–3 проходят на фоне мейоза, 4-я фаза – соответствует стадии тетрад микроспор (разрушение клеточных стенок в тапетуме происходит одновременно с растворением каллозы вокруг тетрад микроспор), а 5-я – стадии отдельных микроспор, когда тапетальные клетки лишены оболочек, а их протопласты ограничены плазмалеммой, при этом ценоцитный плазмодиум не образуется. “Периплазмодий” перемещается в пространство между формирующимися пыльцевыми зернами. Судя по описанию, тапетум у Z. mays претерпевает реорганизацию в рамках амебоидной вариации.
У Arabidopsis thaliana (Brassicaceae) клетки тапетума до стадии тетрады микроспор хорошо отличаются от других слоев стенки микроспорангия (Quilichini et al., 2014). Но уже в конце этой стадии они вакуолизируются и начинают проявлять признаки отделения от смежного среднего слоя. В дальнейшем клетки изолируются за счет разрушения стенок и начинают синтез веществ спорополлениновой природы за пределы клетки. Тапетум сохраняется до стадии зрелых 3-клеточных пыльцевых зерен. Об этом также свидетельствуют данные, полученные другими авторами (Sanders et al., 1999). Следует отметить, что у этого вида ранее (Owen, Makaroff, 1995) было обнаружено, что разрушение стенок в тапетуме начинается во время мейоза. Внутренние тангентальные и радиальные стенки разрушаются на стадии тетрад микроспор. В отличие от других видов сем. Brassicaceae, у A. thaliana разрушаются также наружные тангентальные стенки. После этого начинается секреция со всех сторон образовавшихся протопластов.
У Rhododendron luteum (Ericaceae) (Mirgorodskaya, Miroslavov, 2012; Mirgorodskaya et al., 2015) и Ribes nigrum (Grossulariaceae) (Koteyeva et al., 2015) на стадии тетрад микроспор стенки клеток тапетума разрыхляются, и на поверхности плазмалеммы выявляются экзоцитозные пузырьки. На стадии микроспор по периферии протопласта, обращенного в полость микроспорангия, аккумулируется электронно-плотное вещество, образуются глобулы (орбикулы). Внутренняя тангентальная стенка сохраняется, при этом она сильно разрыхлена. На стадии зрелых 2-клеточных пыльцевых зерен клетки тапетума полностью деградируют, и на их поверхности, обращенной к полости микроспорангия, выявляются лишь остатки мембран и орбикул в виде тапетальной пленки. Исходя из анализа данных, приведенных в работах, для этих видов характерна реорганизация в амебоидный вариант клеточного тапетума.
Периплазмодиальный тапетум, по Камелиной (Kamelina, 1994), характеризуется формированием ценоцитной структуры в течение премейотического и мейотического периодов развития пыльника. Растворение оболочек начинается сразу же после образования тапетального слоя. Так же как и у Claussen (1927), в зависимости от времени возникновения ценоцита и внедрения возникающего периплазмодия в полость микроспорангия выделяются 3 вариации: на стадии микроспороцитов (Ruppia), на стадии тетрад микроспор (Potamogeton), в момент распада тетрад на отдельные микроспоры (Zannichellia). Следует отметить, что у Zannichellia pedunculata (Zannichelliaceae) разрушение клеточных стенок в тапетуме начинается еще на стадии диад, а слияние протопластов и распределение ядер в полости микроспорангия происходит на стадии одиночных микроспор (Kamelina, Teryokhin, 1990). У растений с периплазмодиальным типом на границе тапетума и среднего слоя обнаружена экстратапетальная, или перитапетальная, мембрана. Электронно-прозрачная мембрана, как правило, не содержит орбикулы. На ней откладываются только глобулы спорополленина (Heslop-Harrison, 1969; Dickinson, 1970). У некоторых видов сем. Malvaceae на перитапетальной мембране ложного периплазмодия (синцития), возникшего в результате реорганизации клеточного тапетума, обнаружены орбикулы (Galati et al., 2007).
Использование электронного микроскопа частично подтвердило данные, полученные Камелиной (Kamelina, 1994). У Ruppia maritima из сем. Ruppiaceae было показано, что клеточные стенки тапетума начинают разрушаться уже на стадии ранних микроспороцитов. Протопласты сливаются, инициируя формирования периплазмодия. К началу деления микроспороцитов стенки разрываются, происходит внедрение протопластов в полость микроспорангия и их полное слияние. На стадии тетрад микроспор периплазмодий становится сильно вакуолизированным. После образования отдельных микроспор тапетум полностью распадается, и его остатки сохраняются по углам полости микроспорангия (Taylor et al., 2018). Подобное поведение тапетума характерно и для представителей других семейств порядка Alismatales. Различия касаются времени внедрения протопластов в полость микроспорангия: на стадии мейоза у Juncaginaceae, на стадии тетрад микроспор у Hydrocharitaceae, после распада тетрад у Scheuchzeria (Scheuchzeriaceae) и Echinodorus (Alismataceae) (Furness, Rudall, 1998; Furness, Banks, 2010).
При анализе растений с периплазмодиальным типом тапетума становится явной проблема несоответствия принципов, положенных в разработку разных систем типов тапетума. Как уже было отмечено, Kamelina (1994) указывала, что процессы разрушения клеточных стенок и формирование ценоцитной структуры происходят в течение премейотического и мейотического периодов развития, а при реорганизации клеточного тапетум в синцитий, или ложный периплазмодий, – в начале постмейотического периода развития пыльника. Многие авторы обычно не различают настоящий и ложный варианты периплазмодия по временным параметрам в развитии тапетума. Поэтому примеры процессов в тапетуме после распада тетрад, приводящих к разрушению клеточных стенок тапетума и слиянию протопластов у Scheuchzeria (Scheuchzeriaceae) и Echinodorus (Alismataceae) (Furness, Banks, 2010), можно было бы отнести к синцитию как форме реорганизации клеточного тапетума. Однако у Alisma plantago-aquatica (Alismataceae) эти процессы начинаются во время второго деления мейоза, а выпячивание протопластов в полость микроспорангия – на стадии обособленных микроспор (Nikiticheva, 1990). Подобное после распада тетрад отмечал Claussen (1927) у Sagittaria из этого же семейства. Границы разделения премейотического, мейотического и постмейотического периодов развития пыльника нечеткие. Процессы до мейоза (образование археспория и спорогенных клеток), во время мейоза (микроспорогенез и формирование тетрад микроспор), после мейоза (распад тетрад, возникновение обособленных микроспор и формирование пыльцевых зерен) могут не полностью совпадать с преобразованиями в слоях стенки микроспорангия. Эти трансформации могут начинаться в одном периоде и продолжаться или заканчиваться в других периодах. Так, процессы преобразования периплазмодиального тапетума могут начинаться во время деления микроспороцитов, на стадии тетрад и продолжаться на стадии отдельных микроспор. Именно поэтому все вариации развития тапетума в сем. Alismataceae можно отнести к плазмодиальному типу. Следует добавить, что процессы реорганизации в клеточном тапетуме могут также начинаться не после распада тетрад, а на стадии их формирования. Подобное было отмечено при анализе развития тапетума в роде Euphorbia (Euphorbiaceae): на стадии тетрад микроспор у E. seguieriana, распада тетрада и образования микроспор у E. stepposa, одиночных микроспор у S. iberica и E. petrophila (Anisimova, 2019). Такие же данные приводятся для Avena sativa, Secale cereale и Triticum aestivum (Poaceae) (Ogorodnikova, 1986, 1990).
Большой интерес представляет изучение тапетума у видов сем. Asteraceae. В эмбриологической характеристике этого семейства указывается, что у большинства видов тапетум клеточный, с реорганизацией в постмейотический период в амебоидный, а у представителей триб Arctotideae, Gudelineae, Heliantheae, Vernonieae, Eupatorieae – в ложный периплазмодий (Solntseva, 1987). Однако секреторный тапетум без организации описан у Vernonia cinerea, V. cinerascens (Tiagi, Taimni, 1963), Sonchus oleraceus, S. asper (Walter, Kuta, 1971), Platycarpha carlinoides (Ahlstrand, 1979). В этом случае после распада тетрад клеточные стенки исчезают, а затем тапетум постепенно дегенерирует. У семи видов Chrysothamnus (Anderson, 1970) тапетум описан как периплазмодиальный. После стадии обособленных микроспор протопласты проникают в полость микроспорангия между микроспорами, но при этом они не объединяются. У Cicerbita alpina (Pullaiach, Lakshmi, 1984) тапетум также считается периплазмодиальным, и авторы полагают, что описанные до них варианты секреторного тапетума на самом деле являются формами периплазмодия.
У видов рода Helianthus была выявлена реорганизация клеточного тапетума в ложный периплазмодий. Время этой реорганизации различается. У H. annuus реорганизация тапетума наблюдалась на стадии окончания распада тетрад микроспор, у H. rigidus – на стадии вакуолизированных микроспор (Toderich, 1988). У H. ciliaris и H. tuberosus признаки разрушения клеточных стенок тапетума были замечены уже в начале стадии мейоза (Babro, Voronova, 2018), тем не менее авторы сочли возможным рассматривать его также в рамках синцития.
Исследование, проведенное у H. annuus еще до изучения этого вида Toderich (1988), показало, что у нормальных растений тапетум сначала располагается по периферии полости. На стадии мейоза I образуются 2, 4, 6 ядер в каждой клетке. После этого исчезают клеточные стенки, и образуется периплазмодий, который сохраняется до поздней стадии микроспор. У ЦМС-линий, в отличие от нормальных растений, клеточные стенки в тапетуме не исчезают. После мейоза II происходит дегенерация тапетума, разрушаются тетрады микроспор, хотя в начале мейоза в клетках тапетума начинаются признаки деструкции стенок и цитоплазматических органелл (Horner, 1977). Способ развития тапетума, обнаруженный у нормальных растений H. annuus, присущ, вероятно, также и некоторым другим видам сем. Asteraceae. По данным Heslop-Harrison (1969), до стадии тетрады у Ambrosia artemisifolia, Cosmos bipinnatus, Tagetes patula (Asteraceae) клетки тапетума разобщены в тангентальном направлении. Тангентальные стенки становятся желатинообразными. После распада тетрад микроспор образуется периплазмодий. Вокруг тапетума и микроспор возникает мембрана, образуя своеобразный мешок (“culture sac”). По химическому составу мембрана сходна со спорополленином экзины пыльцевого зерна.
Таким образом, у видов Helianthus и некоторых других родов сем. Asteraceae, по-видимому, формируется периплазмодиальный тапетум. По нашему мнению, об этом свидетельствует комплекс признаков (раннее разрушение клеточных стенок тапетума, слияние протопластов и внедрение их в полость микроспорангия). Однако у H. ciliaris и H. tuberosus выпячивание протопластов в полость микроспорангия происходит не во время мейоза, а чуть позже – на стадии обособленных микроспор, как у Alisma plantago-aquatica (Alismataceae) (Nikiticheva, 1990) и Zannichellia pedunculata (Zannichelliaceae) (Kamelina, Teryokhin, 1990).
В заключение по этому разделу статьи выскажем свою точку зрения о разнообразии и типизации тапетума цветковых растений. Как было отмечено выше, большинство авторов используют в своих исследованиях классификации, которые включают 2 типа тапетума: 1) секреторный (клеточный, париетальный), 2) периплазмодий (плазмодий, амебоидный, инвазивный, интрузивный), не считая вариаций в обоих типах. Проведенный анализ показывает, что любой тип тапетума является секреторным, так как его клетки продуцируют различные вещества для развития микроспор и пыльцевых зерен. На ранних стадиях развития он, как правило, образован таблитчатыми клетками с плотной цитоплазмой, как и ткань секреторного типа. Тапетум начинает развитие, образуя слой или слои клеток. В ходе дальнейшего развития происходит разрушение клеточных стенок. Мы считаем, что первый тип предпочтительнее называть париетальным, как предложил E. Pacini (Pacini et al., 1985; Pacini, 1997, 2010). В этом случае тапетум выстилает полость микроспорангия, не заходя вглубь ее. Клеточное строение сохраняется до распада тетрад микроспор. Хотя, как свидетельствуют литературные данные, разрушение клеточных стенок может начинаться еще во время мейоза I (Echlin, Godwin, 1968; Steer, 1977; Owen, Makaroff, 1995), при образовании тетрад (Ogorodnikova, 1986, 1990; Quilichini et al., 2014), одновременно с растворением каллозы вокруг тетрад (Chebotaru, 1994). После разрушения стенок на тапетальных мембранах, часто внутренних, формируются орбикулы. В результате структурной реорганизации возникают две формы париетального тапетума, такие как амебоидный и окаймляющий симпласт. Обычно термин “амебоидное” характеризует перемещение животной клетки по субстрату, которое осуществляется благодаря внутриклеточному перетеканию цитоплазмы и образованию временных псевдоподий, как у амебы. При формировании амебоидного тапетума речь идет о выростах (выпячиваниях) клеток или интрузии, а не о слиянии протопластов. Такое понимание было дано Budell (1964) по результатам исследования Inula helenium (Asteraceae). У Coleus scutellarioides (Lamiaceae) и Berberis vulgaris (Berberidaceae) им описана особая форма тапетума, названная окаймляющим симпластом – отдельные протопласты объединяются, но при этом остаются в пристенном слое (Budell, 1964). Вопрос о повторном возникновении тапетальной ткани в гнезде микроспорангия (Kamelina, 1981, 1994) требует дальнейшего изучения. Инвазивный, или несинцитиальный тип (Tiwari, Gunning, 1986) представляет собой вариант амебоидного тапетума. При реорганизации возможно формирование орбикул, хотя Kamelina (1981, 1994) считала, что орбикулы образуются только в тапетуме без организации. Но тогда возникает вопрос, какими структурами осуществляется доставка спорополленина к формирующейся спородерме микроспор и пыльцевых зерен, и за счет чего обеспечивается отделение пыльцевых зерен и их рассеивание (Pacini et al., 1985; El-Ghazaly, 1989; Pacini, 2010). Мы показали в статье на приведенных примерах, что у видов с реорганизацией формируются орбикулы. Возможно, есть и другие механизмы по обеспечению упомянутых функций, как, например, при перитапетальном тапетуме. Обе вариации, возникающие в ходе реорганизации, так же как различные варианты без реорганизации, подчеркивают постенное положение париетального тапетума в полости микроспорангия в ходе всего развития.
Второй тип тапетума лучше называть периплазмодиальным (он также образуется после разрушения клеточных стенок), который возникает в результате слияния протопластов клеток. Цитоплазма и ядра периплазмодиального тапетума располагаются не только между развивающимися микроспорами и пыльцевыми зернами, но и контактируют с внутренними слоями полости микроспорангия. Ранее при описании тапетума мы привели описание не только так называемого настоящего (по Carniel, 1963), но и ложного (Carniel, 1952, 1963; Kamelina, 1981) периплазмодия, или синцития (Pacini, 1997, 2010), рассматриваемого во многих исследованиях в качестве формы реорганизации клеточного тапетума. Содержание термина “синцитий” не в полной мере свидетельствует о сходстве процессов генезиса настоящего и ложного периплазмодия. Прежде всего, семантика термина “синцитий” (греч. syn – вместе, kitos – клетка) указывает на сохраняющуюся связь между поделившимися клетками, а не ядрами, которые образуются при ложном периплазмодии. Этот термин также не корректно используется при характеристике нуклеарного эндосперма на ценоцитной стадии развитии у Arabidopsis thaliana (Brassicaceae) (Guo et al., 2018). Типичный синцитий известен у животных в форме зародышевой соединительной ткани мезенхимы. У человека синцитий образуется во время сперматогониальных делений. В этом случае цитокинез не доходит до конца и клетки оказываются соединенными между собой цитоплазматическими мостиками. При последующих делениях образуются клоны взаимосвязанных клеток (Gilbert, 2003; Danilov, Borovaya, 2018). Именно феномен полного слияния протопластов и отсутствие цитоплазматических мостиков позволяет объединить все существующие формы в рамках одного типа – периплазмодиального. В отличие от париетального тапетума, в периплазмодиальном типе реорганизация затрагивает не структурные, а премущественно временные параметры. Критерием для разграничения вариаций является время объединения и внедрения протопластов в полость микроспорангия. В периплазмодиальном тапетуме формируется экстратапетальная, или перитапетальная, мембрана, которая, как правило, содержит глобулы спорополленина. Таким образом, число семейств с периплазмодиальным тапетумом на самом деле значительно больше, чем указывала Камелина (Kamelina, 1994) и составляет не 21 семейство, а около 40 семейств, при этом соотношение однодольных и двудольных по этому признаку примерно равно.
Независимо от типа тапетума и времени начала разрушения клеточных стенок, его активность наиболее высока, вероятно, на стадиях образования тетрад и их распада на отдельные микроспоры. Это, как правило, совпадает с синтезом каллазы и последующим растворением каллозы вокруг тетрад, а также с пиком секреции предшественников спорополленина (Echlin, Godwin, 1968; Steer, 1977; Chebotaru, 1994; Owen, Makaroff, 1995; Mirgorodskaya et al., 2015). У некоторых растений была выявлена цикличность в функционировании тапетума, начиная с окончания мейоза через раннюю, среднюю и позднюю тетрады микроспор до стадии отдельных вакуолизированных микроспор: Pinus sylvestris, Pinaceae (Rowley, Walles, 1988), Strelitzia reginae, Strelitziaceae (Kronestedt-Robards, Rowley, 1989), Nymphaea colorata, Nymphaeaceae (Rowley et al., 1992; Rowley, 1993). Это послужило основанием для выделения особого циклически-инвазивного тапетума (Rowley, 1993). Проведеные исследования показали, что еще в тетрадах с каллозой на примэкзине аккумулируются предшественники спорополленина, и начинается формирование эндэкзины микроспор и пыльцевых зерен.
Таким образом, в эмбриологии цветковых растений существует комплекс нерешенных проблем. Они касаются первых стадий заложения микроспорангия, последовательности формирования слоев его стенки и их характеристики, особенно тапетума, в ходе развития.
Список литературы
Ahlstrand L. 1979. Embryology of Actotideae–Gundeliinae (Compositae). – Bot. Notiser. 132 (3): 377–381.
[Alimova] Алимова Г.К. 1985. Семейство Aceraceae. – В кн.: Сравнительная эмбриология цветковых растений. Brunellaceae–Tremandraceae. Л. С. 183–185.
Anderson L.C. 1970. Embryology of Chrysothamnus (Astereae, Compositae). – Madrono. 20 (7): 337–342.
[Anisimova] Анисимова Г.М. 1983. Семейство Begoniaceae. – В кн.: Сравнительная эмбриология цветковых растений. Phytolaccaceae–Thymelaeaceae. Л. С. 144–148.
[Anisimova] Анисимова Г.М. 2016. Строение пыльника, микроспорогенез и пыльцевое зерно у Kalanchoe nyikae (Crassulaceae). – Бот. журн. 101 (12): 1378–1389.
[Anisimova] Анисимова Г.М. 2019. Строение и развитие пыльника некоторых видов подрода Esula рода Euphorbia (Euphorbiaceae). – Бот. журн. 104 (2): 3–22. https://doi.org/10.1134/S0006813619020017
[Babro, Voronova] Бабро А.А., Воронова О.Н. 2018. Развитие мужских репродуктивных структур у Helianthus ciliaris и H. tuberosus (Asteraceae). – Бот. журн. 103 (9): 1093–1108. https://doi.org/10.7868/S0006813618090028
Banerjee U.C. 1967. Ultrastructure of tapetal membranes in grasses. – Grana Palyn. 7 (2–3): 365–377.
[Batygina, Teryokhin, Alimova, Yakovlev] Батыгина Т.Б., Терехин Э.С., Алимова Г.К., Яковлев М.С. 1963. Генезис мужских спорангиев Gramineae и Ericaceae. – Бот. журн. 48 (8): 1108–1120.
Bhandari N.N. 1968. Studies in the family Ranunculaceae. X. Embryology of Anemone L. – Phytomorphology. 18: 487–497.
Bhandari N.N. 1984. Microsporangium. – In: Embryology of angiosperms. Berlin etc. P. 53–121.
Bhandari N.N., Khosla R. 1982. Development and histochemistry of anther in Triticale cv. Tri-1. I. Some new aspects in early ontogeny. – Phytomorphology. 32 (1): 18–27.
Bhandari N.N., Venkataraman R. 1968. Embryology of Drymis winteri. – J. Arnold Arboretum. 49 (4): 509–524.
Bower F.O. 1935. Primitive land plants also known as the Archegoniatae. London. 658 p.
Brunkener L. 1973. Beiträge zur Kenntnis der frühen Sporangienentwicklung der Pteridophyten und der Gymnospermen. – Svensk. Bot. Tidskr. 67 (4): 333–400.
Budell B. 1964. Untersuchungen der Antherenentwicklung einiger Blü tenpflanzen – Zeitschr. Bot. 52 (1): 1–28.
Camefort H., Boué H., Obre A. 1997. Reproduction et biologie des végétaux supérieurs. Cedex. 436 p.
Carniel K. 1952. Das Verhalten der Kerne im Tapetum der Angiospermen mit besonderer Berücksichung von Endomitosen und sogenannten Endomitosen. – Ősterr. Bot. Zeit. 99 (3): 318–363.
Carniel K. 1961. Das Antherentapetum von Zea mays. – Ősterr. Bot. Zeit. 108 (1): 89–96.
Carniel K. 1963. Das Antherentapetum. – Ősterr. Bot. Zeit. 110 (2–3): 145–176.
Chauhan S.V.S. 1977. Dual role of the tapetum. – Curr. Sci. 46 (19): 674–675.
Chauhan S.V.S. 1979. Development of endothecium in relation to tapetal behaviour in some male sterile plants. – Phytomorphology. 29 (3–4): 245–251.
Chauhan S.V.S., Gupta H.K. 2006. Suppression of endothecium development by malformed tapetum in the anthers of chemically treated Lens culinaris. – Phytomorphology. 56 (1–2): 10–16.
[Chebotaru] Чеботарь А.А. 1994. Тапетум. Ультраструктурные аспекты. – В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. С. 52–56.
Christensen J.E., Horner H.T., Lersten N.R. 1972. Pollen wall and tapetal orbicular wall development in Sorghum bicolor (Gramineae). – Amer. J. Bot. 59: 43–58.
Claussen P. 1927. Űber das Verhalten des Antherentapetum bei einiger Monokotylen und Ranales. – Bot. Archiv Kö nigsberg. 18 (1–3): 1–27.
Clement C., Pacini E. 2001. Anther plastid in angiosperms. – Bot. Rev. 67 (1): 55–73.
Dafni A. 2000. Pollen and pollination. New Yok etc. 158 p.
[Danilov, Borovaya] Данилов Р.К., Боровая Т.Г. 2018. Гистология, эмбриология, цитология. СПб. 520 с.
Davis G.L. 1966. Systematic embryology of angiosperms. New York etc. 528 p.
Dickinson H.G. 1970. The fine structure of a peritapetal membrane investing the microsporangium of Pinus banksiana. – New Phytologist. 69 (4): 1065–1068.
Echlin P. 1971. The role of the tapetum in microsporogenesis of angiosperms. – In: Pollen development and physiology. London. P. 41–62.
Echlin P., Godwin H. 1968. The ultrastructure and ontogeny of pollen in Helleborus foetidus L. I. The development of the tapetum and Ubish bodies. – J. Cell Sci. 3: 161–174.
El-Ghazaly G. 1989. Pollen and orbicule morphology of some Euphorbia species. – Grana. 28: 234–259.
El-Ghazaly G. 2002. Tapetum and orbicules (Ubish bodies). – In: Embryology of flowering plants. Terminology and concepts. Enfield (NH), USA- Plymouth, UK. Vol. 1. P. 20–21.
Fei J., Tan S., Zhang F., Hua L., Liao Y., Fang W., Chen F., Teng N. 2016. Morphological and physiological differences between dehiscent and in dehiscent anthers of Chrysanthemum morifolium. – J. Plant Res. 129 (6): 1069–1082.
Furness C.A., Banks H. 2010. Pollen evolution in the early-divergent monocot order Alismatales. – Int. J. Plant Sci. 171 (3): 713–739.
Furness C.A., Rudall P.J. 1998. The tapetum and systematics in monocotyledons. – Bot. Rev. 64: 201–239.
Galati B.G., Monacci F., Gotelli M.M., Rosenfeldt S. 2007. Pollen, tapetum and orbicule development in Modiolastrum malvifolium (Malvaceae). – Ann. Bot. 99 (4): 755–763.
Garcia C. C. 2003. Combination of sequences of cell divisions in the anther wall formation in Solanaceae species. – Flora. 198: 243–246.
[Gilbert] Гилберт С.Ф. Биология развития. 2003. СПб. 850 с.
Goebel K. 1880. Beiträge zur vergleichenden Entwicklungsgeschichte der Sporangien. –Bot. Zeit. 38: 32–33, 545–552, 561–571.
Goebel K. 1905. Organography of plants. London. Vol. 2. 707 p.
Goldberg R.B., Beals T.P., Sanders P.M. 1993. Anther development: basic principles and practical applications. – The Plant Cell. 5 (10): 1217–1229.
Guo L., Jiang L., Lu X.-L., Liu C.-M. 2018. Anaphase promoting complex/cyclosome-mediated cyclin B1 degradation is critical for cell cycle synchronization in syncytial endosperms. – J. Integr. Plant Biol. 60 (6): 448–454.
Hernández-Cruz R., Barrόn-Pacheco F., Sánchez D., Arias S., Vázquez-Santana S. 2018. Functional dioecy in Echinocereus: ontogenetic patterns, programmed cell death, and evolutionary significance. – Int. J. Plant Sci. 179 (4): 257–274. https://doi.org/10.1086/697072
Heslop-Harrison J. 1969. An acetolysis-resistant membrane investing tapetum and sporogenous tissue in the anthers of certain Compositae. – Canad. J. Bot. 47 (4): 541–542.
Hoefert L.L. 1971. Ultrastructure of the tapetal cell ontogeny in Beta. – Protoplasma. 73: 397–406.
Horner H.T. 1977. A comparative light- and microscopic study of microsporogenesis in male-fertile and cytoplasmic male-sterile sunflower (Helianthus annuus). – Amer. J. Bot. 64 (6): 745–759.
[Kamelina] Камелина О.П. 1981. Пыльник. – В кн.: Сравнительная эмбриология цветковых растений. Winteraceae-Juglandaceae. Л. С. 18–21.
[Kamelina] Камелина О.П. 1983. Семейство Datiscaceae. – В кн.: Сравнительная эмбриология цветковых растений. Phytolaccaceae–Thymelaeaceae. Л. С. 139–144.
[Kamelina] Камелина О.П. 1985. Семейство Escalloniaceae. – В кн.: Сравнительная эмбриология цветковых растений. Brunellaceae–Tremandraceae. Л. С. 9–14.
[Kamelina] Камелина О.П. 1991. Сравнительно-эмбриологический анализ как метод филогенетической систематики цветковых растений: Дисс. … Ташкент. 80 с.
[Kamelina] Камелина О.П. 1994. Новый подход к классификации типов тапетума. – В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. Т. 1. С. 56–60.
Kamelina O.P. 2002. New approach to the classification of tapetum types. – In: Embryology of flowering plants. Terminology and concepts. Enfield (NH), USA- Plymouth, UK. Vol. 1. P. 28–32.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Двудольные. Барнаул. 501 с.
[Kamelina, Teryokhin] Камелина О.П., Терехин Э.С. 1990. Семейство Zannichelliaceae. – В кн.: Сравнительная эмбриология цветковых растений. Butomaceae–Lemnaceae. Л. С. 44–50.
[Kordyum] Кордюм Е.Л. 1978. Эволюционная цитоэмбриология покрытосеменных растений. Киев. 219 с.
[Koteyeva et al.] Котеева Н.К., Миргородская О.Е., Булышева М., Мирославов Е.А. 2015. Формирование пыльцы Ribes nigrum (Grossulariaceae) в связи с периодом пониженных температур. – Бот. журн. 100 (10): 1001–1014.
[Lodkina] Лодкина М.М. 1971. Формирование пыльцевых мешков у двух видов ряски. – Материалы V Всесоюзного совещания по эмбриологии растений. Кишинев. С. 102.
Maheshwari S.C. 1954. The embryology of Wolffia. – Phytomorphology. 4 (4): 355–365.
Maheshwari S.C., Kapil R.N. 1963. Morphological and embryological studies on the Lemnaceae. 1. The floral structure and gametophytes of Lemna paucicostata. – Amer. J. Bot. 50 (7): 677–686.
[Mirgorodskaya, Miroslavov] Миргородская О.Е., Мирославов Е.А. 2012. Микроспорогенез и развитие клеток тапетума Rhododendron luteum (Ericaceae). – Бот. журн. 97 (1): 356–365.
Mirgorodskaya O.E., Koteyeva N.K., Volchanskaya A.V., Miroslavov E.A. 2015. Pollen development in Rhododendron in relation to winter dormancy and bloom time. – Protoplasma. 252: 1313–1323. https://doi.org/10.1007/s00709-015-0764-y
Narayana L.L. 1963. Contributions to the embryology of Balsaminaceae. – J. Ind. Bot. Soc. 42 (1): 102–109.
[Nikiticheva] Никитичева З.И. 1990. Семейство Alismataceae. – В кн.: Сравнительная эмбриология цветковых растений. Butomaceae–Lemnaceae. Л. С. 16–20.
[Ogorodnikova] Огородникова В.Ф. 1986. Генезис и ультраструктура спорополлениновой оболочки клеток тапетума злаков. – Бот. журн. 71 (10): 1366–1371.
[Ogorodnikova] Огородникова В.Ф. 1990. Динамика ультраструктуры клеточных органелл тапетума Triticum aestivum (Poaceae). – Бот. журн. 75 (2): 186–192.
[Ogorodnikova] Огородникова В.Ф. 1994. Тапетальная мембрана. – В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. Т. 1. С. 49–50.
Owen H. A., Makaroff C.A. 1995. Ultrastructure of microsporogenesis and microgametogenesis in Arabidopsis thaliana (L.) Heynh., ecotype Wassilewskaja (Brassicaceae). – Protoplasma. 185: 7–21.
Pacini E. 1997. Tapetum character states: analytical keys for tapetum types and activities. – Canad. J. Bot. 75 (9): 1448–1459.
Pacini E. 2010. Relationships between tapetum, loculus, and pollen during development. – Int. J. Plant Sci. 171 (1): 1–11.
Pacini E., Franchi G.G., Hesse M. 1985. The tapetum: its form, function and possible phylogeny in Embryophyta. – Plant Sys. Evol. 149 (3–-4): 155–185.
Periasamy K., Swamy B.G.L. 1966. Morphology of anther tapetum in angiosperms. – Curr. Sci. 35 (17): 427–431.
Pettit J.M. 1966. A new interpretation of the structure of the megaspore membrane in some gymnospermous ovules. – J. Linn. Soc. London (Bot.). 59 (379): 253–263.
Prakash N., McAlister E.J. 1977. An embryological study of Bauera capitata with comments of the systematic position of Bauera. – Austral. J. Bot. 25 (6): 615–622.
Pullaiach T., Swarajya Lakshmi P.L. 1984. A contribution to the embryology of Cicerbita alpina (Linn.) Wallr. – Proc. Indian Acad. Sci. (Plant Sci.). 93 (4): 437–443.
Quilichini T.D., Douglas C.J., Samuels A.L. 2014. New views of tapetum ultrastructure and pollen exine development in Arabidopsis thaliana. – Ann. Bot. 114 (6): 1189–1201.
Rezanejad F. 2008. The structure and ultrastructure of anther epidermis and pollen in Lagerstroemia indica L. (Lythraceae) in response to air pollution. – Turkish J. Bot. 32 (1): 35–42.
Rowley J.R. 1993. Cycles of hyperactivity in tapetal cells. – Pl. Syst. Evol. [Suppl.]. 7: 23–37.
Rowley J.R., Gabarayeva N.I., Walles B. 1992. Cyclic invasion of tapetal cells into loculi during microspore development in Nymphaea colorata (Nymphaeaceae). – Amer. J. Bot. 79 (7): 801–808.
Rowley J.R., Walles B. 1988. Cell differentiation in microsporangia of Pinus sylvestris: diplotene and diffuse stage. – Ann. Sci. Nat. Paris. Ser. 13. 9: 1–28.
Sanders P.M., Bui A.Q., Weterings K. et al. 1999. Anther developmental defects in Arabidopsis thaliana male-sterile mutants. – Sex. Plant Reprod. 11: 297–322.
[Shamrov] Шамров И.И. 1986. Развитие пыльника у Gentiana lutea (Gentianaceae). – Бот. журн. 71 (6): 733–739.
Shamrov I.I. Structure of septate anthers in some flowering plants. – Ann. Sci. de l’Univ. Reims. 1988. 23: 68–70.
[Shamrov] Шамров И.И. 2006. Морфологическая природа семязачатка и эволюционные тенденции его развития у цветковых растений. – Бот. журн. 91 (11): 1601–1636.
[Shamrov] Шамров И.И. 2008а. Семязачаток цветковых растений: строение, функции, происхождение. М. 356 с.
[Shamrov] Шамров И.И. 2008b. Формирование спорангиев высших растений. – Бот. журн. 93 (12): 1817–1845.
[Shamrov ] Шамров И.И. 2015. Эмбриология и воспроизведение растений. СПб. 200 с.
[Shamrov, Babro] Шамров И.И., Бабро А.А. 2008. Развитие и строение пыльника у Rhododendron schlippenbachii и R. luteum (Ericaceae). – Бот. журн. 93 (8): 61–80.
Smith G.M. 1938. Cryptogamic botany. New York–London. Vol. 1. 1–380 p.
[Solntseva] Солнцева М.П. 1987. Семейство Asteraceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae–Tremandraceae. Л. С. 318–331.
Steer M.W. 1977. Differentiation of the tapetum in Avena. I. The cell surface. – J. Cell Sci. 25: 125–138.
Steffen K., Landmann W. 1958. Entwicklungsgeschichte und Zytologische Untersuchungen am Balkentapetum von Gentiana cruciata und Impatiens grandulifera. – Planta. 50 (4): 423–460.
Swamy B.G.L., Lakshmanan K.K. 1962. Contribution to the embryology of the Najadaceae. – J. Indian Bot. Soc. 41 (2): 247–267.
Taylor M.L., Altrichter K.M., Aeilts L.B. 2018. Pollen ontogeny in Ruppia (Alismatidae). – Int. J. Plant Sci. 179 (3): 217–230.
[Teryokhin et al.] Терёхин Э.С., Батыгина Т.Б., Шамров И.И. 1993. Классификация типов стенки микроспорангия у покрытосеменных. Терминология и концепции – Бот. журн. 78 (6): 16–24.
Teryokhin E.S., Batygina T.B., Shamrov I.I. 2002. New approach to classifying modes of microsporangium wall formation. In: Embryology of flowering plants. Terminology and concepts. Enfield (NH), USA- Plymouth, UK. Vol. 1. P. 32–39.
Tiagi B., Taimni S. 1963. Floral morphology and embryology of Vernonia cinerascens, Schult. and V. cinerea Less. – Agra Univ. J. Res. 12: 123–137.
Tischler G. 1915. Die Periplasmodenbildung in den Antheren der Commelinaceen und Ausblicke aus das Verhalten der Tapetenzellen bei den übrigen Monocotylen. – Jarb. Wiss. Bot. 55 (1): 52–90.
Tiwari S.C., Gunning B.E.S. 1986. Development of tapetum and microspores in Canna L.: an example of an invasive but non-syncytial tapetum. – Ann. Bot. 57 (4): 557–563.
[Toderich] Тодерич К.Н. 1988. Эмбриология подсолнечника (Helianthus annuus, H. rigidus и другие): Дис. … канд. биол. наук. Л. 256 с.
[Torshilova, Batygina] Торшилова А.А., Батыгина Т.Б. 2005. Развитие стенки пыльника тычиночного цветка Dioscorea nipponica (Dioscoreaceae) – Бот. журн. 90 (8): 1208–1215.
Venkareswarlu J., Lakshminarayana L. 1957. A contribution to the embryolohy of Hydrocera triflora W. and A. – Phytomorphology. 7 (2): 194–203.
Warming E. 1873. Untersuchungen über pollenbildende Phyllome und Kaulome. – Bot. Abh. Gebiet. Morphologie und Physiologie. 2 (2): 1–90.
Warming E. 1878. De l`ovule. – Ann. Sci. Natur. Bot. Sér. 6. 5: 175–266.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


