Ботанический журнал, 2021, T. 106, № 5, стр. 438-459
РАЗВИТИЕ ЗАРОДЫШЕВОГО МЕШКА У EUPHORBIA MYRSINITES И E. KOMAROVIANA (EUPHORBIACEAE)
Г. Е. Титова 1, *, М. А. Нюкалова 1
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург,
ул. Проф. Попова, 2, Россия
* E-mail: galina_titova@mail.ru
Поступила в редакцию 17.11.2020
После доработки 18.01.2021
Принята к публикации 16.02.2021
Аннотация
В результате изучения процессов мегаспорогенеза и развития зародышевого мешка у Euphorbia komaroviana и E. myrsinites установлено, что оба вида имеют множественный археспорий, многоклеточный спорогенный комплекс и Polygonum-тип развития женского гаметофита. Выявлено большое сходство в реализации этих процессов: преобразование большинства спорогенных клеток в мегаспороциты, их вступление в мейоз и его завершение (с образованием множества тетрад или триад мегаспор); дальнейшее формирование обычно единственного зародышевого мешка; сходная организация яйцевого аппарата, центральной клетки; длительное сохранение антипод. Различия касаются, главным образом, поведения антипод (деления клеток у E. myrsinites, их отсутствие у E. komaroviana), а также способности семязачатка E. komaroviana к спорадическому формированию нескольких зародышевых мешков на базе многоклеточного спорогенного комплекса. Подтвержден вывод об отсутствии связи между числом клеток археспория и типом развития зародышевого мешка у видов Euphorbia. Внесено уточнение в предполагаемую зависимость между поведением антипод и типом развития зародышевого мешка у видов рода Euphorbia: длительность функционирования антипод может быть более связана не с типом развития женского гаметофита, а с большей активностью халазального гаустория эндосперма и массивностью структур халазальной части семязачатка. Подтверждено преобладание моноспорического Polygonum-типа развития в подроде Esula Pers. рода Euphorbia L., к которому относятся исследованные виды (E. komaroviana – секция Holophyllum, E. myrsinites – секция Myrsiniteae, выделенные в результате молекулярно-филогенетического анализа; Riina et al., 2013).
Подрод Esula Pers. – один из 4 подродов рода Euphorbia L. (Euphorbiaceae), выделенных (наряду с подродами Athymalus Neck. ex Rchb. (= Rhizanthium (Boiss.) Wheeler), Euphorbia и Chamaesyce Raf.) на основании молекулярно-филогенетического анализа (Steinmann, Porter, 2002; Bruyns et al., 2006; Horn et al., 2012). Недавно система подрода Esula была существенно пересмотрена с использованием ядерных (ITS) и хлоропластных (ndhF) маркеров (Geltman et al., 2011; Geltman, 2013; Riina et al., 2013). На основании построения филогенетического древа выделены 21 секция, объем и признаки которых в ряде случаев существенно отличаются от принятых ранее (Prokhanov, 1949, 1964, и др.). Две из них – секции Lathyris Dumort. и Lagascae Lázaro, образуют базальные клады, а остальные секции объединены в две крупные продвинутые клады: клада I – секции Holophyllum (Prokh.) Prokh. и Helioscopia Dumort., клада II – секции Myrsiniteae (Boiss.) Lojac., Pithyusa (Raf.) Lázaro, Tithymalus (Gaertn.) Roep., Paralias Dumort., Esula (Pers.) Dumort. и др. (всего 17 секций). Новая молекулярно-филогенетическая система подрода Esula нуждается в проверке и осмыслении с использованием различных признаков, в том числе эмбриологических, которые, как известно, в силу их высокой консервативности широко используются при решении спорных вопросов систематики и филогении растений (Poddubnaya-Arnoldi, 1982; Johri et al., 1992; Tokuoka, Tobe, 1995, 2002; Kamelina, 2009, и др.).
Одним из важных эмбриологических признаков, традиционно используемых в систематике растений, является тип развития женского гаметофита (зародышевого мешка). Род Euphorbia (как и ряд других родов сем. Euphorbiaceae) относится к числу таксонов, характеризующихся значительным разнообразием этого признака – выявлено наличие моно-, би- и тетраспорических типов развития, причем это разнообразие свойственно, в первую очередь, его подроду Esula (Vinogradova, 2017). Предварительный анализ данных по распределению этого признака среди видов данного подрода показал, что тетраспорические типы (Peneae-, Fritillaria-, Plumbagella- и другие) отмечены у видов его наиболее крупной секции Helioscopia, а биспорический (Allium-тип) – в нескольких небольших секциях (Lagascae, Patellares (Prokh.) Frajman, Aphyllis Webb et Berthel.). Моноспорический Polygonum-тип (наиболее распространенный у видов данного подрода) встречается в пределах разных секций, в том числе (наряду с тетраспорическими типами) и в секции Helioscopia (см. также Vinogradova, 2017). Важно отметить, что секция Helioscopia, в которой концентрируются тетраспорические типы, относится к крупной продвинутой кладе I подрода Esula, а секции Patellares и Aphyllis с биспорическим типом – к его крупной продвинутой кладе II. Базальные клады проявляют гетерогенность: Polygo-num-тип – в секции Lathyris, Allium-тип – в секции Lagascae. Для дальнейшего анализа тенденций в распределении признака “тип развития зародышевого мешка” среди видов подрода Esula рода Euphorbia, а также понимания направлений его эволюции в пределах данного подрода, необходимо вовлечение в исследование большего числа видов: из известных для него примерно 480 видов около 440 видов остаются не изученными в этом отношении. Особенно слабо изучены виды секций, лежащих в основании или близко к основанию его молекулярно-филогенетического древа. Среди видов базальных клад (Lathyris, Lagascae) развитие женского гаметофита изучено лишь у Euphorbia lathyris Dumort. (монотипная секция Lathyris) (Modilewski, 1910, 1911) и E. lagascae Spreng. (секция Lagascae, 3 вида) (D’Amato, 1946). Виды же секций клад I и II, расположенных наиболее близко к этим двум базальным кладам – секций Holophyllum и Myrsiniteae (27 и 16 видов, соответственно), являются практически не изученными.
Цель настощей работы – выявление типа развития зародышевого мешка у Euphorbia myrsinites L. из секции Myrsiniteae и E. komaroviana из секции Holophyllum подрода Esula рода Euphorbia L., расположенных вблизи его базальных секций Lathyris и Lagascae, но контрастирующих по принадлежности к двум разным крупным продвинутым кладам (II и I, соответственно).
МАТЕРИАЛ И МЕТОДЫ
Euphorbia myrsinites (молочай миртолистный) и E. komaroviana (молочай Комарова) являются многолетними травами, у E. myrsinites с полегающими, обычно зимующими побегами и очередными суккулентными листьями, а у E. komaroviana с прямостоячими стеблями и очередными листьями мезофильной природы. Оба вида характеризуются наличием особых соцветий-циатиев и плодов-регма (характерных для всех видов рода Euphorbia). E. myrsinites встречается в Юго-Западной и Юго-Восточной Европе, Юго-Западной Азии (Турция, Иран), на Кавказе и в Крыму; цветет в апреле, повторно – в июне. E. komaroviana произрастает в горных лесах Дальнего Востока, в Манчжурии, также описан в районе Владивостока; цветет с середины апреля по вторую половину мая (Prokhanov, 1949; Radcliffe-Smith, Tutin, 1968; Geltman, 2016).
Материал по Euphorbia myrsinites и E. komaroviana (семязачатки и завязи на разных стадиях развития) собирали в условиях естественного произрастания (окр. Никитского Ботанического сада Национального научного центра РАН, г. Ялта, Крым и Ботанического сада-института ДВО РАН, г. Владивосток, Приморский край, соответственно), в апреле–начале мая 2015 г. Дополнительно, материал по E. myrsinites был также собран на территории Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН (БИН РАН), в июне–июле 2016 и 2017 гг.
Собранный материал фиксировали в смеси FAA (70%-ный этанол : формалин : концентрированная уксусная кислота = 100 : 7 : 7). Постоянные препараты готовили по общепринятой цитоэмбриологической методике (Pausheva, 1980). Срезы толщиной 12 мкм получали на микротоме Microm HM 325 (Carl Zeiss, Germany) и окрашивали сафранином и алциановым синим; анализ препаратов и микрофотосъемку осуществляли на микроскопе Axioplan2 с ПО AxioVision (Carl Zeiss, Germany).
Структуры базальной части нуцеллуса семязачатка описывали в соответствии с типизацией И.И. Шамрова (Shamrov, 2008).
РЕЗУЛЬТАТЫ
Гинецей у Euphorbia myrsinites и E. komaroviana синкарпный, из 3 плодолистиков. Завязь трехгнездная, в каждом гнезде формируется по одному семязачатку. Примордии семязачатков закладываются на центрально-угловых плацентах почти одновременно с примордиями плодолистиков. Однако, в дальнейшем рост плодолистиков опережает рост семязачатков, а плацента подвергается интеркалярному росту с образованием колончатого выроста, верхушка которого разрастается с образованием трех плацентарных обтураторов. Вследствие интеркалярного роста плаценты семязачатки, исходно занимающие в плодолистиках пазушное положение, оказываются расположенными на верхушке плацентарного выроста; при этом они несколько смещаются на боковую поверхность обтуратора, приобретая гемитропное положение – с расположением оси микропиле-халаза почти параллельно поверхности плаценты (рис. 1, 1–7).
Рис. 1.
Развитие семязачатка Euphorbia myrsinites, схематизировано.
1–7 – строение семязачатка на стадиях заложения археспория (1), формирования мегаспороцитов (2); тетрад мегаспор (3), функциональной мегаспоры (4), 2-ядерного (5), 4-ядерного (6) и сформированного зародышевого мешка (7); a – археспорий, с – карункула, c b – проводящий пучок, ep – эндопахихалаза, e s – зародышевый мешок, i i – внутренний интегумент, h – гипостаза, mc – мегаспороциты, о – обтуратор, o i – наружный интегумент, pd – подиум, ps – постамент, p o – плацентарный вырост, p t – париетальная ткань, w o – стенка завязи (объяснения в тексте). Масштабная линейка: 50 мкм.
Fig. 1. Ovule development in Euphorbia myrsinites (schematized).
1–7 – ovule structure at the stages of laying down archesporium (1), formation of megasporocytes (2), tetrads of megaspores (3), functional megaspore (4), 2-nucleate (5), 4-nucleate (6) and formed embryo sac (7); a – archesporium, с – caruncle, c b – conductive band, ep – endopachyhalaza, e s – embryo sac, i i – inner integument, h – hypostase, mc – megasporocytes, о – obturator, o i – outer integument, pd – podium, ps – postament, p o – placenta outgrowth, p t – parietal tissue, w o – wall of ovary (see the text for explanations). Scale bars – 50 μm.
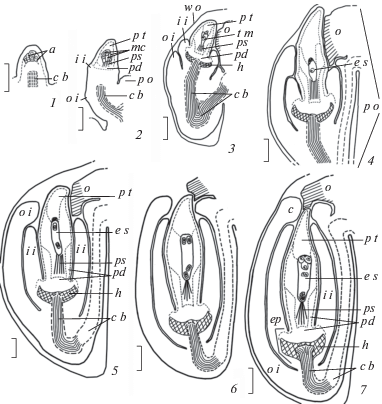
Развитие семязачатка у E. myrsinites и E. komaroviana осуществляется в целом сходно; оно схематично проиллюстрировано нами на примере E. myrsinites. В ходе него происходит заложение и рост основных структур семязачатка – нуцеллуса, интегументов, халазы, гипостазы, рафе и фуникулуса. Сформированные семязачатки гемитропные, крассинуцеллятные, битегмальные, с коротким фуникулусом; ось микропиле–халаза ориентирована под углом в 25° к плаценте и в области микропиле изогнута к обтуратору. Нуцеллус семязачатка имеет отчетливую зональность строения, проявляющуюся в его дифференциации на структуры, свойственные семязачаткам крассинуцеллятного типа – многослойную париетальную ткань и нуцеллярный колпачок, образующие в апикальной части нуцеллуса массивную клювовидную структуру, и хорошо выраженные постамент и подиум в его базальной части. Для семязачатка характерно нетипичное положение гипостазы и окончания массивного проводящего пучка рафе – внутри основания внутреннего интегумента (рис. 1, 1–7), что, очевидно, связано с формированием в нем эндопахихалазы – структуры, закладывающейся в семязачатке, но наиболее отчетливо выявляющейся лишь в ходе развития семени (подробнее, см. Titova et al., 2018а, 2019). Морфогенетический механизм возникновения эндопахихалазы в семязачатке пока остается неясным и явится предметом отдельного исследования. Следует также отметить, что, несмотря на единую общую схему формирования, сформированные семязачатки E. myrsinites и E. komaroviana различаются по массивности структур, особенно базальной части – несколько меньшей у E. myrsinites, чем у E. komaroviana (см. Titova et al., 2019).
Мегаспорогенез и развитие зародышевого мешка у Euphorbia myrsinites. На самых ранних этапах развития в субэпидермальном слое апекса примордия семязачатка E. myrsinites дифференцируется комплекс инициальных клеток, которые далее делятся периклинально, отделяя наружу будущие клетки археспория, а внутрь – клетки, производные которых в дальнейшем войдут в состав базальной части нуцеллуса и внутренних областей халазы и фуникулуса (рис. 1, 1; 2, 1). Клетки археспория расположены в один слой, причем 2 из них, по-видимому, лежат в центре примордия семязачатка, а остальные – по окружности. По мере роста примордия клетки археспория также подвергаются периклинальным делениям, с отделением слоя спорогенных и париетальных клеток (рис. 2, 2). Далее спорогенные клетки вновь делятся периклинально, с образованием массивного комплекса спорогенных клеток (рис. 2, 3), после чего происходит их постепенное преобразование в мегаспороциты (рис. 2, 4). Формирование спорогенного комплекса завершается на стадии инициации в семязачатке интегументов и начала дифференциации базальной зоны нуцеллуса на постамент и подиум. Спорогенный комплекс состоит из 16–18 клеток, лежащих в два слоя (4 клетки в 2 яруса в центре, остальные – в 2 яруса, по окружности), при этом деления париетальных клеток на этой стадии еще не наблюдаются (рис. 1, 2; 2, 5а, b).
Рис. 2.
Мегаспорогенез в семязачатке Euphorbia myrsinites.
1 – строение археспория, 2, 3 – спорогенных клеток (до и после их периклинальных делений, с образованием двух ярусов клеток), 4 – мегаспороцитов, 5а, b – семязачатка на стадии формирования многоклеточного спорогенного комплекса (5а – общий вид, схематизировано, 5b – спорогенный комплекс, объемная реконструкция), 6a, b – основной развивающийся мегаспороцит в окружении менее развитых мегаспороцитов, 7a, b, 8a, b – множественные мегаспороциты, вступающие в мейоз, и тетрады мегаспор (1–5b, 7a, b – продольные срезы семязачатка в дорсивентральной плоскости, 8a, b – в его билатеральной плоскости, 6a, b – поперечные срезы); а c – археспориальные клетки, c b – проводящий пучок, i i – внутренний интегумент, mc – мегаспороциты, n – нуцеллус, o i – наружный интегумент, pd – подиум, ps – постамент, p t – париетальная ткань, s c – спорогенные клетки, t m – тетрады мегаспор (объяснения в тексте). Масштабная линейка – 10 мкм.
Fig. 2. Megasporogenesis in the ovule of Euphorbia myrsinites.
The structure: 1 – of archesporium, 2, 3 – of sporogenous cells (before and after their periclinal divisions, with formation of two cell tiers), 4 – of megasporocytes, 5а, b – of ovule at the stage of many-celled sporogenous complex formation (5а – general view, schematized, 5b – sporogenous complex, 3D-reconstruction); 6a, b – main developing megasporocyte surrounded by less developed ones, 7a, b, 8a, b – multiple megasporocytes entering into meiosis and tetrads of megaspores (1–5b, 7a, b – longitudinal sections of ovule in dorzoventral plane, 8a, b – in bilateral plane, 6a, b – cross sections); а c – archesporial cells, c b – conductive band, i i – inner integument, mc – megasporocytes, n – nucellus, o i – outer integument, pd – podium, ps – postament, p t – parietal tissue, s c – sporogenous cells, t m – tetrads of megaspores (see the text for explanations). Scale bars – 10 µm.
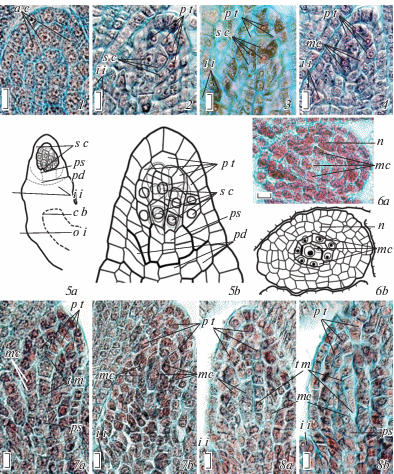
Преобразование спорогенных клеток в мегаспороциты происходит неравномерно – наибольшему удлинению подвергаются, в первую очередь, клетки верхнего центрального яруса, занимающего в семязачатке осевое положение, а остальные отстают в развитии. При этом развивающиеся мегаспороциты уплощаются из-за уплощения нуцеллуса в его билатеральной плоскости (рис. 2, 4, 6а, b). Эти же клетки первыми вступают в мейоз, каждое из двух последовательных делений которого сопровождается заложением клеточных перегородок, с образованием сначала диады, а затем тетрады или триады мегаспор линейного или T-образного типа, что свидетельствует о моноспорическом типе развития. Тетрады мегаспор, формирующиеся из верхних центральных мегаспороцитов, наблюдаются уже на стадии образования в семязачатках примордиев интегументов (рис. 1, 3; 2, 7а–8b), тогда как тетрады, формирующиеся из остальных мегаспороцитов (иногда лишь диады) – на стадии частичного обрастания нуцеллуса интегументами (рис. 3, 1а–с). Характерно, что процесс мейоза сопряжен с активацией дальнейших делений клеток париетальной ткани и латеральной части нуцеллуса, толщина которых заметно увеличивается (число слоев клеток постамента и подиума почти не меняется). При этом в цитоплазме клеток париетальной ткани и мегаспороцитов появляются мелкие сферические включения (рис. 3, 1b, с).
Рис. 3.
Развитие зародышевого мешка у Euphorbia myrsinites.
1a – нуцеллус с тетрадами мегаспор по окончании мейоза, 1b, c – тетрады с начальными (1b) и явными (1c) признаками дегенерации нефункциональных мегаспор, 2 – растущая функциональная мегаспора, 3a – нуцеллус с 2-ядерным зародышевым мешком, 3b – тот же зародышевый мешок в окружении дегенерирующих тетрад мегаспор, увеличено, 3c – другие тетрады и диады мегаспор в разной степени дегенерации на следующем срезе (1а–3с – продольные срезы семязачатка в дорсивентральной плоскости), 4a–d – строение сформированного зародышевого мешка на продольном срезе в билатеральной плоскости семязачатка (4a, b) и на поперечных срезах на уровне яйцевого аппарата (4c) и антипод (4d); a – антиподы, c c – центральная клетка, d – диада, d m – дегенерирующие мегаспоры, e – яйцеклетка, e s – зародышевый мешок, o i – наружный интегумент, p n – полярные ядра, s1, s2 – синергиды, s i – сферические включения, остальные обозначения – см. рис. 1 (объяснения в тексте). Масштабная линейка, мкм: 1a, 3a – 50, 1b – 2, 3b–4d – 10.
Fig. 3. Development of embryo sac in Euphorbia myrsinites.
1a – nucellus with tetrads of megaspores at the completion of the meiosis, 1b, с – tetrads with first (1b) and clear (1c) signs of degeneration of non-functional megaspores, 2 – growing functional megaspore, 3a – nucellus with 2-nucleate embryo sac, 3b – the same embryo sac surrounded by degenerating tetrads of megaspores, enlarged, 3c – other tetrads and dyads with different degree of degeneration on next section (1а–3с – longitudinal sections of ovule in dorzoventral plane), 4a–d – the structure of formed embryo sac at the longitudinal section in ovule bilateral plane (4a, b) and at cross sections at the level of egg apparatus (4c) and antipodals (4d); a – antipodals, c c – central cell, d – dyad, d m – degenerating megaspores, e – egg cell, e s – embryo sac, o i – outer integument, p n – polar nuclei, s1, s2 – synergids, s i – spherical inclusions, for the other designations see Fig. 1 (see the text for explanations). Scale bars, µm: 1a, 3a – 50, 1b – 2, 3b–4d – 10.
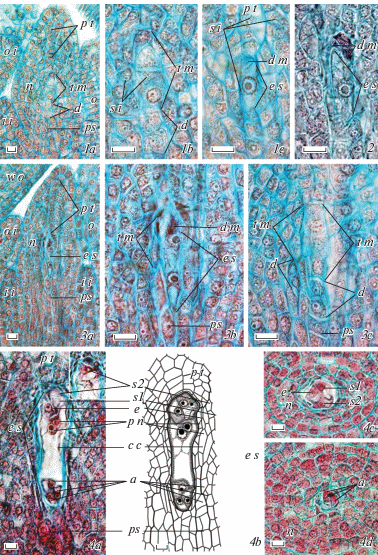
После образования тетрад мегаспор начинается формирование зародышевого мешка, обычно единственного, возникающего на базе одной из тетрад мегаспор верхнего центрального яруса. Функциональной является халазальная мегаспора, которая подвергается удлинению (остальные мегаспоры дегенерируют). Ее ядро занимает центральное положение, а в цитоплазме формируются мелкие вакуоли, и сохраняется присутствие сферических включений (рис. 1, 4; 3, 1с, 2). После первого митотического деления образуется 2-ядерный зародышевый мешок, ядра которого расходятся к противоположным полюсам. Толщина париетальной ткани на этой стадии возрастает до 10–11 слоев клеток. Одновременно происходит рост числа слоев клеток постамента и подиума; внутренний интегумент достигает почти середины нуцеллуса, а наружный – обрастает внутренний. На этой стадии в нуцеллусе еще различимы остальные тетрады и диады мегаспор, остановившиеся в развитии и проявляющие начальные признаки лизиса (рис. 1, 5; 3, 3а–с).
Затем ядра зародышевого мешка на каждом полюсе претерпевают еще два митотических деления, после чего происходит процесс клеткообразования (рис. 1, 6, 7). Сформированный зародышевый мешок 7-клеточный, 8-ядерный: 3 клетки на микропилярном полюсе (яйцевой аппарат), 3 – на халазальном (антиподальный аппарат) и расположенная между ними центральная клетка с двумя полярными ядрами. В ходе этих стадий развития число слоев париетальной ткани почти не увеличивается, однако существенно возрастает массивность постамента, подиума и латеральной части нуцеллуса; наружный интегумент полностью обрастает нуцеллус, при этом его апикальная часть расширяется с образованием карункулы, однако внутренний интегумент еще не достигает верхушки нуцеллуса. Эти тенденции сохраняются и в ходе созревания зародышевого мешка (рис. 4, 1а) и прогамной фазы, в процессе которой внутренний интегумент, однако, также обрастает верхушку нуцеллуса (рис. 4, 2а).
Рис. 4.
Поздние стадии развития зародышевого мешка у Euphorbia myrsinites.
1a–2c – строение зрелого зародышевого мешка до (1a–c) и в ходе (2a–c) прогамной фазы: 1a, 2a – общий вид зародышевого мешка, 1b, 2b – его яйцевого и 1c, 2c – антиподального аппарата, 3a–d – яйцевой аппарат перед вхождением пыльцевых трубок в нуцеллус (3a–c – его последовательные срезы, 3d – объемная реконструкция), продольные срезы семязачатка в его дорсивентральной (1a–b) и билатеральной (2a–3d) плоскости; f a – нитчатый аппарат, n e – ядро яйцеклетки, n s1 – ядро первой синергиды, n s2 – ядро второй синергиды, v s1 – вакуоль первой синергиды, v s2 – вакуоль второй синергиды, v e – вакуоль яйцеклетки, остальные обозначения – см. рис. 1 и 2 (объяснения в тексте). Масштабная линейка, мкм: 1a, 2a – 50, 1b–c, 2b–3d – 10.
Fig. 4. Late stages of embryo sac development in Euphorbia myrsinites.
1a–2c – the structure of mature embryo sac before (1a–c) and during (2a–c) of progamous phase: 1a, 2a – general view of embryo sac, 1b, 2b – of its egg apparatus, and 1c, 2c – of antipodals, 3a–d – egg apparatus prior to entering of pollen tubes into the nucellus (3a–c – its sequential sections, 3d – 3D-reconstruction), longitudinal sections of ovule in its dorzoventral (1a–b) and bilateral (2a–3d) planes; f a – filiform apparatus, n e – nucleus of egg cell, n s1 – nucleus of 1st synergid, n s2 – nucleus of 2nd synergid, v s1 – vacuole of 1st synergid, v s2 – vacuole of 2nd synergid, v e – vacuole of egg cell, for the other designations see Figs. 1 and 2 (see the text for explanations). Scale bars, µm: 1a, 2a – 50, 1b–c, 2b–3d – 10.

В ходе созревания зародышевого мешка его клетки постепенно приобретают характерные черты специализации. На ранних стадиях развития клетки яйцевого аппарата начинают увеличиваться в размерах и подвергаться вакуолизации, с приобретением ими характерной поляризации: расположение ядра в базальной, а вакуоли – в апикальной части синергид, и наоборот – расположение ядра в апикальной, а вакуоли – в базальной части яйцеклетки. Клетки яйцевого аппарата расположены типично: яйцеклетка имеет боковое положение, синергиды лежат одна под другой, прилегая основанием к его микропилярному полюсу (при просмотре в профиль, на продольном тангенциальном срезе семязачатка). Антиподы имеют близкую взаимную топографию, но с некоторыми отличиями – боковое положение верхней клетки и осевое двух нижних, лежащих бок о бок и на большем удалении от верхней клетки (обратно Т-образное положение); при этом верхняя и одна из двух нижних клеток антипод находятся в контакте с центральной клеткой. В центральной клетке полярные ядра сближаются возле яйцевого аппарата, при этом ее цитоплазма имеет сетчато-лучевую вакуолизацию (рис. 3, 4a, b). На поперечных срезах зародышевого мешка видно, что синергиды облегают яйцеклетку с двух сторон (рис. 3, 4с), тогда как в антиподах этого не наблюдается, вследствие отмеченной специфики их взаимоположения (рис. 3, 4d).
На стадии зрелого зародышевого мешка и в прогамной фазе его клетки приобретают окончательные черты специализации, связанные с подготовкой к оплодотворению (рис. 4, 1а, 2а). Клетки яйцевого аппарата становятся значительно крупнее. В яйцеклетке сильно увеличивается объем базальной вакуоли. Синергиды выравниваются по длине с яйцеклеткой, в их основании формируются хорошо развитые зубовидные выросты и нитчатый аппарат; в зауженной апикальной части вакуоль приобретает овальную форму, причем выросты нитчатого аппарата проникают и в тонкий слой цитоплазмы, лежащий вокруг вакуоли. Для центральной клетки характерно сохранение положения полярных ядер (без слияния, в контакте друг с другом, вблизи яйцевого аппарата) и характера вакуолизации (рис. 4, 1b, 2b, 3a–d). Существенные изменения происходят и в антиподах. Верхняя антиподальная клетка становится заметно крупнее и вакуолизированнее двух остальных, более узких клеток антипод, нередко двуядерной. Следует также отметить, что на этой стадии развития нами наблюдался другой – линейный, вариант положения антипод, при котором лишь их верхняя, более крупная клетка граничит с центральной клеткой гаметофита (рис. 4, 1с). Это может указывать либо на возможность наличия у E. myrsinites двух различных вариантов топографии антипод на стадии сформированного зародышевого мешка, либо на ее изменение в ходе развития (вследствие сужения халазального конца зародышевого мешка и его внедрения в постамент). В ходе прогамной фазы (при росте пыльцевых трубок в столбике) клетки антипод претерпевают еще более значительные изменения. Их нижние клетки подвергаются дополнительным делениям, тогда как верхняя клетка сохраняет свою форму и двуядерность (рис. 4, 2с). В результате, антиподальный аппарат у E. myrsinites становится 4–5-клеточным и функционирует в ходе оплодотворения, дегенерируя лишь на начальных этапах развития ценоцитного эндосперма (см. также Titova et al., 2019).
Следует также отметить, что в ходе развития зародышевого мешка (после стадии 2-ядерного ценоцита) клетки нуцеллуса в области прилегания к зародышевому мешку начинают подвергаться лизису, причем лизис затрагивает и остановившиеся в развитии дополнительные тетрады мегаспор. Особенно активно этот процесс осуществляется в латеральной области нуцеллуса, а также в клетках постамента (в области контакта с антиподами), что проявляется в интенсивном специфическом окрашивании сафранином как содержимого клеток постамента, так и их ослизняющихся стенок, вследствие чего они становятся утолщенными, что позволяет предположить в них наличие апопластного транспорта метаболитов. Лизис клеток париетальной ткани (в области прилегания к гаметофиту) становится активным несколько позднее – к стадии сформированного зародышевого мешка. Отмеченные изменения также сопровождаются продолжением накопления сферических включений – как в клетках самого гаметофита, так и в клетках нуцеллуса, особенно в его париетальной ткани (рис. 3, 4а; 4, 1b, c, 2b, c, 3c).
Таким образом, по совокупности признаков (моноспорический, биполярный, 3-митозный) тип развития зародышевого мешка у E. myrsinites следует отнести к Polygonum-типу развития, по классификации И.Д. Романова (Romanov, 1971). В то же время, развитие зародышевого мешка у данного вида характеризуется рядом специфических особенностей, в частности, увеличением числа клеток антипод в ходе его созревания и прогамной фазы, а также числа ядер в их отдельных клетках, вследствие чего зрелый зародышевый мешок становится 8–9-клеточным, 8–10-ядерным.
Мегаспорогенез и развитие зародышевого мешка у Euphorbia komaroviana. Самая ранняя стадия развития, которую мы наблюдали у E. komaroviana – семязачаток на стадии окончания мейоза в мегаспороцитах и начала формирования зародышевого мешка. Семязачаток на этой стадии имеет примерно то же строение, что и у E. myrsinites. Его внутренний интегумент достигает уровня нижней трети нуцеллуса, а наружный интегумент обрастает внутренний интегумент; париетальная ткань 10–11-слойная; в подиуме и постаменте идут активные деления клеток (рис. 5, 1). В центре нуцеллуса уже присутствует 2-ядерный зародышевый мешок, а по бокам от него – многочисленные тетрады мегаспор, также лежащие в два яруса (рис. 5, 2a–c). Ядра в 2-ядерном зародышевом мешке расположены на его противоположных полюсах; выше него расположены дегенерирующие мегаспоры (рис. 5, 2b). Большинство тетрад мегаспор линейного типа и находятся в состоянии дегенерации, хотя в отдельных из них халазальные мегаспоры претерпевают развитие (рис. 5, 2a). Общее число тетрад мегаспор в семязачатке E. komaroviana на этой стадии развития было близким к таковому E. myrsinites (16–18), хотя характер их взаимного положения выяснить не удалось. Это свидетельствует о формировании в семязачатке данного вида на ранних стадиях развития множественного археспория, а также большого числа спорогенных клеток (спорогенного комплекса) и мегаспороцитов (как и у E. myrsinites).
Рис. 5.
Развитие зародышевого мешка у Euphorbia komaroviana.
1 – семязачаток на стадии 2-ядерного зародышевого мешка, 2a–c – последовательные срезы нуцеллуса с 2-ядерным зародышевым мешком и множественными тетрадами мегаспор (дегенерирующими или с развивающейся халазальной мегаспорой), 3a–d – зародышевый мешок в прогамной фазе (3a – общий вид, 3b – яйцевой аппарат и 3c, d – антиподы с линейным и Т-образным расположением), 4а, b – последовательные срезы микропилярной части зародышевого мешка на стадии зиготы, 4с – его халазальная часть с сохраняющимися антиподами; en – эндосперм, e s1 – основной, 2-ядерный зародышевый мешок, e s1 – зародышевый мешок, развивающийся из дополнительной тетрады мегаспор, l e n – нижнее ядро эндосперма, u e n – его верхнее ядро, z – зигота, остальные обозначения – см. рис. 1–3 (объяснения в тексте). Масштабная линейка, мкм: 1a, 3a, 4a–c – 50, 2a–c, 3b–d – 10.
Fig. 5. Development of embryo sac in Euphorbia komaroviana.
1 – ovule at the stage of 2-nucleate embryo sac, 2a–c – sequential sections of its nucellus with 2-nucleate embryo sac and multiple tetrads of megaspores, degenerating or with developing chalazal megaspore, 3a–d – embryo sac in progamous phase (3a – general view, 3b – egg apparatus, 3c, d – antipodals with linear and Т-shaped arrangement), 4а, b – sequential sections of embryo sac micropylar part at the stage of zygote, 4с – its chalazal part with preserving antipodals; en – endosperm, e s1 – main 2-nucleate embryo sac, e s1 – embryo sac developing from megaspore of additional tetrad, l e n – lower nucleus of endosperm, u e n – its upper nucleus, z – zygote, for the other designations see Figs. 1–3 (see the text for explanations). Scale bars, µm: 1a, 3a, 4a–c – 50, 2a–c, 3b–d – 10.
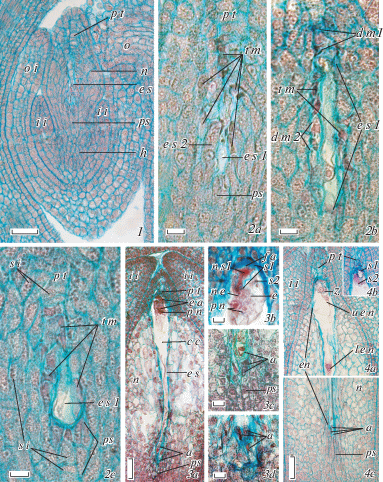
Дальнейшее развитие зародышевого мешка у E. komaroviana также во многом сходно с таковым E. myrsinites, хотя имеются и некоторые отличия. Сформированный зародышевый мешок у этого вида также 7-клеточный 8-ядерный (яйцевой аппарат, центральная клетка с 2 полярными ядрами, 3 клетки-антиподы); его клетки имеют тот же характер специализации. Однако зародышевый мешок E. komaroviana является более длинным и узким, чем у E. myrsinites, а его антиподальный аппарат в процессе специализации не подвергается дополнительным делениям и остается 3-клеточным (рис. 5, 3a–d), причем наблюдалось два варианта топографии его клеток – линейная и Т-образная (рис. 5, 3c, d). Последний факт делает более предпочтительной версию о двух разных исходных вариантах топографии этих клеток и у E. myrsinites. В то же время, антиподы в зародышевом мешке E. komaroviana, как и у E. myrsinites, продолжают функционировать в ходе прогамной фазы и на первых этапах развития ценоцитного эндосперма (рис. 5, 4a–c), после чего подвергаются дегенерации. Еще одна особенность – способность отдельных семязачатков E. komaroviana к реализации развития нескольких гаметофитов. В частности, в некоторых сформированных семязачатках наблюдалось присутствие 3 зародышевых мешков – один полностью развитый, с функциональными клетками, второй – развитый, но с признаками дегенерации клеток, третий – недоразвитый, в стадии 4-ядерного ценоцита; при этом полностью развитый мешок находился в контакте и с париетальной тканью, и с постаментом нуцеллуса (рис. 6, 1a, b), второй (с признаками дегенерации) – лишь в контакте с париетальной тканью (рис. 6, 2), третий (4-ядерный) – лишь в контакте с постаментом (рис. 6, 3). Характерно, что эта особенность развития семязачатка коррелирует у E. komaroviana с достижением к моменту оплодотворения несколько большей массивности структур его халазальной части (по сравнению с E. myrsinites; см. Titova et al., 2019), а также с некоторой спецификой структуры постамента. Клетки постамента, контактирующие с антиподами, не приобретают специфического окрашивания сафранином ни на одной из стадий развития зародышевого мешка(-ов), а для их цитоплазмы характерно накопление сферических включений (рис. 5, 2b, c; 6, 1b), что не свойственно постаменту E. myrsinites. Для остальных зон нуцеллуса характерны те же закономерности развития.
Рис. 6.
Формирование нескольких зародышевых мешков в семязачатке Euphorbia komaroviana.
1a–3 – последовательные срезы нуцеллуса одного и того же сформированного семязачатка, иллюстрирующие развитие в нем 3 зародышевых мешков одновременно: 1a–b – полностью развитого (зрелого), 2 – развитого, но с дегенерирующими клетками и 3 – недоразвитого, 4-ядерного зародышевого мешка (1a – микропилярная, 2b – халазальная часть полостью развитого зародышевого мешка); e s1 – полностью развитый зародышевый мешок, e s2 – развитый зародышевый мешок, но с признаками дегенерации клеток, e s3 – 4-ядерный зародышевый мешок, остальные обозначения – см. рис. 1–4 (объяснения в тексте). Масштабная линейка – 50 мкм.
Fig. 6. Formation of several embryo sacs in the ovule of Euphorbia komaroviana.
1a–3 – sequential sections of the nucellus from the same ovule to illustrate a simultaneous development of 3 embryo sacs: 1a–b – wholly developed (mature) embryo sac, 2 – developed embryo sac, but with degenerating cells, and 3 – undeveloped 4-nucleate embryo sac (1a – micropylar, 2b – chalazal part of fully developed embryo sac); e s1 – wholly developed embryo sac, e s2 – developed embryo sac, but with the signs of degeneration, e s3 – 4-nucleate embryo sac, for the other designations see Figs. 1–4 (see the text for explanations). Scale bars – 50 µm.
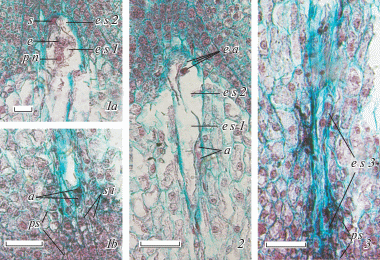
Таким образом, развитие зародышевого мешка E. komaroviana (как и у E. myrsinites) соответствует моноспорическому Polygonum-типу. Однако вследствие отсутствия делений клеток антипод в ходе их специализации, зрелый зародышевый мешок данного вида является 7-клеточным 8-ядерным, хотя его антиподы также сохраняются до первых этапов развития эндосперма. Отдельным семязачаткам E. komaroviana свойственна способность к формированию нескольких зародышевых мешков, что коррелирует с определенной спецификой развития структур семязачатка.
ОБСУЖДЕНИЕ
Как отмечено выше, род Euphorbia относится к числу таксонов цветковых растений, характеризующихся значительным разнообразием типов развития зародышевого мешка, и издавна привлекает внимание эмбриологов в связи с проблемой классификации и эволюции женского гаметофита (Battaglia, 1947, 1989; Maheshwari, 1948, 1950; Romanov, 1971; Chaturvedi, Dalal, 2000; Peche-nitsyn, 2002, и многие др.). У видов данного рода отмечено наличие как моноспорических, так и би- и тетраспорических типов развития зародышевого мешка. Среди моноспорических типов выявлен Polygonum-тип, среди биспорических – Allium-тип, а среди тетраспорических – Penaea-, Fritillaria-, Chrysanthemum cinerariefolium-, Chrysanthemum parthenium- и Plumbagella-типы. Интересно, что все “отклоняющиеся” типы до сих пор описаны лишь у видов подрода Esula рода Euphorbia, выделенного на основании молекулярно-филогенетического анализа (Geltman, 2013, 2016; Riina et al., 2013). Согласно обобщениям Г.Ю. Виноградовой (Vinogradova, 2017), биспорический Allium (= Scilla)-тип обнаружен у E. mauritanica (Ventura, 1933), E. characias, E. amygdaloides (D’Amato, 1939) и E. lagascae (D’Amato, 1946), тетраспорические типы – у E. procera, E. palustris (Penaea-тип; Modilewski, 1909; 1911), E. dulcis (Fritillaria-тип, Carano, 1925, 1926; Cesca, 1961; Kapil, 1961), E. bivonae, E. acanthothamnos (Chrysanthemum cinerariafolium-тип; Cesca, 1966) и E. epithymoides (Chrysanthemum cinerariefolium-, Chrysanthemum parthenium-, Plumbagella- и Fritillaria-типы одновременно; Cesca, 1969). Анализ распределения признака “тип развития зародышевого мешка” среди видов подрода Esula (по системе Riina et al., 2013), проведенный тем же автором (Vinogradova, 2017), показал, что тетраспорические типы сконцентрированы в его наиболее крупной секции Helioscopia, тогда как биспорические – в небольших секциях: Patellares (E. characias, E. amygdaloides), Aphyllis (E. mauritanica) и Lagascae (E. lagascae) (табл. 1). У остальных изученных видов подрода Esula (по данным автора – 23 вида из 33 изученных в целом) выявлен Polygonum-тип.
Таблица 1.
Степень изученности видов подрода Esula рода Euphorbia по признаку “тип развития зародышевого мешка” и распределение этого признака в пределах его разных клад Table 1. Level of knowledge of the character “type of embryo sac development” in the Euphorbia subgenus Esula species and its distribution within its different clades
| Клада Clade |
Секция Section |
Число
видов Number of species |
Число изучен-
ных видов Number of species studied |
Виды с моноспори- ческим типом развития Species with monosporic type of development | Виды с биспо-рическим ти-
пом развития Species with bisporic type of development |
Виды с тетраспори-
ческим типом развития The species with tetrasporic type of development |
|---|---|---|---|---|---|---|
| Lathyris | Lathyris Dumort. | 1 | 1 | E. lathyris L. (Modilewski, 1910, 1911) | ||
| Lagascae | Lagascae Lázaro | 3 | 1 | E. lagascae Spreng. (D’Amato, 1946) | ||
| I | Holophyllum (Prokh.) Prokh. | 27 | 0 | |||
| Helioscopia Dumort. | 131 | 17 | E. altissima Boiss., E. spinosa L. (?) (Donati, 1913), E. coralloides L., E. helioscopia L. (Modilewski, 1910, 1911; Bhalla, 1941), E. hyberna L., E. melitensis Parl. (Cesca, 1963, 1967), E. pilosa L. (Singh, Jane, 1965), E. pubescens Vahl. (= E. hirsuta L.) (D’Amato, 1939), E. platyphyllos L. (Schurhoff, 1924), E. peltata Roxb. (= E. stricta L.) (Mukherjee, 1965 |
E. spinosa L. (?) (Cesca, 1963) | E. procera M. Bieb., E. palustris L. (Modilewski, 1909; 1911; Vinogradova, 2017), E. dulcis L. (Carano, 1925; Cesca, 1961; Kapil, 1961), E. bivonae Steud., E. acanthothamnos Heldr. & Sart. ex Boiss. (Cesca, 1966), E. epithymoides L. (Cesca, 1969), E. soongarica Boiss. (?) (Titova et al., 2018) |
|
| II | Myrsiniteae (Boiss.) Lojac. | 16 | 0 | |||
| Pithyusa (Raf.) Lázaro | 53 | 3 | E. gerardiana Jacq. (= E. segueriana Neck. (Modilewski, 1910, 1911), E. falcatа L., E. pithyusa L. (D’Amato, 1939) |
|||
| Sclerocyathium (Prokh.) Prokh. | 9 | 0 | ||||
| Calyptratae Geltman | 2 | 0 | ||||
| Chylogala (Fourr.) Prokh. | 4 | 0 | ||||
| Szovitsiae Geltman | 1 | 9 | ||||
| Patellares (Prokh.) Frajman | 15 | 2 | E. characias L., E. amygdaloides L. (D’Amato, 1939) | |||
| Herpetorrhizae (Prokh.) Prokh. | 12 | 0 | ||||
| Guyonianae Molero et Riina | 1 | 0 | ||||
| Pachycladae (Boiss.) Tutin | 2 | 2 | E. dendroides L., E. terracina L. (D’Amato, 1946) | – | – | |
| Biumbellatae Molero et Riina | 3 | 0 | ||||
| Exiguae (Geltman) Riina et Molero | 5 | 2 | E. exigua L. (D’Amato, 1946), E. dracunculoides Lam. (Mukherjee, 1961) |
|||
| Aphyllis Webb et Berthel. | 23 | 1 | E. mauritanica L. (Ventura, 1933) | |||
| Paralias Dumort. | 12 | 2 | E. paralias L., E. segetalis L. (D’Amato, 1939, 1946) | |||
| Tithymalus (Gaertn.) Roep. | 35 | 0 | ||||
| Arvales (Geltman) Geltman | 6 | 1 | E. maddenii Boiss. (Bhanwra, 1987) | |||
| Esula (Pers.) Dumort. | 98 | 6 | E. salicifolia Host., E. cyparissias L., E. virgata Waldst. et Kit., E. lucida Waldst. et Kit. (Modilewski, 1910, 1911; Vinogradova, 2017), E. oreophila Miquel. (= E. rothiana Spreng.) (Srivastava, 1952 ; Gopinath, Gopalkrishnan, 1949), E. esula L. (Carmichael, Selbo, 1990) |
Эти обобщения можно также дополнить несколькими положениями:
Во-первых, из 21 секции подрода Esula в отношении развития женского гаметофита изучены представители лишь 11 секций. Это – отдельные виды секций Lathyris и Lagascae, представляющих базальные клады его молекулярно-филогенетического древа, ряд видов секции Helioscopia из продвинутой клады I, а также секций Pithyusa, Pachycladae, Exiguae, Paralias, Arvales, Patellares, Aphyllis и Esula из продвинутой клады II (табл. 1).
Во-вторых, моноспорический Polygonum-тип развития женского гаметофита, свойственный большинству изученных видов подрода Esula, отмечен как в его базальной кладе Lathyris (E. lathyris – монотипная секция Lathyris), так и во многих секциях обеих продвинутых клад (I, II). Тетраспорические типы (наряду с моноспорическим) отмечены в продвинутой кладе I, включающей секции Helioscopia и Holophyllum, причем концентрация тетраспорических типов в секции Helioscopia подтверждается и недавними данными по E. soonga-rica, структура зрелого зародышевого мешка которого с высокой степенью вероятности позволяет говорить о наличии у этого вида также Penaea-типа развития женского гаметофита (Titova et al., 2018a). Биспорический же Allium-тип отмечен преимущественно у видов продвинутой клады II (секции Patellares, Aphyllis), хотя также и в базальной кладе Lagascae (с единственной секцией Lagascae), причем наличие моно- и тераспорических типов в секции Lagascae пока не установлено (табл. 1).
В третьих, выявленные тенденции в распределении признака “тип развития зародышевого мешка” среди крупных клад молекулярно-филогенетического древа подрода Esula представляют интерес, поскольку эти клады отражают две основные и разные линии его эволюции – мезофильную (клада I) и ксерофильную (клада II) линии (Geltman, 2013, 2016; Riina et al., 2013). Этот интерес усиливается и тенденциями в распределении этого признака в пределах более мелких клад, в частности, приуроченостью тетраспорических Penaea- (E. procera, E. palustris) и Fritillaria-типов (E. epithymoides, E. dulcis) развития зародышевого мешка к двум разным и более мелким кладам секции Helioscopia (Vinogradova, 2017). Однако эти тенденции нуждаются в проверке: данные по многим видам отсутствуют, а по ряду видов – нуждаются в уточнении (Polygonum- или Allium-тип у E. spinosa; Donati, 1913; Cesca, 1963). Особый интерес в этом отношении представляют виды секций, расположенных вблизи основания молекулярно-филогенетического древа подрода Esula, но контрастирующих по принадлежности к его разным продвинутым кладам, и в частности, практически не изученных видов секций Holophyllum и Myrsiniteae (клады I и II, соответственно). Некоторые стадии развития зародышевого мешка были изучены у E. myrsinites из секции Myrsiniteae (Schweiger, 1905), но тип его развития не установлен.
Проведенное исследование показало, что E. komaroviana (секция Holophyllum) и E. myrsinites (секция Myrsiniteae) характеризуются наличием Polygonum-типа развития зародышевого мешка (моноспорического, биполярного, 3-митозного), причем оба вида обладают большим сходством в закономерностях его возникновения и развития.
Черты сходства проявляются:
– в заложении на ранних стадиях развития семязачатка множественного археспория, дальнейшем формировании из него массивного комплекса спорогенных клеток, образующихся путем периклинальных делений клеток исходно единственного слоя с организацией двух ярусов клеток (не менее 16 клеток в целом);
– в преобразовании большинства спорогенных клеток в мегаспороциты, их последующем вступлении в мейоз и его завершении, при этом E. myrsinites характеризуется асинхронным развитием мегаспороцитов: удлинению и вступлению в мейоз подвергаются, в первую очередь, осевые центральные мегаспороциты верхнего яруса (E. komaroviana, очевидно, свойственна та же закономерность);
– в образовании в результате мейоза множества линейных или Т-образных тетрад (триад) мегаспор, из которых, однако, дальнейшее развитие, как правило, претерпевает единственная тетрада мегаспор, функциональной из которых является халазальная мегаспора;
– в организации (по завершении 3 циклов митотических делений) 7-клеточного 8-ядерного сформированного зародышевого мешка;
– в общей организации клеток яйцевого аппарата и центральной клетки зрелого зародышевого мешка (расположение вакуоли в базальной части яйцеклетки, а ядра – в ее апикальной части, и, наоборот – вакуоли в апикальной части синергид, а ядра – в базальной части; наличие хорошо развитого нитчатого в синергидах; сближение полярных ядер центральной клетки возле яйцевого аппарата; два варианта расположения антипод).
В то же время, исследованные нами виды проявляли и определенные различия, главным образом, в развитии их антиподального аппарата. У E. myrsinites клетки антипод в процессе созревания зародышевого мешка подвергаются дополнительным делениям (с цитокинезом, реже без цитокинеза), вследствие чего зрелый зародышевый мешок этого вида становится 8–9-клеточным, 8–10-ядерным. У E. komaroviana этого явления не наблюдается, его зрелый зародышевый мешок остается 7-клеточным, 8-ядерным. Следует, однако, отметить, что, несмотря на различия в структуре антиподального аппарата, для обоих видов характерна относительно длительная продолжительность его функционирования (вплоть до стадии зиготы и первых делений ядра первичной клетки эндосперма). Кроме того, у E. komaroviana спорадически наблюдалось формирование нескольких дополнительных зародышевых мешков, которые развивались из дополнительных тетрад мегаспор и находились в сформированном семязачатке на разных стадиях развития.
Сопоставление полученных результатов с литературными данными по развитию зародышевого мешка Polygonum-типа у других видов подрода Esula рода Euphorbia показало, что последним также свойственно наличие линейных или Т-образных тетрад мегаспор, с функциональной халазальной мегаспорой (E. virgata, E. lucida, Modilewski, 1911; Vinogradova, 2017; E. rothiana, Srivastava, 1952; E. pilosa, Singh, Jain, 1965; E. maddenii, Bhanwra, 1987, и др.). Аналогичные типы тетрад мегаспор выявлены и у видов других подродов рода Euphorbia с этим типом зародышевого мешка (см. обзор Vinogradova, 2017). В то же время, множественный археспорий, с последующим образованием спорогенного комплекса, выявлен лишь у отдельных видов подрода Esula с Polygonum-типом зародышевого мешка: E. pilosa из секции Helioscopia (хотя и с небольшим числом клеток – 2–3; Singh, Jain, 1965), E. dendroides из секции Pachycladae и E. exigua из секции Exigua (D’Amato, 1946). У остальных таких видов отмечен 1-клеточный археспорий, иногда с 2 клетками (E. lathyris, E. lucida, Modilewski, 1910, 1911; E. pithyusa, D’Amato, 1939, и др., см. также обзор Vinogradova, 2017). Характерно, что множественный археспорий, а также многоклеточный спорогенный комплекс (до 5–6 клеток) был описан, главным образом, у видов с би- и тетрапорическими типами развития зародышевого мешка (E. procera, E. palustris, Modilewski, 1909, 1911; E. dulcis, Carano, 1925; E. mauritanica, Ventura, 1933). В связи с этим, некоторые ранние авторы (Modilewski, 1909, 1911; D’Amato, 1939) полагали, что он свойственен главным образом видам с этими типами гаметофита. Однако это предположение не нашло подтверждения ни в работе Виноградовой (Vinogradova, 2017), ни в нашем исследовании. В частности, у E. virgata из секции Esula с Polygonum-типом зародышевого мешка, археспорий которой был ранее охарактеризован как одноклеточный (изредка 2-клеточный; Modilewski, 1911), было обнаружено формирование 3–4 клеток археспория (на центральных срезах семязачатка) и до 12 клеток спорогенного комплекса, лежащих в два слоя (Vinogradova, 2017). При этом, по данным автора (Vinogradova, 2017), каждая из спорогенных клеток вступает в мейоз, хотя и асинхронно, и потенциально способна к образованию зародышевого мешка, но преимущественное развитие обычно получает единственная тетрада мегаспор, образующаяся из верхнего слоя спорогенных клеток с центральным положением. Аналогичные наблюдения сделаны нами и по E. komaroviana и E. myrsinites из секций Holophyllum и Myrsiniteae, отличие состоит лишь в несколько большем числе клеток их спорогенного комплекса (до 16–18).
Не менее интересен и другой аспект развития зародышевого мешка у E. komaroviana и E. myrsi-nites, связанный с поведением их антиподального аппарата – его длительным функционированием у обоих видов и даже вторичным увеличением числа клеток у E. myrsinites. Согласно Виноградовой (Vinogradova, 2017), эфемерность антипод является типичным признаком большинства исследованных видов рода Euphorbia с моно- и биспорическим типами развития зародышевого мешка. Длительное функционирование антипод отмечено лишь у отдельных видов с моноспорическим Polygonum-типом развития гаметофита, а также у большинства видов с тетраспорическими типами развития, сконцентрированных в секции Helioscopia (Modilewski, 1910; Cesca, 1966, 1969), причем у видов с Penaea-типом (E. procera, E. palustris) антиподы представлены халазальной группой клеток зародышевого мешка. Однако, несмотря на важность этой информации, заключение о связи поведения антипод с типом зародышевого мешка у видов рода Euphorbia, по-видимому, является несколько преждевременным. Генезис антипод у многих видов не всегда прослежен полностью, а многие данные весьма противоречивы.
Так, для многих видов секции Helioscopia с Polygonum-типом развития гаметофита из клады I подрода Esula, действительно, приводятся сведения об эфемерности антипод (E. coralloides, E. helioscopia – Modilewski, 1910, 1911; Bhalla, 1941; E. pubescens Vahl (= E. hirsuta L.) – D’Amato, 1939; E. peltata Roxb. (= E. stricta L.) – Mukherjee, 1965). В то же время, у E. helioscopia, судя по рисункам некоторых авторов, антиподы присутствуют в организованном зародышевом мешке и разрушаются лишь в ходе оплодотворения (Singh, 1969: рис. 1, 2); у E. pubescens на рисунке взрослого гаметофита антиподы также изображены без видимых признаков дегенерации (D’Amato, 1939)11, У E. oreophyla Miquel. (приоритетное название E. rothiana Spreng.), по данным одних авторов, антиподы эфемерны (Gopinath, Gopalkrishnan, 1949), хотя по данным других, длительно сохраняются (Srivastava, 1952). Для E. pilosa указано лишь, что антиподы в зародышевом мешке вскоре дезинтегрируют, хотя время их дегенерации – до или после оплодотворения, не уточняется (Singh, Jain, 1965).
У большинства видов клады II (как с моноспорическим, так и биспорическими типами развития гаметофита) также отмечена эфемерность антипод: E. dendroides, E. terracina, E. exigua, E. mauritanica, E. characias, E. amygdaloides (Ventura, 1933; D’Amato, 1939, 1946), E. dracunculoides (Mukherjee, 1961), E. esula (Carmichael, Selbo, 1999), E. virgata (Modilewski, 1910; Vinogradova, 2017), и др. Исключение составляют E. myrsinites из секции Myrsiniteae и E. falcata из секции Pithyusa с моноспорическим Polygonum-типом гаметофита, у которых антиподы дегенерируют после оплодотворения. У E. falcata они сохраняются до стадии двуклеточного зародыша (D’Amato, 1939), а у E. myrsinites – до стадии зиготы, причем E. myrsi-nites свойственно их вторичное размножение (настоящее исследование), что впервые отмечено для видов Euphorbia. В то же время, у E. pithyusa var. ovalifolia из секции Pithyusa с тем же типом развития гаметофита, отмечена эфемерность антипод (D’Amato, 1939). Несколько противоречивы данные по E. maddenii из секции Arvales, расположенной почти на вершине филогенетического древа подрода Esula: его антиподы одновременно характеризуются и как эфемерные, и как дегенерирующие вскоре после оплодотворения (Bhanwra, 1987).
Данные по видам базальных секций Lathyris и Lagascae также свидетельствуют об их гетерогенности по признаку длительности функционирования антипод. У E. lathyris из секции Lathyris с Polygonum-типом развития женского гаметофита отмечена эфемерность антипод (Modilewski, 1910; Titova et al., 2018b), тогда как у E. lagascae из секции Lagascae с биспорическим Allium-типом развития – их сохранение до стадии зиготы и образования нескольких пар ядер в ценоцитном эндосперме (D’Amato, 1946).
В целом, однако, несмотря на имеющиеся противоречия, создается впечатление о большей продолжительности жизни антипод у видов клады I (особенно у видов секции Helioscopia с тетраспорическими типами развития гаметофита) и их преимущественной эфемерности у видов клады II, хотя это заключение также нуждается в проверке. Обращает на себя внимание и тот факт, что изученным видам базальных клад (Lagascae), а также расположенных близко к ней секций Holo-phyllum (клада I), Myrsiniteae и Pithyusa (клада II, сестринские секции), независимо от типа развития женского гаметофита, свойственно длительное сохранение антипод – также как и многим видам секции Helioscopia (клада I). Этот факт позволяет полагать, что продолжительность функционирования антипод у видов подрода Esula рода Euphorbia все же является признаком, имеющим определенную таксономическую приуроченность, но напрямую не связанным с типом развития их женского гаметофита, а вероятно более обусловленным другими факторами. Известно, что антиподы являются передаточными клетками, участвующими в транспорте метаболитов из структур базальной части нуцеллуса и халазы (гипостазы, проводящего пучка рафе/фуникулуса) в халазальную часть зародышевого мешка и передающими их в его центральную клетку – родоначальницу первичной клетки эндосперма. При этом антиподы часто участвуют не только в активном транспорте веществ (благодаря образованию протуберанцев клеточных стенок), но и в их переработке и синтезе (Zhukova, Batygina, 2002). Аналогичную функцию по мере деструкции антипод приобретает и халазальная часть эндосперма, которой также нередко свойственно образование гаусториев (Zhukova, 2006). У видов с долго сохраняющимися антиподами эндосперм не образует гаусториев, тогда как в случае эфемерных антипод халазальные гаустории эндосперма обычно формируются (Shamrov, 2008).
В этой связи необходимо отметить, что ранее нами было установлено, что видам подрода Esula рода Euphorbia свойственно формирование халазального гаустория эндосперма, выраженность которого различна у видов разных клад и коррелирует со степенью массивности структур их халазальной части семени (Titova et al., 2018a, 2019). Наиболее крупным гаусторием, с врастаниями в ткани нуцеллуса, обладают изученные виды базальной секции Lathyris и секций Holophyllum и Helioscopia из клады I, что сопряжено с большей массивностью структур халазальной части их семени (подиума, постамента и гипостазы, входящей в состав эндопахихалазы). Изученным же видам клады II (секции Myrsiniteae, Esula) свойственно наличие менее развитого гаустория эндосперма (без врастаний в ткани нуцеллуса), что коррелирует у этих видов с меньшей массивностью структур халазальной части семени. При этом среди видов этой клады наиболее крупный гаусторий (с большей изоляцией от остальной части эндосперма, хотя и без врастаний в нуцеллус) и наибольшую массивность структур семени имела E. myrsinites из секции Myrsiniteae. Не исключено, что бóльшая массивность структур семени у видов секций Holophyllum, Helioscopia и Myrsiniteae обуславливает как бóльшую степень развития халазального гаустория эндосперма, так и более длительную активность их антипод, хотя генезис антипод у видов секции Helioscopia специально не исследовался. В эту зависимость, однако, не укладывается E. lathyris из базальной секции Lathyris с эфемерными антиподами, но с максимальной среди видов подрода Esula массивностью гаустория эндосперма и структур халазальной части семени. Нарушение этой корреляции у E. lathyris представляет особый интерес, поскольку он характеризуется рядом уникальных для подрода Esula и рода Euphorbia морфологических признаков (невскрывающиеся плоды с губчатым перикарпием, перекрестнопарные листья) и предположительно возник в результате интрогрессивной гибридизации (Geltman, 2016). Примечательно также, что антиподы у данного вида, хотя и дегенерируют к моменту оплодотворения, представлены очень крупными, активными клетками на стадии созревания зародышевого мешка (Modilewski, 1911).
С большей массивностью структур халазальной части семени у видов секций Lathyris, Holophyllum и Helioscopia может быть связана и другая особенность развития – способность их семязачатков к одновременному формированию нескольких зародышевых мешков, хотя и не всегда завершающих развитие. Такая способность была обнаружена нами у E. komaroviana из секции Holo-phyllum (настоящая работа), а также у ряда других видов клады I из секции Helioscopia (E. pilosa – Singh, Jain, 1965; E. palustris, E. soongarica – Titova et al., 2015, 2018a) и E. lathyris из секции Lathyris (Titova et al., 2018b, 2019). У некоторых видов клады II (E. dendroides, секция Pachycladae – D’Amato, 1946) в сформированном семязачатке также отмечалось присутствие дополнительных тетрад мегаспор, но без признаков дальнейшего развития. Нельзя, однако, исключать и возможность развития дополнительных зародышевых мешков у E. myrsinites из этой же клады (вследствие значительной массивности халазы), что может быть обнаружено при исследовании бóльшего количества семязачатков.
Характерно, что почти во всех отмеченных выше случаях полностью развитые дополнительные зародышевые мешки находились в контакте и с париетальной тканью, и с постаментом нуцеллуса, а недоразвитые зародышевые мешки (чаще на стадии 4-ядерного ценоцита) – в отрыве от париетальной ткани, но в контакте с постаментом. Этот факт не только подтверждает известную важную роль париетальной ткани и базальной части нуцеллуса в снабжении метаболитами развивающихся зародышевых мешков, но и косвенно указывает на соотношение апикального и базального транспорта веществ в ходе их развития. Так, у E. virgata развитие зародышевого мешка Polygonum-типа сопровождается, в первую очередь, деструкцией латеральной и базальной части нуцеллуса (включая прилегающие дополнительные тетрады мегаспор) и лишь затем, начиная со стадии 4-ядерного ценоцита – париетальной ткани (Vinogradova, 2017), что свительствует о преимущественно базальном транспорте метаболитов до этой стадии развития. Сходные морфогенетические корреляции отмечены нами и у E. myrsinites и E. komaroviana с тем же типом развития гаметофита (единственное исключение составляют небольшие различия в числе слоев этих структур и менее интенсивная деструкция париетальной ткани к стадии зрелого зародышевого мешка). При этом для клеток париетальной ткани обоих этих видов характерно накопление особых сферических включений, очевидно, представляющих собой резерв метаболитов, используемых гаметофитом на поздних стадиях развития. Вследствие развития основного зародышевого мешка, образующегося на базе верхнего центрального яруса мегаспороцитов, остальные зародышевые мешки (тетрады мегаспор), в первую очередь, нижнего яруса, удаляются от париетальной ткани, что, по-видимому, препятствует поступлению в них необходимых для развития метаболитов (или снижению их количества), и соответственно, завершению их формирования. В этой связи, примечательно, что один из почти полностью развитых зародышевых мешков, но с признаками дегенерации клеток, наблюдаемый нами в семязачатке E. komaroviana, находился в контакте лишь с париетальной тканью. Поэтому, к числу факторов, определяющих реализацию потенций к развитию дополнительных зародышевых мешков у видов секций Lathyris, Holophyllum и Helioscopia (резерв репродукции, по Batygina, 2014), вероятно, можно отнести не только массивность структур семязачатка, но и необходимость их контакта как с париетальной тканью, так и постаментом. Перспективным подходом – как в этом направлении, так и в дальнейшей разработке вопросов об эволюции археспория и женского гаметофита в пределах подрода Esula рода Euphorbia, на наш взгляд, является продолжение комплексного сравнительного анализа морфогенетических корреляций в развитии зародышевого мешка и окружающих структур методами световой, флуоресцентной и трансмиссионной электронной микроскопии.
ЗАКЛЮЧЕНИЕ
Проведенное исследование процессов мегаспорогенеза и развития зародышевого мешка у Euphorbia komaroviana и E. myrsinites из секций Holophyllum и Myrsiniteae подрода Esula рода Euphorbia, выделенного в результате молекулярно-филогенетического анализа (Geltman, 2013, 2016; Riina et al., 2013), позволило дополнить эмбриологическую характеристику этого подрода, а также наметить предварительные тенденции в распределении признаков в его системе. Так, нами установлено, что оба изученных вида из секций Holophyllum и Myrsiniteae подрода Esula, лежащих вблизи основания молекулярно-филогенетического древа (рядом с базальными секциями Lathy-ris и Lagascae), но контрастирующих по принадлежности к двум разным крупным продвинутым кладам (I, II), обладают моноспорическим Polygo-num-типом развития зародышевого мешка. Эти данные подтвердили сведения о преобладании этого типа развития гаметофита в подроде Esula (Vinogradova, 2017). Его наличие у видов базальной клады Lathyris и у большинства изученных видов секций Holophyllum, Myrsiniteae и Pithyusa, лежащих вблизи этой клады, вероятно, также позволяет считать данный тип исходным в подроде Esula. Предполагаемые тенденции в приуроченности тетраспорических типов развития к кладе I, а биспорических – к кладе II, пока не нашли подтверждения, однако изучено недостаточное число видов.
Выявлено большое сходство в прохождении процессов мегаспорогенеза и развития зародышевого мешка Polygonum-типа у E. komaroviana и E. myrsinites: формирование множественного археспория и многоклеточного спорогенного комплекса; преобразование большинства спорогенных клеток в мегаспороциты, их вступление в мейоз и его завершение с образованием множества линейных или Т-образных тетрад или триад мегаспор; дальнейшее формирование, как правило, единственного зародышевого мешка на базе халазальной мегаспоры одной из тетрад мегаспор; организация 7-клеточного 8-ядерного сформированного зародышевого мешка; сходство в организации его яйцевого аппарата, центральной клетки и длительном сохранении антипод (до стадии зиготы). Различия касаются, главным образом, поведения антипод (деления их клеток и ядер в ходе созревания зародышевого мешка у E. myrsinites, приводящие к его 8–9-клеточному, 8–10-ядерному состоянию; их отсутствие у E. komaroviana, вследствие чего его зрелый гаметофит остается 7-клеточным 8-ядерным), а также способности E. komaroviana к одновременному формированию в семязачатке нескольких зародышевых мешков, возникающих на базе многоклеточного спорогенного комплекса. При этом способность видов рода Euphorbia (и его подрода Esula) к вторичному размножению клеток антипод показана впервые. Выявленные закономерности, в совокупности с анализом имеющихся литературных данных по этим процессам у других видов рода Euphorbia (на примере подрода Esula), позволили нам подтвердить выводы некоторых предыдущих авторов в отношении взаимосвязей между определенными характеристиками развития их зародышевого мешка Polygonum-типа, а также внести в них ряд уточнений.
В частности, нами подтвержден вывод об отсутствии зависимости между числом клеток археспория и типом развития зародышевого мешка у видов Euphorbia (Vinogradova, 2017) – в противоположность точке зрения ряда ранних авторов о наличии такой зависимости (развитие зародышевого мешка по моноспорическому типу у видов с одноклеточным археспорием и по тетраспорическому – с многоклеточным археспорием; Modilewski, 1909, 1911; D’Amato, 1939). Кроме того, в результате анализа морфогенетических корреляций в развитии зародышевого мешка и окружающих структур нуцеллуса у этих видов нами внесено уточнение в предполагаемую некоторыми авторами (Vinogradova, 2017) зависимость между типом развития зародышевого мешка у видов рода Euphorbia и поведением его антипод (их эфемерность при моно- и биспорическом типах, и относительно длительное сохранение при тетраспорическиих типах). Так, длительность функционирования антипод у видов подрода Esula может быть более связана не с типом развития их гаметофита, а с большей активностью халазального гаустория их эндосперма и массивностью структур халазальной части семязачатка. Это предположение основано на большей приуроченности этих признаков к видам базальных клад подрода Esula и клады I, а также данных о функциях антипод – передаточных клеток, участвующих в транспорте метаболитов в халазальную часть развивающегося зародышевого мешка и нередко передающих эти функции после оплодотворения халазальному гаусторию эндосперма (Zhukova, Batygina, 2000; Zhukova, 2006). Однако, эта гипотеза нуждается в проверке с вовлечением в анализ большего числа видов и с применением специальных методов исследования. Большая массивность структур халазальной части семязачатка может обуславливать и реализацию потенций к развитию дополнительных зародышевых мешков на базе многоклеточного спорогенного комплекса, отмеченных нами у E. komaroviana, а также E. lathyris из базальной клады Lathyris и многих видов клады I (Singh, Jain, 1965; Titova et al., 2015, 2018a, b, 2019), что также нуждается в проверке.
В целом результаты проведенного анализа закономерностей процессов мегаспорогенеза и развития зародышевого мешка у видов подрода Esula рода Euphorbia ставят под сомнение высказывание некоторых авторов о неперспективности использования этих признаков для сравнения видов различных подсемейств и внутри подсемейств сем. Euphorbiaceae, а также об общности признака “эфемерность антипод” у всех видов этого семейства (Tokuoka, Tobe, 1995, 2002). Об этом, в частности, свидетельствуют данные о приуроченности ряда тетраспорических типов развития зародышевого мешка к некоторым мелким, но определенным кладам секции Helioscopia подрода Esula рода Euphorbia, а также данные о длительности функционирования антипод у ряда видов этой секции (Vinogradova, 2017) и наши данные, особенно по E. myrsinites.
Список литературы
Battaglia E. 1947. Divisione eterotipica in cellule somatiche di Sambucus ebulus L. – Nuivi Giorn. Bot. Ital. 54: 724–733.
Battaglia E. 1989. The evolution of the female gametophyte of angiosperms: an interpretative key. – Annali di Botanica 47: 7–144.
[Batygina] Батыгина Т.Б. 2014. Биология развития растений. Симфония жизни. СПб. 764 с.
Bhalla V. 1941. Life history of Euphorbia helioscopia L. – Abstr. of the Proc. 28th Indian Sci. Congr. III. 161 p.
Bhanwra P.K. 1987. Embryology of Euphorbia maddeni and Euphorbia nivulia. – Curr. Sci. 56 (20): 1062–1064.
Bruyns P.V., Mapaya R.J., Hedderson T. 2006. A new subgeneric classification for Euphorbia (Euphorbiaceae) in southern Africa based on ITS and psbA-trnH sequence data. – Taxon. 55 (2): 397–420. https://doi.org/10.2307/25065587
Carano E. 1925. Sul particolare sviluppo del gametofito femminile di Euphorbia dulcis L. – Rendic. della R. Accad. Nazionale dei Loncei. Ser. 6. 1 (11): 633–635.
Carano E. 1926. Ulteriori osservazioni su Euphorbia dulcis L. in rapporto col suo comportamonto apomittico. – Ann. Bot. Roma. 17: 50–79.
Carmichael J.S., Selbo S.M. 1999. Ovule, embryo sac and endosperm development in leafy spurge (Euphorbia esula). – Can. J. Bot. 77 (4): 599–610.
Cesca G. 1961. Ricerche cariologiche ed embriologiche sulle Euphorbiaceae. I. Su alcuni biotipi di Euphorbia dulcis L. della Toscana. – Caryologia. 14 (1): 79–96.
Cesca G. 1963. Ricerche cariologiche ed embrilogiche sulle Euphorbiaceae: Euphorbia spinosa L. ed Euphorbia hyberna L. – Giorn. Bot. Ital. 70 (5–6): 542–543.
Cesca G. 1966. Cytological and embryological studies in the genus Euphorbia. – Giorn. Bot. Ital. 73 (4–6): 276–279.
Cesca G. 1967. Ricerche citologiche ed embriologiche nel genere Euphorbia: E. melitensis Parl. – Giom. Bot. Ital. 101: 288–289.
Cesca G. 1969. Cytological and embryological studies in the genus Euphorbia: Euphorbia epithymoides L. – Proc. Nat. Inst. Sci. India. 35 (2): 139–152.
Chaturvedi A., Dalal L.P. 2000. Embryology of Euphorbia milii des moul with probable phylogeny of the embryo sacs in Euphorbiaceae. – J. Indian Bot. Soc. 79 (1–4): 143–147.
D’Amato F. 1939. Ricerche embriologiche e cariologiche sul genere Euphorbia. – N.G.B.I. n. s. 46: 470–509.
D’Amato F. 1946. Osservazioni critiche su alocuni metodi d’impiego della reazione nucleate in citologia, vegetale. – N.G.B.I. n. s. 53: 657–668.
Donati G. 1913. Ricerche embriologiche sulle Euphorbiaceae. – Annali di Botanica. 11: 395–399.
[Geltman] Гельтман Д.В. 2013. Молочаи (Euphorbia L., Euphorbiaceae) Восточной Европы и Кавказа в зеркале новой системы рода. – Turczaninowia. 16 (2): 30–40.
[Geltman] Гельтман Д.В. 2016. Подрод Esula рода Euphorbia (Euphorbiaceae): система, филогения, географический анализ: Дис. … д-ра биол. наук. СПб. 348 с.
Geltman D.V., Berry P.E., Riina R., Peirsson J. 2011. Typification and synonymy of the species of Euphorbia subgenus Esula (Euphorbiaceae) native to the United States and Canada. – J. Bot. Res. Inst. Texas. 5 (1): 143–151.
Gopinath D.M., Gopalkrishnan K.S. 1949. The ovule and the development of the female gametophyte in Homonia retusa Muell. and Euphorbia oreophila Miquel. – Am. Midl. Nat. 41 (3): 759–764.
Horn J.W., van Ee B.W., Morawetz J.J., Riina R., Steinmann V.W., Berry P.E., Wurdack K.J. 2012. Phylogenetics and the evolution of major structural characters in the giant genus Euphorbia L. (Euphorbiaceae). – Mol. Phylogen. Evol. 63 (2): 305–326. https://doi.org/10.1016/j.ympev.2011.12.022
Johri B.M., Ambegaokar K.B., Srivastava P.S. 1992. Comparative Embryology of Angiosperms. – Springer. Berlin. 1221 p.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Т. 1. Двудольные. Барнаул. 501 с.
Kapil R.N. 1961. Some embryological aspects of Euphorbia dulcis L. – Phytomorphology. 11 (1): 24–36.
Maheshwari P. 1948. The angiosperm embryo sac. – Bot. Rev. 14: 1–56.
Maheshwari P. 1950. An Introduction to the Embryology of Angiosperms. – McGraw-Hill. Inc., New York. 453 p.
Modilewski J. 1909. Zur Embryobildung von Euphorbia procera. – Ber. dtsch. bot. Ges. 27: 21–26.
Modilewski J. 1910. Weitere Beiträge zur Embryobildung einiger Euphorbiaceen. – Ber. Deutsch Bot. Gesells. 28: 413–418.
Modilewski J. 1911. Die anomale Embryosackentwicklung bei Euphorbia palustris. – Ber. Deutsch. Bot. Gesells. 29: 430–436.
Mukherjee P.K. 1961. Embryology of two Euphorbiaceae. – Proc. Nat. Acad. Sci. India. (B). 53: 217–229.
Mukherjee P.K. 1965. Contribution to the embryology of Euphorbia peltata Roxb. – Proc. Nat. Acad. Sci. India. (B). 35: 327–337.
[Pausheva] Паушева З.П. 1980. Практикум по цитологии растений. М. 255 с.
Pechenitsyn V.P. 2002. Evolution of Types of Embryo Sac Development. – In: Embryology of flowering plants. Terminology and concepts. Vol. 1. Generative organs of flower. Enfield. NH. Science Publishers. P. 190–200.
[Poddubnaya-Arnoldi] Поддубная-Арнольди В.А. 1982. Характеристика семейств покрытосеменных растений по цитоэмбриологическим признакам. М. 351 с.
[Prokhanov] Проханов Я.И. 1949. Род молочай – Euphorbia L. – Флора СССР. 14: 304–495.
[Prokhanov] Проханов Я.И. 1964. Конспект системы молочаев СССР. Добавления и изменения. – Новости сист. высш. раст. 1: 226–237.
Radcliffe-Smith A., Tutin T.G. 1968. Euphorbia L. – Flora Europaea. Cambridge. 2: 213–226.
Riina R., Peirson J.A., Geltman D.V., Molero J., Frajman B., Pahlevani A., Barres L., Morawetz J.J., Salmaki Y., Zarre S., Kryukov A., Bruyns P.V., Berry P.E. 2013. A worldwide molecular phylogeny and classification of the leafy spurges, Euphorbia subgenus Esula (Euphorbiaceae). – Taxon. 62 (2): 316–342. https://doi.org/10.12705/622.3
[Romanov] Романов И.Д. 1971. Типы развития зародышевого мешка покрытосеменных растений. – В кн.: Проблемы эмбриологии. Киев. С. 72–112.
Schweiger J. 1905. Beitrage zur Kenntnis der Samenentwicklung der Euphobiaceen. –Flora. 94: 339–382.
Schurhoff P.N. 1924. Zytologische Untersuchungen in der Reihe der Geraniales. – Jahrb. Wiss. Bot. 63: 707–759.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: строение, функции, происхождение. М. 350 с.
Singh R.P. 1969. Structure and development of seeds in Euphorbia helioscopia. – Bot. Mag. Tokyo. 82 (973): 287–293.
Singh R.P., Jain J.L. 1965. Development of female gametophyte in Euphorbia pilosa L. – Curr. Sci. 34 (21): 611–612.
Steinmann V.W., Porter J.M. 2002. Phylogenetic relationships in Euphorbieae (Euphorbiaceae) based on ITS and ndhF sequence data. – Ann. Miss. Bot. Gard. 89 (4): 453–490. https://doi.org/10.2307/3298591
Srivastava R.K. 1952. Contribution to the embryology of Indian Euphorbiaceae. – Ann. Bot. London. 16 (64): 505–511.
[Titova et al.] Титова Г.Е., Яковлева О.В., Жинкина Н.А. 2015. Развитие семени у Euphorbia palustris (Euphorbiaceae). – Бот. журн. 100 (3): 226–248. https://doi.org/10.1134/S0006813615030035
[Titova et al.] Титова Г.Е., Яковлева О.В., Жинкина Н.А., Гельтман Д.В. 2018а. Развитие семени у некоторых видов секций Helioscopia и Esula подрода Esula рода Euphorbia (Euphorbiaceae). – Бот. журн. 103 (11): 1355–1389. https://doi.org/10.7868/S0006813618110017
[Titova et al.] Титова Г.Е., Нюкалова М.А., Жинкина Н.А. 2018b. К репродуктивной биологии Euphorbia lathyris L. (Euphorbiaceae): развитие семени. – Вестник ТвГУ. Серия “Экология и биология”. 3: 35–52.
[Titova et al.] Титова Г.Е., Яковлева О.В., Жинкина Н.А., Нюкалова М.А., Гельтман Д.В. 2019. Развитие семени у некоторых видов секций Lathyris, Holophyllum и Myrsiniteae подрода Esula рода Euphorbia (Euphorbiaceae) – Бот. журн. 104 (4): 528–568. https://doi.org/10.1134/S0006813619040112
Tokuoka T., Tobe H. 1995. Embryology and systematics of Euphorbiaceae sens. lat.; a review and perspective. – J. Plant Res. 108 (1): 97–106. https://doi.org/10.1007/BF02344312
Tokuoka T., Tobe H. 2002. Ovules and seeds in subfamily Euphorbioideae (Euphorbiaceae); structure and systematic implications. – J. Plant Res. 115 (5): 361–374. https://doi.org/10.1007/s10265-002-0047-5
Ventura M. 1933. Sviluppo del gametofito femminile di Euphorbia mauritanica L. – Ann. Bot. Roma. 20: 267–273.
[Vinogradova] Виноградова Г.Ю. 2017. Морфогенез женских репродуктивных структур у видов Euphorbia (Euphorbiaceae), различающихся по типу развития зародышевого мешка. – Бот. журн. 102 (8): 1060–1093. https://doi.org/10.1134/S0006813617080026
Zhukova G.Ya., Batygina T.B. 2002. Antipodal cells. – In: Embryology of flowering plants. Terminology and concepts. Vol. 1. Generative organs of flower. Enfield. NH. Science Publishers. P. 160–162.
Zhukova G.Ya. 2006. Endosperm. – In: Embryology of flowering plants. Terminology and concept. Vol. 2. Seed. Enfield. NH. Science Publishers. P. 111–115.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


