Ботанический журнал, 2022, T. 107, № 12, стр. 1200-1215
МОРФОЛОГИЯ ПЫЛЬЦЕВЫХ ЗЕРЕН НЕКОТОРЫХ ВИДОВ ROSA (ROSACEAE) ИЗ КОЛЛЕКЦИИ БОТАНИЧЕСКОГО САДА ПЕТРА ВЕЛИКОГО
В. В. Григорьева 1, *, А. И. Капелян 1, **, О. А. Гаврилова 1, ***, Д. А. Брицкий 1, ****, К. Г. Ткаченко 1
1 Ботанический институт им. В.Л. Комарова РАН
197022 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: mikhailov_val@mail.ru
** E-mail: allakapelian@bk.ru
*** E-mail: gavrilova@binran.ru
**** E-mail: dmibri@mail.ru
Поступила в редакцию 20.08.2021
После доработки 25.10.2022
Принята к публикации 01.11.2022
- EDN: BZTSJW
- DOI: 10.31857/S0006813622120043
Аннотация
С помощью светового, конфокального лазерного и сканирующего электронного микроскопов изучена морфология пыльцы 28 видов рода Rosa из розария и парка-дендрария Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН. Пыльцевые зерна всех исследованных видов средних размеров, 3-бороздно-оровые со струйчатой скульптурой. Видовые различия по пыльце незначительны, проявляются в размерах пыльцевых зерен, очертании эндоапертур и размерах скульптурных элементов экзины. С помощью трансмиссионного электронного микроскопа впервые описан наружный слой столбиков в эктэкзине спородермы пыльцевых зерен роз. Использование конфокального микроскопа позволило уточнить строение эндоапертур.
Род Rosa L. по оценкам разных авторов объединяет от 150–200 (Wisseman, Ritz, 2007) до 500 видов (Buzunova, 2001; Koopman et al., 2008), распространенных, главным образом, в Северном полушарии в областях умерено теплого и субтропического климата. Разнообразие мнений об объеме таксонов в роде Rosa связано с высоким внутривидовым полиморфизмом. Между видами роз нередко отсутствуют существенные генетические различия (Schanzer, 2011), что объясняется межвидовой гибридизацией, полиплоидией, а также особенностями мейоза и так называемой сбалансированной гетерогамией, характерной для крупнейшей секции Caninae (DC.) Ser. (Wissemann, Hellwig, 1997; Ritz, Wissemann, 2003).
В настоящее время коллекция роз Ботанического сада БИН РАН содержит растения, обладающие разными эколого-морфологическими характеристиками, отражающими природное богатство видов, а также большое разнообразие садовых форм, сохраняющих генофонд старых сортов, а также материал для селекции новых сортов (Kapelyan, 2016). На территории парка-дендрария и в розарии произрастает около 40 видов рода Rosa из различных географических областей Земного шара: Европы, Кавказа, Сибири и Дальнего Востока, Средней Азии, Китая, Японии, Северной Америки. Коллекция постоянно пополняется новыми видами, выращиваемыми из семян, полученных из экспедиций и выписанных по обмену.
С целью определения перспективности видов Rosa для дальнейшей интродукции и использования в озеленении с 1996 года ведутся регулярные фенологические наблюдения, оценивается обилие цветения и плодоношения экземпляров коллекции (Kapelyan, 2017а, b). Исследование пыльцы растений из коллекции роз БИН РАН до сих пор не проводилось, однако оно имеет практическое значение, поскольку изучение морфологии пыльцевых зерен расширяет представления о степени адаптации видов и сортов в условиях интродукции (Orlova et al., 2019).
Морфология пыльцы разных видов рода Rosa изучена достаточно подробно (Reitsma, 1966; Kupriyanova, Aleshina, 1978; Wronska-Pilarek, Boratynska, 2005; Wronska-Pilarek, 2011; Wronska-Pilarek, Jagodzinski, 2011; Fatemi et al., 2012 и др.). Однако до сих пор не до конца выяснены особенности ультраструктуры оболочки пыльцевых зерен и строение эндоапертур у многих представителей рода Rosa.
Цель работы – изучить морфологические особенности пыльцы видов рода Rosa из коллекции Ботанического сада им. Петра Великого БИН РАН, а также оценить таксономическое значение палинологических признаков для идентификации некоторых видов.
МАТЕРИАЛ И МЕТОДЫ
Материалом исследования стали зрелые пыльцевые зерна 28 видов рода Rosa, собранные с растений, произрастающих в парке-дендрарии и розарии Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова в период массового цветения в июне 2019 и 2020 гг. Для получения репрезентативных результатов и увеличения выборки, пыльцу собирали с нескольких растений одного и того же вида.
Для изучения морфологии пыльцевых зерен использовали методы световой (СМ), сканирующей электронной микроскопии (СЭМ), а также конфокальный лазерный сканирующий микроскоп (КЛСМ). Ультраструктуру оболочки пыльцевых зерен изучали с помощью просвечивающего электронного микроскопа (ТЭМ). Для светооптического исследования применяли классический ацетолизный метод Эрдтмана (Erdtman, 1952). Детали строения поверхности пыльцевых зерен изучали на сканирующем электронном микроскопе JEOL JSM-6390 в центре коллективного пользования Ботанического института им. В.Л. Комарова. Предварительно обработанная ацетолизной смесью пыльца фиксировалась на специальном столике с помощью двусторонней липкой ленты, затем в вакуумной установке производилось напыление сплава золота и палладия.
Описания пыльцевых зерен проводили по общепринятой схеме: описывали тип и число апертур, форму и очертания пыльцевых зерен, размеры полярной оси и экваториального диаметра, особенности строения борозд и межапертурных участков, толщину экзины и характер скульптуры ее поверхности (Kupriyanova, Aleshina, 1967, 1972). Количественные показатели основных палиноморфологических характеристик (длина поляр-ной оси и экваториального диаметра, толщина экзины) получены с помощью окулярмикрометра на светооптическом микроскопе Микмед-6 (в каждом образце измеряли не менее 15 пыльцевых зерен). Подсчет деформированных пыльцевых зерен (выборка – 500 пыльцевых зерен) также осуществляли с помощью СМ. При исследовании с помощью конфокальной микроскопии использовали методику О.А. Гавриловой (Gavrilova, 2014).
Ультраструктуру оболочки изучали на ультратонких срезах с помощью трансмиссионного микроскопа Libra 120 в центре коллективного пользования Ботанического института им. В.Л. Комарова. Пыльники, содержащие пыльцевые зерна, фиксировали в 2.5% растворе глутарового альдегида на фосфатном буфере pH 6.8–7.2 при комнатной температуре в течение 24 часов, затем в 1%-ном растворе OsO4 на том же буфере в течение 2 часов. Материал обезвоживали ацетоном с нарастающей концентрацией и заключали в смесь эпона с аралдитом. Ультратонкие срезы изготавливали на ультратоме LCB. Срезы на сеточках контрастировали уранилацетатом (20 мин) и цитратом свинца (10 мин).
Названия видов приведены в соответствии с каталогом коллекции роз БИН РАН (Kapelyan, 2002), созданном на основе работ С.В. Юзупчука (Yuzepchuk, 1941), С.Г. Саакова (Saakov, 1973), С.К. Черепанова (Czerepanov, 1981) и И.О. Бузуновой (Buzunova, 2001).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Основные количественные характеристики пыльцевых зерен изученных видов Rosa представлены в табл. 1.
Таблица 1.
Характеристики пыльцы видов рода Rosa Table 1. Pollen characteristics of the Rosa species
| № | Исследованный образец Sample |
Длина поляр-ной оси (мкм) Polar axis length (μm) |
Длина эква-ториального диаметра (мкм) Equatorial axis length (μm) |
Количество де-формированной
пыльцы (%) Share of deformed pollen (%) |
Атипичные пыльцевые зерна Atypical pollen grains |
|---|---|---|---|---|---|
| 1 | R. acicularis Lindl. | 39.5–44.9 | 39.8–44.9 | 12 | Не выявлено Not found |
| R. acicularis Lindl. | 37.0–44.2 | 36.5–41.3 | 15 | Не выявлено Not found |
|
| 2 | R. alberti Regel | 37.5–44.7 | 37.6–41.5 | 11 | Не выявлено Not found |
| R. alberti Regel | 41.6–50.0 | 36.8–44.8 | 12 | Не выявлено Not found |
|
| 3 | R. altaica Willd. | 33.3–45.3 | 27.0–33.0 | 10 | Не выявлено Not found |
| R. altaica Willd. | 40.6–45.6 | 35.4–42.5 | 10 | Не выявлено Not found |
|
| 4 | R. amblyotis C.A. Mey. | 30.0–36.2 | 25.7–29.5 | 2 | Не выявлено Not found |
| R. amblyotis C.A. Mey. | 32.4–38.8 | 28.7–31.8 | 2 | Единичные 6-апертурные Single 6-aperturate grains |
|
| R. amblyotis C.A. Mey. | 32.1–35.8 | 32.1–34.3 | 2 | Не выявлено Not found |
|
| 5 | R. arkansana Porter | 30.0–36.7 | 28.8–32.5 | 2 | Не выявлено Not found |
| 6 | R. buschiana Chrshan. | 33.5–38.5 | 28.5–30.0 | 15 | Не выявлено Not found |
| 7 | R. canina L. | 30.0–40.0 | 30.0–38.5 | 15 | Единичные с 1-кольцевой бороздой
и 3-синкольпатные Single grains with 1 annular aperture and 3-syncolpate grains |
| 8 | R. davurica Pall. | 30.0–34.5 | 29.3–30.0 | 5 | Единичные синкольпатные Single 3-syncolpate grains |
| R. davurica Pall. | 29.1–36.6 | 25.8–33.4 | 2 | Единичные 3-синкольпатные
и 6-апертурные Single 3-syncolpate and single 6-aperturate grains |
|
| 9 | R. dolichocarpa Galushko | 40.0–47.0 (57.0) | 40.0–47.0 (57) | 99 | Не выявлено Not found |
| 10 | R. gallica L. | 36.8–42.8 | 34.5–37.6 | 15 | Не выявлено Not found |
| 11 | R. glauca Pourr. | 34.4–39.2 | 30.0–35.2 | 25 | 2%: 3-синкольпатные, 39.5%: с 1-кольцевой апертурой, 51%: 6-апертурные 2%: 3-syncolpate, 39.5%: grains with 1 annular aperture, 51%: 6-aperturate grains |
| 12 | R. gymnocarpa Nutt. | 30.0–36.0 | 27.9–30.0 | 10 | Не выявлено Not found |
| R. gymnocarpa Nutt. | 32.2–35.9 | 31.3–34.3 | 10 | Не выявлено Not found |
|
| 13 | R. jundzillii Besser | 37.0–38.5 | 36.0–37.5 | 25 | Единичные 6-апертурные Single 6-aperturate grains |
| 14 | R. kokanica (Re-gel) Regel ex Juz. | 30.0–36.8 | 30.0–33.5 | 3 | Не выявлено Not found |
| R. kokanica (Re-gel) Regel ex Juz. | 32.8–38.0 | 31.0–35.5 | 4 | Не выявлено Not found |
|
| 15 | R. majalis Herrm. | 42.9–50.0 | 41.6–45.8 | 2 | Не выявлено Not found |
| 16 | R. micrantha Borrer ex Sm. | 29.0–37.6 | 26.8–37.0 | 25 | Единичные 3-синкольпатные Single 3-syncolpate and single 6-aperturate grains |
| 17 | R. multiflora Thunb. | 33.5–40.0 | 27.8–32.7 | 3 | Не выявлено Not found |
| 18 | R.myriacantha DC. | 36.8–45.8 | 33.5–36.1 | 9 | Не выявлено Not found |
| R.myriacantha DC. | 42.3–47.0 | 34.5–42.4 | 3 | Не выявлено Not found |
|
| R.myriacantha DC. | 36.0–41.6 | 36.5–39.9 | 14 | Не выявлено Not found |
|
| 19 | R.omeiensis Rolfe | 33.0–41.7 | 32.7–35.5 | 2 | Не выявлено Not found |
| 20 | R. pendulina L. | 35.3–41.0 | 34.2–37.9 | 3 | Не выявлено Not found |
| 21 | R. platyacantha Schrenk | 30.2–34.0 | 29.2–32.5 | 6 | Единичные с 1-кольцевой апертурой Single grains with 1 annular aperture |
| 22 | R. pulverulenta M. Bieb. | 25.8–37.8 | 20.0–33.7 | 94 | Единичные 6-апертурные Single 6-aperturate grains |
| R. pulverulenta M. Bieb. | 33.8–38.9 | 33.4–38.7 | 94 | Единичные 3-синкольпатные,
с 1-кольцевой бороздой, 6-апертурные Single grains with 1 annular aperture, 3-syncolpate and 6-aperturate grains |
|
| 23 | R. roxburgii Tratt. | 28.5–33.5 | 25.4–30.0 | 20 | Не выявлено Not found |
| 24 | R. rugosa Thunb. | 30.0–37.8 | 30.0–36.1 | 9 | Не выявлено Not found |
| R. rugosa Thunb. | 32.9–40.9 | 32.5–35.1 | 6 | Не выявлено Not found |
|
| 25 | R. spinosissima L. | 39.9–49.0 | 33.0–36.2 | 10 | Не выявлено Not found |
| R. spinosissima L. | 36.4–49.0 (52.5) | 35.0–40.0 (52.5) | 90 | Не выявлено Not found |
|
| R. spinosissima L. | 30.0–37.2 | 29.0–30.0 | 14 | Не выявлено Not found |
|
| R. spinosissima L. | 37.1–44.3 | 37.4–44.7 | 10 | Не выявлено Not found |
|
| 26 | R. sweginzowii Koehne | 29.7–37.5 | 27.0–34.0 | 23 | Не выявлено Not found |
| R. sweginzowii Koehne | 35.1–39.2 | 33.8–37.8 | 23 | Не выявлено Not found |
|
| 27 | Rosaussuriensis Juz. | 30.0–37.3 | 27.8–34.7 | 14 | Не выявлено Not found |
| R. ussuriensis Juz. | 30.0–36.5 | 26.6–30.0 | 13 | Не выявлено Not found |
|
| 28 | R.willmottiae Hemsl. | 29.8–33.7 | 28.3–32.8 | 67 | Не выявлено Not found |
Пыльцевые зерна 3-бороздно-оровые, эллипсоидальные (рис. 1, 1, 3, 5), реже широкоэллипсоидальные или почти сфероидальные (рис. 2, 3, 6). В пределах образца соотношение длин полярной оси и экваториального диаметра (P/E), определяющее форму зерна, может незначительно варьировать. В одном цветке одновременно встречаются зерна, слегка отличающиеся по форме (от эллипсоидальных до почти сфероидальных). У некоторых видов в одном цветке наряду с типичными эллипсоидальными или почти сфероидальными пыльцевыми зернами встречаются единичные зерна атипичной яйцевидной формы. В очертании с полюса пыльцевые зерна 3-лопастные, с экватора эллиптические или почти округлые. Мезокольпиумы ромбические или близкие к ромбическому, реже эллиптические. Пыльца изученных роз имеет средние размеры, с максимальной осью не более 50 мкм (в зависимости от формы это либо полярная ось, либо экваториальный диаметр). Самые мелкие пыльцевые зерна характерны для R. roxburgii Tratt. (полярная ось 28.5–33.5 мкм, экваториальный диаметр 25.4–30.0 мкм), у R. pulverulenta M. Bieb. наряду с более крупными были обнаружены мелкие пыльцевые зерна с длиной полярной оси 25.8 мкм и длиной экваториального диаметра 20.0 мкм. Самая крупная пыльца обнаружена у R. dolichocarpa Galushko (полярная ось и экваториальный диаметр 40.0–47.0 мкм, а у единичных зерен 57.0 мкм). Крупная пыльца характерна и для R. spinosissima L. (полярная ось 36.4–49.0 мкм, экваториальный диаметр 34.3–44.7 мкм). В одном из образцов этого вида встречаются единичные пыльцевые зерна с диаметром 52.5 мкм.
Рис. 1.
Морфология пыльцы представителей рода Rosa (СЭМ).
1, 2 – R. roxburgii; 3, 4 – R. sweginzowii; 5, 6 – R. acicularis; 7, 8 – R. majalis; 1, 3, 5, 7 – общий вид пыльцевого зерна с экватора. 2, 4, 6, 8 – скульптура поверхности. Масштабные линейки, мкм: 1, 3, 5, 7 – 5; 2, 4, 6, 8 – 1.
Fig. 1. Pollen morphology of the genus Rosa species (SEM).
1, 2 – R. roxburgii; 3, 4 – R. sweginzowii; 5, 6 – R. acicularis; 7, 8 – R. majalis; 1, 3, 5, 7 – equatorial view of pollen grain. 2, 4, 6, 8 – details of ornamentation. Scale bars, μm: 1, 3, 5, 7 – 5; 2, 4, 6, 8 – 1.

Рис. 2.
Морфология пыльцы представителей рода Rosa (СЭМ).
1–3 – R. myriacantha; 4–6 – R. gallica; 7 – R. glauca; 8 – R. davurica; 9 – R. micrantha; 10, 13 – R. acicularis; 11, 14 – R. pulverulentha; 12 – R. canina; 15 – R. amblyotis. 1–6 – общий вид с экватора типичного пыльцевого зерна. 7–9 – общий вид с полюса атипичного 3 – синкольпатного пыльцевого зерна. 10–15 – общий вид атипичного пыльцевого зерна. Масштабные линейки, мкм: 1–15 – 5.
Fig. 2. Pollen morphology of the genus Rosa species (SEM).
1–3 – R. myriacantha; 4–6 – R. gallica; 7 – R. glauca; 8 – R. davurica; 9 – R. micrantha; 10, 13 – R. acicularis; 11, 14 – R. pulverulentha; 12 – R. canina; 15 – R. amblyotis. 1–6 – equatorial view of a typical pollen grain. 7–9 – polar view of an atypical pollen grain (3-syncolpate). 10–15 – general view of an atypical pollen grain. Scale bars, μm: 1–15 – 5.

Полученные данные показали, что размеры пыльцевых зерен, содержащихся в одном цветке, у большинства изученных видов роз варьируют незначительно. Однако у некоторых видов эта разница в одном цветке может превышать 10 мкм (например, у одного из экземпляров R. spinosissima – 12.6 мкм, а у R. pulverulenta – 12 мкм). Существенной разницы в размерах пыльцы у разных растений одного и того же вида, произрастающих на территории Ботанического сада Петра Великого, не обнаружено (табл. 1).
Вопрос о вариабельности размеров пыльцевых зерен у разных видов роз неоднократно обсуждался в литературе (Wronska-Pilarek, Boratynska, 2005, 2015 и др.). Так, измерение 3850 пыльцевых зерен R. canina L. (Wronska-Pilarek et al., 2015) позволило авторам сделать вывод об относительно низкой вариабельности биометрических характеристик пыльцы этого вида. При этом самая низкая вариабельность размеров была отмечена в одном цветке, самая большая – в разных популяциях (Wronska-Pilarek et al., 2015). Изучение морфологии пыльцы R. gallica L. из 15 районов Южной Польши теми же авторами показало, что разница в размерах пыльцевых зерен этого вида у растений из разных регионов может достигать 25 мкм (Wronska-Pilarek, Boratynska, 2005). Существует мнение, что размеры пыльцевых зерен роз могут зависеть от плоидности растений (Zhou et al., 2008; Le Bris et al., 2011). D.C. Zlesak (2009) на примере большого числа видов и культиваров роз показал, что диплоидные растения продуцируют пыльцу менее 35.6 мкм, тетраплоидные от 35.6–43.7 мкм, гексаплоидные от 43.7 до 47 мкм, а октоплоидные более 47 мкм в диаметре. На основе полученных данных этот автор считает, что размер пыльцевых зерен может быть использован для установления плоидности экземпляров роз. Корреляция между размерами пыльцевых зерен и уровнем плоидности наблюдается в разных таксонах цветковых растений, например, у видов родов Oenothera L. (Onagraceae) (Laws, 1965), Artemi-sia L. (Asteraceae) (Korobkov, 1981), Avena L. (Poaceae) (Katsiotis, Forsberg, 1995); Eriotheca Schott et Endl. (Malvaceae) (Olivera et al., 2013) и др.
Апертуры у пыльцы роз сложные, каждая состоит из внешней меридионально ориентированной борозды (кольпы) и внутренней эндоапертуры (оры). Борозды длинные, глубокие, широкие, сужающиеся к полюсам, с острыми концами и слегка волнистыми краями. Часто борозды с оперкулюмом (крышечкой), который может покрывать мембрану борозды почти по всей ее длине или только ее центральную часть. Иногда вместо оперкулюма сохраняются лишь его фрагменты разного размера и конфигурации. Оперкулюм приподнимается над краями борозд и при исследовании с помощью СМ хорошо виден в полярном положении зерна. СЭМ показывает, что оперкулюмы у пыльцы всех изученных видов имеют такую же струйчатую скульптуру, как и вся поверхность пыльцевого зерна. Размеры и форма оперкулюма сильно варьируют в пределах одного цветка, встречаются зерна как с оперкулюмом, так и без него (рис. 3, 1–7). В литературе нет единого мнения о таксономической значимости этого признака пыльцы роз. Так D. Wronska-Pilarek и A.M. Jagodzinski (2011) отмечают, что R. Popek в 1996 г. по размеру, форме, рельефу их поверхности выделил 6 типов оперкулюмов и считал особенности этой структуры важным дополнительным признаком видового уровня в роде Rosa (цитата по Wrońska-Pilarek, Jagodziński, 2011). Другие авторы полагают, что из-за высокой изменчивости этот признак не может иметь важного диагностического значения (Wroñska-Pilarek, Jagodziński, 2011). Эти же авторы отмечают, что оперкулюм легко можно спутать со структурами другого происхождения, например, с выпячиванием мембраны в области оры. В связи с этим следует отметить, что ошибки возможны только в случае изучения с помощью СЭМ необработанной ацетолизной смесью или кислотой пыльцы. Оперкулюмы сохраняются при обработке пыльцы, тогда как все содержимое разрушается и никаких выпячиваний быть не может. Полученные нами данные показывают высокую степень индивидуальной изменчивости оперкулюмов, что, вероятно, свидетельствует об отсутствии таксономической значимости этого признака для пыльцы роз. Характерной особенностью пыльцы изученных видов рода Rosa является замок, прикрывающий борозду в месте расположения оры (рис. 1, 1; 2, 1, 4). В одном цветке встречаются зерна как с хорошо развитым замком, так и без него. Таким образом, этот признак, так же как и оперкулюм, не является диагностическим для пыльцы отдельных видов роз.
Рис. 3.
Морфология пыльцы представителей рода Rosa (СЭМ, КЛСМ)
1, 11–13 – R. spinosissima; 2 – R. micrantha; 3, 4 – R. altaica; 5 – R. kokanica; 6–7 – R. amblyotis; 8–10 – R. davurica. 1–7 – борозды (СЭМ). 8–13 – эндоапертуры. Масштабные линейки, мкм: 1–13 – 5.
Fig. 3. Pollen morphology of the genus Rosa species (SEM, CLSM)
1, 11–13 – R. spinosissima; 2 – R. micrantha; 3, 4 – R. altaica; 5 – R. kokanica; 6–7 – R. amblyotis; 8–10 – R. davurica. 1–7 – colpus (SEM). 8–13 – endoaperture (CLSM). Scale bars, μm: 1–13 – 5.

Оры (эндоапертуры) у пыльцы роз обычно описывают как округлые или овальные (Wronska-Pilarek, Jagodzinski, 2011). Л.А. Куприянова (Kupriyanova, Aleshina, 1978) называет апертурный тип пыльцы роз бороздно-поровым, тем самым считая ору округлой. У пыльцы большинства исследованных нами видов роз оры слабо просматриваются при светооптическом исследовании и имеют нечеткие очертания. Однако у некоторых видов роз (например, у R. majalis Herrm.) пыльцевые зерна характеризуются четко очерченными и хорошо заметными орами. В одном цветке довольно часто встречаются пыльцевые зерна с разнообразным очертанием ор (экваториально вытянутые прямоугольные с неясными концами, округлые в границах борозды, c расширяющимися частями за краями борозды (в очертаниях напоминающими силуэт бабочки, H-образные), веретеновидные, сильно сжатые в центре борозды.
Можно ли использовать формы ор в качестве таксономического признака, позволяющего различать виды? Насколько этот признак стабилен? По данным СМ можно выделить 2 основных варианта очертания ор: экваториально вытянутые (например, R. pimpinellifolia L., R. pendulina L.) и округлые или овальные, не заходящие за края борозд (например, R. davurica Pall.) с многочисленными промежуточными вариантами. При светооптическом исследовании не удается выяснить, заходят ли оры за края борозд или ограничены краями борозд, имеют округлую или овальную форму или слегка вытянуты по экваториальной оси.
Исследование эндоапертур с помощью КЛСМ показало, что у пыльцы роз можно выделить два варианта ор: 1. Оры, которые при световом микроскопировании выглядят как экваториально вытянутые и состоят из 3 частей. В центре борозды заметно утончение оболочки округлой формы (собственно ора), а за краями борозд, более или менее параллельно ее краям расположены тонкие участки экзины в форме полумесяцев (рис. 3, 9). 2. Оры не заходят за края борозд (рис. 3, 12). Данные КЛСМ позволяют объяснить наблюдаемое многообразие ор у пыльцы из одного цветка роз. Серповидные тонкие участки экзины могут располагаться на разном расстоянии от краев борозды, чем больше это расстояние, тем более вытянутой выглядит ора в СМ. При отсутствии таких утончений экзины наблюдается лишь главная часть оры округлой формы, не заходящая за края борозд. Если края борозд по каким-то причинам сближаются, то очертание оры из округлого трансформируется в овальное, вытянутое по полярной оси. Из сказанного понятно, что пластичность признаков очертаний и размеров ор не позволяют разделить пыльцу изученных роз на группы.
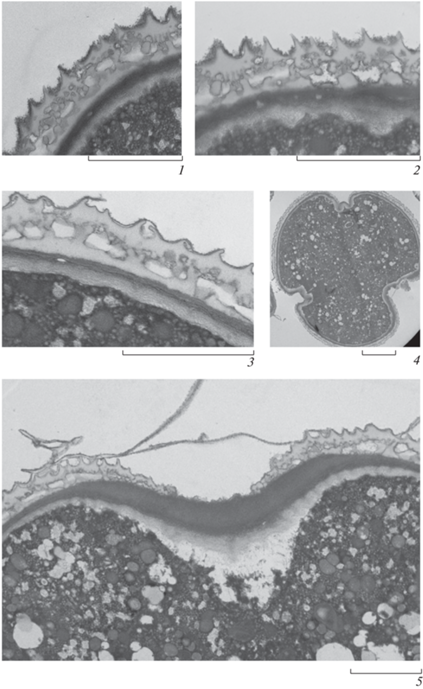
По данным светооптической микроскопии экзина пыльцевых зерен тонкая, она составляет 1.5–2.0 мкм, ее слои и столбики эктэкзины у пыльцы большинства исследованных видов не просматриваются или едва заметны. Проведенное с помощью ТЭМ исследование ультраструктуры оболочки пыльцевых зерен R. amblyotis C. A. Mey. показало, что на ультратонких срезах спородермы отчетливо видны эктэкзина, эндэкзина и интина (рис. 4). Эктэкзина тектатно-колумеллятная. Тектум толстый, до 0.35 мкм толщиной, гомогенный, на поверхности с узкими струйками, которые на срезе имеют треугольные очертания. Снаружи тектум покрыт тонкой электронноплотной пленкой, состоящей из мелких, плотно прилегающих друг к другу гранул. Тектум пронизан немногочисленными перфорациями около 0.08 мкм в диаметре. Под тектумом расположен ряд тонких (0.05 мкм в диаметре) и невысоких (0.08 мкм высотой) столбчатых структур. Этот ряд маленьких “столбиков” (рис. 4, 2, 3), вероятно, можно считать инфратектумом, по аналогии с наружным слоем столбиков у пыльцы представителей семейства Asteraceae (Grigoryeva et al., 2009). Ниже располагается слой более крупных столбиков (колумелл) (0.19 мкм высотой и 0.12 мкм в диаметре), которые опираются на гомогенный подстилающий слой, около 0.12 мкм толщиной. Эндэкзина заметно тоньше эктэкзины, около 0.15 мкм на межапертурных участках, более электронноплотная, на срезах выглядит более темной по сравнению со структурами эктэкзины, имеет ламеллятную структуру. Ламеллы плотно прилегают друг к другу, поэтому на срезах эндэкзина часто выглядит темным гомогенным слоем. Интина образована тонкими фибриллами и имеет меньшую электронную плотность по сравнению с эндэкзиной (на срезах выглядит более светлой). Толщина интины на межапертурных участках составляет около 0.25 мкм и увеличивается в области апертуры до 0.7 мкм. Эктэкзина в зоне апертуры отсутствует. Мембрана борозды образована толстым слоем интины и очень тонким слоем эндэкзины (рис. 4, 5).
Рис. 4.
Ультратонкие срезы спородермы R. amblyotis (TEM).
1–3 – межапертурный участок; 4 – общий вид с полюса; 5 – апертура. Масштабные линейки, мкм: 1–3 – 0.5; 4 – 5; 5 – 2.
Fig. 4. Ultra-thin sections of sporoderm in R. amblyotis (TEM).
1–3 – interapertural site; 4 – polar view; 5 – aperture. Scale bars, μm: 1–3 – 0.5; 4 – 5; 5 – 2.
Скульптура у пыльцы всех изученных видов струйчатая (рис. 1, 2, 4, 6, 8). Струйки у пыльцы разных видов роз различаются размерами (шириной и длиной), поэтому их четкость при светооптическом исследовании неодинакова. СЭМ позволяет уточнить некоторые детали скульптуры. У пыльцы большинства изученных видов струйки длинные, узкие (не более 0.25 мкм шириной), чаще заостренные (треугольные в поперечном сечении), реже плоские. Ширина струек и их длина у пыльцы разных видов роз несколько различается. Самые широкие (до 0.7–0.8 мкм шириной) и самые короткие струйки характерны для пыльцы R. majalis (рис. 1, 8). Пыльцевые зерна в одном цветке могут различаться расположением струек. Можно выделить следующие варианты расположения струек на поверхности пыльцевых зерен.
1. Меридиональное расположение. Струйки идут от одного полюса к другому, почти параллельно, довольно плотно прилегая друг к другу (рис. 2, 1, 2).
2. Струйки образуют концентрические кольца в экваториальной зоне мезокольпиума (рис. 2, 3).
3. Струйки расположены полукольцами в экваториальной зоне мезокольпиума (рис. 2, 6).
4. Струйки образуют концентрические кольца на полюсах пыльцевого зерна.
Плотность примыкания струек друг другу у пыльцы разных видов роз также неодинакова. Струйки плотно прилегают друг к другу, либо расходятся на расстояния, сопоставимые с их шириной. У пыльцы ряда видов промежутки между струйками заметно превышают их ширину. В углублениях между струйками имеются перфорации. По числу и размерам перфораций можно выделить 2 варианта скульптур: перфорации очень мелкие, редкие и перфорации довольно крупные, многочисленные. Четкую границу между двумя вариантами скульптур провести невозможно, поскольку для некоторых видов характерны пыльцевые зерна со скульптурой промежуточных типов.
Большинство палинологов, изучающих пыльцу представителей семейства Rosaceae, отмечают, что особенности скульптуры экзины имеют таксономическое значение, как на родовом, так и на видовом уровне. При этом определяющими считаются ширина, длина струек, расстояние между ними, размер и число перфораций, расположенных в желобках между ними (Eide 1981; Ueda, Tomita, 1989; Hebda, Chinnappa 1990; Ueda 1992). Y. Ueda и H. Tomita (1989) выделили 6 типов и 3 подтипа скульптур пыльцы у исследованных ими видов. Полученные нами данные не согласуются с данными этих авторов, но подтверждают выводы тех исследователей, которые полагают, что число перфораций не является диагностическим признаком на уровне секций и подродов, поскольку пыльца с одинаковым числом перфораций была обнаружена у видов из разных секций и даже подродов (Wronska-Pilarek, Jagodzinski, 2011). При этом ширина струек, расстояние между ними и число перфораций между струйками на поверхности пыльцы могут быть характеристиками отдельных видов. Следует отметить, что при анализе скульптуры некоторые авторы не принимают в расчет факт, что мелкие детали скульптуры, прежде всего перфорации, нередко маскируются тонкой пленкой, покрывающей поверхность пыльцевого зерна. Наличие этой пленки затрудняет анализ скульптуры поверхности пыльцы представителей рода Rosa на СЭМ и может приводить к ошибочной интерпретации полученных результатов. Просмотр большого числа пыльцевых зерен, предварительно обработанных ацетолизной смесью, позволяет избежать ошибок в трактовке особенностей скульптуры у пыльцы роз.
Согласно M. Shinwari и V.A. Khan (2004), основные палинологические характеристики (толщина экзины, форма, длина полярной оси и экваториального диаметра, длина борозд) являются полезными критериями для разграничения видов рода Rosa. Полученные нами данные по морфологии пыльцы видов Rosa из коллекции Ботанического сада им. Петра Великого согласуются с выводами тех авторов, которые считают, что по палинологическим признакам возможна идентификация только некоторых видов роз (Wronska-Pilarek, Jagodzinski, 2011). Из изученных нами видов рода Rosa только пыльца R. majalis достоверно отличается от пыльцы других роз широкими, короткими струйками на поверхности экзины и крупными отчетливыми орами. Палиноморфологические различия у других изученных видов выражены незначительно.
Как уже отмечалось выше, многие признаки изученной пыльцы роз (форма пыльцевого зерна, очертания эндоапертур, морфология оперкулюма) не являются стабильными и варьируют не только в пределах вида, но и одного цветка.
По числу, строению и расположению апертур устанавливаются типы пыльцы (3-бороздный, 3‑бороздно-оровый, поровый и т.д.), которые являются важной палиноморфологической характеристикой вида (Kupriyanova, Aleshina, 1972). В литературе описаны случаи, когда в одном цветке наряду с численно преобладающей пыльцой одного какого-то типа (в зависимости от таксона) встречается небольшое количество (в большинстве случаев единичные зерна) так называемой атипичной пыльцы с другим числом и (или) расположением апертур (Pozhidaev, 1993, 1995 и др.). Такая атипичная пыльца имеет сходную с типичной форму, размеры, скульптуру, ультраструктуру оболочки, лишена каких-либо вмятин на поверхности. Отличается от типичной только числом и (или) расположением апертур. В большинстве случаев она фертильная и способна к прорастанию (Dajoz et al., 1991, 1993; Mignot et al., 1994; Till-Bottraud et al., 1999 и др.). В палиноморфологических исследованиях атипичные пыльцевые зерна, которые отличаются от типичных только числом и расположением апертур, принято отличать от деформированных. Последние характеризуются большим числом вмятин, вплоть до полного изменения формы зерна, значительно отличаются от типичных размерами, у таких зерен бывает сложно определить тип и число апертур (Pozhidaev, 1993, 1995, 1998).
Атипичные пыльцевые зерна выявлены только у 9 (R. amblyotis, R. canina, R. davurica, R. dolichocarpa, R. glauca Pourr., R. jundzillii Besser, R. micrantha Borrer ex Sm., R. platyacantha Schrenk, R. pulverulena M. Bieb.) из 28 изученных видов роз. Из всего многообразия атипичных пыльцевых зерен, описанного в литературе (Pozhidaev, 1993, 1995, 1998) для разных растений с 3-бороздно-оровой пыльцой, у изученных нами видов роз обнаружено только 3 варианта отклонений от основного палинотипа.
1. Пыльцевые зерна с одной кольцевой апертурой, лежащей в экваториальной плоскости (рис. 2, 12) или слегка согнутой, субэкваториальной (рис. 2, 10, 11). R. canina, R. platyacantha, R. pulverulenta.
2. Пыльцевые зерна 3-бороздно-оровые с косо расположенными бороздами (R. glauca).
3. Пыльцевые зерна слитно-3-бороздно-оровые (синкольпатные). R. canina, R. davurica, R. dolichocarpa, R. glauca, R. micrantha, R. pulverulenta (рис. 2, 7–9).
4. Пыльцевые зерна с числом апертур более 3 (6-апертурные и переходные к нему формы). R. amblyotis, R. dolichocarpa, R. glauca, R. jundzillii, R. micrantha, R. pulverulenta (рис. 2, 13–15).
У конкретного экземпляра одного вида роз возможны различные комбинации атипичных форм пыльцы (табл. 1). Так, например, из 3 изученных образцов R. amblyotis атипичные (6-апертурные) пыльцевые зерна обнаружены только в одном из них.
В одном из 2 образцов R. pulverulenta встречаются 3 варианта отклонений (синкольпатные, с одной кольцевой апертурой и 6-апертурные), а в другом образце этого же вида только один из них (6-апертурные пыльцевые зерна). 2 варианта отклонений (пыльцевые зерна с одной кольцевой апертурой и синкольпатные) выявлены у R. canina. У R. micrantha, R. dolichocarpa обнаружены синкольпатные и 6-апертурные пыльцевые зерна.
У 8 из 9 перечисленных видов атипичные формы пыльцы представлены единичными зернами (в процентном выражении это – сотые доли процента) и только в цветках R. glauca преобладает атипичная пыльца (92.5%). Атипичные зерна представлены у этого вида 4 вариантами (51% – 6‑апертурные, 39.5% – с одной кольцевой апертурой, 2% – 3-синкольпатные и 3-бороздно-оровые с косо расположенными бороздами).
Обнаруженные у изученных видов Rosa отклоняющиеся формы пыльцы ранее были описаны в неродственных таксонах цветковых растений с 3‑бороздной или 3-бороздно-оровой пыльцой и представляют часть рядов, связывающих типичные и нетипичные формы пыльцы (Pozhidaev, 1993, 1995 и др.). Причины появления в одном цветке и даже пыльнике пыльцевых зерен с иным числом и расположением апертур пока остаются предметом дискуссии. Существуют разные точки зрения на этот счет. Согласно одному из распространенных предположений, техногенные загрязнения окружающей среды, в том числе повышенный уровень радиации, приводят к появлению и увеличению числа аномальных (в том числе по признаку числа и расположения апертур) пыльцевых зерен (Dzyuba, 2006; Dzyuba et al., 2006; Datta et al., 2009 и др.). Механизмы появления у одного растения, а часто и одного цветка пыльцевых зерен с другим числом и расположением апертур по сравнению с основным типом пока не ясны. В настоящее время ведутся работы по выявлению генов, влияющих на число апертур на примере модельного объекта Arabidopsis thaliana (L.) Heynh., для которого получены линии с безапертурными, 4-бороздными и 6-апертурными пыльцевыми зернами (Dobritsa, Coerper, 2012; Prieu et al., 2016 и др.).
Подсчет деформированных пыльцевых зерен при светооптическом исследовании пыльцы роз, показал, что для большинства изученных видов рода Rosa характерно низкое количество таких зерен (табл. 1). Меньше всего деформированных зерен обнаружено у R. amblyotis, R. majalis, R. omeiensis Rolfe (не более 2%). У большинства изученных видов от 3 до 15%. У R. sweginzowii – 23% зерен, у 3 видов (R. glauca, R. micrantha, R. jundzillii) – 25%. Самое большое количество деформированных пыльцевых зерен было обнаружено у 3 видов: R. willmottiae Hemsl. (67%), R. pulverulenta (94%) и R. dolichocarpa (99%).
Большое количество деформированной пыльцы (90%) выявлено у одного из 4 изученных растений R. spinosissima, тогда как у остальных изученных экземпляров этого вида число деформированных зерен гораздо ниже (от 10 до 14%). Причины такого явления требуют дополнительных исследований, как в условиях интродукции, так и в естественных местах обитания.
Таким образом, большинство изученных роз продуцирует пыльцу без видимых морфологических нарушений, что в высокой степени вероятности может указывать на успешную интродукцию этих видов рода Rosa в климатических условиях г. Санкт-Петербурга.
ЗАКЛЮЧЕНИЕ
Сравнительный палиноморфологический анализ 28 видов рода Rosa, произрастающих на территории Ботанического сада Петра Великого БИН РАН (Санкт-Петербург) показал, что пыльца всех изученных видов характеризуется средними размерами, струйчатой скульптурой экзины и относится к одному 3-бороздно-оровому палинотипу. Полученные данные согласуются с выводами других авторов, которые считают, что по признакам пыльцы возможна идентификация лишь нескольких видов роз (Wrońska-Pilarek, Jagodziński, 2011). Это обусловлено высоким уровнем сходства морфологических признаков пыльцы разных видов роз с одной стороны и довольно высокой вариабельностью палиноморфологических признаков не только у одного вида, но и у одного растения и даже цветка. Из всех изученных нами видов рода Rosa достоверно можно определить только пыльцу одного вида – R. majalis, которая характеризуется короткими и довольно широкими (по сравнению с пыльцой других изученных роз) струйками на поверхности экзины и отчетливыми крупными орами.
Большинство изученных видов рода Rosa, интродуцированных в условиях климата Петербурга, с его влажностью, длиной светового дня летом и частыми колебаниями температур в зимнее время, в одном из центральных районов мегаполиса, окруженного оживленными автомобильными магистралями, тем не менее, продуцирует пыльцу без видимых морфологических отклонений.
Список литературы
[Byalt et al.] Бялт В.В., Фирсов Г.А., Бялт А.В., Орлова Л.В. 2019. Обзор культурной флоры Санкт-Петербурга (Россия). М. 180 с.
Bruun H.H. 2006. Prospects for biocontrol of invasive Rosa rugosa. – BioControl. 51 (2): 141–181. https://doi.org/10.1007/s10526-005-6757-6
[Buzunova] Бузунова И.О. 2001. Роза, шиповник – Rosa L. – В кн.: Флора Восточной Европы. Т. 10. СПб. С. 329–361.
[Czerepanov] Черепанов С.К. 1981. Сосудистые растения СССР. Л. 509 с.
Dajoz I., Till-Bottraud I., Gouyon P.H. 1991. Evolution of pollen morphology. – Scince. 253 (5015): 66–68. https://doi.org/10.1126/science.253.5015.66
Dajoz I., Till-Bottraud I., Gouyon P.H. 1993. Pollen aperture polymorphism and gametophyte performance in Viola diversifolia. – Evolution. 47 (4): 1080–1093. https://doi.org/10.1111/j.1558-5646.1993.tb02137.x
Datta S.K., Datta K., Chatterjee J. 2009. Cyto-palynological, biochemical and molecular characterization of original and induced mutants of garden Chrysanthemum. – In: Induced plant mutation in the genomics era. Rome. P. 450–452.
Dobritsa A., Coerper D. 2012. The novel plant protein inaperturate pollen 1 marrks distinct cellular domains and controls formation of apertures in the Arabidopsis pollen exine. – Plant Cell. 24 (11): 4452–4464. https://doi.org/10.1105/tpc.112.101220
[Dzyuba] Дзюба О.Ф. 2006. Палиноиндикация качества окружающей среды. СПб. 197 с.
Dzyuba O.F., Shrekova O.V., Tokarev P.I. 2006. On the natural polymorphism of pollen grains of Acer tataricum L. – Paleontol. J. 40 (supl. 5): 590–594. https://doi.org/10.1134/s0031030106110062
Eide F. 1981. Key for Northwest European Rosaceae pollen. – Grana. 20 (2): 101–118. https://doi.org/10.1080/00173138109427651
Erdtman G. 1952. Pollen morphology and taxonomy. Angiosperms. Stockholm. 539 p.
Fatemi N., Attar F., Assareh M.H., Hamzehee B. 2012. Pollen morpology of the genus Rosa L. (Rosaceae) in Iran. – Iran. J. Bot. 18 (2): 284–293.
Flora of China. FOC. Vol. 9. P. 357. www.eFloras.org
[Galushko] Галушко А.И. 1960. О нахождении на Кавказе Rosa glabrifolia C.A.M. – Ботан. материалы Гербария Ботан. ин-та им. Комарова. 20: 194–204.
[Gavrilova] Гаврилова О.А. 2014. Применение конфокальной лазерной сканирующей микроскопии (КЛСМ) для исследования морфологии оболочки пыльцевых зерен. – Бот. журн. 99 (10): 1139–1147.
[Grigoryeva et al.] Григорьева В.В., Коробков А.А., Токарев П.И. 2009. Палиноморфология рода Artemisia L. (Asteraceae). – Бот. журн. 94 (3): 328–351.
Hebda R.J., Chinnappa C.C. 1990. Studies on pollen morphology of Rosaceae in Canada. – Rev. Paleobot. Palynol. 64 (1–4): 103–108. https://doi.org/10.1016/0034-6667(90)90123-Z
Иллюстрированный определитель растений Ленинградской области. 2006. М. 799 с.
[Ivanov] Иванов А.Л. 2002. Редкие и исчезающие растения Ставрополья. Ставрополь. 352 с.
[Kapelyan] Капелян А.И. 2002. Коллекция рода Rosa. – В кн.: Растения открытого грунта Ботанического сада Ботанического института им. В.Л. Комарова. СПб. С. 167–178.
[Kapelyan] Капелян А.И. 2016. Коллекция роз в Ботаническом саду БИН РАН. – В сб.: Материалы шестой науч. конф. “Биологическое разнообразие. Интродукция растений”. СПб. С. 145–147.
[Kapelyan] Капелян А.И. 2017a. Привитые и корнесобственные розы в ботаническом саду Петра Великого. – Cб. научных трудов ГНБС. 145: 271–274.
[Kapelyan] Капелян А.И. 2017b. История интродукции видов рода Rosa L. в Санкт-Петербурге. – Плодоводство и ягодоводство России. 51: 155–163.
Katsiotis A., Forsberg R.A. 1995. Pollen grain size in four ploidy levels of genus Avena. – Euphytica. 83 (2): 103–108. https://doi.org/10.1007/BFO1678036
Koopman W.J.M., Wissemann V., de Cock K., Van Huylenbroeck J., de Riek J., Sabatino G.J.H., Visser D., Vosman B., Ritz C., Maes B., Werlemark G., Nybom H., Debener T., Linde M., Smulders M.J.M. 2008. AFLP markers as a tool to reconstruct complex relationships: a case study in Rosa (Rosaceae) . – Am. J. Bot. 95 (3): 353–366. https://doi.org/10.3732/ajb.95.3.353
[Korobkov] Коробков А.А. 1981. Полыни Северо-Востока СССР. Л. 120 с.
[Kupriyanova, Aleshina] Куприянова Л.А., Алешина Л.А. 1967. Палинологическая терминология покрытосеменных растений. Л. 84 с.
[Kupriyanova, Aleshina] Куприянова Л.А., Алешина Л.А. 1972. Пыльца и споры растений флоры европейской части СССР. Т. 1. Л. С. 48–51.
[Kupriyanova, Aleshina] Куприянова Л.А., Алешина Л.А. 1978. Пыльца и споры растений флоры европейской части СССР. Т. 2. Л. С. 109–111.
[K’osev] Кьосев П.А. 2014. Русский травник. Описание и применение лекарственных растений. М. 896 с.
Laws H.M. 1965. Pollen grain morphology of polyploid Oenotheras. – J. Heredity. 56 (1): 18–21.
Mignot A., Hoss C., Dajoz I., Leuret C., Henry J.-P., Dreuillaux J.-M., Heberle-Bors E., Till-Bottraud I. 1994. Pollen aperture polymorphism in the Angiosperms: importance, possible causes and consequences. – Acta Bot. Gallica. 14 (2): 109–122. https://doi.org/10.1080/12538078.1994.10515144
[Orlova et al.] Орлова С.Ю., Павлов А.В., Вержук В.Г. 2019. Жизнеспособность пыльцы сортов черешни (Cerasus avium) различного эколого-географического происхождения в условиях Северо-Западного региона России. – Труды по прикладной ботанике, генетике и селекции. 180 (1): 66–72. https://doi.org/10.30901/2227-8834-2019-1-66-72
Pozhidaev A.E. 1993. Polymorphism of pollen in the genus Acer (Aceraceae). Isomorphism of deviant forms of Angiosperm pollen. – Grana. 32 (2): 79–85.
Pozhidaev A.E. 1995. Pollen morphology of the genus Aesculus (Hippocastanaceae). Patterns in the variety of morphological characteristics. – Grana. 34 (1): 10–20. https://doi.org/10.1080/00173139509429028
Pozhidaev A.E. 1998. Hypothetical way of pollen aperture patterning. 1. Formation of 3-colpate patterns and endoaperture geometry. – Rev. Paleobot. Palynol. 104 (1): 67–83. https://doi.org/10.1016/S0034-6667(98)00045-1
Prieu C., Matamoro-Vidal A., Raquin C., Dobritsa A., Mercier R., Gouyon R., Albert B. 2016. Aperture number influences pollen survival in Arabidopsis mutants. – Am. J. Bot. 103 (3): 452–459. https://doi.org/10.3732/ajb.1500301
Reitsma T.J. 1966. Pollen morphology of some European Rosaceae. – Acta Bot. Neerl. 15 (2): 290–379.
Ritz C.M., Wissemann V. 2003. Male correlated non-matroclinal character inheritance in reciprocal hybrids of Rosa section Caninae (DC) Ser. (Rosaceae). – Plant Syst. Evol. 241 (11): 213–221. https://doi.org/10.1007/s00606-003-0058-2
[Rubtsova] Рубцова О.Л. 2009. Рід Rosa L. в Україні: генофонд, історія, напрями досліджень, досягнення та перспективи. Київ. 375 с.
[Saakov, Rieksta] Сааков С.Г., Риекста Д.А. 1973. Розы. Рига. 359 с.
[Shevchenko, Kuzmina] Шевченко С.В., Кузьмина Т.И. 2018. Некоторые особенности эмбриологии представителей видов Rosa spinosissima L., R. canina L. и сортов R. × damascena Mill. в норме и при вирусной инфекции. – Сельскохозяйственная биология. 53 (3): 624–633. https://doi.org/10.15389/agrobiology.2018.3.624rus
[Schanzer] Шанцер И.А. 2011. Гибридизация, полиморфизм и филогенетические отношения рода Rosa L.: Автореф. дис. … докт. биол. наук. М. 41 с.
[Schanzer, Kutlunina] Шанцер И.А., Кутлунина Н.Л. 2010. Межвидовая гибридизация у шиповников (Rosa L.) секции Caninae DC. – Известия РАН. Сер. Биологическая. 5: 564–573.
Shinwari M., Khan M.A. 2004. Pollen morphology of wild roses from Pakistan. – Hamdard Med. 47 (4): 5–13.
[Shmite] Шмите Д.Х. 1988. Дикорастущие и интродуцированные виды рода Rosa L. Прибалтики: Автореф. дис. … канд. биол. наук. Вильнюс. 18 с.
[Svyazeva] Связева О.А. 2005. Деревья, кустарники и лианы парка Ботанического сада Ботанического института им. В.Л. Комарова. СПб. 384 с.
Till-Bottraud I., Vincent M., Dajoz I., Mignot A. 1999. Pollen aperture heteromorphism: Variation in pollen type proportions along altitudinal transects in Viola calcarata (Violaceae). – Comptes Rendus de l’Académie des Sciences Paris. Life Sciences. 322 (7): 579–589. https://doi.org/10.1016/s0764-4469 (00)88528-5.
Ueda Y. 1992. Pollen surface morphology in the genus Rosa related genera. – Jpn. J. Palynol. 38 (2): 94–105.
Ueda Y., Tomita H. 1989. Morphometric analysis of pollen patterns in roses. – J. Jpn. Soc. Hort. Sci. 581: 211–220.
Wissemann V., Hellwig F. H. 1997. Reproduction and hybridisation in the genus Rosa section Caninae (Ser.) Rehd. – Bot. Acta. 110 (3): 251–256. https://doi.org/10.1111/j.1438-8677.1997.tb00637.x
Wissemann V., Ritz C.M. 2007. Evolutionary patterns and processes in the genus Rosa (Rosaceae). – Plant Syst. Evol. 266 (1–2): 79–89. https://doi.org/10.1007/s00606-007-0542-1
Wronska-Pilarek D., Boratynska K. 2005. Pollen morphology of Rosa gallica L. Rosaceae L. from southern Poland. – Acta Soc. Bot. Polon. 74 (4): 297–304. https://doi.org/10.5586/asbp.2005.038
Wronska-Pilarek D., Jagodzinski A.M. 2009. Pollen morphological variability of Polish native species of Rosa L. (Rosaceae). – Dendrobiology. 62: 71–82.
Wronska-Pilarek D. 2011. Pollen morphology of Polish native species of the Rosa genus (Rosaceae) and its relation to systematics. – Acta Soc. Bot. Pol. 80 (3): 221–232. https://doi.org/10.5586/asbp.2011.031
Wronska-Pilarek D., Jagodzinski A.M. 2011. Systematic importance of pollen morphological features of selected species from the genus Rosa (Rosaceae). – Plant Syst. Evol. 295 (1): 55–72. https://doi.org/10.1007/s00606-011-0462-y
Wronska-Pilarek D., Jagodzinski A.M., Bocianowski J., Janyszek M. 2015. The optimal sample size in pollen morphological studies using the example of Rosa canina L. (Rosaceae). – Palynology. 39 (1): 56–75. https://doi.org/10.1080/01916122.2014.933748
[Yuzepchuk] Юзепчук С.В. 1941. Роза (Шиповник). – Rosa L. – В кн.: Флора СССР. Т. 10. М., Л. С. 431–508.
[Zhao Zhongchen, Chen Hubiao] Чжао Чжунчен, Чэнь Хубяо. 2021. Лекарственное сырье китайской медицины. СПб. 631 с.
Zimmermann H., von Wehrden H., Renison D., Wesche K., Welk E., Damascos M.A., Hensen I. 2012. Shrub management is the principal driver of differing population sizes between native and invasive populations of Rosa rubiginosa L. – Biol. Invasions. 14 (10): 2141–2157. https://doi.org/10.1007/s10530-012-0220
Zlesak D.C. 2009. Pollen diameter and guard cell length as predictors of ploidy in diverse rose cultivars, species, and breeding lines. – Floriculture and ornamental biotechnology. 3 (Special Issue 1): 53–70.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


