Ботанический журнал, 2022, T. 107, № 12, стр. 1125-1146
ЖЕНСКИЙ АРХЕСПОРИЙ ПОКРЫТОСЕМЕННЫХ РАСТЕНИЙ: СТРУКТУРА, ЭВОЛЮЦИЯ, БИОЛОГИЧЕСКАЯ РОЛЬ
Г. Ю. Виноградова *
Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: vinogradova-galina@binran.ru
Поступила в редакцию 11.09.2022
После доработки 11.10.2022
Принята к публикации 01.11.2022
- EDN: WJDOAD
- DOI: 10.31857/S0006813622120110
Аннотация
Обзор посвящен проблеме формирования одноклеточного и многоклеточного археспория в женских репродуктивных структурах (семязачатках), дифференциации его клеток в мегаспороциты, регуляции этих процессов. Рассмотрена терминология, используемая в отношении археспория, проанализированы различные точки зрения о природе археспория, его месте и времени заложения в семязачатке и трансформации в мегаспороциты. На основании этого сделано заключение, что на ранних стадиях развития семязачатка все его клетки однотипны и меристематичны, позднее одна или несколько клеток в субэпидермальном или глубже расположенных слоях начинают свою дифференциацию как археспориальные (спорогенные) клетки, проявляя отличия от остальных клеток по ультраструктурной организации, составу клеточной стенки, характеристикам хроматина в ядре. Рассмотрены различные механизмы генной и эпигенетической регуляции инициации спорогенной клетки, а также возможные факторы, приводящие к дифференциации нескольких спорогенных клеток в семязачатке растений, для которых типично характерен одноклеточный археспорий (арабидопсис, кукуруза, рис). Обозначена роль каллозы в детерминации лишь одного (реже двух) мегаспороцита в многоклеточном спорогенном комплексе для вступления его в мейоз и формирования единственного гаметофита в семязачатке. Представлены данные анализа эволюции женского археспория, сделано предположение, что множественный археспорий стал производным от одноклеточного в ходе исторического развития покрытосеменных, как адаптация для сохранения их репродуктивного потенциала при появлении барьеров в развитии спорогенной клетки или частой ее гибели, в чем, по-видимому, и заключается его биологическая роль.
Жизненный цикл растений представляет смену двух поколений: диплоидного спорофита и гаплоидного гаметофита. В отличие от споровых растений, у семенных эти поколения не разнесены во времени и пространстве, а очень сближены, так что на материнском спорофите формируются мужские и женские гаметофиты, происходит оплодотворение и развитие нового (дочернего) спорофита. В связи с этим некоторые исследователи предлагают их рассматривать не как поколения, а как фазы развития (Poddubnaya-Arnoldi, 1976). Смена диплоидного спорофита и гаплоидного гаметофита связана с двумя противоположными процессами: мейотическим делением и оплодотворением; в результате мейоза диплоидных клеток спорофита образуются гаплоидные микро- и мегаспоры; переход обратно в диплоидную фазу происходит после оплодотворения – слияния мужской (спермия) и женской (яйцеклетки) гамет.
У покрытосеменных растений эти события осуществляются в специализированных репродуктивных органах – цветках, в которых формируются мужские (пыльники) и женские (семязачатки) репродуктивные структуры. На ранних стадиях развития этих структур дифференцируются спорогенные клетки – микро- и мегаспороциты, вступающие в мейоз, после которого образуются микроспоры (в пыльниках) и мегаспоры (в семязачатках). Началом дифференциации спорогенных клеток считается заложение археспориальных клеток (археспория) на самых ранних стадиях развития пыльников и семязачатков (Maheshwari, 1950). В пыльниках археспорий всегда многоклеточный, археспориальные клетки многократно митотически делятся и, соответственно, дифференцируется много микроспороцитов. В семязачатках, наоборот, чаще всего закладывается одна археспориальная клетка, которая трансформируется в единственный мегаспороцит, дающий начало одному женскому гаметофиту (зародышевому мешку). Однако у некоторых растений археспорий может быть многоклеточным.
Впервые различия в числе клеток археспория были рассмотрены K. Schnarf (1927–1929), который предложил свою классификацию, основанную на двух критериях: числе археспориальных клеток, дифференцирующихся в субэпидермальном слое семязачатка; и их способности к делению перед формированием мегаспороцитов или прямого перехода к мегаспороцитам без каких-либо делений. Он выделил 6 типов археспория (Schnarf, 1927–1929). В дальнейшем типизация археспория неоднократно обсуждалась в литературе (Poddubnaya-Arnoldi, 1976; Kordyum, 1978; Nikiticheva, Shamrov, 2002; и др.). Сейчас большинство исследователей принимают точку зрения, что существует только два типа археспория – одноклеточный и многоклеточный (множественный). Однако, характеристики археспория, предложенные Schnarf (1927–1929), до сих пор являются предметом терминологической дискуссии: какие же клетки семязачатка действительно являются археспориальными? Особенно актуальным этот вопрос является в отношении множественного археспория. Вместе с этим, в настоящее время с развитием новых подходов и методов, таких как молекулярные и генетические исследования, появляются новые вопросы, связанные с механизмами инициации и дифференциации спорогенных клеток, а также спорогенеза.
Несмотря на значительный успех исследований в этой области (Balasubramanian, Schneitz, 2000; Gross-Hardtl et al., 2002; Olmedo-Monfil et al., 2010; Tucker et al., 2012, Lora et al., 2019; Mendes et al., 2020 и др.), данные работы выполнены на видах с одноклеточным археспорием, тогда как вопросы дифференциации клеток множественного археспория, их потенции к трансформации в мегаспороциты и мегаспорогенезу остаются без внимания.
Изучение этих аспектов репродукции также поднимает вопросы, связанные с биологической ролью множественного археспория, в чем смысл формирования многочисленных спорогенных клеток, если в большинстве случаев формируется только один зародышевый мешок. Решение этих вопросов будет связано и с проблемой эволюции археспория у покрытосеменных растений, – в каком направлении она шла – по пути увеличения числа археспориальных клеток или их редукции.
В настоящем обзоре проведено обобщение данных по проблеме формирования археспория, дифференциации его клеток в мегаспороциты, с особым акцентом на множественный археспорий. Рассмотрены вопросы, связанные с разработкой терминологии, касающейся археспория в целом и множественного археспория в частности, а также с раскрытием механизмов инициации и развития археспория. Также обсуждается проблема филогенетического значения множественного археспория и его биологическая роль (почему развивается только один зародышевый мешок, несмотря на то, что в семязачатке формируется много спорогенных клеток).
ПОНЯТИЕ “АРХЕСПОРИЙ”. СТРУКТУРА, ВРЕМЯ И МЕСТО ЕГО ДИФФЕРЕНЦИАЦИИ
Вопрос о дифференциации археспория, о сущности этих клеток остается одним из сложных в эмбриологии растений, поскольку до сих пор нет единого мнения, какие же клетки следует считать археспориальными, где и когда они дифференцируются, следует ли вообще выделять археспориальные клетки. Наиболее ясным вопрос об археспории представляется в тенуинуцеллятных семязачатках, где единственным претендентом на роль археспориальной клетки является субэпидермальная клетка примордия семязачатка, которая уже на самых ранних стадиях отличается от окружающих клеток своими размерами, плотностью цитоплазмы и некоторыми другими клеточными характеристиками (Warming, 1878; Gerassimova-Navashina, 1958; Bajon et al., 1999 и др.). По мере развития семязачатка эта клетка продолжает свой рост и непосредственно трансформируется в мегаспороцит, который дает начало мегаспорам после редукционного деления. В крассинуцеллятных семязачатках в ряде случаев археспориальные клетки различить более сложно, особенно если их формируется несколько (множественный археспорий), и к тому же на ранних стадиях в семязачатке начинает формироваться париетальная ткань за счет периклинальных делений в субэпидермальном слое нуцеллуса, формирующая в будущем его апикальную часть и покрывающая спорогенные клетки. При исследовании ранних стадий развития таких семязачатков многие исследователи подчеркивали сложность определения границ той группы клеток, которые в дальнейшем станут мегаспороцитами (Fagerlind, 1937; Khan, 1942; Berger, 1953; Romanov, 1954; Hjelmqvist, 1962; Czapik, 1961, 1962; Solntseva, 1965 и др.). Формирование париетальной ткани в крассинуцеллятных семязачатках затрудняет определение местоположения археспория.
Термин “археспорий” был предложен K. Goebel (1880) для обозначения клеток, дающих начало спорообразующим клеткам. K. Schnarf (1927–1929) предложил в качестве археспориальных клеток рассматривать клетки (или клетку), расположенные в субэпидермальном слое примордия семязачатка, способные либо к непосредственному преобразованию в мегаспороциты, либо через ряд делений. Уточняя характеристику археспория, данную Schnarf (1927–1929), K.V.O. Dahlgren (1927) предложил выделять категории “первичного” археспория, клетки которого закладываются изначально в субэпидермальном слое примордия семязачатка, и “вторичного” – клетки которого дифференцируются после отделения париетальных клеток. Эти термины долгое время широко применялись в описании ранних стадий развития семязачатка (Davis, 1966).
Однако некоторые исследователи полагают, что выделять термины “первичный” и “вторичный” археспорий неправомерно, так как клетки субэпидермального слоя и клетки, формирующиеся после их деления, имеют различное происхождение и не могут быть описаны одинаковым термином, т.е. рассматриваться как археспорий (Bouman, 1984; Nikiticheva, Shamrov, 2002). Поэтому было предложено различать в качестве “археспория”, только клетки, которые закладываются в субэпидермальном слое семязачатка, как их обозначил Schnarf (1927–1929), а клетки, которые формируются после отделения париетальных клеток и дают начало мегаспороцитам, предложено называть “спорогенными” клетками (Nikiticheva, Shamrov, 2002). Однако сами авторы утверждают, что в случае отсутствия периклинального деления археспориальных субэпидермальных клеток, эти клетки непосредственно становятся спорогенными клетками, хотя критерии этого перехода, по мнению авторов, выделить сложно (Nikiticheva, Shamrov, 2002).
K. Goebel в своей работе “Organographie der Pflanzen…” (1933) попытался дать некоторые объяснения относительно термина “археспорий”. Он считал, что “археспорий… возникает из слоя клеток, лежащих под эпидермой”; в результате деления этих клеток “внутри оказываются клетки археспория, а снаружи – слой клеток, который в дальнейшем может делиться периклинально” (с. 55). Данное объяснение, по-видимому, предполагает, что субэпидермальный слой не относится к археспорию. Основываясь на взглядах Goebel (1933), А.Н. Сладков и Н.А. Гревцова (Sladkov, Grevtsova, 1988, 1989) рассматривали субэпидермальный слой лишь как инициальные клетки археспория и париетальных клеток. Собственно к археспорию они относили лишь те клетки, которые дают начало спороцитам (микро- или мегаспороцитам), либо непосредственно становясь ими, либо путем ряда митотических делений с образованием спорогенной ткани (Sladkov, Grevtsova, 1988). При этом местоположение археспория не определяет его сущность – археспорий может формироваться непосредственно в субэпидермальном слое, либо в глубжележащих слоях под париетальной тканью.
Сложность выявления археспориальных клеток в примордии крассинуцеллятного семязачатка привела некоторых авторов к мнению о тождестве археспория с меристемой (Romanov, 1954; Lodkina, 1971). Авторы полагали, что на ранних стадиях развития семязачатка ни в субэпидермальном, ни в других слоях нет возможности различить клетки археспория; все клетки идентичны и меристематичны, и лишь после ряда периклинальных делений под париетальными клетками начинают выделяться клетки, которые в дальнейшем дифференцируются в мегаспороциты (спорогенные клетки). Они считали, что в данном случае название “археспорий” и его границы весьма условны, поскольку меристематичность клеток сохраняется и после их деления (один или несколько раз), до момента появления каких-либо отличительных признаков спорогенных клеток (Lodkina, 1971).
Близкую точку зрения высказывала М.П. Солнцева (Solntseva, 1965), исследуя ранние стадии развития семязачатка у земляники. Она предполагала, что термин “археспорий” не приемлем в этом случае, так как центральные клетки примордия семязачатка у земляники развиваются асинхронно, в результате чего формируется комплекс клеток, находящихся на разных стадиях развития (меристематические клетки, мегаспороциты, диады и тетрады). Она предложила такой комплекс называть “репродуктивной тканью”.
Некоторые исследователи не делают различий между археспориальной клеткой и мегаспороцитом, относя обе к спорогенным клеткам или материнским клеткам мегаспор (megaspore mother cells, MMC) (Sehgal et al., 2011; Armenta-Medina et al., 2011; Bencivenga et al., 2011; Fan et al., 2015 и др.).
В последние годы термины “зародышевая линия” (“germline”) и “зародышевая клетка” (“germ cell”), широко используемые в биологии развития животных, стали применяться и для описания репродуктивных клеток растений (Dickinson, Grant-Downton, 2009; Berger, Twell, 2011; Bai, 2017; Pinto et al., 2019; Hernandez-Lagana et al., 2021 и др.). Унификация концепций о “зародышевой линии” у животных и растений, по мнению некоторых авторов, позволяет провести сравнительный анализ механизмов, лежащих в основе дифференциации репродуктивных клеток этих организмов (Dickinson, Grant-Downton, 2009; Pinto et al., 2019 и др.). Авторы, рассматривающие этот вопрос, отмечают, что в отличие от животных, у которых “зародышевые клетки” (“germ cells”) определяются в раннем эмбриогенезе как особая популяция клеток, сохраняющихся всю жизнь и способных продуцировать гаметы (Hayash, Surani, 2009), у цветковых растений таких очевидных “зародышевых клеток” (“germ cells”) нет. Однако в спорофитной фазе растений всегда сохраняется пул недифференцированных клеток, которые могут дифференцироваться по пути образования клеток репродуктивных органов, содержащих диплоидные спорогенные клетки – инициали гаметофитов, образующих гаметы (Berger, Twell, 2011; Grossniklaus, 2011; Twell, 2011; Schmidt et al., 2015 и др.). Вместе с этим снова появляются терминологические вопросы – на каком этапе появляется “зародышевая линия” (“germline”) и какие клетки могут считаться “зародышевыми клетками” (“germ cells”)? Одни авторы придерживаются точных категорий, что “зародышевая линия” (“germline”) возникает при инициации гаметофита, а клетки, дающие начало гаметофиту – “прародители гамет” (“gamete progenitors”), собственно гаметы (яйцеклетка и спермии) являются истинными “зародышевыми клетками” (“germ cells”) (Berger, Twell, 2011; Twell, 2011). Другие авторы рассматривают “зародышевую линию” (“germline”) более широко, распространяя ее и на спорофитную фазу, предшествующую развитию гаметофита, – заложение археспориальной клетки, дифференциацию мегаспороцита и вступление его в мейоз с образованием гаплоидных спор (Dickinson, Grant-Downton, 2009; Grossniklaus, 2011; Schmidt et al., 2015; Pinto et al., 2019). Pinto et al. (2019) предлагают рассматривать развитие женского гаметофита (споро- и гаметогенез) как определенные этапы “развития женской зародышевой линии” (“female germline development”), где археспориальная клетка приравнена к “germline precursor cell selection”, мегаспороцит – к “primary germline cell”, а собственно женский гаметофит – к “germline maturity with female germ cell”.
Возможно, введение и применение новых терминов актуально для сравнения развития репродуктивных клеток у растений и животных, но следует учитывать, что у растений гораздо больше вариантов, приводящих к образованию гамет (яйцеклеток и спермиев), в том числе и без прохождения мейоза (Koltunow, 1993; Savidan, 2000; Koltunow, Grossniklaus, 2003; Schmidt et al., 2015; Brukhin, 2017 и др.). Вследствие этого, полагаю, что для характеристики развития репродуктивных структур растений лучше использовать более привычные термины, в которых также необходимо внести ясность.
Считаю, что термины “археспориальная клетка” (“археспорий”) и “мегаспороцит” не эквивалентны, это две разные стадии – инициации и развития спорогенной клетки, которые взаимосвязаны и переходят одна в другую. Такой переход хорошо виден на примере одноклеточного археспория некоторых видов (рис. 1, 1–6). На самой ранней стадии развития примордия семязачатка Agapanthus praecox Willd. все его клетки одинаковые и являются меристематичными (рис. 1, 1), по мере роста примордия, в нем начинает дифференцироваться клетка, которая пойдет по пути спорогенной клетки – археспориальная клетка, вместе с образованием париетальных клеток (рис. 1, 2). Рост археспориальной клетки приводит к ее трансформации в мегаспороцит – клетку, готовую к мейозу (рис. 1, 3). Археспориальная клетка может дифференцироваться и в субэпидермальном слое, как у Allium ramosum L. (рис. 1, 4) и далее преобразовываться в мегаспороцит (рис. 1, 5). Иногда у таких видов может дифференцироваться 2 археспориальные клетки и формироваться два мегаспороцита (рис. 1, 6). Аналогичная ситуация наблюдается и в случае многоклеточного археспория. Например, в примордии семязачатка пиона все клетки одинаковы, хотя уже на таких ранних стадиях видны периклинальные деления субэпидермального слоя и образование париетального слоя (рис. 1, 7). С началом инициации интегументов под париетальным слоем начинает выделяться несколько клеток более крупного размера с утолщенной клеточной стенкой, крупными ядрами, расположенными в центре клетки, и слабо вакуолизированной цитоплазмой – археспориальные клетки, которые в дальнейшем продолжают свой рост и дифференцируются в мегаспороциты (рис. 1, 8–9). Множественные археспориальные клетки могут повторно делиться с формированием комплекса археспориальных клеток, как например, у молочаев (рис. 1, 10), но не все из них могут трансформироваться в мегаспороциты. Часть этих клеток, особенно локализованных на периферии клеточного комплекса, остаются покоящимися, окружая дифференцирующиеся мегаспороциты (рис. 1, 11, 12). В таком многоклеточном спорогенном комплексе обычно не все мегаспороциты вступают в мейоз, мегаспорогенез происходит в единственном мегаспороците (Maheshwari, 1950). Археспориальные клетки, не закончившие свою трансформацию в мегаспороциты, предположительно, могут сохранять свои спорогенные свойства, которые могут реализоваться, например, в апомиктичном способе репродукции (апоспории или нуцеллярной эмбрионии) (Kordyum, 1978).
Рис. 1.
Развитие и строение одноклеточного (1–6) и многоклеточного (7–12) археспория на примере Agapanthus praecox (1–3), Allium ramosum (4–6), Paeonia veitchii (7, 8), Paeonia caucasica (9), Euphorbia segueriana (10), Euphorbia condylocarpa (11), Euphorbia petrophila (12). a – археспориальная клетка, i i – внутренний интегумент, m – мегаспороцит, o i – наружный интегумент, p – париетальные клетки. Шкала: 20 мкм.
Fig. 1. Development and structure of the unicellular (1–6) and multicellular (7–12) archesporium, using the examples of Agapanthus praecox (1–3), Allium ramosum (4–6), Paeonia veitchii (7, 8), Paeonia caucasica (9), Euphorbia segueriana (10), Euphorbia condylocarpa (11), and Euphorbia petrophila (12). a – archesporial cell, i i – inner integument, m – megasporocyte, o i – outer integument, p – parietal cells. Scale bar: 20 μm.
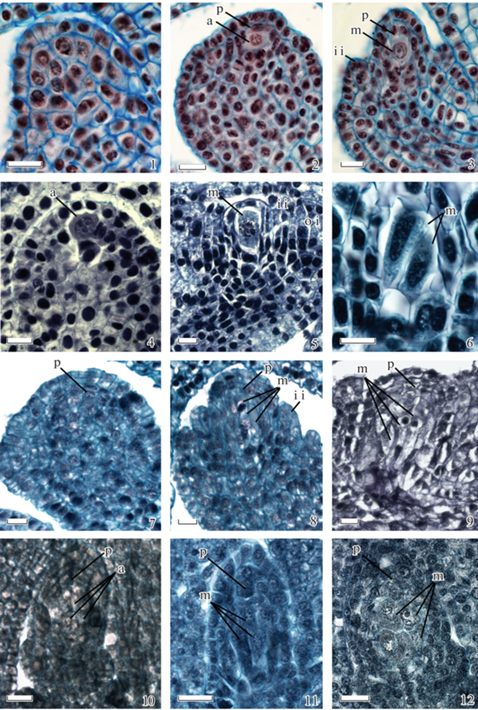
Дифференциация археспориальных клеток не зависит от их местоположения в семязачатке – в субэпидермальном слое или в более глубоких слоях под париетальной тканью, что согласуется с взглядами А.Н. Сладкова и Н.А. Гревцовой (Sladkov, Grevtsova, 1988, 1989). Точка зрения некоторых авторов об облигатном субэпидермальном положении археспориальной клетки и ее возможного деления на спорогенную и париетальную (которая является соматической) клетки (Nikiticheva, Shamrov, 2002) кажется сомнительной. С этим можно согласиться, если рассматривать археспориальную клетку как меристематическую, которая не обладает какой-либо детерминированной судьбой. Тогда эта клетка может делиться на две клетки с различной судьбой – спорогенную и соматическую. Но почему следует использовать термин “археспорий”, если существует термин “меристематическая клетка”? Если рассматривать археспориальную клетку как предшественника мегаспороцита, который уже имеет некоторые признаки или потенции для развития в гаметофит, то эта клетка должна делиться на подобные себе клетки, а не на клетки с другой судьбой – соматические париетальные клетки. Поэтому, археспориальная клетка – это начало дифференциации меристематической клетки в мегаспороцит, клетка, которая уже обладает спорогенными потенциями. Реализация потенций, по-видимому, зависит от каких-то сигнальных факторов, получаемых клеткой извне или продуцируемых ею самой.
Следует также подчеркнуть, что терминологические трудности связаны с отсутствием четких морфологических критериев для археспориальной клетки, как это имеет место для других клеток – мегаспороцитов, мегаспор, клеток зародышевого мешка (Maheshwari, 1950; Bajon et al., 1999). К сожалению, существует немного данных о морфологии археспория. Как правило, археспориальные клетки локализованы в центральной или апикальной части семязачатков и отличаются от соседних клеток более крупными размерами. У Phaius tankervilliae (Banks ex L’Hér.) Blume цитоплазма археспориальной клетки содержит много митохондрий, пластид, цистерн эндоплазматического ретикулума, полисом и Гольджи-телец, много микротрубочек и маленьких вакуолей; в ее клеточной стенке присутствуют плазмодесмы (Tung et al., 2000). На самых ранних стадиях развития семязачатков Annona cherimola Mill. и Persea americana Mill. все их клетки неотличимы друг от друга; позднее, археспориальная клетка начинает дифференцироваться под париетальными слоями клеток. От окружающих клеток она отличается составом своей клеточной стенки, в которой аккумулируются некоторые пектины, арабиногалактаны и экстензины, определенные методами иммунолокализации (Lora et al., 2017). Кроме того, показано, что с началом дифференциации археспориальной клетки у Arabidopsis thaliana (L.) Heynh. у нее появляются специфичные черты, отличающие ее от других клеток примордия, в частности присутствие в ее ядре связанного с хроматином гистона H3.1 (HISTONE THREE RELATED 13 – HTR 13) (Hernandez-Lagana, Autran, 2020).
На основании выше изложенного, можно заключить, что все клетки примордия семязачатка на самых ранних стадиях развития однотипны и меристематичны. Позднее, одна клетка (или несколько клеток), расположенная в субэпидермальном слое у одних видов или в более глубоких слоях у других видов, начинает дифференцироваться, приобретая специфические черты (например, по ультраструктуре или составу клеточной стенки), характеризующие ее как археспориальную клетку(-и) – предшественника мегаспороцита(-ов).
МЕХАНИЗМЫ ИНИЦИАЦИИ АРХЕСПОРИЯ И РАЗВИТИЯ СПОРОГЕННЫХ КЛЕТОК
Молекулярные и генетические исследования показали сходство клеток примордия семязачатка с клетками апикальной меристемы побега (Clark, 2001; Gross-Hardtl, Laux, 2003; Sieber et al., 2004). У Arabidopsis thaliana переход клеток примордия семязачатка к дифференциации, как и в апексе побега, обусловлен действием гена WUSHEL (WUS); в это же время начинается дифференциация археспориальной клетки (Gross-Hardtl et al., 2002; Wyrzykowska, Fleming, 2003). Дифференциация археспориальной клетки во многом обусловлена экспрессией гена SPOROCYTELESS/NOZZLE (SPL/NZZ); у мутанта spl/nzz спорогенная клетка не формируется (Balasubramanian, Schneitz, 2000), а дополнительная эктопическая экспрессия SPL/NZZ, наоборот, приводит к появлению дополнительных клеток, похожих на мегаспороцит (Mendes et al., 2020). Гены WUS и SPL/NZZ также связаны с генами WINDHOSE1 (WIH1) и WIH2, кодирующими малые пептиды. Двойные мутанты wih1wih2 характеризуются различными нарушениями, связанными с инициацией археспориальной клетки, ее дифференциацией в мегаспороцит и вступлением последнего в мейоз (Lieber et al., 2011).
Функциональная классификация генов, которые экспрессируются в семязачатке на стадии мегаспороцита у риса и ананаса, показала их скоррелированность с путями транспорта гормональных сигналов и биосинтеза вторичных метаболитов. Это предполагает, что фитогормоны и активный биосинтез веществ являются критическими для спецификации мегаспороцита у растений (Zhao et al., 2021). Огромную роль в дифференциации клеток семязачатка играют гормоны – ауксин и цитокинин (Bencivenga et al., 2011). Уровень ауксина в клетках регулируется преимущественно активностью белков переносчиков PIN-FORMED (PIN) (Petrasek et al., 2006). В семязачатке Arabidopsis thaliana PIN1 обнаружен на самых ранних стадиях развития; его локализация указывает на движение потока ауксина по эпидермальным клеткам от фуникулуса к апикальному концу нуцеллуса, где аккумулируется максимальный уровень (Pagnussat et al., 2009). В крассинуцеллятных семязачатках Annona cherimola и Persea americana PIN экспрессируется как в эпидермальном слое, так и в париетальных слоях, расположенных выше археспориальной клетки. Высказано предположение, что ауксин может участвовать в дифференциации археспориальной клетки (Lora et al., 2017).
Поскольку PIN1 связан с геном SPOROCYTLESS/NOZZLE (SPL/NZZ) (Balasubramanian, Schneitz, 2000; Bencivenga et al., 2012), вероятно, спорофитный поток ауксина может контролировать дифференциацию археспориальной клетки и мегаспороцита, а также ранние стадии развития женского гаметофита (Pagnussat et al., 2009; Ceccato et al., 2013). Нарушения сигналинга цитокинина в спорофитных тканях семязачатка приводят к снижению регуляции PIN1 и отсутствию формирования спорогенной клетки и гаметофита (Bencivenga et al., 2012).
Значимым фактором для инициации археспориальной клетки (или клеток) является процесс иинциации интегументов в примордии семязачатка (Kordyum, 1978). Это подтверждают и молекулярно-генетические исследования. Так, нарушения в экспрессии генов AINTEGUMENTA (ANT), BELL 1 (BEL1), INNER NO OUTER (INO), ответственных за инициацию интегументов у Arabidopsis thaliana, оказывают влияние на дифференциацию спорогенной клетки. Мутации ant, bel1 и ino характеризуются как нарушениями в формировании интегументов, так и отсутствием спорогенной клетки или раннего гаметофита (Gross-Hardt et al., 2002; Sieber et al., 2004; Bencivenga et al., 2011).
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ПЕРЕХОД К МНОЖЕСТВЕННОМУ АРХЕСПОРИЮ
Поскольку события заложения одной или нескольких археспориальных клеток происходят на самых ранних стадиях развития семязачатка, несомненно, что их инициация взаимосвязана, т.е. факторы, обусловливающие развитие собственно спорогенной клетки связаны и с регуляцией числа этих клеток. К таким факторам можно отнести следующие:
1) мутации по генам, регулирующим дифференциацию спорогенных клеток;
2) нарушения в эпигенетической регуляции;
3) нарушения в пространственно-временной координации процессов развития семязачатка и позиционной информации (рис. 2).
Рис. 2.
Возможные факторы, определяющие дифференциацию дополнительных спорогенных клеток и переход к множественному археспорию.
Fig. 2. Possible factors determining the differentiation of additional sporogenous cells and the transition to the multiple archesporium.

Рассмотрим подробнее каждый пункт.
1) Генетические исследования последних десятилетий показывают, что в примордии семязачатка несколько клеток могут обладать потенциями спорогенных клеток. Так, ген MULTIPLE ARCHESPORIAL CELL 1 (MAC1) у кукурузы (Zea mays L.) участвует в регуляции судьбы спорогенной клетки семязачатка. У мутантов mac1 развивается несколько таких клеток, способных вступать в мейоз и формировать тетрады мегаспор (Sheridan et al., 1996; Wang et al., 2012). У риса (Oryza sativa L.) ген MULTIPLE SPOROCYTE 1 (MSP1), кодируя рецепторо-подобную киназу, активирует сигнальный путь в группе нуцеллярных клеток вблизи мегаспороцита, который ингибирует их дифференциацию; при мутации msp1 действие гена блокируется и в нуцеллусе возникает несколько спорогенных клеток (Nonomura et al., 2003). Также у риса обнаружен ген OsTDL1A, который экспрессируется в семязачатке вместе с MSP1, при его взаимодействии с интерференционной РНК копирует фенотип msp1 с образованием множественных спорогенных клеток (Zhao et al., 2008). Хотя семязачатки msp1 и OsTDL1A‑RNAi содержат множественный археспорий и развивают несколько мегаспороцитов, формируется только один зародышевый мешок (Nonomura et al., 2003; Zhao et al., 2008).
2) В процессах дифференциации спорогенной клетки в семязачатке важную роль играет эпигенетическая регуляция, включающая действие малых РНК, ДНК-метилирование и динамическое распределение гистонов, играющих роль в конденсации хроматина (Nonomura, 2018; Jiang, Zheng, 2022). У Arabidopsis thaliana ген ARGONAUTE 9 (AGO9), экспрессируемый в клетках субэпидермального слоя семязачатка, отвечает за синтез протеина AGO9. У мутанта ago9 в семязачатке появляются крупные клетки, похожие на мегаспороциты (Olmedo-Monfil et al., 2010). Показано, что AGO9, вместе с другими представителями семейства AGO – AGO4, AGO6 и AGO8, играют важную роль в биосинтезе малых РНК (малых интерференционных РНК – siRNA и транс-действующих малых интерференционных РНК – ta-siRNA) у Arabidopsis, что подтверждает участие малых РНК в становлении судьбы спорогенной клетки. Известно, что, ta-siRNA передвигаются как сигнальные молекулы и вызывают выключение генов до их инициации в клетке (Olmedo-Monfil et al., 2010). Биогенез этих РНК также зависит от транскрипции RNA-DEPENDENT POLYMERASE 6 (RDR6), которая конвертирует одноцепочечные РНК-предшественники в двуцепочечные РНК, а также с SUPRESSOR OF GENE SILENCING 3 (SGS3) и NUCLEAR RNA POLYMERASE D1A (NRPD1A) и NRPD1B; мутации rdr6 и sgs3 показывают аналогичные ago9 нарушения, приводя к образованию дополнительных мегаспороцито-подобных клеток (Olmedo-Monfil et al., 2010; Hernandez-Lagana et al., 2016). Также транс-действующие малые интерференционные РНК (ta-siRNA) могут ингибировать образование спорогенных клеток при ограничении экспрессии AUXIN RESPONSIVE FACTOR 3 (ARF3) в нуцеллусе (Su et al., 2017; 2020).
Поскольку малые интерференционные РНК выполняют важную роль в процессе ДНК-метилирования, участвуя в сборке ДНК-метилтрансфераз, регулирующих формирование гетерохроматина (Matzke, Mosher, 2014), различные нарушения в процессе их биогенеза могут приводить к выделению дополнительных мегаспороцитов, что подтверждает необходимость RdDM-пути (RNA-directed DNA methylation) в спецификации и дифференциации мегаспороцита (Mendes et al., 2020).
Дополнительные мегаспороциты также появляются у мутантов по генам, контролирующим клеточный цикл. У Arabidopsis thaliana установлено, что ингибирование циклин-зависимой киназы CDKA;1 протеинами семейства KIP-RELATED PROTEIN (KRP), RETINOBLASTOMA RELATED 1 (RBR1), РНК-геликазой MNEME (MEM) приводят к переключению клетки с митотического пути развития на мейотический (Zhao et al., 2017; Lora et al., 2019; Cao et al., 2018). Мутанты по соответствующим генам показывают нарушения в спецификации мегаспороцита, как без его образования, так и с увеличением числа мегаспороцитов (Su et al., 2017; Zhao et al., 2017; Yao et al., 2018). Мутанты krp4 krp6 kpr7 и rbr1 показывают множественные спорогенные клетки (Zhao et al., 2017). У мутанта rbr1 и тройного мутанта krp обозначенные мегаспороциты подвергаются нескольким митотическим делениям, что приводит к образованию дополнительных мегаспороцитов. Таким образом, уже специализированные мегаспороциты могут подвергаться одному или нескольким митотическим делениям вместо мейотического деления (Zhao et al., 2017).
3) Некоторые исследователи предполагают, что судьба клетки в целом детерминирована позиционной информацией (Poethig, 1989; Dawe, Freeling, 1992; Huala, Sussex, 1993). Позиционно-зависимые коммуникационные процессы, вероятно, происходят между соседними меристематическими клетками, и эти сигнальные события влияют на пути клеточной спецификации, включая становление судьбы спорогенной клетки (Hake, Char, 1997; Clark, 2001).
На основе молекулярно-генетических данных и методов моделирования процессов, происходящих в семязачатке на ранних стадиях, предложена гипотеза о том, что геометрические ограничения во время морфогенеза семязачатка влияют на количество спорогенных клеток и их дифференциацию. Изменение морфологии семязачатка приводит к эктопическим кандидатам спорогенных клеток. Предложенные модели с различным типом роста клеток семязачатка (анизотропным и изотропным) показали, что при анизотропном росте в семязачатке Arabidopsis thaliana может дифференцироваться только одна археспориальная клетка; при изотропном росте формируются более широкие и уплощенные примордии, в которых инициируется несколько археспориальных клеток (Hernandez-Lagana et al., 2021). Отмеченные геометрические закономерности обнаружены у мутанта Arabidopsis kat, у которого мутация приводит к отсутствию протеина KATANIN, связанного с параллельным выстраиванием кортикальных микротрубочек, что снижает целлюлозо-зависимую механическую анизотропию в клеточных стенках и усиливает изотропный рост клеток (Bichet et al., 2001; Burk, Ye, 2001). У этого мутанта формируются уплощенные примордии семязачатков с дополнительными крупными клетками, подобными археспориальной клетке. Идентификация этих клеток с помощью маркеров, указывающих на переход от соматической к репродуктивной клетке: гистона H3.1 (She et al., 2013) и транскрипционного фактора KNUCKLES (KNU) (Tucker et al., 2012), в ряде случаев указывала их принадлежность к спорогенным клеткам, однако окраска анилиновым синим не выявила в их клеточной стенке каллозы, которая присутствовала у основного мегаспороцита (Hernandez-Lagana et al., 2021).
РОЛЬ КАЛЛОЗЫ В СПЕЦИФИКАЦИИ И ФУНКЦИОНИРОВАНИИ МЕГАСПОРОЦИТОВ В СПОРОГЕННОМ КОМПЛЕКСЕ
Первичная клеточная стенка клеток высших растений включает структурные целлюлозные микрофибриллы, погруженные в матрикс из не-целлюлозных полисахаридов, включающих ксилоглюкан, гетероксилан, маннан, (1,3;1,4)-β-D-глюкан и пектин (в зависимости от типа клетки), а также протеины, встроенные в клеточную стенку, фенольные компоненты и воду (Burton et al., 2010). Неоднородность состава матрикса обеспечивает механическую прочность и пластичность клеточной стенки, а также определенную пористость данной структуры, позволяющую транспортировать малые молекулы через апопласт (Carpita et al., 1979; Burton et al., 2010). Клеточная стенка молодого семязачатка может пропускать воду, гормоны, сахара, олигосахариды, малые РНК, пептиды и некоторые протеины (Bloemendal, Kuck, 2013; Van Norman et al., 2011). Крупные макромолекулы, включая протеины и РНК, перемещаются между клетками через плазмодесмы, которые обеспечивают цитоплазматический (симпластический) транспорт (Kim et al., 2007; Lucas et al., 2009). Размер плазмодесм может существенно варьировать благодаря отложению каллозы на их стенках, ограничивая транспорт веществ (Lee, Lu, 2011).
В развитии спорогенных клеток и мегаспорогенезе каллоза (1,3-β-D-глюкан) играет значимую роль. В ходе подготовки мегаспороцита к выполнению его основной функции – меойза, на плазматической мембране начинается синтез каллозы, формирующей дополнительный слой в клеточной стенке, который существенно ограничивает транспорт веществ и изолирует мегаспороцит для мейоза и образования спор (Rodkiewicz, 1970; Rodkiewicz, Bednara, 1976; Webb, Gunning, 1990; Newbigin et al., 2009). Отложение каллозы на стенках мегаспороцита характерно для большинства растений с моноспорическим Polygonum-типом развития зародышевого мешка (Rodkiewicz, 1970). Кроме того, по мнению некоторых исследователей, многие сигнальные компоненты для инициации мегаспороцита к мейозу экспрессируются в соматических нуцеллярных клетках, окружающих спорогенные клетки, причем каллоза является маркером для узнавания этих сигналов (Bencivenga et al., 2011; Tucker, Koltunow, 2014). Это доказывает, что межклеточные взаимодействия являются значимыми для корректной спецификации спорогенной судьбы клетки во время развития семязачатка и обеспечивают дальнейшую функцию этой клетки (Tucker, Koltunow, 2014).
Однако слой каллозы, формирующийся вокруг мегаспороцита, не приводит к полной блокировке транспорта. У многих растений показано, что этот слой часто тоньше на халазальном конце мегаспороцита, также он может быть прерывистым (Rodkiewicz, 1970). Ультраструктура мегаспороцита и мегаспор Arabidopsis thaliana показывает сохранение плазмодесм, связывающих репродуктивную клетку с соматическими, во время мегаспорогенеза (Bajon et al., 1999). Исследования сигнальных путей предполагают активные симпластические взаимодействия между соматическими и репродуктивными клетками посредством транспорта малых РНК, синтезируемых в нуцеллярных клетках и перемещаемых в спорогенную клетку для регуляции ее развития (Olmedo-Monfil et al., 2010; Lieber et al., 2011; Tucker et al., 2012; Cheng et al., 2013).
У растений с множественным археспорием, таких как Paeonia L., Fragaria L., где формируется многоклеточный спорогенный комплекс, каллоза синтезируется только одной (реже двумя) клетками, расположенными в центральной части спорогенного комплекса (Leszczuk et al., 2018; Vinogradova, Zhinkina, 2021).
Анализируя тот факт, что у земляники только один мегаспороцит среди многих имеет каллозу, авторы предполагают, что это связано с возможностью апомиктичного развития мегаспороцитов, у которых нет каллозных стенок (Leszczuk et al., 2018).
Мы предполагаем, что отложение каллозы лишь у одного мегаспороцита может свидетельствовать об ее участии в регуляции судьбы других клеток спорогенного комплекса (Vinogradova, Zhinkina, 2021), что согласуется с ранее высказанной гипотезой о “латеральном ингибировании” дифференциации клеток в семязачатке (Chevalier et al., 2011). Согласно этой гипотезе, основанной на анализе данных о клеточных взаимодействиях в примордии семязачатка, многие клетки семязачатка обладают потенциями к дифференциации в археспориальные клетки, однако преимущество в дифференциации получает лишь одна, имеющая более выгодное положение и первой получающая сигналы к дифференциации. Эта клетка может запретить дальнейший сигналинг к соседним клеткам, блокируя их спорогенную дифференциацию (Chevalier et al., 2011). Дополняя эту гипотезу, мы предположили, что в многоклеточном спорогенном комплексе клетка, расположенная в центральной части семязачатка имеет преимущества перед соседними клетками в получении сигналов, стимулирующих ее к началу мегаспорогенеза. Каллозная оболочка не пропускает такие сигналы через себя к другим клеткам спорогенного комплекса. Более того, мегаспороцит с каллозными стенками, возможно, сам испускает сигналы для ингибирования дальнейшей дифференциации соседних клеток. В результате только одна (реже две) тетрады мегаспор развиваются и одна функциональная мегаспора дает начало женскому гаметофиту в семязачатке. Все другие мегаспороциты дегенерируют во время развития семязачатка (Vinogradova, Zhinkina, 2021).
ЭВОЛЮЦИЯ АРХЕСПОРИЯ
Как отмечено выше, у покрытосеменных существует два типа археспория – одноклеточный и многоклеточный (множественный). Большинство исследователей, рассматривая вопрос об эволюции этого эмбриологического признака, полагают, что многоклеточный археспорий является примитивным признаком, а одноклеточный – более прогрессивным (Schnarf, 1927–1929, 1931; Maheshwari, 1950; Davis, 1966; Poddubnaya-Arnoldi, 1976; Kordyum, 1978; Shamrov, 2008; Kamelina, 2000, 2009 и др.). K. Schnarf (1927–1929), предлагая свою классификацию типов археспория, считал, что из всех шести типов наиболее примитивным является Casuarina-тип, характерный для видов Casuarina L. Семязачатки этих растений содержат большое количество археспориальных клеток, которые располагаются длинными рядами. Одноклеточный архе-спорий рассматривался как производный от многоклеточного через его редукцию. По мнению некоторых исследователей, эта редукция могла идти по двум направлениям: 1) уменьшение числа археспориальных клеток, дифференцирующихся в субэпидермальном слое семязачатка; и 2) уменьшение числа делений в субэпидермальном слое семязачатка, приводящее к отсутствию париетальной ткани и прямого перехода археспориальной клетки в мегаспороцит. В том случае, когда оба направления в редукции женского археспория совпадают во времени, формируется наиболее прогрессивный тип (одноклеточный, без отделения париетальных клеток), завершающий эволюцию женского археспория покрытосеменных (Poddubnaya-Arnoldi, 1976; Kordyum, 1978).
Kordyum (1978) считает, что эволюция мегаспорангия покрытосеменных шла в направлении редукции как вегетативной, так и спорогенной его части, причем оба направления редукции могли не совпадать во времени. Большую роль в эволюции мегаспорангия играли, по мнению автора, процессы стерилизации. В ходе эволюции мегаспорангия увеличивалась и синхронизация развития материнских клеток мегаспор и интегумента или интегументов, в результате чего интегументы стали играть большую роль в защите редуцированного мегаспорангия на ранних стадиях развития материнских клеток мегаспор.
Однако, возможно, процессы стерилизации могли и не выполнять эволюционной роли. Например, M. Treub (1891), детально исследовавший развитие многоклеточного спорогенного комплекса, включающего до 30 клеток, у видов Ca-suarina, полагал, что уже при его формировании происходит стерилизация части мегаспороцитов, в результате чего не все из них становятся функциональными и могут формировать зародышевые мешки. Кроме того, хотя у этих растений и образуется нескольких гаметофитов в семязачатке, пыльцевая трубка входит лишь в один, где и происходит оплодотворение. Вместе с этим, Treub (1891) подчеркивал, что, несмотря на наличие многочисленных спорогенных клеток и халазогамии, виды Casuarina не могут быть рассмотрены, как промежуточная группа между голосеменными и покрытосеменными. Исходя из этого, можно предположить, что автор не рассматривал множественный археспорий, как примитивный признак.
Подавляющее число видов покрытосеменных характеризуется одноклеточным типом женского археспория. В ряде семейств, где описаны два типа археспория – одноклеточный и многоклеточный, обычно превалирует первый. Например, среди обширного семейства сложноцветных известно лишь более десятка родов с многоклеточным археспорием. Из 100 видов зонтичных, исследованных в этом отношении, только у 33 описан многоклеточный археспорий (Kordyum, 1978). Некоторые исследователи предполагали, что такое широкое распространение одноклеточного археспория среди покрытосеменных скорее всего связано с большей экономичностью и скоростью его развития, лучшей обеспеченностью питательными веществами уже на ранних стадиях развития материнской клетки мегаспор, а впоследствии и зародышевого мешка, что, несомненно, является критерием эволюционной продвинутости этого типа археспория (Gerassimova-Navashina, 1958).
Согласно данным “Сравнительной эмбриологии” (Comparative…, 1981–1990), скорректированным с филогенетической системой APG IV (2016), множественный археспорий характерен для представителей семейств Aizoaceae, Altingiaceae, Amaranthaceae, Anacardiaceae, Apiaceae, Asteraceae, Betulaceae, Brassicaceae, Buxaceae, Calycanthaceae, Capparaceae, Caryophyllaceae, Casuarinaceae, Cistaceae, Crossosomataceae, Euphorbiaceae, Fabaceae, Fagaceae, Goodeniaceae, Grossulariaceae, Hypericaceae, Icacinaceae, Irvingiaceae, Juglandaceae, Lardizabalaceae, Lauraceae, Loranthaceae, Lythraceae, Malvaceae, Malpighiaceae, Meliaceae, Metteniusaceae, Muntingiaceae, Myricaceae, Nothofagaceae, Onagraceae, Paeoniaceae, Papaveraceae, Phyllanthaceae, Phytolaccaceae, Proteaceae, Putranjivaceae, Quillajaceae, Rafflesiaceae, Ranunculaceae, Rhamnaceae, Rosaceae, Rubiaceae, Rutaceae, Salicaceae, Santalaceae, Sapindaceae, Scrophulariaceae, Simaroubaceae, Simmondsiaceae, Siparunaceae, Stemonuraceae.
У большинства представителей этих семейств множественный археспорий формируется внутри крассинуцеллятных семязачатков с массивной париетальной тканью. Также этот тип археспория отмечен и у видов с тенуинуцеллятными и медионуцеллятными (согласно классификации И.И. Шамрова (Shamrov, 2008)) семязачатками, которые характерны для Asteraceae, Apiaceae, Brassicaceae, Goodeniaceae, Loranthaceae, Rafflesiaceae, Rubiaceae, Santalaceae, Scrophulariaceae. У некоторых видов из последних семейств археспориальные клетки часто способны к повторным делениям с образованием спорогенного комплекса. Однако, как правило, в семязачатках с множественным археспорием обычно развивается только один гаметофит, несмотря на большое число спорогенных клеток. Одна клетка, расположенная в центральной части, дает начало мегаспороциту, который подвергается мейозу и формирует зародышевый мешок; все другие спорогенные клетки дегенерируют (Naumova, 1987; Shamrov, 1997; Vinogradova, 2017; Vinogradova, Zhinkina, 2021). В связи с этим, полиэмбриония, связанная с формированием зародышей из двух зародышевых мешков – достаточно редкий случай (Kordyum, 1978).
Анализ распределения типов археспория (одно- и многоклеточного) среди порядков покрытосеменных, согласно современной филогенетической системе APG IV (2016), показал, что одноклеточный археспорий характерен для порядков базальных двудольных Amborellales, Nymphaeales, Austrobaileyales, Magnoliales, Piperales, Canellales, Chloranthales, а также для порядков однодольных, следующих за ними. Эти растения, как правило, имеют массивные крассинуцеллятные семязачатки с париетальной тканью. Только в семействах Calycanthaceae, Siparunaceae и Lauraceae из порядка Laurales обнаружены представители с множественным археспорием. Множественный археспорий встречается у представителей многих порядков настоящих двудольных (Eudicots), обычно наряду с одноклеточным. Можно отметить лишь несколько порядков, для которых характерен исключительно многоклеточный архе-спорий (Buxales, Fagales, Metteniusales и Icacinales) (рис. 3).
Рис. 3.
Распределение признака одноклеточного и многоклеточного археспория среди порядков покрытосеменных растений, согласно молекулярно-филогенетической системе APG IV (2016).
Fig. 3. Distribution of the unicellular and multicellular archesporia among angiosperm orders, according to APG IV phylogenetic system (2016).

На основании этих данных, а также литературных обзоров по эволюции семязачатков, предполагающих наличие массивных крассинуцеллятных семязачатков у предков покрытосеменных (Schnarf, 1927–1929; Maheshwari, 1950; Davis, 1966; Kordyum, 1978; Endress, 2011; Shamrov, 2008; Kamelina, 2009), можно предположить, что в таких семязачатках дифференцировалась лишь одна археспориальная клетка и развивался один мегаспороцит, формировалась одна тетрада мегаспор и один гаметофит, соответственно.
У голосеменных, являющихся близкой эволюционной ветвью к покрытосеменным, но более древней, как правило, формируется массивный семязачаток, в котором также формируется массивная париетальная ткань и дифференцируется единственная спорогенная клетка, погруженная глубоко в нуцеллус (Crepet, Delavoyas, 1972; Cecchi Fiordi et al., 1996; Williams, 2009 и др.). Лишь у некоторых голосеменных (некоторых видов Taxaceae – Dupler, 1917, Taxodiaceae – Konar, Oberoi, 1969; Gnetum L. – Vasil, 1959; Friedman, Carmichael, 1998) в нуцеллусе может дифференцироваться 2 или 3 мегаспороцита (т.е. формируется 2–3 археспориальные клетки), однако в мейоз вступает один (реже два).
Исходя из этих данных, можно сделать предположение, что одноклеточный археспорий был изначальным типом, а множественный археспорий – его производным, а не наоборот, как это считали ранее (Schnarf, 1927–1929, 1931; Maheshwari, 1950; Davis, 1966; Poddubnaya-Arnoldi, 1976; Kordyum, 1978; Shamrov, 2008; Kamelina, 2000, 2009; и др.).
У некоторых видов, которые обычно развивают одноклеточный археспорий, отмечены случаи спорадического образования двух или трех археспориальных клеток (Naumova, 1987; Vinogradova, 2009 и др.). Как правило, дополнительные археспориальные клетки не завершают свою дифференциацию в мегаспороциты и не вступают в мейоз, хотя в некоторых случаях возможно развитие двух мегаспороцитов (рис. 1, 6). Вероятно, некоторые эндогенные факторы могут стимулировать спорогенную судьбу в двух нуцеллярных клетках вместо одной. Например, такой эффект вызывает экзогенным ауксином в культуре in vitro у развивающихся семязачатков Allium tuberosum Rottler ex Spreng. (Vinogradova, 2016).
Эти данные, вместе с современными данными о генной регуляции и молекулярных механизмах, приводящих к появлению дополнительных мегаспороцитов (Sheridan et al., 1996; Nonomura et al., 2003; Olmedo-Monfild et al., 2010; и др.), позволяют предположить, что во время исторического развития изначально крассинуцеллятный семязачаток древних покрытосеменных, имеющий только одну археспориальную клетку, принимал способность дифференциации нескольких спорогенных клеток в примордии семязачатка, возможно, как результат влияния некоторых внешних или внутренних факторов. Множественный археспорий, возможно, стал следствием некоторой адаптации растительного организма во время эволюционного процесса.
БИОЛОГИЧЕСКАЯ РОЛЬ МНОЖЕСТВЕННОГО АРХЕСПОРИЯ
Относительно образования множественного археспория и дополнительных мегаспороцитов в семязачатке некоторых видов существует несколько довольно близких друг к другу точек зрения.
Изучая особенности репродукции Paeonia californica Nutt., J.L. Walters (1962) предположил, что для этого вида характерна высокая гетерозиготность, поддерживаемая образованием множества транслокаций в мейозе. Это приводит к различным нарушениям в репродуктивном процессе, в том числе к стерильности семязачатков. Развитие большого числа спорогенных клеток, по мнению автора, является адаптацией к данным изменениям, направленной на образование, по крайней мере, одного функционирующего гаметофита.
Также изучая размножение пионов, М.С Яковлев и М.Д. Иоффе (Yakovlev, Yoffe, 1965) объясняли существование у них множественного археспория и инициацию множественных зародышей как результат несбалансированности всей репродуктивной системы этих растений, вызванной сохранением примитивных признаков.
Существует мнение, что образование множественного археспория необходимо для функционирования системы надежности организма (Batygina, 2002; 2014). Т.Б. Батыгина считала, что в эволюции репродуктивной системы каждого таксона устанавливаются специальные “резервы” и “отказы”, являющиеся главными элементами системы надежности репродукции. “Работа” механизмов выбора среди множественных спорогенных клеток в семязачатке связана с “конкуренцией” и “отказами”, приводящими к появлению различных аномалий (аббераций, деструкций и др.) у большинства клеток (Batygina, 2002). Вместе с этим дополнительные спорогенные клетки могут быть “резервами” (дублирующими структурами) в системе надежности, так как они уже имеют определенные морфогенетические потенции и могут выполнять репродуктивные функции, когда основная репродуктивная клетка (например, мегаспороцит или молодой гаметофит) дегенерируют (Batygina, 2014).
Некоторые исследователи предполагали, что развитие множественного археспория – один из вариантов перехода к апомиктичному пути развития, благодаря формированию инициалей из дополнительных мегаспороцитов, не вступающих в мейоз, но которые могут развиваться в зародышевые мешки без мейоза. Такие случаи отмечены у msp1 мутантов риса (Nonomura et al., 2003; Zhao et al., 2008), гибридов земляники (Leszczuk et al., 2018) и пиона (Shamrov, 1997). Этот путь также может рассматриваться как резервный путь для сохранения репродукции.
Обобщая все эти точки зрения, можно сделать заключение, что множественный археспорий появился в эволюции видов, как адаптация для сохранения их репродукции при наличии (или появлении) некоторых барьеров для успешного развития спорогенной клетки или частой ее гибели. Возможно, это было вызвано нарушениями в мейозе, согласно мнению Walters (1962), или внешними или внутренними условиями, приводящими к гибели мегаспороцита. Дифференциация меристематических клеток в примордии семязачатка, как дополнительных археспориальных клеток, усиливает шансы для реализации репродуктивной программы. Множественный археспорий современных растений – это “репродуктивный резерв”, так как не все клетки в многоклеточном спорогенном комплексе полностью дифференцируются в мегаспороциты, некоторые из них, особенно расположенные на периферии комплекса, сохраняют состояние археспориальных клеток.
ЗАКЛЮЧЕНИЕ
Все выше изложенное можно обобщить в 4 положения:
1. Женский археспорий покрытосеменных представлен двумя типами: одноклеточным и многоклеточным (множественным). Множественный археспорий – это группа клеток, дифференцирующихся в примордии семязачатка и обладающих спорогенными потенциями (способностью к трансформации в мегаспороциты). Дифференциация множественного археспория, также как и одноклеточного, по-видимому, приурочена к инициации внутреннего интегумента и, возможно, регулируется экспрессией генов WUSHEL (WUS), NOZZLE (NZZ), WINDHOSE1 (WIH1) и WIH2, ответственных за дифференциацию клеток в примордии семязачатка, и AINTEGUMENTA (ANT), BEL1, INNER NO OUTER (INO), ответственных за инициацию интегументов. Скоррелированность процессов дифференциации археспория и инициации интегумента – более объективная характеристика археспория, чем его происхождение из субэпидермального слоя, как полагали ранее. Современные данные показали, что у некоторых растений археспориальная(-ые) клетка(-и) могут дифференцироваться под несколькими париетальными слоями, сформированными после повторных делений субэпидермальных клеток.
2. Множественный археспорий – эволюционно более прогрессивный признак, чем одноклеточный. Это подтверждают данные анализа распределения этого признака на молекулярно-филогенетическом древе (APG IV, 2016), показавшего, что порядки базальных двудольных и однодольных, расположенные в основании филогенетического древа, характеризуются одноклеточным археспорием (исключая Laurales). Множественный археспорий характерен, как правило, для более продвинутых порядков настоящих двудольных (Eudicots), но даже в этих порядках и их семействах множественный археспорий не доминирует и появляется у меньшего числа видов, чем одноклеточный. Спорадическое появление дополнительных археспориальных клеток (обычно не развивающихся дальше) у видов с одноклеточным археспорием может доказывать вторичный характер множественного археспория. Молекулярные данные показывают, что образование множественных спорогенных клеток – это результат блокировки экспрессии некоторых генов (MSP, OsTDL1A) или деятельности малых РНК. Возможно, в эволюционном развитии некоторые растения получили множественный археспорий как мутацию, которая стала полезной и зафиксировалась.
3. Несмотря на формирование многих мегаспороцитов при развитии множественного археспория, в зародышевый мешок, как правило, развивается только один. Сделано предположение, что вступление единственного мегаспороцита (редко двух) в мейоз и формирование одного гаметофита во многом обусловлено формированием каллозного слоя на клеточной стенке этого мегаспороцита (или двух). Вероятно, каллоза не только изолирует мегаспороцит, но создает блок для переноса сигнальных молекул к соседним мегаспороцитам, расположенным на периферии спорогенного комплекса, что запрещает их развитие.
4. Биологическая роль множественного архе-спория состоит, по-видимому, в создании и сохранении репродуктивного потенциала в семязачатке. Существование клеточной гетерогенности множественного археспория, состоящей из получающих развитие центрально расположенных клеток и задерживающихся периферических клеток, может обусловливать появление определенной “ниши” клеток в спорогенном комплексе, остающихся в покоящемся состоянии во время развития гаметофита из основного мегаспороцита. При его гибели, заложенные морфогенетические потенции периферических клеток могут включить программу их дальнейшего развития, как по половому пути (мейоз), так и по апомиктичному (апоспория или диплоспория).
Список литературы
APG IV. 2016. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. – Bot. J. Linn. Soc. 181 (1): 1–20.
Armenta-Medina A., Demesa-Arévalo E., Vielle-Calzada J.P. 2011. Epigenetic control of cell specification during female gametogenesis. – Sex. Plant Reprod. 24 (2): 137–147.
Bai S.N. 2017. Two types of germ cells, the sexual reproduction cycle, and the double-ring mode of plant developmental program. – Plant Signaling and Behavior. 12 (7): e1320632.
Bajon C., Horlow C., Motamayor J., Sauvanet A., Robert D. 1999. Megasporogenesis in Arabidopsis thaliana L.: an ultrastructural study. – Sex. Plant Reprod. 12 (2): 99–109.
Balasubramanian S., Schneitz K. 2000. NOZZLE regulates proximal-distal pattern formation, cell proliferation and early sporogenesis in Arabidopsis thaliana. – Development. 127 (19): 4227–4238.
Batygina T.В. 2002. Ovule and seed viewed from reliability of biological systems. – Embryology of flowering plants. Terminology and concepts. Vol. 1. Generative organs of flower. Enfield (NH, USA). 214–217.
[Batygina] Батыгина T.Б. 2014. Биология развития растений. Симфония жизни. СПб. 764 с.
Bencivenga S., Colombo L., Masiero S. 2011. Cross talk between the sporophyte and the megagametophyte during ovule development. – Sex. Plant Reprod. 24 (2): 113–121.
Bencivenga S., Simonini S., Benkova E., Colombo L. 2012. The transcription factors BEL1 and SPL are required for cytokinin and auxin signaling during ovule development in Arabidopsis. – Plant Cell. 24 (7): 2886–2897.
Berger F., Twell D. 2011. Germline specification and function in plants. – Annual Review of Plant Biology. 62: 461–484.
Berger X. 1953. Untersuchungen über Embryologie partiell apomiktischer Rubusbastarde. – Berichte der Schweizerischen Botanischen Gesellschaft. 63: 224–266.
Bichet A., Desnos T., Turner S., Grandjean O., Höfte H. 2001. BOTERO1 is required for normal orientation of cortical microtubules and anisotropic cell expansion in Arabidopsis. – Plant J. 25 (2): 137–148.
Bloemendal S., Kuck U. 2013. Cell-to-cell communication in plants, animals, and fungi: a comparative review. – Naturwissenschaften. 100 (1): 3–19.
Bouman F. 1984. The ovule. – Embryology of angiosperms. Berlin. P. 123–157.
Brukhin V. 2017. Molecular and genetic regulation of apomixis. – Russian Journal of Genetics. 53 (9): 1001–1024.
Burk D.H, Ye Z.H. 2002. Alteration of oriented deposition of cellulose microfibrils by mutation of a katanin-like microtubule-severing protein. – Plant Cell. 14 (9): 2145–2160.
Burton R.A., Gidley M.J., Fincher G.B. 2010. Heterogeneity in the chemistry, structure and function of plant cell walls. – Nature Chemical Biology. 6 (10): 724–732.
Cao L., Wang S., Venglat P., Zhao L., Cheng Y., Ye S., Qin Y., Datla R., Zhou Y., Wang H. 2018. Arabidopsis ICK/KRP cyclin-dependent kinase inhibitors function to ensure the formation of one megaspore mother cell and one functional megaspore per ovule. – Plos Genetics. 14 (3): e1007230.
Carpita N., Sabularse D., Montezionos D., Delmer D.P. 1979. Determination of the pore size of cell walls of living plant cells. – Science. 205 (4411): 1144–1147.
Ceccato L., Masiero S., Roy D.S., Bencivenga S., Roig-Villanova I., Ditengou F.A., Palme K., Simon R., Colombo L. 2013. Maternal control of PIN1 is required for female gametophyte development in Arabidopsis. – PLoS One. 8 (6): e66148.
Cecchi Fiordi A., Mariotti Lippi M., Marini S., Tani G. 1996. Ultrastructural features of megasporogenesis in Torreya nucifera (Taxaceae). – Plant Systematics and Evolution. 202 (1/2): 13–25.
Cheng C.Y., Mathews D.E., Schaller G.E., Kieber J.J. 2013. Cytokinin-dependent specification of the functional megaspore in the Arabidopsis female gametophyte. – Plant J. 73 (6): 929–940.
Chevalier É., Loubert-Hudon A., Zimmerman E.L., Matton D.P. 2011. Cell-cell communication and signaling pathways within the ovule: from its inception to fertilization. – New Phytologist. 192 (1): 13–28.
Clark S.E. 2001. Cell signalling at the shoot meristem. – Nature Reviews Molecular Cell Biology. 2 (4): 276–284.
[Comparative…] Сравнительная эмбриология цветковых растений. 1981, 1983, 1985, 1987, 1990. Л. Т. 1–5.
Crepet W.L., Delevoryas T. 1972. Investigations of North American cycadeoids: Early ovule ontogeny. – Am. J. Bot. 59 (2): 209–215.
Czapik R. 1961, 1962. Embryological studies in the genus Potentilla L. I. P. crantzii. – Acta Biologica Cracoviensia, series Botanica. 14: 97–119.
Dahlgren K.V.O. 1927. Die Morphologie des Nuzellus mit besonderer Berücksichtigung der deckzellosen Typen. – Jahrbücher für Wissenschaftliche Botanik. 67: 347–426.
Davis G.L. 1966. Systematic embryology of the angiosperms. New York, London, Sydney. 528 p.
Dawe R.K., Freeling M. 1992. The role of initial cells in maize anther morphogenesis. – Development. 116 (4): 1077–1085.
Dickinson H.G., Grant-Downton R. 2009. Bringing the generation gap: flowering plant gametophytes and animal germlines reveal unexpected similarities. – Biol. Rev. 84 (4): 589–615.
Dupler A.W. 1917. The gametophyte of Taxus canadensis Marsh. – Botanical Gazette. 64 (2): 115–136.
Endress P.K. 2011. Angiosperm ovules: diversity, development, evolution. – Ann. Bot. 107 (9): 1465–1489.
Fagerlind F. 1937. Embryologische, zytologische und bestäubungsexperimentelle Studien in der Familie Rubiaceae nebst Bemerkungen über einige Polyploi-ditätsprobleme. – Acta Horti Bergiani. 2: 196–470.
Fan X., Yuan D., Tang J., Tian X., Zhang L., Zou F., Tan X. 2015. Sporogenesis and gametogenesis in Chinese chinquapin (Castanea henryi (Skam) Rehder et Wilson) and their systematic implications. – Trees. 29 (6): 1713–1723.
FriedmanW.E., Carmichael J.S. 1998. Heterochrony and developmental innovation: evolution of female gametophyte ontogeny in Gnetum, a highly apomorphic seed plant. – Evolution. 52 (4): 1016–1030.
[Gerassimova-Navashina] Герасимова-Навашина Е.Н. 1958. О гаметофите и об основных чертах развития и функционирования воспроизводящих элементов у покрытосеменных растений. – Проблемы ботаники. 3: 125–167.
Goebel K. 1880. Beitrage zur vergleichenden Entwicklungsgeschichte der Sporangien. – Botanische Zeitung. 38: 545–553.
Goebel K. 1933. Organographie der Pflanzen, insbesondere der Archegoniaten und Samenpflanzen. Auf. 3. Teil. 2, 3. Jena. 642 s.
Gross-Hardt R., Laux T. 2003. Stem cell regulation in the shoot meristem. – Journal of Cell Science. 116 (9): 1659–1666.
Gross-Hardtl R., Lenhard M., Laux T. 2002. WUSCHEL signaling functions in interregional communication during Arabidopsis ovule development. – Genes and Development. 16 (9): 1129–1138.
Grossniklaus U. 2011. Plant germline development: a tale of cross-talk, signaling, and cellular interactions. – Sex. Plant Reprod. 24 (2): 91–95.
Hake S., Char B.R. 1997. Cell-cell interactions during plant development. – Genes and Development. 11: 1087–1097.
Hayashi K., Surani M.A. 2009. Resetting the epigenome beyond pluripotency in the germline. – Cell Stem Cell. 4 (6): 493–498.
Hernandez-Lagana E., Rodriguez-Leal D., Lua J., Vielle-Calzada J.P. 2016. A multigenic network of ARGONAUTE4 clade members controls early megaspore formation in Arabidopsis. – Genetics. 204 (3): 1045–1056.
Hernandez-Lagana E., Mosca G., Mendocilla-Sato E., Pires N., Frey A., Giraldo-Fonseca A., Michaud C., Grossniklaus U., Hamant O., Godin C., Boudaoud A., Grimanelli D., Autran D., Baroux C. 2021. Organ geometry channels reproductive cell fate in the Arabidopsis ovule primordium. – eLife. 10: e66031.
Hernandez-Lagana E., Autran D. 2020. H3.1 eviction marks female germline precursors in Arabidopsis.– Plants. 9 (10): 1322.
Hjelmqvist H. 1962. The embryo sac development of some Cotoneaster species. – Botaniska Notiser. 115: 209–236.
Huala E., Sussex I.M. 1993. Determination and cell interactions in reproductive meristems. – Plant Cell. 5 (10): 1157–1165.
Jiang T., Zheng B. 2022. Epigenetic regulation of megaspore mother cell formation. – Frontiers in Plant Science. 12: article 826871.
[Kamelina] Камелина О.П. 2000. Эмбриологические признаки в филогенетической ситематике цветковых растений. – Бот. журн. 85 (7): 22–33.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Т. 1. Двудольные. Барнаул. 501 с.
Khan R. 1942. A contribution to the embryology of Jussiaea repens L. – Journal of the Indian Botanical Society. 21: 267–282.
Kim I., Kobayashi K., Cho E., Zambryski P.C. 2007. Regulation of plant intercellular communication via plasmodesmata. – Genetic Engineering. Principle and Methods. Vol. 28. New York. P. 1–15.
Koltunow A.M. 1993. Apomixis: embryo sacs and embryos formed without meiosis or fertilization in ovules. – Plant Cell. 5 (10): 1425–1437.
Koltunow A.M., Grossniklaus U. 2003. Apomixis: a developmental perspective. – Annual Review of Plant Biology. 54: 547–574.
Konar R.N., Oberoi Y.P. 1969. Recent work on reproductive structure of living conifers and taxads: a revew. – Botanical Review. 35 (2): 89–116.
[Kordyum] Кордюм Е.Л. 1978. Эволюционная цитоэмбриология покрытосеменных растений. Киев. 219 с.
Lee J.Y., Lu H. 2011. Plasmodesmata: the battleground against intruders. – Trends in Plant Science. 16 (4): 201–210.
Leszczuk A., Domaciuk M., Szczuka E. 2018. Unique features of the female gametophyte development of strawberry Fragaria x ananassa Duch. – Scientia Horticulturae. 234: 201–209.
Lieber D., Lora J., Schrempp S., Lenhard M., Laux T. 2011. Arabidopsis WIH1 and WIH2 genes act in the transition from somatic to reproductive cell fate. – Current Biology. 21 (12): 1009–1017.
[Lodkina] Лодкина M.M. 1971. О понятии “археспория”. – Материалы Всесоюзного совещания по эмбриологии растений. Кишинев. С. 101–102.
Lora J., Herrero M., Tucker M.R, Hormaza J.I. 2017. The transition from somatic to germline identity shows conserved and specialized features during angiosperm evolution. – New Phytologist. 216 (2): 495–509.
Lora J., Yang X., Tucker M.R. 2019. Establishing a framework for female germline initiation in the plant ovule. – Journal of Experimental Botany. 70 (11): 2937–2949.
Lucas W.J., Ham B.K., Kim J.Y. 2009. Plasmodesmata – bridgind the gap between neighboring plant cells. – Trends in Cell Biology. 19 (10): 495–503.
Mahashwari P. 1950. An introduction to the embryology of angiosperms. New York. 455 p.
Matzke M.A., Mosher R.A. 2014. RNA-directed DNA methylation: an epigenetic pathway of increasing complexity. – Nature Reviews Genetics. 15 (6): 394–408.
Mendes M.A., Petrella R., Cucinotta M., Vignati E., Gatti S., Pinto S.C., Bird D.C., Gregis V., Dickinson H., Tucker M.R., Colombo L. 2020. The RNA-dependent DNA methylation pathway is required to restrict SPOROCYTELESS/NOZZLE expression to specify a single female germ cell precursor in Arabidopsis. – Development. 147 (23): dev194274.
[Naumova] Наумова Т.Н. 1987. Family Celastraceae. – Сравнительная эмбриология цветковых растений. Л. С. 49–54.
Newbigin E., Bacic A., Read S. 2009. Callose and its role in pollen and embryo sac development in flowering plants. – Chemistry, Biochemistry and Biology of (1–3)-β-Glucans and Related Polysaccharides. New York, London, Oxford, San Diego. P. 465–498.
Nikiticheva Z.I., Shamrov I.I. 2002. Archesporium. – In: Embryology of flowering plants. Terminology and concepts. Vol. 1. Generative organs of flower. Enfield (NH, USA). P. 112–114.
Nonomura K.I. 2018. Small RNA pathways responsible for non-cell-autonomous regulation of plant reproduction. – Plant Reprod. 31 (1): 21–29.
Nonumura K., Mioshi K., Eiguchi M., Suzuki T., Miyao A., Hirochika H., Kurata N. 2003. The MSP1 gene is necessary to restrict the number of cells entering into male and female sporogenesis and to initiate anther wall formation rice. – Plant Cell. 15 (8): 1728–1739.
Olmedo-Monfil V., Duran-Figueroa N., Arteaga-Vazquez M., Demesa-Arevalo E., Autran D., Grimanelli D., Slotkin R.K., Martienssen R.A., Vielle-Calzada J.P. 2010. Control of female gamete formation by a small RNA pathway in Arabidopsis. – Nature. 464: 628–632.
Pagnussat G.C., Alandete-Saez M., Bowman J.L., Sundaresan V. 2009. Auxin-dependent patterning and gamete specification in the Arabidopsis female gametophyte. – Science. 324 (5935): 1684–1689.
Petrasek J., Mravec J., Bouchard R., Blakeslee J.J., Abas M., Seifertova D., Wisniewska J., Tadele Z., Kubes M., Covanova M., Dhonukshe P., Skupa P., Benková E., Perry L., Krecek P., Lee O.R., Fink G.R., Geisler M., Murphy A.S., Luschnig C., Zazímalová E., Friml J. 2006. PIN proteins perform a rate-limiting function in cellular auxin efflux. – Science. 312 (5775): 914–918.
Pinto S.C., Mendes M.A., Coimbra S., Tucker M.R. 2019. Revisiting the female germline and its expanding toolbox. – Trends in Plant Science. 24 (5): 455–467.
[Poddubnaya-Arnoldi] Поддубная-Арнольди В.А. 1976. Цитоэмбриология покрытосеменных растений. Основы и перспективы. М. 508 с.
Poethig S. 1989. Genetic mosaics and cell lineage analysis in plants. – Trends in Genetics. 5 (8): 273–277.
Rodkiewicz B., Bednara J. 1976. Cell wall ingrowth and callose distribution in megasporogenesis in some Orchidaceae. – Phytomorphology. 26: 276–281.
Rodkiewicz B., Bednara J. 2002. Megasporogenesis. – In: Embryology of flowering plants. Terminology and concepts. Vol. 1. Generative organs of flower. Enfield (NH, USA). P. 114–115.
Rodkiewicz B. 1970. Callose in cell walls during megasporogenesis in angiosperms. – Planta. 93 (1): 39–47.
[Romanov] Романов И.Д. 1954. Эмбриологические исследования хлопчатника. I. Развитие спорообразующих клеток в семязачатке – Труды Среднеазиатского государственного университета. 53: 3–58.
Savidan Y. 2000. Apomixis: genetics and breeding. – In: Plant Breeding Reviews. New York. P. 13–86.
Schmidt A., Schmid M.W., Grossniklaus U. 2015. Plant germline formation: common concepts and developmental flexibility in sexual and asexual reproduction. – Development. 142 (2): 229–241.
Schnarf K. 1927–1929. Embryologie der Angiospermen. Berlin. 689 s.
Schnarf K. 1931. Vergleichende Embriologie der Angiospermen. Berlin. 354 s.
Sehgal A., Khurana J.P., Sethi M., Ara H. 2011. Occurrence of unique three-celled megagametophyte and single fertilization in an aquatic angiosperm – Dalzellia zeylanica (Podostemaceae-Tristichoideae). – Sex. Plant Reprod. 24 (3): 199–210.
[Shamrov] Шамров И.И. 1997. Развитие семязачатка и семени у Paeonia lactiflora (Paeoniaceae). – Бот. журн. 82 (6): 24–46.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: структура, функции, происхождение. М. 350 с.
She W., Grimanelli D., Rutowicz K., Whitehead M.W., Puzio M., Kotlinski M., Jerzmanowski A., Baroux C. 2013. Chromatin reprogramming during the somatic-to-reproductive cell fate transition in plants. – Deve-lopment. 140 (9): 4008–4019.
Sheridan W.F., Avalkina N.A., Shamrov I.I., Batygina T.B., Golubovskaya I.N. 1996. The mac1 gene: Controlling the commitment to the meiotic pathway in maize. – Genetics. 142 (3): 1009–1020.
Sieber P., Gheyselinck J., Gross-Hardtl R., Laux T., Grossniklaus U., Schneitz K. 2004. Pattern formation during early ovule development in Arabidopsis thaliana. – Developmental Biology. 273 (2): 321–334.
[Sladkov] Сладков А.Н., Гревцова Н.А. 1988. О формировании стенки микроспорангия покрытосеменных – Бюл. МОИП. Отд. биол. 93 (4): 69–74.
[Sladkov] Сладков А.Н., Гревцова Н.А. 1989. О формировании стенки мегаспорангия покрытосеменных. – Бюл. МОИП. Отд. биол. 94 (3): 75–79.
[Solntseva] Солнцева М.П. 1965. К развитию множественного археспория у земляники. – Морфология цветка и репродуктивный процесс покрытосеменных растений. М., Л. С. 189–204.
Su Z., Zhao L., Zhao Y., Li S., Won S., Cai H., Wang L., Li Z., Chen P., Qin Y., Chen X. 2017. The THO complex non-cell-autonomously represses female germline specification through the TAS3-ARF3 module. – Current Biology. 27 (11): 1597–1609.
Su Z., Wang N., Hou Z., Li B., Li D., Liu Y., Cai H., Qin Y., Chen X. 2020. Regulation of female germline specification via small RNA mobility in Arabidopsis. – Plant Cell. 32 (9): 2842–2854.
Treub M. Sur les Casuarinees et leur place dans le systeme naturel. – Annales du Jardin Botanique de Buitzenzorg. 10: 145–219.
Tucker M.R., Koltunow A.M. 2014. Traffic monitors at the cell periphery: the role of cell walls during early female reproductive cell differentiation in plants. – Current Opinion in Plant Biology. 17: 137–145.
Tucker M.R., Okada T., Hu Y., Scholefield A., Taylor J.M., Koltunow A.M. 2012. Somatic small RNA pathways promote the mitotic events of megagametogenesis during female reproductive development in Arabidopsis. – Development. 139 (8): 1399–1404.
Tung S.H., Ye X.L., Zee S.Y., Yeung E.C. 2000. The microtubular cytoskeleton during megasporogenesis in the Nun orchid, Phaius tankervilliae. – New Phytologist. 146 (3): 503–513.
Twell D. 2011. Male gametogenesis and germline specification in flowering plants. – Sex. Plant Reprod. 24 (2): 149–160.
Van Norman J.M., Breakfield N.W., Benfey P.N. 2011. Intercellular communication during plant development. – Plant Cell. 23 (3): 855–864.
Vasil V. 1959. Morphology and embryology of Gnetum. – Phytomorphology. 9: 167–215.
[Vinogradova] Виноградова Г.Ю. 2009. Полиэмбриония у Allium ramosum L. и A. schoenoprasum L. (Alliaceae): Автореф. дис. … канд. биол. наук. СПб. 18 с.
[Vinogradova] Виноградова Г.Ю. 2016. Механизмы дифференциации клеток женских репродуктивных структур in vivo и in vitro (на примере видов Allium species). – Материалы VII Междунар. науч.-практ. конф. “Биотехнология, как инструмент для сохранения биоразнообразия растений (физиологические, биохимические, эмбриологические, генетические и правовые аспекты)”, посвященной 30-летию Отдела Биотехнологии Никитского ботанического сада. Симферополь. 352.
[Vinogradova] Виноградова Г.Ю. 2017. Морфогенез женских репродуктивных структур у видов Euphorbia (Euphorbiaceae), различающихся по типу развития зародышевого мешка. – Бот. журнал. 102 (8): 1060–1093.
Vinogradova G.Yu., Zhinkina N.A. 2021. Why does only one embryo sac develop in the Paeonia ovule with multiple archesporium? – Plant Biol. 23 (2): 267–274.
Walters J.L. 1962. Megasporogenesis and gametophyte selection in Paeonia californica. – Am. J. Bot. 49 (7): 787–794.
Wang N., Huang H.J., Ren S.T., Li J.J., Sun Y., Zhang S.Q. 2012. The rice wall-associated receptor-like kinase gene OsDEES 1 plays a role in female gametophyte development. – Plant Physiol. 160 (2): 696–707.
Warming E. 1878. De l’ovule. – Annales des sciences naturelles. Botanique. Series 6. 5: 177–266.
Webb M.C., Gunning B.E.S. 1990. Embryo sac development in Arabidopsis thaliana – I. Megasporogenesis, including the microtubular cytoskeleton. – Sex. Plant Reprod. 3 (4): 244–256.
Williams C.G. 2009. Conifer reproductive biology. Dordrecht, Heidelberg, London, New York. 174 p.
Wyrzykowska J., Fleming A. 2003. Cell division pattern influences gene expression in the shoot apical meristem. – Proceedings of the National Academy of Sciences of the USA. 100 (9): 5561–5566.
[Yakovlev] Яковлев М.С., Иоффе М.Д. 1965. Эмбриология некоторых представителей рода Paeonia L. – Морфология цветка и репродуктивный процесс покрытосеменных растений. М., Л. С. 140–176.
Yao X., Yang H., Zhu Y., Xue J., Wang T., Song T., Yang Z., Wang S. 2018. The canonical E2Fs are required for germline development in Arabidopsis. – Frontiers in Plant Science. 9: 638.
Zhao X., de Palma J., Oane R., Gamuyao R., Luo M., Chaudhury A., Herve P., Xue Q., Bennett J. 2008. OsTDL1A binds to the LRR domain of rice receptor kinase MSP1, and is required to limit sporocyte numbers. – Plant J. 54 (3): 375–387.
Zhao X.A., Bramsiepe J., Van Durme M., Komaki S., Prusicki M.A, Maruyama D., Forner J., Medzihradszky A., Wijnker E., Harashima H., Lu Y., Schmidt A., Guthörl D., Sahún Logroño R., Guan Y., Pochon G., Grossniklaus U., Laux T., Higashiyama T., Lohmann J.U., Nowack M.K., Schnittger A. 2017. RETINOBLASTOMA RELATED1 mediates germline entry in Arabidopsis. – Science. 356 (6336): 378–379.
Zhao L., Liu Y., Dou X., Cai H., Aslam M., Hou Z., Jin X., Li Y., Wang L., Zhao H., Wang X., Sicard A., Qin Y. 2021. Characterization of germline development and identification of genes associated with germline specification in pineapple. – Horticulture Research. 8: 239.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


