Ботанический журнал, 2022, T. 107, № 2, стр. 198-203
МИКРОГАМЕТОФИТОГЕНЕЗ У PINGUICULA VULGARIS (LENTIBULARIACEAE)
Л. А. Николаева (Пушкарева) 1, *, Г. Е. Титова 1
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: pushkareva-lubov@mail.ru
Поступила в редакцию 05.11.2021
После доработки 15.11.2021
Принята к публикации 16.11.2021
- EDN: NSPJSF
- DOI: 10.31857/S0006813622020077
Аннотация
В результате анализа микрогаметофитогенеза у Pinguicula vulgaris, произрастающей на территории Северо-Запада России (Ленинградская обл.), уточнен тип строения пыльцевого зерна – 3-клеточный. В то же время, наряду с 3-клеточными пыльцевыми зернами в зрелых пыльниках выявлено наличие 2-клеточной пыльцы, возможно, с незавершенным циклом развития. Показано, что в 3-клеточных пыльцевых зернах P. vulgaris (как и у некоторых Utricularia из сем. Lentibulariaceae) веретеновидные клетки спермиев энантиоморфны по строению.
Pinguicula vulgaris L. (жирянка обыкновенная) – многолетнее травянистое растение, являющееся, как и все остальные виды сем. Lentibulariaceae Rich., плотоядными организмами (Loyd, 1942; Casper, 1963; Zemskova, 1981, и др.). По системе S. Casper (1966), P. vulgaris относится к секции Pinguicula Casper подрода Pinguicula Casper рода Pinguicula – по данным молекулярно-филогенетического анализа, монофилетичного по происхождению (Jobson et al., 2003, Cieslak et al., 2005, Degtjareva et al., 2006, и др.). Произрастание вида приурочено главным образом к северным районам (или к районам с холодным климатом) Европы, Азии и Америки, где он обычно обитает во влажных и обедненных питанием условиях. В России встречается в различных регионах, в том числе, в Ленинградской области, где относится к категории редких и уязвимых видов с небольшим количеством локалитетов и половозрелых особей (Red…, 2018). Разработка стратегии сохранения P. vulgaris нуждается в изучении различных аспектов ее репродуктивной биологии в условиях конкретных популяций, включая биологию цветения, опыления и семенного размножения, полное понимание которых невозможно без знаний о специфике протекания эмбриологических процессов.
Эмбриология P. vulgaris (развитие семязачатка, женского гаметофита, семени, эмбриогенез, прорастание семян) исследована достаточно полно (Haccius, Harlte-Baude, 1957; Kopczyńska, 1964; Degtjareva et al., 2004; Titova, 2012, и др.; см. также сводки по сравнительной эмбриологии и анатомии семян сем. Lentibulariaceae: Khan, 1970; Poddubnaya-Arnoldi, 1982; Nikiticheva, 1987; Johri et al., 1992; Kamelina, 2009; Yakovleva et al., 2013). В то же время, ряд процессов, в частности, формирование мужского гаметофита, являются недостаточно изученными, вследствие чего данные о типе строения зрелого пыльцевого зерна у этого растения противоречивы – 3-клеточный (Rodondi et al., 2010) или 2-клеточный (Pushkareva et al., 2018). Следует отметить, что у большинства остальных жирянок этот процесс также не изучен, исключая P. crenatiloba DC, подробная иллюстрация микрогаметофитогенеза которой представлена Casper (1966). Вместе с тем, знания об особенностях этого процесса у разных видов жирянок – в большинстве своем также являющихся редкими и охраняемыми видами (Molano-Flores, 2018, и др.), важны для понимания закономерностей прохождения процесса их двойного оплодотворения, успешность которого во многом определяет формирование особями полноценного потомства.
Исходя из этого, цель настощей работы состояла в выявлении закономерностей процесса микрогаметофитогенеза у Pinguicula vulgaris L. из Ленинградской области.
МАТЕРИАЛ И МЕТОДЫ
Сбор материала по Pinguicula vulgaris (бутоны и цветки на разных стадиях развития) производили в окрестностях поселков Пудость и Глядино Ленинградской области (Гатчинский и Ломоносовский р-ны, соответственно) в июне 2019–2021 гг.
Материал фиксировали в смеси FAA (70%-ный этанол : формалин : концентрированная уксусная кислота = 100 : 7 : 7). Постоянные препараты готовили по общепринятой цитоэмбриологической методике (Pausheva, 1980). Срезы толщиной 12 мкм получали на микротоме Microm HM 325 (Carl Zeiss, Germany) и окрашивали основным фуксином по Фельгену с подкраской алциановым синим. Дополнительно использовали давленные препараты пыльников. Анализ препаратов и микрофотосъемку осуществляли на микроскопе Axioplan 2 с ПО AxioVision (Carl Zeiss, Germany).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ процесса микрогаметофитогенеза у Pinguicula vulgaris показал, что развитие мужского гаметофита у этого вида происходит в два этапа – (1) деление микроспоры с образованием вегетативной и генеративной клеток, (2) деление генеративной клетки с образованием двух клеток-спермиев.
Отделение генеративной клетки происходит в сильновакуолизированной микроспоре, приобретающей к этому времени полярное строение (с размещением ядра в пристенном положении). В микроспоре на этой стадии уже отчетливо дифференцированы интина и экзина (с формированием 6–8 борозд), ее ядро неправильной формы, с крупным ядрышком, а цитоплазма почти без запасных питательных веществ (рис. 1, 1). Вследствие асимметричного митоза и последующего цитокинеза, генеративная клетка меньше по размерам, чем вегетативная клетка; в то же время, она достаточно крупная, сначала располагается пристенно, имеет линзовидную форму и содержит ядро с большим ядрышком. Крупное ядро вегетативной клетки (также с большим ядрышком) имеет лопастную форму, а в цитоплазме этой клетки отмечается активная аккумуляция запасных веществ (рис. 1, 2, 3). Деления в микроспорах происходят асинхронно, вследствие чего в гнездах пыльников на этой стадии развития присутствуют и микроспоры, и двуклеточные пыльцевые зерна.
Рис. 1.
Микрогаметофитогенез у Pinguicula vulgaris.
1 – сильновакуолизированная микроспора, 2 – отделение генеративной клетки, 3 – фрагмент пыльцевого зерна с генеративной клеткой в пристенном положении, увеличено, 4, 5 – 2-клеточные пыльцевые зерна с генеративной клеткой внутри вегетативной клетки (5 – ее контакт с ядром вегетативной клетки); 6 – деление генеративной клетки с образованием спермиев (поздняя телофаза), 7 – 3-клеточное пыльцевое зерно с энантиоморфными спермиями, 8 – 2‑клеточное пыльцевое зерно в том же пыльнике; g c – генеративная клетка, n m – ядро микроспоры, n v c – ядро вегетативной клетки, s – спермии, v m – вакуоль микроспоры. Масштабная линейка – 10 мкм.
Fig. 1. Microgametophytogenesis in Pinguicula vulgaris.
1 – highly-vacuolized microspore, 2 – separation of the generative cell, 3 – the part of pollen grain with generative cell in wall-mounted position (magnified), 4, 5 – 2-celled pollen grains with generative cell inside vegetative cell (5 – its contact with nucleus of vegetative cell), 6 – division of generative cell with formation of sperms (late telophase), 7 – 3-celled pollen grain with enantiomorphic sperms, 8 – 2-celled pollen grain from the same anther; g c – generative cell, n m – nucleus of microspore, n v c – nucleus of vegetative cell, s – sperms, v m – vacuole of microspore. Scale bars – 10 µm.
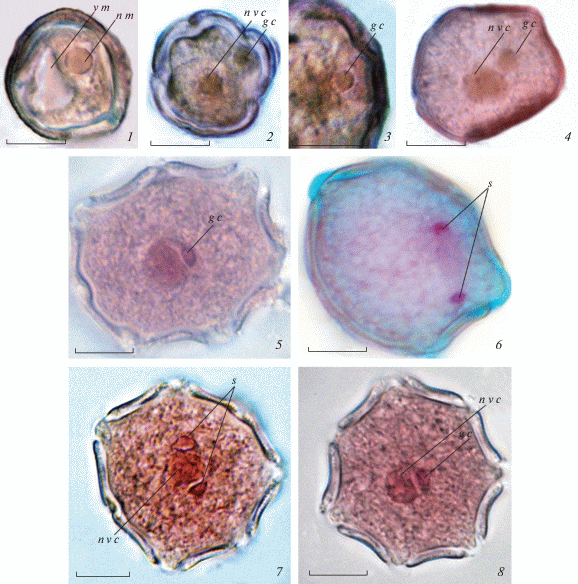
Далее ядро вегетативной клетки смещается в центр пыльцевого зерна, а генеративная клетка отделяется от его стенки и перемещается внутрь вегетативной клетки, первоначально располагаясь на некотором удалении от ее ядра и приобретая при этом веретеновидную форму. Пыльцевые зерна к этой стадии значительно увеличиваются в размерах, при этом в цитоплазме их вегетативной клетки продолжается накопление запасных веществ (рис. 1, 4).
Деление генеративной клетки происходит на поздних этапах развития цветка – в бутонах, близких к раскрытию или при распускании цветка. Перед делением генеративная клетка сближается с ядром вегетативной клетки, вследствие чего образующиеся спермии расположены в том же положении, но на некотором удалении друг от друга. Клетки спермиев имеют слегка веретеновидную (“треугольную”) форму, энантиоморфны и содержат относительно крупное ядро (без отчетливого ядрышка), окруженное тонким слоем цитоплазмы (рис. 1, 5–7). Следует отметить, что процесс образования спермиев в пыльцевых зернах также происходит асинхронно и, возможно, скоррелирован с началом прорастания последних, которое, по данным нашего предыдущего исследования, обычно осуществляется в пыльниках еще нераскрывшихся цветков (на стадии позднего или “рыхлого” бутона – бутонная автогамия; Pushkareva (Nikolaeva) et al., 2018). В гнездах пыльника на этих стадиях развития можно также наблюдать пыльцевые зерна, еще находящиеся в двуклеточном состоянии, часто лишь с начальными признаками набухания апертур или без набухания (рис. 1, 8).
Таким образом, проведенное исследование показало, что зрелые пыльцевые зерна у P. vulga-ris, произрастающей в Ленинградской области, являются 3-клеточными, что согласуется с данными о наличии 3-клеточной пыльцы у P. vulgaris из Альпийской области Италии и Франции (Rodondi et al., 2010). Наше раннее сообщение о наличии у этого вида 2-клеточной пыльцы (Pushkareva et al., 2018) является не точным, что связано с примененной методикой окраски препаратов (гематоксилин по Эрлиху) и гетерогенностью строения пыльцы в пыльниках. Использование окраски препаратов основным фуксином по Фельгену (более четко идентифицирующего ядра спермиев в цитоплазме вегетативной клетки с обильными запасными веществами) позволило установить, что большинство пыльцевых зерен в пыльниках являются 3-клеточными, но некоторая их часть находится в 2-клеточном состоянии, что возможно связано с частичной задержкой их развития в условиях Ленинградской области. Вопрос о способности 2-клеточных пыльцевых зерен к последующему образованию спермиев (по мере набухания апертур и формирования пыльцевых трубок) нуждается в специальном исследовании. Асинхронность формирования пыльцевых зерен в пыльниках – не редкое явление, и в этом случае половые клетки позднее завершают цикл развития. Однако, по предварительным данным, у P. vulgaris из Ленинградской области часть пыльцы (несмотря на внешнюю выполненность) не прорастает даже в полностью раскрытых цветках, а у некоторых особей ее прорастание в пыльниках полностью отсутствует. Возможно, полное отсутствие прорастания пыльцы в пыльниках связано с отсутствием поступления стимула из рыльца, поверхность которого обычно находится в контакте с пыльниками и становится восприимчивым к пыльце еще в бутоне (Pushkareva et al., 2018).
Последовательность событий, связанных с формированием мужских половых клеток в пыльцевом зерне P. vulgaris (асимметричный цитокинез, отделение генеративной клетки с ее первоначальным пристенным положением и характерной линзовидной формой, характер ее перемещения в вегетативной клетке с окончательным расположением возле ядра последней, последующее деление с образованием спермиев) в целом соответствуют общим закономерностям их формирования у других видов цветковых растений (Russell, 1997; Yermakov et al., 2018). В то же время, эти закономерности у P. vulgaris почти полностью идентичны таковым P. crenatiloba, микрогаметофитогенез которой подробно проиллюстрирован (в виде рисунков) Casper (1966). Некоторое исключение составляют различия в форме генеративных клеток (веретеновидной у P. vulgaris, овальной у P. crenatiloba) и клеток спермиев (слегка веретеновидной у P. vulgaris, но округлой у P. crenatiloba). Примечательно также, что спермии P. vulgaris являются четко энантиоморфными (зеркально симметричными), что впервые отмечено в роде Pinguicula, хотя на изображениях пыльцевого зерна P. crenatiloba (Casper, 1966: стр. 28 – рис. 11 ) они также выглядят зеркально-симметричными. Ранее в сем. Lentibulariaceae энантиоморфизм спермиев был описан лишь у видов Utriculariа L. (Kamelina, 2009). Однако, у других изученных видов Pinguicula структура спермиев детально не охарактеризована, хотя и отмечено наличие 3-клеточной пыльцы (P. alpina L., P. arvetii Genty, P. grandiflora Lam. subsp. grandiflora, P. grandiflora subsp. rosea (Mutel) Casper, P. hirtiflora Ten., P. leptoceras Rchb., P. poldinii Steiger et Casper, P. reichenbachiana Schindl., и др., Espinosa-Matias et al., 2005; Shuka et al., 2007; Rodondi et al., 2010).
ЗАКЛЮЧЕНИЕ
Проведенное исследование подтвердило наличие у Pinguicula vulgaris пыльцевых зерен 3-клеточного типа строения (Rodondi et al., 2010). В то же время в зрелых пыльниках этого вида выявлено присутствие 2-клеточной пыльцы, возможно, не завершившей цикл развития в условиях Ленинградской области. Детальный анализ генезиса мужских половых клеток показал, что общие закономерности их формирования (характер деления микроспоры, движения генеративной клетки внутри вегетативной клетки и положения спермиев в последней) полностью соответствуют таковым других видов цветковых растений (Russell, 1997; Yermakov et al., 2018), при этом выявленный нами энантиоморфизм спермиев P. vulgaris также свойственен некоторым видам Utricularia из сем. Lentibulariaceae (Kamelina, 2009).
Список литературы
Casper S.J. 1963. Gedanken zur Gliederung der Gattung Pinguicula L. – Bot. Jahrb. 82 (3): 321–335.
Casper S.J. 1966. Monographie der Gattung Pinguicula L. – Biblioth. Bot. 127 (128): 1–209.
Cieslak T., Polepall J.S., White A., Müller K., Borsch T., Barthlott W., Steiger J., Marchant A. & Legendre L. 2005. Phylogenetic analysis of Pinguicula (Lentibulariaceae): chloroplast DNA sequences and morphology support several geographically distinct radiations. – Am. J. Bot. 92: 1723–1736.
Degtjareva G.V., Casper S.J., Hellwig F. & Sokoloff D. 2004. Seed morphology in the genus Pinguicula (Lentibulariaceae) and its relation to taxonomy and phylogeny. – Bot. Jahrb. Syst. 125: 431–452.
Degtjareva G.V., Casper S.J., Hellwig F., Schmidt A.R., Steiger J. & Sokoloff D.D. 2006. Morphology and nrITS phylogeny of the genus Pinguicula L. (Lentibulariaceae), with special attention to embryo evolution. – Plant Biol. 8: 778–790.
Espinosa-Matías S., Zamudio S. & Márquez-Guzmán J. 2005. Embriología de las estructuras reproductoras masculinas del género Pinguicula L. (Lentibulariaceae). – Bol. Soc. Bot. Méx. 76: 43–52.
Haccius B., Hartle-Baude E. 1957. Embryologische und histogenetische Studien an “monocotylen Dikotylen” II. Pinguicula vulgaris L. und P. alpina L. – Österr. bot. Zeitschr. 103: 567–587.
Jobson R.W., Playford J., Cameron K.M., Albert V.A. 2003. Molecular phylogenetics of Lentibulariaceae inferred from plastid rps16 intron and trnL-F DNA sequences: implications for character evolution and biogeography. – Syst. Bot. 28: 157–171.
Johri B.M., Ambegaokar K.B., Srivastava P.S. 1992. Comparative Embryology of Angiosperms. – Springer. Berlin: 1221 р.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Т. 1. Двудольные. Барнаул. 501 с.
Khan R. 1970. Lentibulariaceae. – Bull. Indian Nat. Sci. Acad. 41.: 290–291.
Kopczyńska K. 1964. Embryo sac development in Pinguicula vulgaris L. – Acta Soc. Bot. Pol. 33: 141–156.
Lloyd F.E. 1942. The carnivorous plants. – Waltham, Mass. USA. 262 p.
Molano-Flores B., Primer S., Annis J., Feist M. A., Coons J., Digges R. 2018. Reproductive ecology of three rare North American Pinguicula species. – Plant Species Biol. 33 (2): 129–139.
[Nikiticheva] Никитичева З.И. 1987. Семейство Lenti-bulariaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae – Asteraceae. Л.: 283–288.
[Pausheva] Паушева З.П. 1980. Практикум по цитологии растений. М. 255 с.
[Poddubnaya-Arnoldi] Поддубная-Арнольди В.А. 1982. Характеристика семейств покрытосеменных растений по цитоэмбриологическим признакам. М. 351 с.
[Pushkareva et al.] Пушкарева Л.А., Виноградова Г.Ю., Титова Г.Е. 2018. Репродуктивная биология Pinguicula vulgaris (Lenibulariaceae) в Ленинградской области. – Бот. журн. 103 (12): 1501–1513.
[Red…] Красная книга природы Ленинградской области: объекты растительного мира. 2018. СПб. 848 с.
Rodondi G., Beretta M. & Andreis C. 2010. Pollen morphology of alpine butterworts (Pinguicula L., Lentibulariaceae). – Review of Palaeobotany and Palynology. 162: 1–10.
Russell S. D. 1997. Male germ unite. – In: Embryology of flowering plants. Terminology and concepts. Vol. 2. Seed. St. Petersburg. P. 127–135.
Shuka L., Xhulaj M., Kashta L., & Casper S.J. 2007. The genus Pinguicula (Lentibulariaceae) in Albania – a critical review. – Wulfenia. 14: 15–65.
[Titova] Титова Г.Е. 2012. Биология прорастания Pinguicula vulgaris (Lentibulariaceae). – Бот. журн. 97 (9): 1137–1162.
[Yakovleva et al.] Яковлева О.В., Титова Г.Е., Иванова А.Н. 2013. Семейство Lentibulariaceae. Сравнительная анатомия семян. Т. 7 (дополнения). Двудольные. Lamiidae.: 201–252.
[Yermakov et al.] Ермаков И.П., Матвеева Н.П., Брейгина М.А. 2009. Физиология гаплоидного поколения семенных растений. Учебное пособие. М. 276 с.
[Zemskova] Земскова Е.А. 1981. Семейство Пузырчатковые (Lentibulariaceae). – В кн.: Жизнь растений Т. 5. Ч. 2. Цветковые растения. М.: 460–462.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


