Ботанический журнал, 2022, T. 107, № 2, стр. 107-131
ЗНАЧЕНИЕ ПРИЗНАКОВ РАЗВИТИЯ ЭНДОСПЕРМА ДЛЯ СРАВНИТЕЛЬНОГО АНАЛИЗА ЭНДОСПЕРМОГЕНЕЗА И ЭМБРИОГЕНЕЗА ПОКРЫТОСЕМЕННЫХ РАСТЕНИЙ
1 Российский государственный педагогический университет им. А.И. Герцена
191186 С.-Петербург, наб. р. Мойки, 48, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197376 С.-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: ivan.shamrov@gmail.com
Поступила в редакцию 28.09.2021
После доработки 22.10.2021
Принята к публикации 16.11.2021
- EDN: YDZJPK
- DOI: 10.31857/S0006813622020107
Аннотация
Обсуждаются процесс оплодотворения, положение ядра первичной клетки, особенности раннего развития эндосперма и принципы его типизации. Предлагается дополненная и уточненная классификация способов развития эндосперма, образующих 3 уровня иерархии – типы, подтипы и вариации. Типы различаются морфогенетическими потенциями первичных микропилярной и халазальной клеток: целллюлярный (кариокинез в обеих клетках сопровождается цитокинезом) и гелобиальный (в обеих клетках происходит только кариокинез, иногда халазальная клетка остается одноядерной). Нуклеарный эндосперм рассматривается как подтип гелобиального типа. Подтипы характеризуются разной степенью участия микропилярной и халазальной клеток в построении эндосперма. В подтипах выделены вариации на основании положения перегородок во время образования тетрад или триад в целлюлярном типе или числа ядер в халазальной клетке в гелобиальном типе.
При сравнительном анализе цветковых растений типы эмбриогенеза можно сравнивать с подтипами и даже вариациями целлюлярного типа эндосперма, при этом оба признака (вклад производных микропилярной и халазальной клеток в построение эндосперма; характер делений этих клеток и форма тетрады) следует рассматривать одновременно. Также можно учитывать и возможности гелобиального эндосперма – наличие 2 подтипов и 2 вариаций.
Эмбриологические признаки, выявленные в ходе сравнительных исследований, могут быть использованы при решении вопросов систематики и филогении. Слабо изученными остаются проблемы развития и типизации эндосперма, что не позволяет в полной мере оценить значимость его типов и способов для решения некоторых проблем биологии развития растений. Современные исследователи практически не разрабатывают теоретические вопросы в области эндоспермогенеза. Имеющиеся литературные данные требуют систематизации и переосмысления. Проведем их анализ, начиная с процесса оплодотворения.
Значение эндосперма для развития зародыша у цветковых растений. Эндосперм, как и зародыш, возникает в результате двойного оплодотворения. Оно включает объединение одного спермия с яйцеклеткой, а второго спермия (той же пары) – с центральной клеткой зародышевого мешка). Известно, что С.Г. Навашин (Nawaschin, 1898a, b) сравнивал двойное оплодотворение с полиэмбрионией. Такой же точки зрения придерживаются и некоторые современные исследователи (Friedman, 1994, 1995; Friedman, Williams, 2004), которые считают, что один из двух зародышей, возникших в результате оплодотворения, постепенно стал выполнять функцию эндосперма. Однако одновременно развивающиеся зародыши неизбежно вступают в конкуренцию за питательные вещества. Дополнительный зародыш дегенерирует, а образовавшиеся пластические вещества могут использоваться для окончательного формирования единственного зародыша. У Dactylorhiza fuchsii (Druce) Soó (Orchidaceae) в большинстве формирующихся семян на ранних стадиях присутствуют глобулярные зародыши. Однако в дальнейшем, вероятно, из-за нарушений во время оплодотворения при образовании эндосперма выявляются различные аномалии в строении зародышей, что приводит к низкой семенной продуктивности (Andronova, 2011). Современные исследования выявили, что трофическая функция не является основной для эндосперма покрытосеменных растений. Наиболее существенным является обеспечение и распределение сигналов, регулирующих процессы дифференциации и органогенеза зародыша. Значимость эндосперма, возникающего при оплодотворении центральной клетки спермием, особенно становится актуальной при апомиксисе. Эндосперм у цветковых растений является, вероятно, структурой de novo (подробнее об этом см. Shamrov, 2020).
Эндосперм выявлен у большинства покрытосеменных растений. Однако у некоторых из них (Podostemaceae) функцию эндосперма выполняет “нуцеллярный плазмодий”, который образуется из клеток халазальной области нуцеллуса (Kapil, 1970). Уже на стадии 2-ядерного зародышевого мешка происходит дезинтеграция клеток этой зоны и постепенно возникает многоядерный симпласт (Arekal, Nagendran, 1975). У видов сем. Orchidaceae, как уже было отмечено, наблюдаются нарушения при объединении ядра спермия с ядрами центральной клетки (Calanthe aristulifera Rchb.f., Listera nipponica Makino). Образование эндосперма подавлено, при этом его первичное ядро чаще всего, не делясь, быстро дегенерирует (Savina, Poddubnaya-Arnoldi, 1990). У Gymnadenia conopsea (L.) R.Br. и Listera ovata (L.) R.Br. тройное слияние происходит нормально, но ядро первичной клетки эндосперма не делится. Оно увеличивается в размерах и находится вблизи клеток постамента, в которых обнаруживаются декстрины. В таком состоянии эндосперм присутствует до начала отделения протодермы в глобулярном зародыше, обеспечивая развивающийся зародыш различными веществами, в том числе необходимых для его дифференциации и гистогенеза (Shamrov, 2008). По-видимому, также функционирует эндосперм у Trapa natans L. (Trapaceae). Первичное ядро эндосперма становится гипертрофированным и смещается в халазальную часть, контактируя с клетками нуцеллуса, богатыми белками и крахмалом. Эндосперм обнаруживается на ранних стадиях эмбриогенеза (Titova et al., 1997).
Особенности раннего эндоспермогенеза и типы эндосперма. Во многих исследованиях выделяют два типа развития эндосперма у цветковых растений в зависимости от особенностей карио- и цитокинеза при прохождении эндоспермогенеза: целлюлярный (деления ядер сопровождаются цитокинезом) и нуклеарный (отсутствие цитокинеза во время ранних стадий). Гелобиальный эндосперм обычно рассматривается как эндосперм с признаками обоих вышеназванных типов – первое деление в эндосперме приводит к образованию двух клеток (камер), в которых (обычно в микропилярной) происходят затем только свободноядерные деления (Khudyak, 1963; Poddubnaya-Arnoldi, 1976; Kordyum, 1978; Vijayaraghavan, Prabhakar, 1984). В ряде исследований число типов увеличивают до четырех, выделяя промежуточный тип, наряду с гелобиальным (Wunderlich, 1959), либо разделяя целлюлярный тип на собственно целлюлярный и тубифлоральный (Kamelina, 1997).
Тип развития во многом определяется положением ядра первичной клетки эндосперма. При нуклеарном типе ядро часто находится в микропилярной части. Однако для ряда растений указывается на его перемещение в среднюю (Onagraceae, Vitaceae) и даже халазальную (Capparaceae, Tiliaceae) области (Zhukova, 1997b). Возникшие ядра распределяются по периферии возникающего ценоцита, оттесненные крупной вакуолью. Далее начинается процесс целлюляризации (рис. 1, 1–4). Нуклеарный эндосперм характерен как для двудольных, так и однодольных растений. При развитии целлюлярного эндосперма ядро первичной клетки располагается чаще всего в микропилярной или средней частях (Shamrov, 1997a), тогда как при гелобиальном типе оно обычно находится вблизи антипод (Vorsobina, Solntseva, 1979; Shamrov, 1997b). Его деление, как правило, поперечное, реже продольное или наклонное. Целлюлярный эндосперм характерен для двудольных растений. Данные, полученные по его развитию у ряда однодольных (Araceae, Burmanniaceae, Lemnaceae), были подвергнуты сомнению (Lawalrée, 1952; Maheshwari, Khanna, 1956; Parameswaran, 1959). Так же обстоит дело и с гелобиальным эндоспермом, который присущ однодольным. Результаты его описания у некоторых двудольных (Olacaceae, Santalaceae, Saxifragaceae) также в дальнейшем не были подтверждены (Swamy, Krishnamurthy, 1973). При гелобиальном эндосперме после первого деления образуются 2 неравные камеры: в крупной микропилярной происходит образование многоядерного ценоцита, а маленькая халазальная может оставаться одноядерной или в ней возникает несколько ядер. Затем в микропилярной, а иногда и халазальной многоядерной камерах начинается формирование клеток.
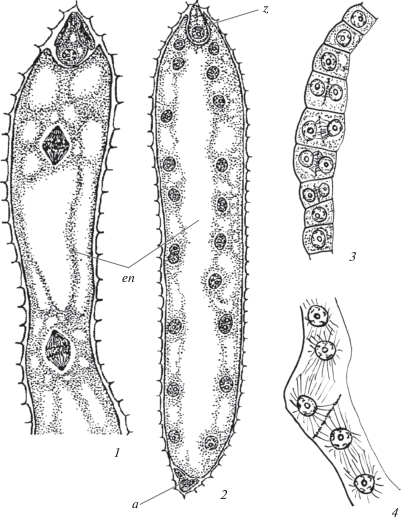
Рис. 1.
Строение и развитие эндосперма по нуклеарному типу у Gentiana lutea. Стадии развития: ценоцитная (1, 2) и альвеолярная (3, 4). a – антиподы, en – эндосперм, z – зигота.
Fig. 1. Endosperm structure and development after Nuclear type in Gentiana lutea. Stages of development: coenocitic (1, 2) and alveolar (3, 4). a – antipodals, en – endosperm, z – zygote.
Выявлены различия в поведении ядра первичной клетки и характере дальнейшего развития при разных типах эндосперма. В сем. Aquifoliaceae (целлюлярный эндосперм) деления в первых двух клетках могут не сопровождаться цитокинезом (Herr, 1961), т. е. развитие эндосперма начинается по гелобиальному типу. У представителей сем. Saxifragaceae обнаружен эндосперм гелобиального типа, однако в некоторых случаях он может быть целлюлярным или нуклеарным (Korobova-Semenchenko, 1977). У ряда видов семейств Balsaminaceae и Loganiaceae (целлюлярный эндосперм) в результате деления микропилярной клетки образуется ряд из трех клеток, верхняя из которых преобразуется в микропилярный гаусторий, а в нижней и средней клетках, дающих собственно эндосперм, происходят свободноядерные деления (Dahlgren, 1934; Yamazaki, 1963). В сем. Acanthaceae эндосперм, образующийся на базе средней клетки, может быть с самого начала либо клеточным, либо свободноядерным (Mohan Ram, 1962; Karlström, 1974a, b; Madhavan, Gupta, 1982). У Arabidopsis thaliana (L.) Heynh. (нуклеарный эндосперм) на стадии 2‑ядерного эндосперма одно ядро мигрирует в халазальный район. Далее здесь образуется 2–8 ядер, которые отделяются плотной цитоплазмой от остальной части эндосперма, имитируя халазальную камеру гелобиального эндосперма как по строению, так и ее роли в дальнейшем развитии (Herr, 1999). Подобная особенность строения и развития эндосперма у этого вида и Capsella bursa-pastoris (L.) Medik. (Brassicaceae) была отмечена нами (Shamrov, 2002, 2007). У A. thaliana число ядер в халазальной части составляло 4 (рис. 2, 1, 2), а у C. bursa-pastoris значительно больше, при этом наблюдалась агрегация ядер и их полиплоидизация. Ядра в халазальной области эндосперма у Arabidopsis thaliana также могут сливаться, в результате чего они становятся в 2–3 раза крупнее, чем ядра микропилярной области, при этом их плоидность возрастает (Baroux et al., 2004). У Gagea stipitata Merckl. ex Bunge (Liliaceae) (Shamrov, 1999) клеткообразование в халазальной части эндосперма, где формируются крупные полиплоидные ядра, не происходит. Сходное поведение нуклеарного эндосперма было описано у Hypericum acutum Moench. (Clusiaceae), когда в период раннего эмбриогенеза ядра в халазальной части эндосперма оказываются связанными между собой (Stenar, 1938). У Allium schoenoprasum L. из сем. Alliaceae (Vinogradova, 2018) выявлено несколько способов прохождения начального этапа развития нуклеарного эндосперма. Чаще всего после первого деления одно ядро и его производные остаются в центральной части первичной клетки (за счет них в дальнейшем создается основная масса эндосперма), а второе мигрирует в халазальную часть, при этом образующиеся ядра крупнее по сравнению с центральными, более хроматизированные и содержат больше ядрышек. Во втором случае возникающие ядра остаются только в центральной части первичной клетки эндосперма. Очень редко деления происходят только в халазальной части, что характерно, как правило, для гелобиального эндосперма. Подобное отмечали при развитии нуклеарного эндосперма у Dioscorea nipponica Makino (Torshilova, 2018).
Рис. 2.
Формирующееся семя на стадии зиготы и первых ядер эндосперма у Arabidopsis thaliana.
Общий вид (1), микропилярная и халазальная части семени (2). ch n – халазальные ядра, en – эндосперм, i i – внутренний интегумент, m n – микропилярные ядра, n – нуцеллус, o i – наружный интегумент, v b – проводящий пучок, z – зигота.
Fig. 2. Developing seed at the stage of zygote and first endosperm nuclei in Arabidopsis thaliana.
General view (1), micropylar and chalazal portions of the seed (2). ch n – chalazal nuclei, en – endosperm, i i – inner integument, m n – micropylar nuclei, n – nucellus, o i – outer integument, v b – vascular bundle, z – zygote.

Особенности формирования нуклеарного и гелобиального типов эндосперма. При нуклеарном и гелобиальном типах ценоцитная фаза сменяется клеточной: вокруг каждого ядра обособляется участок цитоплазмы и образуется клеточная оболочка. По данным электронной микроскопии клеточная оболочка ценоцита эндосперма снабжена многочисленными выростами (Vijayaraghavan, Prabhakar, 1984; Bhandari, Anuradha Mal, 1989). У многих растений такие выросты есть и в центральной клетке зародышевого мешка (Vazart B., Vazart J., 1966; Newcomb, 1973), что способствует осуществлению латерального пути транспорта после оплодотворения, особенно при наличии интегументального тапетума.
Исследователи изучают гены, вовлеченные в процессы митоза и связь между собой образующихся ядер (Liu, Meinke, 1998; Liu et al., 2002; Hara et al., 2015; Guo et al., 2018). При этом, анализируя состояние ядер во время анафазы, которая у Arabidopsis thaliana (Brassicaceae) считается критической стадией в клеточном цикле по синхронизации образующихся ядер эндосперма, ценоцитное состояние эндосперма авторы не корректно называют синцитиальным (Hara et al., 2015; Guo et al., 2018). Прежде всего, семантика термина “синцитий” (греч. syn – вместе, kitos – клетка) указывает на сохраняющуюся связь между поделившимися клетками, а не ядрами, которые образуются при нуклеарном и гелобиальном типах. Так, например, у человека синцитий образуется во время сперматогониальных делений. В этом случае цитокинез не доходит до конца и образуются клоны взаимосвязанных клеток (Gilbert, 2003).
Клетки эндосперма формируются центростремительно: сначала возникают периферические, а затем – внутренние клетки. Начальные этапы целлюляризации характеризуются некоторыми особенностями. При образовании первого слоя формируются радиальные и наружные тангентальные клеточные стенки, при этом со стороны вакуоли клетки покрыты только плазмалеммой. Такая стадия развития нуклеарного и гелобиального эндосперма получила название альвеолярной (Lammeren van, 1988; Xu Han, Lammeren van, 1993, 1994). Термин “альвеола” был предложен C. Sokolowa (1890) для обозначения радиально удлиненных клеток, смыкающихся в центре женского гаметофита хвойных при переходе от нуклеарной к целлюлярной стадии развития. Только после образования внутренних клеточных стенок начинаются деления клеток. Подобный эндосперм у голосеменных обозначают как альвеолярный (Singh, 1978). У цветковых растений, в отличие от голосеменных, после образования первого альвеолярного слоя в его клетках происходят периклинальные деления. Оформляется эпидермальный слой, клетки которого имеют полные оболочки. Нижележащий слой проявляет признаки альвеолярной структуры. Процесс целлюляризации продолжается до тех пор, пока вся вакуоль не будет занята клетками. У растений с доразвитием (Paeoniaceae, Ranunculaceae) с глобулярной стадии развития вокруг зародыша в результате лизиса клеток эндосперма в центре образуется эндоспермальная полость, которая становится выраженной на момент опадения семени (Shamrov, 1997; Butuzova, 2018). У представителей некоторых семейств эндосперм остается ядерным (Cymodoceaceae, Juncaginaceae, Zosteraceae). Число свободно-ядерных делений варьирует у различных таксонов.
Направление заложения клеточных перегородок варьирует в зависимости от таксона: может начинаться с периферии ценоцита и идти к центру либо с одного из полюсов эндосперма и продвигаться в направлении продольной оси к другому полюсу (чаще от микропилярного к халазальному концу). У Gentiana lutea L. (Gentianaceae) клеткообразование начинается по достижению 128 свободных ядер. Первыми образуются клетки вблизи зиготы, затем этот процесс смещается в среднюю и нижнюю часть, что приводит к асинхронному формированию клеток. Так, в микропилярной части уже имеются 2 слоя (соответствует стадии 2-3-клеточного зародыша), тогда как в халазальной части лишь инициируется заложение перегородок между ядрами (рис. 1, 1–4) (Shamrov, ориг. данные).
Механизмы образования клеточных перегородок между ядрами ценоцита дискутируются: (1) путем формирования клеточных пластинок (с помощью вторичных фрагмопластов); (2) способы клеткообразования, не связанные с митозом; (3) инициация цитокинеза обусловлена свободным центростремительным ростом клеточных стенок между ядрами пристенного слоя цитоплазмы эндоспермального ценоцита. Наиболее вероятным представляется первый способ. При исследовании локализации микротрубочек в ходе развития нуклеарного эндосперма Coronopus didymus (L.) Sm. (Brassicaceae) было показано, что перед началом клеткообразования в периферическом слое формируются ядерно-цитоплазматические домены: комплекс ядер и радиально расходящихся от них микротрубочек (Nguyen et al., 2002). В результате взаимодействия перекрывающихся микротрубочек соседних ядер образуются вторичные фрагмопласты, в центре которых формируются клеточные перегородки. Почти также с помощью иммуноцитологического изучения микротрубочек в нуклеарном эндосперме Brassica napus L. было выявлено, что их лучи от одного ядра взаимодействуют с микротрубочками соседнего ядра (Lammeren van et al., 1997). У Gentiana lutea после достижения критического числа свободных ядер начинается их расхождение, при этом в каждой паре ядер одно остается вблизи стенки первичной клетки эндосперма, а другое ядро смещается внутрь относительно первого под углом в 45°. Расположение смежных ядер напоминает ломаную линию. В результате этого создается необходимое пространство для перекрещивания микротрубочек, которые появляются вокруг ядер. Между смежными ядрами возникают радиальные стенки (рис. 1, 3, 4) (Shamrov, ориг. данные). Подобный механизм, вероятно, является общебиологическим. Именно с помощью его происходит формирование тетрад микроспор по симультанному типу (Sampson, 1969), образование клеток в зародышевом мешке. Хотя у животных цитокинез происходит без участия фрагмопластов, борозды дробления возникают также при участии микротрубочек. Цитоплазма морского ежа после митоза ядра зиготы делится на 2 части, благодаря сокращению микрофиламентов в области будущей борозды дробления. Вокруг обоих ядер создаются “звезды” микротрубочек и начинается образование бластомеров (Gilbert, 2003).
Принципы типизации эндосперма. В классификациях эндоспермогенеза используют ряд критериев для выделения иерархических категорий: 1 – наличие или отсутствие клеточной перегородки при делении первичной клетки эндосперма (целлюлярный и нуклеарный типы, соответственно); 2 – положение первой и второй перегородок (модификации в целлюлярном типе, обозначаемые как “типы” (Mauritzon, 1935; Rosén, 1949; Wunderlich, 1967; Di Fulvio, 1983), “формы” (Schnarf, 1917, 1929; Glišić, 1936–1937) или “вариации” (Kapil, Vijayaraghavan, 1962, 1965; Shamrov, Zhinkina, 1994); 3 – число ядер в халазальной клетке (“формы” в гелобиальном типе – Swamy, Parameswaran, 1963); 4 – положение ядер в первичной клетке эндосперма (“типы” и “подтипы” в нуклеарном типе – Di Fulvio, 1983, 1985; Di Fulvio, Cocucci, 1986).
Учитывалась также степень участия первичных микропилярной и халазальной клеток в образовании целлюлярного эндосперма семени. Samuelsson (1913) выделил две серии: серия A – обе клетки принимают участие в образовании эндосперма, серия B – только одна из клеток образует эндосперм, а другая функционирует как гаусторий. На основании этих положений была предложена новая общая классификация эндосперма цветковых растений (Di Fulvio, 1983, 1985; Di Fulvio, Cocucci, 1986). Выделены два способа развития эндосперма (целлюлярный и нуклеарный), которым придан статус мегатипов. Целлюлярный мегатип представлен 5 типами и 12 подтипами. Типы образуют 2 группы, различающиеся положением перегородки во время первого деления в эндосперме: продольное (первая группа), поперечное (вторая группа). В нуклеарном мегатипе на основании положения ядер в первичной клетке эндосперма предложено различать типы и подтипы.
Предложенные критерии, на наш взгляд, не полностью отражают все особенности развития эндосперма. В литературе почти не рассматривается роль гелобиального типа в эволюции эндосперма, хотя число таксонов, у которых он обнаружен, довольно значительно. Ряд исследователей его не рассматривают в качестве самостоятельного и включают в нуклеарный (Sporne, 1954) либо целлюлярный (Swamy, Ganapathy, 1957) типы. Лишь в одной из работ (Herr, 1995) гелобиальный тип рассматривается не как промежуточный этап эволюции от целлюлярного эндосперма к нуклеарному, а как параллельный путь развития. Еще P. Maheshwari (1950) отмечал, что между типами существуют переходные формы. По мнению Э.С. Терехина (Teryokhin, 1996), способ развития эндосперма тесно связан с адаптивным характером прорастания семян.
Все это заставило нас пересмотреть представления о принципах типизации эндосперма. Еще ранее (Shamrov, 2008) нами была представлена возможная система способов развития и строения эндосперма. В дальнейшем в нее были внесены изменения, увеличено и уточнено число подтипов и вариаций. Коррективы были внесены в направления эволюции эндосперма, особенно с учетом современных данных. Для понимания возникновения различий в строении эндосперма были пересмотрены существующие точки зрения на значение эндосперма для развития зародыша, проведен анализ критериев при построении классификаций и выявлены некоторые особенности строения эндосперма. Все это позволило использовать имеющиеся сведения для проведения сравнительного анализа эндоспермогенеза и эмбриогенеза у цветковых растений.
Переработанная и уточненная классификация включает три ступени иерархии: типы, подтипы, вариации. Принцип ее построения в целом сходен с таковым при выделении типов и вариаций эмбриогенеза (Johansen, 1950). В классификации учитываются следующие критерии: морфогенетические потенции первичных микропилярной и халазальной клеток, степень их участия в построении эндосперма семени, положение клеточных перегородок или число ядер после второго и последующего делений, дефинитивная структурная организация.
На основании морфогенетических потенций первичных микропилярной и халазальной клеток предлагаем различать два основных типа развития эндосперма: целлюлярный (в период раннего эндоспермогенеза процессы кариокинеза в обеих клетках завершаются цитокинезом) и гелобиальный (в обеих клетках, чаще всего в микропилярной, осуществляется только кариокинез). Нуклеарный тип рассматривается как подтип гелобиального типа.
Типы подразделяются на ряд подтипов по степени участия микропилярной и халазальной клеток в построении эндосперма.
Подтипы в целлюлярном типе:
микропилярный с халазальным гаусторием – эндосперм образуется за счет микропилярной клетки, а халазальная клетка функционирует как гаусторий (некоторые Icacinaceae, Fouquieriaceae, Saururaceae, многие Nymphaeaceae, Hydatellaceae);
микропилярный с терминальными гаусториями – эндосперм формируется из нижних производных микропилярной клетки, а из халазальной клетки, как и верхних производных микропилярной клетки дифференцируются гаустории (Buddlejaceae, Crassulaceae, Gesneriaceae, Orobanchaceae, Pedaliaceae, Plantaginaceae, Scrophulariaceae, Verbenaceae);
микропилярно-халазальный без гаусториев – обе клетки принимают почти равное участие в образовании эндосперма (Annonaceae, Aristolochiaceae, Ceratophyllaceae, Degeneriaceae, Monimiaceae, Nelumbonaceae, Sarraceniaceae, Winteraceae);
микропилярно-халазальный с терминальными гаусториями – обе клетки двуклеточного эндосперма формируют эндосперм, а также терминальные гаустории (Callitrichaceae, Lentibulariaceae, Lobeliaceae, Stylidiaceae, некоторые Campanulaceae);
халазальный с микропилярным гаусторием – микропилярная клетка становится гаусторием, а халазальная образует эндосперм (Loasaceae, некоторые Campanulaceae, Lamiaceae, Scrophulariaeae.
Также можно предложить халазальный без гаусториев подтип – эндосперм формируется преимущественно производными халазальной клетки (Austrobaileyaceae).
В подтипах целлюлярного типа можно выделить ряд вариаций11 по положению перегородок во время второго деления в эндосперме.
Микропилярный с халазальным гаусторием подтип:
Nymphaea-вариация22 – в микропилярной клетке происходят деления в различных направлениях, а халазальная клетка функционирует как гаусторий (рис. 3, A).
Рис. 3.
Целлюлярный тип, подтипы и вариации.
A – микропилярный с халазальным гаусторием подтип: Nymphaea-вариация; B – халазальный с микропилярным гаусторием подтип: a – Pedicularis-вариация, b – Pentaphragma-вариация; С – микропилярный с терминальными гаусториями подтип: a – Prunella-вариация, b – Callitriche-вариация; D – микропилярно-халазальный без гаусториев подтип: Annona-вариация; E – микропилярно-халазальный с терминальными гаусториями подтип: a – Phyteuma-вариация, b – Scutellaria-вариация. ch c – халазальная клетка, ch h – халазальный гаусторий, m c – микропилярная клетка, m h – микропилярный гаусторий (по: Shamrov, 2008, с изменениями).
Fig. 3. Cellular type with its subtypes and variations.
A – Micropylar with chalazal haustorium subtype: Nymphaea-variation; B – Chalazal with micropylar haustorium subtype: a – Pedicularis-variation, b – Pentaphragma-variation; С – Micropylar with terminal haustoria subtype: a – Prunella-variation, b – Callitriche-variation; D – Micropylar-chalazal without haustoria subtype: Annona-variation; E – Micropylar-chalazal with terminal haustoria subtype: a – Phyteuma-variation, b – Scutellaria-variation. ch c – chalazal cell, ch h – chalazal haustorium, m c – micropylar cell, m h – micropylar haustorium (after Shamrov, 2008, modified).
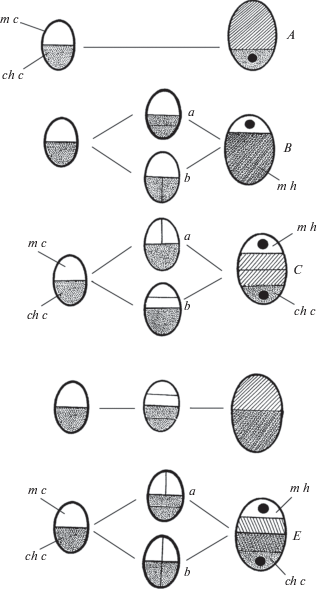
Микропилярный с терминальными гаусториями подтип:
Prunella-вариация – второе продольное деление происходит только в микропилярной клетке, образуется Т-образная триада клеток (Schnarf, 1929); включены Galeopsis-вариация (Schnarf, 1917), Alectorolophus-, Limosella-, Linaria- и Veronica-VI-вариации (Glišić, 1936–1937) (рис. 3, C, a);
Callitriche-вариация – второе поперечное деление происходит в микропилярной клетке, возникает линейная триада клеток (Jörgensen, 1923); включены Incarvillea-вариация (Mauritzon, 1935) и Stachys-вариация (Schnarf, 1917) (рис. 3, C, b).
Микропилярно-халазальный без гаусториев подтип:
Annona-вариация – второе деление в обеих клетках поперечное, образуется линейная тетрада клеток (Schnarf, 1929); включена Ceratophyllum-вариация (Schnarf, 1929); как производные вариации сюда могут быть отнесены Adoxa- и Lappula-вариации, характеризующиеся продольным или вариабельным заложением первой и ряда последующих перегородок на ранних стадиях эндоспермогенеза (Schnarf, 1929) (рис. 3, D).
Микропилярно-халазальный с терминальными гаусториями подтип:
Phyteuma-вариация – микропилярная клетка делится продольно, а халазальная – поперечно, что приводит к формированию обратно Т-образной тетрады клеток (Rosén, 1949); включена Isotoma-вариация (Rosén, 1949) (рис. 3, E, a);
Scutellaria-вариация – второе деление в обеих клетках продольное с образованием изобилатеральной тетрады клеток (Schnarf, 1917, 1929); включены Catalpa-вариация (Govindu, 1950), Codonopsis- и Sphenoclea-вариации (Rosén, 1949), Prolimosella-, Verbascum- и Veronica-I-V-вариации (Glišić, 1936–1937) (рис. 3, E, b).
Сюда можно также отнести Ericaceae- (Schnarf, 1929) и Azorina- (Shamrov, Zhinkina, 1994) вариации, самостоятельность которых является спорной. В этих вариациях первые стадии эндоспермогенеза идут в соответствии с Annona-вариацией (тетрада клеток линейная). Однако судьба производных микропилярной и халазальной клеток (образование терминальных гаусториев) позволяет рассматривать их в составе микропилярно-халазальныого с терминальными гаусториями подтипа.
Халазальный с микропилярным гаусторием подтип:
Pedicularis-вариация – делится поперечно только халазальная клетка, в результате чего образуется линейная триада клеток (Schnarf, 1917, 1929); включена Lavandula-вариация (Polishchyuk, Dzelvatovskii, 1971) (рис. 3, B, a);
Pentaphragma-вариация – в отличие от предыдущей вариации деление в халазальной клетке – продольное, а триада клеток является обратно Т-образной (Kapil, Vijayaraghavan, 1962, 1965) (рис. 3, B, b).
В халазальном без гаусториев подтипе вариации не выделяются (Floyd, Friedman 2000, 2001).
Подтипы в гелобиальном типе:
микропилярный с халазальным гаусторием (собственно гелобиальный тип) – эндосперм формируется из микропилярной клетки, а халазальная клетка трансформируется в гаусторий (Aponogetonaceae, Asphodelaceae, Costaceae, Hydrocharitaceae, Limnocharitaceae, Phormiaceae, Pontederiaceae, Potamogetonaceae, Ruppiaceae, Zannicheliaceae, некоторые Cabombaceae, Nymphaeaceae);
микропилярный без гаусториев (= нуклеарный тип) – во время раннего развития в первичной клетке эндосперма происходят только процессы кариокинеза (Brassicaceae, Cactaceae, Cyperaceae, Eriocaulaceae, Fabaceae, Gentianaceae, Poaceae, Restionaceae, Rosaceae, Zosteraceae).
В микропилярном с халазальным гаусторием подтипе гелобиального типа выделяются две вариации по числу ядер в халазальной клетке двуклеточного эндосперма:
Limnocharis33 (A-форма – Swamy, Parameswaran, 1963, или унинуклеарная – Shamrov, 1997c) – одно ядро в халазальной клетке (рис. 4, A);
Рис. 4.
Гелобиальный тип, подтипы и вариации.
A – микропилярный с халазальным гаусторием подтип: a – Limnocharis-вариация, b – Dianella-вариация; B – микропилярный без гаусториев подтип (собственно нуклеарный тип). ch c – халазальная клетка, ch h – халазальный гаусторий, m c – микропилярная клетка (по: Shamrov, 2008, с изменениями).
Fig. 4. Helobial type with its subtypes and variations.
A – Micropylar with chalazal haustorium subtype: a – Limnocharis- variation, b – Dianella-variation; B – Micropylar without haustoria subtype (Nuclear type proper). ch c – chalazal cell, ch h – chalazal haustorium, m c – micropylar cell (after: Shamrov, 2008, modified).

Dianella44 (B-E-формы – Swamy, Parameswaran, 1963, или полинуклеарная – Shamrov, 1997c) – много ядер в халазальной клетке (рис. 4, B).
В микропилярном без гаусториев подтипе выделение вариаций затруднено (рис. 4, C), так как нет четких критериев для их разделения. Некоторые авторы (Rocén, 1927) в зависимости от способа перехода свободноядерной стадии развития к клеточной различают у центроспермных несколько типов (вариаций) клеткообразования.
Возможные эволюционные направления развития эндосперма. Становление существующих типов развития эндосперма происходило сопряженно с окружающими тканями семязачатка и семени. Наибольшее значение, вероятно, имели взаимосвязи эндосперма с зародышем, с одной стороны, и антиподами, а с другой, обусловленные спецификой транспорта питательных веществ в семязачатке и семени через систему последовательно функционирующих специализированных гаусториальных структур.
Эволюция эндосперма двудольных и однодольных растений происходила, вероятно, независимо. Об этом свидетельствует, прежде всего, распределение типов эндосперма. Для однодольных характерны гелобиальный (34 семейства) и нуклеарный (30 семейств), а для двудольных – нуклеарный (156 семейств) и целлюлярный (135 семейств) типы развития эндосперма (Kamelina, 1991). При этом у примитивных однодольных эндосперм преимущественно гелобиальный, реже нуклеарный, а у продвинутых – только нуклеарный тип эндосперма; у примитивных двудольных наряду с целлюлярным эндоспермом широко распространен нуклеарный эндосперм, тогда как у продвинутых таксонов – либо нуклеарный, либо целлюлярный с гаусториями.
Вопросы эволюционного становления типов развития эндосперма цветковых растений до сих пор дискутируются (Maheshwari, 1950; Wunderlich, 1959; Dahlgren, 1991; Teryokhin, 1996; Zhukova, 1997; Baroux et al., 2002). В качестве исходного типа одни авторы (Schnarf, 1929; Sporne, 1954; Khudyak, 1963; Poddubnaja-Arnoldi, 1976; Battaglia, 1980; Vijayaraghavan, Prabhakar, 1984; Kamelina, 1991) рассматривают нуклеарный, а другие (Coulter, Chamberlain, 1903; Swamy, Ganapathy, 1957; Bhatnagar, Sawhney, 1981; Friedman, 1994, 1995) – целлюлярный. Существует точка зрения, что оба типа возникли одновременно (Palm, 1915; Kordyum, 1978). Также обсуждается вопрос о том, какой из вариантов эндосперма (триплоидный или диплоидный) является анцестральным (Baroux et al., 2002).
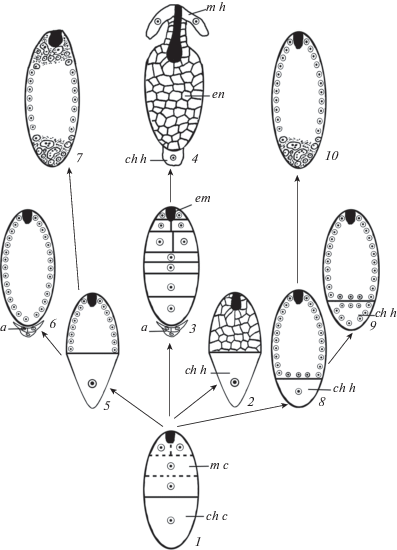
По нашему мнению, исходным является эндосперм, развитие которого характеризуется признаками целлюлярного и гелобиального типов (несбалансированность карио- и цитокинеза в микропилярной клетке двуклеточного эндосперма) (рис. 5, 1). Такое своеобразное развитие эндосперма отмечено у представителей ряда семейств, и эти примеры были обсуждены ранее. Разнообразие типов формирования (три типа развития) описано в сем. Nymphaeaceae (Batygina, Shamrov, 1985). У большинства видов выявлен целлюлярный, однако у Nymphaea stellata Willd. (Khanna, 1967) – гелобиальный, а у Euryale ferox Salisb. – нуклеарный (Khanna, 1964) типы. Гелобиальный тип обнаружен также у представителей сем. Cabombaceae (Batygina, Shamrov, 1985), входящего, как и сем. Nymphaeaceae, в порядок Nymphaeales (APG III, 2009).
Рис. 5.
Схема возможных направлений эволюции эндосперма у цветковых растений (объяснение в тексте).
a – антиподы, ch c – халазальная клетка, ch h – халазальный гаусторий, em – зародыш, en – эндосперм, m c – микропилярная клетка, m h – микропилярный гаусторий.
Fig. 5. Scheme of possible evolutionary trends of endosperm in flowering plants (see the text for explanation).
a – antipodals, ch c – chalazal cell, ch h – chalazal haustorium, em – embryo, en – endosperm, m c – micropylar cell, m h – micropylar haustorium.
Следует отметить, что представителей семейства Hydatellaceae на основании современных молекулярно-генетических данных также включают в пор. Nymphaeales (Stevens, 2007; APG IV, 2016). У них был обнаружен моноспорический униполярный 4-клеточный зародышевый мешок (Rudall et al., 2008), как и у ранее исследованных видов пор. Austrobaileyales (Friedman et al., 2003; Tobe et al., 2007). Обычно его описывают в рамках Oenothera-типа из микропилярной мегаспоры триады или тетрады мегаспор. У видов семейств Cabombaceae, Nymphaeaceae и Hydatellaceae зародышевый мешок возникает из халазальной мегаспоры, подобно Polygonum-типу развития. Выявлены корреляции в способе формирования зародышевого мешка и состоянием нуцеллуса. При Oenothera-типе в массивной микропилярной зоне нуцеллуса, включая париетальную ткань, накапливаются питательные вещества (Chudzik, Śnieźko, 1999). Ранняя лигнификация клеток гипостазы и отложение в них танинов блокируют поступление метаболитов из проводящего пучка, что приводит к смене базального транспорта на апикальный транспорт через париетальную ткань. У большинства изученных представителей сем. Nymphaeaceae (cюда включено монотипное сем. Barclayaceae c родом Hydrostemma) париетальная ткань дегенерирует во время развития зародышевого мешка, что делает невозможным осуществление апикального транспорта. Это коррелирует с формированием моноспорического зародышевого мешка Schizandra-, а не Oenothera-типа, поскольку функциональной в тетраде или триаде является не микропилярная, а халазальная мегаспора (Winter, Shamrov, 1991a, b; Shamrov, Winter, 1991; Winter, 1993). На примере Nuphar lutea (L.) Sm. было показано, что в ходе развития происходит усиленный рост формирующегося зародышевого мешка (его халазальный полюс становится заостренным) сначала в направлении микропиле, а затем халазы. Процесс сопровождается деструкцией клеток постамента (Shamrov, 1998b), что позволяет рассматривать халазальный полюс зародышевого мешка как гаусторий. Таким образом, трудно согласиться с существующей точкой зрения о том, что диплоидный эндосперм, возникающий на базе униполярного 4‑клеточного зародышевого мешка, является анцестральным (Baroux et al., 2002). Такой эндосперм (образуется при слиянии центральной клетки, содержащей одно полярное ядро, со спермием) возник в эволюции при постепенной дегенерации халазального полюса зародышевого мешка и замене функции антипод либо в ходе ранней специализации функциональной мегаспоры и развивающего зародышевого мешка как халазального гаустория (Nymphaeaceae), либо смены путей транспорта метаболитов в формирующийся зародышевый мешок с базального (через антиподы) на апикальный (через париетальную ткань) (Onagraceae).
В дальнейшем было выявлено, что формирование целлюлярного эндосперма с халазальным гаусторием и наличие перисперма и оперкулума в семени характерно не только для сем. Nymphaeaceae, но и сем. Hydatellaceae (Rudall et al., 2009). По мнению этих авторов, раннее состояние эндосперма у Trithuria (Hydatellaceae) и кувшинковых, а именно наличие халазального гаустория, напоминает гелобиальный эндосперм многих однодольных. По сравнению с ними при сходном развитии зародышевого мешка у представителей пор. Austrobaileyales эндосперм семени образуется не за счет производных микропилярной клетки, а только халазальной клетки, при этом гаусторий отсутствует (Floyd, Friedman, 2000, 2001).
У двудольных наиболее близок к анцестральному целлюлярный эндосперм Fouqieriaceae и Saururaceae, который образуется за счет делений микропилярной клетки, а халазальная клетка трансформируется в гаусторий (микропилярный с халазальным гаусторием подтип) (рис. 5, 2). Значительно большее значение в эволюции имел эндосперм, формирующийся за счет делений обеих клеток (первичных микропилярной и халазальной). Он характеризовался меньшей степенью тканевой дифференциации, при этом отсутствовали такие специализированные структуры, как гаустории (микропилярно-халазальный без гаусториев подтип) (Ceratophyllaceae, Monimiaceae, Nelumbonaceae, Winteraceae). Отсутствие гаусториев в этом случае компенсируется формированием крупных, долго сохраняющихся антипод (иногда они увеличиваются в числе), которые участвуют в обеспечении питательными веществами растущего эндосперма на первых стадиях развития (рис. 5, 3). На основе этого в дальнейшем мог сформироваться эндосперм с терминальными гаусториями. В гаустории трансформируются либо верхние производные обеих клеток (микропилярно-халазальный с микропилярным и халазальным гаусториями подтип – Campanulaceae, Lentibulariaceae, Lobeliaceae), либо один из них, халазальный гаусторий, является прямым продолжением одноименной клетки (микропилярный с микропилярным и халазальным гаусториями подтип – Gesneriaceae, Plantaginaceae) (рис. 5, 4). На базе эндосперма, относящегося к микропилярно-халазальному без гаусториев подтипу, мог возникнуть также эндосперм ряда таксонов, характеризующийся продольным или вариабельным заложением первой и последующих перегородок – от поперечного через наклонное до продольного (некоторые Adoxaceae, Asteraceae Boraginaceae, Chloranthaceae, Circaeasteraceae, Diapensiaceae, Dipsacaceae, Piperaceae, Valerianaceae).
Нуклеарный эндосперм у двудольных растений, предположительно, возник в результате постепенной редукции халазальной клетки, функцию которой стали выполнять другие структуры, например, антиподы (Casuarinaceae, Myricaceae, Myristicaceae, Ranunculaceae, некоторые Hamamelidaceae, Papaveraceae и др.). Дальнейшая эволюция была связана с гетероморфностью и гетерополярностью эндосперма и функционированием его микропилярного и халазального районов как гаусториев (рис. 5, 7). Более плотная цитоплазма и скопления ядер, часто гипертрофированных и полиплоидных, обнаруживаются либо только на халазальном полюсе (Aizoaceae, Gentianaceae, Polygonaceae, Rosaceae, Sapindaceae и др.), либо на обоих полюсах (Brassicaceae, Caricaceae, Sterculiaceae и др.), при этом на халазальном полюсе клеткообразование может не происходить, что приводит затем к формированию многоядерного халазального гаустория (Amaranthaceae, Elaeagnaceae, Fabaceae, Nyctaginaceae, Rhamnaceae). Прослеживается корреляция между наличием гаусториев в нуклеарном эндосперме и временем существования антипод. У растений с долго сохраняющимися антиподами эндосперм не образует гаусториев (рис. 5, 6), тогда как в случае эфемерных антипод гаустории и, прежде всего халазальный (рис. 5, 5), формируются.
При обсуждении направлений эволюции эндосперма у однодольных растений отметим пор. Alismatales, у видов которого обнаружены все типы эндосперма. Этот порядок очень обширный и включает 14 семейств (APG, 2016). Считают, что его представители, главным образом сем. Araceae, дали начало порядкам Acorales (одно сем. Acoraceae) и Petrosaviales (одно сем. Petrosaviaceae). У Lysichiton, Orontium, and Symplocarpus подсем. Orontioideae (базальной группы сем. Araceae), в отличие от ранее существовавших данных о нуклеарном эндосперме, было выявлено, что эндосперм является целлюлярным (Tobe, Kadokawa, 2010). У Acorus (сестринской группы для остальных однодольных) возникновение целлярного эндосперма коррелирует с наличием крупных антипод (Rudall, Furness, 1997) и отсутствием халазального эндоспермального гаустория (Floyd, Friedman, 2000). Сравнительный анализ с другими родственными однодольными показал, что признак наличия целлюлярного эндосперма является плезиоморфным для порядков Alismatales, Acorales и Petrosaviales. Эволюционные трансформации эндосперма происходили в них дважды от целлюлярного способа к нуклеарному: один раз они коснулись пор. Alismatales, а во второй раз нуклеарный эндосперм в качестве синапоморфного признака появился у 8 оставшихся порядков однодольных, включая Dioscoreales, Liliales, Asparagales и Poales. Гелобиальный эндосперм затронул всех однодольных и возник независимо (Tobe, Kadokawa, 2010).
У однодольных растений на базе исходного варианта в микропилярной, а иногда и халазальной, клетке стали происходить преимущественно процессы кариокинеза. И, таким образом, первоначально преимущественное развитие получил гелобиальный тип эндосперма (рис. 5, 8, 9). Дальнейшая эволюция происходила, вероятно, в направлении постепенной редукции его халазальной клетки и становления нуклеарного эндосперма (рис. 5, 10). Об этом свидетельствует, например наличие обоих типов развития эндосперма в ряде семейств (Alismataceae, Amaryllidaceae, Asparagaceae, Liliaceae, Melanthiaceae и др.). Функцию халазальной клетки, выполняющей роль гаустория, стал осуществлять весь халазальный полюс нуклеарного эндосперма. В халазальной части эндосперма ряда таксонов (Iridaceae, Juncaginaceae, Najadaceae, Zosteraceae и др.) отмечены более плотная цитоплазма и скопления ядер, часто неправильной формы, иногда формируется гаусторий (Arecaceae, Commelinaceae и др.). Возникновение нуклеарного эндосперма у однодольных коррелирует с общей редукцией семязачатка, становлением тенуинуцеллятности и формированием двуслойных интегументов (Shamrov, 1997e, 1998a, 2000, 2008).
Сравнительный анализ классификаций типов развития зародыша и эндосперма. Как мы уже отмечали, принципы классификаций типов развития зародыша и эндосперма сходны. Однако между этими системами существуют значительные различия, особенно в плане оценки уровня иерархии (типов, подтипов и вариаций) для целей систематики и филогении.
Используемая в современной литературе классификация типов развития зародыша (Jonansen, 1950), представляет собой трансформированный вариант существовавших ранее классификаций. E. Carano (1915) впервые предложил различать два типа: Cruciferae-тип (эмбриогенез Capsella bursa-pastoris) и Asteraceae-тип (эмбриогенез представителей сем. Asteraceae). Эти типы выделены, исходя из особенностей строения четырехклеточного зародыша и последовательности делений его клеток в ходе дальнейшего развития. Позже A. Chiarugi (1925) на основании специфики строения тетрады клеток зародыша, а также степени участия апикальной и базальной клеток в построении зародыша обосновал необходимость выделения еще Solanaceae- и Chenopodiaceae-типов. В последний он включил эмбриогенез представителей сем. Caryophyllaceae. K. Schnarf (1929) дал иное толкование критерия, касающегося участия базальной клетки в построении зародыша. В типах, предложенных Chiarugi (1925), базальная клетка принимает участие в образовании органов зародыша. Поскольку у представителей сем. Caryophyllaceae базальная клетка не участвует в этом процессе, Schnarf (1929) предложил выделить его развитие в оригинальный Caryophyllaceae-тип. Всего в классификации представлено 5 типов развития зародыша, при этом деление зиготы происходит в поперечном направлении. D. Jonansen (1950) изменил названия типов эмбриогенеза и дополнил классификацию Piperad-типом (этот тип до сих пор плохо изучен и его сравнительный анализ с другими типами весьма затруднен) – зигота делится продольно.
Был выделен также Paeoniad-тип (Yakovlev, 1958), характеризующийся ценоцитным состоянием зародыша на ранних стадиях, образованием ценоцитно-клеточной структуры, на которой формируются несколько зародышеподобных структур. Одна из них развивается в хорошо дифференцированный зародыш. Возможно, что подобное развитие зародыша происходит партеногенетически, поскольку у Paeonia lactiflora Pall. при развитии множественного археспория мегаспороциты в халазальной части нуцеллуса проходят нормальный мегаспорогенез, а другие мегаспороциты в микропилярной части вступают на путь апомейоза и становятся инициалями диплоспорических зародышевых мешков. В ходе развития большинство зародышевых мешков дегенерирует. Остается один зародышевый мешок неизвестной природы (с участием или без участия мейоза), в котором яйцеклетка без оплодотворения, возможно, развивается по пути партеногенеза (Shamrov, 1997d). Пыльцевые трубки отмечались в микропиле и верхней части зародышевого мешка, что позволяет предположить у Paeonia наличие псевдогамии. Еще один Graminad-, или Poad-тип выделен на основании наклонного положения перегородок в раннем периоде формирования зародыша и специфике его органогенеза на последующих этапах развития (Batygina, 1974).
На современном этапе развития эмбриологии обычно используют только cистему D. Johansen (1950), которая включает 5 типов: Asterad-, Caryophyllad-, Chenopodiad-, Onagrad- и Solanad. В каждом типе на основании характера первых делений в проэмбрио, числа этажей в нем, строения органов формирующегося зародыша (эти признаки не являются универсальными и в каждом случае указывают лишь на некоторые особенности эмбриогенеза) различают разное число вариаций. Именно поэтому они не могут использоваться для целей систематики и филогении. Существует еще система типов эмбриогении, предложенная R. Souèges (1939), однако она сложна для восприятия и почти не используется в настоящее время.
При анализе систем развития эндосперма и зародыша рассмотрим предложенную нами классификацию типов развития эндосперма и классификацию типов эмбриогенеза Johansen (1950). В обеих системах деления первичной клетки эндосперма и зиготы происходят, как правило, поперечно. В литературе есть данные, свидетельствующие о том, что первое деление может быть продольным или наклонным, или даже не сопровождаться образованием перегородки. Примеры подобного развития эндосперма были рассмотрены выше. Об особых типах эмбриогенеза мы также уже упоминали (Paeoniad-, Piperad-, Poad-типы). Таким образом, в результате первого деления у многих покрытосеменных растений возникают 2 клетки (микропилярная и халазальная применительно к эндосперму и апикальная и базальная применительно к зародышу) (рис. 6, 1–3). Именно после этого начинается процесс диверсификации.
Рис. 6.
Схема возможных взаимосвязей между развитием зародыша и эндосперма.
1 – инициальная клетка зародыша (зигота) или эндосперма (первичная клетка эндосперма); 2 – диада клеток (апикальная и базальная клетки в зародыше и микропилярная и халазальная в эндосперме); 4, 6, 9, 11, 12, 17, 18 – тетрады или триады клеток; 3, 5, 8, 10, 13, 14–16, 19 – вклад апикальной и базальной клеток в построение зародыша, а также микропилярной и халазальной клеток в образование эндосперма; 7 – стадия развития эндосперма. ch c – халазальная клетка, ch h – халазальный гаусторий, m c – микропилярная клетка, m h – микропилярный гаусторий. Точками показаны производные апикальной и микропилярной клеток, а белым – производные базальной и халазальной клеток. Последовательные стадии формирования обозначены стрелками. Пунктирными стрелками показаны возможные способы развития.
Fig. 6. Scheme of possible interconnections between embryo and endosperm development.
1 – initial cell of embryo (zygote) or endosperm (primary cell of endosperm); 2 – dyad of cells (apical and basal cells in embryo, and micropylar and chalazal ones in endosperm); 4, 6, 9, 11, 12, 17, 18 – tetrads or triads of cells; 3, 5, 8, 10, 13, 14–16, 19 – contribution of apical and basal cells in embryo construction, and of micropylar and chalazal cells in endosperm formation; 7 – development stage of endosperm. ch c – chalazal cell, ch h – chalazal haustorium, m c – micropylar cell, m h – micropylar haustorium. The derivatives of the apical and micropylar cells are shown in dotted filling, and the derivatives of the basal and chalazal cells – in white. Successive stages of formation are shown by arrows. Dotted arrows show possible ways of development.

Деления осуществляются в обеих клетках (целлюлярный) либо в них или хотя бы в микропилярной клетке происходят ядерные деления (гелобиальный) типы эндосперма. Формально после стадии 2-клеточного проэмбрио Asterad-, Caryophyllad-, Chenopodiad-, Onagrad- и Solanad- типы не идентифицируются. Существующие способы развития зародыша образуют кластеры, которые различаются комплексом признаков. В Onagrad- и Asterad-типах в результате деления апикальной (продольно) и базальной (поперечно) клеток формируется Т-образная тетрада клеток. В Solanad-, Chenopodiad- и Caryophyllad-типах 4 клетки, возникающие в ходе второй генерации, располагаются линейно. При анализе вклада производных апикальной и базальной клеток в построение органов зрелого зародыша состав кластеров меняется. При Onagrad- и Solanad-типах основная часть зародыша образуется из дериватов апикальной клетки, тогда как из производных базальной клетки возникают гипофизис и подвесок; при Asterad- и Chenopodiad-типах обе клетки принимают более или менее равное участие в организации зародыша, при этом из апикальной клетки возникают семядоли и апекс побега, а из базальной – гипокотиль, зародышевый корень и подвесок; при Caryophyllad-типе основные структуры зародыша формируются на базе апикальной клетки, а базальная клетка дает лишь часть подвеска. Следовательно, типам развития эндосперма соответствуют не “типы” эмбриогенеза, а иной статус. Оба признака при выделении типов эмбриогенеза (вклад производных апикальной и базальной клеток в построение зародыша; характер делений апикальной и базальной клеток и форма тетрады) используются нами при характеристике подтипов (вклад производных микропилярной и халазальной клеток) и вариаций (характер делений микропилярной и халазальной клеток и форма тетрады) эндосперма.
Поскольку в формирующемся семени возникают структуры, выполняющие сходные функции в транспорте метаболитов, то их наличие (гаустории и подвесок) позволяет нам также проводить сравнительный анализ между двумя системами развития эндосперма и зародыша. Однако, при таком рассмотрении из типов эндосперма исключается гелобиальный, поскольку после стадии двух клеток в последних обычно происходят ядерные деления. Кроме того, в зародыше, как правило, присутствует один вариант гаустория – подвесок, сравнимый с халазальным гаусторием.
В эндосперме могут формироваться халазальный и микропилярный (терминальные) гаустории. Тем не менее аналогично выделенным подтипам в целлюлярном типе эндосперма (по степени участия микропилярной и халазальной клеток в построении эндосперма), микропилярный с халазальным гаусторием подтип (эндосперм формируется за счет микропилярной клетки, а халазальная клетка функционирует как гаусторий) сопоставим с Caryophyllad-типом эмбриогенеза (у последнего базальная клетка входит в состав подвеска). Поскольку деления в микропилярной клетке эндосперма происходят в разных направлениях, в том числе и наклонно, то форму тетрады трудно определить. Поэтому такой подтип эндосперма представлен лишь одной Nymphaea-вариацией (рис. 6, 3). Второй микропилярно-халазальный без гаусториев подтип эндосперма (обе клетки принимают почти равное участие в образовании эндосперма) можно сравнить с Asterad- и Chenopodiad-типами. При этом наличие единственной Annona-вариации в микропилярно-халазальном без гаусториев типе эндосперма (второе деление в обеих клетках поперечное, возникает линейная тетрада клеток) характеризует только Chenopodiad-тип эмбриогенеза (рис. 6, 9, 10). У представителей сем. Ceratophyllaceae с Asterad-типом эмбриогенеза (Т-образная тетрада клеток проэмбрио) нет гаусториев не только при образовании эндосперма, но и при формировании зародыша (подвесок отсутствует) (Shamrov, Batygina, 1994). Хотя эндосперм у Ceratophyllum после двух генераций представлен линейной тетрадой, после третьей генерации в самой верхней клетке происходит продольное деление (рис. 6, 7, 8). Следовательно, эндосперм начинает напоминать строение зародыша с Asterad- типом эмбриогенеза (Т-образная тетрада клеток проэмбрио). Среди растений с Asterad- и Chenopodiad-типами эмбриогенеза есть такие, которые характеризуются подвеском (Amaranthaceae, Asteraceae, Chenopodiaceae). Таким образом, строение и развитие их зародыша можно сравнить с микропилярно-халазальным с терминальными гаусториями подтипом целлюлярного типа эндосперма: микропилярная клетка делится продольно, а халазальная – поперечно (Т-образная тетрада клеток, Phyteuma-вариация), как при Asterad-типе эмбриогенеза (рис. 6, 5, 6), второе деление в обеих клетках продольное (изобилатеральная тетрада, Scutellaria-вaриация), как в Chenopodiad-типе (тетрада клеток сначала линейная, но уже на стадии октантов апикальная часть зародыша напоминает изобилатеральную тетраду) (рис. 6, 4, 5).
Микропилярный с терминальными гаусториями подтип (эндосперм формируется из нижних производных микропилярной клетки, а халазальная клетка, как и верхние производные микропилярной клетки образуют терминальные гаустории) близок к Onagrad- и Solanad-типам эмбриогенеза. При этом Prunella-вариация (второе продольное деление происходит только в микропилярной клетке, образуется Т-образная триада клеток) близка к Onagrad-типу эмбриогенеза (рис. 6, 11, 13), а Callitriche-вариация (второе поперечное деление происходит в микропилярной клетке, возникает линейная триада клеток) – к Solanad-типу (рис. 6, 12, 13).
Следует отметить, что Caryophyllad-тип эмбриогенеза (апикальная клетка образует тело зародыша, а базальная – только часть подвеска) сравним с гелобиальным эндоспермом (микропилярная клетка образует собственно эндосперм, а халазальная – халазальный гаусторий (одноядерный гаусторий – Limnocharis-вариация, многоядерный гаусторий – Dianella-вариация; халазальная клетка редуцируется в ходе онто- или филогенеза – собственно нуклеарный эндосперм) (рис. 6, 14–16). Кроме этого, среди моделей эмбриогенеза нет таких, которые были бы похожи на ранних стадиях на халазальный с микропилярным гаусторием подтип целлюлярного эндосперма: халазальная клетка делится поперечно, линейная триада клеток, Pedicularis-вариация; халазальная клетка делится продольно, обратно Т-образная триада клеток, Pentaphragma-вариация (рис. 6, 17–19). Подобное можно предположить и для халазального без гаусториев подтипа. В этом случае собственно эндосперм формируется только из производных халазальной клетки. Примеры такого способа развития зародыша не известны.
Таким образом, при сравнительном анализе цветковых растений из особенностей развития зародыша чаще всего используют типы эмбриогенеза. Что касается эндосперма, то, как мы и отмечали, типам его развития соответствуют не “типы” эмбриогенеза, а иной статус. Прежде всего, в этот анализ можно включить целлюлярный способ развития эндосперма, которому некоторые авторы (Di Fulvio, 1983; Di Fulvio, Cocucci, 1986) придавали статус мегатипа из 5 типов и 12 подтипов. Однако типы и подтипы этими авторами недостаточно обоснованы, при этом не использованы литературные данные о наличии разных способов (форм, вариаций) эндосперма. Не прибегая к использованию категории мегатипа, типы эмбриогенеза можно сравнивать с подтипами (6) и даже вариациями (8) целлюлярного типа эндосперма, при этом оба признака (вклад производных микропилярной и халазальной клеток в построение эндосперма; характер делений этих клеток и форма тетрады) следует учитывать одновременно. Видимо, также можно учитывать и возможности гелобиального эндосперма – наличие 2 подтипов и 2 вариаций.
ЗАКЛЮЧЕНИЕ
Проведенное исследование по сравнительному анализу развития и строения эндосперма и зародыша выявило большое число черт сходства между ними. С одной стороны, это подтверждает мнение ряда авторов, что двойное оплодотворение у цветковых растений можно сравнить с полиэмбрионией, при этом эндосперм уподоблен одному из зародышей. Однако для эндосперма характерны некоторые признаки, которые отсутствуют при развитии зародыша: наличие микропилярного гаустория, возможность формирования собственно эндосперма из производных халазальной клетки. Особенность развития и функционирования эндосперма проявляется также в изменении потоков метаболитов после оплодотворения. На примере Luzula pedemontana Boiss et Reut. (Juncaceae) было показано, что уже в период зиготогенеза начинаются активные процессы деструкции нуцеллуса и внутреннего интегумента и в развивающемся семени устанавливаются два пути поступления метаболитов: более интенсивный базальный – через проводящий пучок, гипостазу, подиум, антиподы и базальную камеру эндосперма в микропилярную камеру (собственно эндосперм), и менее интенсивный апикальный – через париетальную ткань из окружающих клеток нуцеллуса в развивающийся зародыш, базальная клетка которого снабжена мощной полисахаридной оболочкой с протуберанцами. К стадии глобулярного зародыша происходит снижение интенсивности потока веществ из проводящего пучка, вызванное лигнификацией стенок и накоплением танинов в клетках гипостазы. В ходе дальнейшего развития семени потоки метаболитов как в эндосперм, так и зародыш обеспечиваются преимущественно ресурсами самого семени (Shamrov, 2008). У Tropaeolum majus L. (Tropaeolaceae) было выявлено, что клетки подвеска на глобулярной стадии зародыша характеризуются высоким содержанием пероксидазы. Со стадии сердечка активность этого фермента отмечалась лишь в клетках собственно зародыша. Кроме того, происходит разрушение изоляционного слоя зародыша – кутикулы, покрывающей наружные тангентальные стенки клеток эпидермы (Singh et al., 1979). В эндосперме вокруг зародыша возникает зона лизиса. Все это свидетельствует об изменении пути транспорта метаболитов в развивающийся зародыш: вещества начинают поступать апопластически через эпидерму зародыша из окружающих клеток эндосперма, а не через суспензор. Можно предположить, что эндосперм, как питательная ткань, начинается использоваться только на поздних стадиях эмбриогенеза. До этого он сам формируется и участвует в обеспечении и распределении сигналов, регулирующих процессы дифференциации и органогенеза зародыша. Как было отмечено ранее, в отсутствии эндосперма глобулярный зародыш останавливается в развитии. Известно, что это одна из критических стадий эмбриогенеза (Meinke, 1991). Эта особенность наблюдается и при апомиксисе. Партеногенетический глобулярный зародыш не приступает самостоятельно к дифференциации и ожидает момента, когда в результате псевдогамии (после оплодотворения центральной клетки) сформируется эндосперм и запустит этот процесс (Yudakova et al., 2018). В случае адвентивной эмбрионии нуцеллярные и интегументальные соматические зародыши заменяют остановившийся в развитии зиготический зародыш только при наличии эндосперма половой природы (Shamrov, 2019).
Ранее в нашем исследовании (Shamrov, 2020) было высказано предположение, как важно выявить дублирующие механизмы у цветковых растений, которые при отсутствии эндосперма или нарушениях в процессе слияния спермия и центральной клетки, также участвуют в обеспечении и распределении сигналов, регулирующих процессы дифференциации и органогенеза зародыша. Современные исследования свидетельствуют о том, что к числу таких сигналов относятся дипептиды, фитогормоны, центральную роль среди которых играет ауксин (Costa et al., 2014; Locascio et al., 2014; Doll et al., 2017). У мутантов Arabidopsis thaliana (L.) Heynh. (Brassicaceae) было выявлено, что до оплодотворения ауксин присутствует преимущественно в нуцеллусе, при этом он не обнаружен в функциональной мегаспоре. Градиент ауксина обусловливает спицификацию клеток в зрелом зародышевом мешке. Он возрастает от антипод до клеток яйцевого аппарата, при этом больше всего ауксин аккумулируется в синергидах (Pagnussat et al., 2009). Важную роль в развитии, вероятно, выполняют и цитокинины (Terceros et al. 2020). У растений с эфемерными антиподами, которые участвуют в создании пула ауксина до оплодотворения, эту функцию после оплодотворения начинают выполнять халазальные гаустории, обеспечивая развитие зародыша сигнальными молекулами. У растений с длительно существующими антиподами и без халазальных эндоспермальных гаусториев, антиподы продолжают поставлять фитогормоны в зародыш опосредованно через эндосперм, даже если эндосперм развивается автономно, как при некоторых формах апомиксиса, например, в семействах Asteraceae, Rosaceae (Kamelina, 2009). Как было показано нами (Shamrov, 1998b), у Nuphar lutea при отсутствии антипод халазальный полюс зародышевого мешка еще до оплодотворения функционирует как гаусторий, на месте которого появляется халазальный гаусторий эндосперма. Подобное, вероятно, присуще представителям сем. Podostemaceae, которые также лишены антипод, при этом функцию эндосперма выполняет “нуцеллярный плазмодий”, который образуется из клеток халазальной области нуцеллуса (Kapil, 1970; Arekal, Nagendran, 1975).
Исследование по анализу особенностей развития зародыша и эндосперма у цветковых растений выявило комплекс признаков, которые могут быть использованы для целей систематики и филогении.
На основании особенностей развития зародыша можно выделить 2 группы типов эмбриогенеза. Группа I – типы эмбриогенеза с поперечным делением зиготы: Onagrad-тип (2-я генерация эмбриогенеза завершается образованием Т-образной тетрады клеток, большая часть зародыша возникает из производных апикальной клетки), Asterad-тип (2-я генерация эмбриогенеза завершается образованием Т-образной тетрады клеток, производные апикальной и базальной клеток принимают равное участие в формировании зародыша), Solanad-тип (2-я генерация эмбриогенеза завершается образованием линейной тетрады клеток, большая часть зародыша возникает из производных апикальной клетки), Chenopodiad-тип (2-я генерация эмбриогенеза завершается образованием линейной тетрады клеток, производные апикальной и базальной клеток принимают равное участие в формировании зародыша), Caryophyllad-тип (2-я генерация эмбриогенеза завершается образованием линейной триады клеток, базальная клетка не делится, большая часть зародыша возникает из производных апикальной клетки). Группа II – типы эмбриогенеза с непоперечным делением зиготы: Piperad-тип (продольное деление зиготы и ее производных), Paeoniad-тип (образование ценоцитной структуры на первых стадиях деления зиготы), Poad-тип (наклонные деления на первых стадиях деления зиготы и ее производных), новые типы с иным характером деления зиготы и ее производных.
На основании особенностей развития эндосперма можно также выделить 2 группы типов. Группа I – типы эндоспермогенеза с поперечным делением первичной клетки эндосперма: подгруппа a (целлюлярный эндосперм) – микропилярный с халазальным гаусторием подтип (в микропилярной клетке происходят деления в различных направлениях, а халазальная клетка функционирует как гаусторий, Nymphaea-вариация), микропилярный с терминальными гаусториями подтип (второе продольное деление происходит только в микропилярной клетке, образуется Т-образная триада клеток, Prunella-вариация), микропилярный с терминальными гаусториями подтип (второе поперечное деление происходит в микропилярной клетке, возникает линейная триада клеток, Callitriche-вариация), микропилярно-халазальный без гаусториев подтип (второе деление в обеих клетках поперечное, образуется линейная тетрада клеток, Annona-вариация), микропилярно-халазальный с терминальными гаусториями подтип (микропилярная клетка делится продольно, а халазальная – поперечно, что приводит к формированию обратно Т-образной тетрады клеток, Phyteuma-вариация), микропилярно-халазальный с терминальными гаусториями подтип (второе деление в обеих клетках продольное с образованием изобилатеральной тетрады клеток второе деление в обеих клетках продольное с образованием изобилатеральной тетрады клеток, Scutellaria-вариация), халазальный с микропилярным гаусторием подтип (делится поперечно только халазальная клетка, в результате чего образуется линейная триада клеток, Pedicularis-вариация), халазальный с микропилярным гаусторием подтип (деление в халазальной клетке – продольное, а триада клеток является обратно Т-образной, Pentaphragma-вариация), халазальный без гаусториев подтип (вариации не выделяются); подгруппа b (гелобиальный эндосперм): микропилярный с халазальным гаусторием подтип (эндосперм формируется из микропилярной клетки, а халазальная трансформируется в одноядерный гаусторий, Limnocharis-вариация), микропилярный с халазальным гаусторием подтип (эндосперм формируется из микропилярной клетки, а халазальная трансформируется в многоядерный гаусторий, Dianella-вариация), микропилярный без гаусториев подтип (эндосперм формируется из микропилярной клетки, а халазальная редуцируется в ходе филогенеза, собственно нуклеарный эндосперм). Группа II – типы эндоспермогенеза с непоперечным делением первичной клетки эндосперма: новые типы с иным характером деления этой клетки и ее производных.
Список литературы
[Andronova] Андронова Е.В. 2011. Летальные аномалии строения и развития зародыша у Dactylorhiza fuchsii (Orchidaceae). – Бот. журн. 96 (7): 858–863.
APG III. 2009. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG III. – Bot. J. Linn. Soc. 161: 105–121.
APG IV. 2016. An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. – Bot. J. Linn. Soc. 181 (1): 1–20. https://doi.org/10.1111/boj.12385.1
Arekal G.D., Nagendran C.R. 1975. Is there a Podostemon type of embryo sac in the genus Farmeria? – Caryologia. 28 (2): 229–235.
Baroux C., Fransz P., Grossniklaus U. 2004. Nuclear fusions contribute to polyploidization of the gigantic nuclei in the chalazal endosperm of Arabidopsis. – Planta. 220: 38–46.
Baroux C., Spillane C., Grossniklaus U. 2002. Evolutionary origins of the endosperm in flowering plants. – Genome Biology 3 (9): 1–5.
[Batygina] Батыгина Т.Б. 1974. Эмбриология пшеницы. Л. 206 с.
[Batygina, Samrov] Батыгина Т.Б, Шамров И.И. 1985. Сравнительная эмбриология порядков Nymphaeales и Nelumbonales и вопросы их систематики и филогении. – Бот. журн. 70 (3): 368–373.
Battaglia E. 1980. Embryological questions: 2. Is the endosperm of angiosperms sporophytic or gametophytic? – Ann. Bot. (London). 39 (1): 9–30.
Bhatnagar S.P., Sawhney V. 1981. Endosperm – its morphology, ultrastructure, histochemistry. – Int. Rev. Cytol. 73: 55–102.
Bhandari N.N., Anuradha Mal. 1989. Wall ingrowth or trabeculae in the free nuclear embryo sac of Scilla sibirica Sato. – Phytomorphology. 39 (1): 21–28.
[Butuzova] Бутузова О.Г. 2018. Особенности формирования семян у Pulsatilla vulgaris и Helleborus niger (Ranunculaceae) с доразвитием зародыша. – Бот. журн. 103 (3): 313–330. https://doi.org/10.1134/S0006813618030031
Carano E. 1915. Richerche sull’embriogenesi delle Asteraceae. – Ann. Bot. (Rome). 13 (2): 251–301.
Carmichael J., Friedman W. 1995. Double fertilization in Gnetum gnemon: the relationship between the cell cycle and sexual reproduction. – The Plant Cell. 7: 1975–1988.
Chiarugi A. 1925. Embryologia della Cistaceae. N. G. Bot. Ital. N.S. 32 (1): 223–314.
Chudzik B., Śnieźko R. 1999. Histochemical features signaling receptivity of ovules of Oenothera hookeri de Vries and Oe. mut. brevistylis. – Acta Biol. Cracov. Ser. Bot. 41: 119–129.
Costa L.M., Marshall E., Tesfaye M. et al. 2014. Flowering plants central cell-derived peptides regulate early embryo patterning in flowering plants. – Science. 344: 168–172.
Coulter J.M., Chamberlain C.J. 1903. Morphology of angiosperms. New York. 471 p.
Dahlgren G. 1991. Steps towards a natural system of the dicotyledons: embryological characters. – Aliso. 13 (1): 107–165.
Dahlgren K.V.O. 1934. Die Embryologie von Impatiens raylli. – Svensk Bot. Tidskr. 28 (1): 103–125.
Di Fulvio T.E. 1983. Los “tipos” de endosperma y de haustorios ensdospérmicos. Su clasificación. – Kurtziana. 16 (1–4): 7–31.
Di Fulvio T.E. 1985. El sistema EODP en el ordenamiento de Tubiflorae y en la endospermogenesis nuclear. – Anal. Acad. Nac. Cj. Exact., Buenos Aires. 37 (1–4): 111–119.
Di Fulvio T.E., Cocucci A.E. 1986. La endospermogenesis nuclear y el sistema EODP. – Kurtziana. 18 (1): 13–21.
Doll N.M., Depege-Fargeix N., Rogowsky P.M., Widiez T. 2017. Signaling in early maize kernel development. – Mol. Plant. 10: 375–388.
Floyd S.K., Friedman W.E. 2000. Evolution of endosperm developmental patterns among basal flowering plants. – Int. J. Plant Sci. 161: S57–S81.
Floyd S.K., Friedman W.E. 2001. Developmental evolution of endosperm in basal angiosperms: evidence from Amborella (Amborellaceae), Nuphar (Nymphaeaceae), and Illicium (Illiciaceae). – Plant Syst. Evol. 228: 153–169.
Friedman W.E. 1994. The evolution of embryogeny in seed plants and the developmental origin and early history of endosperm. – Am. J. Bot. 81 (11): 1468–1486.
Friedman W.E. 1995. Organismal duplication, inclusive fitness theory, and altruism: understanding the evolution of endosperm and the angiosperm reproductive syndrome. – Proc. Natl. Acad. Sci. (USA). 92: 3913–3917.
Friedman W.E., Gallup W.N., Williams J.H. 2003. Female gametophyte development in Kadsura: implications for Schizandraceae, Austrobaileyales, and the early evolution of flowering plants. – Int. J. Plant. Sci. 164 (Suppl.): S293–S305.
Friedman W.E., Williams J.E. 2004. Developmental evolution of the sexual process in ancient flowering plant lineages. – The Plant Cell. 16: 119–132.
[Gilbert] Гилберт С.Ф. Биология развития. 2003. СПб. 850 с.
Glišić L.M. 1936–1937. Ein Versuch der Verwertung der Endospermmerkmale für typologische und phylogenetische Zwecke innerhalb der Scrophulariaceen. – Bull. Inst. Jard. Bot. Univ. Belgrade. 4: 42–73.
Govindu H.S. 1950. Studies in the embryology of some members of the Bignoniaceae. – Proc. Indian Acad. Sci. 32 (4): 164–178.
Guo L., Jiang L., Lu X.-L., Liu C.-M. 2018. Anaphase promoting complex/cyclosome-mediated cyclin B1 degradation is critical for cell cycle synchronization in syncytial endosperms. – J. Integr. Plant Biol. 60 (6): 448–454.
Hara T., Katon H., Ogawa D., Kagaya Y., Sato Y., Nagato Y., Ishikawa R., Ono A., Kinoshita T., Hattori T. 2015. Rice SNF2 family helicase ENL1 is essential for syncytial endosperm development. – Plant J. 81: 1–12.
Herr J.M. 1961. A new clearing squash technique for the study of ovule development in angiosperms. – Am. J. Bot. 58: 785–790.
Herr J.M. Endosperm development in Arabidopsis thaliana (L.) Heynh. – Acta Biol. Crac., Ser. Bot. 1999. 41 (1): 103–109.
Johansen D.A. 1950. Plant embryology. Waltham MA. 305 p.
Johri B.M., Ambegaokar K.B., Srivastava P.S. 1992. Comparative embryology of angiosperms. Berlin etc. Vol. 1 and 2. 1221 p.
Jőrgensen C.A. 1923. Studies on Callitrichaceae. – Bot. Tidsskr. 38 (1): 81–126.
[Kamelina] Камелина О.П. 1991. Сравнительно-эмбриологический анализ как метод филогенетической систематики цветковых растений: Автореф. дис. … д-ра биол. наук. Ташкент, 1991. 80 с.
[Kamelina] Камелина О.П. 1997. О возможности выделения тубифлорального типа развития эндосперма. В кн.: Эмбриология цветковых растений. Терминология и концепции. СПб. Т. 2. С. 281–284.
[Kamelina] Kamelina O.P. 2009: Систематическая эмбрилогия цветковых растений. Двудольные. – Барнаул. 501 с.
Kapil R.N. 1970. Podostemaceae. – Bull. Indian Nat. Sci. Acad. 41: 104–109.
Kapil R.N., Vijayaraghavan M.R. 1962. Embryology and systematic position of Pentaphragma horsfieldii (Mig.) Airy. – Curr. Sci. 31 (7): 270–272.
Kapil R.N., Vijayaraghavan M.R. 1965. Embryology of Pentaphragma horsfieldii (Mig.) Airy Shaw with a discussion on the systematic position of the genus. – Phytomorphology. 15 (1): 93–102.
Karlström P.O. 1974a. Embryological studies in Acanthaceae. III. The genera Barleria L. and Grobbea Harv. – Svensk Bot. Tidskrift. 68 (2): 121–135.
Karlström P.O. 1974b. Embryological studies in Acanthaceae. IV. The genera Asystasia Bl. and Chamaeranthemum Nees. – Svensk Bot. Tidskrift. 68 (3): 325–328.
Khanna P. 1964. Morphological and embryological studies in Nymphaeaceae. I. Euryale ferox Salisb. – Proc. Indian Acad. Sci. 59 (4): 237–247.
Khanna P. 1967. Morphological and embryological studies in Nymphaeaceae. III. Victoria cruziana D’Orb and Nymphaea stellata Willg. – Bot. Mag. (Tokyo). 80 (950): 309–312.
[Khudyak] Худяк М.И. 1963. Эндосперм покрытосеменных растений (особенности развития и роль в плодообразовании). Киев. 184 с.
[Kordyum] Кордюм Е.Л. 1978. Эволюционная цитоэмбриология покрытосеменных растений. Киев. 219 с.
[Korobova-Semenchenko] Коробова-Семенченко Л.В. 1977. К эмбриологии семейства Saxifragaceae.VII.Отклонение при развитии эндосперма у Bergenia crassifolia (L.) Fritsch. – Вестн. Московск. ун-та. Сер. биол. 2: 81–84.
Lammeren van A.A. 1988. Structure and function of the tubular cytoskeleton during endosperm development in wheat: an immunofluorescence study. – Protoplasma. 146: 18–27.
Lammeren van A.A., Kieft H., Schel J.H.N. 1997. Light microscopical study of endosperm formation in Brassica napus L. – In: Embryology of flowering plants. Terminology and concepts. St. Petersburg. Vol. 2. P. 228–232.
Lawalrée A. 1952. L’embryology des Lemnaceae. Observation sur Lemna minor L. – Cellule. 54 (3): 305–326.
Liu C.M., Mc Elver J., Tzafrir I., Joosen R., Wittich P., Patton D., Lammeren van A.A.M., Meinke D. 2002. Condensin and cohesin knockouts in Arabidopsis exhibit a titan seed phenotype. – Plant J. 29: 405–415. https://doi.org/10.1046/j.1365-313x.2002.01224.x
Liu C.M., Meinke D. 1998.The titan mutants of Arabidopsis are disrupted in mitosis and cycle control during seed development. – Plant J. 16: 21–31.
Locascio A., Roig-Villanova I., Bernardi J., Varotto S. 2014. Current perspectives on the hormonal control of seed development in Arabidopsis and maize: a focus on auxin. – In: Frontiers in Plant Science. 5 (412): 1–22.
Madhavan R., Gupta S.C. 1982. Histochemical studies on postfertilized ovules of Peristrophe bicalyculata. 1. Total carbohydrates of insoluble polysaccharides. – Beitr. Biol. Pflanz. 57 (2): 309–321.
Maheshwari S.C., Khanna P.P. 1956. The embryology of Arisaema wallichianum, and the systematic position of the Araceae. – Phytomorphology. 6 (3–4): 379–388.
Mauritzon J. 1935. Etwas über Embryologie der Bignoniaceen. – Bot. Notis. S. 60–77.
Meinke D.W. 1991. Embryonic mutants of Arabidopsis thaliana. – Dev. Gen. 12: 382–392.
Mohan Ram H.Y. 1962. Post-fertilization development of the ovule in Barleria cristata. – J. Indian Bot. Soc. 41 (2): 288–296.
[Nawaschin] Навашин С.Г. 1898a. Новые наблюдения над оплодотворением у Fritillaria tenella и Lilium martagon. – В кн.: Дневник X съезда русских естествоиспытателей и врачей. Киев. Т. 6: 16–21.
Nawaschin S. 1898b. Resultate einer Revision der Befruchtungsvorgänge bei Lilium martagon und Fritillaria tenella. – Bull. Acad. Imp. Sci. St. Petersbourg. 9 (4): 377–382.
Nguyen H., Brown R.C., Lemmon B.E. 2002. Cytoskeletal organization of the micropylar endosperm in Coronopus didymus L. (Brassicaceae). – Protoplasma. 219: 210–220. https://doi.org/10.1007/s007090200022
Newcomb W. 1973. The development of the embryo sac of sunflower Helianthus annuus after fertilization. – Can. J. Bot. 51 (5): 879–890.
Pagnussat G.C., Alandete-Saez M., Bowman J.L., Sundaresan V. 2009. Auxin-dependent patterning and gamete specification in the Arabidopsis female gametophyte. – Science. 324: 1684–1689.
Palm B. 1915. Studien über Konstruktionstypen und Entwicklungswege des Embryosackes der Angiospermen. Diss. Stockholm. 185 S.
Parameswaran N. 1959. A contribution to the embryology of Theriophonum minutum Engl. – Proc. Indian Acad. Sci. 50 (1): 15–25.
[Poddubnaya-Arnoldi] Поддубная-Арнольди В.А. 1976. Цитоэмбриология покрытосеменных растений. Основы и перспективы. М. 507 с.
[Polishchyuk, Dzelvatovskii] Полiщук В.С., Дзелватовский А.К. 1971. До ембрiологii лаванды колосовой (Lavandula spica L.). – Укр. бот. журн. 28 (6): 778–781.
Rocén Th. Zur Embryologie der Centrospermen: Diss. Uppsala, 1927. 184 S.
Rosén W. 1949. Endosperm development in Campanulaceae and closely related families. – Bot. Notis. 2: 137–147.
Rudall P.J., Furness C.A. 1997. Systematics of Acorus: ovule and anther. – Int. J. Plant Sci. 158: 640–651.
Rudall P.J., Remizowa M.V., Beer A.S., Bradshaw E., Stevenson D.W., MacFarlane T.D., Tuckett R.E., Yadav S.R., Sokoloff D.D. 2008. Comparative ovule and megagametophyte development in Hydatellaceae and water lilies reveal a mosaic of features among the earliest angiosperms. – Ann. Bot. 101: 941–956. https://doi.org/10.1093/aob/mcn032
Rudall P.J., Eldridge T., Tratt J., Ramsay M.M., Tu-ckett R.E., Smith S.Y., Collinson M.E., Remizowa M.V., Sokoloff D.D. 2009. Seed fertilization, development and germination in Hydatellaceae (Nymphaeales): implications for endosperm evolution in early angiosperms. – J. Bot. 96 (9): 1581–1593.
Samuelsson G. 1913. Studien über die Entwicklungsgeschichte einiger Bicornes types. – Svensk Bot. Tidskr. 7 (2): 97–188.
Sampson F.B. 1969. Cytokinesis in pollen mother cells of angiosperms, with emphasis of Laurelia novazelandiae (Monimiaceae). – Cytologia. 34: 511–634.
[Savina, Poddubnaya-Arnoldi] Савина Г.И., Поддубная-Арнольди В.А. 1990. Семейство Orchidaceae. – В кн.: Сравнительная эмбриология цветковых растений. Butomaceae–Lemnaceae. Л. С. 172–179.
Schnarf K. 1917. Beiträge zur Kenntnis der Samenentwicklung der Labiaten. – Denkschr. Kaiser. Akad. Wissensch. Wien. 94. S. 211–275.
Schnarf K. 1929. Embryologie der Angiospermen. Berlin. 689 S.
[Shamrov] Шамров И.И. 1997a. Целлюлярный тип развития эндосперма. – В кн.: Эмбриология развития цветковых растений. Терминология и концепции. СПб. Т. 2. С. 220–228.
[Shamrov] Шамров И.И. 1997b. Гелобиальный тип развития эндосперма. – В кн.: Эмбриология развития цветковых растений. Терминология и концепции. СПб. Т. 2. С. 228–232.
[Shamrov] Шамров И.И. Новый подход к типизации эндосперма в связи с проблемой его эволюции. – В кн.: Эмбриология развития цветковых растений. Терминология и концепции. СПб. Т. 2. С. 284–290.
[Shamrov]. Шамров И.И. 1997d. Развитие семязачатка и семени у Paeonia lactiflora (Paeoniaceae). – Бот. журн. 82 (6): 24–46.
Shamrov I.I. 1997e. Nucellus typification and ovule classification. – Bull. Pol. Acad. Sci. 45 (2–4): 1–10.
Shamrov I.I. 1998a. Ovule classification in flowering plants – new approaches and concepts. – Bot. Jahrb. Syst. 120 (3): 377–407.
[Shamrov] Шамров И.И. 1998b. Формирование гипостазы, подиума и постамента в семязачатке Nuphar lutea (Nymphaeaceae) и Ribes aureum (Grossulariaceae). – Бот. журн. 83 (1): 3–14.
Shamrov I.I. 2000. The integument of flowering plants: developmental patterns and evolutionary trends. – Acta Biol. Cracov. Ser. Bot. 42 (2): 9–20.
[Shamrov] Шамров И.И. 2008. Семязачаток цветковых растений: строение, функции, происхождение. М. 356 с.
Shamrov I.I. 2019. Apomixis in plants and animal: embryological aspects. – In: Collection of scientific articles. Living systems-2019. Saratov. P. 51–52.
[Shamrov] Шамров И.И. 2020. Типы оплодотворения у цветковых растений. – Бот. журн. 105 (3): 3–27. https://doi.org/10.31857/S0006813620030096
[Shamrov, Batygina] Шамров И.И., Батыгина Т.Б. 1984. Развитие зародыша и эндосперма у представителей семейства Ceratophyllaceae. – Бот. журн. 69 (10): 1328–1335.
[Shamrov, Winter] Шамров И.И., Винтер А.Н. 1991. Развитие семяпочки у представителей родов Nymphaea, Victoria (Nymphaeaceae). – Бот. журн. 76 (8): 1073–1083.
[Shamrov, Zhinkina] Шамров И.И., Жинкина Н.А. 1994. Развитие семязачатка у Azorina vidalii (Campanulaceae). – Бот. журн. 79 (6): 19–34.
Singh H. 1978. Embryology of gymnosperms. Berlin-Stuttgart. 302 p.
Singh M., Bhalla P.L., Malik C.P. 1979. Peroxidase localization during embryogenesis in Tropaeolum majus. – Phytomorphology. 29 (3–4): 306–309.
Sokolowa C. 1890. Naissance de l’endosperme dans le sac embryonaire de quelques gymnospermes. – Bulletin de la Sociéte Imperiale des Naturalistes de Moscou. N. S. 4: 446–497.
Souèges R. 1939. Exposes d’embryologie et de morphologie végétales. X. Embryogénie et classification. Deuxième fascicule. Essai d’un système embryogénique (Partie générale). Paris. 95 p.
Sporne K.R. 1954. A note on nuclear endosperm as a primitive character among dicotyledons. – Phytomorphology. 4 (3-4): 275–278.
Stenar H. 1938. Das Endosperm bei Hypericum acutum Moench. – Bot. Notiser. S. 515–527.
Stevens P.F. 2007. Angiosperm phylogeny website, vers. 8, June 2007. http://www.mobot.org/MOBOT/research/APweb/
Swamy B.G.L., Ganapathy P.M. 1957. On endosperm in dicotyledons. – Bot. Gaz. 119 (1): 47–50.
Swamy B.G.L., Krishnamurty K.V. 1973. The helobial endosperm: a dessenial review. – Phytomorphology. 23 (1–2): 74–79.
Swamy B.G.L., Parameswaran N. 1963. The helobial endosperm. – Biol. Rev. 38 (1): 1–50.
Terceros G.C., Resentini F., Cucinotta M., Manrique S., Colombo L. et Mendes M.A. 2020. The importance of cytokinins during reproductive development in Arabidopsis and beyond. – Int. J. Mol. Sci. 21, 81–61. https://doi.org/10.3390/ijms21218161
[Teryokhin] Терехин Э.С. 1996. Семя и семенное размножение. СПб. 376 с.
Titova G.E., Zakharova A.A., Shamrov I.I. 1997. Ovule and seed development in Trapa natans L. in connection with the specific embryo sac structure, absence of endosperm and pseudomonocotyly. – Bull. Polish Acad. Sci. Biol. 45 (2–4): 81–92.
Tobe H., Kimoto Y., Prakash N. 2007. Development and structure of the female gametophyte in Austrobaileya scandens (Austrobaileyaceae). – J. Plant Res. 120: 431–436.
Tobe H., Kadokawa T. 2010. Endosperm development in the Araceae (Alismatales) and evolution of developmental modes in monocots. – J. Plant Res. 123 (6): 731–739. https://doi.org/10.1007/s10265-010-0327-4
[Torshilova] Торшилова А.А. 2018. Процесс двойного оплодотворения в роде Dioscorea (Dioscorea nipponica и D. caucasica). – Бот. журн. 103 (3): 283–296. https://doi.org/10.1134/S0006813618030018
[Vinogradova] Виноградова Г.Ю. 2018. Развитие эндосперма у Allium schoenoprasum L. и A. ramosum L. (Alliaceae). – Бот. журн. 103 (11):1451–1471. https://doi.org/10.7868/S0006813618110066
Vazart B., Vazart J. 1966. Deposition et ultrastructure des cellules du sac embryonaire du lin (Linum usitatissimum L.). – Rev. Cytol. Biol. Véget. 24 (3–4): 251–266.
Vijayaraghavan M.R., Prabhakar K. 1984. The endosperm. – In: Embryology of angiosperms. Berlin etc. P. 319–376.
[Vorsobina, Solntseva] Ворсобина Л.И., Солнцева М.П. 1979. Особенности цветения и процесс оплодотворения у некоторых амариллисовых. – В кн.: Актуальные проблемы эмбриологии покрытосемянных растений. Л. С. 28–38.
[Winter] Винтер А.Н. 1993. Некоторые аспекты репродуктивной биологии Hydrostemma longifolium (Barclaya longifolia) (Barclayaceae). – Бот. журн. 78 (1): 69–83.
[Winter, Shamrov] Винтер А.Н., Шамров И.И. 1991a. Развитие семяпочки и зародышевого мешка у Nuphar lutea (Nymphaeaceae). – Бот. журн. 76 (3): 378–390.
[Winter, Shamrov] Винтер А.Н., Шамров И.И. 1991b. Мегаспорогенез и развитие зародышевого мешка у представителей рода Nymphaea и Victoria (Nymphaeaceae). – Бот. журн. 76 (12): 75–87.
Wunderlich R. 1959. Zur Frage der Phylogenie der Endospermtypen bei den Angiospermen. – Österr. Bot. Zeitschr. 106 (3–4): 203–293.
Wunderlich R. 1967. Ein Vorschlag zu einer natürlichen Gliederung der Labiaten auf Grund der Pollenkorner, der Samenentwicklung und des reifen Samens. – Österr. Bot. Zeitschr. 114 (4–5): 383–483.
[Yakovlev] Яковлев М.С. 1958. Принципы выделения основных эмбриональных типов и их значение для филогении покрытосеменных. Проблемы ботаники. 3: 168–195.
Yamazaki T. 1963. Embryology of Mitrosacme alsinoides var. indica. – Sci. Reports Tôhoku Imp. Univ. Ser. 4 (Biology). 29: 201–205.
[Yudakova, Shakina, Kaybeleva] Юдакова О.И., Шакина Т.Н., Кайбелева Э.И. 2018. Цитоэмбриологические особенности развития эндосперма при апомиксисе у некоторых видов рода Poa (Poaceae). – Бот. журн. 103 (7): 908–918. https://doi.org/10.7868/S0006813618070049
XuHan X., Lammeren van A. A. 1993. Microtubular configurations during the cellularization in coenicytic endosperm in Ranunculus sceleratus L. – Sex Plant Repr. 6: 127–132.
XuHan X., Lammeren van A.A. 1994. Microtubular configurations during endosperm development in Phaseolus vulgaris – Canad. J. Bot. 72: 1489–1495.
[Zhukova] Жукова Г.Я. 1997a. Эндосперм. – В кн.: Эмбриология развития цветковых растений. Терминология и концепции. СПб. Т. 2. С. 212–218.
[Zhukova] Жукова Г.Я. 1997b. Нуклеарный тип развития эндосперма. – В кн.: Эмбриология развития цветковых растений. Терминология и концепции. СПб. Т. 2. С. 218–227.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


