Ботанический журнал, 2022, T. 107, № 3, стр. 287-301
ОСОБЕННОСТИ СТРОЕНИЯ ПЫЛЬНИКА У CODONOPSIS CLEMATIDEA (CAMPANULACEAE)
Н. А. Жинкина 1, Е. Е. Евдокимова 1, *, И. И. Шамров 1, 2
1 Ботанический институт им. В Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
2 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, наб. р. Мойки, 48, Россия
* E-mail: e.e.evdokimova@mail.ru
Поступила в редакцию 03.08.2021
После доработки 20.09.2021
Принята к публикации 21.09.2021
- EDN: URUBQF
- DOI: 10.31857/S0006813621120115
Аннотация
Сравнительный анализ строения пыльников Codonopsis clematidea и других видов сем. Campanulaceae выявил общие черты в их организации. Стенка микроспорангия формируется по типу двудольных и состоит из эпидермы, 1–3-слойного эндотеция, среднего слоя и клеточного тапетума. Формирование тетраэдральных тетрад микроспор происходит по симультанному типу, зрелые пыльцевые зерна – 2-клеточные.
Особенностью строения цветка С. clematidea является наличие двух типов пыльника. В пыльнике 1‑го типа, как у большинства цветковых растений, гнезда в теках обьединены. Но септы в теках не разрушаются и стомиум не формируется. В пыльнике 2-го типа имеются плацентоиды, гнезда в теках не объединяются и септы не образуются. Механизмы вскрывания пыльников сходны с таковыми при вскрывании плодов-коробочек. Исходя из этого, впервые предложено различать несколько способов вскрывания пыльников. У большинства цветковых растений перегородки в теках разрушаются, и пыльники вскрываются септицидно в области стомиума. В пыльниках Codonopsis вскрывание может быть либо локулицидным (1-й тип пыльника), либо асептицидным, но с образованием стомиума, который максимально приближен к связнику, и формированием фиброзных утолщений в клетках плацентоидов (2-й тип пыльника). Второй способ, вероятно, представляет собой один из первичных способов вскрывания, когда микроспорангии в теках не были еще объединенными и отсутствовали септы.
Обсуждается разнообразие плацентоидов, их положение в пыльнике и строение.
Семейство Campanulaceae по результатам молекулярно-генетических исследований включается в порядок Asterales (Shipunov, 2003; APG, 2016; Rodina, Oleinik, 2018; Geltman, 2019). Его система изучается на основании комплекса признаков, в том числе молекулярных данных (Kolakovsky, 1987; Eddie et al., 2003; Lundberg, Bremer, 2003). Биология развития представителей этого семейства находится в центре внимания многих исследователей. Изучаются биоморфологические (Shulkina, 1983; Boronnikova, 2009; Victorov, Kuranova, 2017), анатомические (Zhinkina, 2010), эмбриологические (Korobova, Zhinkina, 1987; Zhin-kina, Shamrov, 1997; Miroshnichenko, 2014, 2019a; Shevchenko, 2020) особенности. Однако эмбриологически виды сем. Campanulaceae изучены еще не достаточно. Среди этих признаков особое место занимают структуры пыльника. Растения семейства резко разделяются на 2 группы: пыльники обычного строения (Azorina vidalii (H.C. Watson) Feer, Gadellia lactiflora (M. Bieb.) Schulkina – Zhinkina, Shamrov, 1997; Adenophora taurica (Sukacz.) Juz. – Shevchenko, Krainyuk, 2019), как у многих цветковых растений, и пыльники, на внутренней стороне гнезда которых со стороны связника формируется дугообразная структура плацентоид (Ostrowskia magnifica Regel – Kamelina, Zhinkina, 1989; Zhinkina, 1995; Platycodon grandiflorus (Jacq.) A.DC. – Zhinkina, Evdokimova, 2020; Shevchenko, 2020). Оказалось, что наличие плацентоидов характерно для растений, которые относятся к реликтовым (Kamelin et al., 1999). Среди них есть некоторые виды Campanula (C. sibirica L., C. talievii Juz., C. taurica Juz. – Miroshnichenko, 2019b).
Исходя из приведенных выше фактов, целью исследования стало изучение строение пыльника одного из видов Codonopsis – С. Clematidea (Schrenk ex Fisch. et C.A. Mey.) C.B. Clarke (кодонопсис, или колокольник ломоносовидный), относящегося к многолетним травянистым растениям. В природе он встречается в горах Западного и Северного Тянь-Шаня, а также на Дальнем востоке. Растения этого вида интродуцированы в Ботаническом саду Петра Великого Санкт-Петербурга. C. clematidea может использоваться как декоративное растение. Понимание особенностей его строения и размножения крайне важно как для введения этого растения в культуру, так и для сохранения в местах естественного произрастания.
МАТЕРИАЛ И МЕТОДЫ
Генеративные побеги Codonopsis clematidea с цветками и бутонами на разных стадиях развития взяты с растений, произрастающих на территории альпийских горок Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН. Материал собирали в конце июня - начале июля в 2018 и 2020 гг. Исследование проводили в течение 3 лет.
Постоянные препараты для исследования готовили по общепринятой методике (Prozina, 1960). Материал фиксировали в смеси FAA (40% р-р формалина, ледяная уксусная кислота, 70% р-р этилового спирта в соотношении 7 : 7 : 100). После проводки через серии этилового спирта, смесей спирта и хлороформа и чистого хлороформа материал заливали в парафин. Срезы толщиной 12 мкм получали на микротоме Microm 325 (фирмы Carl Zeiss), а затем окрашивали гематоксилином по Эрлиху, с подкраской алциановым синим, а также сафранином. Препараты исследовали и фотографировали на микроскопе Axioplan-2 mot (Zeiss), с использованием камеры AxioCam MRc 5 (Zeiss) и программы AxioVision 4.8 (Zeiss). Строение пыльцевых зерен изучено с помощью сканирующего электронного микроскопа Jeol JSM-6390 LA в Центре коллективного пользования БИН РАН.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Цветок, тычинка. У Codonopsis clematidea цветки колокольчатой формы, белые, с оттенком синего или голубого (рис. 1, а). Цветки – 5-членные и тетрациклические. Двойной околоцветник состоит из 5 чашелистиков и 5 лепестков (рис. 1, b). Андроцей из 5 тычинок. Завязь нижняя, синкарпный гинецей из 3–5 плодолистиков (рис. 1, с, d).
Рис. 1.
Общий вид цветущего растения и строение цветка у Codonopsis clematidea.
a – цветущее растение; b – цветок; с, d – андроцей и гинецей цветка, пыльники изогнуты на полюсах и содержат плацентоиды (пыльники 2-го типа). g – гинецей, p – лепесток, s – чашелистик, st – тычинка. Масштабные линейки – 1 мм.
Fig. 1. General view of a flowering plant and the flower structure in Codonopsis clematidea.
a – flowering plant; b – flower; с, d – androecium and gynoecium, anthers are curved at the poles and contain placentoids (anthers of the 2nd type). g – gynoecium, p – petal, s – sepal, st – stamen. Scale bars – 1 mm.

Рис. 2.
Строение пыльника (с) и формирование стенки микроспорангия (a, b, d–f) у Codonopsis clematidea.
a, e, f – пыльник с плацентоидом; b–d – пыльник без плацентоида; a, c, d – поперечные срезы, b, e, f – продольные срезы. a c – археспориальная клетка, an – пыльник, en – эндотеций, ep – эпидерма, i t – внутренний тапетум, ms – микроспора, m l – средний слой, o t – наружный тапетум, pl – плацентоид, t – тапетум, t ms – тетрада микроспор. Масштабные линейки, мкм: a, d–f – 10, b – 20, c – 200.
Fig. 2. Anther structure (с) and microsporangium wall formation (a, b, d–f) in Codonopsis clematidea.
a, e, f – anther witn placentoid; b–d – anther without placentoid; a, c, d – cross sections, b, e, f – longitudinal sections. a c – archesporial cell, an – anther, en – endothecium, ep – epidermis, i t – inner tapetum, ms – microspore, m l – middle layer, o t – outer tapetum, l – placentoid, t – tapetum, t ms – tetrad of microspores. Scale bars, μm: a, d–f – 10, b – 20, c – 200.

Тычинка состоит из короткой тычиночной нити и пыльника, который у C. clematidea является 4-гнездным, или тетраспорангиатным. У изученного вида выявлены 2 типа цветков, пыльники которых имеют различное строение. 1-й тип – пыльники, присущие большинству цветковых растений, гнезда в теках которых образуют общую перегородку, или септу. Пыльники прямые, полностью срастаются с тычиночной нитью только в верхней части тычинки. В базипетальном направлении срастание становится асимметричным и со стороны абаксиальных микроспорангиев образуется ребро (см. рис. 4, c, d). В пыльниках 2-го типа возникают плацентоиды, которые простираются почти по всей длине микроспорангиев, за исключением их полюсов. Вследствие этого пыльники в апикальной и базальной частях тычинки оказываются изогнутыми. Гнезда в теках не объединяются и существуют обособленными на всем протяжении. Связник, являющийся продолжением тычиночной нити, располагается в таких пыльниках лишь в центре и его границы находятся между абаксильными и адаксиальными микроспорангиями, при этом значительная часть микроспорангиев оказывается свободной от объединения. В пыльниках первого типа септы в теках не разрушаются и стомиум не образуется. В пыльниках второго типа септы не формируются. Проводящая система тычиночной нити и связника напоминает стелу стебля, образованную большим (10–12) числом коллатеральных пучков. В пыльниках 1-го типа стела имеет форму кольца, а в пыльниках 2-го типа – в виде овала. Предварительный анализ распределения типов пыльника показал, что в исследованном материале доминируют цветки 2-го типа. Внутри одного цветка отмечается только один тип пыльника (рис. 2, c, d).
Рис. 3.
Морфология пыльцевых зерен (a–c) и характер их поверхности (d) у Codonopsis clematidea.
p f – борозда пыльцевого зерна. Масштабные линейки, мкм: a – 100, b, с – 10, d – 2.
Fig. 3. Morphology of pollen grains (a–c) and the nature of their surface (d) in Codonopsis clematidea.
p f – pollen furrow. Scale bars, μm: a – 100, b, с – 10, d – 2.
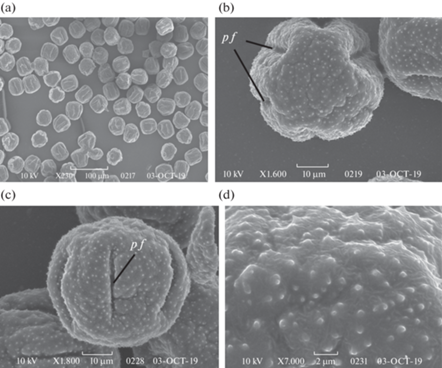
Рис. 4.
Строение зрелого пыльника (a, b, e, d) и мест его вскрывания (с, d, e, f) у Codonopsis clematidea.
a–d – пыльник с плацентоидом; e, f – пыльник без плацентоида (поперечные срезы). cn – связник, d a – область вскрывания, en – эндотеций, ep – эпидерма, p g – пыльцевое зерно, s – перегородка, sm – стомиум, v b – проводящий пучок. Масштабные линейки, мкм: a – 20, b – 10, c, e, f – 100, d – 50.
Fig. 4. Mature anther structure (a, b, e, d) and area of its dehiscence (с, d, e, f) in Codonopsis clematidea.
a–d – anther witn placentoid; e, f – anther without placentoid (cross sections). cn – connective, d a – dehiscence area, en – endothecium, ep – epidermis, p g – pollen grain, s – septum, sm – stomium, v b – vascular bundle. Scale bars, μm: a – 20, b – 10, c, e, f – 100, d – 50.

Микроспорангий. Для формирования тетрад гаплоидных микроспор и пыльцевых зерен особое значение имеет стенка микроспорангия. В ходе развития изменения в ее строении происходят сопряженно с процессами микроспорогенеза и микрогаметогенеза. Выделены 3 стадии формирования стенки микроспорангия (Shamrov, 2015), которые совпадают с премейотическим, мейотическим и постмейотическим периодами в развитии пыльника (Kamelina, 1981a).
В литературе дискутируется вопрос о том, как формируются слои стенки микроспорангия. Обычно считают, что с дистальной стороны (противоположной связнику) ее слои возникают за счет деятельности клеток археспория, которые дифференцируются в субэпидермальном слое каждого микроспорангия. С боков и внутренней стороны слои образуются из клеток меристемы связника (Davis, 1966). Мы поддерживаем исследования, проведенные И.И. Шамровым с соавторами (Shamrov et al., 2019, 2020), которые показали, что при формировании микроспорангия у покрытосеменных растений в субэпидермальном слое сначала дифференцируется группа инициальных клеток, которые образуют как слои стенки микроспорангия, так и сам археспорий. У C. clematidea после периклинального деления центральной субэпидермальной клетки наружу отделяется археспориальная клетка, а внутрь – клетка, из которой формируется проксимальная часть стенки микроспорангия (рис. 2, a). В дальнейшем под эпидермой формируются тяжи археспориальных клеток, располагающиеся в гнезде в виде дуги. Клетки археспория отличаются плотной цитоплазмой и крупными ядрми. Проксимальные клетки, сестринские археспориальным клеткам, дифференцируются в клетки внутреннего тапетума (рис. 2, a). Латеральные субэпидермальные инициальные клетки за счет делений образуют латеральные части стенки микроспорангия. В результате периклинальных делений археспориальных клеток возникают наружный (париетальные клетки) и внутренний (спорогенные клетки) слои. Клетки париетального слоя делятся также периклинально. Клетки внутреннего париетального слоя дифференцируются в тапетум, а наружного – делятся многократно и образуют средний слой и эндотеций – однослойный (пыльники 1-го типа) (рис. 2, b) либо 2–3-слойный (пыльники 2-го типа) (рис. 4, e, f). Формирование стенки гнезда пыльника происходит центробежно (по типу двудольных, согласно Davis, 1966).
У C. clematidea клетки эндотеция сначала почти не отличаются от клеток эпидермы. Они продолговатые, вытянуты вдоль поверхности микроспорангия. Клетки среднего слоя узкие и некрупные и разрушаются к стадии тетрад микроспор (рис. 2, d). Тапетум клеточный. Его клетки крупные, таблитчатой формы и одноядерные. Они расположены в один ряд в пыльниках обоих типов (рис. 2, e–f). Тапетальные клетки со стороны связника в пыльниках с плацентоидами вытянутой формы и значительно крупнее клеток с наружной стороны, при этом они более вакуолизированные.
Клетки спорогенной ткани и формирующиеся микроспороциты отличаются от соседних клеток тапетума удлиненной формой, крупными размерами ядер и более плотной цитоплазмой. У C. clematidea эти клетки расположены в несколько рядов (рис. 2, b). Микроспороциты вступают в мейоз и после симультанного образования перегородок между возникшими ядрами формируются тетраэдральные тетрады микроспор (рис. 2, d). В гнездах пыльника распад тетрад на отдельные микроспоры происходит асинхронно. Процесс микроспорогенеза сопровождается отложением каллозы в периплазматическом пространстве между плазмалеммой и клеточной оболочкой каждого микроспороцита. Микроспоры в тетрадах также со всех сторон окружены каллозой. К моменту формирования тетрад клетки эндотеция, оставаясь еще вакуолизированными, увеличиваются в размерах. Клетки тапетума также вытягиваются и в них продолжаются процессы вакуолизации.
После исчезновения каллозных оболочек происходит распад тетрад и обособление самостоятельных микроспор. Деление ядра микроспоры приводит к образованию пыльцевого зерна. К моменту деления образуется центральная вакуоль, а ядро оказывается в пристенном положении. В результате неравного деления возникают две клетки: маленькая генеративная и большая вегетативная. Генеративная клетка сначала располагается около оболочки пыльцевого зерна. Постепенно она оказывается внутри цитоплазмы вегетативной клетки и может совершать в ней движения.
Зрелые пыльцевые зерна густоплазменные, сфероидальной формы, двухклеточные. На поверхности пыльцевых зерен заметны крупные меридиональные борозды, а также многочисленные шипики конической формы (рис. 3, a–d).
В период образования пыльцевых зерен изменяется строение клеток слоев стенки микроспорангия. Клетки эпидермы продолжают увеличиваться в продольном направлении, в них разрушается протопласт, а на утолщенных наружных тангентальных стенках откладывается кутикула. Клетки эндотеция достигают наибольшего развития к моменту высыпания пыльцы из пыльников. Они рано теряют содержимое и их стенки остаются тонкими в пыльниках 1-го типа. Однако их стенки сильно утолщаются в клетках 2–3-слойного эндотеция в пыльниках 2-го типа. От внутренних стенок их клеток отходит большое количество фиброзных поясков (рис. 4, e, f).
Вскрывание пыльника. Известно, что главной функцией тапетальной ткани является снабжение микроспороцитов и формирующихся микроспор питательными веществами, среди которых важную роль играют полисахариды, ферменты, гормоны, накапливающиеся внутри полости микроспорангия. Клетки тапетума также секретируют фермент каллазу для растворения каллозных оболочек тетрад микроспор, образуют спорополленин экзины и орбикул (телец Убиша), которые обычно располагаются на внутренней мембране клеток и контактируют с развивающимися пыльцевыми зернами (Pacini, 2010).
Кроме того, в тапетуме синтезируются вещества, ингибирующие процессы специализации клеток эндотеция в течение всего микроспорогенеза. После завершения синтеза спорополленина ингибирующее действие заканчивается, и тапетум начинает разрушаться, что обычно соответствует стадии вакуолизированных микроспор. В норме более длительное существование тапетума, заканчивающееся в период формирования пыльцевых зерен, приводит к более позднему возникновению фиброзных утолщений в эндотеции (Chauhan, 2006).
У C. clematidea клетки тапетума перед вскрыванием пыльника еще сохраняются. Это коррелирует с отсутствием фиброзных утолщений в клетках эндотеция пыльников 1-го типа. Тем не менее, пыльники вскрываются. Мы уже отмечали, что в пыльниках первого типа септы в теках не разрушаются и стомиум не формируется. Поэтому продольное вскрывание происходит не в области септы. В пыльниках второго типа нет септ. Клетки тапетума разрушаются на стадии одиночных микроспор. После этого начинается формирование фиброзных утолщений в клетках эндотеция. Последние возникают также почти во всех клетках плацентоидов (рис. 4, a, b).
Пыльники C. clematidea вскрываются еще в закрытом бутоне, и этот процесс осуществляется за счет разных структур. Несмотря на то, что в пыльниках второго типа нет септ, их вскрывание ближе всего к вскрыванию типичного пыльника. Мы уже отмечали, что микроспорангии в теках у них не объединяются, сохраняя индивидуальную организацию. Важно отметить, что они обращены продольной осью перпендикулярно к связнику, а не параллельно, как в типичном пыльнике. Тем не менее, в них создается стомиум, который максимально приближен к связнику. Клетки эпидермы и эндотеция в области стомиума уменьшаются в размерах (иногда эпидерма становится 2-слойной) и срастаются с мелкими тонкостенными клетками многослойной ткани выроста связника. Число слоев клеток эндотеция сокращается от 2–3 до одного слоя, и в них отсутствуют фиброзные утолщения. Перед вскрыванием гнезд происходит обезвоживание клеток эндотеция и их сжатие подобно пружине в результате укорачивания фиброзных утолщений. За счет этого уменьшаются размеры клеток эндотеция и мелкие тонкостенные клетки в области стомиума разрываются, при этом вся стенка микроспорангия раскрывается наружу. В пыльниках 1-го типа в стенке каждого микроспорангия в средней его части с наружной стороны происходит прогибание слоев, имитирущих стомиум. Края выемки формируют крупные клетки эпидермы и эндотеция, наружные тангентальные стенки которых приобретают утолщения. Однако в центре выемки остаются небольшие и тонкостенные клетки. После сжатия клеток эпидермы и эндотеция происходит разрыв мелких клеток, и осуществляется вскрывание гнезд.
ОБСУЖДЕНИЕ
Сравнительный анализ признаков мужской генеративной сферы Codonopsis clematidea и других видов сем. Campanulaceae выявил общие черты в их организации. Стенка микроспорангия формируется по типу двудольных (Davis, 1966), или в соответствии с типовой вариацией центробежного типа (Shamrov et al., 2020). Число ее слоев может различаться у разных видов. Обычно 1‑слойный, эндотеций 1–2-слойный у Azorina vidalii (Zhinkina, Shamrov, 1997) и 2-слойный у Ostrowskia magnifica (Kamelina, Zhinkina, 1989). Число средних слоев различается от одного у большинства изученных видов до 1–2 слоев у A. vidalii, 2–3 – Gadellia lactiflora (Zhinkina, Shamrov, 1997), 3 – Platycodon grandiflorus (Shevchenko, 2020). Тапетум у всех исследованных видов клеточный, однослойный. Со стороны плацентоида клетки тапетума часто более вытянутые, а у O. magnifica имеют папиллообразную форму (Kamelina, Zhinkina, 1989). Клетки тапетума содержат разное число ядер: одно у C. clematidea, 2 у A. vidalii и 2–4 у G. lactiflora, O. magnifica, P. grandiflorus (Kamelina, Zhinkina, 1989; Zhinkina, Shamrov, 1997; Zhinkina, Evdokimova, 2020). Формирование тетрад микроспор у всех исследованных видов происходит по симультанному типу, тетрады микроспор тетраэдральные (Korobova, Zhinkina, 1987; Kamelina, 2009).
Как было уже отмечено, у некоторых представителей сем. Campanulaceae в пыльниках обнаружены плацентоиды (списки видов и литературных источников приведены в начале статьи). Термином “плацентоиды” A. Eames (1961) обозначал выросты стерильной ткани в спорогенную. Они могут представлять собой большие участки паренхимы связника на внутренней стороне спорангия, сильно напоминающие плаценты плодолистиков, на которых образуются семязачатки. Возможная функция таких структур, как считал автор, – разделение спорангиев на начальных этапах становления пыльников.
Проведенное нами исследование показало, что у Сodonopsis clematidea образуются пыльники как с плацентоидами (2-й тип, доминирует), так и без них (1-й тип). В пыльниках 1-го типа, как у большинства цветковых растений, гнезда в теках образуют общую перегородку, или септу. Септы в теках не разрушаются, стомиум не формируется и вскрывание происходит не в области септы. В пыльниках 2-го типа гнезда в теках не объединяются и обособленны на всем протяжении. Септы не образуются, однако фиброзные утолщения формируются, причем и почти во всех клетках плацентоидов. Механизмы вскрывания пыльников очень сходны с таковыми при вскрывании плодов. В синкарпных и лизикарпных коробочках вскрывание осуществляется створками и может быть септицидным (по септам) и локулицидным (по главной жилке каждого плодолистика). В местах вскрывания локулицидной коробочки в эпидермальном слое формируются выемки, клетки которых, за исключением центральных, имеют специфические обратно U-образные утолщения, при этом самыми мощными оказываются наружные тангентальные стенки. В центре выемки имеются небольшие клетки с тонкими оболочками. Эти и нижележащие субэпидермальные клетки септ или дорзального проводящего пучка разрываются при вскрывании. Исходя из этого, впервые предложено различать несколько способов вскрывания пыльников. Один из них встречается в пыльниках большинства цветковых растений – септицидный. Следует отметить, что механизмы вскрывания тек пыльника до сих пор не изучены. Обычно отмечают, что продольное вскрывание тек происходит створками. В области вскрывания образуется стомиум. Сначала дегенерируют клетки септ, а затем стомиума. У табака, например, также сильно разрушается связник (Scott et al., 2004). По мнению некоторых авторов (Rieu et al., 2003), к моменту вскрывания в пыльниках увеличивается содержание этилена. Особый случай описан у Chrysanthemum morifolium Ramat. (Asteraceae) (Fei et al., 2016). У одного культивара со вскрывающимися пыльниками (Qx-097) эндотеций с фиброзными утолщениями, а у другого культивара (Qx-007) пыльники не вскрываются, так как в эндотеции не формируются фиброзные утолщения. Кроме того, у последнего сохраняются полностью септа в теке и стомиум, происходит увеличение размеров клеток пыльника, выявляется сильная гидратация и высокое содержание ионов K+ и Ca2+, тогда как у первого культивара размеры клеток в пыльнике сохраняются, наблюдается обезвоживание, потеря содержимого клеток и снижение указанных ионов. Как свидетельствует анализ литературных данных, в ходе созревания типичного пыльника септы между микроспорангиями тек разрушаются, а с наружной стороны в области вскрывания в клетках эндотеция перестают формироваться фиброзные утолщения. Последние вместе с клетками эпидермы и комплексом мелких тонкостенных клеток между ними создают стомиум. Со стороны связника после разрушения септы остаются небольшие выросты, а стомиум смещен на наружную часть пыльника.
Проведенное нами исследование показало, что в пыльниках 1-го типа в стенке каждого микроспорангия в средней его части с наружной стороны происходит прогибание слоев, имитирущих стомиум. Края выемки формируют крупные клетки эпидермы и эндотеция, наружные тангентальные стенки которых приобретают утолщения. Однако в центре выемки остаются небольшие и тонкостенные клетки. После сжатия клеток эпидермы и эндотеция происходит разрыв мелких клеток, и осуществляется вскрывание гнезд. Несмотря на то, что в пыльниках второго типа нет септ, их вскрывание ближе всего к вскрыванию типичных пыльников. В пыльниках с плацентоидами создается стомиум, который максимально приближен к связнику. Клетки эпидермы и эндотеция в области стомиума уменьшаются в размерах и срастаются с мелкими тонкостенными клетками многослойной ткани выроста связника. Число слоев клеток эндотеция сокращается от 2–3 до одного слоя, и в них отсутствуют фиброзные утолщения. Перед вскрыванием гнезд происходит обезвоживание клеток эндотеция и их сжатие подобно пружине в результате укорачивания фиброзных утолщений. За счет этого уменьшаются размеры клеток эндотеция и мелкие тонкостенные клетки в области стомиума разрываются, при этом вся стенка микроспорангия раскрывается наружу.
Таким образом, в пыльниках Codonopsis вскрывание может быть либо локулицидным (1-й тип пыльника), либо асептицидным, но с образованием стомиума, который максимально приближен к связнику, и формированием фиброзных утолщений в клетках плацентоида (2-й тип пыльника). Второй способ, вероятно, представляет собой один из первичных способов вскрывания, когда микроспорангии в теках не были еще объединены и отсутствовали септы. Его наличие, вероятно, характерно для пыльников с плацентоидами O. magnifica, исходя из иллюстраций, приведенных в статье О.П. Камелиной и Н.А. Жинкиной (Kamelina, Zhinkina, 1989) (рис. 5, a, b). Подобное строение пыльника обнаружено у Paeonia lactiflora Pall. (Paeoniaceae). Однако плацентоиды у этого вида не образуются. Перегородки в теках также не образуются. Слои стенки смежных микроспорангиев заворачиваются и срастаются с клетками связника. В области стомиума эпидермальные слои смежных микроспорангиев лишь сомкнуты. Стомиум приближен к связнику и образован мелкими тонкостенными клетками, при этом в клетках эндотеция отсутствуют фиброзные утолщения, тогда как за пределами стомиума они формируются (Shamrov, неопубл.) (рис. 6, a–d). Вероятно, такое строение имеет пыльник Daphniphyllum macropodum Miq. (Daphniphyllaceae), в котором стомиум подходит вплотную к связнику (Kamelina, 1981b).
Рис. 5.
Строение пыльника у Ostrowskia magnifica (a, b) и Gentiana lutea (c, d).
a – пыльник перед вскрыванием, b – вскрывшийся пыльник с плацентоидами (по: Kamelina, Zhinkina, 1989); c – дугообразное расположение археспориальной ткани, отделение клеток внутреннего тапетума, d – трабекулы в гнезде пыльника на стадии тетрад микроспор (по: Shamrov, 1986). a c – археспориальная клетка, en – эндотеций, ep – эпидерма, i t – внутренний тапетум, m l – средний слой, pl – плацентоид, t – тапетум, tr – трабекула, v b – проводящий пучок. Масштабные линейки, мкм: a, c, d – 30, b – 50.
Fig. 5. Anther structure in Ostrowskia magnifica (a, b) and Gentiana lutea (c, d).
a – anther before dehiscence, b – opened anther with placentoids (after Kamelina, Zhinkina, 1989); c – arcuate arrangement of archesporial tissue, separation of cells of the inner tapetum, d – trabeculae in the anther locule at the stage of microspore tetrads (after Shamrov, 1986). a c – archesporial cell, en – endothecium, ep – epidermis, i t – inner tapetum, m l – middle layer, pl – placentoid, t – tapetum, tr – trabecula, v b – vascular bundle. Scale bars, μm: a, c, d – 30, b – 50.
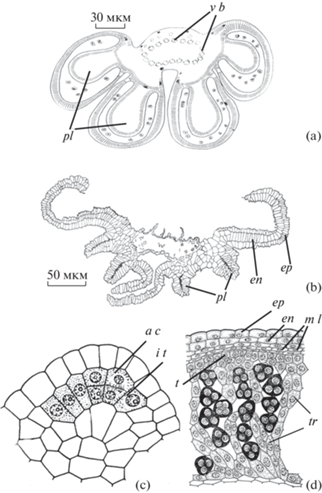
Рис. 6.
Строение зрелого пыльника и области его вскрывания у Paeonia lactiflora.
cn – связник, en – эндотеций, ep – эпидерма, p g – пыльцевое зерно, sm – стомиум, v b – проводящий пучок. Масштабные линейки, мкм: a, d – 100, b – 50, c – 200.
Fig. 6. Mature anther structure and area of its dehiscence in Paeonia lactiflora.
cn – connective, en – endothecium, ep – epidermis, p g – pollen grain, sm – stomium, v b – vascular bundle. Scale bars, μm: a, d – 100, b – 50, c – 200.

Формирование плацентоидов выявлено также в семействах Bignoniaceae (Freiberg, 1987), Lamiaceae (Kamelina, Dzevatovsky, 1987), Scrophulariaceae (Nikiticheva, 1987), Valerianaceae (Kamelina, Zhukova, 1987). Процесс вскрывания пыльников с плацентоидом в них не описан. Однако, в работе по сем. Valerianaceae указывается, что к моменту вскрывания гнезда пыльника сохраняют индивидуальность, т.е. можно предположить, что происходит асептальное вскрывание, как у некоторых изученных видов сем. Campanulaceae. В сем. Lamiaceae плацентоиды образуются в каждом микроспорангии со стороны общей перегородки в теках. Исходя из анализа иллюстраций, вскрывание пыльника типичное, септицидное. В области стомиума в клетках эндотеция отсутствуют фиброзные утолщения, а вскрывание, вероятно, осуществляется за счет разрыва мелких тонкостенных клеток, располагающихся между клетками эпидермы и эндотеция (Kamelina, Dzevatovsky, 1987). По-видимому, также происходит вскрывание пыльников у видов сем. Scrophulariaceae (Nikiticheva, 1987). Однако, плацентоиды, появляющиеся как выросты ткани связника внутрь каждого гнезда, в ходе развития смещаются на септу каждой теки. В результате этого септа становится массивной на всем протяжении, за исключением области стомиума. Возможно, плацентоиды принимали участие в разделении спорангиев на начальных этапах становления пыльников, как считал Eames (1961). Однако у современных цветковых растений с помощью плацентоидов перегородки в гнездах пыльника не образуются, и их клетки никогда не контактируют с клетками стенки микроспорангия.
К плацентоидам относят перегородки, или трабекулы в пыльнике видов семейств Gentianaceae и Menyanthaceae. Существуют 2 точки зрения на их формирование: 1) трабекулы возникают в результате стерилизации некоторых клеток спорогенного комплекса, 2) трабекулы представляют собой клетки тапетума, разрастающиеся внутрь гнезд пыльника. Одним из авторов настоящей статьи подтверждается тапетальное происхождение трабекул (Shamrov, 1986, 1988). У Gentiana lutea L. и Swertia iberica Fisch. ex Boiss. в стенке формирующегося микроспорангия сначала формируется тапетум с внутренней стороны, а затем с латеральных сторон и из париетального слоя, возникшего в результате периклинальных делений археспориальных клеток. Особенностью развития пыльника этих видов является дугообразное расположение спорогенных клеток, при этом внутренний тапетум оказывается внутри дуги и подходит близко к наружному тапетуму. Это приводит к их смыканию и образованию в дальнейшем септированности гнезд. Формально плацентоиды не образуются. Под археспориальными и спорогенными клетками, располагающимися дугообразно, возникает выпячивание со стороны связника, но оно образовано многоклеточной тканью внутреннего тапетума. Возникшие трабекулы проходят радиально через полость гнезда и разделяют единую спорогенную ткань на комплексы клеток (рис. 5, c, d). В ходе развития клетки трабекул и тапетума начинают разрушаться, сохраняясь до стадии 2-клеточных пыльцевых зерен (зрелая пыльца у этих видов – 3-клеточная). Первыми разрушаются клетки внутреннего тапетума, затем трабекулы и последними клетки латерального и наружного тапетума. Вскрывание пыльников в области стомиума септальное, а не локулярное. Анализ литературы позволяет предположить формирование септ в пыльниках Berberis vulgaris L. (Berberidaceae) (Budell, 1964), некоторых видов семейств Balsaminaceae и Onagraceae (Venkateswarlu, Lakshminarayana, 1957; Steffen, Landmann, 1958; Narayana, 1963).
Как уже было отмечено, система сем. Campanulaceae изучается на основании комплекса признаков, в том числе молекулярных данных. На основании карпологических исследований, а также особенностей жизненных форм и экологии прорастания сем. Campanulaceae (без учета семейств Cyphiaceae, Lobeliaceae, Pentaphragmotaceae, Sphenoсleaceae) разделено на 4 подсемейства: Prismatocarpoideae, Canarinoideae (по 1 трибе), Wahlenbergioideae и Campanuloideae (по 9 триб). Из растений с плацентоидом в пыльнике выделяется эндемик Ostrowskia magnifica, образующий в подсем. Wahlenbergioideae монотипную трибу Ostrowskieae (Kolakovsky, 1987). Еще K. Schönland (1889–1894), используя положение свободных частей чашелистиков в верхней части завязи и способ скрывания плода-коробочки, различал в семействе 3 подтрибы, одна из которых (Platycodinae) содержала Platycodon grandiflorus, а другая (Wahlenberginae) – виды Codonopsis. В дальнейшем молекулярные исследования, базирующиеся на ITS-последовательностях нуклеарной рибосомальной ДНК подтвердили, что эти подтрибы находятся очень близко в основании филогенетической системы семейства, образуя группы валенбергиодных и платикононоидных таксонов, при этом виды Codonopsis занимают либо промежуточное положение между этими кладами (Codonopsis dicentrifolia (C.B. Clarke) W. W. Sm., C. lanceolata (Siebold et Zucc.) Benth. et Hook. F. Ex Trautv., C. tangshen Oliv. вместе с Platycodon grandiflorus), либо тяготеют к базальной части платикононоидных, а не валенбергиодных таксонов (C. pilosa Chipp, C. modesta Nannf., C. nervosa (Chipp) Nannf.) (Eddie et al., 2003). Особняком стоят виды Campanula (C. sibirica, C. talievii, C. taurica), для которых также были описаны плацентоиды (Miroshnichenko, 2019b). Виды Campanula относятся к кладам верхней части филогенетической системы – Campanulaceae s.str. – и Rapunculus-клады группы кампанулоидных таксонов (Eddie et al., 2003). Это позволяет предположить, что изученные эндемичные растения являются не видами рода Campanula, а относятся к особому роду, находящемуся вблизи Platycodon и Сodonopsis. Следует отметить, что род Ostrowskia в указанной системе семейства не анализируется. В усовершенствованном варианте системы семейства, предложенного А.А. Колаковским (Kolakovsky, 1995), к подсем. Wahlenbergioideae относится не только этот род, образуя монотипную трибу Ostrowskieae, но и Platycodon и Сodonopsis в составе трибы Wahlenbergieae.
ЗАКЛЮЧЕНИЕ
Codonopsis clematidea характеризуется общей организацией пыльника, присущей большинству изученных видов сем. Campanulaceae. Это касается типа формирования стенки микроспорангия, способа образования и строения тетрад микроспор и пыльцевых зерен. В отличие от других представителей семейства, у C. clematidea обнаружены два особых типа пыльника, различающиеся по строению и способу вскрывания. В пыльниках первого типа септы в теках не разрушаются, стомиум не формируется, и вскрывание не септицидное, как у большинства цветковых растений, а локулицидное. В пыльниках второго типа нет септ (микроспорангии в теках сохраняют индивидуальную организацию и формируются плацентоиды), но образуется стомиум, который максимально приближен к связнику, при этом плацентоиды сохраняются, и в их клетках образуются фиброзные утолщения. Вскрывание является асептицидным и представляет собой один из первичных способов, который был обнаружен не только у Codonopsis clematidea, Ostrowskia magnifica из колокольчиковых, но и Paeonia lactiflora. Анализ систем сем. Campanulaceae, созданных на основании комплекса признаков, в том числе молекулярных данных, свидетельствует о том, что виды колокольчиковых с плацентоидами в пыльниках образуют, по-видимому, древнюю родственную группу растений, о чем также свидетельствует образование большого числа проводящих пучков в тычиночной нити и связнике.
Список литературы
An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. 2016. – Bot. J. Linn. Soc. 181 (1): 1–20. https://doi.org/10.1111/boj.12385
[Boronnikova] Боронникова С.В. 2009. Молекулярно-генетический анализ генофондов редких и исчезающих видов растений Пермского края: Автореф. дис. … докт. биол. наук. Уфа. 45 с.
Budell B. 1964. Untersuchungen der Antherenentwicklung einiger Blȕtenpflanzen. – Zeitschr. Bot. 52 (1): 1–28.
Chauhan S.V.S., Gupta H.K. 2006. Suppression of endothecium development by malformed tapetum in the anthers of chemically treated Lens culinaris. – Phytomorphology. 56 (1–2): 10–16.
Davis G.L. 1966. Systematic embryology of the Angiosperms. N. Y. – London – Sydney. 528 p.
Eames A.J. 1961. Morphology of the angiosperms. New York. 518 p.
Eddie W.M.M., Shulkina T., Gaskin J., Haberle R.C., Jansen R.K. 2003. Phylogeny of Campanulaceae s. str. inferred from its sequences of nuclear ribosomal DNA. – Ann. Missouri Bot. Gard. 90 (4): 554–575.
Fei J., Tan S., Zhang F., Hua L., Liao Y., Fang W., Chen F., Teng N. 2016. Morphological and physiological differences between dehiscent and in dehiscent anthers of Chrysanthemum morifolium. – J. Plant Res. 129 (6): 1069–1082.
[Freiberg] Фрейберг Т.Е. 1987. Семейство Bignoniaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae–Asteraceae. Л. С. 259–264.
[Geltman] Гельтман Д.В. 2019. Современные системы цветковых растений. – Бот. журн. 104 (4): 503–527. https://doi.org/10.1134/S0006813619040045
[Kamelin et al.] Камелин Р.В., Овеснов С.А., Шилова С.И. 1999. Неморальные элементы во флорах Урала и Сибири. Пермь. 83 с.
[Kamelina] Камелина О.П. 1981a. Пыльник. – В кн.: Сравнительная эмбриология цветковых растений. Winteraceae–Juglandaceae. Л. С. 18–21.
[Kamelina] Камелина О.П. 1981b. Семейство Daphniphyllaceae. – В кн.: Сравнительная эмбриология цветковых растений. Winteraceae–Juglandaceae. Л. С. 172–176.
[Kamelina] Камелина О.П. 2009. Систематическая эмбриология цветковых растений. Двудольные. Барнаул. 501 с.
[Kamelina, Dzevatovsky] Камелина О.П., Дзевалтовский А.К 1987. Семейство Lamiaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae–Asteraceae. Л. С. 252–236.
[Kamelina, Zhinkina] Камелина О.П., Жинкина Н.А. 1989. К эмбриологии Ostrowskia magnifica (Campanulaceae). Развитие мужских эмбриональных структур. – Бот. журн. 74 (1): 1293–1301.
[Kamelina, Zhukova] Камелина О.П., Жукова Г.Я. 1987. Семейство Valerianaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae–Asteraceae. Л. С. 171–177.
[Kolakovsky] Колаковский А.А. 1987. Система cемейства Campanulaceae Старого Света. – Бот. журн. 72 (12): 1572–1579.
[Kolakovsky] Колаковский А.А. 1995. Семейство колокольчиковых. М. 92 с.
[Korobova, Zhinkina] Коробова С.Н., Жинкина Н.А. 1987. Семейство Campanulaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae–Asteraceae. Л. С. 300–308.
Lundberg J., Bremer K. 2003. A phylogenetic study of the order Asterales using one morphological and three molecular data sets. – Int. J. Plant Sci. 164 (4): 553–578.
[Miroshnichenko] Мирошниченко Н.Н. 2014. Особенности репродуктивной биологии некоторых видов рода Campanula. – В кн.: Сборник научных трудов ГНБС. 139: 136–146.
[Miroshnichenko] Мирошниченко Н.Н. 2019a. Особенности развития и размножения Campanula talievii Juz.в Крыму. – Бюл. ГНБС. 130: 141–148. https://doi.org/10.25684/NBG.boolt.130.2019.20
[Miroshnichenko] Мирошниченко Н.Н. 2019b. Репродуктивная биология и особенности размножения некоторых представителей рода Campanula в Крыму: Автореф. дис. … канд. биол. наук. Ялта. 24 с.
Narayana L.L. 1963. Contributions to the embryology of Balsaminaceae. – J. Ind. Bot. Soc. 42 (1): 102–109.
[Nikiticheva] Никитичева З.И. 1987. Семейство Scrophulariaceae. – В кн.: Сравнительная эмбриология цветковых растений. Davidiaceae–Asteraceae. Л. С. 251–259.
Pacini E. 2010. Relationships between tapetum, loculus, and pollen during development. – Int. J. Plant Sci. 171 (1): 1–11.
[Prozina] Прозина З.П. 1960. Практикум по цитологии растений. М. 255 с.
Rieu I., Wolters-Arts M., Derksen J., Mariani C., Weterings K. 2003. Ethylene regulates the timing of anther dehiscence in tobacco. – Planta. 217: 131–137.
[Rodina, Oleinik] Родина Е.Ю., Олейник Д.А. 2018. Система APG IV и ее сравнение с системой Тахтаджяна на примере покрытосеменных Сахалинской области. – Межд. журнал прикладных и фундаментальных исследований. 9: 98–105.
Scott, R.J., Spielman M., Dickinson H.G. 2004. Stamen structure and function. – The Plant Cell. 16 (Suppl.): S46–S60.
[Shamrov] Шамров И.И. 1986. Развитие пыльника у Gentiana lutea (Gentianaceae). – Бот. журн. 71 (6): 733‑739.
Shamrov I.I. 1988. Structure of septate anthers in some flowering plants. – Ann. Sci. de l’Univ. Reims. 23: 68–70.
[Shamrov] Шамров И.И. 2015. Эмбриология и воспроизведение растений. СПб. 200 с.
[Shamrov et al.] Шамров И.И., Анисимова Г.М., Бабро А.А. 2019. Формирование стенки микроспорангия пыльника и типизация тапетума покрытосеменных растений. – Бот. журн. 104 (7): 1001–1032. https://doi.org/10.1134/S0006813619070093
Shamrov I.I., Anisimova G.M., Babro A.A. 2020. Early stages of anther development in flowering plants. – Botanica Pacifica. 9 (2): 1–10. https://doi.org/10.17581/bp.2020.09202
[Shevchenko] Шевченко С.В. 2020. Генезис структур генеративной сферы Platycodon grandiflorus (Jacq.) A. DC. – Бюл. ГНБС. 136: 87–97. https://doi.org/10.36305/0513-1634-2020-136-87-97
[Shevchenko, Krainyuk] Шевченко С.В., Крайнюк Е.С. 2019. Биология развития и распространение Adenophora taurica (Campanulaceae) в Крыму. – Бот. журн. 104 (10): 1588–1597. https://doi.org/10.1134/S000681361908009X
[Shipunov] Шипунов А.Б. 2003. Система цветковых растений: синтез традиционных и молекулярно-генетических подходов. – Журн. общ. биол. 64 (6): 499–507.
Schönland S. 1889–1894. Campanulaceae. – In: Engler A, Prantl K. Die natürlichen Pflanzenfamilien. Leipzig. IV (5): 40–70.
[Shulkina] Шулькина Т.В. 1983. Биоморфологический анализ семейства Campanulaceae Juss.: Автореф. дис. … докт. биол. наук. Л. 40 с.
Steffen K., Landmann W. 1958. Entwicklungsgeschichte und Zytologische Untersuchungen am Balkentapetum von Gentiana cruciata und Impatiens grandulifera. – Planta. 50 (4): 423–460.
Venkareswarlu J., Lakshminarayana L. 1957. A contribution to the embryolohy of Hydrocera triflora W. and A. – Phytomorphology. 7 (2): 194–203.
[Victorov, Kuranova] Викторов В.П., Куранова Н.Г. 2017. Некоторые проявления внутриорганизменной изменчивости в роде Campanula. – В кн.: Биоразнообразие: подходы к изучению и сохранению: матер. Междунар. науч. конф., посвященной 100‑летию кафедры ботаники Тверского гос. ун-та (г. Тверь, 8–11 ноября 2017 г.). Тверь. С. 47–50.
[Zhinkina] Жинкина Н.А. 1995. Сравнительная эмбриология представителей семейства Campanulaceae Juss: Дис. … канд. биол. СПб. 131 с.
[Zhinkina] Жинкина Н.А. 2010. Семейство Campanulaceae. – В кн.: Сравнительная анатомия семян. Т. 7. Двудольные. Lamiidae, Asteridae. СПб. С. 354–365.
[Zhinkina, Evdokimova] Жинкина Н.А., Евдокимова Е.Е. 2020. Развитие пыльника у Platycodon grandiflorus (Campanulaceae). – Бот. журн. 105 (3): 93–102.
Zhinkina N.A., Shamrov I.I. 1997. Embryology of Azorina vidalii and Gadellia lactiflora (Campanulaceae). – Bulletin of the Polish Academy of Sciences. 45 (2–4): 119–134.
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


