Ботанический журнал, 2022, T. 107, № 9, стр. 869-884
СТРУКТУРНОЕ РАЗНООБРАЗИЕ УСТЬИЧНЫХ И ПЕРИСТОМАТИЧЕСКИХ КОЛЕЦ
А. А. Паутов 1, *, Ю. О. Сапач 1, Г. Р. Трухманова 1, О. В. Яковлева 2, Е. Г. Крылова 1, И. А. Паутова 2
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, Ул. Проф. Попова, 2, Россия
* E-mail: a.pautov@spbu.ru
Поступила в редакцию 12.06.2022
После доработки 16.07.2022
Принята к публикации 19.07.2022
- EDN: HBBRTY
- DOI: 10.31857/S0006813622090083
Аннотация
Устьичные и перистоматические кольца – структурные элементы клеток устьичных комплексов. Устьичные кольца находятся на замыкающих клетках, перистоматические кольца – на побочных и соседних клетках. Методы световой, сканирующей и трансмиссионной электронной микроскопии были использованы для изучения их строения и расположения на клетках устьичных комплексов у 38 видов цветковых растений. Были определены также типы устьичных комплексов, расположение в них замыкающих и побочных клеток, размер устьиц, геометрия стенок замыкающих клеток. В типичном случае устьичные кольца образованы складками кутикулы. Субкутикулярное пространство таких складок заполнено пектиновыми веществами. Перистоматические кольца могут иметь такое же строение. Они могут быть образованы также локальными утолщениями кутикулы, папиллами, целлюлозными клеточными стенками. Обсуждается морфологическое разнообразие устьичных и перистоматических колец. Как тенденция отмечены связи между наличием устьичных колец, расположением устьиц на побочных клетках и геометрией стенок замыкающих клеток, а также между морфологией устьичных колец и размером устьиц. Продемонстрирована возможность образования перистоматических колец из латеральных устьичных складок, т.е. складок, которые отходят в стороны от устьиц.
Складчатый микрорельеф поверхности отмечен для самых разных надземных частей растений, включая листья (Koch et al., 2009). Хотя такой микрорельеф поверхности воспринимается как чисто кутикулярное образование, возникать он может на разной основе. В ряде случаев кутикула повторяет неровности поверхности целлюлозной части клеточной стенки. Специфический микрорельеф может возникать из-за отложения в субкутикулярном пространстве минеральных включений, например, окислов кремния. Во многих случаях сама кутикула образует складки, субкутикулярное пространство в которых заполнено пектиновыми веществами. Это пространство также иногда содержит волокна, подобные волокнам целлюлозных стенок (Cheng et al., 1986; Koch et al., 2009). Примечательно, что складчатость поверхности может сохраняться после удаления кутикулы с поверхности стенок (Cheng et al., 1986).
Микрорельеф поверхности листьев постоянен у многих видов (Kong, 2001; Yang, Lin, 2005). Изменение различных климатических и эдафических факторов обычно не влияет на развитие и форму складок (Ahmad, 1962). По этой причине особенности микрорельефа поверхности часто рассматриваются в качестве хороших диагностических признаков для разграничения видов и таксонов других рангов (Wilkinson, 1979; Dehgan, 1980; Fontenelle et al., 1994; Klimko, Truchan, 2006; Srinual, Thammathaworn, 2008; Akçin, 2013). Данный факт представляет собой несомненную ценность при изучении палеоботанических объектов (Tarran et, al., 2016). Не отвергая такого взгляда, нельзя не отметить, что по мнению ряда исследователей микроморфологию рельефа следует использовать в сочетании с другими морфологическими и анатомическими характеристиками (Deghan, 1980; Olowokudejo, 1993). Не для всех семейств наличие тех или других кутикулярных структур является таксономически значимым (Baranova, Ostroumova, 1987).
К настоящему времени высказано много суждений относительно функций складчатого микрорельефа. Поверхность растений играет важную роль во взаимодействии с биотической и абиотической средой (Koch et al., 2009). Шероховатость поверхности, вызванная различными микроструктурами, усиливает ее гидрофобность (Barthlott, Neinhuis, 1997; Neinhuis, Barthlott, 1997). Кроме этого, скатывающиеся с поверхности листа капли воды очищают ее, унося споры грибов и различные загрязняющие частицы.
Предполагается, что складчатость кутикулы способна снизить температуру поверхности за счет увеличения турбулентности потоков воздуха возле листовой пластинки (Bargel et al., 2006). Согласно A. Jayeola (1998) влияние микрорельефа поверхности на движение воздуха отражается также на потерях воды через устьица.
Поверхностной складчатости приписывается ряд специфических функций. Так, наличие складок на лепестках цветков привело к предположению, что складки служат тактильными сигналами, направляющими насекомых-опылителей к источникам нектара (Kevan, Lane, 1985). Существуют сообщения, согласно которым складки поверхности влияют на механические свойства клеточных стенок. Например, по мнению А.Е. Васильева (Vasil’ev, 1965) развитие складчатости кутикулы на нижней эпидерме придает прочность листьям осин. Полагают, что не только наличие лентовидных вторичных утолщений клеточных стенок фиброзного слоя, но и складчатость поверхности эпидермы может приводить к такой деформации клеток на фоне обезвоживания тканей, которая влечет за собой вскрывание пыльников (Cheng et al., 1986).
Характерной особенностью эпидермы листьев большого числа цветковых растений является наличие складок на клетках устьичных комплексов. Складки могут радиально расходиться от устьица. Такое их расположение наблюдается, прежде всего, вокруг крупных первичных устьиц (Dunn et al., 1965; Staveren, Baas, 1973). Неоднократно было описано латеральное расположение складок. В качестве примеров растений с таким расположением складок называют Cariaria nepalensis Well (Cariariaceae), Simira rubra (Mart.) Steyeem. (Rubiaceae), ряд представителей рода Populus (Wilkinson, 1979; Moraes et al., 2009). Клетки устьичных комплексов могут нести кольцеобразно расположенные складки. Видимо первой, кто обратила внимание на существование таких складок, была H.P. Wilkinson (1971, цит. по Staveren, Baas, 1973), которая ввела в обиход термин “перистоматическое кольцо” (англ. peristomatal rim). Поскольку приставка “пери” означает “вокруг, около, возле”, то получается, что перистоматическое кольцо – это кольцо, расположенное вокруг устьица на клетках, его окружающих. Такие кольца могут частично перекрывать (накрывать, прикрывать сверху) замыкающие клетки. Позднее было обнаружено, что образованные складками кольца могут целиком располагаться на устьицах. По аналогии с перистоматическими кольцами их было предложено назвать “устьичными кольцами” (англ. stomatal ring) (Pautov et al., 2019).
Иногда наблюдается сочетание кольцевых и радиально расходящихся складок. Такая комбинация складок особенно характерна для крупных первичных устьиц тех видов растений, вторичные устьица которых окружены складками. Она отмечена, в частности, у Nyssa sylvatica Marshall (Nyssaceae), Picrasma quassioides (D. Don) Benn. (Simaroubaceae), Gordonia lasiathus (L.) J. Ellis (Thea-ceae), Coccoloba trollii Brandbyge (Polygonaceae) (Wilkinson, 1979; Anderson, 1983; Brandbyge, 1989).
Наличие на поверхности клеток устьичных комплексов закономерно расположенных складок позволяет предположить, что они влияют на устьичную механику. Такое предположение было, в частности, сделано Н.И. Кочетовой и Ю.В. Кочетовым (Kochetova, Kochetov, 1982). Эти авторы предположили, что подходящие к устьицу латеральные складки могут увеличиваться и уменьшаться под влиянием различных факторов внешней среды, способствуя открыванию или, напротив, закрыванию устьичной щели.
Помня о возможном влиянии складок на механические свойства клеточных стенок, было высказано предположение, согласно которому складки влияют на деформацию клеток устьичных комплексов при изменении в них тургорного давления (Pautov et al., 2002). Известно, что изменение величины апертуры может происходить не только в результате активных, но и гидропассивных устьичных движений. Последние способны нарушить регулируемое функционирование устьиц. Использование компьютерного моделирования показало, что наличие на побочных клетках определенным образом расположенных латеральных складок меняет деформацию клеток при изменении в них тургорного давления таким образом, что гидропассивных движений не происходит или они минимальны (Pautov et al., 2002).
Моделирование – один из основных методов изучения устьичной механики. За более чем столетнюю историю изучения устьиц были использованы механические, математические и, наконец, компьютерные модели (Jost, 1907; Aylor et al., 1973; Woolfenden et al., 2017). Существующие знания о механике устьичных движений основываются, прежде всего, на результатах этих моделирований. Принципиально важным моментом при моделировании является приближение модели по основным характеристикам к моделируемому объекту, в нашем случае – к устьичным комплексам. Среди таких характеристик – морфология устьичного комплекса и его клеток, включая геометрию их оболочек и рельеф поверхности.
Цель работы – оценить существование связи между наличием устьичных и перистоматических колец на поверхности клеток устьичных комплексов и структурной организацией этих комплексов. Ее задачи: изучить строение складок и их расположение на наружных тангентальных стенках замыкающих и побочных (соседних) клеток, определить типы устьичных комплексов, размер устьиц, взаимное расположение друг относительно друга их замыкающих и побочных клеток, охарактеризовать геометрию стенок замыкающих клеток.
МАТЕРИАЛЫ И МЕТОДЫ
Материал собран в ботанических садах им. Петра Великого БИН РАН, Санкт-Петербургского государственного университета, субтропического сада “Белые ночи”. Изучено строение устьичных комплексов у 38 видов двудольных растений: Acokanthera oblongifolia (Hochst.) Codd (Apocynaceae), A. oppositifolia (Lam.) Codd (Apocynaceae), Artocarpus heterophyllus Lam. (Moraceae), Cleyera japonica Thunb. (Pentaphylacaceae), Coptosperma cymosum (Willd. ex Schult.) De Block (Rubiaceae), Coriaria japonica A. Gray (Coriaria-ceae), C. nepalensis Wall. (Coriariaceae), Diospyros kaki Thunb. (Ebenaceae), Elaeodendron xylocarpum (Vent.) DC. (Celastraceae), Exbucklandia populnea (R. Br. ex Griff.) R.W. Brown (Hamamelidaceae), Fagraea ceilanica Thunb. (Gentianaceae), Ficus microcarpa L. f. (Moraceae), Heptaplerum actinophyllum (Endl.) Lowry et G.M. Plunkett (Araliaceae), Hura crepitans L. (Euphorbiaceae), Ilex corallina Franch. (Aquifoliaceae), Ixora javanica (Blume) DC. (Rubiaceae), Kadsura japonica (L.) Dunal (Schisandraceae), Myrsine australis (A. Rich.) Allan (Primulaceae), Neopanax colensoi (Hook. f.) Allan (Araliaceae), Osmanthus yunnanensis (Franch.) P.S. Green (Olea-ceae), Photinia davidiana (Decne.) Cardot (Rosaceae), Plumeria obtusa L. (Apocynaceae), Populus heterophylla L. (Salicaceae), P. mexicana Wesm. ex DC. (Salicaceae), P. pruinosa Schrenk (Salicaceae), P. szechuanica C.K. Schneid. (Salicaceae), Prunus laurocerasus L. (Rosaceae), P. lusitanica L. (Rosa-ceae), Pseudopanax crassifolius (Sol. ex A. Cunn.) K. Koch (Araliaceae), Pyracantha hort. ‘Morel’ (Rosaceae), Rhaphiolepis umbellata (Thunb.) Makino (Rosaceae), R. × delacourii André (Rosaceae), Sarcococca hookeriana var. digyna Franch. (Buxaceae), Schefflera digitata J.R. Forst. et G. Forst. (Araliaceae), Stenocarpus salignus R. Br. (Proteaceae), Ternstroemia gymnanthera (Wight et Arn.) Bedd. (Pentaphylacaceae), Viburnum odoratissimum Ker Gawl. (Viburnaceae), V. suspensum Lindl. (Viburnaceae). Названия видов приведены в соответствии с International Plant Names Index (IPNI) (https://www.ipni.org. Дата обращения 10.06.2022). Выбор объектов исследования обусловлен наличием на их устьицах и побочных (соседних) клетках устьичных и (или) перистоматических колец. Была изучена эпидерма не менее 6 листьев каждого вида.
Часть материала фиксировали в 70%-м спирте. Изучены фрагменты листовой пластинки, взятые из ее средней части между главной жилкой и краем листа. Эпидерма с фрагментов пластинки была отделена методом мацерации (Kerp, 1990) и окрашена сафранином. Просмотр препаратов для определения типов устьичных комплексов и измерения длины устьиц проводили с помощью светового микроскопа Leica DM1000 (Wetzlar, Germany). Снимки были сделаны с помощью камеры Leica EC3.
Материал для электронной микроскопии фиксировали в 3%-м растворе глутарового альдегида на 0.1 М фосфатном буфере (рН 7.4) с постфиксацией в 2%-м растворе OsO4 на 0.1 М фосфатном буфере (рН 8.0). После обезвоживания в серии спиртов и ацетонов возрастающих концентраций материал заключали в смесь эпона и аралдита. Полутонкие срезы толщиной 1–3 мкм были изготовлены на ультратоме Sorvall RMC MT500 (Du Pont Company, USA). Их контрастировали раствором цитрата свинца, приготовленного по методике E.S. Reynolds (Reynolds, 1963). Микрофотографии были получены на электронном микроскопе Zeiss Libra 120 (Oberkochen, Germany). Поверхность листьев изучена на сканирующем электронном микроскопе JSM-6390LA. Объекты исследования обезвоживали в серии спиртов, проводили через смесь изоамилацетата со спиртом и чистый изоамилацетат. Затем образцы высушивали при критической точке жидкой углекислоты. Сухие объекты наклеивали на столики, напыляли золотом и изучали в микроскопе.
Качественная оценка степени размеров устьиц дана по следующей схеме: >10–20 мкм – мелкие; >20–30 мкм – средних размеров; >30–40 мкм – крупные; >40–50 мкм – очень крупные; >50 мкм – чрезвычайно крупные устьица.
РЕЗУЛЬТАТЫ
В ходе изучения эпидермы листьев модельных объектов выделено несколько способов расположения кольцеобразных складок на наружных тангентальных стенках замыкающих клеток. Одним из них является формирование колец выступов, т.е. колец, расположенных непосредственно на наружных устьичных выступах (рис. 1 a, b, d–h). Их наличие отмечено у Acokanthera oblongifolia, A. oppositifolia, Exbucklandia populnea, Rhaphiolepis umbellata, R. × delacouri, Ternstroemia gymnanthera. Кольцо представляет собой либо кутикулярный валик (рис. 1 b, d), либо, реже, загнутый в сторону пластинки край устьичного выступа. В последнем случае краевое устьичное кольцо напоминает край пластмассового стаканчика. Такое строение кольца выступов свойственно Acokanthera oblongifolia и A. oppositifolia.
Рис. 1.
Устьичные комплексы с кольцами выступов (a–h) и краевыми устьичными кольцами (i–k) у Exbucklandia populnea (a–c), Ternstroemia gymnanthera (d, e), Acokanthera oblongifolia (f), Acokanthera oppositifolia (g), Raphiolepis × delacourii (h), Viburnum suspensum (i), Photinia davidiana (j), Osmanthus yunnanensis (k). a, e–j – фрагменты поверхности листовой пластинки (SEM). b, d, k – фрагменты поперечных срезов устьичных комплексов по данным СЭМ (b, d) и ТЭМ (k). c – внутренняя поверхность устьичного комплекса (световой микроскоп). ol – наружный устьичный выступ, rl – кольцо выступов, la – апертура наружных устьичных выступов, gc – замыкающая клетка, sc – побочная клетка, nc – соседняя клетка, wp – восковая пробка, mr – краевое устьичное кольцо. Масштабные линейки: a, c, f–j – 10 мкм; b, d, k – 5 мкм; e – 20 мкм.
Fig. 1. Stomatal complexes with rings of ledges (a–h) and marginal stomatal rings (i–k) in Exbucklandia populnea (a–c), Ternstroemia gymnanthera (d, e), Acokanthera oblongifolia (f), Acokanthera oppositifolia (g), Raphiolepis × delacourii (h), Viburnum suspensum (i), Photinia davidiana (j), Osmanthus yunnanensis (k). a, e–j – fragments of leaf blade surface under SEM. b, d, k – fragments of cross sections of a stomatal complex under SEM (b, d) and TEM (k). c – inner surface of a stomatal complex under light microscope. ol – outer stomatal ledge, rl – ring of ledges, la – outer stomatal ledge aperture, gc – guard cell, sc – subsidiary cell, nc – neighbouring cell, wp – wax plug, mr – marginal stomatal ring. Scale bars: a, c, f–j – 10 µm; b, d, k – 5 µm; e – 20 µm.

Устьичные комплексы относятся преимущественно к энциклоцитному (Acokanthera oblongifolia, A. oppositifolia, Exbucklandia populnea), реже – стефаноцитному (Rhaphiolepis umbellata, R. × delacouri) и аномоцитному (Ternstroemia gymnanthera) типам. Их устьица, за исключением Rhaphiolepis × delacouri, имеющего устьица средних размеров, крупные (Acokanthera oblongifolia, Exbucklandia populnea, Rhaphiolepis umbellata) или очень крупные (Acokanthera oppositifolia, Ternstroemia gymnanthera) (табл. 1). Для устьиц характерны мощные наружные выступы. У большинства изученных видов устьица лежат на побочных клетках (рис. 1b). Стенки замыкающих клеток утолщены неравномерно. Как правило, наиболее сильно утолщены те части внутренних тангентальных стенок, которые граничат с устьичной щелью. Остальная часть внутренних тангентальных стенок, смежных со стенками побочных клеток, напротив, тонкая. Исключение – Ternstroemia gymnanthera. Замыкающие клетки этого вида лежат на одном уровне с соседними клетками (рис. 1d). Они демонстрируют и иную геометрию стенок: одинаково сильно утолщены наружные и внутренние тангентальные стенки, утоньшены – антиклинальные стенки, связанные срединными пластинками с соседними клетками (рис. 1d). Эпидерма Rhaphiolepis × delacouri, Rhaphiolepis umbellata, Exbucklandia populnea имеет складчатый рельеф поверхности, наиболее сильно выраженный у первого из перечисленных видов (рис. 1h). Замыкающие клетки часто лежат у изученных видов в небольших углублениях (рис. 1e).
Таблица 1.
Длина устьиц (мкм) (N – число измерений; SD – стандартное отклонение) Table 1. Stomata length (µm) (N – number of observations; SD – standard deviation)
| Вид/Species | N | Min | Average ± SD | Max |
|---|---|---|---|---|
| Acokanthera oblongifolia | 27 | 34.7 | 38.3 ± 1.9 | 41.6 |
| Acokanthera oppositifolia | 21 | 37.0 | 40.6 ± 2.3 | 44.6 |
| Artocarpus heterophyllus | 27 | 20.5 | 22.8 ± 1.2 | 25.4 |
| Cleyera japonica | 21 | 31.3 | 35.7 ± 2.0 | 38.8 |
| Coriaria japonica | 21 | 30.4 | 32.0 ± 1.8 | 36.0 |
| Coriaria nepalensis | 21 | 29.8 | 32.9 ± 1.6 | 35.3 |
| Diospyros kaki | 21 | 23.9 | 32.8 ± 5.0 | 40.2 |
| Elaeodendron xylocarpum | 27 | 28.5 | 32.1 ± 2.3 | 38.1 |
| Exbucklandia populnea | 27 | 27.6 | 33.6 ± 3.5 | 37.9 |
| Fagraea ceilanica | 21 | 27.4 | 30.9 ± 1.6 | 33.6 |
| Ficus microcarpa | 21 | 36.3 | 39.7 ± 1.8 | 42.2 |
| Hura crepitans | 21 | 31.5 | 33.1 ± 2.0 | 36.2 |
| Ilex corallina | 21 | 26.8 | 28.7 ± 2.2 | 33.9 |
| Ixora javanica | 21 | 29.8 | 32.0 ± 1.4 | 33.4 |
| Kadsura japonica | 21 | 60.3 | 66.3 ± 4.6 | 72.7 |
| Prunus lusitanica | 21 | 27.1 | 30.3 ± 1.8 | 35.3 |
| Prunus laurocerasus | 21 | 28.9 | 34.3 ± 1.8 | 36.7 |
| Myrsine australis | 21 | 24.3 | 27.4 ± 1.7 | 29.9 |
| Neopanax colensoi | 27 | 34.5 | 45.3 ± 5.2 | 53.6 |
| Osmanthus yunnanensis | 27 | 23.6 | 27.2 ± 2.0 | 30.4 |
| Plumeria obtusa | 21 | 22.4 | 25.8 ± 2.1 | 30.0 |
| Populus heterophylla | 21 | 25.0 | 26.1 ± 1.0 | 27.3 |
| Populus mexicana | 21 | 32.5 | 35.4 ± 1.9 | 38.6 |
| Populus pruinosa | 21 | 24.9 | 29.0 ± 3.4 | 34.1 |
| Populus szechuanica | 21 | 38.7 | 41.4 ± 1.5 | 43.8 |
| Pseudopanax crassifolius | 21 | 40.9 | 44.7 ± 2.6 | 47.3 |
| Pyracantha hort. “Morel” | 21 | 26.3 | 29.4 ± 2.2 | 32.9 |
| Raphiolepis umbellata | 27 | 27.5 | 30.3 ± 1.7 | 33.5 |
| Raphiolepis × delacourii | 27 | 20.5 | 24.3 ± 2.2 | 30.1 |
| Coptosperma cymosum | 21 | 24.7 | 27.5 ± 1.3 | 29.1 |
| Sarcococca hookeriana var. digyna | 27 | 39.5 | 47.3 ± 3.2 | 52.7 |
| Heptaplerum actinophyllum | 21 | 31.5 | 35.5 ± 2.5 | 45.3 |
| Schefflera digitata | 21 | 24.9 | 28.4 ± 1.8 | 31.4 |
| Stenocarpus salignus | 21 | 34.6 | 36.6 ± 1.4 | 39.5 |
| Photinia davidiana | 21 | 28.0 | 31.3 ± 2.0 | 34.7 |
| Ternstroemia gymnanthera | 21 | 40.9 | 45.4 ± 2.3 | 49.4 |
| Viburnum odoratissimum | 21 | 37.6 | 39.7 ± 2.0 | 43.9 |
| Viburnum suspensum | 27 | 27.1 | 30.1 ± 1.7 | 33.3 |
Еще один тип размещения складок на устьицах демонстрируют краевые устьичные кольца, чаще одиночные (Artocarpus heterophyllus, Elaeodendron xylocarpum, Osmanthus yunnanensis, Pyracantha hort. “Morel”, Viburnum suspensum, Prunus lusitanica, Coptosperma cymosum, Prunus laurocerasus, Neopanax colensoi, Pseudopanax crassifolius, Myrsine australis, Photinia davidiana, Ixora javanica, Fagraea ceilanica, Stenocarpus salignus, Ilex corallina, Viburnum odoratissimum). Краевое устьичное кольцо опоясывает устьице, располагаясь непосредственно на стенках замыкающих клеток (рис. 1 i–k). Такие кольца образованы обычно складками кутикулы, субкутикулярное пространство в которых заполнено пектиновыми веществами (рис. 1k). Это пространство может быть редуцировано до узких пектиновых прожилок. У Stenocarpus salignus их краевые устьичные кольца представляют собой утолщения кутикулы. Кольца сильно истончаются на полюсах устьиц у Osmanthus yunnanensis.
Устьичные комплексы аномоцитные (Prunus laurocerasus, Prunus lusitanica, Photinia davidiana, Artocarpus heterophyllus, Pyracantha hort. ‘Morel’), латероцитные (Viburnum suspensum, Elaeodendron xylocarpum, Osmanthus yunnanensis), парацитные (Coptosperma cymosum, Stenocarpus salignus), анизоцитные (Neopanax colensoi, Pseudopanax crassifolius, Myrsine australis, Fagraea ceilanica), аллелоцитные (Ixora javanica). Перечислены доминирующие типы устьичных комплексов. Вместе с этим, у ряда видов резко выражена гетеростоматность. Так, в эпидерме Fagraea ceilanica присутствуют геликоцитные и анизоцитные комплексы, в эпидерме Viburnum odoratissimum – парацитные и латероцитные комплексы, у Ilex corallina – тетрацитные, анизоцитные, ставроцитные комплексы. Устьица средних размеров (Coptosperma cymosum, Myrsine australis, Artocarpus heterophyllus, Pyracantha hort. ‘Morel’, Ilex corallina), крупные (Prunus lusitanica, P. laurocerasus, Photinia davidiana, Viburnum odoratissimum, Viburnum suspensum, Elaeodendron xylocarpum, Ixora javanica, Fagraea ceilanica, Stenocarpus salignus) и очень крупные (Neopanax colensoi, Pseudopanax crassifolius) (табл. 1). Они лежат на побочных клетках. Стенки замыкающих клеток утолщены неравномерно. Как и в типичных устьичных комплексах с кольцом выступов, сильнее прочих утолщены те части их внутренних тангентальных стенок, которые обращены к устьичной щели. Остальные части внутренних тангентальных стенок, смежные со стенками побочных клеток, тонкие (рис. 1k).
Существуют варианты этого типа, связанные с особенностями микрорельефа поверхности как замыкающих, так и околоустьичных (побочных и соседних) клеток. Так, замыкающие клетки могут быть опоясаны не одинарным кольцом, а несколькими, обычно переплетающимися складками, образующими своего рода составные краевые устьичные кольца (рис. 2 a–d). Часть складок может переходить на околоустьичные клетки. Составные кольца отмечены у Cleyera japonica, Prunus laurocerasus и Sarcococca hookeriana var. digyna. У некоторых видов, иногда в пределах одной пластинки листа, встречаются как одинарные, так и составные кольца (Prunus laurocerasus, Sarcococca hookeriana var. digyna). Устьица с составными кольцами входят в состав аномоцитных (Prunus laurocerasus, Cleyera japonica) и латероцитных (Sarcococca hookeriana var. digyna) устьичных комплексов. Они крупные (Prunus laurocerasus, Cleyera japonica) и очень крупные (Sarcococca hookeriana var. digyna) (табл. 1).
Рис. 2.
Составные (a–d) и многочисленные (e–h) краевые устьичные кольца у Prunus laurocerasus (a), Sarcococca hookeriana var. digyna (b), Cleyera japonica (c, d), Kadsura japonica (e, f), Hura crepitans (g, h). a–g – фрагменты поверхности листовой пластинки (СЭМ). h – фрагмент поперечного среза устьичного комплекса ( ТЭМ). ol – наружный устьичный выступ, la – апертура наружных устьичных выступов, cr – составное краевое устьичное кольцо, gc – замыкающая клетка, sc – побочная клетка, nr – многочисленные краевые устьичные кольца, sf – складки поверхности побочных (соседних) и основных клеток эпидермы. Масштабные линейки: a–g – 10 мкм; h – 5 мкм.
Fig. 2. Composite (a–d) and numerous (e–h) marginal stomatal rings in Prunus laurocerasus (a), Sarcococca hookeriana var. digyna (b), Cleyera japonica (c, d), Kadsura japonica (e, f), Hura crepitans (g, h). a–g – fragments of leaf blade surface under SEM. h – fragment of a stomatal complex cross section under TEM. ol – outer stomatal ledge, la – outer stomatal ledge aperture, cr – composite marginal stomatal ring, gc – guard cell, sc – subsidiary cell, nr – numerous marginal stomatal rings, sf – folds of the surfaces of subsidiary (neighbouring) and ordinary epidermal cells. Scale bars: a–g – 10 µm; h – 5 µm.

На наружных тангентальных стенках замыкающих клеток может располагаться не одно, а несколько параллельно лежащих краевых устьичных колец (Kadsura japonica, Diospyros kaki, Hura crepitans) (рис. 2 e–h). Наружные кольца нередко не замкнуты и переходят в складки на поверхности околоустьичных клеток. Устьица у этих видов от крупных (Diospyros kaki, Hura crepitans) до чрезвычайно крупных (Kadsura japonica) (табл. 1). Устьичные комплексы парацитные (Hura crepitans), парацитные и латероцитные (Kadsura japo-nica), аномоцитные (Diospyros kaki).
Еще более разнообразен рельеф поверхности клеток, примыкающих к устьицам, несущим краевые кольца. У части изученных видов поверхность возле устьиц лишена складок (Artocarpus heterophyllus, Pyracantha hort. ‘Morel’, Elaeodendron xylocarpum, Viburnum suspensum, Photinia davidiana) (рис. 1i, j). При этом устьица некоторых из них слегка погружены в покровную ткань (Artocarpus heterophyllus, Elaeodendron xylocarpum). Это может происходить, в частности, в результате более сильного развития кутикулы на стенках побочных клеток. Устьичные комплексы этих растений аномоцитные и латероцитные.
Выше, при характеристике составных и многочисленных краевых устьичных колец, было отмечено, что их складки могут переходить с замыкающих на околоустьичные клетки. Чаще складки на поверхности околоустьичных клеток структурно не связаны со складками на замыкающих клетках. Перечислим наиболее характерные варианты их расположения на околоустьичных клетках комплексов, замыкающие клетки которых обладают краевыми устьичными кольцами.
Складки части видов плотно размещены на поверхности околоустьичных клеток. При этом они могут располагаться без видимого порядка (Viburnum odoratissimum, Myrsine australis) (рис. 3a). В формировании таких складок может принимать участие целлюлозная стенка (Viburnum odoratissimum). В этом случае ее поверхность неровная. Покрытые кутикулой выступающие части стенки образуют складчатость.
Рис. 3.
Складки около устьиц у Viburnum odoratissimum (a), Coriaria japonica (b), Stenocarpus salignus (c), Fagraea ceilanica (d), Prunus lusitanica (e), Ilex corallina (f), Coptosperma cymosum (g), Prunus laurocerasus (h), Ixora javanica (i), Neopanax colensoi (j, k). a–j – фрагменты поверхности листовой пластинки (СЭМ). k – фрагмент поперечного среза стенок между эпидермальными клетками (ТЭМ). mr –краевое устьичное кольцо, sf – складки поверхности побочных (соседних) и основных клеток эпидермы, lf – латеральные складки, pr – перистоматическое кольцо, fl – продольная складка, nfl – многочисленные продольные складки, cpr – составное перистоматическое кольцо, ps – перистоматическая спираль, c – кутикула, cw – клеточная стенка, ml – срединная пластинка. Масштабные линейки: a–j – 10 мкм, k – 2 мкм.
Fig. 3. Folds near stomata in Viburnum odoratissimum (a), Coriaria japonica (b), Stenocarpus salignus (c), Fagraea ceilanica (d), Prunus lusitanica (e), Ilex corallina (f), Coptosperma cymosum (g), Prunus laurocerasus (h), Ixora javanica (i), Neopanax colensoi (j, k). a–j – fragments of the leaf blade surface under SEM. k – fragment of a cross section of the walls between epidermal cells under TEM. mr – marginal stomatal ring, sf – folds of the surfaces of subsidiary (neighbouring) and ordinary epidermal cells, lf – lateral folds, pr – peristomatal rim, mr – marginal stomatal ring, fl – longitudinal fold, nfl – numerous longitudinal folds, cpr – composite peristomatal rim, ps – peristomatal spiral, c – cuticle, cw – cell wall, ml – middle lamella. Scale bars: a–j – 10 µm, k – 2 µm.

В эпидерме Coriaria japonica, C. nepalensis и Plumeria obtusa присутствуют устьичные комплексы с латеральным, кольцеобразным и промежуточным между ними расположением складок (рис. 3b). Устьичные комплексы этих видов относятся к парацитному типу. Складки переходят на полюсах их устьиц с одной побочной клетки на другую. Перистоматические кольца в комплексах – многочисленные. Устьица средних размеров (Plumeria obtusa) и крупные (Coriaria japonica, C. nepalensis) (табл. 1). В формировании складок может принимать участие целлюлозная клеточная стенка (Plumeria obtusa). Не только побочные, но и каждая из замыкающих клеток нередко несет 1–2 складки, способные к объединению в краевые устьичные кольца. В состав этих складок у Plumeria obtusa, как и в состав складок на побочных клетках, входит целлюлозная стенка.
В том случае, если складки не переходят на полюсах устьица с одних побочных клеток на другие, образуются комплексы, в которых замыкающие клетки сопровождаются либо многочисленными (Stenocarpus salignus), либо одиночными (Fagraea ceilanica) продольно расположенными перистоматическими складками (рис. 3c, d). В обоих случаях устьица крупные (табл. 1). Они входят в состав парацитных (Stenocarpus salignus) и анизоцитных (Fagraea ceilanica) устьичных комплексов. Рассматриваемые структуры представляют собой складки кутикулы.
Части модельных видов свойственно наличие одиночных перистоматических колец, плотно примыкающих к устьицам (Ilex corallina, Prunus lusitanica) (рис. 3e, f). Положение этих колец сближает их с краевыми устьичными кольцами. Они образованы складками кутикулы. Устьица в этих комплексах окружены побочными или соседними клетками.
Подобно составным устьичным кольцам, перистоматические кольца могут быть образованы переплетающимися складками кутикулы (рис. 3g). Они свойственны Coptosperma cymosum, имеющей устьица средних размеров, входящих в комплексы парацитного типа.
Поверхность листьев некоторых видов может быть покрыта широкими складками (Prunus laurocerasus, Neopanax colensoi, Pseudopanax crassifolius) (рис. 3 h, j, k). Эти складки образуют не всегда замкнутые (Prunus laurocerasus) кольца вокруг устьиц. В формировании мощных перистоматических колец с перекрывающимися концами Prunus laurocerasus принимает участие клеточная стенка. Иначе организован рельеф вокруг устьиц Neopanax colensoi и Pseudopanax crassifolius. Эпидерма этих видов несет кутикулярные утолщения, приуроченные главным образом к антиклинальным стенкам эпидермальных клеток. Так что рисунок утолщений в значительной степени повторяет контуры клеток ткани при взгляде на нее с поверхности. Особенностью этих образований является то, что кутикула не только утолщена над антиклинальными стенками эпидермальных клеток, но и образует клиновидные врастания между ними (рис. 3 j, k).
Для аллелоцитных устьичных комплексов Ixora javanica и геликоцитных комплексов Fagraea ceilanica характерно образование перистоматических спиралей. Один конец каждой такой спирали соединен с краевым устьичным кольцом, другой – свободно лежит на побочных клетках (рис. 3i). Как уже было отмечено, устьица этих видов имеют крупные размеры (табл. 1).
Перистоматические кольца могут формироваться и в тех случаях, когда устьица не имеют краевых устьичных колец. Их можно видеть, в частности, у видов Schefflera, Ficus, Populus.
Перистоматическое кольцо у Heptaplerum actinophyllum и Schefflera digitata образовано имеющими вид кутикулярных дуг складками, от которых отходят в стороны короткие складки-подпорки. Последние упираются в кольцеобразно расположенные более мелкие складки поверхности (рис. 4a). По своей организации эти кольца наиболее близки к составным перистоматическим кольцам. Устьичные комплексы относятся к анизоцитному и геликоцитному комплексу. Устьица средних размеров или крупные (табл. 1). Замыкающие клетки лежат на одном уровне с побочными клетками. Наиболее сильно у них утолщены тангентальные стенки. Самыми тонкими являются дорсальные стенки (рис. 4b).
Рис. 4.
Перистоматические кольца и латеральные складки у Heptaplerum actinophyllum (a, b), Populus szechuanica (c), Populus heterophylla (d), Populus mexicana (e), Populus pruinosa (f), Ficus microcarpa (g, h). a, c–g – фрагменты поверхности листовой пластинки (СЭМ). b, h – фрагменты поперечных срезов эпидермы: b – световая микроскопия, h – ТЭМ. pr – перистоматическое кольцо, sf – складки поверхности основных эпидермальных клеток, wf – покрытые воском складки, gc – замыкающая клетка, sc – побочная клетка, mc – клетка мезофилла, ol – наружный устьичный выступ, il – внутренний устьичный выступ, lf – латеральные складки, s – устьице, p – папилла. Масштабные линейки: a–g – 10 мкм, h – 1 мкм.
Fig. 4. Peristomatal rims and lateral folds in Heptaplerum actinophyllum (a, b), Populus szechuanica (c), Populus heterophylla (d), Populus mexicana (e), Populus pruinosa (f), Ficus microcarpa (g, h). a, c–g – fragments of the leaf blade surface under SEM. b, h – fragments of epidermis cross sections under light microscope (b) and TEM (h). pr – peristomatal rim, sf – folds of the ordinary epidermal cell surface, wf – waxed folds, gc – guard cell, sc – subsidiary cell, mc – mesophyll cell, ol – outer stomatal ledge, il – inner stomatal ledge, lf – lateral folds, s – stoma, p – papilla. Scale bars: a–g – 10 µm, h – 1 µm.
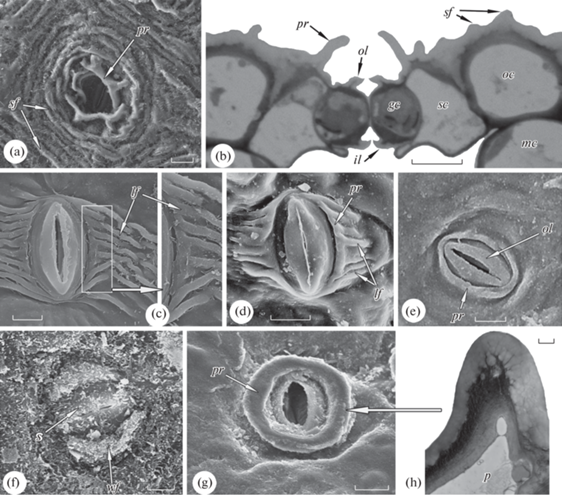
Для большого числа видов тополей характерно наличие складок, которые расходятся в стороны от устьица. Они представляют собой складки кутикулы, субкутикулярное пространство которых заполнено пектиновыми веществами. Основания этих складок у Populus szechuanica, изгибаясь, соединяются друг с другом возле замыкающих клеток. В результате образуются складки, сопровождающие устьица (рис. 4с). Последние вполне соответствуют складкам перистоматического кольца, правда, слабо развитого. Радиальные складки Populus heterophylla могут быть сильно редуцированы, а вот параллельные устьицу складки, напротив, усилены (рис. 4d). Такие складки покрыты у Populus pruinosa мощным слоем эпикутикулярного воска. Завоскованные складки выглядят как утолщения по бокам устьица (рис. 4f). Попутно отметим, что короткие латеральные складки похожи на складки-подпорки у Heptaplerum actinophyllum и Schefflera digitata. Populus mexicana имеет типичные одиночные перистоматические кольца (рис. 4e). В отличие от Prunus lusitanica и Ilex corallina, также имеющих одиночные перистоматические кольца (рис. 3e, f), устьица данного вида лежат на одном уровне с побочными клетками. Его перистоматические кольца существенно перекрывают края устьиц. Устьичные комплексы тополей парацитные и латероцитные. Их устьица средних размеров (Populus heterophylla, P. pruinosa), крупные (P. mexicana) и очень крупные (P. szechuanica) (табл. 1). Геометрия стенок замыкающих клеток тополей не одинакова. У разных их видов могут быть утолщены как вентральные, так и тангентальные стенки.
Иначе организовано перистоматическое кольцо у Ficus microcarpa, устьичные комплексы которого относятся к энциклоцитному типу. Вид обладает двухслойной эпидермой. Замыкающие клетки его устьиц встроены между клетками этих слоев: одни из побочных клеток покрывают примерно наполовину замыкающие клетки сверху, другие – подстилают их снизу. Папиллярные выросты этих клеток образуют кольца: одно наружное (рис. 4 g, h), другое, более мелкое, внутреннее, лежащее со стороны мезофилла. По происхождению такие кольца являются перистоматическими, поскольку образованы побочными клетками. Однако, располагаются они не вокруг устьиц, а над устьицами. Устьица крупные (табл. 1). Наиболее тонкими у их замыкающих клеток являются дорсальные стенки.
ОБСУЖДЕНИЕ
Имеющиеся данные свидетельствуют о том, что устьичные кольца встречаются в различных группах цветковых растений. Они обнаружены в Eudicots (Proteales, Buxales), Superrosids (Saxifragales), Fabids (Rosales, Malpigiales, Celastrales), Asterids (Ericales), Euasterids (Gentianales) и Campanulids (Aquifoliales, Apiales, Dipsacales). Учитывая тот факт, что было изучено относительно небольшое число видов, есть все основания предполагать, что список таких групп на самом деле длиннее.
Проведенная работа показала наличие различных вариантов расположения и строения этих колец. В зависимости от положения на замыкающих клетках выделены кольца выступов, одинарные краевые устьичные кольца, многочисленные устьичные кольца и, наконец, составные краевые устьичные кольца, образованные перекрывающимися или переплетающимися складками. Ультраструктурная организация этих колец может быть разной. Кольца выступов образованы кутикулой. Краевые устьичные кольца чаще всего представляют собой складки кутикулы, субкутикулярное пространство которых заполнено пектиновыми веществами.
Кольца выступов характерны прежде всего для крупных и очень крупных устьиц, имеющих мощные наружные выступы. Эти устьица входят в состав комплексов разного типа. Побочные клетки в них частично смещены под замыкающие клетки. Последние имеют идентичную геометрию стенок.
Таким образом, наблюдается довольно устойчивое сочетание признаков, включающее отмеченное расположение замыкающих и побочных клеток, геометрию стенок замыкающих клеток, гипертрофированно развитые наружные выступы и кольца выступов. Это можно встретить у видов, занимающих удаленное положение в APG IV. Так что, вряд ли оно является случайным. В то же время сочетание не является жестко детерминированным. Например, у Trochodendron aralioides наблюдается обсуждаемый набор признаков, но нет колец выступов. Возможно, эта структура играет вспомогательную роль в выполнении какой-то функции.
Моделирование с использованием программного комплекса ANSYS показывает, что крупные наружные выступы влияют на движения устьиц, лежащих на побочных клетках (Pautov et al., 2017). При увеличении тургорного давления в замыкающих клетках, не имеющих выступов, устьица выгибаются над поверхностью эпидермы. Широко открывающаяся устьичная пора также выносится над эпидермой. Выступы препятствуют движениям наружных тангентальных стенок замыкающих клеток и, напротив, стимулируют движения их внутренних стенок, граничащих с побочными клетками. Результатом этих процессов является уменьшение как ширины открытой устьичной поры, так и величины ее вертикальных перемещений. Степень влияния выступов зависит от их механических характеристик, а именно, от их жесткости. Эта характеристика может определяться как непосредственно свойствами материала выступов, так и их конструктивными особенностями. Нельзя исключать, что кольца выступов играют роль ребер жесткости.
Из общей картины выпадает Ternstroemia gymnanthera. Устьица этого вида также имеют крупные наружные выступы с кольцами, но лежат они на одном уровне с соседними клетками и демонстрируют иную геометрию стенок замыкающих клеток. Без моделирования сложно оценить участие выступов и колец в устьичной механике T. gymnanthera. Необходимо, однако, отметить, что роль гипертрофированно развитых выступов не ограничивается их влиянием на движения замыкающих клеток при изменении в них тургорного давления. Крупные выступы формируют стенки и свод наружных устьичных камер. Показано, что эти камеры способны существенно снизить потери воды при открытых устьицах. Важным условием для этого является узкая апертура наружных выступов, пронизывающая свод камеры (Roth-Nebelsick et al., 2013). Такие апертуры можно встретить и у T. gymnanthera (рис. 1e). В ряде случаев, например у Acokanthera oblongifolia, апертуры заткнуты пробками (рис. 1f). Не исключено, что кольца выступов, внося свой вклад в повышение жесткости стенок устьичных камер, препятствуют изменению апертуры выступов во время устьичных движений. Согласно результатам моделирования, верхние части выступов могут совершать движения в процессе открывания и закрывания устьиц (Pautov et al., 2021). Любопытно, что устьица T. gymnanthera могут нести дополнительные складки, расположенные под кольцами выступов.
Краевые устьичные кольца обнаружены на устьицах, которые имеют разную величину и входят в состав устьичных комплексов разного типа. Эти устьица часто занимают в комплексах такое же положение, как и устьица с кольцами выступов, т.е. лежат на побочных клетках (рис. 1k, 2h). Кроме этого, для них характерна одинаковая с теми устьицами геометрия стенок замыкающих клеток. Чаще были встречены одиночные краевые устьичные кольца. Установлено, что эти кольца, в сочетании с наружными выступами, влияют, подобно гипертрофированно развитым наружным выступам, на устьичные движения (Pautov et al., 2017). Их наличие ведет к уменьшению ширины открытой устьичной поры и ее погружению в эпидерму. Глубина этого погружения вновь зависит от механических характеристик выступов и кольца: больше их жесткость – глубже погружение. В связи с этим интересно формирование на устьицах ряда видов не единичных (рис. 1 i, j), а более мощных составных (рис. 2 a–d) или многочисленных колец (рис. 2 e–g). Выборка не велика. Тем не менее, составные и многочисленные краевые кольца, видимо, менее характерны для мелких устьиц и устьиц средних размеров.
Для эпидермы листьев многих видов цветковых растений свойственно явление гетеростоматности – наличия в эпидерме листа устьичных комплексов, относящихся к разным типам. Устьица листовой пластинки могут существенно различаться также своими размерами. По мнению ряда исследователей, этот признак коррелирует со скоростью устьичной реакции (Raven, 2014). Пример Prunus laurocerasus и Sarcococca hookeriana var. digyna показывает, что в пределах листовой пластинки могут присутствовать устьица как с одним краевым кольцом, так и с составными кольцами (рис. 2a, 3h). Если краевые кольца влияют на деформацию замыкающих клеток и это влияние зависит от механических свойств колец, то очевидно, что в функциональном отношении устьица с одиночными кольцами и составными кольцами не равноценны. Итак, особенности микрорельефа поверхности замыкающих клеток, возможно, не только влияют на функционирование устьиц, но и могут быть причиной их функционального разнообразия в пределах листа.
Перистоматические кольца структурно более разнообразны, чем краевые устьичные кольца. Они могут быть образованы как складками кутикулы, так и локальными утолщениями кутикулы, неровной поверхностью целлюлозной стенки, папиллами. Выделены следующие варианты перистоматических колец: одиночные, многочисленные, составные, широкие, образованные папиллами кольца, перистоматическая спираль. По своему строению и положению наиболее сходны с краевыми кольцами одиночные перистоматические кольца некоторых видов (рис. 3 e, f). Их идентификация в качестве именно перистоматических может быть затруднена. Комбинация краевого устьичного кольца и одиночного перистоматического кольца, видимо, способна усилить механическое воздействие на стенки деформирующихся замыкающих клеток. В этом отношении она напоминает составное краевое устьичное кольцо или смещенные к дорсальным стенкам многочисленные краевые устьичные кольца (рис. 2g).
Перистоматические кольца обнаружены на клетках устьичных комплексов разного типа. Среди них есть комплексы, где побочные, как и соседние, клетки, окружают устьица и комплексы, где побочные клетки лежат по бокам устьица, не соединяясь на его полюсах. Лишь в некоторых случаях была отмечена связь между расположением побочных клеток и складок. Прежде всего это касается перистоматической спирали. Спиральное расположение складок у Fagraea ceilanica следует за спиральным расположением побочных клеток в геликоцитном устьичном комплексе. В анизоцитных комплексах этого вида складки лежат по бокам устьиц (рис. 3d). Спираль образуется и в аллелоцитном комплексе Ixora javanica, где она также соединяет последовательно возникающие разновозрастные побочные клетки.
Если краевые устьичные кольца характерны для устьиц, лежащих на побочных клетках, то перистоматические кольца наблюдаются в комплексах, где устьица занимают как поверхностное положение, так и находятся на одном уровне с побочными клетками. Замыкающие клетки этих устьиц могут иметь разную геометрию стенок.
Имеющиеся материалы свидетельствуют о реальности возникновения перистоматических колец из латеральных складок. Происходить это может по-разному. Приуроченные к побочным клеткам у ряда видов латеральные складки (Coriaria nepalensis, C. japonica, Plumeria obtusa) изгибаются при уменьшении ширины побочных клеток. Последнее может иметь место, например, при изменении взаимного расположения замыкающих и побочных клеток, когда последние смещаются под устьица. Если в таких комплексах складки переходят на полюсах устьица с одной побочной клетки на другую побочную клетку, то возникают многочисленные перистоматические кольца (рис. 3b).
Другой путь возникновения перистоматических колец из латеральных складок демонстрируют тополя (рис. 4 c–e). В этом случае перистоматические кольца образуются из оснований латеральных складок, которые, сливаясь друг с другом, формируют узкое, прерывающееся кольцо (рис. 4 c). Усиление этого кольца и редукция латеральных складок (рис. 4d) может завершиться образованием перистоматического кольца. Такое кольцо действительно обнаружено у тополей (рис. 4 e). Нет сомнений, что подобные переходы неоднократно имели место в эволюции растений.
ЗАКЛЮЧЕНИЕ
Итак, проведенное исследование обнаружило значительное структурное разнообразие устьичных и перистоматических колец. Устьичные кольца представляют собой, обычно, складки кутикулы. Перистоматические кольца могут быть образованы складками кутикулы, локальными утолщениями кутикулы, папиллами, целлюлозными клеточными стенками. На основе морфологических признаков и расположения на тангентальных стенках выделено несколько вариантов устьичных и перистоматических колец. В качестве тенденции отмечены связи между наличием устьичных колец, расположением устьиц на побочных клетках и геометрией стенок замыкающих клеток, а также между типом устьичных колец и размером устьиц. Связей между наличием перистоматических колец на клетках устьичных комплексов, с одной стороны, типом комплексов, взаимным расположением замыкающих и побочных клеток, геометрией стенок замыкающих клеток, с другой, не обнаружено. Побочные и соседние клетки разных видов объединяет периодически происходящее в них изменение тургорного давления. Если верны представления о влиянии устьичных колец на деформацию замыкающих клеток, то, вероятно, есть все основания предполагать, что и перистоматические кольца оказывают влияние на деформацию побочных и соседних клеток во время устьичных движений.
Список литературы
Ahmad K.J. 1962. Cuticular striations in Cestrum. – Curr. Sci. 31: 388–390.
Akçin Ö.E., Şenel G., Akçin Y. 2013. Leaf epidermis morphology of some Onosma (Boraginaceae) species from Turkey. – Turk. J. Bot. 37: 55–64. https://doi.org/10.3906/bot-1202-33
Anderson L.C. 1983. Trichomes and stomata of Gordonia lasianthus (Theaceae) – SIDA. Contrib. bot. 10 (2): 103–113. https://www.jstor.org/stable/23909542
Aylor D.E., Parlange J.-Y., Krikorian A.D. 1973. Stomatal mechanics. – Am. J. Bot. 60 (2): 163–171. https://doi.org/10.1002/j.1537-2197.1973.tb10213.x
[Baranova, Ostroumova] Баранова М.А., Остроумова Т.А. 1987. Признаки устьиц в систематике – Итоги науки и техники. Сер. Ботаника. 6 (1): 173–192.
Bargel H., Koch K., Cerman Z., Neinhuis C. 2006. Structure-function relationships of the plant cuticle and cuticular waxes–a smart material? – Funct. Plant Biol. 33 (10): 893–910. https://doi.org/10.1071/FP06139
Barthlott W., Neinhuis C. 1997. Purity of sacred lotus or escape from contamination in biological surfaces. – Planta 202: 1–8. https://doi.org/10.1007/s004250050096
Brandbyge J. 1989. Two new species of the genus Coccoloba (Polygonaceae). – Nord. J. Bot. 9 (2): 205–208. https://doi.org/10.1111/j.1756-1051.1989.tb02116.x
Cheng P.C., Greyson R.I., Walden D.B. 1986. The anther cuticle of Zea mays. – Can. J. Bot. 64: 2088–2097. https://doi.org/10.1139/b86-274
Deghan B. 1980. Application of epidermal morphology to taxonomic delimitations in the genus Jatropha L. (Euphorbiaceae). – Bot. J. Linn. Soc. 80: 257–278. https://doi.org/10.1111/j.1095-8339.1980.tb01989.x
Dunn D.B., Sharma G.K., Campbell C.C. 1965. Stomatal patterns of dicotyledons and monocotyledons – Am. Midl. Nat. 74 (1): 185–195. https://doi.org/10.2307/2423132
Fontenelle G.B., Costa C.G., Machado R.D. 1994. Foliar anatomy and micromorphology of eleven species of Eugenia L. (Myrtaceae). – Bot. J. Linn. Soc. 116: 111–133. https://doi.org/10.1006/bojl.1994.1056
Jayeola A.A. 1998. Surface sculpturing of Alstonia boonei De Wild. and A. congensis Engl. (Apocynaceae) and its importance on their taxonomy. – Feddes Repert. 109: 429–433. https://doi.org/10.1002/fedr.19981090514
Jost L. 1907. Lectures on plant physiology. Oxford. 564 p.
Kerp H. 1990. The study of fossil Gymnosperms by means of cuticular analysis. – Palaios 5: 548–569.
Kevan P.G., Lane M.A. 1985. Flower petal microtexture is a tactile cue for bees. – Proc. Natl. Acad. Sci. USA 82: 4750–4752. https://doi.org/10.1073/pnas.82.14.4750
Klimko M., Truchan M. 2006. Morphological variability of the leaf epidermis in selected taxa of the genus Ficus L. (Moraceae) and its taxonomic implications. – Acta Soc. Bot. Pol. 75 (4): 309–324. https://doi.org/10.5586/asbp.2006.038
Koch K., Bhushan B., Barthlott W. 2009. Multifunctional surface structures of plants: an inspiration for biomimetics: invited review. – Prog. Mater. Sci. 54: 137–178. https://doi.org/10.1016/j.pmatsci.2008.07.003
[Kochetova, Kochetov] Кочетова Н.И., Кочетов Ю.В. 1982. Адаптивные свойства поверхности растений. М. 176 с.
Kong H.-Z. 2001. Comparative morphology of leaf epidermis in the Chloranthaceae. – Bot. J. Linn. Soc. 136 (3): 279–294. https://doi.org/10.1006/bojl.2001.0442
Moraes T.M., Barros C.F., Silva Neto S.J., Gomes V.M., Da Cunha M. 2009. Leaf blade anatomy and ultrastructure of six Simira species (Rubiaceae) from the Atlantic Rain Forest, Brasil. – Biocell. 33 (3) 155–165.
Neinhuis C., Barthlott W. 1997. Characterization and distribution of water-repellent, self-cleaning plant surfaces. – Ann. Bot. 79: 667–677. https://doi.org/10.1006/anbo.1997.0400
Olowokudejo J.D. 1993. Comparative epidermal morphology of West African species of Jatropha L. (Euphorbiaceae) – Bot. J. Linn. Soc. 111 (2): 139–154. https://doi.org/10.1111/j.1095-8339.1993.tb01896.x
Pautov A., Bauer S., Ivanova O., Krylova E., Sapach Yu., Gussarova G. 2017. Role of the outer stomatal ledges in the mechanics of guard cell movements. – Trees – Structure and Function. 31 (1): 125–135. https://doi.org/10.1007/s00468-016-1462-x
Pautov A., Bauer S., Ivanova O., Krylova E., Yakovleva O.V., Sapach Yu., Pautova I. 2019. Influence of stomatal rings on movements of guard cellsv. – Trees – Structure and Function. 33 (5): 1459–1474. https://doi.org/10.1007/s00468-019-01873-y
Pautov A., Bauer S., Ivanova O., Krylova E., Yakovleva O., Sapach Y., Pautova I. 2021. Stomatal rings: Structure, functions and origin. – Bot. J. Linn. Soc. 195 (3): 357–379. https://doi.org/10.1093/botlinnean/boaa096
[Pautov et al.] Паутов А.А., Яковлева О.В., Колодяжный С.Ф. 2002. Микрорельеф поверхности листьев у Populus (Salicaceae). – Бот. журн. 87 (1): 63–72.
Raven J.A. 2014. Speedy small stomata? – J. Exp. Bot. 65 (6): 1415–1424. https://doi.org/10.1093/jxb/eru032
Roth-Nebelsick A., Fernández V., Peguero-Pina J.J., Sancho-Knapik D., Gil-Pelegrín E. 2013. Stomatal encryption by epicuticular waxes as a plastic trait modifying gas exchange in a Mediterranean evergreen species (Quercus coccifera L.). – Plant Cell Environ. 36 (3): 579–589. https://doi.org/10.1111/j.1365-3040.2012.02597.x.
Srinual A., Thammathaworn A. 2008. Leaf Anatomy of Vatica L. (Dipterocarpaceae) in Thailand. Nat. Hist. J. Chulalongkorn University 8 (2): 121–134.
Staveren M.G.C. van, Baas P. 1973. Epidermal leaf characters of the Malesian Icacinaceae – Acta Bot. Neerl. 22 (4): 329–359.
Tarran M., Wilson P.G., Hill R.S. 2016. Oldest record of Metrosideros (Myrtaceae): Fossil flowers, fruits, and leaves from Australia. – Am. J. Bot. 103 (4): 754–768. https://doi.org/10.3732/ajb.1500469
Reynolds E.S. 1963. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. – Journal of Cell Biology 17: 208–212
[Vasil’ev] Васильев A.E. 1965. Ксероморфные признаки в роде Populus L. – В кн.: Проблемы современной ботаники. Т. 2. М.-Л. С. 69–74.
Wilkinson H.P. 1979. The plant surface (mainly leaf). – In: Anatomy of the dicotyledons. Ed. 2. Vol. I. Oxford. P. 97–117.
Woolfenden H.C., Bourdais G., Kopischke M., Miedes E., Molina A., Robatzek S., Morris R.J. 2017. A computational approach for inferring the cell wall properties that govern guard cell dynamics. – Plant J. 92: 5–18. https://doi.org/10.1111/tpj.13640
Yang R.Y., Lin Q. 2005. Comparative morphology of the leaf epidermis in Schisandra (Schisandraceae). – Bot. J. Linn. Soc. 148: 39–56. https://doi.org/10.1111/j.1095-8339.2005.00396.x
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


