Ботанический журнал, 2022, T. 107, № 9, стр. 885-905
СТРОЕНИЕ АПИКАЛЬНЫХ МЕРИСТЕМ ПОБЕГОВ И ОСОБЕННОСТИ УЛЬТРАСТРУКТУРЫ ИХ КЛЕТОК У ПЛАУНОВИДНЫХ И ПАПОРОТНИКОВИДНЫХ
М. А. Романова 1, *, О. В. Яковлева 2, А. И. Максимова (Евкайкина) 2, А. Н. Иванова 1, 2, В. В. Домашкина 1
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Университетская наб., 7–9, Россия
2 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, ул. Проф. Попова, 2, Россия
* E-mail: m.romanova@spbu.ru
Поступила в редакцию 20.06.2022
После доработки 02.07.2022
Принята к публикации 19.07.2022
- EDN: OFBVOF
- DOI: 10.31857/S0006813622090095
Аннотация
Выполнено сравнительное изучение апикальных меристем побегов у 2 видов плауновидных: Selaginella kraussiana с меристемой моноплексного типа, т.е. с единственной апикальной инициалью, Huperzia selago с меристемой симплексного типа, т.е. с несколькими апикальными инициалями и 3 видов папоротниковидных с апикальной меристемой моноплексного типа. Выявлено, что единственная апикальная инициаль как у плауновидного S. kraussiana, так и у папоротниковидных сходна по своей структуре со своими ближайшими производными. Клетки апикальных меристем папоротниковидных, в отличие от S. kraussiana, отличаются не типичной для клеток апикальных меристем высокой степенью вакуолизации, наличием крахмальных зерен в пластидах и липидов в цитоплазме. Для клеток моноплексной апикальной меристемы и S. kraussiana, и папоротниковидных характерны расположение ядер в нижней части клеток и наличие в клеточных стенках большого количества неветвящихся (первичных) плазмодесм. Вакуолизация клеток симплексной апикальной меристемы H. selago небольшая, ядра располагаются в центре клеток, в клеточных стенках отмечается небольшое количество как неветвящихся, так и ветвящихся (вторичных) плазмодесм. Для папоротниковидных установлена взаимосвязь неравных периклинальных делений поверхностных инициалей со снижением вакуолизации. В целом ультраструктура клеток моноплексной меристемы плауновидного S. kraussiana более сходна с симплексной меристемой плауновидного H. selago, чем с моноплексной апикальной меристемой изученных папоротниковидных. Полученные данные свидетельствуют в пользу исходности симплексной апикальной меристемы у спорофитов высших растений и независимой реверсии к моноплексному типу у некоторых плауновидных и большинства папоротниковидных.
Одна из ключевых особенностей морфогенеза высших растений – способность расти и образовывать органы в течение всей жизни из апикальных меристем. Эта способность предположительно унаследована высшими растениями от харовых и зигнемовых водорослевых предков (Tomescu et al., 2014; Bowman et al., 2019; Szovenyi et al., 2019; Spencer et al., 2020). Для водорослевых предков (Graham et al., 2000) и большинства плауновидных и папоротниковидных (Gifford, 1983; Gifford, Foster, 1989) характерно наличие на верхушках талломов и побегов (соответственно) единственной апикальной инициали тетраэдрической формы. Это сходство позволило предположить, что апикальная меристема побега с единственной апикальной инициалью, называемая моноплексной, исходна для высших растений (Kenrick, Crane, 1997; Graham et al., 2000; Philipson, 1990; Schneider et al., 2009). В то же время у риниевых, древнейших из наземных растений спорофитной линии эволюции, нет такой тетраэдрической инициали; вместо нее на верхушках теломов располагается несколько апикальных инициалей призматической формы (Kidston, Lang, 1920; Spencer et al., 2020). Не одна, а несколько апикальных инициалей характерны также для плауновидных из порядков Lycopodiales и Isoetales и папоротниковидных из порядков Marattiales и Osmundales (Gifford, Foster, 1989: Philipson, 1990; Kenrick, Crane, 1997; Imaichi, Hiratsuka, 2007; Romanova et al., 2010; Evkaikina et al., 2017). Эти факты легли в основу альтернативной точки зрения о том, что исходной для высших растений является меристема с несколькими апикальными инициалями, называемая симплексной (Cooke et al., 1996; Imaichi, Hiratsuka, 2007; Frank et al., 2015). Обе гипотезы актуальны и в настоящее время.
Существует мнение, что число апикальных инициалей в меристеме связано со способом формирования плазмодесм – межклеточных цитоплазматических каналов (Cooke et al., 1996; Imaichi, Hiratsuka, 2007; Evkaikina et al., 2014). Принято выделять два способа формирования плазмодесм: во время цитокинеза в результате распределения цистерн эндоплазматического ретикулума (ЭПР) между вновь возникшими клетками и формированием вокруг них цитоплазматического канала, выстланного плазмалеммой, и пост-цитокинетически, путем ферментативного растворения уже сформированных клеточных стенок и объединения участков ЭПР соседних клеток (Lucas et al., 1995). Эти два типа плазмодесм различаются структурно: плазмодесмы, образовавшиеся в ходе цитокинеза, называемые первичными, имеют вид неветвящихся каналов, тогда как возникшие пост-цитокинетически, называемые вторичными, имеют Н-образную или У-образную форму (Lucas et al., 1995; van der Schoot, Rinne, 1999). На примере ряда несеменных и семенных растений показано, что для меристем с несколькими апикальными инициалями характерны преимущественно ветвящиеся плазмодесмы, тогда как для меристем моноплексного типа – исключительно неветвящиеся (Michaux, 1971; Michaux-Ferrière, Hallet, 1985; Steeves, Sussex, 1989; Sossountzov, 1976; Michaux Ferriere, Hallet, 1985; Seilhean, Michaux-Ferriere, 1985; Gunning, 1978; Tilney et al., 1990; Imaichi, Hiratsuka, 2007). На основании этих фактов возникновение симплексной апикальной меристемы связывают с появлением механизма пост-цитокинетического формирования плазмодесм, который позволил устанавливать симпластические контакты между производными разных апикальных инициалей (Cooke et al., 1996; Imaichi, Hiratsuka, 2007; Evkaikina et al., 2014). В моноплексной апикальной меристеме, все клетки которой являются производными единственной апикальной инициали, формирование вторичных плазмодесм не является необходимым, и межклеточные контакты возможны только через плазмодесмы, образовавшиеся во время цитокинеза (Cooke et al., 1996; van der Schoot, Rinne, 1999). В рамках дискуссии об исходном для высших растений типе апикальной меристемы было высказано предположение, что возникновение механизма пост-цитокинетического формирования плазмодесм, которое привело к появлению симплексной апикальной меристемы, произошло одновременно с выходом растений на сушу. В рамках этой гипотезы моноплексная апикальная меристема плауновидных из рода Selaginella и большинства папоротниковидных является результатом независимой реверсии к водорослевому, моноплексному типу, связанной с утратой механизма формирования вторичных плазмодесм в этих группах растений (Evkaikina et al., 2014, 2017).
Таким образом, вопрос об исходном для высших растений структурном типе апикальной меристемы дискуссионен. Дать дополнительные аргументы в рамках этой дискуссии помогут данные об ультраструктуре клеток апикальных меристем с разным числом инициалей. В 70-е–90-е годы прошлого века проводились интенсивные исследования ультраструктуры клеток меристем с единственной апикальной инициалью у некоторых папоротниковидных (Michaux, 1971; Michaux-Ferrière, Hallet, 1985; Steeves, Sussex, 1989; Sossountzov, 1976; Michaux-Ferriere, Hallet 1985; Tilney et al., 1990) и с группой апикальных инициалей у цветковых растений (Gunning, Steer, 1996). Однако их результаты не могли быть использованы для решения вопроса об исходном типе меристем из-за того, что эти таксоны различны по своему эволюционному уровню.
Целью настоящего исследования являлось изучение строения апикальных меристем побегов, ультраструктуры их клеток и распределения плазмодесм у плауновидных и папоротниковидных.
МАТЕРИАЛЫ И МЕТОДЫ
Объектами настоящего исследования послужили два вида плауновидных и три вида папоротниковидных. Изученные плауновидные различались по типу апикальной меристемы, но были сходны по способу ветвления и органообразовательной ритмике; все папоротниковидные имели моноплексную апикальную меристему, но различались по способу ветвления и органообразовательной ритмике.
Плауновидные:
Selaginella kraussiana (Kuntze) A. Braun (Selaginellaceae, Isoetopsida) с моноплексной апикальной меристемой, верхушечно (дихотомически) ветвящимися стелющимися надземными побегами, на верхушке каждого из которых ежегодно образуется несколько десятков листьев (рис. 1А).
Рис. 1.
Объекты исследования.
Плауновидные: A – Selaginella kraussiana, B – Huperzia selago. Папоротниковидные: C – подземные побеги (корневища) Pteridium aquilinum, D – корневища Dryopteris carthusiana, E – верхушка корневища Athyrium filix-femina.
Fig. 1. Plant material.
Lycophytes: A – Selaginella kraussiana, B – Huperzia selago. Ferns: C – underground shoots (rhizomes) of Pteridium aquilinum, D – rosette rhizome of Dryopteris carthusiana, E – the tip of rosette rhizome of Athyrium filix-femina.

Huperzia selago (L.) Bernh. ex Schrank (Lycopodiaceae, Lycopodiopsida) с симплексной апикальной меристемой, верхушечно ветвящимися прямостоячими надземными побегами, на верхушке каждого из которых ежегодно образуется несколько десятков листьев (рис. 1B).
Папоротниковидные:
Pteridium aquilinum (L.) Kuhn (Dennstaedtiaceae, Polypodiopsida) с верхушечно ветвящимися удлиненными подземными побегами (корневищами), на верхушке каждого из которых ежегодно образуется единственный лист, через два–три года выносящийся на поверхность (рис. 1C);
Dryopteris carthusiana (Vill.) H.P. Fuchs. (Dryopteridaceae, Polypodiopsida) с неветвящимися корневищами, ежегодно образующими 8–16 листьев (рис. 1D);
Athyrium filix-femina (L.) Roth (Aspidiaceae, Polypodiopsida) с верхушечно ветвящимися укороченными корневищами, на верхушке каждого из которых ежегодно образуется 10–20 листьев (рис. 1E).
Побеги Selaginella kraussiana собирали в оранжереях Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН в мае. Сбор побегов H. selago проводили в начале июня в разных точках Ленинградской области: в Лужском районе (станция Новинка) и в окрестностях поселка Кузнечное. Побеги P. aquilinum, A. filix-femina и D. carthusiana были собраны в конце мая в Курортном районе Санкт-Петербурга в окрестностях станции Комарово.
Фрагменты апексов побегов всех изученных растений размером 3 × 5 мм в повторности по 5 апексов фиксировали в растворе 3% глутаральдегида и 2% параформальдегида на 0.1 M фосфатном буфере с pH 7.2 (Ruzin, 1999) при +4°C, постфиксировали 2% раствором тетраоксида осмия при температуре +4°C в течение ночи, затем обезвоживали в серии спиртов возрастающих концентраций и 100% ацетоне. Во время обезвоживания образцы контрастировали раствором уранилацетата на 70% спирте в течение 60 мин. Образцы заключали в смесь эпоксидных смол эпона и аралдита. Ультратонкие срезы получали с помощью ультрамикротома Ultracut E (Reichart, Германия) и контрастировали в растворах 2% уранилацетата и цитрата свинца (Ruzin, 1999). Срезы анализировали с помощью трансмиссионных электронных микроскопов JEM 1400 (Jeol, Япония), Hitachi H-600 (Hitachi, Япония) и Tesla BS-500 (Tesla, Чехия). Отдельные фотографии объединяли в панорамные снимки с помощью программы Adobe Photoshop. На фотографиях апикальных инициалей и их производных P. aquilinum в программе ImageJ (NIH, США) было подсчитано число плазмодесм на 20 мкм клеточной стенки. Полученные данные представлены в виде гистограмм с помощью программы Microsoft Excel.
При описании структуры моноплексной и симплексной апикальных меристем использовали общепринятую терминологию (McAlpin, White, 1974; Stevenson, 1976, 1978). Дополнительно была использована методика выделения мерофитов – “клеточных пакетов”, образовавшихся из каждой производной апикальной инициали моноплексной меристемы (Bierhorst, 1971, 1977). При их выделении мы обращали внимание на толщину клеточных стенок, форму, размеры и взаимное расположение клеток.
РЕЗУЛЬТАТЫ
Зональность апикальных меристем
На продольных срезах апексов побегов P. aquilinum, D. carthusiana, A. filix-femina и S. kraussiana различима клетка, имеющая форму равнобедренного треугольника с основанием, обращенным к поверхности – тераэдрическая апикальная инициаль (рис. 2 А–D, F–I, K–N). Апикальная инициаль делится косоантиклинально, образуя призматические клетки; с каждым таким делением предыдущие производные отодвигаются от нее. У папоротниковидных апикальная инициаль вместе с граничащими с ней с каждой стороны тремя–десятью призматическими клетками составляют зону поверхностных инициалей (SI, рис. 2 F–H). У плауновидного S. kraussiana апикальная инициаль с каждой стороны граничит с десятью–пятнадцатью призматическими клетками (рис. 2 I), то есть зона поверхностных инициалей существенно больше по объему, чем у папоротниковидных. Периклинальные деления поверхностных инициалей – неравные. В поверхностном слое апекса остается большая по длине производная призматическая клетка, а в подповерхностном – меньшая изодиаметрическая. Совокупность изодиаметрических клеток составляет зону подповерхностных инициалей (SSI, рис. 2 F–I). В состав этой зоны как у папоротниковидных, так и у плауновидного S. kraussiana входит восемь–двенадцать клеток. У папоротниковидных с каждым из периклинальных делений поверхностные клетки укорачиваются (SI1–SI3, рис. 2 F–H) и после трех или четырех делений приобретают изодиаметрическую форму. У плауновидных такого явления не наблюдается.
Рис. 2.
Апикальные меристемы и схемы их строения у папоротниковидных и плауновидных.
Продольные срезы апикальных меристем папоротников Pteridium aquilinum (A), Dryopteris carthusiana (B), Athyrium filix-femina (C) и плаунов Selaginella kraussiana (D), Huperzia selago (E). Cхемы зональной структуры апикальных меристем P. aquilinum (F), D. carthusiana (G), A. filix-femina (H), S. kraussiana (I), H. selago (J). Схемы последовательных клеточных делений в мерофитах моноплексных апикальных меристем P. aquilinum (K), D. carthusiana (L), A. filix-femina (M) и S. kraussiana (N). На рисунках K–N границы мерофитов обозначены сплошной линией; границы клеток, являющиеся производными каждого из мерофитов – пунктирной линией. AI – апикальная инициаль или инициали, SI – поверхностные призматические инициали, SSI – подповерхностные инициали, CZ – чашевидная зона, LAC – апикальная клетка листа, LP – зачатки листьев, pith – сердцевина, сх – кора, pc – прокамбий; CNZ – центральная, PZ – периферическая части апикальной меристемы. У папоротниковидных разным оттенком голубого цвета обозначены поверхностные инициали, которые делились периклинально один (SI1), два (SI2) и три (SI3) раза, М1–М4 – мерофиты; цифрами обозначена последовательность их образования. Масштабные линейки, мкм: A–N – 50.
Fig. 2. Structure of shoot apical meristems with single and several apical initials in ferns and lycophytes.
Median longitudinal sections through the apical meristems of ferns Pteridium aquilinum (A), Dryopteris carthusiana (B), Athyrium filix-femina (C) and lycophytes Selaginella kraussiana (D), and Huperzia selago (E). Zonal structure of the shoot apical meristem of P. aquilinum (F), D. carthusiana (G), A. filix-femina (H), S. kraussiana (I), H. selago (J). Patterns of cell segmentation in successive merophytes of the single apical initial in P. aquilinum (K), D. carthusiana (L), A. filix-femina (M) and S. kraussiana (N). In Figs. K–N , the borders of separate merophytes are denoted with solid line, the borders of cells belonging to one merophyte – with dashed line. Here and in Figs. 3–7: AI – apical initial (or initials), SI – surface prismatic initials, SSI – subsurface initials, CZ – cup zone, LAC – leaf apical cell, LP – leaf primordia, pith – pith, cx – cortex, pc – procambium, CNZ – central part, PZ – peripheral part of the shoot apical meristem. In ferns, the surface initials that have divided periclinally once (SI1), twice (SI2) or thrice (SI3) are marked by different tones of blue color, М1–М4 – successive merophytes, with numbers denoting the sequence. Scale bars, μm: A–N – 50.

В апикальной меристеме изученных папоротниковидных поверхностные и подповерхностные инициали окружены несколькими десятками более мелких изодиаметрических клеток, которые составляют зону, называемую за свою форму чашевидной (CZ, рис. 2 F–H). Таким образом, у папоротниковидных производные апикальной инициали не только отодвигаются от нее, но и, укорачиваясь, “переходят” из зоны поверхностных инициалей в чашевидную. В апикальной меристеме S. kraussiana чашевидная зона отсутствует (рис. 2 D, I), поэтому “перемещения” производных апикальной инициали из одной зоны в другую не происходит.
При сравнении ультраструктуры клеток, относящихся к разным зонам, в апикальной меристеме моноплексного типа (рис. 2 F–J) дополнительно оценивали примерное число и направление делений, которое произошло в ходе их смещения от апикальной инициали. Для этого определяли принадлежность клеток к мерофитам (группам клеток, образованным производными одной и той же исходной клетки; в данном случае – призматического сегмента апикальной инициали), находящимся на разном удалении от нее. У изученных видов удалось определить границы четырех ближайших к апикальной инициали мерофитов (М1–М4, рис. 2 K–N). Первый, второй и третий мерофиты изученных папоротниковидных состоят из поверхностных и подповерхностных инициалей. Поверхностные инициали, входящие в состав первого мерофита, делились периклинально не более одного раза, входящие в состав второго мерофита – один или два раза, входящие в состав третьего мерофита – два или три раза. Четвертый мерофит состоит не только из поверхностных и подповерхностных инициалей, но и из клеток чашевидной зоны (рис. 2 K–М), то есть входящие в его состав клетки делились периклинально три раза или более. У плауновидного S. kraussiana в состав всех четырех мерофитов входят только поверхностные и подповерхностные инициали (рис. 2 N).
На продольном срезе симплексной апикальной меристемы H. selago в поверхностном слое различимы четыре–восемь относительно крупных призматических апикальных инициалей (рис. 2 E, J). С ними граничат сходные по длине антиклинальных стенок, но более узкие призматические клетки, образующие зону поверхностных инициалей. Под апикальными инициалями располагаются восемь–четырнадцать изодиаметрических клеток, образующих зону подповерхностных инициалей. Поскольку границу между апикальными и остальными поверхностными инициалями провести нелегко, симплексную меристему споровых растений обычно подразделяют (Stevenson, 1976; Evkaikina et al., 2017) на центральную зону, образованную апикальными инициалями и их ближайшими производными, и периферическую, в которой образуются листья (рис. 2E, 2J). Чашевидная зона в апикальной меристеме H. selago отсутствует.
В моноплексных апикальных меристемах плауновидного S. kraussiana (рис. 2 D, I, N) и изученных папоротниковидных (рис. 2 A–C, F–H, K–M) образование листа начинается с появления в поверхностном слое апикальной клетки листа. В симплексной апикальной меристеме плауновидного H. selago листья образуются путем пролиферации группы поверхностных и подповерхностных клеток (рис. 2 E, 2 J).
Ультраструктура клеток апикальных меристем
Плауновидные
Selaginella kraussiana
На продольном срезе апикальной инициали S. kraussiana различимы несколько десятков мелких вакуолей, большая часть которых расположена у наружной клеточной стенки. Некоторые вакуоли – прозрачные; в других имеются конденсированные электронноплотные включения (рис. 3 A, B). Ядро, в котором различимо четко оформленное ядрышко, располагается в нижней части клетки. Пластиды вытянутой формы, с неразвитой тилакоидной системой сосредоточены преимущественно вокруг ядра (рис. 3 A, B). В околоядерной цитоплазме располагаются немногочисленные скопления липидных капель (рис. 3 D).
Рис. 3.
Ультраструктура клеток апикальной меристемы плауновидного Selaginella kraussiana.
A – продольный срез апикальной меристемы, проходящий через тетраэдрическую апикальную инициаль, поверхностные и подповерхностные клетки, входящие в состав первого и второго мерофитов (М1, М2 на рис. 2N); B – фрагмент наружной части апикальной инициали; С – пластиды в поверхностной инициали; D – липиды в апикальной инициали; E – продольный срез листового зачатка и апикальной клетки листа; F, G – продольные срезы апикальной меристемы, проходящие через апикальную, поверхностные и подповерхностные инициали и зачаток листа. L – липидные капли, n – ядро, v – вакуоль; треугольники указывают на пластиды. Остальные обозначения, как на рис. 2. Масштабные линейки, мкм: А, E, F, G – 20, B – 5, C, D – 0.5.
Fig. 3. Ultrastructure of the shoot apical meristem cells of lycophyte Selaginella kraussiana.
A – longitudinal section through the single apical initial surface and subsurface initials belonging to the first and the second merophytes (M1, M2 in Fig. 2N), B – fragment of the outer part of the apical initial; C – plastids in the surface initial; D – lipids in the apical initial; E – longitudinal section through the leaf primordium and the leaf apical cell; F, G – longitudinal section through the single apical initial, surface, subsurface initials and the leaf primordium. L – lipid droplets, n – nucleus, v – vacuole; arrowheads point to plastids. Scale bars, μm: А, Е, F – 20, B – 5, C, D – 0.5.

По морфологии и расположению вакуолей, ядра, наличию в ядре четко оформленного ядрышка, наличию липидов в околоядерной цитоплазме апикальная инициаль S. kraussiana сходна с поверхностными и подповерхностными инициалями из граничащих с ней мерофитов (М1–М2, рис. 2 N; рис. 3 A, G). Пластиды в поверхностных инициалях отличаются от пластид в апикальной инициали удлиненной формой, наличием выростов и развитой тилакоидной системой с единичными гранами (рис. 3 С). В некоторых пластидах присутствуют единичные крахмальные зерна и пластоглобулы.
Поверхностные инициали, относящиеся к третьему–четвертому мерофитам (М3–М4, рис. 2 N) имеют ряд ультраструктурных отличий от апикальной инициали и ее ближайших производных: ядро располагается в центральной части клетки, число вакуолей уменьшается, но они становятся более крупными (рис. 3 F); пластиды приобретают сильно вытянутую форму, в них различимы множественные пластоглобулы. Таким образом, хотя неравные периклинальные деления поверхностных инициалей у S. kraussiana не сопровождаются уменьшением длины их антиклинальных стенок, по мере удаления от апикальной клетки в них наблюдаются изменения ультраструктуры.
В стенках апикальной инициали S. kraussiana и граничащих с ней поверхностных и подповерхностных инициалей выявлено большое количество неветвящихся плазмодесм (рис. 4 A).
Рис. 4.
Плазмодесмы в стенках клеток апикальных меристем.
Фрагменты: антиклинальных стенок апикальных инициалей плауновидных Selaginella kraussiana (А) и Huperzia selago (B), папоротниковидных Pteridium aquilinum (С), Dryopteris carthusiana (D) и Athyrium filix-femina (E); F – стенки клетки чашевидной зоны P. aquilinum. Треугольники указывают на неветвящиеся (А–F), стрелки – на ветвящиеся (B) плазмодесмы. Масштабные линейки, мкм: A–F – 1.
Fig. 4. Plasmodesmata in the walls of the cells of the apical meristems with single (А, C–E) and multiple (B) apical initials.
Fragments: of the anticlinal walls of the apical initials of lycophytes Selaginella kraussiana (A) and Huperzia selago (B), ferns Pteridium aquilinum (C), Dryopteris carthusiana (D) and Athyrium filix-femina (E); the cell wall of P. aquilinum cup zone cell (F). Arrowheads point to the unbranched (A–F) and arrows to the branched (B) plasmodesmata. Scale bars, μm: A–F – 1.

Апикальная клетка листа сходна с апикальной инициалью побега по форме и длине антиклинальных стенок (рис. 3 E, F). Однако эти клетки различаются по местоположению ядра: вблизи наружной клеточной стенки у первой и в нижней части клетки у последней. Апикальная клетка листа отличается от апикальной инициали побега значительно меньшим количеством вакуолей и дифференцированными пластидами, хотя со слабо развитой тилакоидной системой и электронноплотными включениями.
Huperzia selago
Апикальные инициали вытянуты вдоль оси побега. По визуальной оценке степень их вакуолизации H. selago (рис. 5 A) несколько ниже, чем у апикальной инициали S. kraussiana и ее ближайших производных. Немногочисленные мелкие вакуоли сосредоточены преимущественно у наружной и внутренней клеточных стенок. В центре апикальных инициалей располагаются крупные относительно общего объема клеток, вытянутые вдоль оси клеток ядра с диффузным хроматином и одним-двумя мелкими ядрышками (рис. 5 A). В апикальных инициалях H. selago встречаются более крупные, чем в апикальной инициали S. kraussiana, липидные капли (рис. 5 В, С). Пластиды округлой формы с одиночными тилакоидами, небольшим количеством пластоглобул и одиночными крахмальными зернами (рис. 5 В) располагаются преимущественно в верхней и нижней частях апикальных инициалей – выше и ниже центрально расположенного ядра (рис. 5 А).
Рис. 5.
Ультраструктура клеток апикальной меристемы плауновидного Huperzia selago.
A – продольный срез апикальной меристемы, проходящий через апикальные инициали и их подповерхностные производные; В, С – фрагменты околоядерной цитоплазмы одной из апикальных инициалей; D – продольный срез через клетки, расположенные в периферической зоне апикальной меристемы; E – продольный срез клеток образующегося листового зачатка, F – фрагмент поверхностного слоя апикальной меристемы, включающий апикальные инициали, поверхностные инициали и клетки листового зачатка. Обозначения, как на рис. 2, 3. Масштабные линейки, мкм: А, D–F – 20, B, C – 5.
Fig. 5. Ultrastructure of the shoot apical meristem cells of lycophyte Huperzia selago.
A – longitudinal section through the apical initials and their subsurface derivatives; B, C – fragments of the perinuclear cytoplasm of the AI, D – longitudinal sections through the cells of the peripheral zone of the SAM; E – longitudinal sections through the cells of emerging leaf primordium, F – fragment of the surface layer of the apical meristem that includes apical initials, surface initials and the cells of leaf primordium. See Figs. 2, 3 for symbols. Scale bars, μm: А, D–F – 20, B, C – 5.

Хотя периклинальные деления поверхностных инициалей H. selago не сопровождаются укорочением антиклинальных стенок (рис. 2 E, J), клетки этой зоны не однородны по ультраструктуре. Поверхностные инициали, относящиеся к центральной зоне, сходны по ультраструктуре с апикальными инициалями (рис. 5A, F). Клетки поверхностных инициалей, расположенных в периферической зоне апикальной меристемы, ${\text{у}}'$же, чем в центральной, ядро в них приобретает округлую форму, ядрышко становится более крупным и занимает центральное положение (рис. 5 D). Увеличивается количество пластид и они равномерно распределяются вокруг ядра. Число вакуолей увеличивается, в них появляются электронноплотные включения; увеличивается размер липидных капель (рис. 5 D).
Клетки зоны подповерхностных инициалей отличаются от апикальных инициалей только изодиаметрической формой, округлой формой ядра и равномерным распределением вакуолей (рис. 2 E, J).
В стенках апикальных инициалей H. selago существенно меньше плазмодесм (рис. 4 B), чем у S. kraussiana. Преобладают ветвящиеся Н- и У‑образные плазмодесмы, однако наряду с ними встречаются и одиночные неветвящиеся, а также слепо заканчивающиеся в клеточных стенках плазмодесмы, не образующие сквозного канала.
Клетки образующегося листового зачатка по ультраструктуре более сходны с апикальными инициалями, чем с окружающими их поверхностными инициалями (рис. 5 E, F).
Папоротниковидные (P. aquilinum, D. carthusiana и A. filix-femina)
Апикальные инициали в меристемах всех трех изученных видов папоротниковидных обладают сходными ультраструктурными особенностями. Наиболее заметная из них – существенно более высокая степень вакуолизации, чем у обоих плауновидных. На продольных срезах апикальных инициалей P. aquilinum (рис. 6 А), D. carthusiana (рис. 7 А) и A. filix-femina (рис. 8 А) цитоплазма располагается вокруг ядра, по периметру клеточной стенки, а также в форме узких тяжей, соединяющих околоядерную цитоплазму с пристенной. Апикальные инициали различаются по морфологии вакуолей: у P. aquilinum они равномерно заполнены электронноплотными хлопьями (рис. 6 А), а у других папоротниковидных тонопласт со стороны полости вакуолей обрамлен электронноплотным веществом, более-менее равномерным у D. carthusiana (рис. 7 А), и имеющим вид отдельных глобул у A. filix-femina (рис. 8 А). Ядро располагается в нижней части клетки и имеет два ядрышка (рис. 6 А). В апикальной инициали изученных папоротниковидных присутствует существенно большее, чем у обоих плауновидных, количество липидных капель, сконцентрированных у P. aquilinum вдоль наружной стенки (рис. 6 E) или образующих скопления вдоль антиклинальных стенок (рис. 6 G), а у D. carthusiana и A. filix-femina (рис. 8 Е) расположенных более или менее равномерно вдоль антиклинальных стенок. В пластидах, имеющих слабо развитую тилакоидную систему и лежащих у P. aquilinum преимущественно вокруг ядра (рис. 6 F), а у D. carthusiana (рис. 7 А) и A. filix-femina (рис. 8 А) – в цитоплазматических тяжах, находится большое количество крупных крахмальных зерен (рис. 6 H) и небольшое количество пластоглобул.
Рис. 6.
Ультраструктура клеток апикальной меристемы папоротниковидного Pteridium aquilinum.
A – продольный срез апикальной меристемы, проходящий через апикальную, поверхностные и подповерхностные инициали, входящие в состав первого и второго мерофитов (М1, М2 на рис. 2K); В – продольный срез поверхностных инициалей, относящихся третьему мерофиту (М3 на рис. 2K) и, вероятно, включающих апикальную клетку листа; С – фрагмент подповерхностной клетки, принадлежащей первому мерофиту (М1 на рис. 2K); D – продольный срез клеток чашевидной зоны; фрагменты апикальной инициали: наружная клеточная стенка (Е), ядро и околоядерная цитоплазма (F), антиклинальная стенка (G), околоядерная цитоплазма (Н). s – крахмальное зерно; w – клеточная стенка. стрелки указывают на клеточные стенки. Остальные обозначения, как на рис. 2, 3. Масштабные линейки, мкм: А, B, F – 20, С, D – 10, E – 1, G, H – 0.5.
Fig. 6. Ultrastructure of the shoot apical meristem cells of fern Pteridium aquilinum.
A – longitudinal section through the single apical initial, surface and subsurface initials, that belong to the first and the second merophytes (М1 and М2 in Fig. 2K); B – longitudinal section through the peripheral part of the surface initials zone, that belong to the third merophyte (M3 in Fig. 2K) and presumably include the leaf apical cell (LAC in Fig. 2K); C – fragments of the subsurface initial from the first merophyte (M1 in Fig. 2K); D – longitudinal section through the cup zone cells; fragments of the apical initial: external wall (E), nucleus and perinuclear cytoplasm (F), anticlinal wall (G), perinuclear cytoplasm (H). w – cell wall, s – starch grains; arrows point to сell walls. See Figs. 2, 3 for the other symbols. Scale bars, μm: А, B, F – 20, C – 10, E – 1, G, H – 0.5.
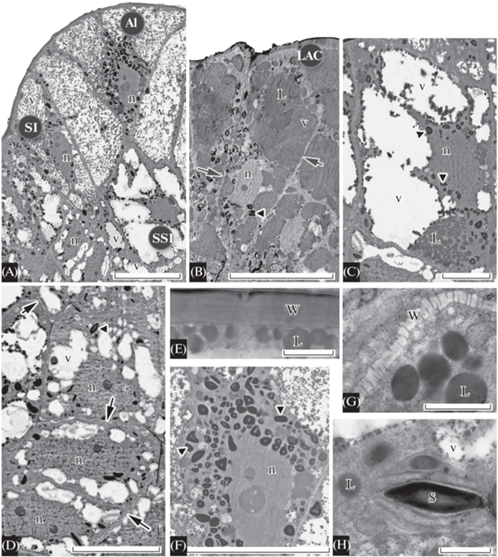
Рис. 7.
Ультраструктура клеток апикальной меристемы папоротниковидного Dryopteris carthusiana.
A – продольный срез апикальной меристемы, проходящий через апикальную инициаль, поверхностные и подповерхностные клетки, входящие в состав первого и второго мерофитов (М1, М2 на рис. 2L); В – продольный срез клеток зоны поверхностных инициалей, относящихся к третьему или четвертому мерофиту (М3 или М4 на рис. 2L), С – продольный срез клеток зоны подповерхностных инициалей, относящихся ко второму или третьему мерофиту (М2 или М3 на рис. 2L); D – фрагмент околоядерной цитоплазмы поверхностной инициали; E – продольный срез клеток чашевидной зоны, входящих в состав четвертого мерофита (М4 на рис. 2L). Обозначения, как на рис. 2, 3, 6. Масштабные линейки, мкм: А–С, Е – 20, D – 1.
Fig. 7. Ultrastructure of the shoot apical meristem cells of fern Dryopteris carthusiana.
A – longitudinal section through the single apical initial, surface and subsurface initials, that belong to the first and the second merophytes (М1 or М2 in Fig. 2L); B – longitudinal section through the peripheral part of the surface initials zone, that belong to the third or the fourth merophyte (M3 or M4 in Fig. 2L); C – longitudinal section through the subsurface initials, that belong to the second or the third merophyte (M2 or M3 in Fig. 2L); D – fragment of the perinuclear cytoplasm of the surface initial; E – longitudinal section through the cup zone cells, that belong to the fourth merophyte (М4 in Fig. 2L). See Figs. 2, 3, 6 for symbols. Scale bars, μm: А–С, E – 20, D – 1.
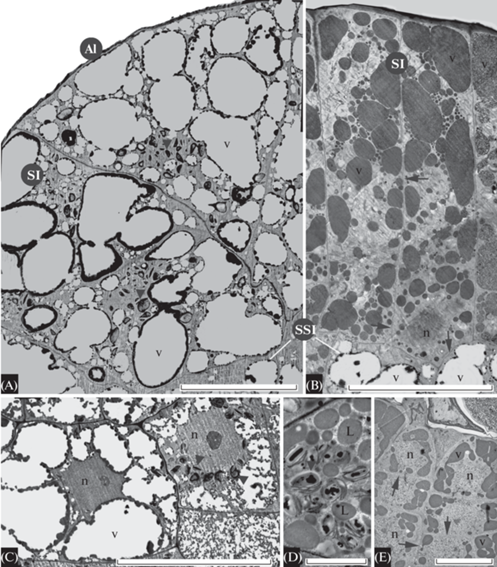
Рис. 8.
Ультраструктура клеток апикальной меристемы папоротниковидного Athyrium filix-femina.
A – продольный срез апикальной меристемы, проходящий через апикальную инициаль и поверхностные клетки, входящие в состав первого и второго мерофитов (М1, М2 на рис. 2M), В – продольный срез периферической части клеток зоны поверхностных инициалей, относящихся к третьему или четвертому мерофиту (М3 или М4 на рис. 2М); С – продольный срез подповерхностных клеток, входящих в состав второго или третьего мерофитов (М2 или М3 на рис. 2M); D – продольный срез клеток чашевидной зоны, входящих в состав четвертого мерофита (М4 на рис. 2M); E – фрагмент антиклинальной стенки и пристенной цитоплазмы двух соседних поверхностных инициалей; F – фрагмент околоядерной цитоплазмы поверхностной инициали. Обозначения, как на рис. 2, 3, 6. Масштабные линейки, мкм: А, В – 20, С, D – 10, E, F – 1.
Fig. 8. Ultrastructure of the shoot apical meristem cells of fern Athyrium filix-femina.
A – longitudinal section through the single apical initial and surface initials, that belong to the first and the second merophytes (М1, М2 in Fig. 2M); B – longitudinal section through the peripheral part of the surface initials (SI) zone, that belong to the third or the fourth merophyte (M3 or M4 in Fig. 2 M); C – longitudinal section through the subsurface initials, that belong to the second or the third merophyte (M2 or M3 in Fig. 2M), D – longitudinal section through the cup zone cells, that belong to the fourth merophyte (М4 in Fig. 2M); E, F – fragments of the anticlinal wall and cortical cytoplasm of two neighbouring surface initials. See Figs. 2, 3, 6 for symbols. Scale bars, μm: А, B – 20, C, D – 10, E – 1, F – 0.5.
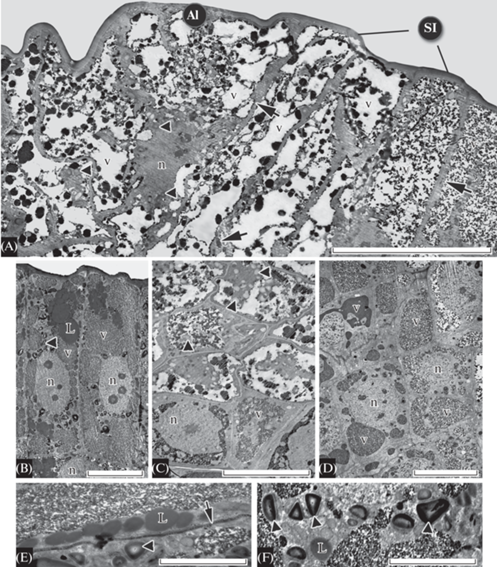
У всех изученных папоротниковидных поверхностные инициали, входящие в состав ближайших к апикальной инициали мерофитов (М1, М2 на рис. 2К–М, рис. 6 А, рис. 7 А, рис. 8 А), сходны с ней по ультраструктуре. Для этих клеток также характерны высокая степень вакуолизации, присутствие большого количества липидных капель и крахмальных зерен в пластидах (рис. 7 D, рис. 8 E, F). Их внутриклеточная локализация сходна с таковой в апикальной инициали.
У всех поверхностных инициалей P. aquilinum, D. carthusiana и A. filix-femina ядра располагаются в нижней части клетки (рис. 6 А, В, рис. 7 В, рис. 8 А, В), что указывает на неравный характер их периклинальных делений. В то же время периклинальные деления поверхностных инициалей, относящихся к третьему и четвертому мерофитам (M3, М4 на рис. 2 К–М), сопровождаются изменениями их ультраструктуры. В вакуолях этих поверхностных инициалей увеличивается количество содержимого, более электронноплотного у P. aquilinum и D. carthusiana (рис. 6 В, рис. 7 В) и зернистого у A. filix-femina (рис. 8 В). Число ядрышек в ядрах у A. filix-femina (рис. 8 В) увеличивается до трех. Липидные капли заметно увеличиваются в количестве и размерах (рис. 6 В, 8 В) и сосредоточены в цитоплазме, преимущественно у наружных клеточных стенок. Пластиды с крахмальными зернами более или менее равномерно распределены по цитоплазме (рис. 6 В, 8 F).
Подповерхностные инициали всех изученных папоротниковидных сходны с поверхностными по степени вакуолизации, наличию большого количества крахмала в пластидах и липидов в цитоплазме, но отличаются от них изодиаметрической формой, центральным положением ядра, меньшим размером липидных капель, локализацией пластид не в околоядерной, а в пристенной цитоплазме (рис. 6 C, рис. 7 C, рис. 8 C).
Большая часть клеток, входящих в состав четвертого мерофита P. aquilinum, D. carthusiana и A. filix-femina (М4 на рис. 2 К–М) образовалась в результате трех или более периклинальных делений поверхностных инициалей и относится к чашевидной зоне. Поверхностные и подповерхностные клетки чашевидной зоны сходны между собой по ультраструктуре. Они существенно менее вакуолизированы, чем поверхностные и подповерхностные инициали: десять и более мелких вакуолей равномерно располагаются вокруг ядра, занимающего центральное положение в клетке (рис. 6 D, рис. 7 E, рис. 8 D). Вакуоли D. carthusiana и A. filix-femina (но не P. aquilinum) заполнены электронноплотным содержимым, сходным с содержимым вакуолей поверхностных инициалей, входящих в состав третьего и четвертого мерофитов этих папоротников. Липидные капли в цитоплазме и пластиды с крахмальными зернами отсутствуют или единичны.
Характерной особенностью всех изученных папоротниковидных является присутствие в стенках апикальной инициали и граничащих с ней поверхностных и подповерхностных инициалях большого количества неветвящихся плазмодесм (рис. 4 С–Е). У P. aquilinum (рис. 4 С) и A. filix-femina (рис. 4 Е) плазмодесмы равномерно распределены по всей длине клеточных стенок, а у D. carthusiana (рис. 4 D) сгруппированы в плазмодесменные поля. На примере P. aquilinum выявлено, что плотность распределения плазмодесм снижается по мере смещения клеток от апикальной инициали. Так, в стенках клеток чашевидной зоны, относящихся к четвертому мерофиту, плотность плазмодесм существенно ниже, чем в стенках апикальной инициали и ее ближайших производных (рис. 4 F, рис. 9).
Рис. 9.
Плотность распределения плазмодесм у Pteridium aquilinum. По оси ординат обозначено число плазмосдесм на 1 мкм клеточной стенки. Обозначения как на рис. 2
Fig. 9. Density of plasmodesmata distribution in Pteridium aquilinum. Number of units per 1 μm of the cell wall are plotted on the Y-axis. See Fig. 2 for symbols.

Апикальная клетка листа P. aquilinum по форме напоминает апикальную инициаль побега, но по электронноплотному содержимому вакуолей, большим количеству и размерам липидных капель и их локализации в наружной части клетки сходна с окружающими ее поверхностными инициалями, относящимися к третьему мерофиту (рис. 6 В).
ОБСУЖДЕНИЕ
Проведенное исследование позволило дополнить характеристику апикальных меристем моноплексного и симплексного типов в рамках разработки вопроса об исходном для высших растений типе апикальной меристемы побега.
Выявленная в моноплексной апикальной меристеме папоротниковидных D. carthusiana, A. filix-femina и P. aquilinum сильная вакуолизация апикальной инициали и ее ближайших производных не типична для клеток апикальной меристемы семенных растений (Cecich, 1977; Imaichi, Hiratsuka, 2007; Rogge-Renner et al., 2013), но характерна для меристематических клеток их камбиальной зоны (Gunning, 1978; Catesson, 1994; Gunning, Steer, 1996; Prislan et al., 2013; Fischer et al., 2019). В то же время клетки моноплексной апикальной меристемы плауновидного S. kraus-siana характеризуются меньшей степенью вакуолизации и более сходны по этому признаку с апикальными инициалями симплексных меристем плауновидного H. selago и голосеменных растений (Owston, 1969; Cecich, 1977; Imaichi, Hiratsuka, 2007; Rogge-Renner et al., 2013), чем с папоротниковидными.
На примере некоторых папоротниковидных показано, что вакуолизация апикальной инициали увеличивается с возрастом (Michaux, 1971; Gunning, 1978; Gifford, 1983; Michaux-Ferrière, Hallet, 1985), что интерпретируется как признак “старения”, приводящий, в конце концов, к прекращению ее функционирования (Gunning, 1978). В то же время известно, что у папоротниковидных с моноплексной апикальной меристемой “старая” апикальная инициаль время от времени заменяется двумя новыми, что приводит к дихотомическому ветвлению побегов. Высказано предположение, что вновь возникающие апикальные инициали менее вакуолизированы, чем “старая” и служат для продолжения апикального роста (Romanova, Borisovskaya, 2004; Romanova et al., 2010). Однако в настоящем исследовании выявлено, что регулярно заменяющиеся апикальные инициали папоротниковидных P. aquilinum и A. filix-femina с дихотомически ветвящимися побегами, и не заменяющиеся у D. carthusiana с неветвящимися побегами не отличались по степени вакуолизации. Не было выявлено снижения вакуолизации при замене апикальных инициалей также при дихотомическом ветвлении побегов папоротниковидного sensu lato Psilotum nudum (Naumenko, Romanova, 2008). С другой стороны, апикальная инициаль и ее производные в моноплексной меристеме плауновидного S. kraussiana, дихотомическое ветвление побегов которой также происходит в результате замены апикальных инициалей (Jernstedt et al., 1992; Harrison et al., 2007; Spencer et al., 2020), менее вакуолизированы, чем у папоротниковидных. Таким образом и у некоторых папоротниковидных, и у плауновидных апикальные инициали могут сменять друг друга, но у первых они сильно вакуолизированы, а у вторых нет. Можно предположить, что снижение вакуолизации при замене апикальных инициалей не характеризует все растения с моноплексной апикальной меристемой.
У апикальной инициали и ее ближайших производных изученных папоротниковидных выявлено накопление крахмала в пластидах вокруг ядра и липидных капель в цитоплазме. Эти признаки в апикальной меристеме семенных указывают на состояние сезонного покоя (Koteeva, 1997; Rinne, van der Schoot, 2004; van der Schoot et al., 2014; Guzicka et al., 2018), но характерны для активно делящихся клеток камбиальной зоны семенных растений (Gunning, 1978; Catesson, 1994; Gunning, Steer, 1996; Prislan et al., 2013; Fischer et al., 2019). Сходное строение клеток моноплексной апикальной меристемы папоротниковидных и камбиальной зоны может свидетельствовать о преобладании фазы пролиферативного покоя над фазой деления в обоих типах меристем. Меньшее содержание крахмала и липидов в моноплексной и симплексной меристемах изученных плауновидных, сходное с апикальными меристемами семенных растений (Cecich, 1977; Imaichi, Hiratsuka, 2007; Rogge-Renner et al., 2013), может быть связано с более активной пролиферацией их клеток и, как следствие, образованием существенно большего (несколько десятков ежегодно), чем у папоротниковидных (от одного до двадцати в год) числа листьев.
Выявленная в настоящем исследовании ультраструктурная неоднородность поверхностных инициалей папоротниковидных D. carthusiana, A. filix-femina и P. aquilinum, в которых произошло разное число периклинальных делений, подтверждает ранее установленную связь этих делений с функциональным изменением клеток (Romanova et al., 2010). Так, известно, что новые апикальные инициали, появление которых приводит к дихотомическому ветвлению побегов, образуются из поверхностных клеток, в которых произошло одно периклинальное деление, апикальные клетки листьев – из клеток, претерпевших два периклинальных деления (Romanova et al., 2010). Поверхностные инициали, которые после третьего периклинального деления переходят в чашевидную зону, не способны к образованию органов (Romanova et al., 2010), но активно делятся, обеспечивая нарастание побегов. Эти клетки не только уменьшаются в размерах, но изменяют свое строение: характеризуются меньшей степенью вакуолизации, снижением содержания липидов в цитоплазме и крахмала в пластидах или их отсутствием и сходны по ультраструктуре с клетками апикальной меристемы семенных растений (Gunning, Steer, 1996). Таким образом, особенность меристем папоротниковидных в том, что листья образуются в них из более крупных и вакуолизированных клеток, а не из более мелких и менее вакуолизированных, как у семенных растений (Gunning, Steer, 1996). В отличие от папоротниковидных, все поверхностные инициали плауновидных S. kraussiana с моноплексной и H. selago с симплексной апикальной меристемой сходны между собой по ультраструктуре. Они менее вакуолизированы, характеризуются незначительным содержанием крахмала и липидов, но также способны образовывать листья. Это показывает, что изменение структуры поверхностных инициалей в результате периклинальных делений характеризует моноплексную апикальную меристему папоротниковидных, но не плауновидных.
В настоящем исследовании у трех видов папоротниковидных и плауновидного S. kraussiana с моноплексной апикальной меристемой выявлено большое количество исключительно неветвящихся плазмодесм в стенках апикальной инициали и ближайших к ней клеток. На примере папоротниковидного P. aquilinum показано, что плотность распределения плазмодесм в клеточных стенках снижается по мере удаления клеток от апикальной инициали. Это снижение может быть следствием двум различных процессов. Плотность плазмодесм в антиклинальных стенках клеток, расположенных по внешней границе мерофитов уменьшается в результате того, что границы мерофитов “растягиваются” (то есть удлиняются) по мере деления их клеток (сравн. М1–М4 на рис. 2 К–М), а новые (пост-цитокинетические) плазмодесмы в них не образуются (Cooke et al., 1996; Romanova, Jernstedt, 2005; Imaichi, Hiratsuka, 2007). Наличие меньшего количества плазмодесм в стенках вновь образующихся в данном мерофите клеток свидетельствует о том, что количество образующихся первичных (цитокинетических) плазмодесм по мере удаления мерофитов от апикальной инициали снижается. В стенках клеток симплексной апикальной меристемы плауновидного H. selago присутствуют как неветвящиеся, так и ветвящиеся Н- и У-образные плазмодесмы. Их плотность существенно ниже, чем в моноплексной апикальной меристеме. Отсутствие видимых различий в плотности распределения плазмодесм между стенками клеток разных зон может свидетельствовать о наличии у H. selago механизма пост-цитокинетического формирования плазмодесм. Таким образом, морфология и плотность плазмодесм коррелируют с числом апикальных инициалей в меристеме, но не таксоноспецифичны, так как первичные плазмодесмы характерны и для плауновидного S. kraussiana, и для изученных папоротниковидных. Полученные данные можно рассматривать в качестве дополнительных аргументов в пользу гипотезы о корреляции между числом апикальных инициалей в меристеме и способом (цитокинетическим и пост-цитокинетическим) формирования плазмодесм (Cooke et al., 1996; Imaichi, Hiratsuka, 2007; Evkaikina et al., 2014).
Согласно литературным данным, молекулярно-генетическая регуляция моноплексных меристем папоротниковидных и плауновидных так же, как и их структура, имеет и сходство, и различия. Сходство заключается в том, что и у плауновидных, и у папоротниковидных клетки периферической части моноплексной апикальной меристемы характеризуются экспрессией гомологов генов I класса семейства KNOX – маркеров меристематических клеток (Harrison et al., 2005; Sano et al., 2005; Ambrose, Vasco, 2016, 2020; Spencer et al., 2020; Maximova et al., 2021) и генов III класса семейства HD–Zip (Prigge, Clark, 2006; Vasco et al., 2016). Особенность экспрессии обоих гомологов по сравнению с цветковыми растениями, у которых она маркирует все клетки апикальной меристемы, в том, что и у плауновидных, и у папоротниковидных она отсутствует в апикальной инициали и клетках ближайших к ней мерофитов. С одной стороны, эти данные подтверждают выявленную в настоящей работе структурную неоднородность поверхностных инициалей в моноплексной апикальной меристеме папоротниковидных. С другой стороны, они показывают, что несмотря на выявленную в настоящей работе структурную однородность, поверхностные инициали S. kraussiana неоднородны транскрипционно. Молекулярно-генетическая особенность моноплексной апикальной меристемы плауновидных в том, что наряду с меристем-специфичными генами в ней происходит транскрипция гомолога гена ARP – регулятора образования листьев (Harrison et al., 2005; Spencer et al., 2020; Hernández-Hernández et al., 2021), который у папоротниковидных и цветковых растений никогда не экспрессируется в апикальной меристеме. Сравнение транскриптомов клеток моноплексных апикальных меристем плауновидного S. kraussiana и папоротниковидного sensu lato Equisetum arvense с помощью ДНК-микрочипов показало, что они менее сходны между собой, чем каждый из них с транскриптомом многоклеточной меристемы кукурузы (Frank et al., 2015). Различия транскриптомов, а также различия в экспрессии гомологов ARP свидетельствуют о существенных молекулярно-генетических различиях моноплексных апикальных меристем плауновидных и папоротниковидных.
Заслуживает внимания то, что симплексные меристемы как плауновидных, так и голосеменных характеризуются наличием гомологов меристем-специфичных генов KNOX (Maximova et al., 2021), “листовых” генов YABBY и отсутствием гомологов “листовых” генов ARP (Evkaikina et al., 2017; Romanova et al., 2021). Таким образом, симплексная апикальная меристема плауновидного H. selago сходна с симплексной апикальной меристемой голосеменных как по изученной в настоящем исследовании структуре клеток, так и по клеточным аспектам образования листьев (Romanova et al., 2010) и по молекулярно-генетической регуляции.
ЗАКЛЮЧЕНИЕ
Настоящее исследование показало, что наряду с общими чертами в зональности и неравных периклинальных делениях поверхностных инициалей, клетки моноплексных апикальных меристем плауновидного Selaginella kraussiana и папоротниковидных Pteridium aquilinum, Dryopteris carthu-siana и Athyrium filix-femina различаются по степени вакуолизации, отсутствию/наличию (соответственно) липидов в цитоплазме и крахмала в пластидах вокруг ядра, а также однородности/неоднородности ультраструктуры поверхностных инициалей, которые претерпели разное число периклинальных делений. Ультраструктура клеток апикальных меристем плауновидных S. kraussiana и Huperzia selago более сходна между собой, чем с таковой папоротниковидных. Таким образом, можно заключить, что структурные особенности клеток моноплексных апикальных меристем плауновидных и папоротниковидных различаются. В то же время выявлены таксоноспецифичные особенности меристематических клеток, то есть признаки, которые отличают клетки апикальных меристем плауновидных и папоротниковидных. Сходство в структуре и молекулярно-генетической регуляции в апикальных меристемах симплексного типа плауновидных и голосеменных растений (Evkaikina et al., 2017; Maximova et al., 2021; Romanova et al., 2021), а также сходный способ заложения листьев в этих группах растений (Romanova et al., 2010) можно рассматривать как аргументы в пользу гипотезы об исходности для высших растений многоклеточной (симплексной) апикальной меристемы. Реверсия к моноплексному структурному типу у некоторых плауновидных (пор. Selaginellales) и большинства папоротниковидных произошла независимо и, предположительно, явилась следствием утраты у них механизма формирования вторичных плазмодесм (Imaichi, Hiratsuka, 2007; Evkaikina et al., 2014, 2017; Frank et al., 2015). Однако для окончательного разрешения вопроса об исходном для высших растений типе апикальной меристемы необходимы структурные и молекулярно-генетические исследования более широкого круга несеменных растений с разными структурными типами апикальной меристемы побега.
Список литературы
Ambrose B., Vasco A. 2016. Bringing the multicellular fern meristem into focus. – New Phytol. 210 (3): 790–793. https://doi.org/10.1111/nph.13825
Ambrose B., Vasco A. 2020. Simple and Divided Leaves in Ferns: Exploring the Genetic Basis for Leaf Morphology Differences in the Genus Elaphoglossum (Dryopteridaceae). – Int. J. Mol. Sci. 21 (15): 5180. https://doi.org/10.3390/ijms21155180
Bierhorst D.W. 1971. Morphology of Vascular Plants. New York. 560 p.
Bierhorst D.W. 1977. On the stem apex, leaf initiation and early leaf ontogeny in filicalean ferns. – Am. J. Bot. 64 (2):125–152. https://doi.org/10.2307/2442101
Bowman J.L., Briginshaw L.N., Florent S.N. 2019. Evolution and co-option of developmental regulatory networks in early land plants. – Curr. Top. Devel. Biol. 131: 35–54. https://doi.org/10.1016/bs.ctdb.2018.10.001
Catesson A.-M. 1994. Cambial Ultrastructure and Biochemistry: Changes in Relation to Vascular Tissue Differentiation and the Seasonal Cycle. – Int. J. Plant Sci. 155 (3): 251–261. https://doi.org/10.1086/297165
Cecich R.A. 1977. An electron microscopic evaluation of cytohistological zonation in the shoot apical meristem of Pinus banksiana. – Am. J. Bot. 64 (10): 1263–1271. https://doi.org/10.2307/2442490
Cooke T.D., Tilney M.S., Tilney L.G. 1996. Plasmodesmatal networks in apical meristems and mature structures: geometric evidence for both primary and secondary formation of plasmodesmata. – In: Membranes: specialized functions in plants. Cambridge. P. 471–488.
Evkaikina A.I., Romanova M.A., Voitsekhovskaja O.V. 2014. Evolutionary aspects of non-cell-autonomous regulation in vascular plants: structural background and models to study. – Front. Plant Sci. 5: 31. https://doi.org/10.3389/fpls.2014.00031
Evkaikina A.I., Berke L., Romanova M.A., Proux-Wéra E., Ivanova A.N., Rydin C., Pawlowski K., Voitsekhovskaja O.V. 2017. The Huperzia selago shoot tip transcriptome sheds new light on the evolution of leaves. – Genome Biol. Evol. 9: 2444–2460. https://doi.org/10.1093/gbe/evx169
Fischer U., Kucukoglu M., Helariutta Y., Bhalerao R.P. 2019. The dynamics of cambial stem cell activity. – Annu. Rev. Plant Biol. 70: 293–319. https://doi.org/10.1146/annurev-arplant-050718-100402
Frank M.H., Edwards M.B., Schultz E.R., McKain M.R., Fei Z., Sørensen I., Rose J.K.C., Scanlon M.J. 2015. Dissecting the molecular signatures of apical cell– type shoot meristems from two ancient land plant lineages. – New Phytol. 207 (3): 893–904. https://doi.org/10.1111/nph.13407
Gifford E.M. 1983. Concept of apical cells in bryophytes and pteridophytes. – Annu. Rev. Plant Physiol. 34 (1): 419–440.
Gifford E.M., Foster A.S. 1989. Morphology and evolution of vascular plants. New York. 626 p.
Graham L.E., Cook M.E., Busse J.S. 2000. The origin of plants: body plan changes contributing to a major evolutionary radiation. – Proc. Natl. Acad. Sci. USA. 97 (9): 4535–4540. https://doi.org/10.1073/pnas.97.9.4535
Gunning B.E.S. 1978. Age–related and origin–related control of the numbers of plasmodesmata in cell walls of developing Azolla roots. – Planta. 143: 181–190. https://doi.org/10.1007/BF00387789
Gunning B.E.S., Steer M.W. 1996. Plant Cell Biology: Structure and Function. Massachusetts. 120 p.
Guzicka M., Pawlowski T.A., Staszak A., Rozkowski R., Chmura D.J. 2018. Molecular and structural changes in vegetative buds of Norway spruce during dormancy in natural weather conditions. – Tree Physiol. 38 (5): 721–734. https://doi.org/10.1093/treephys/tpx156
Harrison C.J., Corley S.B., Moylan E.C., Alexander D.L., Scotland R.W., Langdale J.A. 2005. Independent recruitment of a conserved developmental mechanism during leaf evolution. – Nature. 434 (7032): 509–514. https://doi.org/10.1038/nature03410
Harrison C.J., Rezvani M., Langdale J.A. 2007. Growth from two transient apical initials in the meristem of Selaginella kraussiana. – Development. 134(5): 881–889. https://doi.org/10.1242/dev.001008
Hernández-Hernández B., Tapia-López R., Ambrose B.A., Vasco A. 2021. R2R3-MYB evolution in plants, incorporating ferns into the story. – Int. J. Plant Sci. 182 (1): 1–8. https://doi.org/10.1086/710579
Imaichi R., Hiratsuka R. 2007. Evolution of shoot apical meristem structures in vascular plants with respect to plasmodesmatal network. – Am. J. Bot. 94 (12): 1911–1921. https://doi.org/10.3732/ajb.94.12.1911
Jernstedt J.A., Cutter E.G., Gifford E.M., Lu P. 1992. Angle meristem origin and development in Selaginella martensii. – Ann. Bot. 69 (4): 351–363. https://doi.org/10.1093/oxfordjournals.aob.a088352
Kenrick P., Crane P.R. 1997. The origin and early evolution of plants on land. – Nature. 389 (6646): 33–39. https://doi.org/10.1038/37918
Kidston R., Lang W.H. 1920. On Old Red Sandstone plants showing structure, from the Rhynie Chert Bed, Aberdeenshire. Part III. Asteroxylon mackiei, Kidston and Lang. – Trans. R. Soc. Edinb. 52 (03): 643–680. https://doi.org/10.1017/S0080456800004506
[Koteeva] Котеева Н.К. 1997. Изменение ультраструктуры клеток апикальной меристемы побега Pinus sylvestris (Pinaceae) в годичном цикле. – Бот. журн. 82 (6): 10–23.
Lucas W.J., Bouché–Pillon S., Jackson D.P., Nguyen L., Baker L., Ding B., Hake S. 1995. Selective trafficking of KNOTTED1 homeodomain protein and its mRNA through plasmodesmata. – Science. 270 (5244): 1980–1983. https://doi.org/10.1126/science.270.5244.1980
Maximova (Evkaikina) A.I., Berke L., Salgado M., Klimova E., Pawlowski K., Romanova M., Voitsekhovskaja O.V. 2021. What can the phylogeny of class I KNOX genes and their expression patterns in land plants tell us about the evolution of shoot development? – Bot. J. Linn. Soc. XX: 1–27. https://doi.org/10.1093/botlinnean/boaa088
McAlpin B.W., White R.A. 1974. Shoot organization in the Filicales: the promeristem. – Am. J. Bot. 61 (6): 562–579. https://doi.org/10.2307/2441679
Michaux N. 1971. Durée du cycle mitotique dans le méristème apical du jeune sporophyte du Pteris cretica L. CR. – Acad. Sci. Paris. 273: 336–339.
Michaux-Ferrière N., Hallet J.N. 1985. La cellule apicale: son rôle dans le contrôle de l’activité méristématique caulinaire. – Bull. Soc. Bot. Fr. Act. Bot. 132 (1): 49–61. https://doi.org/10.1080/01811789.1985.10826712
[Naumenko, Romanova] Науменко А.Н., Романова М.А. 2008. Апикальный морфогенез Psilotum nudum (Psilotaceae) и Botrychium lunaria (Ophioglossaceae). – Вестн. С.-Петерб. ун-та. Сер. 3. 2: 15–27.
Owston P.W. 1969. The shoot apex in eastern white pine: its structure, seasonal development, and variation within the crown. – Can. J. Bot. 47 (7): 1181–1188.
Philipson W.R. 1990. The significance of apical meristems in the phylogeny of land plants. – Plant. Sys. Evol. 173 (1–2): 17–38.
Prigge M., Clark S. 2006. Evolution of the class III HD-Zip gene family in land plants. – Evol. Dev. 8 (4): 350–61. https://doi.org/10.1111/j.1525-142X.2006.00107.x
Prislan P., Čufar K., Koch G., Schmitt U., Gričar J. 2013. Review of cellular and subcellular changes in the cambium. – IAWA J. 34 (4): 391–407. https://doi.org/10.1163/22941932-00000032
Rinne P.L.H., van der Schoot C. 2004. Cell-cell communication as a key factor in dormancy cycling. – J. Crop Improv. 10 (1–2): 113–156. https://doi.org/10.1300/J411v10n01_07
Rogge-Renner G.D., Steiner N., Schmidt É.C., Bouzon Z.L., Farias F.L., Guerra M.P. 2013. Structural and component characterization of meristem cells in Araucaria angustifolia (Bert.) O. Kuntze zygotic embryo. – Protoplasma. 250 (3): 731–739. https://doi.org/10.1007/s00709-012-0457-8
Romanova M., Jernstedt J. 2005. Morphogenetic events in the Ceratopteris richardii shoot apex. – Fern. Gaz. 17 (4): 204.
[Romanova, Borisovskaya] Романова М.А., Борисовская Г.М. 2004. Принципы структурной организации вегетативного тела папоротников: онтогенетический подход. – Бот. журн. 89 (5): 705–717.
[Romanova et al.] Романова М.А., Науменко А.Н., Евкайкина А.И. 2010. Особенности апикального морфогенеза в разных таксонах несеменных растений. – Вестн. С.-Петерб. ун-та. Сер. 3. 3: 29–41.
Romanova M.A., Maksimova A.I., Pawlowski K., Voitse-khovskaja O.V. 2021. YABBY Genes in the Development and Evolution of Land Plants. – International Journal of Molecular Sciences. 22 (4139): 1–23. https://doi.org/10.3390/ijms22084139
Ruzin S.E. 1999. Plant microtechnique and microscopy. New York. 322 p.
Sano R., Juárez C.M., Hass B., Sakakibara K., Ito M., Banks J.A., Hasebe M. 2005. KNOX homeobox genes potentially have similar function in both diploid unicellular and multicellular meristems, but not in haploid meristems. – Evol. Dev. 7 (1): 69–78.
Schneider H., Smith A.R., Pryer K.M. 2009. Is morphology really at odds with molecules in estimating fern phylogeny? – Syst. Bot. 34 (3): 455–475. https://doi.org/10.1600/036364409789271209
Seilhean V., Michaux-Ferriere N. 1985. Cell cycle duration in the meristem of Nephrolepis biserrata stolons: the role of the apical cell. – Am. J. Bot. 72 (7): 1089–1094. https://doi.org/10.2307/2443454
Sossountzov L. 1976. Intrastructure comparée de l’apex de bourgeons en activité et de bourgeons au repos chez une fougere, Marsilea drummondii. – A. Br. La Cellule 71: 275–307.
Spencer V., Venza Z.N., Harrison C.J. 2020. What can lycophytes teach us about plant evolution and development? Modern perspectives on an ancient lineage. – Evol. Dev. 2350: 1–23. https://doi.org/10.1111/ede.12350
Steeves T.A., Sussex I.M. 1989. Patterns in plant development. Cambridge. 388 p.
Stevenson D.W. 1976. Observations on phyllotaxis, stelar morphology, the shoot apex and gemmae of Lycopodium lucidulum Michaux (Lycopodiaceae). – Bot. J. Linn. Soc. 72 (2): 81–100. https://doi.org/10.1111/j.1095-8339.1976.tb01353.x
Stevenson D.W. 1978. Observations on shoot apices of Eusporangiate ferns. – Kew Bulletin. 33 (2): 279–283.
Szovenyi P., Waller M., Kirbis A. 2019. Evolution of the plant body plan. – In: Current Topics in Developmental Biology. Vol. 131. P. 1–34. https://doi.org/10.1016/bs.ctdb.2018.11.005
Tilney L.G., Cooke T.J., Connelly P.S., Tilney M.S. 1990. The distribution of plasmodesmata and its relationship to morphogenesis in fern gametophytes. – Development. 110 (4): 1209–2121.
Tomescu A.M.F., Wyatt S.E., Hasebe M., Rothwell G.W. 2014. Early evolution of the vascular plant body plan – the missing mechanisms. – Curr. Opin. Plant. Biol. 17 (2): 126–136. https://doi.org/j.pbi.2013.11.016
van der Schoot C., Rinne P. 1999. Networks for shoot design. – Trends Plant Sci. 4 (1): 31–37. https://doi.org/10.1016/S1360-1385(98)01362-4
van der Schoot C., Paul L. K., Rinne P. 2014. The embryonic shoot: a lifeline through winter – J. Exp. Bot. 65 (7): 1699–1712. https://doi.org/10.1093/jxb/ert413
Vasco A., Smalls T.L., Graham S.W., Cooper E.D., Wong G.K., Stevenson D.W., Moran R.C., Ambrose B.A. 2016. Challenging the paradigms of leaf evolution: Class III HD-Zips in ferns and lycophytes. – New Phytol. 212 (3): 745–758. https://doi.org/10.1111/nph.14075
Дополнительные материалы отсутствуют.
Инструменты
Ботанический журнал


