Физиология человека, 2019, T. 45, № 1, стр. 29-36
Изменения пространственной организации деятельности мозга под влиянием комбинированной антидепрессивной терапии, включающей транскраниальную магнитную стимуляцию
Е. В. Дамянович 1, Е. В. Изнак 1, И. В. Олейчик 1, Т. И. Медведева 1, А. Ф. Изнак 1, *
1 ФГБНУ Научный центр психического здоровья
Москва, Россия
* E-mail: iznak@inbox.ru
Поступила в редакцию 23.08.2018
После доработки 09.09.2018
Принята к публикации 01.10.2018
Аннотация
С целью выявления изменений пространственной организации деятельности мозга после курса комбинированной антидепрессивной терапии, включавшей прием антидепрессантов и высокочастотную (20 Гц) ритмическую транскраниальную магнитную стимуляцию (ТМС) дорсолатеральной префронтальной коры левого полушария, проведено мультидисциплинарное клинико-психолого-нейрофизиологическое исследование двух групп больных депрессией, получавших чисто медикаментозную (контрольная группа) или комбинированную терапию (группа ТМС). Показано, что после курса терапии в обеих группах произошло улучшение клинического состояния, но психологическое состояние и самочувствие оказалось лучше в группе ТМС. После курса терапии в обеих группах произошли тонкие изменения пространственной организации деятельности мозга, которые в большей степени отражались в значениях когерентности, а не спектральной мощности ЭЭГ. Основные изменения значений когерентности в контрольной группе наблюдались в поддиапазонах α2 (9–11 Гц), α3 (11–13 Гц) и θ1 (4–6 Гц), а в группе ТМС – в поддиапазоне β2 (20–30 Гц), в том числе, в области непосредственного воздействия ТМС. Полученные результаты свидетельствуют о том, что терапевтический эффект комбинированной антидепрессивной терапии, включающей высокочастотную ТМС дорсолатеральной префронтальной коры левого полушария, в виде более выраженного улучшения психологических и когнитивных показателей у больных группы ТМС обусловлен активацией не только самой этой области коры как зоны непосредственного воздействия ТМС, но и других тесно связанных с ней областей коры и подкорковых отделов головного мозга. Повышение когерентности более низкочастотных диапазонов ЭЭГ (α и θ) в других корковых областях может быть обусловлено усилением тормозных влияний со стороны префронтальной и орбито-фронтальной коры.
Одной из основных задач клинической нейрофизиологии в психиатрии является уточнение нейрофизиологических механизмов, лежащих в основе компенсаторных перестроек деятельности мозга в результате терапии.
В ряду социально-значимых психических заболеваний особое место принадлежит депрессивным расстройствам из-за их широкой распространенности и связанного с ними тяжелого социально-экономического бремени. Всемирная Организация Здравоохранения (ВОЗ) сообщает, что в мире более 120 млн больных депрессией [1]. Как причина длительной потери работоспособности, инвалидности и смертности депрессия уже вышла на первое место в мире среди психических расстройств и, по прогнозам ВОЗ, вскоре займет второе место в мире среди всех заболеваний [1, 2]. В связи с этим повышение эффективности лечения депрессии представляет собой высоко актуальную медико-социальную проблему, тем более что многие больные (до 30–60%) проявляют неудовлетворительный клинический эффект антидепрессивной фармакотерапии (фармакорезистентность), а также нежелательные побочные эффекты [2–6].
Одним из перспективных путей преодоления фармакорезистентности при депрессиях является комбинированная терапия, включающая прием антидепрессантов и транскраниальную магнитную стимуляцию (ТМС) [7–14]. Показано, что лучшие клинические результаты дает активирующая высокочастотная ритмическая ТМС дорсолатеральной префронтальной коры левого полушария. При этом не только редуцируются симптомы депрессии [7–14], но и улучшаются когнитивные функции [10].
Однако нейрофизиологические механизмы терапевтического действия ТМС пока изучены недостаточно. Так, во многих работах не было обнаружено изменений спектральной мощности ЭЭГ в динамике терапии в области непосредственного воздействия ТМС [8, 11, 12], хотя результаты психологических тестов, адресованных префронтальной коре, указывали на улучшение ее функционального состояния после курса ТМС [10, 12]. При этом изменения ЭЭГ отмечались в других зонах коры, но несмотря на высокую частоту ТМС (20–25 Гц), касались более низкочастотных α и θ) диапазонов ЭЭГ [8, 11, 12].
В современной клинической нейрофизиологии в качестве одного из ведущих механизмов патогенеза ряда психических, в том числе депрессивных, расстройств рассматривается нарушение взаимодействия между разными областями коры и между корой и подкорковыми структурами головного мозга [15–17]. Считается, что вовлечение разных областей коры в единую функциональную систему должно находить отражение в сходстве характеристик ЭЭГ в этих отведениях. Степень сходства активности разных зон коры отражают значения когерентности (Ког) ЭЭГ [18]. Ког ЭЭГ, наряду с параметрами спектральной мощности ЭЭГ, является информативным показателем изменений функционального состояния головного мозга при развитии и в процессе терапии психических расстройств [7, 8, 13, 16–22].
Цель данного исследования – выявление изменений пространственной организации деятельности мозга по параметрам Ког ЭЭГ после курса комбинированной антидепрессивной терапии, включавшей прием антидепрессантов и высокочастотную ритмическую ТМС дорсолатеральной префронтальной коры левого полушария.
МЕТОДИКА
Мультидисциплинарное клинико-психолого-нейрофизиологическое исследование проводили с соблюдением современных этических норм и правил биомедицинских исследований в соответствии с Хельсинкским соглашением Всемирной медицинской ассоциации (в редакции 1964/1972/2000 гг.) на базе лаборатории нейрофизиологии, отдела медицинской психологии и отдела по изучению эндогенных психических расстройств и аффективных состояний ФГБНУ “Научный центр психического здоровья”.
Исследование проводили на 2-х группах больных клиники ФГБНУ НЦПЗ с депрессивными состояниями легкой и умеренной степени тяжести, отвечающими критериям рубрик F31.3, F33.0 и F33.1 по Международной классификации болезней (МКБ-10). При предшествующих госпитализациях в различные лечебные учреждения клинический эффект антидепрессивной фармакотерапии у этих больных оказывался недостаточным, что отвечает критериям фармакорезистентной депрессии [3–5]. Группы были идентичны по полу (все женщины, праворукие), статистически не различались по возрасту (p > 0.05) и имели сходную синдромальную структуру депрессии. В первую группу (далее – группа контроля) вошли 24 пациентки в возрасте от 19 до 48 лет (средний возраст 27.5 ± 8.5 лет), во вторую (далее – группа ТМС) – 27 пациенток в возрасте от 18 до 49 лет (средний возраст 33.3 ± 10.5 лет). Больных отбирали в эти две группы случайным образом. Клиническое состояние больных характеризовали наличием комплекса симптомов депрессии в виде сниженного настроения, пессимистической оценки жизненных ситуаций, тревоги, раздражительности, эмоциональной лабильности, замедления моторики и мышления, нарушений сна, а также снижения работоспособности (как профессиональной, так и в быту). В ходе исследования все больные получали синдромально обоснованную медикаментозную терапию антидепрессантами (преимущественно, селективными ингибиторами обратного захвата серотонина), а пациенткам группы ТМС в рамках комбинированной терапии дополнительно проводили курс высокочастотной ритмической ТМС дорсолатеральной префронтальной коры левого полушария.
Больные обеих групп дважды, до начала курса терапии (на визите 1) и через 3 нед. терапии (на визите 2), проходили количественное клиническое, психологическое и нейрофизиологическое (ЭЭГ) обследование. Для группы ТМС, получавшей комбинированную терапию, визит 2 соответствовал окончанию проведения 15 сеансов ТМС.
Клинико-психологическая оценка динамики состояния. Клинический эффект медикаментозной и комбинированной терапии количественно оценивался по шкале Гамильтона для депрессии (HDRS-17) [23]. Общее психологическое состояние и самочувствие больных количественно оценивалось с помощью симптоматического опросника SCL-90-R (Symptome Check List-90-Revised) [24].
Для оценки динамики когнитивных функций принятия решений в процессе терапии использовались компьютерные версии Висконсинского теста сортировки карточек (Wisconsin Card Sorting Test – WCST) [25] и теста Айовская Игровая Задача (Iowa Gambling Task – IGT) [26]. Тест WCST является классическим для определения сохранности когнитивных функций, опосредованных лобными и префронтальными полями коры головного мозга: произвольного внимания, активации, регуляции деятельности, целенаправленной активности, принятия логических решений [27, 28]. Тест IGT определяет функциональное состояние орбито-фронтальной коры и лимбических структур головного мозга и оценивает роль эмоций в принятии интуитивных решений [26, 29].
Нейрофизиологическое (ЭЭГ) исследование. С целью оценки динамики функционального состояния головного мозга в процессе терапии всем больным проводилаи многоканальную регистрацию фоновой ЭЭГ в состоянии спокойного бодрствования с закрытыми глазами с помощью аппаратно-программного комплекса “Нейро-КМ” и компьютерной программы “BrainSys” [30]. ЭЭГ записывалась в 16-ти отведениях: F7, F3, F4, F8, T3, C3, Cz, C4, T4, T5, P3, Pz, P4, T6, O1 и O2 относительно ипсилатеральных ушных референтов А1 и А2, по Международной системе 10–20, с полосой пропускания 35 Гц, постоянной времени 0.1 с и частоте оцифровки 200 Гц.
Затем проводили спектрально-когерентный анализ безартефактных фрагментов ЭЭГ (не менее 30-ти 4-секундных эпох) в 8-ми узких частотных поддиапазонах (∆ – 2–4, θ1 – 4–6, θ2 – 6–8, α1 – 8–9, α2 – 9–11, α3 – 11–13, β1 – 13–20 и β2 – 20–30 Гц). Анализировали динамику количественных значений абсолютной спектральной мощности и Ког ЭЭГ до начала курса терапии и через 3 нед. терапии (на визитах 1 и 2 соответственно). Сравнивали значения Ког ЭЭГ в каждом из выделенных узких частотных поддиапазонов во всех возможных парах из 12-ти ЭЭГ-отведений: F7, F3, F4, F8, T3, C3, C4, T4, P3, P4, O1 и O2 в каждой группе пациентов до и после курса медикаментозной (для группы контроля) и комбинированной (для группы ТМС) терапии, как между двумя группами для каждого визита в отдельности, так и для каждой группы между 1-м и 2-м визитами. С целью снижения “статистического шума” для анализа отбирали только те пары отведений, в которых исходные значения Ког (на визите 1) были равны или превышали 0.70. Кроме того, для каждой из групп оценивали количество изменившихся, увеличившихся и уменьшившихся значений Ког для всех пар отведений на 2-м визите по сравнению с 1-м визитом. Увеличение или уменьшение Ког отмечали, когда оно превышало порог 0.05.
Транскраниальная магнитная стимуляция. Сеансы ТМС проводили ежедневно (кроме выходных дней) в течение трех недель (всего 15 сеансов) с помощью магнитного стимулятора “Нейро-МС/Д” (производства ООО “Нейрософт”, г. Иваново, Россия), снабженного 8-образным индуктором. Во время сеанса пациентки находились в положении сидя в удобном кресле. Каждый сеанс ТМС включал 40 серий по 40 прямоугольных магнитных импульсов с частотой 20 Гц (всего 1600 импульсов за сеанс) с интервалами между сериями по 14 с, общая продолжительность сеанса 10.5 мин. Интенсивность импульсов, наносимых на область проекции левой дорсолатеральной префронтальной коры (в районе ЭЭГ-отведений Fp1, F3, F7), индивидуально подбирали таким образом, чтобы во время ритмической ТМС не происходило сокращений мышц лица. Она составляла 60–80% от предварительно определенного для каждой больной моторного порога, т.е. интенсивности одиночного магнитного импульса, наносимого на область корковой проекции кисти правой руки в левом полушарии (точка на 5–7 см латеральнее vertex, в районе ЭЭГ-отведения С3) и вызывавшего моторный ответ в виде вздрагивания большого пальца правой руки.
Статистический анализ данных. Статистическую обработку комплекса клинических, психологических и нейрофизиологических данных осуществляли с использованием программ описательной и непараметрической статистики пакетов “STATISTIСA для Windows” 6.0 и IBM SPSS v.22, а также статистических программ, встроенных в пакет программ для анализа и топографического картирования ЭЭГ “BrainSys” [30]. Достоверность различий средних значений клинических и психологических параметров до (на визите 1) и после курса терапии (на визите 2) в группах ТМС и контроля определяли методом ANOVA с повторными измерениями. В связи с очень незначительными межгрупповыми и динамическими различиями значений Ког во всех проанализированных парах ЭЭГ-отведений, для их статистической оценки в категориях: “изменились/не изменились”, “увеличились/не увеличились”, “уменьшились/не уменьшились”, были использованы непараметрические методы: критерий Пирсона (χ2) и точный тест Фишера (в одностороннем – F1 и двустороннем – F2 вариантах).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Клинико-психологическая оценка эффективности терапии. После курса терапии и в группе ТМС, и в контрольной группе больных выявлено статистически высоко достоверное (p < 0.001) улучшение клинического состояния по шкале HDRS-17. Среднее по группе ТМС значение общей суммы баллов шкалы HDRS-17 уменьшилось с 21.00 ± 5.53 до начала терапии до 7.26 ± 4.82 после 15-ти сеансов ТМС. В группе контроля этот показатель уменьшился с 23.21 ± 7.22 до начала терапии до 9.14 ± 6.94 после 3-х нед. лечения. Однако значительная редукция депрессивной симптоматики в обеих группах и высокая дисперсия данных внутри каждой из групп не позволили выявить достоверных различий между группами ТМС и контрольной по показателям шкалы HDRS-17 (р > 0.05).
В обеих группах после курса терапии также достоверно (p < 0.05–0.0001) улучшились показатели психологического состояния и самочувствия по всем шкалам опросника SCL-90-R. При этом были выявлены достоверные межгрупповые различия по динамике интегрального показателя SCL-90-R “Индекс тяжести наличного дистресса”. Значения этого параметра до начала терапии в обеих группах были сопоставимы: 2.24 ± 0.43 в группе ТМС и 2.16 ± 0.44 в контрольной группе. После курса терапии они достоверно (p < 0.001) снизились и в группе ТМС (до 1.58 ± 0.55) и в контрольной группе (до 1.73 ± 0.56), но снижение в группе ТМС было более выражено. Так, после курса терапии в группе ТМС процент больных с низким индексом дистресса (менее 1.75) составил 77.8%, в то время как в контрольной группе – 58% (p < 0.038) (рис. 1).
Рис. 1.
Изменения психологического состояния больных после курса антидепрессивной терапии. На диаграмме представлен процент больных с низким и высоким индексом наличного дистресса (по опроснику SCL-90-R) до начала и после курса антидепрессивной терапии в группе ТМС и в контрольной группе. а – низкий уровень индекса дистресса (менее 1.75), б – высокий уровень индекса дистресса (1.75 и выше), численные значения процента больных с низким и высоким индексом наличного дистресса дополнительно указаны в столбиках диаграммы. 1 – группа контроля до начала курса медикаментозной терапии (визит 1), 2 – группа ТМС до начала курса комбинированной терапии (визит 1), 3 – группа контроля после курса медикаментозной терапии (визит 2), 4 – группа ТМС после курса комбинированной терапии (визит 2).
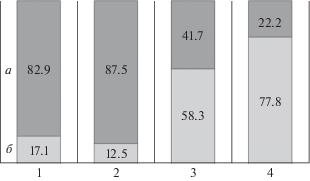
Таким образом, хотя значительная редукция депрессивной симптоматики после курса терапии отмечена в обеих группах, больные из группы ТМС показали более выраженное улучшение психологического состояния и самочувствия, по сравнению с контрольной группой.
Динамика когнитивных функций в процессе терапии. После курса комбинированной терапии в группе ТМС было отмечено статистически достоверное уменьшение процента персевераторных ошибок при выполнении Висконсинского теста сортировки карточек (WCST) – с 18% на 1-м визите до 12% на 2-м визите (р < 0.05). В контрольной группе значения этого показателя составили 18 и 15% соответственно, и изменения не достигли уровня достоверности (р > 0.05). Поскольку выполнение теста WCST связано с активацией дорсолатеральных префронтальных областей коры [27, 28], уменьшение процента персевераторных ошибок в тесте WCST свидетельствует об улучшении функционирования как самой префронтальной коры, ответственной за программирование, контроль деятельности и принятие логических решений, так и корково-подкорковых связей, связанных с энергетическим обеспечением работы мозга, его регуляцией и активацией.
При выполнении Айовской Игровой задачи (IGT) в группе ТМС достоверно увеличились значения интегрального параметра “Превышение "хороших” выборов над “плохими” с 10.93 на 1-м визите до 19.21 на 2-м визите (р < 0.05). Выполнение теста IGT связано с активацией орбито-фронтальной коры и эмоциональным научением [26, 29]. В контрольной группе достоверного улучшения этого параметра выявлено не было – его значения составили 12.58 и 15.50 соответственно (р > 0.05).
Таким образом, помимо улучшения динамических характеристик деятельности (в виде сокращения времени на выполнение тестов), отмеченное в обеих группах, больные из группы ТМС после курса комбинированной терапии продемонстрировали выраженное улучшение показателей принятия логических решений (в тесте WCST), а также способности к эмоциональному научению и принятию интуитивных решений (в тесте IGT).
Динамика когерентности ЭЭГ в процессе терапии. Анализ количественных значений Ког всех возможных пар из 12-ти ЭЭГ-отведений для каждой из групп пациентов до начала терапии (на визите 1), не выявил достоверных различий между группами (р > 0.05), что позволило провести межгрупповые сравнения изменений значений Ког в тех же парах отведений через 3 нед. лечения (на визите 2).
Статистически достоверные различия между группами пациентов по числу изменившихся значений Ког получены в поддиапазонах ЭЭГ α2 (9–11 Гц), α3 (11–13 Гц), θ1 (4–6 Гц) и β2 (20–30 Гц). В большинстве пар ЭЭГ-отведений значения Ког в этих поддиапазонах ЭЭГ увеличились (рис. 2), что согласуется с данными литературы [7, 8, 13, 16–22].
Рис. 2.
Изменения когерентности ЭЭГ больных в группе ТМС и в контрольной группе после курса антидепрессивной терапии. На рисунке представлены топографические карты значений когерентности ЭЭГ в группе ТМС в поддиапазоне ЭЭГ β2 (20–30 Гц) – А (кружком в левой лобно-передневисочной области помечена зона воздействия ТМС), и в контрольной группе в поддиапазонах ЭЭГ θ1(4–6 Гц), α2 (9–11 Гц) и α3 (11–13 Гц) – Б, до начала лечения (слева от шкалы) и после курса терапии (справа от шкалы). Ахроматическая (в оттенках серого) шкала между картами – в единицах когерентности (Ког) ЭЭГ. На картах линиями, соединяющими точки ЭЭГ-отведений, обозначены значения Ког в этих парах отведений, равные или превышающие 0.70.
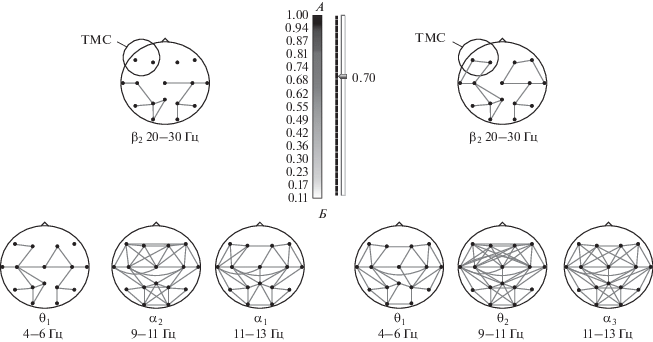
Так, в поддиапазоне α2 (9–11 Гц) в контрольной группе достоверно (χ2 = 7.07, р = 0.0078; F1 р = 0.0069; F2 р = 0.0137) увеличились значения Ког в 19-ти парах отведений (F7-F3, F7-T3, F7-C3, F7-C4, F3-C3, F3-T3, F3-C4, F4-C3, F4-C4, F4-T3, F8-C3, F8-C4, F8-T4, T3-C4, T3-P3, C3-T3, C3-P3, C4-P4 и T4-P4) (рис 2). В группе ТМС значения Ког изменились в 10-ти парах отведений, из них в 7-ми парах (F7-T3, F3-T3, F4-T4, F8-T4, C3-T3, C3-C4 и C4-P4) они увеличились и в 3-х парах (T3-P3, F8-C4 и F4-C4) – уменьшились (для уменьшившихся значений Ког в этих парах межгрупповые различия оказались не достоверны – р > 0.05).
В поддиапазоне α3 (11–13 Гц) в контрольной группе значения Ког увеличились (χ2 = 4.55, р = 0.0330; F1 р = 0.0324) в 10-ти парах (F7-F4, F3-F4, F3-C4, F3-F8, F4-C3, F4-C4, F8-C4, C3-C4, C4-P4 и T4-P4). В группе ТМС изменились пять значений Ког, из них три увеличились (в парах C3-C4, F4-T4 и F8-T4) и два уменьшились (в парах C4-T4 и T4-P4).
Таким образом, увеличение значений Ког в поддиапазонах α2 (9–11 Гц) и α3 (11–13 Гц) для перечисленных выше пар отведений наблюдалось в обеих группах пациентов. Но более выраженное повышение сходства ЭЭГ в контрольной группе достигнуто за счет усиления длинных межполушарных связей, в то время как в группе ТМС усиливались преимущественно короткие внутриполушарные связи.
В поддиапазоне θ1 (4–6 Гц) в контрольной группе отмечено изменение (χ2 = 4.223, р = 0.0399) 11-ти значений Ког, из них 10 увеличились (в парах F4-C3, F4-T4, F8-C4, F8-T4, C4-T4, T4-P4, P3-T3, P4‑T4, P4-O1 и O1-O2) и одно уменьшилось (в паре C4-P4). В группе ТМС изменились восемь значений Ког, из них одно увеличилось (в паре F4-C3) и семь уменьшились (в парах T3-P3, C3-P3, C4-F8, C4‑T4, T4-P4, P3-O1 и O1-O2).
В поддиапазоне β2 (20–30 Гц) в контрольной группе увеличилось только одно значение Ког (в паре F7-F3). В группе ТМС изменились восемь значений Ког, из них семь увеличились (в парах F7‑F3, F7-T3, F3-C3, F4-F8, F4-C4, F8-T4 и T3-C3,) и одно уменьшилось (в паре Т4-С4) (χ2 = 5.40, р = 0.0201; F1 р = 0.0240, F2 р = 0.0479).
Таким образом, основные изменения Ког после курса терапии в группе контроля наблюдались в поддиапазонах α2 (9–11 Гц), α3 (11–13 Гц) и θ1 (4–6 Гц), а в группе ТМС – в поддиапазоне β2 (20–30 Гц). В контрольной группе увеличилось сходство ЭЭГ преимущественно в лобно-центрально-височных зонах левого и правого полушарий, а также межполушарное сходство ЭЭГ этих же областей. В группе ТМС увеличилось сходство ЭЭГ в лобно-височных областях левого и правого полушарий, но без изменения значений Ког в межполушарных симметричных парах отведений.
Традиционно повышение Ког ЭЭГ в β-диапазоне расценивается как отражение активации данной области коры [7, 8, 13, 16–22]. Однако, судя по результатам анализа спектральной мощности ЭЭГ, в группе ТМС повышение сходства ЭЭГ в поддиапазоне β2 (20–30 Гц) в лобно-передневисочных областях левого и правого полушарий обусловлено разнонаправленными процессами.
Как видно на рис. 3, значения спектральной мощности β2-поддиапазона в левой лобно-центрально-передневисочной области после курса комбинированной антидепрессивной терапии несколько увеличиваются, тогда как в правом полушарии они заметно уменьшаются. Хотя эти изменения ЭЭГ и не достигают уровня статистической значимости (p > 0.05), они дают основания предполагать повышение активации левой лобно-височной области под действием ТМС и снижение активации симметричной зоны правого полушария, возможно, за счет межполушарного торможения.
Рис. 3.
Изменения спектральной мощности ЭЭГ больных в группе ТМС после курса комбинированной антидепрессивной терапии. На рисунке представлены топографические карты спектральной мощности ЭЭГ в β2 (20–30 Гц) поддиапазоне ЭЭГ в группе ТМС до начала (А) и после (Б) курса комбинированной антидепрессивной терапии. Ахроматическая (в оттенках серого) шкала между картами А и Б – в единицах спектральной мощности ЭЭГ (мкВ2). Кружком в левой лобно-передневисочной области помечена зона воздействия ТМС.

Это согласуется с результатами тестирования психологического состояния и самочувствия (по опроснику SCL-90-R), а также принятия решений (по тестам WCST и IGT). Они убедительно свидетельствуют, что после курса комбинированной терапии, включающей высокочастотную ТМС, происходит активация как самой левой дорсолатеральной префронтальной коры, так и ее нисходящих связей, ответственных за энергетическое обеспечение и регуляцию работы мозга [28], а также орбито-фронтальной коры левого полушария [26], находящейся в непосредственной близости от области воздействия ТМС.
Таким образом, улучшение функционального состояния головного мозга больных после трехнедельного курса лечения в контрольной группе, получавшей только медикаментозную терапию, ассоциируется с повышением Ког в диапазонах α2, α3 и θ1, что согласуется с данными литературы [7, 8, 13, 16–22]. В группе ТМС, получавшей комбинированную терапию (медикаментозную и ТМС), это сочетается с изменениями Ког и спектральной мощности преимущественно в β2-поддиапазоне в лобно-центрально-височных областях, свидетельствующими о повышении активации этих зон в левом полушарии (в области непосредственного воздействия ТМС) и уменьшении их активации в правом полушарии.
Полученные в работе данные согласуются с классическими [31] и современными [6, 32–34] представлениями о предпочтительной роли передних отделов левого полушария в регуляции положительных эмоций, а правого полушария – в регуляции отрицательных эмоций и в патогенезе депрессивных расстройств.
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют о том, что после курса комбинированной антидепрессивной терапии, включающей высокочастотную ТМС дорсолатеральной префронтальной коры левого полушария, у больных депрессией происходят тонкие изменения пространственной организации деятельности мозга, которые в большей степени отражаются в значениях когерентности, а не спектральной мощности фоновой ЭЭГ. При этом дополнительный эффект ТМС в виде более выраженного улучшения психологических и когнитивных показателей обусловлен активацией не только самой этой области коры как зоны непосредственного воздействия ТМС, но и других, тесно связанных с ней, областей коры и подкорковых отделов головного мозга. В свою очередь, повышение когерентности ЭЭГ в более низкочастотных, по сравнению с частотой ТМС, α- и θ-диапазонах ЭЭГ в других корковых областях может быть обусловлено усилением тормозных влияний со стороны префронтальной и орбито-фронтальной коры.
Исследование поддержано РФФИ (грант РФФИ № 18-01-00029а).
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
World Health Organization. Depression. WHO Statistics, 2011. 170 p.
Краснов В.Н. Расстройства аффективного спектра. М.: Практическая медицина, 2011. 432 с.
Мосолов С.Н. Резистентность к психофармакотерапии и методы ее преодоления // Психиатрия и психофармакотерапия. 2002. № 4. С. 132.
Fava M. Diagnosis and definition of treatment-resistant depression // Biological Psychiatry 2003. V. 53. № 8. P. 649.
Быков Ю.В., Беккер Р.А., Резников М.К. Депрессии и резистентность. М.: РИОР: ИНФРА-М, 2013. 374 с.
Изнак А.Ф., Изнак Е.В., Олейчик И.В. и др. ЭЭГ-корреляты лобной дисфункции как предикторы относительной фармакорезистентности при терапии эндогенных аффективных расстройств // Журн. неврологии и психиатрии им. С.С. Корсакова. 2014. Т. 114. № 12. С. 53.
Padberg F., Zwanzger P., Thoma H. et al. Repetitive transcranial magnetic stimulation (rTMS) in pharmacotherapy-refractory major depression: comparative study of fast, slow and sham rTMS // Psychiatry Research. 1999. V. 88. P. 163.
Мельникова Т.С., Капилетти С.Г., Мариненко К.Е. и др. Спектральный анализ динамики ЭЭГ при терапии депрессий транскраниальной магнитостимуляцией // Социальная и клиническая психиатрия. 2002. № 4. С. 24.
Gross M., Nakamura L., Pascual-Leone A., Fregni F. Has repetitive transcranial magnetic stimulation (rTMS) treatment for depression improved? A systematic review and meta-analysis comparing the recent vs. the earlier rTMS studies. // Acta Psychiatr. Scand. 2007. V. 116. № 3. P. 165.
Маслеников Н.В., Цукарзи Э.Э., Мосолов С.Н. Депрессии при шизофрении: оценка когнитивных функций в динамике при лечении транскраниальной магнитной стимуляцией // Социальная и клиническая психиатрия. 2013. Т. 23. № 1. С. 5.
Noda Y., Nakamura M., Saeki T. et al. Potentiation of quantitative electroencephalograms following prefrontal repetitive transcranial magnetic stimulation in patients with major depression // Neuroscience Research. 2013. V. 77. № 1–2. P. 70.
Изнак А.Ф., Изнак Е.В., Дамянович Е.В. и др. Транскраниальная магнитная стимуляция в комплексной терапии фармакорезистентной депрессии: динамика клинических, психологических и ЭЭГ показателей // Физиология человека. 2015. Т. 41. № 5. С. 57.
Мельникова Т.С., Цукарзи Э.Э., Ковалев А.В., Мосолов С.Н. Динамика когерентных характеристик ЭЭГ при транскраниальной магнитной стимуляции у больных с терапевтически резистентной депрессией // Социальная и клиническая психиатрия. 2016. Т. 26. № 3. С. 38.
Croarkin P.E., Nakonezny P.A., Zhi-De Deng et al. High-frequency repetitive TMS for suicidal ideation in adolescents with depression // Journal of Affective Disorders. 2018. V. 239. P. 282.
Beauregard M., Paquette V., Levesque J. Dysfunction in the neural circuitry of emotional self-regulation in major depressive disorder // Neuroreport. 2006. V. 17. № 8. P. 843.
Бочкарев В.К., Киренская А.В., Солнцева С.В., Ткаченко А.А. Особенности пространственной организации вызванных ритмов ЭЭГ у больных параноидной шизофренией // Журн. неврологии и психиатрии им. С.С. Корсакова. 2017. Т. 117. № 1. С. 29.
Изнак А.Ф., Изнак Е.В., Мельникова Т.С. Параметры когерентности ЭЭГ как отражение нейропластичности мозга при психической патологии // Психиатрия. 2018. № 2. С. 127.
Nunez P.L., Silberstein R.B., Shi Z. et al. EEG cohe-rence // Clin. Neurophysiol. 1999. V. 110. № 3. P. 469.
Стрелец B.Б., Гарах Ж.В., Новотоцкий-Власов В.Ю., Магомедов Р.А. Соотношение между мощностью и синхронизацией ритмов ЭЭГ в норме и при когнитивной патологии // Журнал высшей нервной деятельности им. И.П. Павлова. 2005. Т. 55. № 4. С. 496.
Мельникова Т.С., Лапин И.А., Саркисян В.В. Информативность использования когерентного анализа ЭЭГ в психиатрии // Функциональная диагностика. 2009. № 1. С. 88.
Варламов А.А., Стрелец В.Б. Анализ когерентности ЭЭГ при депрессивных расстройствах: современное состояние проблемы и перспективы клинического применения // Журн. высшей нервной деятельности им. И.П.Павлова. 2013. Т. 63. № 6. С. 613.
Ahn J., Han D.H., Hong J.S. et al. Features of Resting-State Electroencephalogram Theta Coherence in Somatic Symptom Disorder Compared With Major Depressive Disorder: A Pilot Study // Psychosom. Med. 2017. V. 79. № 9. P. 982.
Hamilton M.Y. Psychopathology of depressions: quantitative aspects. Psychopathology of depression. Helsinki: WHO Press, 1980. P. 201.
Derogatis L.R., Savitz K.L. The SCL-90-R and the Brief Symptom Inventory (BSI) in Primary Care / Handbook of psychological assessment in primary care settings. Ed. Maruish M.E. Mahwah, NJ, US: Lawrence Erlbaum Associates Publishers, 2000. V. 236. P. 297.
Heaton R.K. Wisconsin Card Sorting Test: Computer Version 4, Research Edition (WCST: CV4). Lutz, FL: Psychological Assessment Resources, 2003.
Must A., Horvath S., Nemeth V.L., Janka Z. The Iowa Gambling Task in depression – what have we learned about sub-optimal decision-making strategies? // Front. Psychol. 2013. V. 4. P. 732.
Stuss D.T., Levine B., Alexander M.P. et al. Wisconsin Card Sorting Test performance in patients with focal frontal and posterior brain damage: effects of lesion location and test structure on separable cognitive processes // Neuropsychologia. 2000. V. 38. № 4. P. 388.
Лурия А.Р. Высшие психические функции человека и их нарушения при локальных поражениях мозга. 3-е издание. М.: Академический Проект, 2004. 512 с.
Медведева Т.И., Ениколопова Е.В., Ениколопов С.Н. Гипотеза соматических маркеров Дамасио и игровая задача (IGT) // Психологические исследования. 2013. № 6. С. 12.
Митрофанов А.А. Компьютерная система анализа и топографического картирования электрической активности мозга с нейрометрическим банком ЭЭГ-данных (описание и применение). М., 2005. 63 с.
Flor-Henry P. Cerebral Basis of Psychopathology. Boston: Wright, 1983. 346 p.
Davidson, R.J., Jackson, D.C., Kalin N.H. Emotion, plasticity, context, and regulation: perspectives from affective neuroscience // Psychological Bulletin. 2000. V. 126. № 6. P. 890.
Thibodeau R., Jorgensen R.S., Kim S. Depression, an-xiety, and resting frontal EEG asymmetry: a meta-analytic review // J. Abnormal Psychology. 2006. V. 115. 34. P. 715.
Mathersul D., Williams L.M., Hopkinson P.J., Kemp A.H. Investigating models of affect: relationships among EEG alpha asymmetry, depression and anxiety // J. Biological Psychology. 2008. V. 80. P. 560.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


