Физиология человека, 2019, T. 45, № 1, стр. 19-28
Влияние команд Go/NoGo на уровни индуцированных ответов на лицевые стимулы
В. Н. Думенко 1, *, М. К. Козлов 1, Е. А. Черемушкин 1
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
* E-mail: vdumenko@yandex.ru
Поступила в редакцию 21.09.2017
После доработки 26.12.2017
Принята к публикации 04.04.2018
Аннотация
На модели когнитивной установки на лицевую экспрессию в четырехсекундных интервалах между целевым и пусковым стимулами исследовали (вейвлет-преобразование) динамику корковых потенциалов в четырех диапазонах частот (8–13, 15–20, 21–40 и 41–60 Гц) при предъявлении в середине интервала кондиционирующих стимулов Go/NoGo, повышающих нагрузку на рабочую память. Паттерны значимых индуцированных ответов, сформировавшиеся в определенных корковых зонах в каждом из полушарий, различались в группах испытуемых соотносительно “успешности” выполнения задания. Показано влияние обоих кондиционирующих стимулов на уровни индуцированных ответов в зависимости от диапазона частот. В первых диапазонах доминировали влияния положительного стимула Go. Тормозной стимул NoGo в высокочастотном диапазоне 41–60 Гц оказывал более выраженное влияние на уровни индуцированных ответов, что и определило формирование паттерна значимых ответов в более обширной зоне активированных областей. Можно предположить, что процесс взаимовлияния между функционально различающимися стимулами Go и NoGo в широкой полосе компонентов ЭЭГ является важным фактором, определяющим взаимодействие высокочастотной активности с другими диапазонами частот в пространственно разнесенных областях, что, в свою очередь, обеспечивает условия когнитивной деятельности человека.
Работа выполнена на модели когнитивной установки [1], что предусматривает возможность испытуемым в пределах одного эксперимента выделять как восприятие предъявляемого выражения лица (стадия формирования установки), так и опознание измененного его выражения (стадия тестирования установки). В работе [2] в условиях 16-секундного интервала между лицевым и пусковым стимулами была выявлена зависимость между пластичностью когнитивной деятельности испытуемых (количество допущенных ошибок при выполнении задания) и динамикой реакций α-ритма 8–13 Гц. При этом уровни мощности α-диапазона существенно изменялись в ситуациях повышения нагрузки на рабочую память за счет предъявления кондиционирующих стимулов (положительный стимул Go – нажимать на кнопку или тормозной стимул NoGo – не нажимать).
В предыдущей работе [3] впервые была показана динамика уровня мощности компонентов ЭЭГ в широкой частотной полосе 8–60 Гц в четырех диапазонах (8–13, 15–20, 21–40 и 41–60 Гц) под влиянием указанных кондиционирующих стимулов. В ситуации 16-секундного интервала у более “успешных” испытуемых (группа 1; 1–5 ошибок) положительный стимул Go вызывал значимо бóльшие уровни потенциалов, чем тормозной стимул NoGo. В высокочастотных диапазонах 21–40 и 41–60 Гц эти различия были более выражены, чем в диапазоне 15–20 Гц, при отсутствии заметных изменений в α-полосе 8–13 Гц. У испытуемых группы 2 (6–40 ошибок) подобная динамика не была выявлена.
В данном исследовании использовали 4-секундные интервалы: 1-й фрагмент (1–2 с) – предъявление лицевых стимулов, на их фоне – предъявление кондиционирующих стимулов (Go или NoGo) и 2-го фрагмента (3–4 с) с индуцированными ответами. Более короткие интервалы снижают нагрузку на рабочую память, однако используемая модель эксперимента предусматривала дополнительные требования к испытуемым: тормозной стимул NoGo сигнализировал отсутствие не только двигательных, но и словесных ответов (см. Методика). Стимулы Go (или NoGo) предъявляли в конце первого фрагмента 1–2 с, а 4-секундный интервал между комплексами стимулов менялся случайным образом.
Цель работы – исследовать функциональное влияние кондиционирующих стимулов Go–NoGo на вызванные лицевыми стимулами изменения амплитуды потенциалов в 4-секундных интервалах в разных диапазонах частот (8–13, 15–20, 21–40 и 41–60 Гц) у испытуемых в каждой из трех групп: группа 1 (n = 13) – без ошибок выполнения задания, группа 2 (n = 19) – 1–5 ошибок, группа 3 (n = 10) – 6–40 ошибок.
Задачи работы: 1) сопоставить влияния функционально противоположных кондиционирующих стимулов (Go, NoGo) на индуцированные ответы лицевых стимулов в широкой полосе частот 8–60 Гц в двух фрагментах (1–2 и 3–4 с) у испытуемых как на стадии формирования установки (восприятие предъявляемого выражения лица), так и тестирования установки (опознание измененного выражения лица); 2) оценить значимость уровня потенциалов в соответствующих паттернах индуцированных ответов в 18-ти отведениях обоих полушарий в каждом из четырех диапазонов у испытуемых трех групп (1, 2, 3) в зависимости от “успешности” решения поставленной задачи.
МЕТОДИКА
В исследовании участвовали 42 испытуемых (студенты, аспиранты, научные сотрудники), средний возраст 23.8 ± 0.8 лет. Испытуемые были ознакомлены с характером предстоящего исследования и давали добровольное письменное согласие на него. Исследование соответствовало принципам Хельсинкской декларации.
Стимулы и процедура эксперимента. На экране одновременно предъявляли изображения лица одного и того же человека: слева – с “сердитым” выражением, справа – с “нейтральным” (экспозиции стимула – 350 мс). На стадии формирования этот стимул предъявляли 20 раз; на стадии тестирования 40 раз предъявляли измененный стимул (оба лица имели нейтральное выражение); “пусковым стимулом” служила точка в центре экрана [2]. Пусковой стимул появлялся через 4 с после лицевого стимула. В конце первого интервала (1–2 с) в случайном порядке предъявляли кондиционирующие стимулы: на предъявление круга зеленого цвета (сигнал для положительного стимула Go) следовало нажимать на кнопку после пускового сигнала, а синего цвета (сигнал для тормозного стимула NoGo) – не нажимать (цвета меняли случайным образом) [3]. В данной работе учитывали изменения уровня компонентов ЭЭГ (вейвлет-преобразование) только в пределах 4-секундного интервала (до предъявления пускового сигнала), что определялось комплексным стимулом (исходный лицевой стимул + памятный след Go/NoGo, хранящийся в рабочей памяти). Условия проведения эксперимента включали требования к испытуемым тормозить словесный ответ при предъявлении круга синего цвета (сигнал NoGo). По количеству ошибок на стадии тестирования испытуемые были разделены на три группы: группа 1 (без ошибок решения задания; n = 13), группа 2 (1–5 ошибок; n = 19), группа 3 (6–40 ошибок; n = 10).
Регистрация ЭЭГ. Регистрацию электрической активности мозга проводили от 20 точек поверхности головы в соответствии с международной схемой 10–20% (F3, F4, F7, F8, Fz, C3, C4, Cz, T3, T4, T5, T6, P3, P4, O1, O2) и 4-х дополнительных электродов (FC3, FC4, FT7, FT8) монополярным способом относительно объединенного ушного электрода. Электрод заземления устанавливали на поверхности головы между Fz и Cz. ЭЭГ регистрировали с помощью системы Neocortex-Pro (“Neurobotics”, Россия), которая была установлена на компьютере IBM (“Pentium 4”). Частота дискретизации – 1000 Гц, полоса пропускания частот – 0.5–70 Гц, использования 1–70 Гц. Применяли хлорсеребряные электроды (“Micromed”, Венгрия) с сопротивлением не более 5 кОм. Предъявление стимулов осуществляли с помощью второго компьютера на базе процессора “Pentium 3”. В данной работе использовали полосу частот 8–60 Гц: 8–13 Гц – α; 15–20 Гц – β1; высокочастотные диапазоны 21–40 Гц – γ1 и 41–60 Гц – γ2.
Анализ данных. Для оценки динамики уровней компонентов ЭЭГ, вызванных (induced) лицевыми стимулами, 4-секундный интервал делили на 2 последовательных отрезка по 2 с и рассчитывали изменения вейвлет-коэффициентов относительно уровня односекундного предстимульного периода. Для этих отрезков с шагом 1 Гц и разрешением по времени 4 мс вычисляли непрерывное вейвлет-преобразование на основе “материнского” комплексного Morlet-вейвлета (пакет MATLAB 7.0.1) в полосе 8–60 Гц [3], которую разделили на четыре диапазона частот: 8–13, 15–20, 21–40 и 41–60 Гц. Использовали функцию “cwt”, после чего от полученных комплексных коэффициентов вейвлет-преобразования (КВП) переходили к их модулю (амплитуде). Основной числовой единицей данных, на которых строили дальнейший анализ, выступала величина этой вейвлет-амплитуды, усредненная отдельно по каждому частотному диапазону на отрезках длительностью одна секунда.
Анализировали величину изменения этой (средней) амплитуды по отношению к ее значению на предстимульном периоде, которую оценивали соотношением R = 100% × (A – Af)/Af , где A – средние значения модуля КВП по каждому диапазону на том или ином односекундном отрезке между целевым и пусковым стимулами, Af – те же значения на предстимульном отрезке, R – величина изменений, вызванных лицевыми стимулами.
Эту величину рассматривали как непосредственно при характеристике функциональных и межгрупповых различий в разных диапазонах частот, так и сравнением ее распределений по пяти либо по трем условным уровням, отображаемых соответствующими гистограммами. Мерой различия двух аналогичных распределений является сумма модулей разностей числа случаев, приходящихся на каждый отдельный отсчет этих распределений.
Для выявления региональных особенностей динамики корковых потенциалов использовали разработанный авторами специальный показатель, отражающий “значимость” или “выраженность” изменения активности, характеризующий эту динамику в каждом из 20-ти отведений обоих полушарий. Этот показатель вычисляли как произведение трех весовых коэффициентов и определяли данное отведение как “работающее”, если его значение превосходило 1. Базовым значением в общем показателе выраженности изменения активности в данном регионе выступал масштаб убывания (1-й весовой коэффициент). Это – просто модуль изменения КВП, отмасштабированный к порогу в 2%. Второй и третий коэффициенты соотносят величину изменения КВП с ее средними значениями по совокупности отведений и соответствующей дисперсией с тем же эмпирическим порогом в 2%. Они носят корректирующий характер, занижая значимость, если изменения в данном регионе мало отличаются от изменения общего уровня активности коры.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В данной работе, как и в предыдущей [4], в ответ на предъявление лицевых стимулов наблюдали снижение уровня потенциалов относительно предстимульного периода. У всех испытуемых, допускающих разное количество ошибок (группы 1, 2, 3), в первом фрагменте (1–2 с) изменения уровня в полосе частот 8–60 Гц в большинстве случаев ограничивались величиной изменения амплитуды в пределах ±2% от предстимульного периода. Во втором фрагменте (3–4 с) динамику амплитуды оценивали по модулю коэффициента вейвлет-преобразования. На табл. 1 представлены усредненные по обоим полушариям изменения амплитуды корковых потенциалов (модуль КВП) у испытуемых двух групп (наиболее различающихся по своей “успешности”): группа 1 и группа 3 (табл. 1). Положительный стимул Go вызывал повышение уровня ответов во втором фрагменте в 4-х диапазонах частот (8–13, 15–20, 21–40 и 41–60 Гц) в состоянии формирования и тестирования, при этом у испытуемых 1-й группы они были более высокого уровня, чем в 3-й. Значимые превышения уровня (сравнение по критерию Стьюдента) наблюдали на стадии формирования в высокочастотных диапазонах 21–40 Гц и особенно 41–60 Гц.
Таблица 1.
Усредненные изменения амплитуды корковых потенциалов в 2-х фрагментах (I, II) 4-секундного интервала у испытуемых группы 1 и группы 3
| Испытуемые | Диапазоны, Гц | Go | NoGo | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Ф | T | Ф | T | ||||||
| I | II | I | II | I | II | I | II | ||
| Гр. 1 | 8–13 | 0.42 | –4.30 | 0.76 | –2.76 | –0.37 | 1.92 | 2.31 | 3.23 |
| 15–20 | –0.18 | –3.34 | 0.68 | –2.63 | –0.88 | –1.93 | 0.91 | –0.48 | |
| 21–40 | –1.09 | –5.21 | –0.60 | –4.73 | –2.08 | –5.80 | –1.64 | –4.64 | |
| 41–60 | –1.39 | –5.87 | –1.15 | –5.14 | –4.09 | –7.73 | –2.91 | –6.58 | |
| Гр. 3 | 8–13 | –1.82 | –6.49 | 1.17 | –5.17 | 1.31 | 0.38 | –2.03 | –1.91 |
| 15–20 | 0.16 | –3.84 | 2.88 | –3.27 | 0.99 | –0.88 | 0.63 | –0.39 | |
| 21–40 | 1.38 | –3.53 | 3.81 | –3.54 | 1.00 | –2.23 | –0.45 | –3.12 | |
| 41–60 | 0.44 | –3.93 | 1.91 | –4.56 | –0.24 | –4.78 | –2.16 | –4.20 | |
Тормозные стимулы NoGo у этих испытуемых на стадии формирования вызывали более высокие уровни потенциалов, особенно в высокочастотном диапазоне 41–60 Гц, чем в ситуации стимула Go. На стадии тестирования наблюдали значимое повышение уровня индуцированных ответов по сравнению со стимулом Go. Таким образом, тормозной стимул NoGo индуцировал более высокие амплитуды ответов в высокочастотных диапазонах (21–40 и 41–60 Гц) и сравнительно низкие – в α-полосе (8–13 Гц).
У испытуемых группы 3 (6–40 ошибок) амплитуды компонентов в высокочастотных диапазонах 21–40 и 41–60 Гц были значимо ниже, чем у испытуемых 1-й группы в обеих ситуациях. У испытуемых группы 2 (1–5 ошибок) в большинстве случаев не наблюдали различий в уровне суммарных ответов первого и второго фрагментов.
В связи с отчетливо выраженной неравномерностью распределения значений амплитуд в исследуемых 4-секундных интервалах, особенно при сопоставлении первого фрагмента (1–2 с) со вторым (3–4 с), при суммарной оценке каждого фрагмента (с учетом 18 корковых отведений) использовали для наглядности 3 условных уровня на основе соответствующих числовых значений. Так, близкие значения к исходному односекундному предстимульному периоду (>–5 усл. ед.) обозначали символом а, изменения от –5 до ‒10 усл. ед. – б и, наконец, наибольшие изменения (<–10…–25 усл. ед.) – в. В результате каждый 2-секундный фрагмент получал условную оценку соответствующих уровней потенциалов, исходя из 36 или 72 вариантов (9 × 4 – объединение полушарий; 18 × 4 – раздельно по полушариям), которая была выражена в процентах (а, б, в; %). Образец такого условного распределения приведен в табл. 2 для 1-го (I) и 2-го (II) фрагментов в четырех диапазонах частот. Такие таблицы использовались для построения гистограмм распределения уровней изменения корковых потенциалов (величин вейвлет-коэффициентов).
Таблица 2.
Распределение величины изменения компонентов ЭЭГ по трем условным уровням (а, б, в) в I и II фрагментах 4-секундного интервала в ситуации предъявления стимулов Go (А) и NoGo (Б) у испытуемых группы 1 (без ошибок)
| А | |||||||
|---|---|---|---|---|---|---|---|
| Интервалы | Диапазоны, Гц | Ф | Т | ||||
| а | б | в | а | б | в | ||
| I | 8–13 | 66.67 | 19.44 | 13.89 | 65.28 | 23.61 | 11.11 |
| 15–20 | 69.44 | 18.06 | 12.50 | 77.78 | 18.06 | 4.17 | |
| 21–40 | 70.83 | 27.78 | 1.39 | 77.78 | 22.22 | 0.00 | |
| 41–60 | 70.83 | 22.22 | 6.94 | 62.50 | 36.11 | 1.39 | |
| II | 8–13 | 23.61 | 27.78 | 48.61 | 31.94 | 31.94 | 36.11 |
| 15–20 | 27.78 | 38.89 | 33.33 | 34.72 | 33.33 | 31.94 | |
| 21–40 | 11.11 | 40.28 | 48.61 | 19.44 | 38.89 | 41.67 | |
| 41–60 | 9.72 | 33.33 | 56.94 | 9.72 | 52.78 | 37.50 | |
| Б | |||||||
| Интервалы | Диапазоны, Гц | Ф | Т | ||||
| а | б | в | а | б | в | ||
| I | 8–13 | 66.67 | 16.67 | 16.67 | 77.78 | 9.72 | 12.50 |
| 15–20 | 68.06 | 25.00 | 6.94 | 77.78 | 18.06 | 4.17 | |
| 21–40 | 61.11 | 30.56 | 8.33 | 56.94 | 41.67 | 1.39 | |
| 41–60 | 30.56 | 36.11 | 33.33 | 30.56 | 55.56 | 13.89 | |
| II | 8–13 | 70.83 | 20.83 | 8.33 | 83.33 | 5.56 | 11.11 |
| 15–20 | 43.06 | 31.94 | 25.00 | 55.56 | 30.56 | 13.89 | |
| 21–40 | 11.11 | 30.56 | 58.33 | 13.89 | 56.94 | 29.17 | |
| 41–60 | 0.00 | 11.11 | 88.89 | 1.39 | 27.78 | 70.83 | |
Примечание: величина изменения амплитуды относительно предстимульного периода: а – больше, чем –3, б – от –3 до –6, и в – меньше –6%. Обозначения см. табл. 1.
В ситуации предъявления положительного стимула Go у испытуемых 1-й группы (без ошибок) для первого фрагмента 1–2 с (табл. 2, А, I) распределения выраженности компонентов ЭЭГ по трем условным уровням (а, б, в; %; табл. 2, А) показали, что доли наименьшего уровня (а) в четырех диапазонах частот составили 67–71% (стадия формирования) и 63–77% (стадия тестирования), тогда как доли наибольшего уровня (в) – соответственно 1–14% (стадия формирования) и 0–11% (стадия тестирования). Из табл. 2, А, II следует, что во втором фрагменте (3–4 с) высокие уровни потенциалов (в) распределялись по диапазонам частот следующим образом: 8–13 Гц – 49%, 15–20 Гц – 33%, 21–40 Гц – 49% и 41–60 Гц – 57% на стадии формирования установки, а на стадии тестирования соответственно: 36, 32, 42 и 38%.
У этих испытуемых в ситуации предъявления тормозного стимула NoGo для первого фрагмента 1–2 с (табл. 2, Б, I) наблюдали уровни потенциалов (а) в 68–31% (стадия формирования) и 78–31% (стадия тестирования), тогда как уровни (в) – соответственно 7–33% (стадия формирования) и 1–14% (стадия тестирования). Распределения изменений потенциалов во втором фрагменте (табл. 2, Б, II) существенно различались: высокие их уровни (в) распределялись по диапазонам частот следующим образом: 8–13 Гц – 8%, 15–20 Гц – 25%, 21–40 Гц – 58% и 41–60 Гц – 89% на стадии формирования, а на стадии тестировани соответственно: 11, 14, 29 и 71%. Таким образом, во втором фрагменте влияние тормозного стимула NoGo выражалось в значительном повышении уровня высокочастотных компонентов (89 и 71%) в отличие от влияний стимула Go.
У испытуемых в группах 2 (1–5 ошибок) и 3 (6–40 ошибок) выраженность распределения высокого уровня потенциала (в) во втором фрагменте не отличалась от первого фрагмента в ситуациях предъявления стимулов Go или NoGo.
С целью дальнейшего анализа индуцированных ответов в более информативном втором фрагменте (3–4 с) на одном рисунке сопоставляли динамику долевых высоких уровней потенциала (в) в ситуациях предъявления как стимула Go (а), так и NoGo (б) у испытуемых группы 1 и группы 3 (рис. 1). Оказалось, что в состояниях формирования и тестирования у испытуемых группы 1 (рис. 1, А и Б) в диапазонах частот 8–13 и 15–40 Гц доли ответов на стимулы Go были выше, чем на стимулы NoGo (30–40% числа случаев против 10%). Однако в высокочастотном диапазоне 41–60 Гц доли индуцированных ответов на стимулы NoGo достигали уровня 89% на стадии формирования и 71% на стадии тестирования, что значительно отличалось от ответов, индуцированных стимулом Go (в пределах 50–60%).
Рис. 1.
Сопоставление долей наибольшего уровня корковых потенциалов (уровень в) по диапазонам частот (8–13, 15–20, 21–40, 41–60 Гц) во втором фрагменте (3–4 с) в ситуациях предъявления положительного стимула Go (а) и тормозного NoGo (б) в состояниях формирования и тестирования (А, Б) у испытуемых групп 1 и 3. По вертикали – доли наибольшего уровня корковых потенциалов (<–10…–25 усл. ед.).
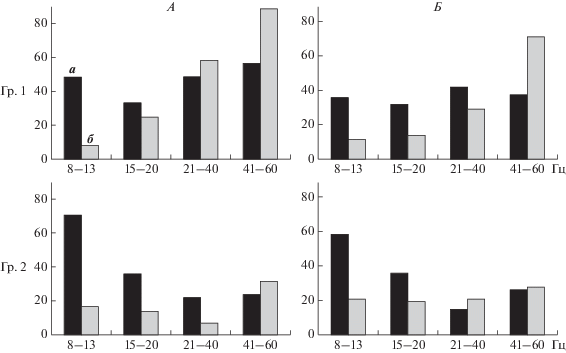
У испытуемых группы 3 (рис. 1) высокие уровни потенциалов индуцировались стимулом Go только в диапазоне 8–13 Гц (до 70% числа случаев), постепенно ослабляясь в диапазонах 15–20, 21–40 и 41–60 Гц (в пределах 20–30%). Феномен повышения доли индуцированных ответов на стимулы NoGo (б) в высокочастотных диапазонах (21–40, 41–60 Гц) вообще не наблюдали, что, возможно, и определило наличие ошибок у испытуемых этой группы.
У испытуемых 2-й группы не отмечали различий уровней ответов между фрагментами.
Следующий этап исследований заключался в попытке оценить топографию значимых индуцированных ответов в 18-ти отведениях обоих полушарий. Стимулы Go/NoGo слабо влияли на топографическую оценку динамики корковых потенциалов в первом фрагменте 1–2 с (табл. 3, I). Так, у испытуемых группы 1 (n = 13) значимые уровни ответов, индуцированных стимулом Go, наблюдали в 5-ти отведениях в 4-х диапазонах частот (табл. 3, I), а влияние стимулов NoGo – в 2-х отведениях только в диапазоне 8–13 Гц (табл. 3).
Таблица 3.
Топография значимых ответов в 18-ти отведениях обоих полушарий в двух фрагментах (I, II) 4-секундного интервала в 4-х диапазонах частот в ситуациях раздельного предъявления стимулов Go и NoGo у испытуемых группы 1
| Диапазоны, Гц | I | II | ||
|---|---|---|---|---|
| Go | NoGo | Go | NoGo | |
| 8–13 | P3 | P3, T5 | F7, FT7, C3, T3 | – |
| – | – | F8, FT8, C4 | F8, FT8 | |
| 15–20 | C3 | – | C3 | T3 |
| F4 | – | FC4, F4, FT8, C4 | T4 | |
| 21–40 | C3 | – | FC3, C3 | O1 |
| – | – | FC4, C4 | C4, P4, O2, T4 | |
| 41–60 | – | – | C3 | F7, FC3, FT7, C3, P3 |
| F4 | – | F4, FC4, C4, O2, T6 | F8, C4, P4, T6 | |
Примечание: в пределах каждого диапазона верхняя строка – левое полушарие, нижняя – правое. Обозначения см. табл. 1.
Более сложные паттерны корковых потенциалов у этих испытуемых получали отражение во втором фрагменте (3–4 с) в виде мозаики представительств разных отведений (табл. 3, II ). Положительный стимул Go индуцировал значимые ответы в диапазонах 8–13 и 15–20 Гц в 12-ти отведениях, тогда как тормозной NoGo – только 4-х, т.е. больше в 3 раза (табл. 3, II ). В диапазоне 21–40 Гц стимулы Go и NoGo индуцировали 4 и 5 ответов (табл. 3, II ). В высокочастотном диапазоне 41–60 Гц число ответов, индуцированных стимулом NoGo, было больше, чем индуцированных Go (9 и 6; табл. 3, II ).
Под влиянием кондиционирующих стимулов формировались определенные корковые зоны (рис. 2). В диапазонах 8–13 и 15–20 Гц стимул Go индуцировал большее число корковых зон, чем стимул NoGo (12 к 4). Только в высокочастотном диапазоне 41–60 Гц стимул NoGo индуцировал наибольшее число ответов в корковых зонах обоих полушарий, что указывает на расширение зоны влияний тормозного стимула (9 областей) по сравнению с положительным стимулом Go (6 областей). Можно предположить, что полученные данные указывают на функциональное значение высокочастотных составляющих в обеспечении взаимовлияния стимулов Go и NoGo, и что, возможно, является важным условием “успешности” испытуемых группы 1.
Рис. 2.
Топографическое отображение областей коры со значимыми ответами на лицевые стимулы во втором фрагменте (3–4 с) четырехсекундного интервала в 4-х диапазонах частот в условиях действия положительных Go и тормозных NoGo стимулов у испытуемых группы 1 (без ошибок). Значимость величины изменения уровня потенциалов определялась произведением трех весовых коэффициентов, выражающих ее отклонение от нулевого и среднего по полушарию уровня (см. “Методика”). ⚫ – показатель в данном отведении превышает единицу.

У испытуемых в группе 2 (n = 19) положительный стимул Go в высокочастотном диапазоне 41–60 Гц не индуцировал значимые уровни ответов, что исключило возможность взаимодействия с тормозным стимулом NoGo (рис. 3, Гр. 2).
Рис. 3.
Топографическое отображение областей коры со значимыми ответами на лицевые стимулы во втором фрагменте (3–4 с) четырехсекундного интервала в 2-х диапазонах частот (21–40 и 41–60 Гц) в условиях действия положительных Go и тормозных NoGo стимулов у испытуемых групп 2 и 3. Обозначения см. рис. 2.

У испытуемых группы 3 (n = 10) паттерны значимых ответов, индуцированных Go и NoGo, получили отчетливое отражение в высокочастотном диапазоне Г, однако, в отличие от испытуемых группы 1, эти зоны выделяли меньшее число областей. Следует подчеркнуть, что среди них отсутствовали функционально значимые фронтальные области (рис. 3, Гр. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данной работе (в условиях требования к испытуемым тормозить словесный ответ) показаны различия в динамике влияний кондиционирующих стимулов у испытуемых разных групп. У наиболее успешных испытуемых (группа 1) тормозной стимул NoGo индуцировал более высокие амплитуды ответов в высокочастотных диапазонах (21–40 и 41–60 Гц) в двух ситуациях: как при усреднении мощности (модуль КВП) областей обоих полушарий (табл. 1), так и при оценке топографии значимых ответов (рис. 2).
В предыдущей работе (в условиях сохранения словесных ответов на оба кондиционирующих стимула) у успешных испытуемых положительный стимул Go индуцировал в высокочастотных диапазонах значимо более высокие амплитуды ответов, чем тормозной стимул NoGo [3].
Сопоставление обеих ситуаций (торможение вербальных ответов или их сохранение) позволяет предположить наличие процесса взаимовлияния функционально различающихся стимулов Go и NoGo в пространственных паттернах γ2-ответов, что, возможно, облегчает взаимодействие γ-компонентов с другими частотами ЭЭГ в обеспечении когнитивной деятельности человека.
В литературе широко представлены работы о функциональном значении γ-полосы ЭЭГ. Динамика выраженности высокочастотных колебаний человека (35–65 Гц) обусловлена различными когнитивными процессами: вниманием [5, 6 и др.], нагрузкой на рабочую память [7 и др.], восприятием времени [8 и др.]. Функциональное значение γ-полосы ЭЭГ было показано в процессе оценки коррелятов реальных и замаскированных ответов [9]. В дальнейшем исследовали повышение уровня высокочастотной активности в зависимости от субъективных состояний [10], а также при оценке электрографических коррелятов “внутренней речи” [11].
Многие авторы [5, 12–15] предполагали, что процесс формирования образа стимула (Geschtalt) определяется интеграцией активности нейронов входа как по восходящей системе (bottom up), так и нисходящих контролирующих влияний (top down) со стороны зон префронтальной коры за счет синхронизованной деятельности γ-диапазона. Полученные в данной работе результаты подтверждают этот тезис, поскольку наиболее высокие уровни ответов на кондиционирующие стимулы относились к высокочастотному диапазону 41–60 Гц.
Весьма интересны данные, свидетельствующие, что зоны орбитофронтальной коры способны частично анализировать информацию о зрительных стимулах, предвосхищая момент определения идентичности объекта и немедленно предсказывая значимое будущее [7, 16–18 и др.]. Интегрированный образ каждой конкретной ситуации содержит не только модель сенсорных стимулов, но и информацию о планируемых действиях [5, 7, 19]. В этой связи способность префронтальной коры критически (crucial) анализировать информацию о зрительных стимулах, можно рассматривать как оказывающую контролирующие тормозные влияния (top-down inhibitory). Таким образом, можно предположить, что наблюдаемое в данной работе значимое повышение уровня ответов, индуцированных тормозными стимулами NoGo в высокочастотном диапазоне 41–60 Гц, является отражением нисходящих контролирующих влияний префронтальной коры, определяющих адекватные ответы у успешных испытуемых.
Убедительные данные литературы о тесной корреляции между уровнем мощности высокочастотных колебаний в месте отведения и уровнем оксигенации крови (ответы BOLD, blood oxygenation level dependent) рассматривались авторами в аспекте метаболических ресурсов [20]. Полученные в нашей работе у более успешных испытуемых уровни значимых ответов на лицевые стимулы, индуцированные стимулами NoGo, также относились к высокочастотному диапазону 41–60 Гц, что позволяет рассматривать их как отражение метаболического ресурса. У испытуемых групп 2 (1–5 ошибок) и 3 (6–40 ошибок) не наблюдали подобную динамику.
В другой работе [21] в ситуации 8-секундных межстимульных интервалов у успешных испытуемых наблюдали повышение амплитуды высокочастотных ответов, что также рассматривали в аспекте энергетических ресурсов.
ВЫВОДЫ
1. В данной работе (в условиях требования к испытуемым тормозить словесный ответ) показаны различия динамики уровней потенциалов (вейвлет–преобразование) в зависимости от двух факторов: диапазона частот (исследуемая полоса 8–60 Гц) и функционально различающихся кондиционирующих стимулов Go и NoGo. У испытуемых группы 1 (без ошибок) тормозные стимулы NoGo в высокочастотном диапазоне 41–60 Гц индуцировали существенно более высокий уровень значимых ответов в сравнении с положительным стимулом Go. У испытуемых групп 2 (1–5 ошибок) и 3 (6–40 ошибок) значимые влияния кондиционирующих стимулов в этих условиях не выявлялись.
2. Сложные паттерны потенциалов значимых ответов на лицевые стимулы, индуцированные функционально различающимися стимулами Go или NoGo, были выражены в виде мозаики представительств 18-ти отведений обоих полушарий. У испытуемых 1-й группы (n = 13) показана определенная динамика влияний обоих кондиционирующих стимулов на паттерны потенциалов значимых ответов. Доминирование тормозного стимула NoGo в высокочастотных диапазонах определило формирование более обширной зоны активированных фронтальных и фронто-центральных областей с более высоким уровнем ответов в сравнении с положительным стимулом Go.
3. У испытуемых группы 2 (n = 19) при анализе полученных данных не выявлены влияния кондиционирующих стимулов на формирование индуцированных ответов. У испытуемых группы 3 (n = 10) в зонах индуцированных ответов (в отличие от группы 1) отсутствовали функционально важные фронтальные области.
Список литературы
Узнадзе Д.Н. Психология установки. Спб.: “Питер”, 2001. 416 с.
Костандов Э.А., Черемушкин Е.А., Яковенко И.А., Петренко Н.Е. Зависимость между пластичностью когнитивной деятельности и реакцией альфа-ритма на кондиционирующие сигналы // Физиология человека. 2015. Т. 41. № 5. С. 16.
Думенко В.Н., Козлов М.К., Черемушкин Е.А., Петренко Н.Е. Изменения выраженности компонентов ЭЭГ (8–60 Гц) под влиянием предъявления стимулов Go/NoGo на фоне 16-секундного интервала в зависимости от “успешности” испытуемых // Журн. высш. нервн. деят. им. И.П. Павлова. 2017. Т. 67. № 2. С. 150.
Думенко В.Н., Козлов М.К., Черемушкин Е.А. Мощность вызванных гамма-ответов на лицевую экспрессию при восьмисекундной паузе между целевым и пусковым стимулами // Журн. высш. нервн. деят. им. И.П. Павлова. 2014. Т. 64. № 4. С. 401.
Tallon-Baudry C. The roles of gamma-band oscillatory synchrony in human visual cognition // Front. Biosci. 2009. V. 14. P. 321.
Morgan H.M., Muthukumaraswamy S.D., Hibbs C.S. et al. Feature integration in visual working memory: Parietal gamma activity is related to cognitive coordination // J. Neurophysiol. 2011. V. 106. № 6. P. 3185.
Rouhinen S., Panula J., Palva M., Palva S. Load dependence of beta and gamma oscillations predicts individual capacity of visual attention // J. Neurosci. 2013. V. 33. № 48. P. 19023.
Бушов Ю.В., Светлик М.В., Крутенкова Е.П. Высокочастотная электрическая активность мозга и восприятие времени. Труды Томского ун-та, 2009. С. 113.
Кирой В.Н., Владимирский Б.М., Асланян Б.В. и др. Электрографические корреляты реальных и мысленных движений // Журн. высш. нервн. деят. им. И.П. Павлова. 2010. Т. 60. № 5. С. 525.
Миняева Н.Р., Медведев Д.С. Высокочастотная осцилляторная активность мозга человека при восприятии фигур с субъективными контурами // Инженерный вестник Дона. 2014. Т. 31. № 4-1. С. 117.
Кирой В.Н., Бахтин О.М., Миняева Н.Р. и др. Электрографические корреляты внутренней речи // Журн. высш. нервн. деят. им. И.П. Павлова. 2015. Т. 65. № 5. С. 616.
Соколов Е.Н. Проблема гештальта в нейробиологии // Журн. высш. нервн. деят. им. И.П. Павлова. 1996. Т. 46. № 2. С. 229.
Freeman W.J. The wave packet: an action potential for the 21st centure // J. Integr. Neurosci. 2003. V. 2. № 1. P. 3.
Lee T.G., D’Esposito M. The dynamic nature of top-down signals originating from prefrontal cortex: A combined fMRI-TMS study // J. Neurosci. 2012. V. 32. № 44. P. 15 458.
Spitzer B., Gloel M., Schmidt T.T., Blankerburg F. Working memory coding of analog stimulus properties in the human prefrontal cortex // Cereb. Cortex. 2014. V. 24. № 8. P. 2229.
Roux F., Wibral M., Mohr H.M. et al. Gamma–band activity in human prefrontal cortex codes for the number of relevant items maintained in working memory // J. Neurosci. 2012. V. 32. № 36. P. 12411.
Chaumon M., Kveraga K., Barrett L.F., Bar M. Visual predictions in the orbitofrontal cortex rely on associative content // Cereb. Cortex. 2014. V. 24. № 11. P. 2899.
Panichello M.F., Cheung O.S., Bar M. Predictive feedback and conscious visual experience // Front. Psychol. 2013. V. 3. P. 620.
Melloni L., Schwiedrzik C.M., Muller M. et al. Expectation change the signatures and timing of electrophysiological correlates of perceptual awareness // J. Neurosci. 2011. V. 31. № 2. P. 1386.
Niessing J., Ebisch B., Schmidt K.E. et al. Hemodynamic signals correlate tighty with synchronized gamma oscillations // Science. 2005. V. 309. P. 948.
Думенко В.Н., Козлов М.К. Динамика амплитуды гамма-ответов ЭЭГ в условиях восьмисекундного интервала между лицевыми и пусковыми стимулами в зависимости от “успешности” выполнения задания // Физиология человека. 2016. Т. 42. № 5. С. 13.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


