Физиология человека, 2019, T. 45, № 1, стр. 49-63
Анализ реактивных паттернов ээг у лиц с фибрилляцией предсердий
О. Е. Дик 1, *, И. А. Святогор 1, А. Д. Ноздрачев 1, Н. Л. Гусева 2
1 ФГБУН Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
2 ФГБУН Институт экспериментальной медицины
Санкт-Петербург, Россия
* E-mail: dickviola@gmail.com
Поступила в редакцию 20.07.2017
После доработки 07.02.2018
Принята к публикации 04.04.2018
Аннотация
С помощью методов нелинейной динамики (вейвлетный и рекуррентный анализы) ЭЭГ оценена реакция усвоения ритма фотостимуляции у лиц с фибрилляцией предсердий пароксизмальной и постоянной форм. В качестве количественных параметров этой реакции рассматриваются коэффициенты усвоения и удержания ритма, время запоминания ритма, значение вейвлет-когерентности, а также средняя длина диагональных линий совместной рекуррентной диаграммы светового сигнала и паттерна ЭЭГ. Проведенное исследование демонстрирует возможность примененных методов количественно оценить лабильность мозга воспроизводить предложенные ритмы у разных групп пациентов.
Как известно, в связи со старением населения постоянно увеличивается число людей с нарушениями сердечного ритма, в частности, возрастает риск возникновения мерцательной аритмии [1]. Нарушения гемодинамики и тромбоэмболические осложнения, связанные с хронической мерцательной аритмией (фибрилляцией предсердий постоянного типа) повышают риск возникновения ишемического инсульта и даже смерти [2–4]. При пароксизмальной форме фибрилляции предсердий нарушение сердечного ритма может проходить самостоятельно или под действием лекарств, однако по мере прогрессирования заболевания возможен переход пароксизмальной формы в постоянную [5]. В соответствии с многочисленными наблюдениями, существует прямая связь между нарушением деятельности сердечно-сосудистой и нервной систем [6–8]. При этом отмечается четкая зависимость степени снижения когнитивных функций ЦНС от времени существования нарушения сердечного ритма, т.е. от постоянной или пароксизмальной форм фибрилляции предсердий [9–12]. Отмечается также, что фибрилляция предсердий увеличивает риск снижения когнитивных функций и развития деменции, независимо от клинически явного инсульта и базовой когнитивной функции [13]. В связи с этим для пациентов с мерцательной аритмией важной является оценка функционального состояния не только сердечно-сосудистой системы, но и нервной системы. В то же время выявление изменений в паттернах электроэнцефалограммы (ЭЭГ) при заболеваниях сердца, как и при сосудистых заболеваниях мозга, затруднено в силу отсутствия специфичности ЭЭГ у таких пациентов. В этих случаях использование функциональных нагрузок может помочь выявить степень патологических проявлений в ЦНС и оценить перестройку электрической активности мозга в соответствии с частотой, равной или кратной частоте световых импульсов [14]. Как известно, выраженность такой перестройки определяется возбудимостью и лабильностью корковых нейронов, зависящей от соотношения синхронизирующих и десинхронизирующих процессов [15].
У здоровых людей наблюдается относительно слабая реакция усвоения ритма световых импульсов в диапазоне от 8 до 20 Гц, т.е. в полосе собственных частот ЭЭГ, однако отсутствие усвоения ритма не является патологией [16]. Критерием патологии при оценке реакции фотостимуляции считается расширение диапазона усвоения ритма в сторону как более низких (<8 Гц), так и более высоких (>20 Гц) частот ЭЭГ [17], а также межполушарная асимметрия реакции усвоения ритма [18]. Ранее мы показали, что параметры вейвлетных спектров реактивных паттернов ЭЭГ пациентов с цереброваскулярной болезнью различной степени выраженности статистически значимо отличаются от аналогичных параметров, полученных для здоровых лиц, т.е. мозг здорового человека или человека с нарушениями функционального состояния ЦНС по-разному воспроизводит ритмы частот β-, θ- или α-диапазонов [19].
Целью данной работы является количественная оценка функционального состояния нервной системы на основе анализа нелинейной динамики реактивных паттернов ЭЭГ при ритмической фотостимуляции у лиц с фибрилляцией предсердий пароксизмального и постоянного типа.
МЕТОДИКА
В обследовании участвовали 38 пациентов (мужчин) с основными диагнозами: ишемическая болезнь сердца и гипертоническая болезнь. На момент нарушения ритма сердца по типу фибрилляции предсердий сердечная недостаточность не превышала первой стадии (по классификации сердечной недостаточности, предложенной Нью-Йоркской Ассоциацией кардиологов), т.е. без ограничений физической активности и влияния на качество жизни пациента. Все больные находились на лечении в клинике военно-морской терапии Военно-медицинской академии. Из них 16 человек имели пароксизмальную форму фибрилляции предсердий (группа I) и 22 человека – постоянную форму фибрилляции предсердий (группа II). В группе I обследовали пациентов в возрасте от 57 до 78 лет (в среднем 66.6 лет) с давностью заболевания в среднем 6 лет. Вторую группу составили пациенты в возрасте от 50 до 67 лет (в среднем 61.8 лет) с давностью заболевания в среднем 11 лет. Ишемическую болезнь сердца диагностировали у 61% больных группы II и у 33% больных группы I, гипертоническую болезнь – у 39% больных группы II и у 67% больных группы I. Для всех обследованных пациентов были характерны жалобы на головные боли, снижение памяти и быстрая утомляемость. При кардиологическом обследовании проводили суточное мониторирование ЭКГ для регистрации нарушений ритма.
В качестве контроля исследовали 10 здоровых человек в возрасте от 56 до 62 лет.
Электрическую активность мозга регистрировали на 21-канальном электроэнцефалографе фирмы “Мицар-ЭЭГ” (Россия, Санкт-Петербург). Регистрацию осуществляли в состоянии покоя и при ритмической фотостимуляции. Регистрацию ЭЭГ у лиц с пароксизмальной формой фибрилляции предсердий осуществляли в межприступный период. Активные электроды располагали по стандартной схеме 10/20. В качестве индифферентного электрода использовали усредненный электрод Av. Данные записывали с частотой дискретизации 512 Гц и содержали безартефактные фрагменты записи в трех состояниях: до воздействия светового стимула, во время его и во время релаксации. Фотостимулятор находился на расстоянии 15 см от глаз пациента в темном помещении. Энергия лампы составляла 0.3 Дж. Действие светового стимула длилось 10 с для каждой частоты, время релаксации до включения фотовспышки другой частоты составляло 20 с. Так как световые сигналы распространяются симметрично и имеют максимальную амплитуду в затылочных долях мозга, оценивали паттерны в O1-, Oz- и O2-отведениях.
Для оценки энергетических характеристик паттернов ЭЭГ и изменений, возникающих в процессе фотостимуляции, применяли метод непрерывного вейвлет-преобразования временного ряда x(t), описывающего исследуемый сигнал [20]. Анализ проводили с использованием пакета программ Wavelet Toolbox MATLAB.
В качестве базисного вейвлета был использован комплексный вейвлет Морле:
Величина квадрата модуля вейвлет-преобразования паттерна ЭЭГ |W(f, t0)|2 описывает мгновенное распределение энергии фрагмента ЭЭГ по частотам, т.е. локальный вейвлетный спектр энергии в момент времени t0, где f – частота.
Интеграл $E(f) = \int_{{{t}_{1}}}^{{{t}_{2}}} {{\text{|}}W(f,{{t}_{0}}){{{\text{|}}}^{2}}d{{t}_{0}}} $ определяет глобальный вейвлетный спектр, т.е. интегральное распределение энергии вейвлетного спектра сигнала по частотам в интервале времени [t1, t2]. Интеграл $E({{t}_{0}}) = \int_{{{f}_{C}} - \Delta f}^{{{f}_{C}} + \Delta f} {{{{\left| {W(f,{{t}_{0}})} \right|}}^{2}}df} $ оценивает энергию вейвлетного спектра в узком диапазоне частот вокруг частоты фотостимуляции fC.
Поскольку регистрацию ЭЭГ осуществляли непрерывно до и во время фотостимуляции, для сравнения динамики двух сигналов (светового стимула y(t) и паттерна ЭЭГ x(t) во время действия этого стимула) использовали кросс-вейвлетные спектры $\left| {{{W}_{{xy}}}} \right| = \left| {{{W}_{x}}(f,{{t}_{0}})W_{y}^{*}(f,{{t}_{0}})} \right|,$ определяющие локальные соотношения между двумя сигналами в определенные моменты времени на определенных частотах, а также оценку вейвлет-когерентности этих сигналов $WC = \frac{{\left| {S({{W}_{{xy}}})} \right|}}{{\sqrt {\left| {S({{W}_{{xx}}})} \right|} \sqrt {\left| {S({{W}_{{yy}}})} \right|} }},$ описывающую корреляцию двух нестационарных сигналов в один и тот же момент времени [21]. Cимвол S обозначает предварительное сглаживание вейвлетного спектра сигнала с целью улучшения частотно-временного разрешения и статистической значимости. Процедура сглаживания состояла в использовании скользящего среднего с шириной эпохи усреднения в 50 отсчетов [22].
WC может принимать значения от 0 до 1 и описывает локальные корреляции между двумя сигналами; чем ближе это значение к 1, тем более коррелированы сигналы. Статистически значимую вейвлет-когерентность определяли с использованием теста, описанного в работе [23], т.е. рандомизацию исходного сигнала осуществляли по методу Монте-Карло с использованием авторегрессионной модели первого порядка. Статистический уровень значимости каждой частоты оценивали по 100 рандомизированным реализациям.
Вейвлет-преобразование светового сигнала подробно описано в работе [19]. Световой сигнал задавали последовательностью k гауссовых импульсов, следующих друг за другом с частотой fC и описывали функцией:
Рис. 1 иллюстрирует пример нормированных интегральных распределений энергий вейвлетных спектров $e({{t}_{0}}) = {{E({{t}_{0}})} \mathord{\left/ {\vphantom {{E({{t}_{0}})} {{{E}_{{\max }}}({{t}_{0}})}}} \right. \kern-0em} {{{E}_{{\max }}}({{t}_{0}})}}$ паттерна ЭЭГ (рис. 1, А) и светового сигнала (рис. 1, Б). Интегралы пересекаются в двух точках, обозначенных (t1, e1) и (t2, eH), после включения и выключения сигнала фотовспышки. Если обозначить через tm момент времени достижения максимума интегрального распределения паттерна ЭЭГ, то время нарастания энергии вейвлетного спектра в частотном диапазоне [fС – Δf, fС + Δf] можно вычислить как Tinсr= tm – t1. Эта разность может характеризовать время запоминания внешнего ритма определенной частоты, так как, чем меньше указанная величина, тем быстрее реакция усвоения ритма [24, 25].
Рис. 1.
Нормированные интегральные распределения энергий вейвлетных спектров паттерна ЭЭГ (а) и светового сигнала (б).

Величину коэффициента удержания ритма заданной частоты (kH) можно оценить по второму пересечению интегральных распределений исследуемого сигнала ЭЭГ и сигнала фотостимула: kH = eH. Чем меньше эта величина, тем хуже удерживается ритм данной частоты в исследуемом паттерне ЭЭГ [19].
Коэффициент усвоения ритма (kR) в частотном диапазоне [fС – Δf, fС + Δf] может быть определен как отношение максимумов глобальных вейвлетных спектров во время и до действия фотостимула частоты fC: ${{k}_{R}} = {{{{E}_{{\max }}}{{{(f)}}_{{{\text{during}}}}}} \mathord{\left/ {\vphantom {{{{E}_{{\max }}}{{{(f)}}_{{{\text{during}}}}}} {{{E}_{{\max }}}{{{(f)}}_{{{\text{before}}}}}}}} \right. \kern-0em} {{{E}_{{\max }}}{{{(f)}}_{{{\text{before}}}}}}}.$ Чем больше величина kR, тем лучше воспроизводится ритм внешней частоты. Если kR < 1, то энергия глобального вейвлетного спектра данного частотного диапазона во время фотостимуляции меньше энергии в состоянии покоя, что означает отсутствие нарастания энергии вейвлетного спектра при действии определенного светового сигнала.
Для оценивания реакции усвоения ритма применили также метод кросс-рекуррентного анализа, позволяющий визуализировать определенные закономерности в двух сигналах (даже от различных физических источников) [26]. Процедуры CRP Toolbox доступны на сайте tocsy.pik-potsdam.de/crp.php.
Совместная рекуррентная диаграмма (СРД) является графическим представлением матрицы ${{R}_{{i,j}}}(\varepsilon ) = \left\{ {\begin{array}{*{20}{c}} {1,\,\,{{y}_{i}} \approx {{y}_{j}},\,\,{{x}_{i}} \approx {{x}_{j}},} \\ {0,\,\,{{y}_{i}} \ne {{y}_{j}}{{x}_{i}} \ne {{x}_{j}}} \end{array},} \right.$ в которой значения 1 или 0 соответствуют черной или белой точкам, при этом черная точка соответствует рекуррентности или ее отсутствию. Совместная рекуррентность с точностью до ε-ошибки определяется как возврат состояния yj к состоянию yi и одновременный возврат состояния xj к состоянию xi.
Фазовую траекторию состояний y(t) получали из исходного временного ряда {z(t)} методом временных задержек [27]: y(t) = (z(t), z(t + d), …, z(t + (m – 1)d), где d – временная задержка, m – размерность вложения (минимальная размерность пространства, в котором восстановленная траектория воспроизводит свойства исходной траектории). Подбор оптимальной задержки производили на основании поиска первого минимума функции взаимной информации [28]. Далее методом поиска ближайших ложных соседей определяли оптимальную размерность вложения m [29]. Выделение сигнала в узкой полосе частот вблизи частоты фотостимуляции позволяет находить в качестве оптимальной размерности вложения значения m < 5. Величина ε равна 1% от величины стандартного отклонения анализируемого сигнала.
Методом рекуррентного анализа определяли численные показатели рекуррентных диаграмм: L – среднюю длину диагональных линий в СРД и τ – рекуррентное время, необходимое для тогo, чтобы значение сигнала вернулось в ε окрестность точки, в которой оно было ранее.
Для сравнения средних значений параметров, полученных для разных электродных отведений одного тестируемого человека из каждой группы применяли непараметрический тест Фридмана (p < 0.05). Усреднение проводили по пяти сеансам записей ЭЭГ для каждого тестируемого. Для выяснения различий между средними значениями вычисленных параметров для каждой из групп больных и средними значениями параметров, полученными для контрольной группы, использовали непараметрический тест Манна−Уитни (p < 0.05).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Примеры реактивных паттернов ЭЭГ во время фотостимуляции частотой 8 Гц у пациентов с мерцательной аритмией пароксизмальной и постоянной формы представлены на рис. 2, Б, Е. Кросс-вейвлетные спектры и вейвлет-когерентности этих сигналов приведены на рис. 2, В, Ж и Г, З соответственно. Узкие светлые полосы в кросс-вейвлетные спектрах в этих двух примерах указывают на когерентность светового сигнала и паттерна ЭЭГ (согласованное протекание во времени колебательных процессов). Однако анализ вейвлет-когерентности обнаруживает значительную и статистически значимую когерентность только между паттерном ЭЭГ и фотостимулом для пациента с мерцательной аритмией пароксизмальной формы (рис. 2, Г), но не для пациента с мерцательной аритмией постоянной формы (рис. 2, З). Подобное рассогласование в оценках кросс-вейвлетных спектров и вейвлет-когерентности отмечается в работе [21], в которой также указывается на методические погрешности при оценивании кросс-вейвлетных спектров.
Рис. 2.
Световой сигнал частоты 8 Гц (А, Д) и паттерны ЭЭГ во время фотостимуляции у пациента с мерцательной аритмией пароксизмальной (Б) и постоянной (Е) формы (отведение О1). Соответствующие им кросс-вейвлетные спектры (В, Ж) и вейвлет-когерентности (Г, З). Белый цвет означает когерентность между сигналами, черный – ее отсутствие.

Рассмотрим динамические изменения, происходящие в глобальных E(f) и локальных |W(f, t0)|2 вейвлетных спектрах, а также в нормированных интегральных распределениях энергии вейвлетных спектров паттерна ЭЭГ во время действия фотостимула в узких частотных диапазонах вблизи частоты фотостимуляции.
Рис. 3 демонстрирует пример отсутствия реакции усвоения ритма частоты 8 Гц и слабую реакцию усвоения частоты 10 Гц в паттернах ЭЭГ обследуемого человека из контрольной группы. Отсутствие реакции усвоения ритма заданной частоты оценивается на основании отсутствия возрастания энергии глобального вейвлетного спектра E(f) вокруг частоты фотостимуляции во время действия фотостимула (рис. 3, А, Б) и отсутствия увеличения интегрального распределения энергии вейвлетного спектра E(t0)/Emax(t0) паттерна в ответ на фотостимул (сплошная и штрихпунктирная линии рис. 3, Е соответственно). Наличие реакции усвоения ритма заданной частоты определяется по увеличению энергии E(f) (рис. 3, В, Г) и нарастанию интегрального распределения E(t0)/Emax(t0) во время фотостимуляции (рис. 3, З). Незначительность реакции усвоения частоты 10 Гц в анализируемом паттерне ЭЭГ оценивается величиной коэффициента усвоения ритма (kR), значение которого близко к 1.
Рис. 3.
Отсутствие реакции усвоения ритма частоты 8 Гц и слабая реакция усвоения частоты 10 Гц в паттернах ЭЭГ здорового человека (отведение О1). А–Г – глобальные вейвлетные спектры E(f) до и во время действия фотостимула. Д, Ж – локальные вейвлетные спектры |W(f, t0)|2 паттерна. Е, З – нормированные интегральные распределения энергии вейвлетных спектров паттерна ЭЭГ и фотостимула (сплошная и штрихпунктирная линия). Начало и конец фотостимуляции отмечены вертикальными стрелками. Коэффициент усвоения ритма kR < 1 для рис. 3, Б и kR ~ 1 для рис. 3, Г.

Пример выраженной реакции на частоту 8 Гц у пациента с мерцательной аритмией пароксизмальной формы дан на рис. 4. Наблюдается значительное нарастание энергии глобального вейвлетного спектра во время действия фотостимула (рис. 4, А, Б). Максимум локального вейвлетного спектра достигается в конце интервала фотостимуляции (рис. 4, В), т.е. наблюдается медленное нарастание энергии вейвлетного спектра вблизи заданной частоты в данном паттерне (рис. 4, Г).
Рис. 4.
Пример выраженной реакции на частоту 8 Гц у пациента с мерцательной аритмией пароксизмальной формы (отведение О2). Коэффициент усвоения ритма kR $ \gg $ 1.

Пример незначительной реакции усвоения ритма частоты фотостимуляции 12 Гц у пациента с мерцательной аритмией постоянной формы приведен на рис. 5. Во время действия фотостимула происходит небольшое увеличение энергии глобального вейвлетного спектра (рис. 5, А, Б). Незначительность реакции оценивается на основании близости к единице коэффициента усвоения ритма (kR ~ 1.4).
Рис. 5.
Пример слабой реакции на частоту 12 Гц у пациента с мерцательной аритмией постоянной формы (отведение О2). Коэффициент усвоения ритма kR ~ 1.4.

Локальный вейвлетный спектр достигает максимума в середине интервала фотостимуляции (рис. 5, В), т.е. наблюдается быстрое нарастание энергии вейвлетного спектра и затем ее уменьшение (рис. 5, Г).
Рис. 6 иллюстрирует различия в результатах, полученных с помощью вейвлет-преобразования реактивных паттернов ЭЭГ и быстрого преобразования Фурье, а также оконного преобразования Фурье. Быстрое преобразование Фурье позволяет обнаружить в спектре единственный максимум на частоте стимуляции (12 Гц) (рис. 6, А), но не определить момент появления в сигнале этой частоты. Нормированные интегральные распределения энергии спектра, полученного методом оконного преобразования Фурье (рис. 6, В, Е), зависят от параметров метода w (длины окна) и n (числа перекрывающихся значений), (nL – общее число значений в анализируемом паттерне), и, следовательно, не позволяют единственным образом вычислить значения коэффициента удержания ритма заданной частоты kH и время Tinсr его запоминания. В отличие от этого непрерывное вейвлет-преобразование дает возможность однозначно определить эти коэффициенты, характеризующие реакцию усвоения ритмической фотостимуляции в анализируемом фрагменте ЭЭГ.
Рис. 6.
Сравнение результатов быстрого преобразования Фурье, оконного преобразования Фурье и непрерывного вейвлет-преобразования при анализе реакции усвоения ритмической фотостимуляции частотой 12 Гц. Спектр мощности паттерна ЭЭГ, построенный после быстрого преобразования Фурье (А), нормированные распределения энергии спектров, полученных оконным преобразованием Фурье для различных значений параметров окна (w = nL/5, n = w/2 для рис. 6, В и w = nL/9, n = w/6 для рис. 6, Е), нормированные интегральные распределения энергии вейвлетных спектров паттерна и фотостимула (Д).

Еще одним доказательством наличия реакции усвоения ритма в паттернах ЭЭГ у пациентов с фибрилляцией предсердий является присутствие одновременных рекуррентностей (повторяемости) в совместных рекуррентных диаграммах этих паттернов и ритмических световых сигналов определенных частот. Примеры таких диаграмм для пациентов с мерцательной аритмией пароксизмальной и постоянной форм представлены на рис. 7, Б и Г соответственно. Эти диаграммы построены при величине временной задержки d = 5 и размерности вложения m = 3, величина размера окрестности ε равна 1% от величины стандартного отклонения анализируемых временных рядов.
Рис. 7.
Примеры паттернов ЭЭГ во время фотостимуляции частотой 12 Гц пациентов с мерцательной аритмией пароксизмальной (А) и постоянной (В) формы (отведение О1). Б, Г – совместные рекуррентные диаграммы этих паттернов и световых сигналов.
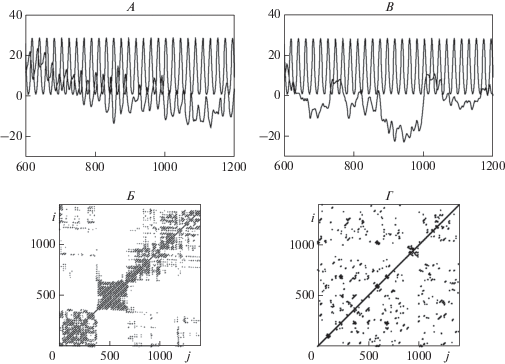
Паттерны ЭЭГ во время фотостимуляции частотой 12 Гц показаны на рис. 7, А, В. Левая диаграмма (рис. 7, Б) содержит квазипериодические рекуррентные структуры с различными расстояниями между диагональными линиями, которые группируются в нерегулярные черные кластеры, что свидетельствует о квазипериодическом возникновении одновременных рекуррентностей в паттерне ЭЭГ у пациента с мерцательной аритмией пароксизмальной формы и световом сигнале заданной частоты. В отличие от этого, правая диаграмма (рис. 7, Г) содержит только редкие и короткие диагональные линии, т.е. почти не имеет совместных рекуррентностей в данном световом сигнале и анализируемом паттерне пациента с мерцательной аритмией постоянной формы.
Представленные на рис. 2–7 реакции усвоения ритма заданных частот были характерны не менее чем для 90% лиц из каждой обследуемой группы, что позволило авторам при дальнейших количественных оценках использовать усреднение значений полученных параметров по числу испытуемых в каждой группе.
В табл. 1 приведены средние значения коэффициентов усвоения (kR) и удержания (kH) ритма заданной частоты, а также времени запоминания ритма (Tinсr) для реактивных паттернов различных групп обследованных лиц.
Таблица 1.
Усредненные значения коэффициентов усвоения (kR) и удержания (kH) ритма заданной частоты, а также времени запоминания ритма (Tinсr) в исследуемых паттернах ЭЭГ
| Состояние | Диапазон | kR | Tincr | kH | Реакция усвоения |
|---|---|---|---|---|---|
| Контроль (N = 9 из 10) | |||||
| Отведение О1 | α, 8 Гц | <1 | – | – | Отсутствует |
| 10 Гц | 1.31 ± 0.06 | 6.1 ± 0.3 | 0.12 ± 0.01 | Незначительная | |
| 12 Гц | 1.16 ± 0.04 | 5.4 ± 0.3 | 0.11 ± 0.01 | ||
| Отведение О2 p2 > 0.05 |
α, 8 Гц | <1 | – | – | Отсутствует |
| 10 Гц | 1.27 ± 0.05 | 6.3 ± 0.3 | 0.19 ± 0.01 | Незначительная | |
| 12 Гц | 1.13 ± 0.04 | 5.8 ± 0.3 | 0.16 ± 0.01 | ||
| Пароксизмальная форма мерцательной аритмии (N = 15 из 16) | |||||
| Отведение О1 | θ, 4 Гц | 31 ± 3 | 4.7 ± 0.2 | 0.19 ± 0.01 | Значительная |
| 6 Гц | 63 ± 5 | 4.2 ± 0.2 | 0.11 ± 0.01 | ||
| α, 8 Гц | 545 ± 38 | 5.4 ± 0.3 | 0.77 ± 0.04 | ||
| 10 Гц | 302 ± 15 | 3.8 ± 0.2 | 0.81 ± 0.05 | ||
| p1 = 0.023 | p1 = 0.039 | p1 = 0.015 | |||
| 12 Гц | 475 ± 29 | 3.2 ± 0.1 | 0.51 ± 0.03 | ||
| p1 = 0.018 | p1 = 0.035 | p1 = 0.025 | |||
| Отведение О2 p2 > 0.05 |
θ, 4 Гц | 29 ± 3 | 4.4 ± 0.2 | 0.14 ± 0.01 | Значительная |
| 6 Гц | 69 ± 6 | 4.6 ± 0.2 | 0.11 ± 0.01 | ||
| α, 8 Гц | 572 ± 41 | 5.5 ± 0.3 | 0.79 ± 0.04 | ||
| 10 Гц | 315 ± 17 | 3.3 ± 0.2 | 0.85 ± 0.05 | ||
| p1 = 0.019 | p1 = 0.036 | p1 = 0.017 | |||
| 12 Гц | 487 ± 35 | 3.1 ± 0.1 | 0.60 ± 0.04 | ||
| p1 = 0.017 | p1 = 0.032 | p1 = 0.025 | |||
| Постоянная форма мерцательной аритмии (N = 20 из 22) | |||||
| Отведение О1 | θ, 4 Гц | 306 ± 27 | 4.8 ± 0.3 | 0.78 ± 0.05 | Значительная |
| 6 Гц | 289 ± 17 | 3.5 ± 0.3 | 0.88 ± 0.06 | ||
| α, 8 Гц | 3.2 ± 0.1 | 5.2 ± 0.3 | 0.33 ± 0.01 | Слабая | |
| 10 Гц | 3.9 ± 0.2 | 4.8 ± 0.2 | 0.21 ± 0.01 | ||
| p1 = 0.041 | p1 = 0.045 | p1 = 0.045 | |||
| 12 Гц | 2.7 ± 0.1 | 3.1 ± 0.1 | 0.25 ± 0.01 | ||
| p1 = 0.048 | p1 = 0.035 | p1 = 0.048 | |||
| Отведение О2 p2 > 0.05 |
θ, 4 Гц | 209 ± 15 | 4.7 ± 0.2 | 0.69 ± 0.05 | Значительная |
| 6 Гц | 198 ± 10 | 4.2 ± 0.2 | 0.76 ± 0.05 | ||
| α, 8 Гц | 2.9 ± 0.1 | 5.4 ± 0.3 | 0.30 ± 0.01 | Слабая | |
| 10 Гц | 2.4 ± 0.1 | 3.8 ± 0.2 | 0.23 ± 0.01 | ||
| p1 = 0.047 | p1 = 0.034 | p1 = 0.045 | |||
| 12 Гц | 2.3 ± 0.1 | 3.4 ± 0.2 | 0.27 ± 0.01 | ||
| p1 = 0.048 | p1 = 0.031 | p1 = 0.042 | |||
Данные табл. 1 свидетельствуют об отсутствии статистически значимых различий в средних значениях параметров, вычисленных для затылочных отведений О1 и О2 (p2 > 0.05), что говорит об отсутствии асимметрии реакции усвоения ритма у всех тестируемых пациентов.
Для 9 из 10 лиц из контрольной группы значение коэффициента усвоения ритма kR < 1 во всех частотных диапазонах, что означает отсутствие нарастания энергии во время фотостимуляции. Незначительное усвоение выявляется только для частот 10 и 12 Гц (kR = 1.31 ± 0.06 и kR = 1.16 ± 0.04 соответственно). Удержание ритма заданной частоты также незначительно (kH = 0.12 ± 0.01 и kH = 0.11 ± 0.01), а время запоминания ритма максимально (Tinсr = 6.1 ± 0.3 с и Tinсr = 5.4 ± 0.3 с).
Для пациентов с мерцательной аритмией ответы на реакцию фотостимуляции значительно отличаются от ответов в контрольной группе на уровне значимости p1 < 0.05 по тесту Манна−Уитни. Прежде всего, в паттернах ЭЭГ у 15 из 16 лиц с фибрилляцией предсердий пароксизмального типа и у 20 из 22 лиц с фибрилляцией предсердий постоянного типа отмечается усвоение частот θ-диапазона. При этом используемый математический аппарат позволяет выявить специфические особенности реакции в каждой группе пациентов. Так, например, для лиц с пароксизмальным типом мерцательной аритмии коэффициент усвоения ритма частоты 6 Гц kR = 63 ± 5, а коэффициент удержания ритма kH = 0.11 ± 0.01, что говорит о том, что, несмотря на значительную реакцию, удержание ритма небольшое. В отличие от этого, в группе лиц с мерцательной аритмией постоянного типа реакция усвоения ритма θ-диапазона значительно сильнее. Так для той же частоты 6 Гц коэффициент усвоения ритма kR = 289 ± 17, а коэффициент удержания ритма kH = 0.88 ± 0.06.
Усвоение ритма частот α-диапазона наблюдается для обеих групп пациентов. При этом максимальное усвоение характерно для группы с мерцательной аритмией пароксизмального типа (например, kR = 545 ± 38, Tinсr = 5.4 ± 0.3 с, kH = 0.77 ± 0.04 для частоты 8 Гц), что свидетельствует о медленном и сильном нарастании энергии вейвлетного спектра вблизи частоты фотостимуляции и значительном удержании ритма заданной частоты.
Для группы лиц с мерцательной аритмией постоянного типа получены гораздо меньшие значения коэффициентов усвоения и удержания ритма α-диапазона (например, kR = 2.7 ± 0.1, Tinсr = 3.1 ± 0.1 с, kH = 0.25 ± 0.01 для частоты 12 Гц), что позволяет говорить о более быстром, но слабом нарастании энергии вейвлетного спектра вблизи частоты фотостимуляции при незначительном удержании ритма заданной частоты.
Усвоение ритма β-диапазона не характерно ни для одной из обследуемых групп.
Значения численных показателей рекуррентных диаграмм (средняя длина диагональных линий (L) и рекуррентное время, необходимое для возврата сигнала в ε окрестность точки, в которой он было ранее (τ)), даны в табл. 2. Средняя длина диагональных линий максимальна для паттернов ЭЭГ пациентов с мерцательной аритмией пароксизмального типа (L = 8.5 ± 0.8, частота 8 Гц ) и минимальна для паттернов ЭЭГ пациентов с мерцательной аритмией постоянного типа (L = 1.9 ± 0.2, частота 10 Гц). Рекуррентное время также максимально для пациентов с мерцательной аритмией пароксизмального типа (τ = 0.85 ± 0.08, частота 8 Гц) и минимально для пациентов с мерцательной аритмией постоянного типа (τ = 0.24 ± 0.02, частота 10 Гц).
Таблица 2.
Усредненные значения средней длины диагональных линий (L) и рекуррентных времен (τ) в совместных рекуррентных диаграммах паттернов ЭЭГ и световых сигналов
| Состояние | Диапазон | L | τ | Реакция усвоения |
|---|---|---|---|---|
| Контроль (N = 9 из 10) | ||||
| Отведение О1 | α, 8 Гц | – | – | Отсутствует |
| 10 Гц | 1.7 ± 0.1 | 0.20 ± 0.02 | Незначительная | |
| 12 Гц | 1.6 ± 0.1 | 0.18 ± 0.02 | ||
| Отведение О2 p2 > 0.05 |
α, 8 Гц | – | – | Отсутствует |
| 10 Гц | 1.3 ± 0.1 | 0.19 ± 0.01 | Незначительная | |
| 12 Гц | 1.8 ± 0.1 | 0.16 ± 0.01 | ||
| Пароксизмальная форма мерцательной аритмии (N = 15 из 16) | ||||
| Отведение О1 | θ, 4 Гц | 5.3 ± 0.5 | 0.45 ±0.04 | Значительная |
| 6 Гц | 4.7 ± 0.4 | 0.40 ± 0.04 | ||
| α, 8 Гц | 8.5 ± 0.8 | 0.85 ± 0.08 | ||
| 10 Гц | 6.9 ± 06 | 0.75 ± 0.07 | ||
| p1 = 0.039 | p1 = 0.015 | |||
| 12 Гц | 7.8 ± 0.7 | 0.66 ± 0.06 | ||
| p1 = 0.035 | p1 = 0.025 | |||
| Отведение О2 p2 > 0.05 |
θ, 4 Гц | 4.4 ± 0.2 | 0.44 ± 0.04 | Значительная |
| 6 Гц | 4.6 ± 0.2 | 0.39 ± 0.04 | ||
| α, 8 Гц | 8.1 ± 0.8 | 0.79 ± 0.04 | ||
| 10 Гц | 6.3 ± 0.6 | 0.72 ± 0.07 | ||
| p1 = 0.036 | p1 = 0.017 | |||
| 12 Гц | 8.2 ± 0.8 | 0.60 ± 0.06 | ||
| p1 = 0.032 | p1 = 0.025 | |||
| Постоянная форма мерцательной аритмии (N = 20 из 22) | ||||
| Отведение О1 | θ, 4 Гц | 8.1 ± 0.8 | 0.79 ± 0.07 | Значительная |
| 6 Гц | 6.7 ± 0.6 | 0.59 ± 0.06 | ||
| α, 8 Гц | 2.9 ± 0.3 | 0.31 ± 0.02 | Слабая | |
| 10 Гц | 1.9 ± 0.2 | 0.24 ± 0.02 | ||
| p1 = 0.045 | p1 = 0.045 | |||
| 12 Гц | 2.1 ± 0.2 | 0.28 ± 0.02 | ||
| p1 = 0.035 | p1 = 0.048 | |||
| Отведение О2 p2 > 0.05 |
θ, 4 Гц | 8.4 ± 0.8 | 0.76 ± 0.07 | Значительная |
| 6 Гц | 6.2 ± 0.6 | 0.56 ± 0.05 | ||
| α, 8 Гц | 2.4 ± 0.2 | 0.30 ± 0.02 | Слабая | |
| 10 Гц | 1.7 ± 0.2 | 0.23 ± 0.02 | ||
| p1 = 0.034 | p1 = 0.045 | |||
| 12 Гц | 2.3 ± 0.2 | 0.27 ± 0.02 | ||
| p1 = 0.032 | p1 = 0.041 | |||
В контрольной группе эти показатели принимают меньшие значения. Так, например, L = 1.6 ± 0.1 и τ = 0.18 ± 0.02 для частоты 12 Гц. Это свидетельствует о чрезвычайно слабой совместной рекуррентности светового сигнала и физиологического ответа.
Данные табл. 2 показывают, что для реактивных паттернов ЭЭГ у лиц с мерцательной аритмией пароксизмального типа характерно наличие значительных совместных рекуррентностей для сигналов как в θ-, так и в α-диапазонах. В отличие от этого, паттернам ЭЭГ лиц с мерцательной аритмией постоянного типа свойственны рекуррентности преимущественно в θ-диапазоне.
Таким образом, для пациентов с фибрилляцией предсердий пароксизмального типа отмечается медленная и сильная реакция усвоения ритма частот α-диапазона и менее выраженная реакция усвоения ритма частот θ-диапазона, в то время как для пациентов с фибрилляцией постоянного типа – значительно более слабая реакция для частот α-диапазона и выраженная реакция для частот θ-диапазона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
ЭЭГ-реакция усвоения внешнего ритма оценивалась в данной работе по значениям количественных параметров (коэффициентов усвоения и удержания ритма, временам нарастания энергии вейвлетного спектра вблизи частоты светового стимула, значениям вейвлет-когерентности, а также средним длинам диагональных линий и рекуррентным временам совместных рекуррентных диаграмм световых сигналов и паттернов ЭЭГ).
Отсутствие реакции усвоения ритма в диапазоне θ- и β-частот на фоне слабого усвоения α-ритма, выявленное у здоровых испытуемых, отражает сбалансированность процессов возбуждения и торможения и преобладание внутренней синхронизации нейронных структур при навязывании внешнего ритма. Это согласуется с данными, полученными в работах [18, 30–32].
Отсутствие реакции усвоения ритма практически всех предложенных частот наблюдалось в паттернах ЭЭГ лиц контрольной группы, и было связано с отсутствием нарастания энергии вейвлетного спектра вблизи частоты фотостимуляции, низкой вейвлет-когерентностью и малыми рекуррентными временами.
Наличие выраженной реакции усвоения ритмов фотостимуляции практически во всем диапазоне предлагаемых частот может свидетельствовать о повышении процесса возбуждения [30, 32, 33]. В паттернах ЭЭГ пациентов двух исследованных групп с мерцательной аритмией отмечалось повышение коэффициентов усвоения и удержания ритмов в θ- и α-диапазонах, что связано, вероятно, с повышением неустойчивости внутренней синхронизации нейронных ансамблей и усилением их внешней синхронизации. При этом для лиц с пароксизмальной формой мерцательной аритмии было характерно значительное усвоение ритма частот как α-, так и θ-диапазонов. Это может быть связано с развитием неустойчивости нейродинамических процессов в результате появления в центральной нервной системе патологического очага возбуждения (генератор повышенного усиления возбуждения по Крыжановскому) [34]. В отличие от этого у лиц с постоянной формой мерцательной аритмии наблюдалась слабая реакция усвоения ритма частот α-диапазона и выраженная реакция усвоения ритма частот θ-диапазона. Это может свидетельствовать о преобладании процессов торможения в нервной системе этих пациентов.
Результаты наших исследований подтверждаются клиническими данными, полученными для обследуемых пациентов. Так при нейропсихологическом тестировании были показаны более выраженные изменения когнитивных функций у больных с постоянной формой мерцательной аритмии, по сравнению с больными с пароксизмальной формой [35, 36].
Ранее мы показали, что у пациентов с сосудистой патологией мозга в виде вертебрально-базилярной недостаточности отмечается значительная реакция усвоения ритмов не только α-, но и θ-, и β-диапазонов, связанная с вовлечением большого количества нейронных ансамблей в патологический процесс, приводящий к разрушению внутренней синхронизации [19, 30]. Слабая реакция на фотостимуляцию у пациентов с постоянной формой мерцательной аритмии может быть связана с уменьшением возбудимости и лабильности корковых нейронов вследствие хронической гипоксии мозга. Это подтверждается особенностями фоновой ЭЭГ в данной группе пациентов. Так ранее, в работе [37] у этих пациентов нами было выявлено преобладание θ-активности в фоновых паттернах, а преобладание θ-активности, как известно, связано с усилением процессов торможения [15, 38, 39].
В отличие от нашей предыдущей публикации [19], посвященной вейвлет-анализу реактивных паттернов ЭЭГ у пациентов с сосудистой патологией мозга, в данной работе приводятся дополнительные доказательства особенностей реакции усвоения ритма в паттернах ЭЭГ у пациентов с фибрилляцией предсердий. К их числу относятся: присутствие одновременных рекуррентностей в совместных рекуррентных диаграммах этих паттернов и ритмических световых сигналов определенных частот; наличие вейвлет-когерентности световых сигналов и реактивных паттернов ЭЭГ.
Рекуррентные диаграммы лиц контрольной группы практически не содержат совместных рекуррентностей в анализируемых паттернах и световых сигналах частот θ- и α-диапазонов. Квазипериодическое возникновение одновременных рекуррентностей в паттернах ЭЭГ и световых сигналах частот θ- и α-диапазонов является характерной особенностью рекуррентных диаграмм пациентов с мерцательной аритмией пароксизмальной формы. Рекуррентные диаграммы лиц с фибрилляцией предсердий в постоянной форме также имеют квазипериодическую структуру совместных рекуррентностей в паттернах ЭЭГ и световых сигналах частот θ-ритма, однако в α-диапазоне содержат только небольшое количество рекуррентных точек, т.е. проявляют очень слабую рекуррентность.
Результаты анализа вейвлет-когерентности также свидетельствуют о возможности достоверно оценивать различия в функциональном состоянии ЦНС у пациентов с сердечно-сосудистыми заболеваниями в виде мерцательной аритмии пароксизмального и постоянного типа. В реактивных паттернах ЭЭГ этих пациентов обнаружена значительная вейвлет-когерентность светового сигнала и физиологического ответа в диапазоне θ-ритма. Однако для лиц с фибрилляцией предсердий пароксизмального типа наблюдается также значительная вейвлет-когерентность и для частот α-ритма, в то время как для лиц с фибрилляцией предсердий постоянного типа вейвлет-когерентность в этом диапазоне не определяется.
По нашему мнению, вейвлетный и рекуррентный методы имеют большие перспективы для анализа физиологических сигналов. Так, например, кросс-рекуррентный анализ сигналов ЭЭГ от различных электродных отведений позволяет обнаруживать различия в преиктальном и иктальном состояниях у больных эпилепсией генерализованной формы, а также определять эпилептические локусы в случаях фокальной эпилепсии по значениям меры фазовой синхронизации между сигналами (коэффициента корреляции между вероятностями рекуррентностей) [40].
Определение таких показателей рекуррентных диаграмм, как ламинарность и максимальная длина вертикальных линий, в процессе анализа вариабельности частоты сердечных сокращений позволяет обнаружить появление так называемых ламинарных состояний (характеризующихся неустойчивыми сингулярностями) непосредственно до начала приступа желудочковой пароксизмальной тахикардии [41]. Таким образом, на основании анализа рекуррентностей физиологических сигналов возможно создание экпресс-диагностики с целью предотвращения как эпилептических, так и сердечных приступов.
ЗАКЛЮЧЕНИЕ
Проведенный с помощью методов нелинейной динамики анализ реактивных паттернов ЭЭГ позволил выявить количественные изменения в функциональном состоянии центральной нервной системы при патологических нарушениях, связанных с фибрилляцией предсердий пароксизмального и постоянного типа.
У разных групп пациентов с мерцательной аритмией, различающихся по времени существования нарушения сердечного ритма, т.е. с постоянной или пароксизмальной формами фибрилляции предсердий, обнаруживаются достоверные различия в количественных параметрах реакции усвоения ритма фотостимуляции (значениях коэффициентов усвоения и удержания ритма, временах его запоминания, а также значениях вейвлет-когерентности и рекуррентных временах совместных рекуррентных диаграмм световых сигналов и паттернов ЭЭГ).
Можно полагать, что проведение дальнейших расширенных исследований на основе одновременного анализа паттернов ЭЭГ и ЭКГ послужит основой для создания экспресс-диагностики патологических изменений функционального состояния ЦНС при нарушениях ритма сердца и связанных с ними когнитивных нарушений.
Работа выполнена при финансовой поддержке Программы фундаментальных научных исследований государственных академий на 2013–2020 гг. (ГП-14, раздел 64).
Список литературы
Lloyd-Jones D.M., Wang T.J., Leip E.P. et al. Lifetime risk for development of atrial fibrillation: the Framingham Heart Study // Circulation. 2004. V. 110. № 9. P. 1042.
Benjamin E.J., Wolf P.A., D’Agostino R.B. et al. Impact of atrial fibrillation on the risk of death: the Framingham Heart Study // Circulation. 1998. V. 98. № 10. P. 946.
Wattigney W.A., Mensah G.A., Croft J.B. Increased atrial fibrillation mortality: United States, 1980–1998 // Am. J. Epidemiol. 2002. V. 155. № 9. P. 819.
Narumiya T., Sakamaki T., Sato Y. et al. Relationship between left atrial appendage function and left atrial thrombus in patients with nonvalvular chronic atrial fibrillation and atrial flutter // Circulation Journal. 2003. V. 67. № 1. P. 68.
Heeringa J., van der Kuip Deirdre A. M., Hofman A. et al. Prevalence, incidence and lifetime risk of atrial fibrillation: the Rotterdam study // Eur. Heart J. 2006. V. 27. 8. P. 949.
Mead G.E., Keir S. Association between cognitive impairment and atrial fibrillation: a systematic review // J. Stroke Cerebrovasc Dis. 2005. V. 10. № 1. P. 35.
Kilander L., Andrén B., Nyman H. et al. Atrial fibrillation is an independent determinant of low cognitive function: a cross-sectional study in elderly men // Stroke. 1998. V. 29. № 9. P. 1816.
Mielke M.M., Rosenberg P.B., Tschanz J. et al. Vascular factors predict rate of progression in Alzheimer disease // Neurology. 2007. V. 69. P. 1850.
Park H., Hildreth A., Thomson R. et al. Non-valvular atrial fibrillation and cognitive decline: a longitudinal cohort study // Age Ageing. 2007. V. 36. № 2. P. 157.
Santangeli P., Di Biase L., Bai Rong et al. Atrial fibrillation and the risk of incident dementia: a meta-analysis // Heart Rhythm. 2012. V. 9. № 11. P. 1761.
Knecht S., Oelschläger C., Duning T. et al. Atrial fibrillation in stroke-free patients is associated with memory impairment and hippocampal atrophy // Eur. Heart J. 2008. V. 29. № 17. P. 2125.
Udompanich S., Lip G.Y.H., Apostolakis S. et al. Atrial fibrillation as a risk factor for cognitive impairment: a semi-systematic review // QJM. 2013. V. 106. № 9. P. 795.
Kwok C.S., Loke Y.K., Hale R. et al. Atrial fibrillation and incidence of dementia: a systematic review and meta-analysis // Neurology. 2011. V. 76. № 10. P. 914.
Drake. J.M.E., Shy K.E., Liss L. Quantitation of photic driving in dementia with normal EEG // Clinical Electroencephalography. 1989. V. 20. P. 153.
Гриндель О.М., Сазонова О.В. Введение в клиническую ЭЭГ / Нейрофизиологические исследования в клинике. М.: Антидор, 2001. С. 13.
Федотчев А.И., Бондарь А.Т., Ларионова А.В. и др. Информационно-вычислительные технологии в познании механизмов деятельности мозга: как нервная система реагирует на поличастотную стимуляцию? // Биомедицинская химия. 2004. Т. 50. № 1. С. 188.
Fedotchev I., Bondar A.T., Akoev I.G. Dynamic characteristics of the human resonance EEG responses to rhythmic photostimulation // Human Physiology. 2000. V. 26. № 2. P. 64.
Русинов В.С., Гриндель О.М., Болдырева Г.Н., Вакар Е.М. Биопотенциалы мозга человека. Математический анализ. М.: Медицина, 1987. 254 с.
Dick O.E., Svyatogor I.A. Wavelet and multifractal estimation of the intermittent photic stimulation response in the electroencephalogram of patients with dyscirculatory encephalopathy // Neurocomputing. 2015. V. 165. № 1. P. 361.
Grossmann Morlet J. Decomposition of Hardy functions into square integrable wavelets of constant shape // S.I.A.M. J. of Math. Anal. 1984. V. 15. № 4. P. 723.
Maraun D., Kurths J. Cross wavelet analysis: significance testing and pitfalls // Nonlinear Processes in Geophysics. 2004. V. 11. № 4. P. 505.
Grinsted A., Moor J.C., Jevrejeva S. Application of the cross wavelet transform and wavelet coherence to geophysical timeseries // Nonlinear Processes in Geophysics. 2004. V. 11. № 5. P. 561.
Torrence C., Compo G.P. A practical guide to wavelet analysis // Bulletin of the American Meteorological Society. 1998. V. 79. P. 61.
Божокин С.В. Вейвлет-анализ динамики усвоения и забывания ритмов фотостимуляции для нестационарной электроэнцефалограммы // Журн. Технической физики. 2010. Т. 80. № 9. С. 16.
Dick O.E. Wavelet analysis of the human brain lability to reproduce the external rhythm // J. Chaotic Modeling and Simulation. 2013. V. 3. P. 387.
Marwan N., Romano M.C., Thiel M. et al. Recurrence plots for the analysis of complex systems // Physics Reports. 2007. V. 438. № 5. P. 237.
Takens F. Detecting strange attractors in turbulence. Dynamical Systems and Turbulence, Lecture Notes in Mathematics // Eds. Rand D., Young L.S. Berlin: Springer-Verlag, 1981. V. 898. P. 366.
Fraser A.M., Swinney H.L. Independent coordinates for strange attractors from mutual information // Phys. Rev. 1986. V. 33. № 2. 1134.
Kennel M.B., Brown R., Abarbanel H.D. Determining embedding dimension for phase-space reconstruction using a geometrical construction // Phys. Rev. A. 1992. V. 45. № 6. P. 3403.
Святогор И.А., Гусева Н.Л. ЭЭГ-реакция усвоения ритма в норме и при нарушении функционального состояния центральной нервной системы // Вестник клинической нейрофизиологии. 2014. Т. 1. № 1. С. 13.
Федотчев А.И., Бондарь А.Т., Акоев И.Г. Резонансные ЭЭГ – реакции при ритмических световых воздействиях разной интенсивности и частоты // Журн. ВНД. 2001. Т. 51. № 1. С. 17.
Поворинский А.Г., Заболотных В.А. Пособие по клинической энцефалографии. Л.: Наука, 1987. 64 с.
Федотчев А.И., Бондарь А.Т., Матрусов С.Г. и др. Использование сигналов обратной связи от эндогенных ритмов пациента для нелекарственной коррекции функциональных расстройств // Журн. Успехи физиол. наук. 2006. Т. 37. № 4. С. 82.
Крыжановский Г.Н. Общая патофизиология нервной системы. М.: Медицина, 1997. 351 с.
Аланичев А.Е., Гришаев С.Л., Черкашин Д.В. и др. Исследование функционального состояния центральной нервной системы по паттернам электроэнцефалограммы у больных с фибрилляцией предсердий // Вестник военно-медицинской академии. 2015. Т. 51. № 3. С. 62.
Ишинова В.А, Сердюков С.В., Гусева Н.Л., Святогор И.А. Использование психофизиологической саморегулчции в комплексе реабилитационных мероприятий для больных ишемической болезнью сердца и соматоформными расстройствами // Медико-социальная экспертиза и реабилитации. 2013. Т. 3. № 3. С. 14.
Святогор И.А., Гусева Н.Л., Софронов Г.А. и др. Оценка функционального состояния центральной нервной системы у пациентов с фибрилляцией предсердий по фоновым и реактивным паттернам ЭЭГ // Медицинский академический журнал. 2015. Т. 15. № 1. С. 39.
Жирмунская Е.А. Клиническая электроэнцефалография. М.: МЭЙБИ, 1991. 77 с.
Жирмунская Е.А. В поисках объяснения феноменов ЭЭГ. М.: Медицина, 1996. 118 с.
Rangaprakash D., Pradhan N. Study of phase synchronization in multichannel seizure EEG using nonlinear recurrence measure // Bioledical Signal Processing and Control. 2014. V. 11. № 1. P. 114.
Marwan N., Wessel N., Meyerfeldt U. et al. Recurrence plot based measures of complexity and ist application to heart rate variability data // Physical Review E. 2002. V. 66. № 2. P. 26702.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


