Физиология человека, 2019, T. 45, № 1, стр. 64-72
Влияние дыхания на частоте резонанса на нелинейные динамики вариабельности сердечного ритма
Д. А. Димитриев 1, *, Е. В. Саперова 1, А. Д. Димитриев 1, О. С. Индейкина 1, Н. М. Ремизова 1
1 ФГБОУ ВО Чувашский государственный педагогический университет им. И.Я. Яковлева,
Чебоксары, Россия
* E-mail: rothman68@mail.ru
Поступила в редакцию 28.12.2017
После доработки 01.04.2018
Принята к публикации 01.06.2018
Аннотация
Изучение нелинейной динамики ритма сердца является ключом к пониманию физиологических механизмов, лежащих в основе различных функциональных состояний и определяющих способность организма человека к адаптации. Целью данной работы является изучение нелинейных параметров ритма сердца при резонансе, который представляет собой максимальную степень синхронизации дыхания и ритма сердца. В исследовании приняли участие 70 здоровых студентов, которые прошли предварительное обучение дыханию на заданной частоте. Запись ритма сердца осуществлялась как при дыхании со свободной частотой, так и при дыхании с навязанной частотой: 4.5, 5, 5.5, 6, 6.5 дых/мин. Посредством спектрального анализа определялась частота дыхания, на которой возникает резонанс. Нелинейная динамика ритма сердца оценивалась с помощью параметров энтропии (ApEn, SampEn, MSE), детрендного флуктуационного анализа (DFA), корреляционной размерности (D2), рекуррентной диаграммы (REC, DET, Lmean, Lmax, ShanEn), показателей графика Пуанкаре (SD1, SD2) и асимметрии временного ряда (GI, P). Полученные результаты свидетельствуют об уменьшении уровня сложности и увеличении самоподобия интервалов RR, уменьшении хаотической составляющей и усилении асимметрии ритма сердца при дыхании на резонансной частоте.
Вариабельность сердечного ритма (ВСР) является результатом взаимодействия между различными физиологическими осцилляторами [1]. Изначально моделирование сердечного ритма основывалось на простой системе из двух линейных осцилляторов, активность которых определяет продолжительность конкретного интервала RR [2]. Изучение нелинейных динамик и применение показателей сложности сигнала, его фрактальных и хаотических свойств в физиологических исследованиях существенным образом повлияло на представление о физиологических системах, регулирующих ритм сердца и артериальное давление, способствовало углублению наших знаний и проведению инновационных исследований функционирования сердечно-сосудистой системы [3].
Нелинейные методы использовались для исследования хаотического поведения биологических систем и применения полученных знаний в медицине и биологии [4]. Позднее интерес сместился в сторону изучения и моделирования сердечно-сосудистой системы, которая характеризуется высоким уровнем сложности и демонстрирует нелинейное поведение [3]. Однако к настоящему времени значение нелинейных методов для понимания функционирования сердечно-сосудистой системы (ССС) изучено лишь отчасти [5, 6 ] .
Ряд интервалов RR представляет собой сложный сигнал, который отражает активность и взаимодействие ряда физиологических осцилляторов [7, 8], среди которых особое место занимает дыхание. Известно, что дыхание оказывает существенное влияние на ритм сердца, а апноэ проявляется в подавлении амплитуды различных волн ВСР. Респираторная синусовая аритмия (РСА) проявляется в виде характерного волнового паттерна ВСР в области высоких частот; в формирование этого паттерна вовлечены дыхательные и вегетативные структуры ствола мозга [9]. Изначально РСА рассматривалась как феномен, который необходимо учитывать при анализе ВСР в физиологии и медицине [9]. В последующем РСА привлекла к себе интерес исследователей как физиологический механизм взаимодействия между дыхательной и сердечно-сосудистой системами, как индикатор активности блуждающего нерва и адаптационных возможностей организма человека [10]. Другим направлением исследования РСА стало изучение кардиореспираторного взаимодействия при различных частотах дыхания [11]. В ходе исследований такого рода был обнаружен резонанс ВСР – резкое повышение амплитуды дыхательных волн ВСР при дыхании на заданной частоте [12]. Резонанс проявляется в том случае, если временные параметры искусственно навязанного дыхательного цикла соответствуют периоду колебаний ритма сердца, обусловленных барорефлексом [12].
Моделирование ВСР основывалось на различных математических подходах, но, начиная с 90-х гг., в этих моделях все большее место отводится нелинейным методам [3]. Было показано, что между дыхательной и сердечно-сосудистой системами имеется тесное взаимодействие нелинейного характера [3].
Различные нелинейные меры ВСР отражают разные аспекты нелинейной динамики ритма сердца. Показатели энтропии являются мерами динамики аттрактора. Корреляционная размерность описывает комплексную структуру аттрактора и аппроксимирует фрактальную размерность. График Пуанкаре описывает эволюцию системы формирования ритма сердца. Детрендный флуктуационный анализ (ДФА) является количественной мерой фрактальных свойств физиологического сигнала. Меры асимметрии физиологического сигнала отражают необратимость последовательности интервалов RR. Повторяемость является важным свойством многих динамических систем и представляет собой повторное появление данного состояния системы во времени. Для оценки повторяемости используют рекуррентные диаграммы (recurrence plot, RP). RP является инструментом изучения сложных процессов посредством отражения рекуррентной траектории на двухмерной двоичной матрице. Количественная оценка RP посредством исследования плотности точек и диагональных структур позволяет определить уровень рекуррентности, детерминизм, максимальную длину диагональных структур, энтропию и тренд. Эти меры в основном базируются на распределении длины диагональных структур на RP [1].
Использование этих и других мер нелинейного анализа началось с пионерских работ L. Glass et al. [13], а также A.L. Goldberger et al. [14]. Эти и последующие работы показали, что система регуляции ритма сердца обладает всеми свойствами нелинейных систем. Хотя механизмы формирования ВСР не обладают высоким уровнем сложности, но их взаимодействие между собой и обратные связи (положительные и отрицательные) обуславливают сложную динамику ритма сердца, что является индикатором того, что вся система формирования ритма сердца не может быть представлена в виде простой суммы отдельных компонентов. Небольшие изменения в исходных параметрах ритмограммы (ряда интервалов RR) могут вызвать существенные изменения ВСР. Важным преимуществом нелинейных параметров ВСР является то, что они не зависят от частоты сердечных сокращений (ЧСС) [15].
Нелинейные методы анализа ВСР нашли широкое применение в клинической практике, а также при исследовании различных функциональных состояний [3]. Обнаружено, что для ВСР при дыхании с заданной частотой характерны выраженные нелинейные свойства [14].
Целью данной работы является изучение нелинейных параметров ритма сердца при резонансе ВСР, который представляет собой максимальную степень синхронизации дыхания и ритма сердца.
МЕТОДИКА
В исследовании участвовала группа из 70 здоровых, некурящих студентов Чувашского государственного педагогического университета им. И.Я. Яковлева в возрасте от 19 до 24 лет (средний возраст составил 20.44 ± 0.12 лет). У всех обследованных студентов не было выявлено заболеваний и функциональных нарушений сердечно-сосудистой, дыхательной и нервной систем, никто из них не принимал лекарственные препараты в течение двух недель, предшествовавших исследованию, не принимал алкоголь и не пил содержащие кофеин напитки в течение 12 ч перед исследованием. Исследование было одобрено этическим комитетом по экспертизе биомедицинских исследований ЧГУ им И.Н. Ульянова. От всех студентов, принимавших участие в исследовании, получили письменное согласие.
На первом этапе проводили обучение студентов дыханию с заданной частотой (4.5, 5, 5.5, 6, 6.5 дых/мин) [12]. Целью обучения – формирование устойчивого навыка дыхания на навязанной частоте. Одновременно осуществляли запись электрокардиограммы (ЭКГ) и дыхательного паттерна с помощью системы “Поли-Спектр” фирмы “Нейрософт”. Полученные записи ЭКГ анализировали с применением программы Kubios HRV Premium (Kubious OY, Финляндия), что позволило более точно определить частоту дыхания. Вторым этапом исследования была запись ритмограммы при различных навязанных режимах дыхания. Эта запись осуществлялась в течение 5 мин в положении лежа с помощью системы “Поли-Спектр” и с соблюдением правил Европейской кардиологической ассоциации [16].
Полученные ритмограммы подвергли первичной обработке с применением Kubios HRV Pr-emium. Применяемый в этой программе алгоритм позволяет осуществлять автоматическую фильтрацию ряда и интервалов RR с целью выявления и удаления артефактов как технического, так и физиологического происхождения.
Нелинейные показатели чувствительны к наличию тренда в ряду кардиоинтервалов. В частности, тренд к повышению или понижению ЧСС может существенно исказить результаты вычисления мер энтропии. В связи с этим применяли метод удаления тренда посредством сглаживания, реализованный в Kubios HRV Premium. Резонанс ВСР проявляется в виде максимального пика амплитуды колебаний RR. Для определения резонанса ВСР использовали спектральный анализ сердечного ритма, который позволил определить частоту дыхания, на которой спектральная мощность дыхательных волн ритма сердца достигает своего максимума, т.е. частоту резонанса ВСР.
Нелинейный анализ кардиоинтервалов осуществляли с применением программы Kuibious HRV Premium как для исходных последовательностей RR, так и для кардиоритмограмм, из которых был удален шум. Такой подход позволил не только проанализировать влияние резонанса ВСР на нелинейные динамики ритма сердца, но и определить эффект фильтрации.
Для определения резонанса ВСР и параметров для оценки нелинейных параметров были рассчитаны значения SDNN (стандартного отклонения нормальных интервалов RR) и проведен спектральный анализ ВСР [1].
Построение диаграммы Пуанкаре осуществлялось на основе двух рядов RRi и RRi + 1. Анализ графика Пуанкаре проводили посредством построения эллипса с последующим измерением его ширины SD1 и длины SD2. График Пуанкаре также явился основой для вычисления показателей асимметрии временных рядов – индекса Порта (P) и индекса Гузика (GI). Индекс P представляет собой отношение числа отрицательных значений ΔRR к общему числу ΔRR на графике Пуанкаре. Индекс GI отражает отношение суммы квадратов расстояний до линии идентичности от точек, лежащих выше этой линии, к аналогичной сумме расстояний от всех точек до линии идентичности. Значение P и GI выше 50% означает, что распределение ΔRR смещено в сторону положительных значений, т.е. средняя магнитуда положительных ΔRR больше, чем средняя магнитуда отрицательных ΔRR. При значении индексов P и GI ниже 50% ситуация обратная [17].
Для вычисления ApEn определили два параметра – длина m вектора и уровень толерантности r. При анализе ВСР стандартными являются следующие значения этих показателей: m = 5 и r = 0.2 × SDNN [1], где SDNN – стандартное отклонение нормальных интервалов RR, поэтому мы использовали именно эти значения в своей работе.
Выборочную энтропию (sample entropy – SampEn) вычисляли по схожему с ApEn алгоритму, но было важное отличие – SampEn не учитывает совпадение вектора с самим собой. При вычислении SampEn применяли те же значения m и r, что и при вычислении ApEn.
Также применили более сложный вариант вычисления SampEn, который основывается на методе мультимасштабного анализа энтропии (Multiscale entropy, MSE). Этот метод подразумевает разделение исходного ряда на непересекающиеся окна размером τ, причем τ постепенно увеличивается. Размер отрезка определяется как N/τ, где N – число кардиоинтервалов. Внутри каждого отрезка производится усреднение кардиоинтервалов, а затем на основе вновь полученного ряда рассчитывается SampEn. При τ = 1 мы получали обычное значение SampEn [1].
Детрендный флуктуационный анализ (detrended fluctuation analysis – DFA) использовали для количественной оценки фрактальных корреляционных свойств интервалов RR. При проведении анализа ВСР эти корреляции разделяются на кратковременные и долговременные флуктуации, которые характеризуются параметрами α1 и α2 соответственно. Эти параметры представляют собой коэффициенты наклона линии корреляции между логарифмированными значениями корреляционной меры относительно длины временного сегмента. Мы вычисляли значения α1 в интервале 4–11 RR и α2 в интервале более 11 RR [1].
Применили широко используемый в физиологии ВСР метод оценки сложности сигнала - корреляционная размерность (correlation dimension – D2). D2 является инструментом для оценки того, какое минимальное количество динамических переменных необходимо для моделирования системы, генерирующей кардиоинтервалы. Исходными параметрами для вычисления D2 являются размерность вложения m (m = 10) и порог r (r = $\sqrt {mSDNN} $).
Анализ сложности также проводили с помощью рекуррентной диаграммы RP [18]. RP представляет собой простую бинарную матрицу, образованную значениями 0 и 1. Точка RP имеет значение 1, если два вектора совпадают друг с другом (разница между ними меньше порога r) и 0, если векторы отличаются друг от друга. Матрица рекуррентности содержит черные и белые точки. Черные точки обозначают наличие рекуррентности, а белые – ее отсутствие. На матрице RP видны сегменты, параллельные основной диагонали. Длины этих сегментов отражают степень близости рекуррентных структур друг к другу. Для оценки рекуррентности используют следующие показатели – средняя длина линии (Lmean), максимальная длина линии (Lmax), уровень рекуррентности (REC), детерминизм (DET), энтропию Шеннона для распределения длин линий (ShanEn) [18].
Все данные представлены в виде средняя ± ошибка. Для тестирования различий между данными, полученными при свободном дыхании и дыхании с навязанной частотой, использовали критерий Уилкоксона Z для связанных выборок и критерий Манна−Уитни U.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Дыхание на частоте резонанса ВСР сопровождалось пиком спектральной мощности на частоте дыхания. Спектральный анализ кардиоритмограмм показал, что чаще всего резонанс ВСР возникал при дыхании с частотой 6 дых/мин (4.5 дых/мин – у 2 человек, 5 дых/мин – у 19 человек, 5.5 дых/мин – у 8 человек, 6 дых/мин – у 29 человек, 6.5 дых/мин – у 12 человек). Средние значения ЧСС при резонансе ВСР изменились статистически незначимо (p > 0.05), что обусловлено наличием разнонаправленной динамики ЧСС на индивидуальном уровне – у 36 человек при переходе в состояние резонанса ВСР произошло снижение ЧСС, а у 34 – повышение этого показателя.
Результаты анализа нелинейной динамики ритма сердца приведены в табл. 1.
Таблица 1.
Нелинейные параметры ритма сердца при переходе от дыхания на свободной частоте к дыханию на частоте резонанса ВСР
| Показатель ВСР | Свободное дыхание | Резонанс | Z | P |
|---|---|---|---|---|
| SD1, мс | 28.91 ± 1.67 | 35.61 ± 1.68 | 4.42 | 0.00 |
| SD2, мс | 51.51 ± 2.83 | 106.79 ± 4.55 | 7.05 | 0.00 |
| SD2/SD1 | 1.92 ± 0.07 | 3.08 ± 0.05 | 7.29 | 0.00 |
| ApEn | 1.22 ± 0.02 | 0.91 ± 0.02 | 7.05 | 0.00 |
| SampEn | 1.65 ± 0.03 | 1.02 ± 0.03 | 7.29 | 0.00 |
| D2 | 2.56 ± 0.19 | 2.34 ± 0.08 | 1.55 | 0.12 |
| DFAα1 | 1.03 ± 0.03 | 1.55 ± 0.02 | 7.29 | 0.00 |
| DFAα2 | 0.31 ± 0.01 | 0.14 ± 0.01 | 7.29 | 0.00 |
| RP_Lmean | 9.33 ± 0.29 | 17.03 ± 0.51 | 6.81 | 0.00 |
| RP_Lmax | 133.56 ± 14.41 | 297.91 ± 10.51 | 6.33 | 0.00 |
| RP_REC | 24.77 ± 0.82 | 30.38 ± 0.27 | 4.18 | 0.00 |
| RP_DET | 96.79 ± 0.18 | 98.81 ± 0.06 | 6.81 | 0.00 |
| RP_ShanEn | 2.97 ± 0.03 | 3.35 ± 0.02 | 6.10 | 0.00 |
| GI | 50.88 ± 0.61 | 57.38 ± 0.67 | 5.85 | 0.00 |
| P | 49.01 ± 0.44 | 54.92 ± 0.54 | 6.07 | 0.00 |
Переход на дыхание с заданной частотой вызывает существенное повышение не только показателей ВСР временной и частотной области, но и изменение формы “облака” на графике Пуанкаре – происходит существенное повышение как длины (SD2), так и ширины (SD1), что указывает на усиление выраженности динамики продолжительности интервалов RR. Изменение распределения значения пар интервалов RRi, RRi + 1, сопровождается существенным усилением асимметрии распределения точек на графике Пуанкаре относительно линии идентичности (RRi = RRi + 1), на что указывает существенное повышение показателей графика Пуанкаре GI и P (p < 0.001). Одновременно с этим произошло повышение значения отношения длины облака к его ширине SD2/SD1, что свидетельствует о том, что дыхание с навязанной частотой в большей степени влияет на длину облака, чем на его ширину.
Большая упорядоченность последовательности интервалов RR при резонансе ВСР приводит к тому, что наблюдается снижение сложности сигнала, о чем можно судить по уровням показателей энтропии ApEn и SampEn, которые существенно снизились при переходе на дыхание с навязанной частотой (p < 0.001). При этом необходимо отметить важную особенность наблюдаемых перестроек динамики ВСР – снижение показателей энтропии сопровождается увеличением SDNN (с 42.08 ± 2.25 мс при свободном дыхании, до 79.64 ± 3.4 мс при резонансе, p < 0.01), т.е. повышением ВСР.
Для резонанса ВСР характерна особенность – снижение показателей энтропии не сопровождается существенным изменением другого показателя сложности – корреляционной размерности D2 (p > 0.05).
Еще одной важной особенностью резонанса ВСР является сочетание повышения SDNN с повышением показателя α1 (p < 0.01), что указывает на повышение самоподобия ряда интервалов RR. Обычно повышение показателя α1 связано с уменьшением ВСР [1]. Одновременно мы наблюдали снижение показателя α2, что может быть связано с повышением спектральной мощности волн LF.
Снижение уровня сложности подтверждается результатами вычисления MSE (рис. 1). Как видно из рис. 1, учет комплексной временной флуктуации, присущей здоровым физиологическим системам, не оказал существенного влияния на результаты вычисления энтропии. Изменение динамики интервалов RR привело к существенному изменению формы рекуррентной диаграммы (рис. 2).
Рис. 1.
Результаты исследования MSE при различных режимах дыхания. а – свободное дыхание, б – резонанс. # – наличие достоверного различия между свободным дыханием и резонансом ВСР.

Рис. 2.
Рекуррентная диаграмма (RP) при свободном дыхании и дыхании с навязанной частотой. Верхний ряд – соответствующие ритмограммы (интервалы RR – в секундах); А – свободное дыхание, Б – резонанс.
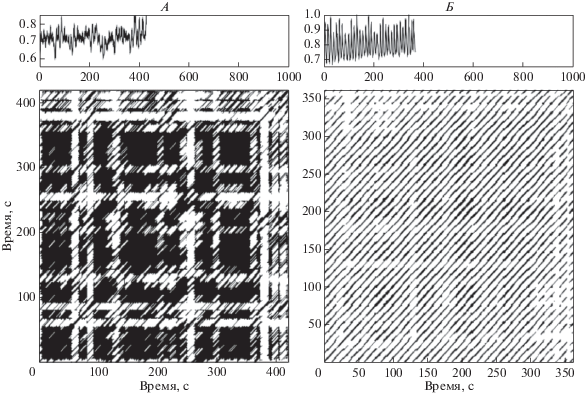
На графике RP (рис. 2) можно видеть существенное изменение расположения белых и закрашенных точек, т.е. произошло изменение паттерна совпадения векторов, изменение размера диагональных элементов. Эти перестройки привели к выраженному увеличению показателей средней и максимальной длины диагональных элементов, что необычным образом сочетается с повышением ВСР, хотя в большинстве случаев имеет место обратная закономерность [19]. Изменение формы графика обуславливает существенное повышение SampEn и коэффициента детерминизма DET (p < 0.01).
Поскольку ЧСС в значительной степени влияет на динамику кардиоинтервалов, нами был проведен сравнительный анализ изменения нелинейных показателей ВСР (уровень при резонансе ВСР – уровень при свободном дыхании) с учетом характера изменения ЧСС (повышение или понижение). Результаты анализа представлены в табл. 2.
Таблица 2.
Динамика изменения нелинейных показателей ВСР при переходе от свободного дыхания к дыханию на частоте резонанса ВСР (резонанс – исходный уровень) с учетом характера изменения ЧСС
| Показатель | Все | группа 1 | группа 2 | U | P |
|---|---|---|---|---|---|
| ΔGI | 6.53 ± 0.85 | 6.11 ± 1.27# | 6.98 ± 1.12# | 518.00 | 0.36 |
| ΔP | 5.89 ± 0.68 | 6.13 ± 0.94# | 5.64 ± 0.99# | 577.00 | 0.83 |
| ΔSampEn | –0.63 ± 0.04 | –0.56 ± 0.06# | –0.7 ± 0.05# | 481.00 | 0.13 |
| ΔApEn | –0.31 ± 0.02 | –0.32 ± 0.03# | –0.3 ± 0.03# | 531.00 | 0.34 |
| ΔD2 | –0.22 ± 0.19 | 0.22 ± 0.24 | –0.69 ± 0.27# | 376.00 | 0.01 |
| ΔDFAα1 | 0.52 ± 0.04 | 0.39 ± 0.05# | 0.65 ± 0.04# | 300.00 | 0.00 |
| ΔDFAα2 | –0.17 ± 0.02 | –0.2 ± 0.02# | –0.14 ± 0.02# | 469.00 | 0.09 |
| ΔLmean | 7.7 ± 0.66 | 7.06 ± 0.91# | 8.37 ± 0.96# | 572.00 | 0.64 |
| ΔLmax | 164.36 ± 19.25 | 106.39 ± 30.07# | 225.74 ± 18.92# | 309.50 | 0.00 |
| ΔRec | 5.6 ± 0.94 | 2.57 ± 1.42 | 8.81 ± 0.95# | 350.00 | 0.00 |
| ΔDet | 2.02 ± 0.19 | 1.51 ± 0.27# | 2.56 ± 0.24# | 378.00 | 0.01 |
| ΔShannon | 0.38 ± 0.04 | 0.3 ± 0.06# | 0.47 ± 0.05# | 458.00 | 0.07 |
| ΔSD1 | 6.69 ± 1.76 | 13.93 ± 2.44# | –0.96 ± 1.8# | 212.00 | 0.00 |
| ΔSD2 | 55.28 ± 4.7 | 65.46 ± 6.89# | 44.5 ± 5.92# | 433.00 | 0.04 |
Как следует из данных табл. 2, для всех показателей, за исключением D2, свойственно совпадение направленности изменения показателей ВСР, но степень этих изменений DFAα1, REC, DET, SD1 зависит от характера изменения ЧСС при переходе к резонансу ВСР.
ОБСУЖДЕНИЕ РЕЗУЛЬТАОВ
Связанный с дыханием резонанс ВСР привел к существенному изменению динамики аттрактора, если судить по размерам облака на графике Пуанкаре (скатерограммы). Особенно сильное повышение SD2 может быть связано с увеличением амплитуды колебаний LF, обусловленным тем, что частота резонанса ВСР находится в этом диапазоне. Одновременно с этим изменилось и положение точек скатерограммы относительно линии идентичности, что привело к повышению асимметрии облака. Повышение значения индексов асимметрии временного ряда является индикатором того, что при дыхании на частоте резонанса ВСР происходит увеличение необратимости временного ряда: средние значения индексов GI и P существенно выше, чем 50, что указывает на то, что число негативных ΔRR существенно больше, чем число положительных ΔRR, т.е. продолжительность периодов брадикардии короче, чем периодов тахикардии [17]. Как свидетельствуют данные экспериментальных исследований, введение антихолинергических препаратов вызывает существенное снижение асимметрии [20], что согласуется с данными о том, что повышение ВСР и усиление РСА указывают на повышение активности парасимпатического отдела вегетативной нервной системы (ВНС).
Физиологические механизмы, обуславливающие сложность физиологических сигналов и влияющие на показатели энтропии, еще недостаточно изучены. Так, снижение ApEn и SampEn происходит при активации симпатического отдела ВНС при пассивном ортостазе (tilt) [21, 22]. Кроме того, фармакологическая блокада атропином приводила к понижению энтропии, что позволяет предположить, что именно активность вагуса является основным фактором, влияющим на уровень энтропии [23]. С другой стороны, исследования, проведенные M. Weipert et al. [24] указывают на то, что в уровень сложности сердечного ритма вносят вклад оба отдела ВНС. Наблюдаемое нами снижение показателей энтропии ApEn и SampEn также свидетельствует в пользу данной точки зрения, поскольку снижение энтропии сопровождается повышением SDNN, значение которого традиционно связывают с активностью парасимпатической нервной системы [1].
Нами было обнаружено статистически достоверное снижения D2 при возникновении резонанса ВСР в случае одновременного повышения ЧСС. При обычных функциональных состояниях система формирования сердечного ритма колеблется между устойчивыми метастабильными состояниями или аттракторами, что обеспечивает возможность адаптироваться к непрерывно изменяющимся внешним условиям [25]. Чем больше D2, тем больше степеней свободы у пейсмекера ритма сердца и тем шире разнообразие возможных адаптационных реакций [21]. Снижение D2 обычно наблюдается при стрессе, когда повышается активность симпатического отдела ВНС и снижается ВСР [21]. Таким образом, тот факт, что снижение D2 наблюдается только лишь при увеличении ЧСС, можно объяснить повышением симпатического тонуса. Это позволяет сделать вывод о том, что положительное влияние резонанса ВСР на состояние организма [26] может наблюдаться только в том случае, если дыхание с соответствующей навязанной частотой не сопровождается напряжением.
Детрендный флуктуационный анализ (DFA) представляет собой методику, позволяющую изучать как внутренние колебания, генерируемые сложной системой, так и влияние внешних факторов на эту систему. Наблюдаемые нами изменения показателей DFA свидетельствуют об увеличении самоподобия ряда кардиоинтервалов благодаря воздействию внутреннего осциллятора (дыхания с заданным ритмом), а не внешнего [27]. Сопоставление полученных нами данных c результатами исследования ментального стресса показывает, что стресс сопровождается снижением DFA1 и повышением DFA2 [28], а при резонансе ВСР картина обратная.
Важным преимуществом RP является то, что данная методика не чувствительна к нестационарности, не требует предварительной фильтрации сигнала, что позволяет использовать ее для анализа показателей функционирования физиологических систем в естественных условиях [19]. Повышение показателя коэффициента DET и Lmax можно интерпретировать как индикатор снижения сложности и повышения предсказуемости сигнала [19]. Показатель Lmean характеризуется выраженной обратной корреляцией с наибольшей экспонентой Ляпунова (Largest Lyapunov Exponent – LLE); таким образом, увеличение Lmean свидетельствует о снижение хаотической составляющей ритма сердца при резонансе ВСР [19].
Повышение уровня энтропии Шеннона подтверждает высказанную ранее идею о том, что ShanEn может быть использован в качестве индикатора взаимодействия внутри крадиореспираторной системы [29].
ЗАКЛЮЧЕНИЕ
Полученные нами данные согласуются с теоретической моделью кардиореспираторного взаимодействия [30] согласно которой по мере усиления взаимодействия в кардиореспираторной системе на первый план выходит синхронизация, подавляющая хаотическую динамику ритма сердца, снижающая сложность сигнала и повышающая его самоподобие. Важной особенностью исследования является тот факт, что повышение предсказуемости, снижение хаотичности и сложности сочетается с повышением общей ВСР, хотя традиционно наблюдается обратная картина. Результаты исследования также свидетельствуют о том, что понижение сложности ритма сердца не следует рассматривать исключительно как проявление возрастных или патологических изменений в регуляции сердечного ритма.
Работа поддержана грантом Министерства образования и науки РФ (№ 19.9737.2017/БЧ).
Список литературы
Ernst G. Heart rate variability. London: Springer, 2014. 315 p.
Billman G.E., Huikuri H.V., Sacha J., Trimmel K. An introduction to heart rate variability // Frontiers in Phy-siology. 2015. V. 6. P. 55.
De Godoy M.F. Nonlinear Analysis of Heart Rate Variability: A Comprehensive Review // J. Cardiology and Therapy. 2016. V. 10. № 3. P. 528.
West B.J. An essay on the importance of being nonlinear. Berlin: Springer Science & Business Media, 2013. 220 p.
Музалевская Н.И., Каменская В.Г. Оценка адаптационного ресурса и состояния здоровья старшеклассников методом нелинейной стохастической кардиоинтервалометрии // Физиология человека. 2007. Т. 33. № 2. С. 60.
Hoshi R.A., Pastre C.M., Vanderlei L.C., Godoy M.F. Poincaré plot indexes of heart rate variability: relationships with other nonlinear variables // Autonomic Neuroscience. 2013. V. 177. № 2. P. 271.
Иляхинский А.В., Пахомов П.А., Ануфриев М.А., Мухина И.В. Информационно-статистические показатели самоорганизации систем регуляции сердечной деятельности в оценке вариабельности ритма сердца // Физиология человека. 2017. Т. 43. № 3. С. 116.
Berntson G.G., Thomas Bigger J., Eckberg D.L. et al. Heart rate variability: origins, methods, and interpretive caveats // Psychophysiology. 1997. V. 34. № 6. P. 623.
Billman G.E. Heart rate variability – a historical perspective // Frontiers in physiology. 2011. V. 2. P. 86.
Complementary and integrative treatments in psychiatric practice / Eds. Gerbard P.L., Muskin P.R., Brown R.P. Washington DC: American psychiatric association publishing, 2017. 425 p.
Song H.S., Lehrer P.M. The effects of specific respiratory rates on heart rate and heart rate variability // Applied psychophysiology and biofeedback. 2003. V. 28. № 1. P. 13.
Vaschillo E.G., Vaschillo B., Lehrer P.M. Characteristics of resonance in heart rate variability stimulated by biofeedback // Applied psychophysiology and biofeedback. 2006. V. 31. № 2. P. 129.
Glass L., Shrier A. Functional characterization of oscillatory and excitable media // Bulletin of mathematical biology. 2015. V. 77. № 5. P. 782.
Goldberger A.L., Henriques T.S., Mariani S. Sublimation-like behavior of cardiac dynamics in heart failure: A malignant phase transition? // Complexity. 2016. V. 21. № 2. P. 24.
Dimitriev D.A., Saperova E.V., Dimitriev A.D. State anxiety and nonlinear dynamics of heart rate variability in students // PLoS One. 2016. V. 11. № 1. e0146131.
Camm A.J., Malik M., Bigger J.T. et al. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart rate variability. Standards of measurement, physiological interpretation, and clinical use // Circulation. 1996. V. 93. P. 1043.
Alvarez-Ramirez J., Echeverria J.C., Meraz M., Rodriguez E. Asymmetric acceleration/deceleration dynamics in heart rate variability // Physica A: Statistical Mechanics and its Applications. 2017. V. 479. P. 213.
Tarvainen M.P., Niskanen J.P., Lipponen J.A. et al. Kubios HRV–heart rate variability analysis software. Computer methods and programs in biomedicine. 2014. V. 113. № 1. P. 210.
Schlenker J., Socha V., Riedlbauchová L. et al. Recurrence plot of heart rate variability signal in patients with vasovagal syncopes // Biomedical Signal Processing and Control. 2016. V. 25. P. 1.
Yan C., Li P., Ji L. et al. Area asymmetry of heart rate variability signal // Biomedical engineering online. 2017. V. 16. № 1. P. 112.
Porta A., De Maria B., Bari V. et al. Are Nonlinear Mod-el-Free Conditional Entropy Approaches for the Assessment of Cardiac Control Complexity Superior to the Linear Model-Based One? // IEEE Transactions on Biomedical Engineering. 2016. V. 64. № 6. P. 1287.
Turianikova Z., Javorka K., Baumert M. et al. The effect of orthostatic stress on multiscale entropy of heart rate and blood pressure // Physiol. Meas. 2011. V. 32. P. 1425.
Porta A., Castiglioni P., Bari V. et al. K-nearest-neighbor conditional entropy approach for the assessment of short-term complexity of cardiovascular control // Physiol. Meas. 2013. V. 34. P. 17.
Weippert M., Behren M., Riege A. et al. Sample entropy and traditional measures of heart rate dynamics reveal different modes of cardiovascular control during low intensity exercise // Entropy. 2014. V. 16. P. 5698.
Lipsitz L.A. Age-related changes in the “complexity” of cardiovascular dynamics: a potential marker of vulnerability to disease // Chaos. 1995. V. 5. P. 102.
Lehrer P.M., Vaschillo E., Vaschillo B. Resonant frequency biofeedback training to increase cardiac variability: Rationale and manual for training // Applied psychophysiology and biofeedback. 2000. V. 25. № 3. P. 177.
Platisa M.M., Gal V. Reflection of heart rate regulation on linear and nonlinear heart rate variability measures // Physiological measurement. 2006. V. 27. № 2. P. 145.
Mukherjee S., Yadav R., Yung I. et al. Sensitivity to mental effort and test – retest reliability of heart rate variability measures in healthy seniors // Clinical Neurophysiology. 2011. V. 122. № 10. P. 2059.
Tzeng Y.C., Larsen P.D., Galletly D.C. Cardioventilatory coupling in resting human subjects // Experimental Physiology. 2003. V. 88. № 6. P. 775.
Valenza G., Lanatá A., Scilingo E.P. Improving emotion recognition systems by embedding cardiorespiratory coupling // Physiological measurement. 2013. V. 34. № 4. P. 449.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


