Физиология человека, 2019, T. 45, № 2, стр. 58-69
Биоэлектрическая активность головного мозга и церебральная гемодинамика у спортсменов при сочетании когнитивной и физической нагрузки
Л. В. Капилевич 1, 2, *, Г. С. Ежова 1, А. Н. Захарова 1, А. В. Кабачкова 1, С. Г. Кривощеков 3
1 Национальный исследовательский Томский государственный университет
Томск, Россия
2 Национальный исследовательский Томский политехнический университет
Томск, Россия
3 ФГБНУ НИИ физиологии и фундаментальной медицины
Новосибирск, Россия
* E-mail: kapil@yandex.ru
Поступила в редакцию 11.01.2018
После доработки 27.08.2018
Принята к публикации 01.10.2018
Аннотация
Изучали влияния физических нагрузок на электрическую активность головного мозга, церебральный кровоток и когнитивные функции у спортсменов, занимающихся циклическими и ациклическими видами спорта. Исследования проводили с участием здоровых юношей в возрасте от 18 до 23 лет. Применяли когнитивные тесты и методы электроэнцефалографии и реоэнцефалографии. После динамической и статической нагрузки происходит изменение показателей гемодинамики головного мозга. При этом реакция системы мозгового кровотока после статической нагрузки более выражена, чем после циклической нагрузки. Также показали, что статические нагрузки вызывают снижение активности β- и θ-диапазона ЭЭГ при когнитивном тесте. Установили, что нагрузки циклического характера положительно влияют на когнитивные функции, тогда как при нагрузках силового характера подобные эффекты не регистрируются.
Существуют многочисленные свидетельства взаимосвязи физической активности и когнитивной деятельности [1, 2], в частности, регулярные занятия физическими упражнениями играют важную роль в сохранении когнитивных функций [3]. Выполнение физических упражнений связано с поступлением в центральную нервную систему сигналов о состоянии мышц, степени их сокращения или расслабления, положении тела и его частей в пространстве, поддержании позы. Вследствие этого изменяется функциональное состояние коры больших полушарий и подкорковых центров, происходит активизация процессов возбуждения и торможения, увеличивается сила и подвижность нервных процессов [4], формируются новые внутри- и межсистемные связи [5]. Развитие новых двигательных навыков в процессе спортивного совершенствования связано с формированием достаточно сложных функциональных систем, включающих различные звенья, количество и степень вовлеченности которых зависит от типа осуществляемой деятельности [6].
Показано наличие связи между уровнем физической активности, размерами гиппокампа и когнитивными функциями. Исследования K.I. Eric-kson и A.F. Kramer выявили прямую корреляцию между повышенным уровнем двигательной активности, улучшением когнитивных процессов и размерами гиппокампа, поддерживая идею о том, что физическая деятельность приводит к анатомическим и физиологическим изменениям в головном мозге [1]. Предполагается, что высокий уровень физической активности связан с увеличением объема гиппокампа, улучшением мозгового кровотока и пространственной памяти, а также снижением числа погибших нейронов. Хотя большинство исследований проводилось с участием взрослых, однако существуют данные о положительном влиянии физической активности на успеваемость школьников [7]. Отмечено, что аэробные упражнения способствуют увеличению скорости обработки информации у детей [2] и более высокой производительности работы мозга [8].
В настоящее время существуют несколько гипотез, объясняющих, как физические упражнения могут повлиять на функции мозга. Первая касается влияния физических нагрузок на кровоснабжение тканей мозга. В частности, в ряде работ показано, что физические упражнения увеличивают насыщение крови кислородом и стимулируют ангиогенез в областях мозга, активированных при выполнении задачи [9]. A.F. Kramer et al. обнаружили, что аэробные упражнения увеличивают скорость потребления кислорода у пожилых людей, уменьшение времени реакции и повышение производительности мозга [9]. Вторая гипотеза предполагает, что физические упражнения способствуют повышению уровня нейротрансмиттеров мозга, таких как серотонин и норадреналин, тем самым облегчая обработку информации [10]. Третья гипотеза заключается в том, что при физических нагрузках активируются нейротрофины: BDNF, IGF-I, bFGF, которые поддерживают работу нейронов, увеличивают их выживаемость, стимулируют дифференцировку в развивающемся головном мозге, облегчают синаптическую передачу [11]. Показано, что отдельные физические упражнения приводят к явному усилению синтеза BDNF в мозге человека, что обусловлено феноменом нейрогенеза, обуславливающего последующее улучшение когнитивной функции [12].
Часть исследователей указывает на прямое влияние физической активности на мозговую деятельность. Так, в работе H. Guiney et al. показано, что физическая активность улучшает регуляцию мозгового кровотока и контроль над когнитивной деятельностью у взрослых людей, не имеющих сосудистых патологий. При этом именно скорость кровотока является решающим фактором, влияющим на когнитивные процессы [13]. Представлены доказательства, что у взрослых людей аэробные упражнения вызывают увеличение объема мозга в лобной области, повышение внимания, улучшение памяти [14], производительности при решении познавательных задач [15], защищают от ухудшения когнитивных функций с возрастом [9].
В то же время в ряде работ показано, что физические нагрузки оказывают опосредованное влияние на мозговые функции. Нагрузки различной мощности, интенсивности и длительности вызывают метаболические изменения в клетках скелетных мышц, стимулируют смещения показателей гомеостаза, оказывают влияние на деятельность систем транспорта кислорода, а также функционирование многих других органов, включая и мозговые структуры [16]. Эти метаболические изменения в свою очередь стимулируют сигнальные каскады, которые оказывают влияние на процессы синтеза веществ, в частности белков, в мышечных клетках [17]. Метаболические изменения в мышцах являются причиной вазодилатации и увеличения кровотока в работающей мышечной ткани и в других органах [18].
Кроме того, физические упражнения улучшают функцию эндотелия и способствуют снижению артериальной ригидности сонных артерий [19], стимулируют ангиогенез и сосудистую функцию во многих областях мозга, включая кору [20]. При этом в процессах адаптации организма к физическим нагрузкам важную роль играет оксид азота, как фактор расслабления кровеносных сосудов [21].
Выполнение простых трудовых двигательных действий пожилыми людьми вызывает увеличение кровотока средней, передней и задней мозговых артерий [22]. Можно предположить, что именно увеличение церебрального кровотока является ведущим фактором для синтеза нейротрофинов и стимуляции работы мозга [23]. Таким образом, физические нагрузки оказывают воздействие на когнитивную деятельность, улучшают процессы познания, стимулируют процессы улучшения памяти, снижают риск развития цереброваскулярных заболеваний [24].
Определенный уровень физической активности является жизненно важным для поддержания состояния капилляров [25], мозгового кровотока, доставки питательных веществ. S.J. Colcombe et al. выявили, что увеличение уровня физической активности обратно коррелирует со снижением объема серого и белого вещества у пожилых людей, особенно в теменной, лобной и височной областях коры головного мозга [26].
Как известно, компонентами психофизиологических перестроек, происходящих в процессе спортивной деятельности, являются психомоторные, когнитивные и психофизиологические функции [27]. По всей видимости, уровень и преобладающий характер двигательной активности будут в значительной степени определять механизмы физиологической адаптации, что должно найти отражение в особенностях психофизиологических и когнитивных параметров и в соответствующих коррелятах биоэлектрической активности головного мозга.
Таким образом, по результатам многочисленных исследований выявлено положительное влияние физической активности на работу мозга. Литературные данные показывают, что физические нагрузки заметно сказываются на показателях биоэлектрической активности головного мозга, психофизиологических и когнитивных способностях человека как в состоянии спокойного, так и в состоянии активного бодрствования. В то же время механизмы, которые лежат в основе связи физической активности и когнитивных функций, во многом еще не выяснены. Нет данных о влиянии различных видов физических нагрузок статического и динамического характера на головной мозг и когнитивную деятельность.
В связи с вышеизложенным, цель данного исследования – изучение влияния физических нагрузок на электрическую активность головного мозга, церебральный кровоток и когнитивные функции у спортсменов, занимающихся циклическими и ациклическими видами спорта.
МЕТОДИКА
В исследовании принимали участие здоровые юноши в возрасте от 18 до 23 лет. Были сформированы 3 группы обследуемых:
1) Основная группа 1 (ТА): высококвалифицированные спортсмены силовых видов спорта (кандидаты в мастера спорта и мастера спорта, стаж занятий не менее 6 лет) – тяжелая атлетика – 20 чел.
2) Основная группа 2 (ЛА): высококвалифицированные спортсмены циклических видов спорта (кандидаты в мастера спорта и мастера спорта, стаж занятий не менее 6 лет) – легкая атлетика (бег на средние дистанции 200–800 м) – 20 чел.
3) Контрольная группа (КГ): условно здоровые нетренированные волонтеры, не занимающиеся спортом, не имеющие спортивного разряда – 30 чел. Контрольная группа была разделена на две подгруппы по 15 чел.: КГ-С и КГ-Д.
Антропометрические данные участников исследования представлены в табл. 1. На проведение исследования было получено разрешение этической комиссии Томского государственного университета (регистрационный номер 11 от 24 сентября 2015 г.).
Таблица 1.
Антропометрические данные участников исследования (Xср ± m)
| Группа | Возраст, лет | Рост, см | Масса тела, кг |
|---|---|---|---|
| ТА (тяжелая атлетика) | 19.9 ± 1.4 | 177.0 ± 4.5 | 82.7 ± 10.2 |
| ЛА (легкая атлетика) | 20.8 ± 1.4 | 180.2 ± 6.2 | 73.2 ± 6.9 |
| КГ (контроль) | 19.5 ± 0.7 | 183.2 ± 5.7 | 74.5 ± 4.75 |
Реографическое исследование головного мозга (РЭГ) осуществляли с помощью аппаратно-программного комплекса “Валента” (ООО “Компания Нео”, Россия). Применяли фронто-мастоидальное (FM) и окципито-мастоидальное (OM) отведения, которые характеризуют каротидный и вертебробазилярный бассейны соответственно. Частота зондирующего тока для РЭГ 100 кГц. Показатели регистрировали в состоянии относительного покоя (фоновая запись), а также во время выполнения когнитивного теста до и после физической нагрузкой. Основные показатели, используемые для оценки РЭГ:
РИ (б/р) – реографический индекс, отношение систолической волны к стандартному калибровочному сигналу (0.1 Ом = 10 мм), выражается в относительных единицах, характеризует величину и скорость притока крови в исследуемой зо-не. Сравнение показателей фоновых реограмм с показателями после применения функциональных проб позволяет судить о кровоснабжении тканей: увеличение свидетельствует об усилении, уменьшение – об ухудшении кровенаполнения;
МУ (%) – модуль упругости – отношение длительности восходящей части волны к длительности всей волны. Используется для оценки эластико-тонических свойств сосудов (эластичность – увеличение показателя);
ВО (%) – венозный отток – характеризует величину оттока крови к сердцу в исследуемой области (чем показатель ВО выше, тем выше отток). В значительной степени определяется тонусом венозного русла исследуемой области;
ДКИ – дикротический индекс – отношение амплитуды на уровне инцизуры (“i”) к амплитуде систолической волны (“m”). Используется для оценки состояния тонуса на уровне мелких сосудов (артериол). Увеличение показателя свидетельствует о повышении периферического сосудистого сопротивления;
ДСИ – диастолический индекс – отношение величины амплитуды на уровне дикротического зубца (“d”) к амплитуде систолической волны (“m”). Характеризует тонус венул. Используют для оценки состояния оттока. При затруднении венозного оттока показатель ДСИ увеличивается.
Метод электроэнцефалографии (ЭЭГ). Электроэнцефалографическое обследование выполняли на программно-аппаратном комплексе “Нейрон-спектр”. Электроды располагали в соответствии с международной схемой “10–20” (монтаж монополярный, референтные электроды – ушные): лобные (FP), область центральной борозды (С), височные (Т), затылочные (О) отведения. Показатели регистрировали в состоянии относительного покоя (фоновая запись), а также во время когнитивной нагрузки. Регистрацию ЭЭГ выполняли в полосе пропускания 0.3–50 Гц и при частоте дискретизации 500 Гц. Каждую запись ЭЭГ автоматически сканировали на наличие артефактов. Для спектрального анализа использовали 60-секундные отрезки без артефактной записи, подразделявшиеся на четырехсекундные эпохи, подвергавшиеся быстрому преобразованию Фурье с использованием окна Ханна. В ходе исследования была проведена оценка таких параметров ЭЭГ, как: средняя амплитуда спектра для α-, β- и θ-диапазонов; средняя мощность спектра для α-, β- и θ-диапазонов.
В качестве когнитивной нагрузки использовали математический тест со счетом до и после физической нагрузки. Тест со счетом включал в себя вычитание одного и того же двухзначного числа из четырехзначного (например: 1693 – 14 = 1679, 1679 – 14 = ?…). Оценивали количество правильных вычислений за 1 мин [28].
Физическая нагрузка. Спортсмены-тяжелоатлеты и волонтеры контрольной группы 1 (КГ-С) в качестве статической нагрузки выполняли однократное удержание штанги на уровне ниже колен. Вес отягощения составлял 50% от максимального результата, показанного в упражнении становая тяга. Максимальный вес определяли заранее, не позднее чем за неделю до исследования. Выполнение упражнения осуществляли под руководством инструктора. Удержание штанги проводили до развития выраженного утомления и отказа продолжать упражнение. В группе тяжелоатлетов поднимаемый вес штанги в среднем составил 65.0 ± 11.5 кг, время удержания штанги в среднем составило 61.8 ± 13.5 с. В контрольной группе поднимаемый вес составил 57.5 ± 3.75 кг, время удержания штанги – 53.0 ± 15.2 с.
Спортсмены-легкоатлеты и волонтеры контрольной группы 2 (КГ-Д) выполняли динамическую нагрузку циклического характера на велоэргометре. В качестве динамической нагрузки использовали методику стандартного теста PWC170 на велоэргометре (Kettler ergometer, Германия) [29]. По результатам теста с динамической нагрузкой показатель PWC170 в группе легкоатлетов составил 1912.8 ± 86.2 кгм/мин, в контрольной группе – 1322.3 ± 33.1 кгм/мин. Полученные показатели в соответствии с таблицами оценки работоспособности характеризуют уровень работоспособности выше среднего [30].
Методы математической статистики. Статистическую обработку данных проводили при помощи программы STATISTICA 8.0. Оценку на нормальность распределения признаков в группах производили при помощи критерия Шапиро−Уилка (Shapiro−Wilkstest). Сравнительный анализ независимых выборок проводили при помощи критерия Манна−Уитни (Mann−Whitneytest) и зависимых – при помощи критерия Вилкоксона (Wilcoxontest). За статистически значимое различие принимали p < 0.05 [31].
Дизайн исследования. Перед началом обследования производили измерение артериального давления, пульса и субъективную оценку самочувствия. Далее производили снятие реограммы и электроэнцефалограммы головного мозга в состоянии относительного покоя в положении сидя и затем при выполнении когнитивного теста. Перед испытуемым размещали планшет с примером для вычисления. Участники выполняли вычисления мысленно в течение 1 мин, при этом производилаcь запись реограммы и электроэнцефалограммы головного мозга. После этого участникам было предложено выполнить физическую нагрузку (см. Методику). Сразу после нагрузки вновь повторяли процедуру записи реоэнцефалограммы в покое и при выполнении когнитивного теста. После нагрузки испытуемым предлагали вычислить другой пример (например: 1843 – 18 = ?…).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Результативность когнитивного теста на фоне физических нагрузок. До выполнения физической нагрузки в группе тяжелоатлетов в среднем количество вычислений за 1 мин составило 8.2 (7.5; 8.8), при этом данный показатель статистически значимо ниже, чем в группе контроля, где количество вычислений за минуту составило 11.75 (10.8; 12.2) (p < 0.05), но не отличается от показателя в группе легкой атлетики (количество вычислений за 1 мин 9.17 (8.9; 11.8)). После выполнения физической нагрузки наибольшее число вычислений было зафиксировано в группе легкоатлетов, оно составило 16.5 (15.4; 17.3), что на 33.1% выше показателя в контрольной группе (количество вычислений за 1 мин 12.4 (11.3; 13.1) (p < 0.05)). В группе тяжелоатлетов после статической нагрузки количество вычислений за 1 мин составило 10.5 (9.8; 11.2), что на 57.1% ниже, чем в группе легкой атлетики, и на 20.7% ниже, чем в группе контроля после статической нагрузки (количество вычислений за 1 мин 13.2 (12.5; 13.9) (p < 0.05)). Между контрольными группами после статической и динамической нагрузки различий не выявлено (рис. 1).
Рис. 1.
Результаты математического теста. КГ-С – контрольная группа после статической нагрузки; КГ-Д – контрольная группа после динамической нагрузки; ТА – группа спортсменов-тяжелоатлетов; ЛА – группа спортсменов-легкоатлетов; а – показатели до нагрузки, б – показатели после нагрузки; * – статистически значимые изменения относительно показателя до нагрузки при p < 0.05; p < 0.05 при сравнении между группами.
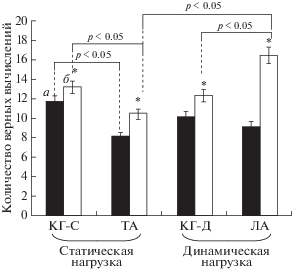
В целом можно отметить, что во всех группах после статической и динамической нагрузки произошло статистически значимое увеличение количества вычислений в сравнении с показателем до нагрузки.
Характеристика биоэлектрической активности головного мозга при сочетании когнитивных и физических нагрузок. По показателям электроэнцефалографии после физической нагрузки на фоне когнитивного теста были выявлены различия в группе спортсменов-тяжелоатлетов по сравнению с контролем (табл. 2).
Таблица 2.
Показатели ЭЭГ после физической нагрузки на фоне когнитивного теста в наблюдаемых группах
| Отведение | Группа наблюдения | ||||
|---|---|---|---|---|---|
| КГ-Д | КГ-С | ЛА | ТА | ||
| Высокочастотный β-диапазон | |||||
| Т (средняя амплитуда, мкВ/с) | Пр. | 0.67 (0.36; 0.87) |
0.66 (0.38; 0.87) |
0.65 (0.42; 0.73) |
0.39 (0.25; 0.46)1 |
| C (средняя амплитуда, мкВ/с) | Лев. | 0.70 (0.57; 0.99) |
0.69 (0.57; 0.99)) |
0.61 (0.47; 0.72 |
0.39 (0.38; 0.43)* |
| θ-диапазон | |||||
| О (средняя амплитуда, мкВ/с) | Лев. | 1.75 (1.41; 1.99) |
1.76 (1.41; 1.99) |
1.81 (1.46; 2.17) |
1.43 (1.10; 1.78)* |
| C (средняя мощность, мкВ2/с) | Лев. | 5.01 (3.22; 6.31) |
5.01 (3.22; 6.31) |
5.00 (3.68; 6.84) |
3.12 (2.66; 3.59)* |
Примечание: запись выборочных данных представлена в форме Me (Q25; Q75); C – отведения области центральной борозды, O – затылочные отведения, T – височные отведения; КГ-Д – контрольная группа после динамической нагрузки, КГ-С – контрольная группа после статической нагрузки, ТА – тяжелоатлеты, ЛА – легкоатлеты. * – статистически значимые различия между показателями (выделены жирным) при сравнении с группой КГ (p ≤ 0.05).
В височном отведении в группе тяжелоатлетов зафиксирован более низкий показатель высокочастотного β-ритима на 40% в отличие от группы контроля (p < 0.05). Также более низкие значения данного диапазона отмечены в области центральной борозды: в группе ТА средняя амплитуда ритма составила 0.39 (0.25; 0.46) мкВ/с, тогда как в контрольной группе данный показатель составил 0.69 (0.57; 0.99) мкВ/с (p < 0.05). Некоторые авторы (G. Dolce и H. Waldeier) связывают повышение уровня активации мозга при решении арифметических задач, при чтении текста и просто при открывании глаз с ростом мощности β-частот [32]. Вероятно поэтому результативность математического теста оказалась более низкой именно в группе спортсменов силовых видов спорта.
β-ритм (частота 18–30 Гц) значительно усиливается при различных видах деятельности, связанных с активацией рабочих механизмов мозга. Есть мнение, что наиболее сильное увеличение мощности β-ритма происходит при стрессе [33]. Э.А. Голубева и др. в своих исследованиях пришли к выводу, что для лабильных личностей характерен высокий уровень суммарной мощности частот ритмов β1 и β2 [34]. Полученные нами характеристики β-активности могут быть связаны с различной степенью активации нервных центров при выполнении физических упражнений в разных группах и отражать уровень адаптационного потенциала, степень эмоциональной стабильности устойчивости к стрессовым ситуациям.
В затылочных отведениях в группе тяжелоатлетов средняя амплитуда θ-ритма статистически значимо ниже, чем в группе контроля. В группе ТА – 1.43 (1.10; 1.78) мкВ/с, в КГ – 1.76 (1.41; 1.99) мкВ/с (p < 0.05). Активность θ-ритма более низкая и в области центральной борозды в группе спортсменов силовых видов спорта на 37.7%. Различий между группой контроля и группой спортсменов легкоатлетов не выявлено. Также не обнаружено различий в активности ритмов ЭЭГ между контрольными группами после статической и динамической нагрузки на фоне когнитивного теста. Таким образом, статическая нагрузка привела к более значительному изменению показателей ритмов ЭЭГ у спортсменов силовых видов спорта.
Увеличение активности θ-диапазона может быть связано с нервно-эмоциональным напряжением во время умственной деятельности, так как в ряде работ можно найти подтверждение тому, что θ-ритм является индикатором эмоционального возбуждения, “ритм напряжения” [35]. В.Н. Кирой так же пришел к выводу, что при переходе от состояния спокойного бодрствования к интеллектуальной деятельности мощность θ-ритма ЭЭГ преимущественно повышается [36].
θ-ритм особенным образом связан с процессом запоминания, так как одной из структур, генерирующих θ-ритм, является гиппокамп, участвующий в процессе формирования следов долговременной памяти. Рост активности θ-ритма у спортсменов может быть связан с преобладанием процессов активации в результате регулярных паттернов моторной активности, а также с формированием новых, достаточно сложных двигательных стереотипов в процессе совершенствования технико-тактических навыков.
Особо стоит отметить, что при выполнении когнитивного теста после физической нагрузки в группе ТА – снизились показатели средней амплитуды спектра и средней мощности спектра θ-ритма ЭЭГ в центральных и затылочных областях. По всей видимости, у спортсменов, особенно силовых видов спорта, физическая нагрузка не соревновательного характера вызывает снижение эмоционального напряжения, с чем может быть связано и снижение θ-ритма у тяжелоатлетов.
Полученные результаты исследования свидетельствуют о том, что от характера, уровня и спортивного мастерства зависит влияние кратковременных физических нагрузок на показатели когнитивной деятельности спортсмена. Это влияние реализуется через механизмы формирования специфических паттернов биоэлектрической активности коры головного мозга. Наиболее значительные изменения в электрической активности мозга были выявлены у представителей группы тяжелоатлетов. В группе легкоатлетов они оказались менее выраженными, что вероятно, обусловлено тем, что циклический (аэробный) характер физической нагрузки лучше обеспечивает кислородный гомеостаз мозговой ткани, по сравнению с силовыми нагрузками, модулируя подкорковые центры, связанные с двигательными функциями. Подобные изменения отражают специфику приспособления организма к определенному уровню двигательной активности, а также приобретенных и закрепленных специфичных двигательных навыков.
Характеристика церебральной гемодинамики при сочетании когнитивных и физических нагрузок. При анализе изменения РЭГ на фоне когнитивного теста после статической и динамической нагрузки у спортсменов были выявлены особенности по ряду показателей (рис. 2).
Рис. 2.
Изменение церебральной гемодинамики после статической (в группе ТА) и динамической (в группе ЛА) физической нагрузки на фоне когнитивного теста относительно соответствующей контрольной группы. РИ – реографический индекс; МУ – модуль упругости; ВО – венозный отток; ДКИ – дикротический индекс; ДСИ – диастолический индекс; FM – фронто-мастоидальное отведение; а – показатели соответствующей контрольной группы; б – показатели группы спортсменов-тяжелоатлетов (ТА); в – показатели группы спортсменов легкоатлетов (ЛА); * – статистически значимые различия с контрольной группой, p < 0.05.

В обеих контрольных группах при выполнении когнитивного теста после cтатической и динамической нагрузки произошло увеличение кровенаполнения справа (на 24 и 35% соответственно). В группе КГ-С показатель РИ до физической нагрузки составил 1.33 (1.20; 1.41), после – 1.44 (1.21; 1.69) (p < 0.05). До физической нагрузки показатель РИ в группе КГ-Д составил 0.77 (0.69; 0.79), после нагрузки ‑ 1.07 (0.88; 1.13) (p < 0.05). Слева статистически значимых изменений не выявлено (рис. 3).
Рис. 3.
Изменение церебральной гемодинамики в контрольных группах после статической (КГ-С) и после динамической нагрузки (КГ-Д) на фоне когнитивного теста. а – показатели фоновой записи; б – показатели группы КГ-С; в – показатели группы КГ-Д; * – статистически значимые различия с фоновой записью, p < 0.05.

В группе тяжелоатлетов после физической нагрузки показатель кровенаполнения в левом каротидном бассейне составил 1.86 (1.61; 2.07), в группе легкоатлетов – 1.34 (1.26; 1.37), что выше на 38.8 и 34% соответственно относительно группы контроля (p < 0.05). В правом каротидном бассейне в группе легкоатлетов РИ составил 1.26 (0.91; 1.40), что на 17.8% выше, чем в группе контроля (p < 0.05). В группе тяжелоатлетов: показатель РИ – 1.09 (0.94; 1.62), что статистически значимо ниже, чем в группе контроля – РИ 1.44 (1.21; 1.69) (p < 0.05) (табл. 3).
Таблица 3.
Показатели РЭГ после физической нагрузки на фоне когнитивного теста в наблюдаемых группах
| Показатель | Группа наблюдения | ||||
|---|---|---|---|---|---|
| КГ-Д | КГ-С | ЛА | ТА | ||
| РИ (б/р) | Лев. | 1.00 (0.97; 1.21) | 1.34 (1.10; 1.47) | 1.34 (1.26; 1.37)* | 1.86 (1.61; 2.07)* |
| Пр. | 1.07 (0.88; 1.13) | 1.44 (1.21; 1.69) | 1.26 (0.91; 1.40)* | 1.09 (0.94; 1.62)* | |
| МУ (%) | Лев. | 17.0 (16.0;18.0) | 21.0 (19.0; 21.0) | 18.0 (15.0; 19.0) | 17.0 (11.5; 19.5)* |
| Пр. | 15.0 (14.0;16.0) | 19.5 (16.0; 24.0) | 18.5 (17.0; 22.0) | 15.5 (9.5; 21.5)* | |
| ВО (%) | Лев. | 31.0 (22.5; 35.0) | 44.0 (35.0; 48.0) | 34.0 (34.0; 43.0)* | 71.0 (42.0; 81.0)* |
| Пр. | 27.0 (23.0; 32.0) | 33.0 (28.0; 62.0) | 27.5 (20.0; 35.0) | 25.0 (21.0; 39.0)* | |
| ДКИ (усл.ед.) |
Лев. | 0.53 (0.45; 0.55) | 0.54 (0.21; 0.69) | 0.48 (0.45; 0.62) | 0.33 (0.29; 0.39)* |
| Пр. | 0.38 (0.33; 0.44) | 0.57 (0.43; 0.58) | 0.65 (0.47; 0.67)* | 0.45 (0.38; 0.60)* | |
| ДСИ (усл.ед.) |
Лев. | 0.63 (0.59; 0.71) | 0.68 (0.36; 1.04) | 0.53 (0.49; 0.64) | 0.38 (0.35; 0.46)* |
| Пр. | 0.58 (0.56; 0.60) | 0.59 (0.49; 0.67) | 0.67 (0.61; 0.71) | 0.57 (0.45; 0.72) | |
Примечание: РИ – реографический индекс; МУ – модуль упругости; ВО – венозный отток; ДКИ – дикротический индекс; ДСИ – диастолический индекс; * – статистически значимые различия между показателями при сравнении с группой КГ (p ≤ 0.05). Остальные обозначения см. табл. 2.
В целом увеличение кровенаполнения после физической нагрузки на фоне когнитивного теста связано с системным эффектом увеличения кровотока во время двигательной деятельности. Увеличение мозгового кровотока является важным средством удовлетворения метаболических потребностей головного мозга в процессе длительных динамических нагрузок [37]. Повышение кровенаполнения сосудов головного мозга может также быть следствием морфологических изменений сосудистой стенки под влиянием физических нагрузок. По литературным данным выявлено, что тренировки на выносливость, а также силовые тренировки вызывают увеличение диаметра сосудов [38]. Увеличение просвета сосудов обеспечивает увеличение перфузии головного мозга после статической и динамической нагрузки.
Ключевая роль в увеличении кровотока при физических нагрузках принадлежит мышечным механорецепторам, активация которых происходит при физических нагрузках. Зарегистрировано увеличение кровотока во время статических упражнений в премоторных и моторных зонах коры головного мозга. При этом после блокады мышечных механорецепторов это увеличение устраняется [39].
Одним из возможных факторов, стимулирующих изменение кровотока, является концентрация лактата [40]. Также одним из факторов увеличения кровотока мозга при физических нагрузках является гипоксия, которая стимулирует вазодилатацию сосудов головного мозга [41].
Статические упражнения индуцируют повышение артериального давления до 450/380 мм рт. ст., и, таким образом, могут значительно повлиять на скорость кровотока [42]. S. Ogoh et al. утверждают об увеличении скорости кровотока в средней мозговой артерии в течение статического усилия на уровне 30% от максимального произвольного сокращения [43]. В исследованиях Y. Yamaguchi et al. было показано увеличение кровотока и вазодилатация в задней мозговой артерии в ответ на визуальную стимуляцию при статическом усилии. Кроме того, авторы считают, что вазодилатация является единственным фактором увеличения кровотока в задней мозговой артерии в ответ на визуальную стимуляцию [44].
По литературным данным установлено наличие взаимосвязи между нейронами головного мозга и сосудами [45]. Также выявлено, что активность астроцитов мозга оказывает влияние на тонус сосудов через посредство химических агентов [46]. При выполнении когнитивного теста происходит увеличение притока крови, что связывают с увеличением активности нейронов [44].
Следует обратить внимание на то, что у спортсменов-тяжелоатлетов на фоне увеличения кровенаполнения сосудов головного мозга наблюдался не столь значительный прирост результативности выполнения математического теста после статической нагрузки. Вероятно это связано с тем, что главным фактором увеличения кровенаполнения после статической нагрузки является рефлекторная компенсация недостаточности кровенаполнения во время выполнения статического усилия (при статическом усилии происходит пережатие кровеносных сосудов в работающих органах, а затем усиление притока крови для удаления продуктов обмена), тогда как при динамической – усиление кровотока происходит во время нагрузки. При этом данная реакция является системной и распространяется на всю сосудистую систему. Таким образом, в головном мозге также происходит реакция усиления кровенаполнения, ведущим фактором которой не является усиление активности нейронов. Кроме того, доказана роль некоторых миокинов в активации деятельности головного мозга [47], при этом продукция данных белков незначительна при статических нагрузках, в отличие от динамических [48].
В левом каротидном бассейне ВО у тяжелоатлетов составил 71.0 (42.0; 81.0)%, что на 61.4% выше, чем в группе контроля (ВО 44.0 (35.0; 48.0)) (p < 0.05), при этом справа различий не выявлено. В группе ЛА ВО составил 34.0 (34.0; 43.0)%, что статистически значимо выше, чем в контрольной группе, где показатель ВО равен 29.0 (21.0; 53.0) (p < 0.05). При этом справа статистически достоверных различий с КГ не выявлено.
После статической нагрузки в группе нетренированных лиц венозный отток значительно увеличился в каротидном бассейне слева и справа (на 91.3 и 53.5% соответственно). До физической нагрузки ВО в группе КГ-С 20.0 (18.0; 27.0)%, после статической нагрузки – 44.0 (35.0;48.0)%, что статистически значимо выше (p < 0.05). После динамической нагрузки венозный отток увеличился только в левом каротидном бассейне относительно фоновой записи в покое. До нагрузки ВО – 29.0 (21.0; 53.0)%, после нагрузки – 31.0 (22.5; 35.0)% (p < 0.05). Увеличение венозного оттока может являться следствием увеличения кровенаполнения.
В группе спортсменов силовых видов спорта выявлен более низкий показатель МУ в левом (17.0 (11.5; 19.5)%) и правом (15.5 (9.5; 21.5)%) каротидном бассейне относительно контроля, где МУ составил слева – 21.0 (19.0; 21.0)%, справа –19.5 (16.0; 24.0) (p < 0.05). Данный показатель характеризует тонус крупных и средних артерий. При этом у легкоатлетов различий с группой контроля не выявлено.
Тонус крупных и средних артерий (МУ) после статической нагрузки у нетренированных волонтеров контрольной группы увеличился слева на 31.3%. До нагрузки МУ составил 15.5 (12.0; 17.0)%, после нагрузки –21.0 (19.0; 22.0)%, при этом после динамической нагрузки увеличение также произошло, но на 21.4% (p < 0.05).
Тонус артериол (ДКИ) у спортсменов-тяжелоатлетов статистически значимо ниже, чем в группе контроля в левом и правом каротидном бассейне (38.9 и 21.1% соответственно). В группе легкоатлетов выявлен более высокий показатель ДКИ справа на 21% относительно контроля (табл. 3).
Тонус артериол (ДКИ) у нетренированных лиц после статической нагрузки снизился слева и справа относительно фоновой записи. До нагрузки в группе КГ-С ДКИ слева составил 0.63 (0.33; 0.75) усл. ед., после нагрузки – 0.54 (0.21; 0.69), справа до нагрузки – 0.67 (0.56; 0.71) усл. ед., после нагрузки – 0.57 (0.43; 0.58) усл. ед. После динамической нагрузки тонус артериол слева увеличился на 29.3% и составил 0.53 (0.45; 0.55) усл. ед., справа снизился на 37.7% и составил 0.38 (0.33; 0.44) усл. ед. (p < 0.05).
Тонус венул (ДСИ) у тяжелоатлетов слева также статистически значимо ниже (на 44.9%) в сравнении с группой контроля (табл. 3).
Тонус венул у нетренированных лиц до нагрузки составил 0.73 (0.70; 0.75) усл. ед. и снизился после статического усилия в правом каротидном бассейне на 29.8% (0.59 (0.49; 0.67) усл. ед.) (p < 0.05).
При этом после динамической нагрузки тонус венул снизился слева и справа на 24.1 и 19.4% соответственно (фоновые показатели ДСИ слева: 0.57 (0.43; 0.62) усл. ед., справа: 0.70 (0.65; 0.82) усл. ед.) (p < 0.05).
Изменение тонических свойств сосудов у спортсменов, особенно силовых видов спорта может быть связано с адаптационными изменениями сосудистой системы под влиянием регулярных силовых и статических нагрузок.
По результатам ряда исследований выявлено, что при физических нагрузках происходит изменение эластичности сосудов. Артериальная ригидность выше у спортсменов силовых видов спорта, чем у спортсменов, тренирующихся на выносливость и у нетренированных лиц [38]. Хорошо известно, что регулярные физические нагрузки аэробного характера способствуют снижению ригидности сосудов в состоянии покоя и способствуют восстановлению эластичности сосудов [49].
Физиологические механизмы, лежащие в основе изменения эластичности стенок артерий, связанной с высокоинтенсивными тренировками с отягощениями еще во многом не объяснены. Интенсивные тренировки с отягощениями, как известно, вызывают значительное увеличение активности симпатической нервной системы, что вызывает повышение тонуса сосудов. Также подобные изменения возможны вследствие значительного повышения артериального давления в процессе выполнения силовых упражнений. Однако при физических нагрузках на сосудистый тонус могут оказывать влияние и циркулирующие факторы.
При анализе данных изменения гемодинамики головного мозга при выполнении когнитивного теста выявлено, что после статической нагрузки в группе тяжелоатлетов и в группе контроля изменения более значительные, чем после динамической.
По данным литературы можно утверждать, что физические нагрузки вызывают изменения свойств сосудов и гемодинамики не только в работающих мышцах, но и в сосудах головного мозга. Данные изменения носят системный характер. Влияние циклических, силовых и статических нагрузок на гемодинамику и свойства сосудов также неоднозначны, вероятно, эти изменения обусловлены интенсивностью нагрузки. Механизмы влияния физических нагрузок на сосудистую систему также во многом невыяснены. Существует несколько возможных механизмов, ответственных за местные и системные эффекты на сосудистую систему у человека, среди которых отмечены гормоны (инсулин), напряжение сдвига, изменение морфологических свойств сосудов (увеличение просвета сосудов), а также миокины.
ЗАКЛЮЧЕНИЕ
Срочная и долговременная адаптация к регулярным физическим нагрузкам происходит на уровне всех органов, в том числе и сосудистой системы человека. При этом адаптационные перестройки носят системный характер, они наблюдаются не только локально, в работающих группах мышц, но и в других органах, в том числе и в головном мозге.
Характер, уровень и периодичность физических нагрузок наряду с формированием двигательных стереотипов, оказывают влияние на психофизиологическую сферу спортсмена. Влияние кратковременных физических нагрузок на показатели когнитивной деятельности в большей степени зависит от уровня и характера тренированности спортсмена и также находит отражение в характерных для каждой группы особенностях биоэлектрической активности коры головного мозга.
В проведенном исследовании было установлено, что после динамической и статической нагрузки происходит изменение показателей гемодинамики головного мозга. При этом реакция системы мозгового кровотока у тяжелоатлетов после статической нагрузки более выражена, чем у легкоатлетов после циклической нагрузки. Установлено, что физическая нагрузка способствует улучшению результатов выполнения когнитивного теста со счетом у всех испытуемых, однако у легкоатлетов результативность теста после динамической нагрузки была значительно выше, чем у тяжелоатлетов и нетренированных лиц. Полученные результаты позволяют считать, что статические нагрузки вызывают снижение активности β- и θ-диапазона ЭЭГ при когнитивном тесте, тогда как динамическая нагрузка таких изменений не вызывает. Сниженная активность β-диапазона может быть связана с различной степенью активации нервных центров при выполнении физических упражнений в разных группах и отражать уровень адаптационного потенциала, степень эмоциональной стабильности устойчивости к стрессовым ситуациям. Снижение активности θ‑ритма после статической нагрузки может приводить к ухудшению процессов запоминания и снижению результативности математического теста.
В целом, полученные данные позволяют утверждать, что характер физической активности оказывает существенное влияние на показатели церебральной гемодинамики и биоэлектрическую активность головного мозга. Происходящие при этом физиологические перестройки в свою очередь модифицируют состояние когнитивных функций. По результатам исследования можно предполагать, что нагрузки циклического характера положительно влияют на когнитивные функции, тогда как при нагрузках силового характера подобные эффекты не регистрируются.
Список литературы
Erickson K.I., Kramer F. Aerobic exercise effects on cognitive and neural plasticity in older adults // Br. J. Sports Med. 2008. V. 43. № 1. P. 22.
Hillman C.H., Castelli D.M., Buck S.M. Aerobic fitness and neurocognitive function in healthy preadolescent children // Med. Sci. Sports Exerc. 2005. V. 37. № 11. P. 1967.
Wendel-Vos G.C.W., Schuit A.J., Feskens E.J.M. et al. Physical activity and stroke. A meta-analysis of observational data // Int. J. Epidemiol. 2004. V. 33. № 4. P. 787.
Кабачкова А.В., Фомченко В.В., Фролова Ю.С. Двигательная активность студенческой молодежи // Вестник Томского государственного университета. 2015. № 392. С. 175.
Brunkner P., Khan K. Clinical sports medicine. Sydney: McGraw Hill, 2008. 1013 p.
Varraine E., Bonnard M., Pailhous J. Interaction between different sensory cues in the control of human gait // Exp. Brain Res. 2002. V. 142. № 3. P. 374.
Bass R.W., Brown D.D., Laurson K.R. et al. Physical fitness and academic performance in middle school students // Acta Paediatr. 2013. V. 102. № 8. P. 832.
Buck S.M., Hillman C.H., Castelli D.M. The relation of aerobic fitness to stroop task performance in preadolescent children // Med. Sci. Sports Exerc. 2008. V. 40. № 1. P. 166.
Kramer F., Hahn S., Cohen N.J. et al. Ageing, fitness and neurocognitive function // Nature. 1999. V. 400. № 6743. P. 418.
McMorris T., Collard K., Corbett J. et al. A test of the catecholamines hypothesis for an acute exercise-cognition interaction // Pharmacol. Biochem. Behav. 2008. V. 89. № 1. P. 106.
Schinder A.F., Poo M.-М. The neurotrophin hypothesis for synaptic plasticity // Trends in Neurosciences. 2000. V. 23. № 12. P. 639.
Szuhany K.L., Bugatti M., Otto M.W. A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor // Journal of Psychiatric Research. V. 60. P. 56.
Guiney H., Lucas S.J., Cotter J.D. et al. Evidence cerebral blood-flow regulation mediates exercise-cognition links in healthy young adults // Neuropsychology. 2015. V. 29. № 1. P. 1.
Colcombe S.J., Erickson K.I., Scalf P.E. et al. Aerobic exercise training increases brain volume in aging humans // J. Gerontol. A. Biol. Sci. Med. Sci. 2006. V. 61. № 11. P. 1166.
Hillman C.H., Snook E.M., Jerome G.J. Acute cardiovascular exercise and executive control function // Int. J. Psychophysiol. 2003. V. 48. № 3. P. 307.
Egan B.J., Zierath J.R. Exercise metabolism and the molecular regulation of skeletal muscle adaptation // Cell Metab. 2013. V. 17. № 2. P. 162.
Bernecker C., Scherr J., Schinner S. et al. Evidence for an exercise induced increase of TNF-α and IL-6 in marathon runners // Scand. J. Med. Sci. Sport. 2013. V. 23. № 2. P. 207.
Padilla J. Simmons G.H., Bender S.B. et al. Vascular effects of exercise: endothelial adaptations beyond active muscle beds // Physiology (Bethesda, Md.). 2011. V. 26. № 3. P. 132.
Fleenor B.S., Marshall K.D., Durrant J.R. et al. Arterial stiffening with ageing is associated with transforming growth factor-β1-related changes in adventitial collagen: reversal by aerobic exercise // J. Physiol. 2010. V. 588. № 20. P. 3971.
McCloskey D.P., Adamo D.S., Anderson B.J. Exercise increases metabolic capacity in the motor cortex and striatum, but not in the hippocampus // Brain Res. 2001. V. 891. P. 168.
Осипенко А. Роль системы оксида азота в процессах адаптации организма к физическим нагрузкам // Наука в олимпийском спорте. 2014. № 1. С. 23.
Kim S.S., Lee B.H. Measuring cerebral hemodynamic changes during action observation with functional transcranial Doppler // J. Phys. Ther. Sci. 2015. V. 27. № 5. P. 1379.
Banoujaafar H., Van Hoecke J., Mossiat C.M. et al. Brain BDNF levels elevation induced by physical training is reduced after unilateral common carotid artery occlusion in rats. // J. Cereb. Blood Flow Metab. 2014. V. 34. № 10. P. 1681.
Lyngeraa T.S., Pedersen L.M., Mantoni T. et al. Middle cerebral artery blood velocity during running // Scand. J. Med. Sci. Sports. 2013. V. 23. № 1. P. 32.
Schmidt W., Endres M., Dimeo F. et al. Train the vessel, gain the brain: Physical activity and vessel function and the impact on stroke prevention and outcome in cerebrovascular disease // Cerebrovascular Diseases. 2013. V. 35. № 4. P. 303.
Colcombe S.J., Erickson K.I., Raz N. et al. Aerobic fitness reduces brain tissue loss in aging humans // J. Gerontol. A. Biol. Sci. Med. Sci. 2003. V. 58. № 2. P. 176.
Стрельникова Ю.Ю. Временные характеристики познавательных процессов как фактор повышения результативности обучения в высшей школе // Вестник Санкт-Петербургского университета МВД России. 2010. № 1. С. 228.
Critchley H.D., Corfield D.R., Chandler M.P. et al. Cerebral correlates of autonomic cardiovascular arousal: a functional neuroimaging investigation in humans // J. Physiol. 2000. V. 523. № 1. P. 259.
Svannshvili R.A., Sopromadze Z.G., Kakhabrishvili Z.G. et al. Athletes’ physical working capacity // Georgian Med. News. 2009. № 166. P. 68.
Карпман В.Л., Белоцерковский З.Б., Гудков И.А. Тестирование в спортивной медицине. М.: Физкультура и спорт, 1988. 208 с.
Реброва О.Ю. Статистический анализ медицинских данных. М.: Медиа Сфера, 2002. 312 с.
Dolce G., Waldeier H. Spectral and multivariate analysis of EEG changes during mental activity in man // EEG and Clin. Neurophysiol. 1974. V. 36. P. 577.
Ильюченок И.Р. Различия частотных характеристик ЭЭГ при восприятии положительно-эмоциональных, отрицательно эмоциональных и нейтральных слов // Журн. ВНД. 1996. № 3. С. 457.
Голубева Э.А. Связь ритмов электроэнцефалограммы с основными свойствами нервной системы. М.: Педагогика, 1974. 235 с.
Русалов В.М., Кошман С.А. Дифференциально-психологический анализ интеллектуального поведения человека в вероятностной среде // Психофизиологические исследования интеллектуальной саморегуляции и активности. М.: ООО “Наука и технологии”, 1980. 305 с.
Кирой В.Н. Механизмы формирования функционального состояния мозга человека. Ростов-на-Дону: Изд-во Рост. ун-та, 1990. 165 с.
Ogoh S. Cerebral blood flow during exercise: mechanisms of regulation // J. Appl. Physiol. 2009. V. 107. № 5. P. 1370.
Stebbings G.K. Resting arterial diameter and blood flow changes with resistance training and detraining in healthy young individuals // J. Athl. Train. 2013. V. 48. № 2. P. 209.
Jørgensen L.G., Perko M., Hanel B. et al. Middle cerebral artery flow velocity and blood flow during exercise and muscle ischemia in humans // J. Appl. Physiol. 1992. V. 72. № 3. P. 1123.
Mintun M.A. Increased lactate/pyruvate ratio augments blood flow in physiologically activated human brain // Proc. Natl. Acad. Sci. USA. 2004. V. 101. № 2. P. 659.
Ainslie P.N. Cardiorespiratory and cerebrovascular responses to acute poikilocapnic hypoxia following intermittent and continuous exposure to hypoxia in humans // J. Appl. Physiol. 2007. V. 102. № 5. P. 1953.
Dickerman R.D. Middle cerebral artery blood flow velocity in elite power athletes during maximal weight-lifting // Neurol. Res. 2000. V. 22. № 4. P. 337.
Ogoh S., Sato K., Akimoto T. et al. Dynamic cerebral autoregulation during and after handgrip exercise in humans // J. Appl. Physiol. 2010. V. 108. № 6. P. 1701.
Yamaguchi Y., Kashima H., Fukuba Y. et al. Cerebral blood flow and neurovascular coupling during static exercise // J. Physiol. Sci. 2014. V. 64. № 3. P. 195.
Filosa J.A., Bonev A.D., Nelson M.T. Calcium dynamics in cortical astrocytes and arterioles during neurovascular coupling // Circ. Res. 2004. V. 95. № 10. P. 73.
Hamel E. Perivascular nerves and the regulation of cerebrovascular tone // J. Appl. Physiol. 2006. V. 100. № 3. P. 1059.
Baune B.T., Ponath G., Golledge J. et al. Association between IL-8 cytokine and cognitive performance in an elderly general population - the MEMO-Study // Neurobiol Aging. 2008. V. 29. № 6. P. 937.
Seifert T., Brassard P., Wissenberg M. et al. Endurance training enhances BDNF release from the human brain // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2010. V. 298. № 2. P. 372.
Seals D.R., Desouza C.A., Donato A.J. et al. Habitual exercise and arterial aging // J. Appl. Physiol. 2008. V. 105. № 4. P. 1323.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


