Физиология человека, 2019, T. 45, № 2, стр. 70-77
Валидация метода для оценки анаэробного порога в работающей мышце
Д. В. Попов 1, 2, *, С. Ю. Кузнецов 1, Е. А. Орлова 1, А. П. Шарова 1, А. С. Боровик 1, О. Л. Виноградова 1, 2
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова
Москва, Россия
* E-mail: danil-popov@yandex.ru
Поступила в редакцию 07.08.2018
После доработки 23.09.2018
Принята к публикации 01.11.2018
Аннотация
Цель данного исследования – описание и валидация метода определения анаэробного порога (АП) в работающей мышце, основанного на измерении ЭМГ-активности и содержания дезоксигемоглобина (АПHHb-ЭМГ). В исследовании участвовали мужчины разного уровня тренированности. Во время теста с непрерывно повышающейся нагрузкой на велоэргометре (n = 40) и при имитации одновременного бесшажного лыжного хода на лыжном эргометре (n = 9) измеряли концентрацию лактата в крови, содержание в мышце дезоксигемоглобина и ЭМГ-активность. Часть испытуемых (n = 11) участвовала в повторном выполнении велоэргометрического теста. В обоих тестах (на велоэргометре и при одновременном бесшажном ходе) обнаружены тесные и значимые корреляции (r = 0.89–0.92, p < 0.002) между лактатным порогом (маркером анаэробного порога на уровне организма) и АПHHb-ЭМГ (маркером АП на уровне работающей мышцы). Коэффициент вариации АПHHb-ЭМГ в велоэргометрическом тесте оказался низким и составил ~3%. Таким образом, АПHHb-ЭМГ демонстрирует хорошую воспроизводимость и может использоваться для оценки уровня тренированности человека. Появление на рынке беспроводных миниатюрных ЭМГ-усилителей и ИК-спектрометров открывает широкие возможности для использования предлагаемого метода в лабораторных исследованиях и в полевых условиях.
Оценка аэробной работоспособности очень важна для спорта, физической культуры и восстановительной медицины. Для оценки аэробной работоспособности и выбора на этой основе оптимального уровня тренировочных нагрузок широко используется показатель мощность на уровне анаэробного порога (АП), который определяют в тесте с возрастающей нагрузкой. В многочисленных исследованиях показано, что АП это информативный и надежный показатель, характеризующий аэробную работоспособность на уровне организма [1–5]. В литературе описано несколько методов определения АП в тесте с повышающейся нагрузкой. В большинстве исследований [1, 6–8] для расчета АП используются системные показатели (содержание лактата в крови, легочная вентиляция, скорость потребления O2, продукции CO2 и т.п.). Это означает, что эти подходы можно корректно применять только при работе большой мышечной массы (бег, езда на велосипеде, бег на лыжах и т.п.).
При выполнении человеком аэробной работы низкой и умеренной интенсивности рекрутируются в основном низкопороговые мотонейроны, иннервирующие мышечные волокна I типа. Постепенное увеличение мощности приводит к вовлечению в работу высокопороговых мотонейронов и волокон II типа, окислительные возможности которых ниже, чем у волокон I типа [9]. Увеличение интенсивности работы сопровождается нарастающим накоплением различных метаболитов, особенно в волокнах II типа, развитием утомления и, как следствие, увеличением скорости рекрутирования новых волокон. Описанные процессы дают возможность определить АП во время теста с повышающейся нагрузкой непосредственно в работающей мышце. Действительно, с применением ядерной магниторезонансной спектроскопии, электромиографии (ЭМГ), и спектроскопии в близком инфракрасном (ИК) диапазоне удается обнаружить “точку перегиба” на кривых, описывающих, соответственно, динамику содержания креатинфосфата и рН в работающей мышце [10, 11], интегрированную ЭМГ-активность (маркер рекрутирования двигательных единиц) [12–14], а также содержание деоксигемоглобина (HHb) в мышце [15] (индекс, характеризующий экстракцию кислорода мышцей) во время теста с возрастающей нагрузкой. Эти подходы могут обеспечить оценку “мышечного” АП во время теста с повышающейся нагрузкой при работе как большой, так и малой мышечной массы. Однако рассматриваемые подходы имеют существенные ограничения: измерение содержания в работающей мышце креатинфосфата и рН с помощью магнито-резонансной спектроскопии – это дорогостоящий и неудобный для использования метод. Точку перегиба на кривой изменения ЭМГ-активности во время теста с повышающейся нагрузкой не всегда удается зарегистрировать [16, 17], кроме того этот показатель демонстрирует низкую воспроизводимость при повторных тестированиях [16–20] по сравнению с обычными методами определения АП [21]. Предлагается несколько подходов для оценки мышечного АП с помощью спектроскопии в близком инфракрасном диапазоне [22–24], в частности с использованием показателя HHb [15, 25–29], однако такой метод не был валидирован.
Недавно мы описали метод определения мышечного АП с использованием одновременной регистрации HHb и ЭМГ-активности (АПHHb-ЭМГ) [30]. В настоящем исследовании описан усовершенствованный алгоритм определения АПHHb-ЭМГ, позволяющий увеличить надежность метода, и представлены результаты валидации метода. Для этого: 1) АПHHb-ЭМГ сравнивали с хорошо описанным и широко используемым методом – лактатным порогом при выполнении велоэргометрического теста и теста на лыжном эргометре, имитирующем движения рук при бесшажном ходе; 2) оценивали надежность теста при сравнении с результатами повторного тестирования.
МЕТОДИКА
Исследование одобрено этической комиссией ГНЦ РФ-ИМБП РАН и выполнено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации. Все испытуемые дали информированное письменное согласие на участие в эксперименте.
Алгоритм оценки мышечного АПHHb-ЭМГ во время теста с непрерывно повышающейся нагрузкой. ЭМГ-активность и содержания HHb в работающей мышце во время теста с непрерывно повышающейся нагрузкой (рамп-тест) записывали непрерывно (рис. 1, А). ЭМГ-сигнал выпрямляли, и затем рассчитывали усредненные за 20 с величины ЭМГ и HHb (mEMG и mHHb). Средние величины нормировали с использованием следующих формул:
(1)
$\begin{gathered} nEMG = {{\left( {mEMG--{\text{max}}\left[ {mEMG} \right]} \right)} \mathord{\left/ {\vphantom {{\left( {mEMG--{\text{max}}\left[ {mEMG} \right]} \right)} {}}} \right. \kern-0em} {}} \hfill \\ \,\,\,\,\left( {{\text{max}}\left[ {mEMG} \right]--{\text{min}}\left[ {mEMG} \right]} \right), \hfill \\ \end{gathered} $(2)
$\begin{gathered} nHHb = {{\left( {mHHb--{\text{max}}\left[ {mHHb} \right]} \right)} \mathord{\left/ {\vphantom {{\left( {mHHb--{\text{max}}\left[ {mHHb} \right]} \right)} {}}} \right. \kern-0em} {}} \hfill \\ \,\,\,\,\left( {{\text{max}}\left[ {mHHb} \right]--{\text{min}}\left[ {mHHb} \right]} \right) \hfill \\ \end{gathered} $Рис. 1.
Анаэробный порог (AПHHb-ЭMГ) для m. vastus lateralis во время велоэргометрического теста с непрерывно повышающейся нагрузкой (скорость увеличения нагрузки 15 Вт/мин) оценивали с использованием ЭМГ-активности и изменения содержания деоксигемоглобина (HHb). Представлены типичные данные для сигналов нативной ЭМГ-активности и HHb (А). Точку перегиба на функции, описывающей соотношение между нормированными HHb и ЭМГ-активностью определяли с использованием метода V-slope (Б). Затем определяли мощность на анаэробном пороге (В). AПHHb-ЭMГ, определенный в велоэргометрическом тесте, коррелировал с ЛП4 (Г).
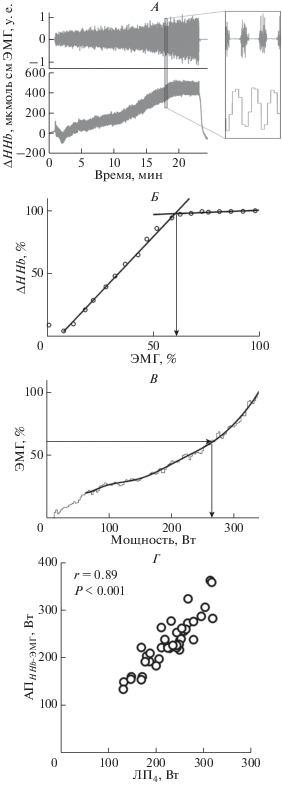
Сравнение мышечного АПHHb-ЭМГс лактатным порогом. Лактатный порог, оцениваемый при фиксированном уровне лактата крови 4 ммоль/л (ЛП4), является информативным и надежным предиктором аэробной работоспособности [5]. Поэтому сравнили этот широко используемый показатель ЛП4 с мышечным АПHHb-ЭМГ в различных тестах с повышающейся нагрузкой, выполняемых большой мышечной массой (велоэргометрия и имитация одновременного бесшажного лыжного хода).
Велоэргометрический тест с возрастающей нагрузкой. В исследовании принимали участие 40 молодых мужчин различного уровня подготовленности: от нетренированных до спортсменов-любителей, тренирующих выносливость (лыжные гонки, бег, велогонки). Средний возраст составил (медиана и межквартильный разброс) 26 (20–35) лет, масса тела 70 (65–85) кг. Первый визит в лабораторию был ознакомительный. Спустя 2–3 дня каждый испытуемый выполнил тест с непрерывно возрастающей нагрузкой на электромагнитном велоэргометре (Ergoselect 200, Ergoline, Германия). Начальная нагрузка, скорость прироста нагрузки и частота вращения педалей составили 0 Вт, 15 Вт/мин, 60–70 об./мин соответственно. Работу выполняли до отказа. Во время работы раз в 2 мин и сразу по окончании работы брали пробы крови из кончика пальца (20 мкл) для определения содержания лактата (анализатор Biosen C-line, EKF Diagnostics, Германия). Во время теста непрерывно регистрировали ЭМГ-активность m. vastus lateralis с помощью усилителя CP511 (Grass Telefactor, США) и стандартных накожных Ag/AgCl электродов. Сигнал усиливали в 1000 раз и пропускали через фильтр 3–300 Гц. Кожу в месте наложения электродов брили, зачищали абразивной тканью и протиралась спиртом. Изменения содержания HHb (ΔHHb) оценивали c помощью спектрометра NIRO-200 (Hamamatsu Photonics K.K., Япония) с частотой 6 Гц. ИК-излучатель и приемник располагали на расстоянии 4 см друг от друга вблизи ЭМГ-электродов. Аналоговые сигналы с обоих устройств оцифровывали с частотой 1000 Гц с использованием АЦП E440 (L-Сard, Россия) и записывали с помощью ПО PowerGraph (ДИСофт, Россия).
Тест руками с возрастающей нагрузкой. В исследовании участвовали 9 нетренированных молодых мужчин, возраст 26 (21–35) лет, масса тела 73 (66–74) кг. Все испытуемые знакомились с процедурой тестирования и выполняли тест с непрерывно возрастающей нагрузкой до отказа на лыжном эргометре SkiErg (Concept2, США). Начальная нагрузка и скорость ее прироста составили 25 Вт и 10 Вт/мин соответственно. Каждый испытуемый поддерживал задаваемую нагрузку с помощью визуальной обратной связи.
Два−три дня спустя каждый испытуемый участвовал в двух тестах с повышающейся нагрузкой до отказа, выполняемых в случайном порядке: в тесте с непрерывно возрастающей нагрузкой (как описано выше) и в тесте со ступенчато повышающейся нагрузкой. В ступенчатом тесте начальная нагрузка, длительность ступени и прирост нагрузки составили 25 Вт, 2 мин и 20 Вт соответственно. Важно отметить, что средняя скорость прироста нагрузки в обоих тестах составила 10 Вт/мин.
Во время теста с непрерывно возрастающей нагрузкой для вычисления АПHHb-ЭМГ измеряли ЭМГ-активность и содержание HHb в дистальной части m. latissimus dorsi, как описано выше. Во время ступенчатого теста в конце каждой ступени брали пробы капиллярной крови из пальца во время коротких остановок (10–15 с) для определения ЛП4.
Оценка надежности определения АПHHb-ЭМГ при повторном выполнении теста. 11 человек, возраст 27 (24–34) г., масса тела 72 (70–79) кг, выполнявших велоэргометрический тест, повторили его через неделю. Измеряли те же параметры, что и в первом тесте.
Статистика. Поскольку большинство данных имели ненормальное распределение, они приводятся в виде медианы и межквартильного разброса. Значимость различий определяли с помощью парного непараметрического критерия Вилкоксона, корреляцию оценивали с помощью коэффициента корреляции Спирмена. Уровень значимости был 0.05. Коэффициент вариации (КВ) вычисляли как отношение стандартного отклонения к среднему и выражали в процентах.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
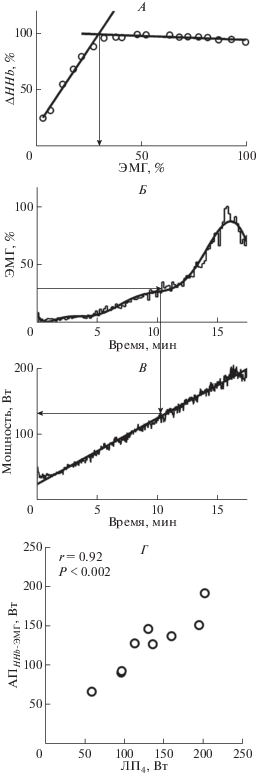
Сравнение АПHHb-ЭMГ с лактатным порогом. Обнаружены тесные и статистически значимые корреляции между АПHHb-ЭМГ и ЛП4 как в велоэргометрическом тесте (r = 0.89, p < 0.001, рис. 1, Г), так и в тесте на лыжном эргометре (r = 0.92, p < < 0.002, рис. 2, Г).
Рис. 2.
Мышечный анаэробный порог (AПHHb-ЭMГ) для m. latissimus dorsi во время теста одновременный бесшажный ход с непрерывно увеличивающейся нагрузкой оценивали на основе данных ЭМГ-активности и изменения содержания деоксигенированного гемоглобина (HHb). Точку перегиба на кривой, описывающей соотношение между нормированными HHb и ЭМГ-активностью определяли с использованием метода V-slope (А), затем определяли время (Б) и мощность (В) AПHHb-ЭMГ. AПHHb-ЭMГ в рамп-тесте при имитации одновременного бесшажного хода статистически значимо коррелирует с ЛП4, определенном в одноименном тесте со ступенчато повышающейся нагрузкой (Г), n = 9. Средняя скорость увеличения нагрузки – 10 Вт/мин в обоих тестах.
Оценка надежности АПHHb-ЭМГ при повторном выполнении теста. При повторном выполнении теста на велоэргометре АПHHb-ЭМГ, ЛП4, максимальная аэробная мощность (Wмакс) и лактат крови при отказе от работы (Laпик) не отличались от показателей первого теста (табл. 1). КВ был наименьшим для Wмакс и наибольшим для Laпик. Коэффициенты вариации для АПHHb-ЭМГ и ЛП4 были низкими и не различались между собой: 3.1% (0.8–5.4)% и 2.4% (1.0–8.0)% соответственно (табл. 1).
Таблица 1.
Физиологические данные и коэффициенты вариации (КВ) в велоэргометрическом тесте с непрерывно повышающейся нагрузкой и при его повторном выполнении
| Регистрируемые показатели | Wмакс, Вт | Laпик, ммоль/л | ЛП4, Вт | AПHHb-ЭMГ, Вт |
|---|---|---|---|---|
| Тест | 257(246–311) | 9.0(8.0–10.3) | 201(153–244) | 219(166–236) |
| Повторное выполнение теста | 262(251–314) | 9.1(8.8–10.2) | 188(170–249) | 221(158–234) |
| Значение p | 0.08 | 0.52 | 0.82 | 0.52 |
| КВ, % | 1.2(0.7–1.9) | 7.6(4.1–12.2) | 2.4(1.0–8.0) | 3.1(0.8–5.4) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В данном исследовании была проведена валидизация предлагаемого метода определения АП. Принцип метода основывается на следующих положениях: 1) к концу теста с повышающейся нагрузкой прогрессирующее накопление метаболитов в работающей мышце приводит к развитию утомления и увеличению скорости включения в работу новых двигательных единиц. Это приводит к нелинейному увеличению нормированной ЭМГ-активности; 2) во время теста с повышающейся нагрузкой возрастает содержание HHb в мышце, показатель, связанный с экстракцией кислорода мышцей [32], но к концу теста это увеличение замедляется. Функция, описывающая динамику соотношения между HHb и ЭМГ-активностью во время работы повышающейся мощности, имеет выраженную точку перегиба (рис. 1, Б и 2, А). Эта точка перегиба легко обнаруживается для m. vastus lateralis во время велоэргометрического теста и для m. latissimus dorsi во время теста на лыжном эргометре. Следует подчеркнуть, что m. vastus lateralis и m. latissimus dorsi являются ведущими мышцами при велоэргометрии и одновременном бесшажном ходе соответственно. В обоих тестах найдены тесные и достоверные корреляции между ЛП4 (маркер AП на уровне целого организма) и АПHHb-ЭМГ (маркер AП на уровне работающей мышцы). Можно предположить, что для мышц, не выполняющих основную нагрузку во время теста, корреляция может быть менее значимой и АПHHb-ЭМГ может отличаться от ЛП4. Важно отметить, что предложенный подход для определения АПHHb-ЭМГ может дать возможность определять уровень тренированности отдельных мышц во время упражнения большой мышечной массы.
Важная характеристика каждого метода – это вариативность. В предыдущих исследованиях КВ для ЛП4 составил от 1.4 до 5.9% [21, 33–35]. Эти величины вполне сопоставимы с вариативностью ЛП4, полученной в исследовании (КВ, 2.4%). КВ для АПHHb-ЭМГ при повторном выполнении велоэргометрического теста был достаточно низкий (3.1%) и не отличался от КВ для ЛП4.
Предлагаемый метод имеет существенное ограничение. Излучение в близком инфракрасном диапазоне проникает в ткань на глубину, не превышающую половину расстояния между излучателем и приемником [36], которое составило в нашем исследовании 40 мм. При толщине подкожно-жирового слоя более 10 мм, сигнал регистрируемый от жировой ткани будет маскировать изменения в содержания HHb в мышце [36]. Кроме того следует отметить, что на измеряемую величину HHb могут влиять изменения перфузии кожи и рассеивания света в ткани во время теста с повышающейся нагрузкой [37].
ЗАКЛЮЧЕНИЕ
В литературе описано несколько методов определения АП при выполнении работы повышающейся мощности. В некоторых исследованиях мышечный АП оценивался с использованием показателей ЭМГ-активности и HHb, связанных с рекрутированием двигательных единиц и потреблением кислорода мышцей, соответственно. АП, определяемый с помощью этих подходов в тесте с возрастающей нагрузкой, детектируется не всегда [15–17] и демонстрирует относительно низкую воспроизводимость при повторных тестированиях [16–21]. В настоящем исследовании для увеличения надежности оценки мышечного АП использовали оба показателя: ЭМГ и HHb. Мышечный АПHHb-ЭМГ показал хорошую воспроизводимость и значимо коррелировал с широко используемым ЛП4. Мышечный АПHHb-ЭМГ может быть использован для оценки уровня подготовленности отдельных мышц во время работы большой мышечной массы. Появление на рынке недорогих беспроводных миниатюрных ЭМГ-усилителей и ИК-спектрометров открывает широкие возможности для использования предлагаемого метода в лабораторных исследованиях и в полевых условиях.
Исследование выполнено по плану фундаментальных исследований ГНЦ РФ ИМБП РАН и при финансовой поддержке РФФИ в рамках научного проекта № 17-00-00308 (17-00-00242).
Список литературы
Farrell P.A., Wilmore J.H., Coyle E.F. et al. Plasma lactate accumulation and distance running performance // Med. Sci. Sports. 1979. V. 11. № 4. P. 338.
Komi P.V., Ito A., Sjodin B. et al. Muscle metabolism, lactate breaking point, and biomechanical features of endurance running // Int. J. Sports Med. 1981. V. 2. № 3. P. 148.
Loat C.E., Rhodes E.C. Relationship between the lactate and ventilatory thresholds during prolonged exercise // Sports Med. 1993. V. 15. № 2. P. 104.
Mader A. Evaluation of the endurance performance of marathon runners and theoretical analysis of test results // J. Sports Med. Phys. Fitness. 1991. V. 31. № 1. P. 1.
Faude O., Kindermann W., Meyer T. Lactate threshold concepts: how valid are they? // Sports Med. 2009. V. 39. № 6. P. 469.
Beaver W.L., Wasserman K., Whipp B.J. A new method for detecting anaerobic threshold by gas exchange // J. Appl. Physiol. 1986. V. 60. № 6. P. 2020.
Beaver W.L., Wasserman K., Whipp B.J. Improved detection of lactate threshold during exercise using a log-log transformation // J. Appl. Physiol. 1985. V. 59. № 6. P. 1936.
Wasserman K., McIlroy M.B. Detecting the threshold of anaerobic metabolism in cardiac patients during exercise // Am. J. Cardiol. 1964. V. 14. P. 844.
Gollnick P.D., Piehl K., Saltin B. Selective glycogen depletion pattern in human muscle fibres after exercise of varying intensity and at varying pedalling rates // J. Physiol. 1974. V. 241. № 1. P. 45.
Marsh G.D., Paterson D.H., Thompson R.T., Driedger A.A. Coincident thresholds in intracellular phosphorylation potential and pH during progressive exercise // J. Appl. Physiol. (1985). 1991. V. 71. № 3. P. 1076.
Zanconato S., Buchthal S., Barstow T.J., Cooper D.M. 31P-magnetic resonance spectroscopy of leg muscle metabolism during exercise in children and adults // J. Appl. Physiol. 1993. V. 74. № 5. P. 2214.
Viitasalo J.T., Luhtanen P., Rahkila P., Rusko H. Electromyographic activity related to aerobic and anaerobic threshold in ergometer bicycling // Acta Physiol Scand. 1985. V. 124. № 2. P. 287.
Nagata A., Muro M., Moritani T., Yoshida T. Anaerobic threshold determination by blood lactate and myoelectric signals // Jpn. J. Physiol. 1981. V. 31. № 4. P. 585.
Moritani T., Takaishi T., Matsumoto T. Determination of maximal power output at neuromuscular fatigue threshold // J. Appl. Physiol. (1985). 1993. V. 74. № 4. P. 1729.
Grassi B., Quaresima V., Marconi C. et al. Blood lactate accumulation and muscle deoxygenation during incremental exercise // J. Appl. Physiol. 1999. V. 87. № 1. P. 348.
Taylor A.D., Bronks R. Reproducibility and validity of the quadriceps muscle integrated electromyogram threshold during incremental cycle ergometry // Eur. J. Appl. Physiol Occup. Physiol. 1995. V. 70. № 3. P. 252.
Hug F., Laplaud D., Lucia A., Grelot L. EMG threshold determination in eight lower limb muscles during cycling exercise: a pilot study // Int. J. Sports Med. 2006. V. 27. № 6. P. 456.
Lucia A., Sanchez O., Carvajal A., Chicharro J.L. Analysis of the aerobic-anaerobic transition in elite cyclists during incremental exercise with the use of electromyography // Br. J. Sports Med. 1999. V. 33. № 3. P. 178.
Pavlat D.J., Housh T.J., Johnson G.O. et al. An examination of the electromyographic fatigue threshold test // Eur. J. Appl. Physiol Occup. Physiol. 1993. V. 67. № 4. P. 305.
Mahmutovic S., Sprout E.Y., Fontaine J.C. et al. Test-retest reliability of the electromyographic fatigue threshold for cycle ergometry // Muscle Nerve. 2016. V. 53. № 5. P. 803.
Hopkins W.G., Schabort E.J., Hawley J.A. Reliability of power in physical performance tests // Sports Med. 2001. V. 31. № 3. P. 211.
Bhambhani Y.N., Buckley S.M., Susaki T. Detection of ventilatory threshold using near infrared spectroscopy in men and women // Med. Sci. Sports Exerc. 1997. V. 29. № 3. P. 402.
Belardinelli R., Barstow T.J., Porszasz J., Wasserman K. Changes in skeletal muscle oxygenation during incremental exercise measured with near infrared spectroscopy // Eur. J. Appl. Physiol Occup. Physiol. 1995. V. 70. № 6. P. 487.
Soller B.R., Yang Y., Lee S.M. et al. Noninvasive determination of exercise-induced hydrodgen ion threshold through direct optical measurement // J. Appl. Physiol. (1985). 2008. V. 104. № 3. P. 837.
Bellotti C., Calabria E., Capelli C., Pogliaghi S. Determination of maximal lactate steady state in healthy adults: can NIRS help? // Med. Sci. Sports Exerc. 2013. V. 45. № 6. P. 1208.
Osawa T., Kime R., Hamaoka T. et al. Attenuation of muscle deoxygenation precedes EMG threshold in normoxia and hypoxia // Med. Sci. Sports Exerc. 2011. V. 43. № 8. P. 1406.
Fontana F.Y., Keir D.A., Bellotti C. et al. Determination of respiratory point compensation in healthy adults: Can non-invasive near-infrared spectroscopy help? // J. Sci. Med. Sport. 2015. V. 18. № 5. P. 590.
Keir D.A., Fontana F.Y., Robertson T.C. et al. Exercise Intensity Thresholds: Identifying the Boundaries of Sustainable Performance // Med. Sci. Sports Exerc. 2015. V. 47. № 9. P. 1932.
Wang L., Yoshikawa T., Hara T. et al. Which common NIRS variable reflects muscle estimated lactate threshold most closely? // Appl. Physiol Nutr. Metab. 2006. V. 31. № 5. P. 612.
Кузнецов С.Ю., Попов Д.В., Боровик А.С., Виноградова О.Л. Определение аэробно-анаэробного перехода по интенсивности ЭМГ и данным инфракрасной спектроскопии работающей мышцы // Физиология человека. 2015. Т. 41. № 5. С. 108.
Jones R.H., Molitoris B.A. A statistical method for determining the breakpoint of two lines // Anal. Biochem. 1984. V. 141. № 1. P. 287.
Grassi B., Quaresima V. Near-infrared spectroscopy and skeletal muscle oxidative function in vivo in health and disease: a review from an exercise physiology perspective // J. Biomed. Opt. 2016. V. 21. № 9. P. 091313.
Jensen K., Johansen L. Reproducibility and validity of physiological parameters measured in cyclists riding on racing bikes placed on a stationary magnetic brake // Scand. J. Med. Sci. Sports. 1998. V. 8. № 1. P. 1.
Pfitzinger P., Freedson P.S. The reliability of lactate measurements during exercise // Int. J. Sports Med. 1998. V. 19. № 5. P. 349.
Hoefelmann C.P., Diefenthaeler F., Costa V.P. et al. Test-retest reliability of second lactate turnpoint using two different criteria in competitive cyclists // Eur. J. Sport Sci. 2015. V. 15. № 4. P. 265.
Homma S., Fukunaga T., Kagaya A. Influence of adipose tissue thickness on near infrared spectroscopic signals in the measurement of human muscle // J. Biomed. Optics. 1996. V. 1. P. 418.
Ferreira L.F., Hueber D.M., Barstow T.J. Effects of assuming constant optical scattering on measurements of muscle oxygenation by near-infrared spectroscopy during exercise // J. Appl. Physiol. (1985). 2007. V. 102. № 1. P. 358.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


