Физиология человека, 2019, T. 45, № 3, стр. 16-23
Исследование спектральной мощности ЭЭГ у детей с расстройствами аутистического спектра: неоднородность группы
Е. А. Лущекина 1, *, В. С. Лущекин 2, В. Б. Стрелец 1
1 ФГБУН Институт высшей нервной деятельности и нейрофизиологии РАН
Москва, Россия
2 Детский психоневрологический центр
Москва, Россия
* E-mail: elena.luschekina@yandex.ru
Поступила в редакцию 30.06.2018
После доработки 05.11.2018
Принята к публикации 20.12.2018
Аннотация
Из общей группы детей (средний возраст 6.05 лет) с расстройствами аутистического спектра (РАС) выделено 2 подгруппы, в одной из которых предполагается дальнейшее развитие по аутистическому типу (группа АТ), а в другой – переход к развитию по шизотипическому типу (группа ШТ). Проведено исследование особенностей спектральной мощности (СМ) ЭЭГ в фоне в группах АТ и ШТ, а также в группе детей с расстройствами шизофренического спектра (РШС) в сравнении с группой нормально развивающихся детей того же возраста. В группах РШС и ШТ наблюдаются более высокие значения СМ θ- и α-ритма в передних отделах коры по сравнению с нормой и пониженные значения СМ α-ритма в задних отделах коры. В группе АТ отмечаются пониженные значения θ- и α-активности, в особенности, в задних отделах. СМ α-ритма в затылочных отделах во всех экспериментальных группах ниже, чем в норме. При этом в группах РШС и ШТ наблюдается правостороннее преобладание α-ритма. В группе АТ наблюдается увеличение представленности γ-ритма в переднее-центральных и височных отделах. Обсуждается проблема неоднородности группы детей с РАС в связи с возможным переходом РАС в РШС и признаки, по которым, по-видимому, можно прогнозировать этот переход.
Разграничение расстройств аутистического спектра (РАС) и ранней детской шизофрении имеет не только теоретический интерес, но играет принципиальную роль в подборе лечения [1]. Ряд авторов полагает, что детский аутизм может предшествовать развитию шизофрении [2, 3]. Есть точка зрения, что шизофрения является одним из частных случаев РАС с наиболее выраженными проявлениями [1, 4]. Таким образом, очевидна необходимость обнаружения “опорных моментов”, указывающих на возможность перехода аутистического заболевания в процессуальное. Разработаны коррекционные методики, улучшающие психофизиологические показатели детей с РАС [5, 6]. В ряде случаев они оказываются неэффективны. Возможно, это происходит в том случае, когда неправильно поставлен диагноз, и в группу аутистов попадают дети с РАС.
Можно выделить из группы РАС детей, которые развиваются по шизотипическому варианту, с помощью ЭЭГ-маркеров. У детей с нарушениями психического развития характеристики ЭЭГ могут быть более информативными, чем результаты МРТ- или ПЭТ-исследований, не всегда подтверждающих аномалии в развитии мозга [7]. ЭЭГ – неинвазивный, относительно дешевый метод, и на основании использования только этого метода можно с высокой степенью вероятности констатировать РАС [8]. В связи с этим исследования биоэлектрической активности мозга при попытке выяснения фундаментальной природы данного заболевания, так же как и для клинической диагностики, не утрачивают своей актуальности.
В предыдущих исследованиях [9] методом математической классификации (дискриминантный анализ) из общей группы детей с РАС выделено 2 подгруппы, одна из которых по классификационным параметрам оказалась близкой к группе детей с расстройствами шизофренического спектра (РШС). В этой подгруппе переход к развитию по шизотипическому типу (группа ШТ – шизотипический тип развития). Вторая подгруппа по результатам дискриминантного анализа осталась в пределах группы РАС, поэтому дети из этой подгруппы продолжат развитие по аутистическому типу (группа АТ – аутистический тип развития). При достаточно четком разделении методом математической классификации группы РАС на подгруппы, названные АТ и ШТ, нейрофизиологические характеристики данных подгрупп нуждаются в дальнейшем уточнении, что и явилось целью данной работы.
Задача работы состояла в анализе ритмов ЭЭГ в состоянии спокойного бодрствования у детей с РАС из подгруппы, близкой к РАС в целом (АТ) и из подгруппы, близкой к РШС (ШТ) по сравнению со здоровыми детьми того же возраста и в выделении областей коры и ритмов “повышенного интереса”, значимо отличающихся от нормы.
МЕТОДИКА
В исследовании принимали участие мальчики-правши в возрасте от 4 лет 5 мес. до 7 лет 9 мес. Первая группа – группа контроля состояла из здоровых детей (36 чел., средний возраст 7.11 ± 0.86). Вторая группа детей с РШС включала диагнозы “шизофрения” F. 20 или “шизотипическое расстройство” F. 21 по Международной классификации болезней (19 чел., средний возраст 6.32 ± 1.54). Третья группа состояла из детей с РАС и соответствовала диагнозу F. 84 по Международной классификации болезней (39 чел., средний возраст 5.79 ± 1.42). Эту группу предварительно разделили на 2 подгруппы [9]: одна подгруппа по данным дискриминантного анализа была близка к группе РШС. Ее рассматривали как группу РАС, в которой в дальнейшем предполагается развитие по шизотипическому типу (ШТ, 18 чел., средний возраст 6.08 ± 1.33); вторую подгруппу рассматривали как группу, в которой предполагается дальнейшее развитие по аутистическому типу (АТ, 21 чел., средний возраст 6.05 ± 0.86).
Испытуемые находились на этапе предварительного обследования в Детском психоневрологическом центре г. Москвы и еще не получали медикаментозного лечения. Родители всех детей дали письменное согласие на участие их детей в обследовании. Дети, участвующие в исследовании понимали и выполняли речевые команды и могли воспроизвести цифровой ряд или произвести простые арифметические действия.
ЭЭГ-регистрацию проводили от 16 электродов по стандартной схеме 10–20% и объединенных ушных электродов с помощью электрофизиологического компьютерного комплекса CONAN 4.5, состоящего из 16-канального усилителя и персонального компьютера [5]. Регистрировали ЭЭГ в диапазоне 0.3–75 Гц с частотой опроса 256 Гц, постоянной времени 0.3 с и эпохой анализа, равной 60 с. ЭЭГ регистрировали в состоянии покоя с закрытыми глазами. После стандартных процедур первичной обработки, включающей полосовую фильтрацию для удаления сетевых помех и вырезания артефактов, данные подвергали вторичной обработке с помощью программ анализа биоэлектрической активности. Вторичная обработка ЭЭГ включала последовательно фильтрацию и факторный анализ по методу “главных компонент”, позволяющий в ходе последующих преобразований визуально выбрать сигналы, относящиеся к артефактам. Выбранные артефактные сигналы вычитали далее из исходной ЭЭГ до процедуры фильтрации с использованием коэффициентов линейной регрессии. Спектральные характеристики вычисляли с использованием быстрого преобразования Фурье; статистическому анализу подвергали средние значения амплитуд в частотных диапазонах. Исследовали спектральную мощность (СМ) в диапазонах θ2 (4–8 Гц), α (8–14 Гц), и γ1 (30–45 Гц). Использовали показатели натурального логарифма СМ (lnСМ), которые имели распределения, близкие к нормальным, что позволило исследовать их средствами параметрической статистики. Достоверность различий для межгрупповых сравнений определяли с помощью парного Т-теста Стьюдента.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Из общей группы детей с РАС выделено 2 подгруппы, в одной из которых предполагается дальнейшее развитие по аутистическому типу (группа АТ), а в другой – переход к развитию по шизотипическому типу (группа ШТ). Исследование особенностей СМ ЭЭГ в фоне в группах АТ и ШТ, а также в группе детей с РШС в сравнении с группой нормально развивающихся детей того же возраста показало следующее.
На первом этапе был проведен статистический анализ методом парных сравнений по Т-критерию Стьюдента нормы и экспериментальных групп по отведениям с целью выделения областей значимо отличающихся от нормы.
В группе РШС (рис. 1, А) выявлено достоверное превышение показателей содержания θ2-ритма в передних отделах по сравнению с группой нормально развивающихся детей. Повышенные значения показателей lnСМ для θ2-ритма с высокой степенью достоверности (p < 0.001) обнаруживалось в отведениях: Fp1–2, F7–8, F3–4, C3–4, Т3–4. В проекционных зонах О1–2 наблюдались пониженные с высокой степенью (p < 0.0001) достоверности по сравнению с нормой значения lnСМ α-ритма (0.001 < p < 0.01). При этом отмечалась достоверная правосторонняя асимметрия α-ритма (рис. 2). Процентная представленность α-ритма по отношению ко всему исследуемому частотному диапазону составляла 36.07% в левом затылочном отведении и 39.22% в правом затылочном отведении, что достоверно отличается от нормы, где соответствующие показатели составляют 54.01 и 54.07% (рис. 3). В диапазоне γ1 наблюдались незначительные изменения в сторону увеличения по сравнению с нормой по отведениям Fp1, F3, F8 (p < 0.05). (Рис. 1, А).
Рис. 1.
Карты различий между логарифмами спектральной мощности при сравнении контрольной группы с экспериментальными группами в 16 отведениях. Серый цвет соответствует изменениям в сторону превышения показателей в экспериментальной группе по сравнению с нормой; черный цвет соответствует изменениям в сторону снижения показателей в экспериментальной группе по сравнению с нормой. А – изменения в группе РШС по сравнению с нормой; Б – изменения в группе ШТ по сравнению с нормой; В – изменения в группе АТ по сравнению с нормой; а – θ2-ритм; б – α-ритм; в – γ-ритм. Цифрами обозначена достоверность различий по T-критерию Стьюдента с вероятностью ошибки (0.0001 < p < 0.01) в каждом из 16 отведений.
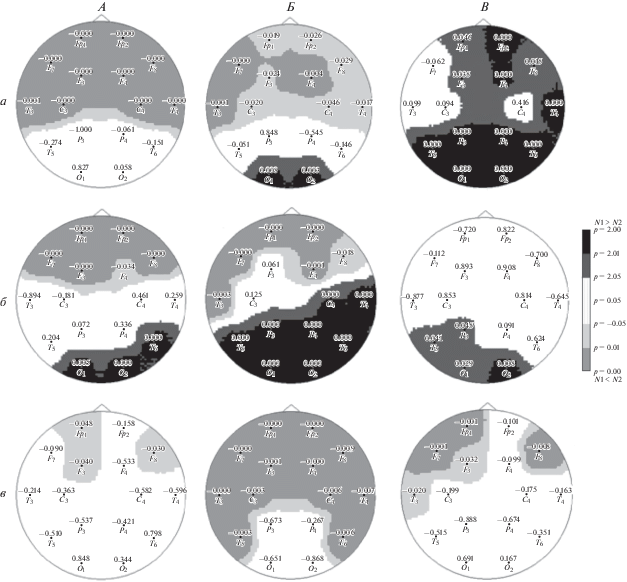
Рис. 2.
Логарифм спектральной мощности α-ритма у трех групп испытуемых и в норме. Темные столбики – отведение О1; светлые столбики – О2. а – группа нормально развивающихся детей, б – группа РШС, в – группа ШТ, г – группа АТ. * – достоверные различия (p(t) < 0.01).

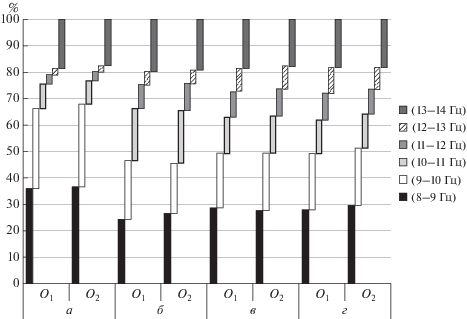
Рис. 3.
Процентная представленность α-ритма по отношению ко всему исследуемому частотному диапазону. * – достоверные различия (p(t) < 0.001); ** – p(t) < 0.01. Остальные обозначения см. рис. 2.

В группе ШТ (рис. 1, Б), как и в группе РШС отмечено достоверное превышение показателей содержания θ2-ритма в передних отделах по сравнению с группой нормально развивающихся детей. Повышенные значения показателей lnСМ для θ2-ритма с высокой степенью достоверности (p < 0.001) обнаруживались в отведениях: F7, F4, Т3 и с меньшей степенью достоверности (p < 0.01) в отведениях Fp1–2, F8, F3, С3–4 и Т4. В затылочных отделах выявлена противоположная тенденция: пониженные по сравнению с нормой значения lnСМ в отведениях О1–2. Пониженные по сравнению с нормой показатели α-ритма отмечались в отведениях О1–2, Р3–4, Т5–6 (0.01 < p < 0.0001). Так же как в группе РШС обнаружена правосторонняя асимметрия α-ритма, достоверно отличающаяся от соотношения “право-лево” в норме (рис. 2). Процентная представленность α-ритма по отношению ко всему исследуемому частотному диапазону составляла 29.3% в левом затылочном отведении и 32.2% в правом затылочном отведении, что так же, достоверно ниже нормы и несколько меньше, чем в группе РШС (рис. 3). В диапазоне γ1 в передних отделах Fp1, Fp7–8 (p < < 0.001) наблюдались несколько более выраженное, чем в группе РШС, превышение нормальных показателей (рис. 1, Б).
В группе АТ (рис. 1, В) наблюдались сниженные по сравнению с нормой показатели lnСМ для θ2-ритма в Fp2, Т4, Т5–6, Р3–4, О1–2 (p < 0.0001) и менее достоверные различия по сравнению с нормой в отведениях Fp1, F3, F8 (p < 0.05). Изменения lnСМ α-ритма по сравнению с нормой состояли в уменьшении представленности в задних отделах: в отведении О2 (p < 0.005) и в О1, Т5, Р3 (p < 0.01). Показатели спектральной мощности α-ритма в затылочных отведениях в АТ оказались наиболее низкими по сравнению с остальными группами испытуемых. Правостороннее преобладание отсутствовало (рис. 2). Процентная представленность α-ритма по отношению ко всему исследуемому частотному диапазону при сравнении группы АТ с нормой составляла 26.4% в левом затылочном отведении и 25.97% в правом затылочном отведении. Эти показатели оказались самыми низкими по сравнению с другими группами, причем процентная представленность α-ритма справа несколько (на уровне тенденции) меньше, чем слева, в то время как в других группах наблюдалось обратное соотношение (рис. 3). По большинству отведений значения lnСМ γ-ритма превышают нормативные значения с верояностью (0.001 < p < 0.0001). В отведениях О1, О2, Р3, Р4 изменения недостоверны (рис. 1, В).
При исследовании пропорций СМ α-ритма по отношению ко всему α-диапазону выявляется отчетливая тенденция к увеличению пропорции высокочастотных (α3) компонентов в группах РШС, ШТ и АТ по сравнению с нормой, где преобладает “медленный” (α1) ритм. Наиболее показательны различия для диапазона 11–13 Гц, где различия доходят до 8% (норма – 13%; АТ – 21%). В низкочастотном диапазоне 8–10 Гц в норме пропорции α1 составляют 65–67%, тогда как в группе РШС – 46%, в группе ШТ – 49%, а в группе ТА – 50–51% (рис. 4).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное исследование особенностей СМ фоновой ЭЭГ в группах АТ и ШТ , а также в группе детей с РШС в сравнении с группой нормально развивающихся детей того же возраста показало, что в группах РШС и ШТ наблюдаются более высокие значения СМ θ-ритма в передних отделах коры по сравнению с нормой (“гипофронтальность”). СМ α-ритма в затылочных отделах во всех экспериментальных группах оказалась ниже, чем в норме. При этом в группах РШС и ШТ наблюдалось правостороннее преобладание α-ритма. При исследовании пропорций СМ α-ритма по отношению ко всему исследованному диапазону просматривалась отчетливая тенденция к увеличению пропорции высокочастотных (α3) компонентов в группах РШС, ШТ и АТ по сравнению с нормой, где преобладает “медленный” (α1) ритм. В группе АТ наблюдались пониженные значения θ- и α-активности, в особенности, в задних отделах и увеличение представленности γ-ритма в передне-центральных и височных отделах.
Исходя из неоднородности группы РАС и различной эффективности коррекционных мероприятий [10], мы предположили, что в составе экспериментальной группы высоко функциональных аутистов встречаются дети с РШС. В связи с этим ранее была предпринята попытка разделения группы РАС на подгруппы методом математической классификации (дискриминантный анализ) [9]. Использование этого метода позволило выделить из общей группы детей с РАС две подгруппы, в одной из которых предполагалось дальнейшее развитие по аутистическому типу (группа АТ), а в другой, приближенной по результатам классификации к группе РШС, – переход к развитию по шизотипическому типу (группа ШТ).
Увеличение θ-активности в передних отделах коры – гипофронтальность – обнаруженное нами в группах, приближенных к шизотипическому варианту развития (РШС и ШТ), но не в группе, предположительно развивающейся по АТ, подтверждает данные, полученные в многочисленных исследованиях различных вариантов РШС [11–15] и точку зрения о том, что этот признак является устойчивым показателем различных вариантов шизотипического расстройства [15]. Преобладание медленной активности во фронтальных отделах (в особенности, при выполнении когнитивного задания) описана при шизофрении [16] и сочетается с уменьшением представленности α-ритма [17, 18], как и в нашем исследовании.
Общим для всех экспериментальных групп оказалась пониженная по сравнению с нормой СМ α-ритма в затылочных отделах, что совпадает с данными, полученными для взрослых больных с различными формами шизофрении [15, 16], а также для подростков, страдающих РШС [19, 20]. Наиболее выраженное снижение СМ α-ритма в группе АТ позволяет считать этот фактор устойчивым признаком патологии не только шизотипического, но и аутистического круга.
Существенное снижение процентной представленности СМ α-ритма по отношению к СМ всего частотного диапазона, которое обнаружено во всех экспериментальных группах по сравнению с нормой, свидетельствует о повышенной активации коры в фоновом состоянии. Максимальное падение процента α-ритма в группе АТ, сопровождающееся повышением представленности γ-ритма, а не θ-ритма, как в группах РШС и ШТ, является подтверждением того, что повышенный уровень активации коры в группе АТ, по-видимому, обусловлен заболеванием.
Правостороннее преобладание α-ритма в затылочных отделах, которое в предыдущих работах [21] считалось одной из характеристик аутизма, в данном исследовании проявилось, напротив, только у детей с шизотипическим типом развития. Можно предполагать, что наши предыдущие данные о правостороннем преобладании α-ритма при аутизме связаны именно с неоднородностью группы РАС и присутствию в ней детей с патологией шизотипического круга. Согласно данным литературы, правостороннее преобладание α-ритма описано у взрослых больных шизофренией [16], в то время как для аутистов показана правосторонняя редукция мощности α-ритма [22].
Отчетливая тенденция к увеличению пропорции высокочастотных (α3) компонентов по отношению ко всему α-диапазону в группах РШС, ШТ и АТ по сравнению с нормой, где преобладает “медленный” (α1) ритм, полученная в нашей работе, описана при эволютивной форме РАС – высокофункциональном синдроме Аспергера, но не при синдроме Каннера, при котором, напротив, обнаруживается задержка в формировании α-ритма [7, 23]. Высокие пропорции α3, полученные в исследованиях, являются косвенным подтверждением того, что это высокофункциональные аутисты. Пониженные значения θ-активности в группе АТ также свидетельствуют об относительно легкой форме течения заболевания у детей этой группы.
Увеличение представленности γ-ритма в передне-центральных и височных отделах в группе АТ является выраженным отличительным признаком данной группы, что соответствует представлениям о повышенном уровне высокочастотной ЭЭГ активности при аутизме [24]. При шизофрении аналогичное увеличение описано при выполнении задания [15, 25], а при РАС оно проявляется уже в состоянии покоя, что может быть прогностическим признаком РАС.
Анализ, проведенный в данном исследовании с целью выявления “областей повышенного интереса”, позволяет выделить левые височные (Т5 и Т3) и затылочные (О1, О2) отделы коры, относящиеся к специально выделенным зонам, функции которых максимально нарушены при аутизме [26]. В группе АТ левые височные зоны, наряду с передними областями, обнаруживают наиболее достоверное повышение показателей СМ γ-ритма по сравнению с нормой, а на частоте α- и θ-ритмов в них, напротив, наблюдается падение показателей СМ по сравнению с нормой, особенно выраженное в задневисочной области Т5. Высоко достоверные различия в зоне Т5 выявлены также в группах РШС и ШТ на частоте α-ритма. Таким образом, значимой зоной коры, в которой отмечаются различия между нормой и больными РАС и РШС, является левая височная область (зона Вернике), отвечающая преимущественно за слуховое восприятие и развитие речевых функций, претерпевающих существенные нарушения при аутизме [27, 28] и при шизофрении [16, 29]. Выраженные изменения СМ α-ритма в затылочных отделах во всех экспериментальных группах по сравнению с нормой (максимальные различия получены в группе АТ), обнаруженные в нашей работе, свидетельствуют о патологических перестройках в проекционных зонах зрительного анализатора, ответственных за зрительное восприятие и, в частности, за восприятие лиц [30]. Активация проекционных зон слухового и зрительного анализаторов максимально выражены в группе АТ. С этими изменениями может быть связана аномальная сенсорная чувствительность у детей с РАС, которая проявляется у этих детей в трудностях модуляции ответа на сенсорную стимуляцию [31–34].
Таким образом, при попытке выявить в составе группы РАС детей с высоким риском РШС можно ориентироваться на следующие критерии. Характеристики α-ритма – пониженная СМ и преобладание высокочастотных компонентов – являются общими для всех экспериментальных групп. Высокие значения СМ θ-ритма в передних отделах коры по сравнению с нормой (гипофронтальность) могут являться признаком “перехода” из группы РАС в группу РШС. Увеличение представленности гамма ритма уже в фоне, а не только при выполнении функциональных проб, может служить критерием развития по аутистическому типу.
ВЫВОДЫ
1. Проведенное исследование показывает достоверные различия между выделенными подгруппами детей (средний возраст 6.05 лет) с РАС и нормой, что согласуется с результатами классификации, осуществленной ранее методом дискриминантного анализа. В одной из подгрупп предполагается дальнейшее развитие по аутистическому типу (группа АТ), а в другой – переход к развитию по шизотипическому типу (группа ШТ).
2. Снижение СМ α-ритма в затылочных отделах во всех экспериментальных группах по сравнению с нормой, в группе АТ оказалось максимальным. Уменьшение процентного соотношения α-ритма по отношению ко всему частотному диапазону также оказалось наиболее выраженным в группе АТ.
3. Во всех экспериментальных группах наблюдалось увеличение пропорции высокочастотных (α3) компонентов α-ритма.
4. θ-ритм в группах РШС и ШТ имеет более высокие значения СМ в передних отделах коры по сравнению с нормой.
5. θ-активность в группе АТ по сравнению с нормой снижена, в особенности, в задних отделах, а γ-активность, напротив, повышена по сравнению с нормой, в передне-центральных и височных отделах.
Работа выполнена при поддержке РФФИ (грант 17-06-00659-ОГН).
Список литературы
Иовчук Н.М., Северный А.А. Современные проблемы диагностики аутизма // Психологическая наука и образование. 2013. № 5. С. 91.
Башина В.М. Аутизм в детстве. М.: Медицина, 1999. 236 с.
Тиганов А.С., Башина В.М. Современные подходы к пониманию аутизма в детстве // Журн. неврологии и психиатрии. 2005. № 8. С. 4.
King B.H., Lord C. Is schizophrenia on the autism spectrum? // Brain Res. 2011. № 1380. P. 34.
Шоплер Э., Ланзинд М., Ватере Л. Поддержка аутичных и отстающих в развитии детей. Минск: Изд-во БелАПДИ “Открытые двери”, 1997. 200 с.
Yang D., Pelphrey K.A., Sukhodolsky D.G. et al. Brain responses to biological motion predict treatment outcome in young children with autism // Transl. Psychiatry. 2016. V. 6. № 11. https://doi.org/10.1038/tp.2016.213
Симашкова Н.В., Клюшник Т.П., Якупова Л.П., Коваль-Зайцев А.А. Расстройства аутистического спектра (мультидисциплинарные клинико-биологические подходы к диагностике и терапии) // Психиатрия. 2013. Т. 60. № 4. С. 5.
Bosl W.J., Tager-Flusberg H., Nelson C.A. EEG Analytics for Early Detection of Autism Spectrum Disorder: A Data-Driven Approach // Scientific Reports. 2018. V. 1. № 8. https://doi.org/10.1038/s41598-018-24318-x
Лущекина Е.А., Лущекин В.С., Стрелец В.Б. Биоэлектрическая активность мозга детей с расстройствами аутистического спектра: неоднородность группы // Физиология человека. 2018. Т. 44. № 4. С. 32.
Лущекина Е.А., Хаердинова О.Ю., Лущекин В.С., Стрелец В.Б. Межполушарные различия спектральной мощности и когерентности ритмов ЭЭГ у детей с расстройствами аутистического спектра // Физиология человека. 2017. Т. 43. № 3. С. 32.
Fehr T., Kissler J., Moratti S. et al. Source distribution of neuromagnetic slow waves and MEG-delta activity in schizophrenic patients // Biol. Psychiatry. 2001. V. 2. № 50. P. 108.
Harris A., Melkonian D., Williams L., Gordon E. Dynamic spectral analysis findings in first episode and chronic schizophrenia // Int. J. Neurosci. 2006. № 116. P. 223.
Boutros N.N., Arfken C., Galderisi S. et al. The status of spectral EEG abnormality as diagnostic test for schizophrenia // Schizophr. Res. 2008. V. 99. № 1–3. P. 225.
Hong L.E., Summerfelt A., Mitchell B.D. et al. A shared low-frequency oscillatory rhythm abnormality in resting and sensory gating in schizophrenia // Clin. Neurophysiol. 2012. V. 123. № 2. P. 285.
Garakh Z., Zaytseva Y., Kapranova A. et al. EEG correlates of a mental arithmetic task in patients with first episode schizophrenia and schizoaffective disorder // Clinical Neurophysiology. 2015. V. 126. № 11. P. 2090.
Стрелец В.Б. Картирование биопотенциалов мозга при эмоциональной и когнитивной патологии // Журн. высш. нерв. деят. 1997. Т. 47. № 2. С. 226.
Fenton G.W., Fenwick P.B., Dollimore J. et al. EEG spectral analysis in schizophrenia // Br. J. Psychiatry. 1980. V. 136. № 5. P. 445.
Sponheim S.R., Clementz B.A., Iacono W.G., Beiser M. Clinical and biological concomitants of resting state EEG power abnormalities in schizophrenia // Biol. Psychiatry. 2000. V. 48. № 11. P. 1088.
Каплан А.Я., Борисов С.В., Желиговский В.А. Классификация ЭЭГ подростков по спектральным и сегментным характеристикам в норме и при расстройствах шизофренического спектра // Журн. высш. нерв. деят. 2005. Т. 55. № 4. С. 478.
Борисов С.В., Каплан А.Я., Горбачевская Н.Л., Козлова И.А. Анализ структурной синхронности ЭЭГ подростков, страдающих расстройствами шизофренического спектра // Физиология человека. 2005. Т. 31. № 3. С. 16.
Лущекина Е.А., Подрезная Е.Д., Лущекин В.С. и др. Особенности спектральной мощности ЭЭГ у детей с ранним детским аутизмом и их связь с развитием различных симптомов шизофрении // Журн. высш. нерв. деят. 2011. Т. 61. № 5. С. 545.
Stroganova T., Orekhova E., Tcetlin M. et al. EEG evidences of aberrant brain functioning in young children with autism // Int. J. Psychophysiol. 2008. № 69. P. 203.
Якупова Л.П., Симашкова Н.В. Связь нарушений ЭЭГ с клиническими особенностями расстройств аутистического спектра // Вестник Совета молодых ученых Челябинской области. 2016. Т. 3. № 2. С. 134.
Горбачевская Н.Л., Мамохина У.А., Вершинина Н.В. и др. Особенности спектральных характеристик ЭЭГ у лиц с расстройствами аутистического спектра // Психиатрия. 2018. Т. 78. № 2. С. 48.
Стрелец В.Б., Гарах Ж.В., Новотоцкий-Власов В.Ю., Магомедов Р.А. Соотношение между мощностью и синхронизацией ритмов ЭЭГ в норме и при когнитивной патологии // Журн. высш. нерв. деят. 2005. Т. 55. № 4. С. 496.
Hazlett H.C., Gu H., Munsell B.C. et al. Early brain development in infants at high risk for autism spectrum disorder // Nature. 2017. V. 542. № 7641. P. 348.
Thai N.J., Longe O., Rippon G. Disconnected brains: What is the role of fMRI in connectivity research? // Internat. J. Psychophysiology. 2009. V. 73. № 1. P. 27.
Roberts T.P.L., Schmidt G.L., Egeth M. et al. Electrophysiological signatures: magnetoencephalographic studies of the neural correlates of language impairment in autism spectrum disorders // Int. J. Psychophysiol. 2008. № 68. P. 149.
Tang Y., Chen K., Zhou Y. et al. Neural activity changes in unaffected children of patients with schizophrenia: A resting-state fMRI study // Schizophrenia Research. 2015. № 168. P. 360.
Tye Ch., Mercure E., Ashwood K.L. et al. Neurophysiological responses to faces and gaze direction differentiate children with ASD, ADHD and ASD + ADHD // Developmental Cognitive Neuroscience. 2013. № 5. P. 71.
Строганова Т.А., Орехова Е.В., Галюта И.А. Монотропизм внимания у детей с аутизмом // Экспериментальная психология. 2014. Т. 7. № 4. С. 66.
Crane L., Goddard L., Pring L. Sensory processing in adults with autism spectrum disorders // Autism. 2009. V. 13. № 3. P. 215.
Harrison J., Hare D.J. Brief report: assessment of sensory abnormalities in people with autistic spectrum disorders // J. Autism and Developmental Disorders. 2004. V. 34. № 6. P. 727.
Wiggins L.D., Robins D.L., Bakeman R., Adamson L.B. Brief report: sensory abnormalities as distinguishing symptoms of autism spectrum disorders in young children // J. Autism and Developmental Disorders. 2009. V. 39. № 7. P. 1087.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека