Физиология человека, 2019, T. 45, № 3, стр. 92-98
Влияние метилпреднизолона на поздние этапы дифференцировки CD4+ Т-клеток памяти при ревматоидном артрите: исследование in vitro
Н. М. Тодосенко 1, К. А. Юрова 1, О. Г. Хазиахматова 1, Л. С. Литвинова 1, *
1 Балтийский федеральный университет им. И. Канта,
Калининград, Россия
* E-mail: larisalitvinova@yandex.ru
Поступила в редакцию 20.04.2018
После доработки 15.05.2018
Принята к публикации 01.11.2018
Аннотация
В системе in vitro исследованы эффекты метилпреднизолона (МП) на поздние этапы дифференцировки активированных Т-клеток памяти у здоровых доноров и у пациентов с диагнозом ревматоидный артрит (РА). Установлено супрессорное влияние метилпреднизолона (МП) на число СD4+ Т-клеток, экспрессирующих молекулы активации (CD25) и костимуляции (CD28) в CD3+CD45RO+ культурах здоровых доноров и больных ревматоидным артритом (РА). Оценка уровня экспрессии мРНК генов U2af1l4 и Gfi1, контролирующих альтернативный сплайсинг гена Ptprc, позволила продемонстрировать однонаправленные, но разной степени выраженности изменения в норме и при РА. Выявленные ассоциации между уровнем экспрессии генов U2af1l4 и Gfi1 и числом СD3+CD4+CD45RO–CD28– клеток в популяциях TCR-активированных Т-клеток памяти больных РА, подвергнутых действию МП, подтверждают гипотезу о способности глюкортикоидов стимулировать образование терминально-дифференцированных лимфоцитов (CD4+CD28–CD45RO–; TEMRA), которые предположительно играют ключевую роль в патогенезе РА.
Ревматоидный артрит (РА) – хроническое аутоиммунное заболевание (АИЗ), характеризующееся воспалительной реакцией в результате дизрегуляции Т-клеточного звена иммунитета [1]. Предполагают, что основными артритогенными клетками в патогенезе РА являются CD4+CD45RO+Т-лимфоциты памяти с высоким провоспалительным потенциалом [2]. Молекула CD45RO представляет собой короткий вариант общелейкоцитарного рецептора CD45, образующийся в результате альтернативного сплайсинга гена Ptprc (кодирующего молекулу CD45) [3]. Установлено, что несоответствующее сплайсирование пре-мРНК гена Ptprc или наличие некоторых полиморфных вариантов гена CD45 коррелируют с восприимчивостью к широкому спектру аутоиммунных заболеваний, вирусных инфекций и тяжелых иммунодефицитов человека [3]. Можно предположить, что альтернативный сплайсинг гена Ptprc регулируется взаимоисключающими факторами: сплайсинга U2af1l4 (U2 small nuclear RNA auxiliary factor 1-like 4, U2af1l4) и транскрипции Gfi1 (growth factor independent 1), определяющими образование специфических изоформ гликопротеина CD45 в процессах дифференцировки и созревания Т-лимфоцитов [4].
С целью снижения воспалительной реакции организма при АИЗ, в частности при РА, применяют глюкокортикоидные препараты (ГК) [1, 5]. Однако на фоне постоянного приема ГК (примерно у 50% пациентов) возможен рецидив аутоиммунного процесса с утяжелением течения заболевания [5], что позволяет сделать предположение, что ГК не в полной мере блокируют основное звено патогенеза – аутореактивные лимфоциты. Мы предполагаем, что ГК, регулируя альтернативный сплайсинг гена Ptprc [6], участвуют в процессе терминальной дифференцировки аутореактивных Т-клеток при АИЗ, что в свою очередь, может определять исход/течение иммунных реакций при РА. В данной работе в условиях in vitro была оценена взаимосвязь между изменением уровней экспрессии генов U2af1l4 и Gfi1 и фенотипическими проявлениями, характеризующими процессы активации и дифференцировки TCR-стимулированных CD3+CD4+CD45RO+Т-клеток, индуцированных ГК – метилпреднизолоном (МП) в норме и при РА.
МЕТОДИКА
Материалом для исследования служили мононуклеарные лейкоциты, выделенные из венозной крови, взятой из локтевой вены утром натощак с помощью стандартных вакуумных систем “BD VACUTAINERTM” (“Greiner-bio-one”, Австрия) с гепарином (20 ед./мл) у 50 больных РА (38 женщин и 12 мужчин в возрасте 36.4 ± 7.2 лет) и 20 доноров без заболевания РА (10 женщин и 10 мужчин в возрасте 35.3 ± 8.9 лет). Верификацию диагноза и набор пациентов в группы исследования осуществляли зав. ревматологическим отделением, заслуженный врач РФ И.П. Малинина на базе областной клинической больницы г. Калининграда (главный врач – заслуженный врач РФ К.И. Поляков). Постановку диагноза РА выполняли согласно приказу № 21 “Об утверждении стандарта медицинской помощи больным ревматоидным артритом” от 13 января 2006 г.
Диагностические исследования включали опрос пациентов, рентгенографию, компьютерную и ядерно-магнитно-резонансную (ЯМР)-томографию суставов, выявление ревматоидного фактора и титра антител к циклическому цитрулин-содержащему пептиду, оценку скорости оседания эритроцитов и С-реактивного белка. На основании оценки анамнеза болезни в исследование включили пациентов, отвечающих следующим критериям:
– активность болезни – ремиссия (DAS28 (визуальный калькулятор оценки активности заболевания при РА) < 2.6) (10 чел.) или низкая (DAS28 – 2.6–3.2) (40 чел.);
– ревматоидный фактор – серопозитивный;
– антитела к циклическому цитрулин-содержащему пептиду – серопозитивный;
– отсутствие терапии стероидными и цитостатическими препаратами с момента манифестации заболевания (не менее 6 мес.);
– продолжительность заболевания – не более года с момента постановки диагноза.
Критерием исключения пациентов из исследования явилось получение медикаментозной терапии (в том числе терапия ГК препаратами) на момент взятия крови и наличие внесуставных осложнений заболевания. Со всеми обследованными лицами подписали добровольное информационное согласие на исследование. Разрешение на проведение исследования получили в локальном этическом комитете (№ 2 от 11 ноября 2014 г.).
Мононуклеарные клетки (МНК) получали методом центрифугирования в градиенте плотности (1.077 г/см3) фиколл-урографина (“Pharmacia”, Швеция) по стандартной методике. Культуры T-клеток (CD3+CD45RO+) получали из МНК методом иммуномагнитной сепарации с использованием технологии MACS® (MidiMACS Separator, LS Columns, “Miltenyi Biotec”, Германия) и моноклональных антител к CD14 и CD45RО с парамагнитными частицами (MicroBeads human, Miltenyi Biotec, Германия), согласно протоколу фирмы-изготовителя. Использовали клеточные культуры, чистота которых после магнитной сепарации составляла в среднем 97.5 ± 2.12% (фенотип CD3+CD45RO+CD14−CD19−) (далее, CD3+CD45RO+ клетки). Число живых клеток в культурах составляло не менее 98%. CD3+CD45RO+ клетки (106 кл./мл) культивировали в 48-луночном планшете в бессывороточной среде Искова (“Sigma”, США), содержащей 0.5% сывороточного альбумина человека (Микроген, Россия), 5 × 10−5 M β-меркаптоэтанола (“Acros Organic”, США) и 30 мкг/мл гентамицина, в присутствии синтетического ГК (МП) (“Orion Pharma”, Россия) в разных концентрациях или без него (контроль) при 37°С во влажной атмосфере, содержащей 5% СO2 в течение 48 ч. В качестве активатора Т-лимфоцитов использовали реагент T-Cell Activation/Expansion Kit human (“Miltenyi Biotec”, Германия) – антибиотиновые частицы MACSiBead тм с биотинилированными антителами против CD2+, CD3+, CD28+ человека (далее Ac/Exp). Использовали следующие варианты культивирования: 1) интактная проба (без добавления Ac/Exp и синтетических ГК); 2) проба с добавлением Ac/Exp; 3) пробы с добавлением Ac/Exp и разных концентраций МП (10.6; 21.3; 46.2; 85.3; 170.7 мг). Дозы МП, используемые в эксперименте, определили, исходя из математической фармакокинетической двухкамерной модели, где учитывался расчетный объем распределения ГК в организме [7].
Число клеток, несущих поверхностные маркеры (CD3, CD4, CD25, CD28, CD71, CD45RO), определяли методом проточной лазерной цитометрии с помощью моноклональных антител, конъюгированных с Viablue (CD45RO), аллофикоцианином (APC) (CD3) (“Miltenyi Biotec”, Германия), флюоресцеинизотиоцианатом (FITC) (CD25), фикоэритрином (PE) (СD4), (“Abcam”, Cambridge, UK); с конъюгатом РЕ с цианином (PE-Cy7) (CD71) или с пиридинхлорофиллом (PerCP) (CD28) “e-Bioscience”, США) согласно методикам производителя. Регистрацию результатов проводили на проточном цитофлюориметре MACSQuant (“Miltenyi Biotec”, Германия). Все результаты цитометрического анализа проанализировали с помощью программы “KALUZA Analysis Software” (“Beckman Coulter”, США).
После инкубации клеточных культур тотальную РНК выделяли с использованием водного раствора фенола и гуанидин-изотиоцианата (ExtractRNA kit “Евроген”, Россия) согласно протоколу производителя. Обратную – проводили с использованием набора реагентов MMLV RT kit (“Евроген”, Россия) согласно протоколу производителя. В качестве затравки использовали олигонуклеотидный праймер (oligo(dT23), 20 мкМ) (“Бигль”, Россия). Для определения уровней относительной экспрессии генов проводили мультиплексный анализ ПЦР с использованием специфичных зондов TaqMan (“Бигль”, Россия). ПЦР проводили с использованием реагентов qPCRmixHS (“Евроген”, Россия) и праймеров в концентрации 10 пМ. В качестве матрицы использовали 4 мкл кДНК, в качестве референсного гена – ген GAPDH. Предварительную оценку специфичности праймеров, ампликонов и зондов проводили с помощью on-line программы BLAST. Последовательности олигонуклеотидных праймеров, используемых в эксперименте, а также протоколы амплификации, описаны ранее [6].
Статистическую обработку результатов осуществляли с помощью программы IBM SPSS Statistics 20 (Statistical Package for the Social Sciences). Статистическую обработку данных ПЦР с детекцией продуктов в режиме реального времени осуществляли с помощью специализированной программы REST 2009 v. 2.0.12. Уровень экспрессии исследуемых генов в контрольной группе приняли за 1 усл. ед.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Сравнительный анализ эффектов активатора и МП на реакции, характеризующие процессы активации и дифференцировки TCR-стимулированных CD3+CD4+CD45RO+Т-клеток, проведенный нами с учетом гендерных различий доноров без заболевания РА и больных РА, не выявил статистически достоверных отличий тестируемых параметров. На наш взгляд, отсутствие различий по половому признаку в модели исследования in vitro обусловлено тем фактом, что иммунокомпетентные клетки, в частности, Т-лимфоциты женщин и мужчин по сути не отличаются по функциям и фенотипу, а их рецепторный репертуар определяется гормональным фоном организма [8, 9].
Культивирование CD3+CD45RO+ клеток в присутствии активатора приводило к достоверному повышению числа CD4+ Т-клеток, экспрессирующих молекулу CD25, напротив, содержание CD4+CD28+ Т-лимфоцитов снижалось по сравнению с интактной пробой (табл. 1). Известно, что молекула CD25 экспрессируется на ранних этапах Т-клеточной активации и свидетельствует о пролиферативном и дифференцировочном потенциале клетки [10]. Молекула костимуляции CD28, в свою очередь, опосредует функциональную активность Т-лимфоцитов, участвуя в формировании иммунного синапса с последующей клональной экспансией Т-клеток [11, 12].
Таблица 1.
Содержание CD25, CD28 и CD28–CD45RO– (негативных) клеток (%) в культурах CD3+CD4+CD45RO+ Т-лимфоцитов, полученных у здоровых доноров (n = 20) и больных ревматоидным артритом (n = 50), в условиях инкубации с разными концентрациями метилпреднизолона (МП) и активатором (Ac/Exp) (Ме (Q1–Q3))
| Показатель | Условия культивирования | Здоровые доноры | Больные РА | |
|---|---|---|---|---|
| CD25+ | Без активации | 3.11 (2.99–3.14) | 1.95 (1.60–2.70)◊ | |
| Ac/Exp | 35.22 (30.19–36.29)* | 25.13 (15.75–27.52)*◊ | ||
| Ac/Exp + МП (мг) | 10.6 | 28.63 (24.54–29.50)** | 20.96 (13.13–22.95)**◊ | |
| 21.3 | 24.29 (20.82–25.03)** | 15.41 (9.67–16.88)**◊ | ||
| 42.6 | 13.55 (11.61–13.96)** | 14.87 (9.32–16.88)** | ||
| 85.3 | 11.78 (10.10–12.14)** | 15.91 (9.97–17.42)**◊ | ||
| 170.7 | 10.71 (9.18–11.03)** | 14.76 (9.25–16.16)**◊ | ||
| CD28+ | Без активации | 47.86 (45.83–50.57) | 33.65 (29.11–37.85)◊ | |
| Ac/Exp | 41.70 (40.53–43.15)* | 31.15 (26.44–35.96)◊ | ||
| Ac/Exp + МП (мг) | 10.6 | 38.35 (35.04–41.85) | 29.20 (27.05–31.63)◊ | |
| 21.3 | 37.85 (32.98–42.70) | 24.77 (21.20–29.80)◊ | ||
| 42.6 | 31.32 (27.83–34.87)** | 21.22 (18.99–25.08)**◊ | ||
| 85.3 | 24.30 (22.72–27.13)** | 16.44 (15.23–18.21)**◊ | ||
| 170.7 | 21.13 (19.50–23.14)** | 11.33 (9.16–13.33)**◊ | ||
| CD45RO–CD28– | Без активации | 2.50 (2.07–3.09) | 5.59 (4.46–6.82)◊ | |
| Ac/Exp | 6.48 (5.96–7.15)* | 8.70 (8.37–8.75)*◊ | ||
| Ac/Exp + МП (мг) | 10.6 | 7.75 (7.68–7.83)** | 10.76 (10.54–10.93)**◊ | |
| 21.3 | 8.74 (8.55–9.05)** | 12.30 (11.72–12.98)**◊ | ||
| 42.6 | 9.57 (9.37–9.78)** | 15.89 (15.37–17.00)**◊ | ||
| 85.3 | 13.54 (13.35–13.59)** | 20.08 (19.52–21.03)**◊ | ||
| 170.7 | 14.13 (13.36–14.71)** | 23.25 (21.91–24.49)**◊ | ||
Инкубация TCR-активированных CD3+CD45RO+ клеток с МП (весь ряд используемых концентраций) сопровождалась снижением (р < 0.05) числа СD4+ клеток, экспрессирующих молекулы активации (CD25) и костимуляции (CD28) в контроле и у больных РА (табл. 1). Полученные нами результаты не противоречат данным литературы, раскрывающим геномные противовоспалительные эффекты ГК [10, 13, 14]. Кроме того, потеря экспрессии молекулы коактивации (CD28) ТCR-активированными CD3+CD45RO+ Т-клетками может косвенно указывать на процессы созревания Т-лимфоцитов под действием МП [6, 15].
Известно, что в процессе антигенной стимуляции Т-лимфоциты претерпевают активационные изменения, затрагивающие экспрессию молекулы CD45, которая является критическим регулятором сигнализации, опосредованной Т-клеточным рецептором (TCR) [16, 17]. Как уже упоминалось, регуляция альтернативного сплайсинга гликопротеина CD45 осуществляется за счет совместного действия двух факторов: сплайсинга U2AF26 (U2 smallnuclear RNA auxiliary factor 1 like 4, U2af1l4) и транскрипции Gfi1 (growth factor independent 1), реципрокное действие которых определяет соотношение коротких и длинных сплайсо-форм CD45 [3]. Так, экспрессия продукта гена U2af1l4 приводит к образованию короткой молекулы CD45 (CD45RO), тогда как Gfi1 способствует формированию высокомолекулярной изоформы CD45 – CD45RА, характерной, преимущественно, для наивных Т-лимфоцитов [3, 4, 13]. В процессе терминальной дифференцировки эффекторные клетки памяти (TEM) (CD3+CD45RO+CD28–) могут реэкспрессировать длинный сплайс-вариант CD45 (CD45RА), образуя пул терминально-дифференцированных клеток (TEMRA, CD3+CD45RO–CD45RА+CD28–) [15].
Согласно полученным результатам, культивирование CD3+CD45RO+ Т-клеток в присутствии Ас/Ехр сопровождалось повышением уровня экспрессии гена Gfi1 в Т-лимфоцитах в обеих исследуемых группах, по сравнению с интактными пробами (рис. 1).
Рис. 1.
Относительный уровень ($\overline X $ ± SD) экспрессии гена Gfi1 в культурах CD3+CD45RO+Т-лимфоцитов здоровых доноров (“а”, n = 20) и больных ревматоидным артритом (“б”, n = 50), инкубируемых с Т-клеточным активатором (Ас/Ехр) и разными концентрациями метилпреднизолона (МП). а – группа здоровых доноров, б – группа больных РА. kont/exp – отношение уровня экспрессии мРНК в контрольных образцах (без воздействия) и образцов с добавлением Т-клеточного активатора; exp/МП (10.6; 21.3; 46.2; 85.3; 170.7 мг) – отношение уровня экспрессии мРНК в образцах с добавлением Т-клеточного активатора и в образцах с добавлением МП. * – достоверность различий экспрессии гена Gfi1 по сравнению с пробой kont/exp; ◊ – достоверность различий экспрессии гена Gfi1 в культурах Т-лимфоцитов от здоровых доноров и больных РА.
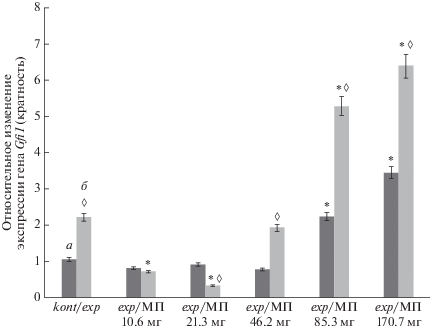
Интересно, что Ас/Ехр значимо угнетал экспрессию гена U2af1l4 (в 35.43 раза) в Т-клетках здоровых доноров, напротив, у больных РА данный показатель возрастал в 2.2 раза по отношению к пробам без активатора (рис. 2). Добавление в TCR-активированные CD3+CD45RO+ культуры здоровых доноров МП (10.6–46.2 мг) сопровождалось снижением экспрессии гена Gfi1, тогда как увеличение дозы МП (85.3; 170.7 мг) в среде приводило к возрастанию данного показателя (рис. 1).
Рис. 2.
Относительный уровень ($\overline X $ ± SD) экспрессии гена U2af1l4 в культурах CD3+CD45RO+ Т-лимфоцитов от здоровых доноров (n = 20) и больных РА (n = 50), инкубируемых с Т-клеточным активатором (Ас/Ехр) и разными концентрациями метилпреднизолона (МП). Обозначения см. рис. 1.

У больных РА изменения уровня экспрессии гена Gfi1 в CD3+CD45RO+ Т-клетках под влиянием МП носило аналогичный характер (рис. 1). МП (весь спектр концентраций) повышал экспрессию гена U2af1l4 в культурах группы контроля и больных РА (рис. 2). Следует отметить, что эффекты МП, оказываемые на культуры больных РА, в отношении экспрессии генов Gfi1 и U2af1l4 носили дозозависимый характер (коэффициент регрессии r 2 = 0.446; r 2 = 0.622, р < 0.05, соответственно).
Основываясь на предположении, что МП может оказывать влияние на процессы созревания и дифференцировки CD3+CD4+CD45RO+ Т-клеток памяти, нами была проведена оценка влияния МП на содержание СD4+CD28–CD45RO– лимфоцитов в культурах TCR-активированных CD3+CD45RO+ клеток. Было обнаружено, что инкубация CD3+CD45RO+ Т-клеток с активатором сопровождалась ростом числа СD4+CD28–CD45RO– Т-лимфоцитов (табл. 1). МП дозозависимым образом увеличивал число СD4+CD28–CD45RO– клеток в TCR-активированных культурах Т-лимфоцитов здоровых доноров (коэффициент регрессии r 2 = 0.897; р < 0.05) и больных РА (r 2 = 0.922; р < 0.05). Важно отметить, что количество клеток СD4+CD28–CD45RO– в культурах, полученных у больных РА, превосходило таковое в пробах здоровых доноров, индуцированное действием МП (≈ в 1.5–2.0 раза) (табл. 1).
Проведенный корреляционный анализ позволил выявить взаимосвязи между содержанием СD4+CD28–CD45RO– клеток и уровнем относительной экспрессии мРНК гена Gfi1 в CD3+CD45RO+ Т-клетках в культурах у больных РА (r = 0.874 – при действии активатора, r = = 0.463, r = 0.563, r = 0.374 – при действии активатора и МП (46.2; 85.3; 170.7 мг, р < 0.05), а также отрицательные ассоциации между числом CD3+CD4+CD45RO+CD28+Т-клеток и содержанием СD4+CD28–CD45RO– лимфоцитов как у здоровых доноров (r = 0.342 – при действии активатора, r = 0.298, r = 0.563, r = 0.301 – при действии активатора и МП (46.2; 170.7 мг) р < 0.05, соответственно), так и у больных РА (r = 0.562 – при действии активатора, r = 0.549, r = 0.672, r = 0.800 – при действии активатора и МП (46.2; 85.3; 170.7 мг) р < 0.05, соответственно), что подтверждает верность выдвинутой гипотезы и свидетельствует об МП-индуцированном созревании Т-клеток в терминальные эффекторы как в норме, так и при РА.
ЗАКЛЮЧЕНИЕ
Таким образом, можно говорить о направленном влиянии МП в условиях in vitro на терминальные стадии дифференцировки CD4+ Т-клеток памяти в норме при РА, что способствует появлению пула TEMRA лимфоцитов. Последние, согласно данным литературы, обладают выраженными цитотоксическими свойствами (гранзимовые и перфориновые гранулы) и высоким провоспалительным потенциалом [15], утрачивая при этом пролиферативную активность [6].
Можно предположить, что на фоне системного супрессирующего эффекта ГК, у больных РА происходит формирование резистентной к их действию популяции эффекторных TEMRA лимфоцитов (CD4+CD45RO–CD28–), которая способствует прогрессии заболевания, в частности, за счет мощного выброса провоспалительных факторов. Ранее нами был продемонстрирован высокий провоспалительный потенциал эффекторной (TEM) популяции Т-клеток с фенотипом – CD4+CD28–CD45RO+ у больных РА (но не у здоровых доноров), который сохранялся на фоне действия ГК в условиях in vitro [18]. Безусловно, дальнейшая работа в контексте изучаемой тематики, должна быть направлена на расшифровку спектра реакций эффекторных (потенциально аутореактивных/артритогенных) Т-клеток на глюкокортикоидную терапию, для расширения фундаментальных знаний о патогенезе РА (с точки зрения Т-клеточной парадигмы) и разработки методологических основ оптимального (патогенетически оправданного) персонализированного фармакологического лечения заболевания.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены этическим комитетом Балтийского федерального университета им. И. Канта (Калининград).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках субсидии “Организация проведения научных исследований 20.4986.2017/6.7” Балтийского федерального университета им. И. Канта (Калининград).
Благодарности. Выражаем благодарность зав. ревматологическим отделением, заслуженному врачу РФ И.П. Малининой областной клинической больницы г. Калининграда (главный врач – заслуженный врач РФ, К.И. Поляков) за помощь в верификации диагноза и наборе пациентов в группы исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Pandya J.M., Lundell A.C., Hallström M. et al. Circulating T helper and T regulatory subsets in untreated early rheumatoid arthritis and healthy control subjects // J. Leukoc. Biol. 2016. V. 100. № 4. P. 823.
Perng O.A., Aitken M., Rankin A.L. et al. The degree of CD4+ T cell autoreactivity determines cellular pathways underlying inflammatory arthritis // J. Immunol. 2014. V. 192. № 7. P. 3043.
Heyd F., ten Dam G., Möröy T. Auxiliary splice factor U2AF26 and transcription factor Gfi1 cooperate directly in regulating CD45 alternative splicing // Nat. Immunol. 2006. V. 7. № 8. P. 539.
Litvinova L.S., Sokhonevich N.A., Gutsol A.A., Kofanova K.A. The influence of immunoregulatory cytokines IL-2, IL-7, and IL-15 upon activation, proliferation, and apoptosis of immune memory T-cells in vitro // Cell and Tissue Biology. 2013. V. 7. № 6. C. 566.
Сытыбалдиев А.М. Лечение ревматической полимиалгии // Современная ревматология. 2013. № 1. С. 66.
Тодосенко Н.М., Юрова К.А., Хазиахматова О.Г. и др. Влияние дексаметазона на процессы активации и созревания CD3+CD4+CD45RO+ Т-клеток при ревматоидном артрите in vitro // Патологическая физиология и экспериментальная терапия. 2017. Т. 61. № 4. С. 89.
Справочник Видаль. Лекарственные препараты России. 20-е изд. М.: ЮБМ Медика Рус., 2014. 1600 с.
Phiel K.L., Henderson R.A., Adelman S.J., Elloso M.M. Differential estrogen receptor gene expression in human peripheral blood mononuclear cell populations // Immunol. Lett. 2005. V. 97. № 1. P. 107.
Laffont S., Rouquie N., Azar P. et al. X-chromosome complement and estrogen receptor signaling independently contribute to the enhanced TLR7-mediated IFN-alpha production of plasmacytoid dendritic cells from women // J. Immunol. 2014. V. 193. № 11. P. 107.
Gutsol A.A., Sokhonevich N.A., Seledtsov V.I., Litvinova L.S. Dexamethasone effects on activation and proliferation of immune memory T cells // Bulletin of Experimental Biology and Medicine. 2013. V. 155. № 4. P. 474.
Hui E., Cheung J., Zhu J. et al. T cell costimulatory receptor CD28 is a primary target for PD-1-mediated inhibition // Science. 2017. V. 155. № 6332. P. 1428.
Riha P., Rudd C.E. CD28 co-signaling in the adaptive immune response // Self Nonself. 2010. V. 1(3). P. 231.
Braitch M., Harikrishnan S., Robins R.A. et al. Glucocorticoids increase CD4CD25 cell percentage and Foxp3 expression in patients with multiple sclerosis // Acta Neurol. Scand. 2009. V. 119. № 4. P. 239.
Cain D.W., Cidlowski J.A. Immune regulation by glucocorticoids // Nat. Rev. Immunol. 2017. V. 17. № 4. P. 233.
Matsuki F., Saegusa J., Nishimura K. et al. CD45RA-Foxp3(low) non-regulatory T cells in the CCR7-CD45RA-CD27+CD28+ effector memory subset are increased in synovial fluid from patients with rheumatoid arthritis // Cell Immunol. 2014. V. 290. № 1. P. 96.
Mustelin T., Taskén K. Positive and negative regulation of T-cell activation through kinases and phosphatases // Biochem J. 2003. V. 371. P. 15.
McNeill L., Salmond R.J., Cooper J.C. et al. The differential regulation of Lck kinase phosphorylation sites by CD45 is critical for T cell receptor signaling responses // Immunity. 2007. V. 27. № 3. P. 425.
Zola H. Markers of cell lineage, differentiation and activation // J. Biol. Regul. Homeost. Agents. 2000. V. 14. № 3. P. 218.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


