Физиология человека, 2019, T. 45, № 4, стр. 53-61
Механизмы вазодилатации в коже при чрескожной электростимуляции спинного мозга на уровне поясничного утолщения
Г. И. Лобов 1, *, Ю. П. Герасименко 1, Т. Р. Мошонкина 1
1 ФГБУН Институт физиологии им. И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: gilobov@yandex.ru
Поступила в редакцию 12.09.2018
После доработки 15.10.2018
Принята к публикации 21.12.2018
Аннотация
У 12 здоровых испытуемых методом лазерной допплеровской флоуметрии зарегистрированы изменения перфузии кожи голени при чрескожной электростимуляции спинного мозга (ЧЭССМ) подпороговыми биполярными импульсами частотой 30 Гц. Установлено, что ЧЭССМ в области позвонков Т11 и L1 приводит к выраженному увеличению кожного кровотока. При интенсивности стимулов 90% от двигательного порога прирост перфузии составил более 85% по отношению к исходному уровню. Результаты исследования свидетельствуют о том, что стимуляция кровотока в коже при ЧЭССМ реализуется преимущественно за счет антидромной стимуляции сенсорных нервных волокон. Важным посредником, способствующим вазодилатации и увеличению кожного кровотока при ЧЭССМ, является оксид азота (NO), имеющий преимущественно эндотелиальное происхождение. Показано, что в процесс вазодилатации в коже при ЧЭССМ вовлечены Са2+-чувствительные К+-каналы большой проводимости. Выявлено взаимодействие NO- и ВКСа-опосредованных механизмов в коже голени при ЧЭССМ, приводящее к усилению вазодилатации и кровотока.
По данным ВОЗ в мире ежегодно от 250 000 до 500 000 чел. получают повреждения спинного мозга (СМ), в итоге в развитых странах число пациентов с травмой СМ превышает 100 чел. на 100 000 населения [1]. Классическими проявлениями травмы СМ являются тяжелые соматические расстройства – нарушения или выпадения двигательных и чувствительных функций ниже места повреждения. В то же время при травме СМ нарушается и контроль процессов и функций, регулируемых вегетативной нервной системой. Одним из важнейших расстройств вегетативной регуляции является нарушение функций сердечно-сосудистой системы (ССС) (в остром периоде – брадикардия, гипотензия, гипотермия, в последующем – дисрегуляция коронарного кровотока, ортостатическая гипотония, нарушения регуляции кровообращения в коже и, как следствие, нарушения регуляции температуры и реакций на физические упражнения) [2, 3].
Тяжесть нарушений функций ССС определяется уровнем травмы. Травма СМ даже на таком низком уровне, как Т12, сопровождается потерей супраспинального и спинального контроля симпатических нейронов, расположенных в нижних поясничных ганглиях, иннервирующих сосуды нижних конечностей и отсутствием периферических вазомоторных ответов [2]. В то же время имеются данные о том, что после травмы СМ спинальные нейронные цепи способны генерировать определенную активность [3], и, в частности, несмотря на отсутствие активирующего влияния со стороны супраспинальных систем, спонтанную активность проявляют и симпатические преганглионарные нейроны [4].
Лечение пациентов с травмой СМ – большая медицинская и социальная проблема, продолжается поиск методов, которые могли бы значительно облегчить их состояние. В частности, в последние десятилетия значительное развитие в восстановлении двигательных функций после травмы СМ получил метод электростимуляции (ЭС) СМ, который позволяет не только управлять тонусом скелетных мышц нижних конечностей, но и вызывать шагательные движения [5]. Однако необходимо отметить, что ЭС СМ была предложена для применения в клинической практике более 50 лет назад C.N. Shealy et al., прежде всего, для лечения ишемической боли, не поддающейся другим видам терапии [6]. Метод оказался достаточно эффективным и обычно применялся при невозможности реваскуляризации конечности у пациентов с эндартериитами и болезнью Рейно. Однако процедура, применявшаяся для лечения, являлась инвазивной, требовалось введение 4–8 электродов в эпидуральное пространство между 8 и 11 грудными или 1 и 2 поясничными позвонками [6, 7]. Сложные способы введения электродов и их фиксации часто сопровождались аппаратными (миграция электродов, нарушения контактов, гематомы) и инфекционными осложнениями, частота которых достигала 36.3 и 6.7% соответственно [8, 9].
В последние годы был разработан метод чрескожной электрической стимуляции спинного мозга человека (ЧЭССМ), принципиально отличающийся тем, что он является неинвазивным. Этот метод предусматривает расположение электродов на коже над определенными сегментами спинного мозга и позволяет модулировать сокращения скелетных мышц нижних конечностей, а при определенных параметрах электрических импульсов и вызывать шагательные движения у здоровых волонтеров и пациентов с параличом нижних конечностей вследствие травмы СМ [5, 10, 11]. Авторами метода установлено, что в процессе мультисегментарной ЧЭССМ происходит конвергенция нисходящих и восходящих влияний на нейронные сети, управляющие постуральными и локомоторными функциями. В этих работах внимание исследователей в первую очередь было направлено на изучение эффектов ЧЭССМ на нейронные сети, управляющие скелетными мышцами. Но анализ эффектов показал, что ЧЭССМ, воздействуя на задние корешки СМ, активирует не только нейронные сети, контролирующие скелетные мышцы, но и другие структуры СМ. Позднее нами было проведено исследование ЧЭССМ на кровоток в коже пальцев стопы [12]. Кожа как ткань для оценки эффектов ЧЭССМ на кровоток была выбрана не только из-за удобства исследования, что тоже немаловажно, но и по другим причинам: в коже представлены все виды регуляции микроциркуляторного кровотока [13], в ней не проявляется рабочая гиперемия, характерная для скелетных мышц, которая может маскировать нейрогенные регуляторные реакции. Кроме того, диапазон изменений кожного кровотока невероятно большой по сравнению с другими тканями: у человека практически от нуля на холоде до 6–7 л/мин при экстремальных тепловых нагрузках [14].
Нами было показано, что при ЧЭССМ увеличивалась перфузия кожи, при этом также возрастала амплитуда колебаний микрокровотока в диапазоне частот 0.05–0.1 Гц [12], что доказывало их нейрогенное происхождение [15]. В задачу данного исследования входило изучение эффектов и механизмов действия ЧЭССМ, не вызывающей двигательный ответ, на кровоток в коже голени, в которой, в отличие от кожи подошвенной поверхности пальцев, функционирует более сложная система регуляции вазомоторных реакций [16].
МЕТОДИКА
В исследовании участвовали 12 добровольцев в возрасте 27–42 лет (5 мужчин, 7 женщин). Все испытуемые были здоровыми, не имели сердечно-сосудистых или метаболических заболеваний, не принимали какие-либо лекарственные препараты и не курили в течение последних суток.
Стимулирующие электроды (катоды) располагали на двух уровнях между остистыми отростками соседних позвонков Т11–Т12 и L1–L2, аноды помещали над гребнями подвздошных костей. Техника проведения ЧЭССМ и применяемое оборудование были описаны ранее [17]. На первом этапе определяли минимальную интенсивность тока, вызывающего двигательные ответы в мышцах ног на одиночные монополярные импульсы длительностью 1 мс при стимуляции каждого из двух уровней спинного мозга, – двигательный порог (ДП). У разных испытуемых ДП составлял от 40 до 100 мА. Для определения двигательного ответа использовали метод поверхностной электромиографии. Регистрировали активность m. biceps femoris, m. rectus femoris, m. gastrocnemius lateralis и m. tibialis anterior на обеих ногах. Для регистрации ЭМГ-активности использовали электроды H124SG (Covidien-ARBO-Kendall), комплекс A-M Systems (США) и программное обеспечение LabChart (США).
На втором этапе исследования регистрировали влияние непрерывной ЧЭССМ на уровнях Т11 и L1. Использовали биполярные импульсы частотой 30 Гц, заполненные частотой 5 кГц, длительность серии – 0.5−1 мин. Интенсивность тока постепенно увеличивали от 0 мА до величины 90% от индивидуального ДП с шагом 5–10 мА. Для оценки параметров и механизмов регуляции кровотока в коже применяли многофункциональный лазерный диагностический комплекс ЛАКК М (LAZMA, РФ). В помещении, в котором проводили исследование, поддерживали температуру 22–23°С. Кончик световодного зонда диагностического комплекса располагали на коже передней поверхности нижней трети голени. Показатель эффективной перфузии рассчитывали по формуле: Мэфф = М × Амакс, где М – показатель микроциркуляции, Амакс – максимальная усредненная амплитуда осцилляций, доминирующая по величине среди амплитуд колебаний всех активных диапазонов частот [15].
На третьем этапе исследования определяли механизмы регуляции кровотока, активируемые при ЧЭССМ. Применяли следующие вещества: нитро-L-аргинина метиловый эфир (L-NAME, Sigma) в концентрации 20 мМ, тетраэтиламмония хлорид (ТЭА, Sigma) в концентрации 20 мМ, крем EMLA (AstraZeneca, Wilmington, DE), содержащий 2.5% лидокаина и 2.5% прилокаина. L-NAME и ТЭА растворяли в дистиллированной воде. Препараты вводили в кожу посредством ионофореза, применяли аппарат для электрофореза “Элфор-Проф” (“Невотон”, РФ). При ионофорезе сила тока составляла 1 мА, длительность ионофореза – 2 мин. Ранее проведенные исследования показали, что ионофорез 0.9% раствора NaCl с указанной силой тока на протяжении 2 мин не вызывал значимых изменений параметров кровотока в коже. Крем EMLA наносили непосредственно на кожу на площади около 4 см2. После аппликации веществ проводили непрерывную ЧЭССМ по протоколу, использованному на втором этапе исследования.
Для математической обработки ЛДФ-грамм применяли прилагаемое к комплексу ЛАКК-М стандартное программное обеспечение (версия 3.0.2.376). Для анализа амплитудно-частотных характеристик использовали алгоритм вейвлет-преобразования, которое осуществляли программой, поставляемой производителем в комплекте с прибором. Статистическую обработку данных выполняли с помощью электронных таблиц “Microsoft Excel” и пакета прикладных программ “Statistica for Windows”, v. 10. Результаты анализа представлены средними значениями данных (М) и величинами стандартного отклонения. Оценку статистической значимости различий средних осуществляли на основе t-критерия Стьюдента. Статистически значимыми считали результаты при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
ЧЭССМ одиночными стимулами не приводила к значимым изменениям перфузии кожи. Непрерывная ЧЭССМ с амплитудой тока выше 20% от ДП сопровождалась быстрым повышением показателя микроциркуляции (ПМ) в коже. По мере возрастания стимулирующего тока величина и скорость увеличения ПМ кожи возрастали. Максимальная величина кожного кровотока достигалась примерно через 30 с действия ЧЭССМ. Типичная запись перфузии кожи голени при ЧЭССМ с величиной тока 90% от ДП показана на рис. 1, а усредненные данные о величине ПМ в коже голени при ЧЭССМ с амплитудой стимулов, составляющих 30, 60 и 90% от ДП, представлены в табл. 1. ПМ в коже голени был недостоверно больше при стимуляции на уровне L1, чем на уровне T11 при одной и той же величине тока (в % от ДП).
Рис. 1.
Динамика показателя микроциркуляции (ПМ) кожи голени при непрерывной ЧЭССМ на уровне L1 с амплитудой стимулов 85 мА (90% от ДП).
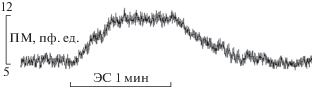
Таблица 1.
Показатель микроциркуляции в коже голени при непрерывной ЧЭССМ на уровне Т11 и L1
| Интенсивность ЭС | ПМ в покое, пф. ед. | ПМ при ЭС на уровне Т11, пф. ед. | ПМ при ЭС на уровне L1, пф. ед. |
|---|---|---|---|
| 30% ДП | 6.62 ± 0.39 | 8.33 ± 0.51* | 8.74 ± 0.47* |
| 60% ДП | 6.62 ± 0.39 | 9.46 ± 0.61*# | 10.32 ± 0.60*# |
| 90% ДП | 6.62 ± 0.39 | 11.52 ± 0.66*#& | 12.46 ± 0.73*#& |
Вейвлет-анализ записанных во время ЧЭССМ ЛДФ-грамм показал увеличение амплитуды колебаний микрокровотока в нейрогенном диапазоне, наиболее выраженными эти реакции были при ЧЭССМ с амплитудой 90% ДП. При ЧЭССМ в области L1 с амплитудой стимулов 90% ДП показатель эффективной перфузии в коже голени увеличился на 93.7%.
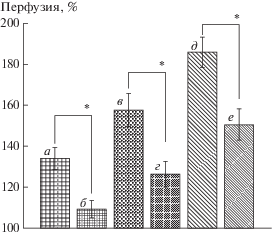
Поскольку в нашем исследовании эффекты ЧЭССМ на уровнях Т11 и L1 на кожный кровоток не имели достоверных различий, далее представлены данные, полученные при ЧЭССМ только на уровне L1. На рис. 2 показаны результаты тестирования кожного кровотока, полученные после предварительного воздействия на кожу крема EMLA, блокирующего сенсорные нервы [18]. На участках кожи, обработанных EMLA, вазодилататорный ответ на ЧЭССМ уменьшался. Применение EMLA снизило прирост кровотока, вызванный ЧЭССМ с интенсивностью стимулирующего тока 30% ДП на 73.0 ± 5.7%, 60% ДП – на 54.3 ± 4.2%, 90% ДП – на 41.4 ± 3.8% от величины прироста ПМ в интактной коже.
Рис. 2.
Показатель микроциркуляции в интактной коже голени и коже голени, предварительно обработанной EMLA, при ЧЭССМ на уровне L1 непрерывными стимулами интенсивностью (в % от ДП). а – 30%, б – 30% на фоне EMLA, в – 60%, г – 60% на фоне EMLA, д – 90%, е – 90% на фоне EMLA. Различия достоверны, * – р < 0.01.
При исследовании роли сенсорных нервов в рефлекторной вазодилатации в коже людей B.J. Wong показал, что часть вазодилатации обусловлена оксидом азота (NO) [18]. Поэтому в части экспериментов мы перед ЧЭССМ посредством электрофореза вводили в кожу L-NAME – ингибитор синтазы NO. Результаты этих опытов представлены на рис. 3. Обработка кожи L-NAME приводила к значительному уменьшению гиперемии, вызванной ЧЭССМ. Снижение гиперемии на фоне L-NAME при ЧЭССМ с интенсивностью стимулов 30% ДП составило 58.8 ± 4.11% от гиперемии в интактной коже, а при 90% ДП – 38.6 ± ± 3.32%.
Рис. 3.
Показатель микроциркуляции в коже голени при ЧЭССМ с величиной тока 30% ДП (а) и 90% ДП (б) на уровне L1 в интактной коже (ЭС), на фоне ингибирования продукции NO (L-NAME), на фоне блокирования BKCa-каналов (ТЭА) и при совместном применении L-NAME и ТЭА. Различия достоверны: * – р < 0.01.
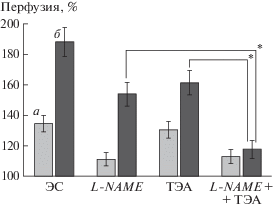
В работе G.J. Hodges et al. [19] при исследовании механизмов реактивной гиперемии в коже была продемонстрирована значимая роль Са-чувствительных К+-каналов большой проводимости (BKCa-каналов) гладкомышечных клеток в вазодилатации. С учетом результатов этого и других исследований мы провели изучение роли BKCa-каналов гладкомышечных клеток микрососудов кожи в реализации вазодилататорного эффекта при ЧЭССМ. BKCa-каналы блокировали перед ЧЭССМ посредством ионофоретического введения в кожу ТЭА [20]. Результаты данной серии экспериментов представлены на рис. 3. Величина ПМ в коже после ионофореза ТЭА не претерпевала значимых изменений. ЧЭССМ после ионофореза ТЭА приводил к увеличению кожного кровотока, однако на фоне ТЭА прирост ПМ был значительно меньшим по сравнению с таковым при ЧЭССМ на интактной коже. Ингибирующий эффект ТЭА проявлялся только при ЧЭССМ стимулами 60 и 90% ДП, при стимуляции током в 30% ДП на фоне действия ТЭА изменения ПМ были недостоверными.
При одновременном ионофорезе L-NAME и ТЭА эффект ингибирования был максимальным (при стимуляции интенсивностью 90% ДП прирост ПМ составил 19.9 ± 2.14% от прироста ПМ в интактной коже). Необходимо отметить, что ингибирующий эффект комбинации L-NAME + + ТЭА был больше по сравнению с суммой ингибирующих эффектов L-NAME и ТЭА по отдельности (рис. 3).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Травма спинного мозга приводит не только к нарушению моторной и сенсорной функций ниже места травмы, но и к потере супраспинального контроля вегетативных функций. Преганглионарные нейроны и интернейроны, принимающие участие в регуляции вегетативных функций, теряют связь с нейронами ростровентромедиальной зоны продолговатого мозга, а через них и с супрабульбарными структурами, осуществляющими интеграцию соматовегетативных реакций [4, 21, 22]. Значительная часть этих нейронов обладает спонтанной активностью, которая регулируется посредством бульбоспинальных связей. Отсутствие бульбарных влияний приводит к растормаживанию преганглионарных нейронов, что при травмах СМ на уровне Т4–Т6 сопровождается опасной для жизни дисрефлексической гипертонией [23].
ЭС СМ в последнее десятилетие широко применяется для регуляции позы и инициации шагательных движений у пациентов с травмами СМ [1, 5, 24]. При этом ЭС СМ, помимо влияния на нейронные сети СМ, ответственные за реализацию соматических функций, оказывает выраженное воздействие и на структуры СМ, регулирующие вегетативные функции. Это же происходит и при применении неинвазивной ЧЭССМ [10, 11]. В нашей предыдущей работе при изучении локомоторных реакций испытуемых на ЧЭССМ, в которой применялись сверхпороговые стимулы, одновременно измерялся и кровоток в коже пальцев стопы [12]. При этом мышечные реакции в ответ на стимулы, создавали определенные сложности для регистрации кровотока в коже методом ЛДФ. Задачей данного исследования было изучение параметров кровотока и механизмов его регуляции в коже голени при ЧЭССМ с параметрами ниже ДП. Измерение кожного кровотока при ЭССМ в качестве индикатора влияния ЭССМ на вегетативные функции не только удобно, но и является максимально информативным при исследовании эффектов ЭССМ на кровообращение. Кровоток в коже можно измерять на протяжении длительного времени с применением неинвазивной техники, не вызывающей активации регуляторных механизмов в сосудах микроциркуляторного русла (МЦР). Кровеносные сосуды кожи голени, в отличие от голой кожи пальцев, имеют более сложную иннервацию, которая представлена симпатическими адренергическими, симпатическими холинергическими и сенсорными пептидэргическими волокнами [16]. Немаловажным является и то, что кожу в настоящее время принято рассматривать в качестве универсальной адекватной модели для исследования микроциркуляторного кровотока при различных патологических состояниях, поскольку выявленные в ней изменения адекватно отражают системные сосудистые реакции и динамику регуляторных механизмов [25, 26].
В данном исследовании установлено, что перфузия кожи голени была значительно ниже по сравнению с перфузией кожи подошвенной поверхности первого пальца стопы [12]. У испытуемых в покое показатель микроциркуляции (ПМ) в коже голени колебался от 5.2 до 7.6 пф. ед. Вейвлет-преобразование ЛДФ-грамм показало, что у испытуемых в состоянии покоя амплитуда колебаний микрокровотока в миогенном, нейрогенном и эндотелийзависимом диапазоне была примерно одинаковой с небольшими индивидуальными особенностями. Непрерывная ЧЭССМ в области позвонков Т11 и L1 подпороговыми стимулами с силой тока 30, 60 и 90% от ДП приводила к выраженному увеличению ПМ в коже голени. При этом повышение перфузии при расположении электродов в области L1 было несколько большим по сравнению с эффектом стимуляции в области Т11. По нашему мнению, небольшие различия в реакциях МЦР кожи при ЧЭССМ в области позвонков Т11 и L1 объясняются тем, что в отличие от эпидуральной стимуляции, где воздействие стимулов довольно локально (катод и анод находятся на одной электродной матрице на твердой мозговой оболочке спинного мозга), при ЧЭССМ, когда катод и анод значительно разнесены на теле испытуемого, возбуждающее действие стимулов проявляется не только непосредственно под электродом, но и, распространяясь по коже, подкожной жировой клетчатке и мышцам, захватывает и соседние корешки спинного мозга. В итоге стимулирующему воздействию подвергается несколько входов в пояснично-крестцовое утолщение, расположенное на уровне позвонков Т10–L1.
Степень увеличения перфузии кожи определялась амплитудой действующих стимулов. По мере возрастания силы тока увеличивалась величина вазодилататорной реакции в коже, приводя к увеличению перфузии при силе тока 90% ДП на 71.1 и 85.2% по сравнению с исходной (при стимуляции в зонах Т11 и L1 соответственно) (табл. 1). ЧЭССМ с разной величиной тока сопровождалась не только изменениями величины гиперемии, но и скорости ее нарастания. При стимуляции с амплитудой 90% ДП скорость возрастания ПМ была максимальной (рис. 1). Одновременно с увеличением перфузии в микроциркуляторном русле возрастало и среднеквадратичное отклонение ПМ, что свидетельствует об активации регуляторных механизмов микрокровотока [15]. Как указывалось ранее, вейвлет-анализ записанных во время ЧЭССМ ЛДФ-грамм выявил увеличение амплитуды колебаний микрокровотока в нейрогенном диапазоне. Указанные изменения параметров перфузии свидетельствуют об усилении регуляции микрокровотока в коже со стороны нервных структур [12, 15]. Также достоверно возрастала амплитуда колебаний кожного микрокровотока в эндотелийзависимом диапазоне. В процессе ЧЭССМ возрастал не только ПМ, но и показатель эффективной перфузии, который в ряде случаев бывает более информативным по сравнению с ПМ.
В коже человека выявляется максимальный диапазон колебаний кровотока по сравнению с другими органами: от минимального, приближающегося к нулю, при сильном охлаждении до 6–7 л/мин при гипертермии [16, 27, 28]. Исследованию механизмов термозависимой вазодилатации в коже посвящены сотни работ [11, 19, 27–29], однако до настоящего времени в этом вопросе нет полной ясности. Более того, нередко авторы разных работ высказывают практически противоположные мнения о значимости того или иного механизма вазодилатации для регуляции кровотока в коже [19, 28]. Аналогичная ситуация выявляется также при анализе литературных данных о механизмах увеличения кровотока в коже при ЭССМ [7–9, 30]. По мнению части исследователей, вазодилатация, индуцированная ЭС СМ, может происходить в результате торможения активности симпатических нейронов [31, 32]. Вторая теория, которой придерживается большинство специалистов, заключается в том, что ЭССМ антидромно активирует сенсорные волокна и вызывает в нервных окончаниях выброс вазодилататоров, приводящих к увеличению просвета резистивных сосудов и возрастанию притока крови [33–35]. В последние годы высказывается также мнение о значимости симпатических холинергических нервов в регуляции кровотока в неголой (волосистой) коже [9, 16].
В данной работе для изучения механизмов вазодилатации в коже при ЧЭССМ мы использовали несколько тестов с применением ингибиторов и блокаторов. Кожу в месте исследования предварительно обрабатывали кремом EMLA. Крем содержит лидокаин и прилокаин, эффект которых заключается в блокаде ионных каналов сенсорных нервов, крем широко используется при исследовании механизмов регуляции кровотока в коже [19]. Применение EMLA значительно уменьшало прирост перфузии в коже в процессе ЧЭССМ при всех величинах стимулирующего тока (рис. 2). Результаты этого теста позволяют сделать заключение о том, что часть эффекта вазодилатации в коже голени при ЧЭССМ реализуется за счет антидромной активации афферентных волокон в дорзальных корешках, вызывающих высвобождение вазодилататорных субстанций в сенсорных нервных окончаниях в коже. Подтверждением участия сенсорных нервов в увеличении кровотока в коже при ЧЭССМ является также значительное снижение в коже, обработанной EMLA, амплитуды колебаний микрокровотока в нейрогенном диапазоне по сравнению с таковой в интактной коже [15].
Таким образом, мы протестировали гипотезу о том, что увеличение перфузии кожи при ЧЭССМ происходит в значительной степени за счет антидромной активации сенсорных нервных волокон. Однако оставался открытым вопрос о том, что же непосредственно оказывает тормозное влияние на гладкомышечные клетки (ГМК) сосудов кожи, приводя к их расслаблению и, как следствие, к вазодилатации и гиперемии. В ряде работ показано, что в окончаниях сенсорных нервов содержатся несколько соединений, обладающих вазодилататорными свойствами [36]. Известно, что мощным микрососудистым вазодилататором, находящимся в нервных окончаниях, является кальцитонин-ген-родственный пептид (CGRP). Мы не смогли оценить непосредственную роль CGRP в ЧЭССМ-вызванной вазодилатации, поскольку применяемый в экспериментах на животных классический антагонист рецептора CGRP – CGRP 8–37, не разрешен в медицинской практике. Однако существовала возможность оценить опосредованный эффект этого пептида. Имеются данные, что CGRP повышает содержание оксида азота (NO) в стенке микрососудов [37]. NO считается важным компонентом, участвующим в вазодилатации, индуцированной эпидуральной стимуляцией СМ [9, 33, 34]. В исследовании мы применяли электрофорез в кожу L-NAME, являющегося неспецифическим ингибитором NO-синтазы [33, 37]. Измерение микрокровотока в коже после электрофореза L-NAME в термонейтральных условиях показало отсутствие достоверных изменений по сравнению с микровотоком в интактной коже. Однако при ЧЭССМ после электрофореза L-NAME величина прироста перфузии кожи была достоверно ниже, составив в среднем 10.3 ± 0.77 пф. ед. против 12.5 ± 0.86 пф. ед. в интактной коже. Полученные данные являются доказательством участия NO в ЧЭССМ-индуцированной вазодилатации в коже голени. Есть основания полагать, что образующийся при ЧЭССМ NO имеет преимущественно эндотелиальное происхождение. Подтверждением данного положения являются: 1) литературные данные о том, что L-NAME эффективно ингибирует эндотелиальную NO-синтазу, 2) зарегистрированное нами в процессе ЧЭССМ возрастание амплитуды колебаний микрокровотока в эндотелийзависимом диапазоне, свидетельствующее об увеличении активности эндотелия в микрососудах кожи [15].
Блокада синтеза NO в наших экспериментах уменьшала величину ЧЭССМ-индуцированной вазодилатации в коже голени, но не отменяла ее, что подразумевает вовлечение при ЧЭССМ других механизмов, приводящих к расслаблению ГМК сосудов и вазодилатации. В литературе имеются данные об участии различных типов К+-каналов эндотелиальных и гладкомышечных клеток в вазодилатации в коже при гипертермии [38]. В частности, была показана значительная роль Са-чувствительных К+-каналов большой проводимости ГМК в гипертермической вазодилатации в коже. Са-чувствительные К+-каналы большой проводимости (ВКСа-каналы) располагаются на мембране сосудистых ГМК, их активация приводит к выходу К+ из клетки, гиперполяризации мембраны и расслаблению ГМК [39]. В работе S. Lorenzo и C.T. Minson были получены данные, свидетельствующие о том, что у людей ВКСа-каналы являются главными участниками в реализации реактивной гиперемии в коже, обеспечивая до 45% гиперемии [21]. Вместе эти данные указывают на важную роль ВKCa-каналов в реализации различных регуляторных влияний на микроциркуляцию кожи. Поэтому мы провели серию исследований, чтобы определить, принимают ли участие ВKCa каналы в реализации вазодилататорного эффекта ЧЭССМ в коже. Использовали ионофорез TЭA, являющегося неспецифическим ингибитором ВKCa каналов. Ионофорез ТЭА приводил к некоторому снижению кожного кровотока в покое, однако это снижение было статистически недостоверным. ЧЭССМ после ионофореза ТЭА вызывала прирост кровотока в коже при всех применяемых величинах тока, однако этот прирост был меньшим по сравнению с эффектом ЧЭССМ в интактной коже. При токе силой 30% от ДП изменения перфузии в коже были небольшими (рис. 3), при увеличении тока до 90% от ДП ингибирующий эффект ТЭА возрастал (рис. 3). Полученные данные подтверждают участие ВKCa каналов в реализации вазодилататорного эффекта ЧЭССМ в коже голени.
Представляются важными и результаты совместного применения ТЭА и L-NAME. Ионофорез двух препаратов значительно увеличивал их ингибирующий эффект на ЧЭССМ-вызванную вазодилатацию, снижение прироста кровотока в этом случае было больше по сравнению с суммой ингибирующих эффектов при применении L-NAME и ТЭА по отдельности. Мы полагаем, что представляются важными и результаты совместного применения ТЭА и L-NAME. Одновременный ионофорез двух препаратов значительно увеличивал их ингибирующий эффект на ЧЭССМ-индуцированную вазодилатацию, снижение прироста кровотока в этом случае было больше по сравнению с суммой ингибирующих эффектов при применении L-NAME и ТЭА по отдельности. Механизмы вазодилатации, запускаемые сенсорными нервами, каким-то образом интегрируется с сигнальными путями, инициируемыми активацией ВKCa-каналов, возможно через симпатическую холинергическую иннервацию [18, 40]. Однако этот потенциальный механизм вазодилатации требует отдельного исследования.
ЗАКЛЮЧЕНИЕ
Основные результаты данного исследования заключаются в следующем:
1. ЧЭССМ на уровне Т11 и L1 непрерывными электрическими импульсамис частотой 30 Гц и интенсивностью 30−90% от интенсивности, вызывающей двигательный ответ, приводит к возрастанию перфузии кожи голени.
2. Получены данные, свидетельствующие, что увеличение микрокровотока в коже при ЧЭССМ вызвано в основном антидромной активацией сенсорных нервных волокон.
3. Установлено, что в коже важным компонентом, опосредующим вазодилататорный эффект ЧЭССМ, является NO.
4. Впервые показано, что в процесс вазодилатации в коже при ЧЭССМ вовлечены Са2+-чувствительные К+-каналы большой проводимости.
5. Выявлено взаимодействие NO- и ВКСа-опосредованных механизмов в коже при ЧЭССМ, приводящее к усилению вазодилатации.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института физиологии им. И.П. Павлова РАН (Санкт-Петербург).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено при финансовой поддержке гранта РФФИ № 16-29-08277 и программы фундаментальных исследований Президиума РАН № 1.42.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Rouanet C., Reges D., Rocha E. et al. Traumatic spinal cord injury: current concepts and treatment update // Arq. Neuropsiquiatr. 2017. V. 75. № 6. P. 387
Garstang S.V., Miller-Smith S.A. Autonomic nervous system dysfunction after spinal cord injury // Phys. Med. Rehabil. Clin. N. Am. 2007. V. 18. № 2. P. 275.
Krassioukov A., Claydon V.E. The clinical problems in cardiovascular control followingspinal cord injury: an overview // Prog. Brain Res. 2006. V. 152. P. 223.
Schramm L.P. Spinal sympathetic interneurons: their identification and roles after spinal cord injury // Prog. Brain Res. 2006. V. 152. P. 27.
Harkema S., Gerasimenko Y., Hodes J. et al. Effect of epidural stimulation of the lumbosacral spinal cord on voluntary movement, standing, and assisted stepping after motor complete paraplegia: a case study // Lancet. 2011. V. 377. № 9781. P. 1938.
Stojanovic M.P., Abdi S. Spinal cord stimulation // Pain Physician. 2002. V. 5. № 2. P. 156.
Jivegård L.E., Augustinsson L.E., Holm J. et al. Effects of spinal cord stimulation (SCS) in patients with inoperable severe lower limb ischemia: a prospective randomized controlled trial // Eur. J. Vasc. Endovasc. Surg. 1995. V. 9. № 4. P. 421.
Pedrini L., Magnoni F. Spinal cord stimulation for lower limb ischemic pain treatment // Interact. Cardiovasc. Thorac. Surg. 2007. V. 6. № 4. P. 495.
Naoum J.J., Arbid E.J. Spinal Cord Stimulation for Chronic Limb Ischemia // Methodist Debakey Cardiovasc. J. 2013. V. 9. № 2. P. 99.
Gerasimenko Y., Gorodnichev R., Moshonkina T. et al. Transcutaneous electrical spinalcord stimulation in humans // Ann. Phys. Rehabil. Med. 2015. V. 58. № 4. P. 225.
Gerasimenko Y., Gorodnichev R., Puhov A. et al. Initiation and modulation of locomotor circuitry output with multisite transcutaneous electrical stimulation of the spinal cord in noninjured humans // Journal of Neurophysiology. 2015. V. 113. № 3. P. 834.
Лобов Г.И., Щербакова Н.А., Городничев Р.М. и др. Эффект чрескожной электростимуляции спинного мозга на кровоток в коже нижних конечностей // Физиология человека. 2017. Т. 43. № 5. С. 36.
Johnson J.M., Minson C.T., Kellogg D.L., Jr. Cutaneous vasodilator and vasoconstrictor mechanisms in temperature regulation // Compr. Physiol. 2014. V. 4. № 1. P. 33.
Smith C.J., Johnson J.M. Responses to hyperthermia. Optimizing heat dissipation by convection and evaporation: Neural control of skin blood flow and sweating in humans // Auton. Neurosci. 2016. V. 196. P. 25.
Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем (Руководство для врачей). М.: Либроком, 2013. 496 с.
Wong B.J., Hollowed C.G. Current concepts of active vasodilation in human skin // Temperature (Austin). 2016. V. 4. № 1. P. 41.
Гришин А.А., Мошонкина Т.Р., Солопова И.А. и др. Устройство для неинвазивной электрической стимуляции спинного мозга // Медицинская техника. 2016. № 5. С. 8.
Wong B.J. Sensory nerves and nitric oxide contribute to reflex cutaneous vasodilation in humans // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013. V. 304. № 8. P. R651.
Hodges G.J., Traeger J.A., Tang T. et al. Role of sensory nerves in the cutaneous vasoconstrictor response to local cooling in humans // Am. J. Physiol. Heart Circ Physiol. 2007. V. 293. P. H784.
Carter S.J., Hodges G.J. Sensory and sympathetic nerve contributions to the cutaneousvasodilator response from a noxious heat stimulus // Exp. Physiol. 2011. V. 96. P. 1208.
Lorenzo S., Minson C.T. Human cutaneous reactive hyperaemia: role of BKCa channels and sensory nerves // J. Physiol. 2007. V. 585. P. 295.
Turner A., Kumar N., Farnham M. et al. Rostroventrolateral medulla neurons with commissural projections provide input to sympathetic premotor neurons: anatomical and functional evidence // Eur. J. Neurosci. 2013. V. 38. № 4. P. 2504.
Rabchevsky A.G. Segmental organization of spinal reflexes mediating autonomic dysreflexia after spinal cord injury // Prog. Brain Res. 2006. V. 152. P. 265.
Shah P., Sureddi S., Alam M. et al. Unique spatiotemporal neuromodulation of the lumbosacral circuitry shapes locomotor success after spinal cord injury // J. Neurotrauma. 2016. V. 33. № 18. P. 1709.
Bagno A., Martini R. Wavelet analysis of the Laser Doppler signal to assess skin perfusion // Conf. Proc. IEEE Eng. Med. Biol. Soc. 2015. P. 7374.
Holowatz L.A., Thompson-Torgerson C.S., Kenney W.L. et al. The human cutaneous circulation as a model of generalized microvascular function // Journal of Applied Physiology Published. 2008. V. 105. № 1. P. 370.
Rowell L.B. Reflex control of regional circulations in humans // J. Auton. Nerv. Syst. 1984. V. 11. № 2. P. 101.
Charkoudian N., Fromy B., Saumet J.L. Reflex control of the cutaneous circulation after acute and chronic local capsaicin // J. Appl. Physiol. 2001. V. 90. P. 1860.
Hodges G.J., Del Pozzi A.T., McGarr G.W. et al. The contribution of sensory nerves to cutaneous vasodilatation of the forearm and leg to local skin heating // Eur. J. Appl. Physiol. 2015. V. 115. № 10. P. 2091.
Wu M., Linderoth B., Foreman R.D. Putative mechanisms behind effects of spinal cord stimulation on vascular diseases: a review of experimental studies // Auton. Neurosci. 2008. V. 138. № 1-2. P. 9.
Linderoth B., Herregodts P., Meyerson B.A. Sympathetic mediationof peripheral vasodilation induced by spinal cord stimulation: animalstudies of the role of cholinergic and adrenergic receptor subtypes // Neurosurgery. 1994. V. 35. P. 711.
Tanaka S., Barron K.W., Chandler M.J. et al. Local cooling alters neural mechanisms producing changes in peripheral blood flow by spinal cord stimulation // Auton. Neurosci. 2003. V. 104. № 2. P. 117.
Carter S.J., Hodges G.J. Sensory and sympathetic nerve contributions to the cutaneous vasodilator response from a noxious heat stimulus // Exp. Physiol. 2011. V. 96. № 11. P. 1208.
Croom J.E., Foreman R.D., Chandler M.J., Barron K.W. Cutaneous vasodilation during dorsal column stimulation is mediated by dorsal roots and CGRP // Am. J. Physiol. 1997. V. 272. P. 950.
Tew G.A., Klonizakis M., Moss J. et al. Role of sensory nerves in the rapid cutaneous vasodilator response to local heating in young and older endurance-trained and untrained men // Exp. Physiol. 2011. V. 96. № 2. P. 163.
van Beek M., van Kleef M., Linderoth B. et al. Spinal cord stimulation in experimental chronic painful diabetic polyneuropathy: Delayed effect of High-frequency stimulation // Eur. J. Pain. 2017. V. 21. № 5. P. 795.
Wu M., Komori N., Qin C. et al. Roles of peripheral terminals of transient receptor potential vanilloid-1 containing sensory fibers in spinal cord stimulation-induced peripheral vasodilation // Brain Res. 2007. № 1156. P. 80.
Félétou M. Endothelium-Dependent Hyperpolarization and Endothelial Dysfunction // J. Cardiovasc. Pharmacol. 2016. V. 67. № 5. P. 373.
Fujii N., Louie J.C., McNeely B.D. et al. K+ channel mechanisms underlying cholinergic cutaneous vasodilation and sweating in young humans: roles of KCa, KATP, and KV channels? // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2016. V. 311. № 3. P. R600.
Fujii N., Meade R.D., Minson C.T. et al. Cutaneous blood flow during intradermal NO administration in young and older adults: roles for calcium-activated potassium channels and cyclooxygenase? // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2016. V. 310. № 11. P. R1081.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


