Физиология человека, 2019, T. 45, № 5, стр. 5-19
Возрастные изменения функциональной организации корковых звеньев регуляторных систем мозга у подростков. Анализ нейронных сетей покоя в пространстве источников ЭЭГ
Р. И. Мачинская 1, *, А. В. Курганский 1, Д. И. Ломакин 1
1 ФГБНУ Институт возрастной физиологии РАО
Москва, Россия
* E-mail: reginamachinskaya@gmail.com
Поступила в редакцию 01.03.2019
После доработки 25.03.2019
Принята к публикации 03.04.2019
Аннотация
В данной работе исследовалось, как на протяжении подросткового периода развития изменяется характер функционального и эффективного взаимодействия между ключевыми кортикальными структурами, входящими в три важнейших нейронных сети покоя: дефолтной сети (default mode network, DMN), сети обнаружения ключевых событий (salience network, SN) и центральной управляющей сети (central executive network, CEN). В исследовании принимали участие 34 подростка младшей возрастной группы 11–13 лет (12.61 ± 0.75 лет, 13 девочек и 21 мальчик) и 54 подростка старшей возрастной группы 14–16 лет (15.00 ± 0.75 лет, 20 девочек и 34 мальчика). Частотно-специфические оценки силы функциональных и эффективных связей между узлами сетей DMN, SN и CEN были получены в 6 частотных диапазонах – θ (4–7 Гц), α1 (7.5–9.5 Гц), α2 (10–13 Гц), β1 (14–18 Гц), β2 (20–27 Гц) и γ (30–40 Гц) – с помощью метода векторного авторегрессионного моделирования корковых источников ЭЭГ, зарегистрированной в состоянии покоя. Анализ функциональных связей выявил возрастные различия в θ-диапазоне частот, где сила связей между узлами всех сетей в младшей возрастной группе оказалась выше, чем в старшей группе. В диапазонах β2 и γ выявлены также половые различия: связи между узлами дефолтной сети DMN у девочек оказались сильнее, чем у мальчиков. Анализ направленных связей выявил значимое влияние возраста во всех частотных диапазонах для CEN и DMN, а для SN – во всех, кроме диапазонов β2 и γ. Наиболее выраженные возрастные изменения обнаружены для восходящих связей, направленных от более каудальных к более фронтальным областям в двух сетях CEN и DMN, причем в младшей возрастной группе сила эффективных связей больше, чем в старшей. Влияние пола на силу эффективных связей проявилось преимущественно в младшей группе и заключалось в более сильных связях в DMN и СЕN у девочек по сравнению с мальчиками.
Подростковый возраст – один из критических периодов развития, который характеризуется “резкой сменой социально-средовых факторов и их взаимодействия с процессами морфо-функционального созревания” [1]. У подростков процессы адаптации к новым физиологическим и психологическим условиям нередко протекают в форме кризиса, который проявляется в различных проблемах контроля познавательной деятельности и поведения: чаще, чем в другие периоды развития, встречается импульсивное поведение, игнорирование социальных норм, склонность к неоправданному риску и различного рода зависимостям [2–4].
Большинство исследователей сходятся в том, что “подростковые” проблемы определяются особенностями взаимодействия мозговых систем, обеспечивающих произвольный контроль и эмоционально-мотивационную регуляцию поведения [3]. Ключевыми структурами системы произвольного контроля являются различные зоны префронтальной и теменной коры, связанные с субкортикальными структурами в единую сеть [5]. Система эмоционально-мотивационной регуляции включает в себя лимбические структуры, в частности, цингулярную кору и амигдалу, мезолимбическую “систему награды” (reward system) и островок [6–9]. Различные звенья систем произвольного контроля и эмоционально-мотивационной регуляции связаны между собой многочисленными реципрокными связями [10–12].
Несмотря на интенсивные исследования регуляторных систем мозга у подростков, вопросы о балансе уровня активности отдельных компонентов этих систем, характере их взаимодействия, возрастных изменениях и половой специфике их функционирования остаются открытыми [3, 13].
Большинство сведений о мозговом обеспечении контроля поведения было получено в ходе экспериментальных и клинических исследований специфических видов деятельности. Следует подчеркнуть, что согласно современным представлениям о морфофункциональной организации мозга познавательная деятельность и целенаправленное поведение обеспечиваются крупномасштабными распределенными нейронными сетями – специфичными для конкретного вида деятельности ансамблями взаимодействующих макроскопических структур мозга [14]. Эти ансамбли являются динамическими образованиями, т.е. они формируются в процессе подготовки к деятельности и разрушаются по ее окончании. Основным механизмом формирования таких ансамблей является модуляция силы функциональных связей между их будущими участниками [15]. Вместе с тем динамическая организация распределенных нейронных сетей в процессе деятельности определяется не только целями и характером самой деятельности, но также и более жесткими видовыми (филогенетичекая модуляция) и возрастными (онтогенетическая модуляция) особенностями связей между различными структурами мозга [16] – морфофункциональной основой распределенных нейронных сетей.
Исследования статистических взаимозависимостей между спонтанными колебаниями BOLD-сигнала (Blood-oxygen-level dependent signal), отражающего уровень оксигенации крови в различных участках мозга, в состоянии покоя выявили хорошо воспроизводимые топографические паттерны, получившие название нейронных сетей покоя (resting state networks, RSN). Нейронные сети покоя – это ансамбли мозговых структур, в пределах которых статистическая связь между сигналами, получаемыми от небольших объемов мозговой ткани (вокселов), сильнее, чем связь между сигналами от вокселов, не принадлежащих этому ансамблю [17, 18]. Показано, что конфигурация сетей покоя (отдельные узлы и связи между ними) в значительной степени совпадает с конфигурацией морфологических объединений структур головного мозга, участвующих в реализации базовых когнитивных и аффективных функций [18]. В настоящее время исследователи выделяют, по меньшей мере, 10 сетей покоя, в том числе сети, связанные с контролем и регуляцией когнитивных функций и поведения [18, 19]. Можно подчеркнуть два существенных обстоятельства, указывающие на определенные преимущества анализа нейронных сетей покоя для изучения возрастных особенностей функциональной организации мозга. Во-первых, в отличие от обеспечивающих конкретные виды деятельности подвижных и специфических ансамблей мозговых структур, нейронные сети покоя представляют собой устойчивые ансамбли взаимодействующих областей. Во-вторых, клинические исследования показали, что характер связей как в пределах отдельных нейронных сетей покоя, так и между структурами, входящими в разные сети, изменяется специфическим образом при различных формах патологии ЦНС и поведения [20], что позволяет рассчитывать на их “чувствительность” к возрастным морфофункциональным преобразованиям. Вместе с тем данные о влиянии возраста и пола на силу функциональных и эффективных связей в нейронных сетях покоя противоречивы [21, 22].
Цель данной работы состоит в том, чтобы оценить, как изменяется на протяжении подросткового периода развития характер функционального взаимодействия между ключевыми кортикальными структурами, входящими в сети покоя, связанные с обеспечением произвольного контроля и эмоционально-мотивационной регуляции поведения, и выявить возможную зависимость этих изменений от половой принадлежности.
Оценка характера функционального взаимодействия между мозговыми структурами основывается на анализе сигналов, связанных с функционированием нейронов этих структур. Существующие данные о функциональных связях в пределах сетей покоя получены, главным образом, при анализе очень медленных метаболических процессов (BOLD-сигнала). Между тем для исследования морфофункциональной основы ментальных функций и поведения существенное значение имеет нарушение/сохранность синхронизации быстрых нейронных процессов в совместно функционирующих мозговых структурах [23]. Такими сигналами являются трансмембранный электрический ток и создаваемое им магнитное поле [24]. В данной работе для исследования статистических связей между структурами коры головного мозга используется электроэнцефалограмма (ЭЭГ). ЭЭГ отражает профиль потенциала на скальпе, вызванного протеканием в тканях головы суммарного экстраклеточного электрического тока, порождаемого множеством пирамидных кортикальных нейронов [24]. Объемное проведение этого экстраклеточного тока не позволяет надежно дифференцировать активность отдельных корковых зон, что является серьезным препятствием для использования электроэнцефалографического метода при оценке взаимодействий в нейронных сетях коры. Однако использование ЭЭГ высокой плотности (64 электрода и более) и численных методов решения обратной задачи электроэнцефалографии [25] позволяет достаточно надежно оценить локальную нейронную активность (токовые диполи) в небольших объемах кортикальной ткани (вокселах) [26], т.е. перейти от анализа сигналов в пространстве сенсоров к анализу сигналов в пространстве источников.
В данной работе с помощью метода векторного авторегрессионного моделирования (ВАР-моделирование) [27–29] оценивались частотно-специфические функциональные и эффективные связи между корковыми источниками, характеризующими активность областей, входящих в состав трех нейронных сетей покоя – дефолтной сети (default mode network, DMN), сети обнаружения ключевых событий (salience network, SN) и центральной управляющей сети (central executive network, CEN). Выбор именно таких сетей покоя обусловлен участием входящих в них мозговых структур в обеспечении когнитивного контроля и эмоционально-мотивационной регуляции поведения – процессов, представляющих наибольший интерес при изучении биологической основы “подростковых” проблем. DMN образуют вентральная медиальная префронтальная кора, левая и правая нижние теменные дольки, а также задняя (постцентральная) часть поясной цингулярной коры и частично предклинье [18]. Эту сеть покоя связывают с процессами переработки субъективно значимой информации (автобиографической памятью) и социальным интеллектом [30]. Показано, что взаимодействие между структурами, входящими в DMN снижается при трудностях понимания других людей и проблемах социального взаимодействия, в частности при расстройствах аутистического спектра [31]. Сеть SN включает в себя переднюю часть островка и передне-дорсальную цингулярную кору. Эта нейронная сеть покоя связана с обнаружением ключевых (salient) для текущей целесообразной деятельности событий и привлечением внимания к этим событиям [18]. Сеть CEN – третья из анализируемых в данной работе сетей покоя – включает в себя дорзо-латеральную префронтальную и теменную зоны коры, участвующие в нисходящем контроле обработки значимой информации при произвольном внимании и рабочей памяти [32].
МЕТОДИКА
В данной работе использовали индивидуальные записи фоновой ЭЭГ подростков двух возрастных групп обоих полов. Младшую группу составили 34 подростка 11–13 лет (12.61± 0.75 лет, 13 девочек и 21 мальчик), старшую возрастную группу – 54 подростка 14–16 лет (15.00 ± 0.75 лет, 20 девочек и 34 мальчика). Все подростки проходили обучение в средней общеобразовательной школе, не испытывали выраженных трудностей обучения и не демонстрировали признаков отклонений в поведении. Визуальный анализ записей ЭЭГ этих подростков не выявил существенных отклонений функционального состояния коры и глубинных структур головного мозга от возрастной нормы.
Регистрация ЭЭГ. ЭЭГ высокой плотности регистрировали в состоянии покоя с закрытыми глазами (далее – фоновая ЭЭГ) с помощью компьютерного электроэнцефалографа (Electrical Geodesics, Inc.) в полосе частот 0.1–70 Гц (частота оцифровки – 250 Гц) от 129 электродов, расположенных на шлеме HydroCel GSN (HCGSN), один из которых (вертексный электрод) использовали в качестве референтного при записи ЭЭГ.
Индивидуальные записи фоновой ЭЭГ извлекали из файлов, создаваемых программой NetStation, управляющей электроэнцефалографом, и преобразовывали к формату (*.mat) для последующей их обработки в среде Matlab/Octave. Перед количественной обработкой записи ЭЭГ просматривали с помощью специально созданного программного обеспечения, которое позволяло выделять артефактные участки для их последующего исключения из анализа.
Оценка активности корковых источников ЭЭГ. Оценку корковой активности в состоянии покоя (корковых источников фоновой ЭЭГ) выполняли в приближении распределенных источников [26]. В этом приближении в произвольный момент времени потенциал на каждом электроде определяется взвешенной суммой парциальных вкладов токовых диполей, расположенных в фиксированных небольших объемных элементах (вокселах) корковой ткани и имеющих фиксированное направление в пространстве. При использовании усредненного референта в рамках этого приближения вектор значений потенциала на электродах U = [U1, U2, …, UM]T связан с амплитудой токовых диполей J = [J1, J2, …, JN]T матричным соотношением U = LJ, в котором L представляет собой прямоугольную N × M матрицу. Для вычисления матрицы L требуется решить прямую задачу электроэцефалографии [33], что предполагает знание координат вокселов и электродов. Знание матрицы L позволяет решить обратную задачу электроэнцефалографии [25] – определить “восстанавливающую” матрицу W, позволяющую оценить распределение величины дипольного момента по всем N вокселам. Для каждого момента времени t вектор-столбец оцененных значений плотности тока $\hat {J}(t)$ вычисляется с помощью умножения слева вектора-столбца потенциалов $U(t)$ на “восстанавливающую” матрицу W:
Таким образом, умножение на матрицу W превращает M физически регистрируемых непрерывно зависящих от времени потенциалов (вектор $U(t)$) в N локализованных в вокселах корковых источников этих потенциалов (вектор $\hat {J}(t)$).Все вычисления в данной работе осуществляли в программной среде Matlab/Octave. Матрица L была вычислена с использованием функциональности программной системы spm8 [34]. Для вычисления матрицы W использовали алгоритм e-LORETA [35], позволяющий найти сглаженную в пространстве вокселов оценку распределения $\hat {J}(t).$ При этом использовали усредненные координаты сенсоров шлема HydroCel GSN (www.egi.com) и стандартную геометрию черепа и головного мозга (ICBM-152).
Оценка функциональных и эффективных корковых связей. Для оценки силы корковых взаимодействий использовали векторную авторегрессионную модель – ВАР-модель [28]. ВАР-модель описывает статистическую структуру многоканального сигнала, исходя из того, что в произвольный дискретный момент времени $n$ вектор $x(n) = {{[{{x}_{1}}(n),{{x}_{2}}(n), \ldots ,{{x}_{M}}(n)]}^{T}}$ (надстрочное “T” соответствует операции транспонирования), образованный значениями сигнала в каждом из М каналов, с точностью до белого гауссового шума $e(n) = {{[{{e}_{1}}(n),{{e}_{2}}(n), \ldots ,{{e}_{M}}(n)]}^{T}}$ определяется линейной комбинацией прошлых значений этого сигнала:
В выражении (2) верхний предел суммирования $P$ соответствует порядку модели (числу предыдущих отсчетов, с помощью которых предсказывается текущий отсчет), а последовательность квадратных матриц $a(p)$ размерности M содержит подлежащие определению коэффициенты авторегрессии ${{a}_{{km}}}(p).$В частотной области, М-канальная ВАР-модель сводится к простому умножению матриц:
где заглавными буквами $X(f)$ и $E(f)$ обозначены векторы Фурье-образов, соответственно, $x(n)$ и $e(n),$ а матричные элементы $H(f)$ являются частотными фильтрами, зависящими от коэффициентов $a(p).$ Таким образом, ВАР-модель утверждает, что наблюдаемый в каждом канале сигнал образуются за счет смешения результатов частотной фильтрации M независимых белых гауссовых шумов.Спектральная матрица, содержащая авто- и кросс-спектры, следующим образом выражается через матрицу $H(f)$ и ковариационную матрицу шумов ${{C}_{{ee}}}{\text{:}}$
(надстрочное “H” – означает эрмитово сопряжение). Из выражения (4) следует, что если белые гауссовые шумы в разных каналах статистически независимы, то сигнал в каждом канале представляет собой сумму независимых вкладов всех M каналов:(5)
${{S}_{{kk}}}(f) = \sum\limits_{m = 1}^{m = M} {\sigma _{{mm}}^{2}{{{\left| {{{H}_{{km}}}(f)} \right|}}^{2}}} .$Степень влияния одного канала на другой (направленной влияние) удобно оценить с помощью функции направленной когерентности (directed coherence, DC), вычисляемой по формуле:
и предложенной в работе [29]. Как следует из приведенной формулы, на заданной частоте f для любых двух каналов с индексами m и k функция $D{{C}_{{mk}}}(f)$ показывает, какая доля сигнала, наблюдаемого в канале m, связана с фильтрованным белым шумом, порожденным в канале k. Спектральная матрица $S(f)$ позволяет также вычислить меру функционального взаимодействия – функцию когерентности:Области интереса. В данной работе функцию когерентности и функцию направленной когерентности использовали для оценки, соответственно, функционального и эффективного взаимодействия в пределах нескольких участков корковой ткани – заранее выбранных областей интереса (regions of interest, ROI). Следуя работе [36], в качестве областей интереса мы выбрали следующие 6 корковых зон по 2 для каждой сети (в квадратных скобках даны MNI-координаты центров этих областей): для сети управляющего контроля CEN были выбраны участок правой латеральной префронтальной коры (R-LPFC: [38, 16, 50 ]) и участок правой латеральной теменной коры (R-LPC: [45, –64, 40]); для сети обнаружения ключевых событий SN были выбраны участок дорсальной передней цингулярной коры (dACC: [1, 9, 52]) и участок фронто-островкового комплекса (FIC: [49, 13, –6]); для дефолтной сети DMN выбрали участок медиальной префронтальной коры (MPFC: [–2, 53, 5]) и участок задней цингулярной коры (PCC: [–1, –61, 16]).
Каждой области интереса ставился в соответствие один сигнал (один временнóй ряд), интегрально характеризующий совокупную активность всех вокселов, заключенных в пределах сферы радиусом 1 см, построенной вокруг центра этой области. В качестве этого сигнала использовали первый главный компонент (компонент с наибольшей дисперсией), найденный с помощью метода принципиальных компонентов (Principal Component Analysis, PCA). Таким образом, в пространстве источников, активность выбранных областей интереса характеризовалась шестиканальным временны́ м рядом (по числу ROI), а взаимодействие между этими областями описывалось шестиканальной ВАР-моделью.
Статистический анализ данных. Длительность безартефактной записи ЭЭГ в общем случае различна у разных испытуемых, соответственно, различны и длительности сигналов, характеризующих активность корковых источников. Если оценивать функцию $D{{C}_{{mk}}}(f)$ (или $CO{{H}_{{mk}}}(f)$), используя авторегрессионные коэффициенты, вычисленные для записей сигнала разной длины, то эти оценки будут подвержены статистическому смещению – чем короче запись, тем больше величина смещения (наглядный пример смещения приведен в обзорной работе [28]). Для того чтобы статистическое смещение функции $D{{C}_{{mk}}}(f)$ (или $CO{{H}_{{mk}}}(f)$) не влияло на анализ групповых данных, коэффициенты авторегрессии оценивали по отрезкам сигнала одинаковой для всех испытуемых длины, что обеспечивало одинаковую для всех индивидуальных данных величину статистического смещения. Это достигалось следующим образом. Активность в ROI, оцененная по безартефактным участкам фоновой ЭЭГ каждого испытуемого, разбивали на неперекрывающиеся отрезки секундной длительности. Из множества таких отрезков формировали последовательности по 10 отрезков в каждой. Число таких последовательностей N оказывалось разным для разных испытуемых. Для каждой такой последовательности из 10 отрезков строили отдельную, парциальную ВАР-модель. Можно отметить, что поскольку отдельные секундные отрезки в такой последовательности не составляли непрерывной записи, для построения ВАР-модели использовали алгоритмы, описанные в [37] и доступные в виде готовых и отлаженных программных процедур.
Для каждой из парциальных ВАР-моделей вычислялись соответствующие ей оценки функции $DC_{{mk}}^{{(i)}}(f)$ и $COH_{{mk}}^{{(i)}}(f),$ где i – порядковый номер парциальной модели, варьирующий от 1 до N. В результате каждый испытуемый характеризовался усредненной по всем N моделям функцией направленной когерентности:
и обычной функцией когерентности: Дальнейшему статистическому анализу подвергались значения этих функций в шести частотных диапазонах: θ (4–7 Гц), α1 (7.5–9.5 Гц), α2 (10–13 Гц), β1 (14–18 Гц), β2 (20–27 Гц) и γ (30–40 Гц). Статистический анализ этих данных выполняли с помощью дисперсионного анализа по схеме с повторными измерениями (rmANOVA). Ниже при описании результатов статистического анализа помимо значимости (p-величина) приводятся величины ${\eta }_{p}^{2}$ (частная эта-квадрат), характеризующие размер наблюдаемого эффекта.РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Функциональные связи. Силы функциональных связей между парами узлов (значения функции когерентности, COH) в каждой из трех нейронных сетей покоя (CEN, SN и DMN) анализировались с помощью дисперсионного анализа, выполненного по схеме с повторными измерениями (rmANOVA), которая включала внутри-индивидуальный фактор СЕТЬ (CEN, SN и DMN) и меж-индивидуальные факторы ВОЗРАСТНАЯ ГРУППА (подростки 11–13 лет, подростки 14–16 лет) и ПОЛ (девочки, мальчики). Анализ COH по этой схеме проводился отдельно в каждом из 6 частотных диапазонов (θ, α1, α2, β1, β2 и γ).
Во всех шести частотных диапазонах обнаружен высоко значимый главный эффект фактора СЕТЬ (табл. 1). Из рис. 1 видно, что для трех сетей CEN, SN и DMN характерны существенно различные значения COH: самое высокое значение наблюдается в DMN, а самое низкое – в CEN.
Таблица 1.
Главный эффект фактора СЕТЬ на величину COH, характеризующую функциональные связи по отдельным частотным диапазонам ЭЭГ
| Диапазон | F (2, 83) | p | ${\eta }_{p}^{2}$ |
|---|---|---|---|
| θ | 97.849 | <0.0005 | 0.558 |
| α1 | 92.524 | <0.0005 | 0.690 |
| α2 | 95.124 | <0.0005 | 0.696 |
| β1 | 96.877 | <0.0005 | 0.700 |
| β2 | 105.224 | <0.0005 | 0.717 |
| γ | 93.058 | <0.0005 | 0.692 |
Рис. 1.
Средние по группам значения COH (вертикальная ось) между зонами, входящими в CEN (А), SN (Б) и DMN (В) в разных частотных диапазонах ЭЭГ у девушек (а) и юношей (б) двух возрастных групп 11–13 и 14–16 лет.

Попарные сравнения с помощью теста Стьюдента показали, что значения COH в каждом из 6 частотных диапазонов значимо различаются во всех парах, образованных из трех сетей CEN, SN и DMN (кроме одного случая p = 0.018, все p < < 0.0005).
Значимый главный эффект фактора ВОЗРАСТНАЯ ГРУППА обнаружен только в θ (F(1, 84) = = 4.434, p = 0.038, ${\eta }_{p}^{2}$ = 0.050) и α1 (F(1, 84) = 4.178, p = 0.044, ${\eta }_{p}^{2}$ = 0.047) диапазонах частот. В диапазонах α2 (F(1, 84) = 3.508, p = 0.065, ${\eta }_{p}^{2}$ = 0.040) и β1 (F(1, 84) = 3.403, p = 0.069, ${\eta }_{p}^{2}$ = 0.039) обнаруживается лишь тенденция к влиянию этого фактора. В наиболее высокочастотных диапазонах β2 и γ главного эффекта фактора ВОЗРАСТНАЯ ГРУППА не обнаружено (p > 0.3). В то же время, в этих двух диапазонах начинает сказываться влияние фактора ПОЛ. В диапазоне β2 выявлено значимое взаимодействие факторов СЕТЬ и ПОЛ (F(2, 83) = 5.660, p = 0.005, ${\eta }_{p}^{2}$ = 0.120), а в диапазоне γ обнаружена тенденция к такому взаимодействию (F(2, 83) = 2.999, p = 0.055, ${\eta }_{p}^{2}$ = 0.067). Парные сравнения в β2 диапазоне показали, что наличие значимого взаимодействия факторов ПОЛ и СЕТЬ связано с тем, что половые различия в величинах COH отсутствуют для сетей CEN (t(86) = 0.575, p = 0.567) и SN (t(86) = 0.109, p = = 0.914), но достигают уровня значимости в случае дефолтной сети DMN (t(86) = 2.218, p = 0.031).
Результаты описанного выше анализа функциональных связей в трех нейронных сетях покоя можно кратко подытожить следующим образом:
– Для всех исследованных диапазонов обнаружены различия между силой внутри-сетевых связей в состоянии покоя: максимальная сила связей наблюдалась между узлами дефолтной сети, т.е. между медиальной префронтальной и задней цингулярной корой, минимальная – между узлами сети когнитивного контроля, т.е. между латеральной префронтальной и латеральной теменной зонами коры правого полушария.
– Для диапазона θ выявлены возрастные различия в силе функциональных связей, при этом сила функциональных связей между узлами всех исследованных сетей выше в младшей возрастной группе.
– Для относительно высокочастотных диапазонов выявлены половые различия, которые заключаются в более сильной связи между узлами дефолтной сети у девочек по сравнению с мальчиками.
Эффективные связи. Силы эффективных связей в пределах трех нейронных сетей покоя и шести частотных диапазонов были подвергнуты общему дисперсионному анализу по схеме с повторными измерениями. В отличие от анализа функциональных связей, при анализе эффективных связей в качестве одного из внутри-индивидуальных факторов использовался фактор НАПРАВЛЕНИЕ (влияние второго узла на первый 1 ← 2, далее условно обозначенное как “восходящее”, влияние первого узла на второй 2 ← 1, далее условно обозначенное как “нисходящее”). Для всех сетей узел “1” соответствовал фронтальным зонам коры, а узел “2” – зонам теменной или цингулярной коры. Кроме этого, в схему дисперсионного анализа включались внутри-индивидуальные факторы СЕТЬ (CEN, SN и DMN) и ДИАПАЗОН (θ, α1, α2, β1, β2 и γ). Межиндивидуальными факторами служили ВОЗРАСТНАЯ ГРУППА (подростки 11–13 лет, подростки 14–16 лет) и ПОЛ (девочки, мальчики).
Этот анализ обнаружил высоко значимое влияние фактора ВОЗРАСТНАЯ ГРУППА (F(1, 84) = = 12.087, p = 0.001, ${\eta }_{p}^{2}$ = 0.126) и влияние фактора ПОЛ на уровне тенденции (F(1, 84) = 3.002, p = = 0.087, ${\eta }_{p}^{2}$ = 0.035). Главный эффект каждого из трех внутри-индивидуальных факторов СЕТЬ (F(1, 84) = 148.865, p < 0.0005, ${\eta }_{p}^{2}$ = 0.782), ДИАПАЗОН (F(5, 80) = 133.737, p < 0.0005, ${\eta }_{p}^{2}$ = 0.893) и НАПРАВЛЕНИЕ (F(1, 84) = 177.590, p < 0.0005, ${\eta }_{p}^{2}$ = 0.679) оказался высоко значимым. Оказались высоко значимыми также два двойных СЕТЬ × × ДИАПАЗОН (F(10, 75) = 13.578, p < 0.0005, ${\eta }_{p}^{2}$ = 0.644) и СЕТЬ × НАПРАВЛЕНИЕ (F(2, 83) = = 97.616, p < 0.0005, ${\eta }_{p}^{2}$ = 0.702) и одно тройное взаимодействие СЕТЬ × ДИАПАЗОН × НАПРАВЛЕНИЕ (F(10, 75) = 5.675, p < 0.0005, ${\eta }_{p}^{2}$ = = 0.431) внутри-индивидуальных факторов. Значимыми оказались одно двойное НАПРАВЛЕНИЕ × ВОЗРАСТНАЯ ГРУППА (F(1, 84) = = 5.685, p = .019, ${\eta }_{p}^{2}$ = 0.063) и одно тройное СЕТЬ × НАПРАВЛЕНИЕ × ВОЗРАСТНАЯ ГРУППА (F(2, 83) = 3.107, p = 0.05, ${\eta }_{p}^{2}$ = 0.070) взаимодействия с участием фактора ВОЗРАСТНАЯ ГРУППА. Наконец, этот анализ выявил одно тройное взаимодействие, в котором участвуют факторы СЕТЬ, ВОЗРАСТНАЯ ГРУППА и ПОЛ (F(2,83) = 3.577, p = 0.032, ${\eta }_{p}^{2}$ = 0.079).
Характер полученных эффектов иллюстрирует рис. 2.
Рис. 2.
Средние по группам значения DC (вертикальная ось) между зонами, входящими в CEN (А), SN (Б) и DMN (В) в разных частотных диапазонах ЭЭГ у девушек (а) и юношей (б) двух возрастных групп 11–13 и 14–16 лет. 1 – восходящие связи (от более каудальных зон к более фронтальным), 2 – нисходящие связи.
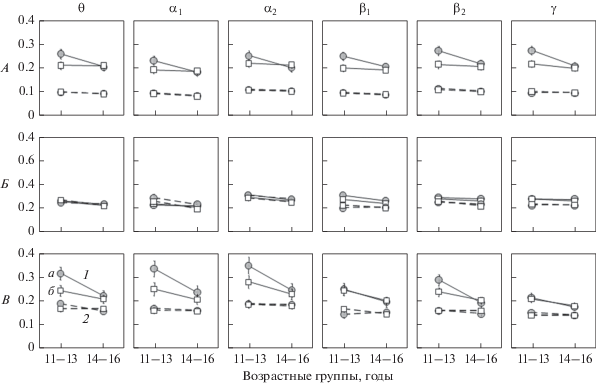
Результаты описанного выше дисперсионного анализа свидетельствуют о различии в паттерне направленных влияний в сетях CEN, SN и DMN и чувствительности этого различия к частотному диапазону. Так, из рис. 2 видно, что различие в величине направленной когерентности между двумя направлениями влияния максимально в сети CEN и минимально в сети SN. Из рис. 2 видно также, что в случае дефолтной сети DMN величина направленной когерентности в среднем выше в трех низкочастотных диапазонах, чем в трех высокочастотных.
Для выяснения деталей влияния возраста и пола подростков на внутрисетевые направленные связи значения функции направленной когерентности в парах узлов анализировались отдельно в каждой из трех нейронных сетей покоя (CEN, SN и DMN) и отдельно для каждого частотного диапазона с помощью дисперсионного анализа, выполненного по схеме с повторными измерениями (rmANOVA). В качестве внутрииндивидуального фактора использовался фактор НАПРАВЛЕНИЕ (восходящее, нисходящее), а межиндивидуальными факторами служили ВОЗРАСТНАЯ ГРУППА (подростки 11–13 лет, подростки 14–16 лет) и ПОЛ (девочки, мальчики).
Значимые влияния межиндивидуальных и внутрииндивидуальных факторов представлены в табл. 2, 3 и 4.
Таблица 2.
Главный эффект фактора НАПРАВЛЕНИЕ на величину DC, характеризующую эффективные связи для трех нейронных сетей покоя CEN, SN и DMN в разных частотных диапазонах ЭЭГ
| Частотный диапазон |
CEN | SN | DMN |
|---|---|---|---|
| F(1, 84)/p/${\eta }_{p}^{2}$ | F(1, 84)/p/${\eta }_{p}^{2}$ | F(1, 84)/p/${\eta }_{p}^{2}$ | |
| θ | 205.443 <0.0005 0.710 |
NS | 36.656 <0.0005 0.304 |
| α1 | 174.118 <0.0005 0.675 |
NS | 39.047 <0.0005 0.317 |
| α2 | 163.611 <0.0005 0.661 |
NS | 33.355 <0.0005 0.284 |
| β1 | 234.441 <0.0005 0.736 |
51.777 <0.0005 0.381 |
38.929 <0.0005 0.317 |
| β2 | 191.098 <0.0005 0.695 |
15.408 <0.0005 0.155 |
54.020 <0.0005 0.391 |
| γ | 52.320 <0.0005 0.384 |
36.010 <0.0005 0.300 |
52.320 <0.0005 0.384 |
Таблица 3.
Главный эффект фактора ВОЗРАСТНАЯ ГРУППА на эффективные связи для трех нейронных сетей покоя CEN, SN и DMN
| Частотный диапазон |
CEN | SN | DMN |
|---|---|---|---|
| F(1, 84)/p/${\eta }_{p}^{2}$ | F(1, 84)/p/${\eta }_{p}^{2}$ | F(1, 84)/p/${\eta }_{p}^{2}$ | |
| θ | 5.327 0.023 0.060 |
7.039 0.010 0.077 |
11.235 0.001 0.118 |
| α1 | 5.738 0.019 0.054 |
6.395 0.013 0.071 |
6.443 0.013 0.071 |
| α2 | 4.350 0.040 0.049 |
4.599 0.035 0.052 |
7.983 0.005 0.087 |
| β1 | 4.918 0.029 0.055 |
4.170 0.044 0.047 |
5.369 0.023 0.060 |
| β2 | 7.514 0.007 0.082 |
NS | 9.327 0.003 0.100 |
| γ | 5.183 0.025 0.058 |
NS | 5.183 0.025 0.058 |
Примечание: обозначения см. табл. 2.
Таблица 4.
Главный эффект фактора ПОЛ на эффективные связи для трех нейронных сетей покоя CEN, SN и DMN
| Частотный диапазон |
CEN | SN | DMN |
|---|---|---|---|
| F(1, 84)/p/η2 | F(1, 84)/p/η2 | F(1, 84)/p/η2 | |
| θ | NS | NS | 4.158 0.045 0.047 |
| α1 | NS | NS | 4.437 0.038 0.050 |
| α2 | NS | NS | NS |
| β1 | 5.586 0.020 0.062 |
NS | NS |
| β2 | 6.082 0.016 0.068 |
NS | NS |
| γ | NS | NS | NS |
Примечание: обозначения см. табл. 2.
Результаты описанного выше анализа эффективных (направленных) связей в трех нейронных сетях покоя можно кратко подытожить следующим образом:
– Все три исследованные нейронные сети демонстрируют значимую асимметрию в направленном влиянии двух узлов сети друг на друга. В сети когнитивного контроля CEN наблюдается наибольшая асимметрия: восходящее влияние правой латеральной теменной коры (R-LPC) на правую латеральную префронтальную кору (R-LPFC) существенно больше, чем обратное влияние. Наименьшая асимметрия направленных влияний наблюдается в сети обнаружения ключевых событий SN, где дорсальная передняя цингулярная кора (dACC) и фронто-островковый комплекс (FIC) влияют друг на друга приблизительно с одинаковой силой.
– Силы направленных связей значимо зависят от возраста для всех трех сетей CEN, SN и DMN. Для CEN и DMN влияние возраста значимо во всех частотных диапазонах, а для сети SN – во всех, кроме β2 и γ. Из рис. 2 видно, что наиболее выраженные изменения при переходе от младших подростков к старшим претерпевают восходящие связи: от правой латеральной теменной коры (R-LPC) к правой латеральной префронтальной коре (R-LPFC) в CEN и от задней цингулярной коры (PCC) к медиальной префронтальной коре (MPFC) в DMN. Видно также, что возрастные изменения силы влияний, обратных указанным выше, либо отсутствуют, либо выражены существенно слабее. Наконец, возрастные изменения неодинаковы для двух полов. Влияние фактора ПОЛ оказалось значимым для сети CEN (в диапазонах β1 и β2) и для сети DMN (в диапазонах θ и α1). Хотя взаимодействие факторов ПОЛ и ВОЗРАСТНАЯ ГРУППА не достигают уровня значимости в post hoc-анализах, из рис. 2 видно, что в старшей возрастной группе значения направленной когерентности практически не зависят от пола, в то время как в младшей возрастной группе сила направленных связей выше у девочек в CEN и DMN (в последней везде, кроме диапазонов β1 и γ). В исследованном возрастном диапазоне в сети CEN у девочек наблюдается уменьшение влияния правой латеральной теменной коры (R-LPC) на правую латеральную префронтальную кору (R-LPFC), а у мальчиков такие изменения отсутствуют. В дефолтной сети DMN, как у мальчиков, так и у девочек, с возрастом снижается сила восходящих влияний задней цингулярной коры (PCC) на медиальную префронтальную кору (MPFC), причем у девочек это изменении выражено сильнее, поскольку величина этого влияния в младшей возрастной группе у девочек выше, чем у мальчиков.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Помимо результатов, связанных с исходной целью данного исследования – оценкой влияния возраста и пола на силу функциональных и эффективных связей между узлами трех нейронных сетей покоя, – мы получили данные, касающиеся структуры каждой из сетей. Оказалось, что, по крайней мере, в двух сетях DMN и CEN связи между центрами асимметричны. При этом асимметрия неодинакова в трех сетях, и ее степень изменяется с возрастом. Об этом говорят высоко значимый эффект фактора НАПРАВЛЕНИЕ и наличие значимых взаимодействий НАПРАВЛЕНИЕ × ВОЗРАСТНАЯ ГРУППА и СЕТЬ × НАПРАВЛЕНИЕ × ВОЗРАСТНАЯ ГРУППА. В какой мере этот результат соответствует литературным данным? Наиболее изученной в этом отношении является дефолтная сеть DMN и наиболее подходящими для сравнения с нашими данными являются результаты ряда фМРТ-исследований, в которых анализировались спонтанные колебания BOLD-сигнала в этой сети [22, 30, 38, 39]. Эффективные связи между основными четырьмя узлами DMN – задней цингулярной корой PCC, медиальной префронтальной корой MPFC и латерально симметричными внутри-теменными областями (LIPC, RIPC) – были оценены в работах [30, 38, 39], в которых использовались различные варианты метода динамического причинно-следственного моделирования (DCM – dynamic causal modelling). Для оценки силы эффективных связей в работе [39] с помощью DCM из 8 различных вариантов связей между четырьмя узлами сети DMN выбирался один, наилучшим образом объясняющий зарегистрированные спонтанные колебания BOLD-сигнала. Наилучшей оказалась модель, в которой наиболее сильными связями были те, что соответствовали влиянию LIPC и RIPC на MPFC и PCC, в то время как MPFC и PCC связаны слабыми реципрокными возбуждающими связями. В выполненном ранее похожем исследовании [38] наилучшая структура связей была иной: MPFC оказывала на PCC существенное прямое одностороннее возбуждающее влияние, а обратного влияния PCC на MPFC не было. Кроме того, эта структура характеризовалась существенной латеральной асимметрией: левая внутритеменная кора LIPC не оказывала практически никакого влияния (и не подвергалась никакому влиянию со стороны остальных узлов), зато правая внутритеменная кора RIPC оказывала сильное одностороннее возбуждающее влияние как на MPFC, так и на PCC. Исследование структуры связей DMN было выполнено также в работе [30]. Авторы этой работы анализировали колебания BOLD-сигнала не только в основных узлах дефолтной сети DMN (PCC, MPFC, IPL), но также и в более широком ансамбле мозговых структур, активирующихся при переработке информации, отнесенной к собственному “я” (self-referential processes). Анализ проводился с использованием детерминистического варианта DCM, и состоял в выборе наилучшей модели (наиболее соответствующей полученным данным) из набора 32 моделей-кандидатов. Этот анализ показал, что эффективные связи между медиальной префронтальной корой MPFC и задней цингулярной корой PCC существенно несимметричны: PCC оказывает возбуждающее влияние на MPFC, а противоположное влияние MPFC на PCC является тормозным. Если учесть не только прямое, но также и косвенное влияние PCC на MPFC через структуру IPL, которое фактически является однонаправленным и носит возбудительный характер, то суммарное влияние PCC на MPFC окажется не только иного знака, но и более сильным по абсолютной величине. Наконец, стоит упомянуть еще одно исследование [22], в котором, правда, моделировались взаимодействия не только в пределах дефолтной сети DMN, но и между узлами трех сетей DMN, SN и DAN (dorsal attention network – дорзальной сети внимания). В этом исследовании не было выявлено никакого прямого значимого взаимного влияния между PCC и MPFC. Помимо перечисленных выше исследований, сила межцентральных связей в трех сетях DMN, CEN и SN была оценена также в работе [40], в которой анализировались флуктуации BOLD-сигнала, зарегистрированного в состоянии покоя, но использовался другой метод – метод восстановления причинно-следственных связей по Грэйнджеру. В этой работе было выявлено наличие симметричных реципрокных слабых связей между R-LPFC и R-LPC в сети CEN, более выраженных и также симметричных реципрокных связей между MPFC и PCC в сети DMN и асимметричных связей между FIC и dACC с существенным преобладанием влияния FIC на dACC.
Как следует из рассмотренного выше, данные относительно структуры эффективных связей в сетях DMN, CEN и SN противоречивы. В частности, что касается сети DMN, то от работы к работе варьирует оценка не только преимущественного направления влияния (PCC на MPFC или MPFC на PCC), но также знак влияния (возбуждающее, тормозное) и его абсолютная сила. Полученные нами результаты в отношении асимметрии направленных влияний в дефолтной сети качественно наиболее близки к тем, что получены в работе [30]. Согласно данным этой работы PCC на MPFC оказывает возбуждающее влияние, а MPFC на PCC – тормозное, а результат данного исследования состоит в том, что влияние PCC на MPFC в полтора-два раза выше, чем влияние MPFC на PCC. Почему можно говорить о качественном сходстве этих двух, на первый взгляд, непохожих результатов? Тормозные влияния относятся к числу существенно нелинейных эффектов, которые успешно моделируются в рамках метода DCM [41]. Особенность ВАР-модели заключается в том, что она позволяет оценить степень линейной статистической взаимосвязи между сигналами (здесь есть сходство с коэффициентом линейной корреляции и функцией когерентности) и не опирается на какие-либо предположения о природе этих сигналов. Поэтому можно предположить, что в рамках линейной ВАР-модели нелинейное тормозное влияние MPFC на PCC будет выглядеть как ослабление влияния MPFC на PCC. Причем ослабление будет тем большим, чем сильнее тормозное влияние.
Важно также учесть и другие ограничения, которые налагают особенности используемых методов на сопоставимость наших результатов и результатов цитируемых работ. Прежде всего, в работе [30] и большинстве остальных цитируемых выше работ анализировался BOLD-сигнал, лишь косвенно отражающий биоэлектрические процессы. Напротив, в нашей работе силы функциональных и эффективных связей оценивались на основе ЭЭГ, непосредственно связанной с биоэлектрическими процессами в корковых нейронах. Кроме того, в нашей работе использована направленная когерентность – частотно-специфическая мера взаимного направленного влияния между каналами, – в то время как метод DCM дает лишь не зависящую от частоты оценку весового коэффициента. Наконец, следует отметить, что при неполном учете всех истинных участников взаимодействия, т.е. в рамках редуцированной модели, влияния пропущенных участников системы приписываются взаимодействиям между немногими моделируемыми участниками (это относится в равной степени и к ВАР-моделированию, и к DCM). Все сказанное выше относительно сопоставимости результатов ВАР-моделирования и DCM относится, конечно, не только к сети DMN, но и в равной мере к двум другим сетям CEN и SN.
Выполненное в данной работе сравнение двух возрастных групп подростков показало наличие поло-возрастных различий как в характере функциональных, так и в характере эффективных связей между парами корковых областей, принадлежащих трем нейронным сетям покоя DMN, SN и CEN. Основные морфологические изменения, связанные с развитием головного мозга и приходящиеся на подростковый период, заключаются в процессах арборизации аксонов и дендритов, конкурентной элиминации (competitive elimination) синаптических контактов и в миелинизации аксонов [42, 43]. Все три процесса в принципе способны оказать влияние на характер анатомических связей (как локальных, так и дистантных) в нейронных сетях мозга. Соответственно, такие обусловленные созреванием преобразования структуры морфологических связей могут проявиться в изменении паттерна измеряемых в состоянии покоя функциональных и эффективных связей, которые мы наблюдали в данной работе. Возрастные изменения в структуре нейронных сетей покоя исследовались достаточно интенсивно [21, 22, 44–48]. Как правило, такие исследования проводились в широком возрастном диапазоне (от младшего школьного возраста до взрослости) и в них дополнительно оценивали влияние пола. Основным методом в них служила оценка силы функциональных связей на основе вычисления линейной корреляции между спонтанными колебаниями BOLD-сигнала в узлах исследуемых нейронных сетей покоя (реже оценивали эффективные связи).
В целом, опубликованные результаты возрастных исследований не позволяют построить однозначную картину изменений структуры нейронных сетей покоя в подростковом периоде и влияния на нее пола подростков. В литературе можно встретить весь спектр данных о возрастной динамике функционального взаимодействия структур мозга в сетях покоя. Так, в работе [44] было обнаружено, что в нейронных сетях покоя DMN, CEN и SN сила функциональных и эффективных внутрисетевых связей, оцененных по спонтанным флуктуациям BOLD-сигнала, увеличивается с возрастом. В лонгитюдном исследовании [45] анализировались функциональные внутри- и межсетевые связи в DMN и CEN в раннем подростковом периоде. Общая тенденция состояла в том, что в возрастном интервале от 10 до 13 лет функциональные связи между узлами одной и той же сети покоя становятся более сильными, а связи между узлами разных сетей, напротив, ослабевают. Следует отметить, что особенность цитированной работы состояла в том, что флуктуации BOLD-сигнала регистрировались не в состоянии покоя, а во время прослушивания бессмысленной квазиречи, составленной из реальных слогов. В то же время в работе [21] при исследовании функциональных связей в 6 сетях покоя, включая DMN, CEN, SN в широком возрастном диапазоне от 7 до 18 лет были обнаружены разнонаправленные изменения корреляционной связи между узлами сетей, но не было обнаружено ни влияния пола, ни сочетанного влияния факторов возраста и пола. В работе [22], в которой были проанализированы спонтанные колебания BOLD-сигнала у большой группы (404 чел.) подростков и молодых взрослых в возрастном диапазоне от 14 до 23 лет, не было обнаружено влияния ни возраста, ни пола на величину оцениваемых в этой работе эффективных связей между областями коры. Вместе с тем, в работе [46], также выполненной на основе анализа спонтанных колебаний BOLD-сигнала с участием большого числа здоровых испытуемых 12–70 лет (601 чел.), сообщается о снижении функционального взаимодействия с возрастом и более сильном взаимодействии между узлами внутри отдельных сетей покоя у женщин, чем у мужчин. Еще в одном популяционном исследовании (494 чел.) сообщается о разнонаправленных различиях в силе функциональных связей в сетях покоя у молодых (22–36) мужчин и женщин в зависимости от локализации связей. Возрастные изменения в этом исследовании наблюдались в ограниченном числе связей, но там, где они были, речь шла об их снижении [47].
Результаты данного исследования указывают на достаточно выраженные и зависящие от пола изменения в силе эффективных связей в трех нейронных сетях покоя DMN, CEN и SN при сравнении подростков младшей (11–13 лет) и старшей (14–16 лет) возрастных групп. При этом зависимость от пола наиболее заметна в DMN и CEN (рис. 2 и табл. 4) и характерна преимущественно для младшей возрастной группы (рис. 2). Таким образом, полученные в работе данные согласуются с результатами тех исследований, которые указывают на присутствие возрастных изменений в сетях покоя и их связанную с полом специфичность. При этом наши данные показывают, что сила эффективных связей, как и сила функциональных связей, на протяжении подросткового периода либо уменьшается, либо остается постоянной.
Некоторые возможные причины несоответствия результатов нашего ЭЭГ-исследования и части литературных данных, полученных при исследовании гемодинамических процессов, мы уже упомянули выше при обсуждении вопроса о степени асимметрии эффективных связей в трех исследуемых нейронных сетях покоя. Не исключено, что возрастные изменения силы функциональных и эффективных связей, не являются глобальным мозговым эффектом, и различаются по силе и даже направлению для связей разной природы. Так, ЭЭГ-исследование корково-корковых взаимодействий в покое в широком возрастном диапазоне от 2 мес. до 16.67 лет [48] указывает на возможность снижения функциональных связей с возрастом в том случае, если речь идет о дистантных взаимодействиях, морфологическим субстратом которых являются проводящие корково-корковые пути в глубине белого вещества полушарий. Снижение силы функциональных связей в работе [48] связывается с уменьшением с возрастом количества синаптических контактов в системах, объединенных длинными проводящими путями. Можно предположить, что наблюдаемое уменьшение силы функциональных и эффективных связей между корковыми узлами сетей покоя частично объясняются интенсивной элиминацией синаптических контактов в коре головного мозга в подростковом возрасте [49, 50]. В частности, обнаруженное нами снижение силы восходящих влияний на префронтальные области коры может быть связано с возрастным уменьшением количества возбуждающих синапсов в этих структурах [51].
Выявленные в работе половые различия в силе функциональных связей – большая их сила у девочек по сравнению с мальчиками – вполне согласуются с приведенными выше данными [46, 47], а также результатами работы [52], выполненной с участием взрослых испытуемых. Анализ эффективных связей позволил обнаружить, что половые различия касаются прежде всего взаимодействия между узлами дефолтной сети – задней цингулярной и медиальной префронтальной зон коры. Более сильные взаимодействия в нейронных сетях покоя у девочек и взрослых женщин, особенно в дефолтной сети, узлы которой входят в мезолимбическую модулирующую систему, могут быть обусловлены активирующим влиянием женских половых гормонов (эстрогенов) на молекулярные рецепторы дофамина [53]. Учитывая более раннее наступление пубертатного периода у девочек [1], преобладание половых различий восходящих эффективных связей в младшей группе (11–13 лет) можно связать с всплеском активирующего влияния половых гормонов на возбуждающие дофаминовые рецепторы в нейронных сетях префронтальной коры [54].
Какое значение могут иметь полученные результаты для понимания основной проблемы подросткового периода – проблемы баланса когнитивного и эмоционально-мотивационного контроля поведения? Можно полагать, что полученные в исследовании данные свидетельствуют в пользу снижения с возрастом восходящих влияний каудальных корковых узлов регуляторных систем мозга на префронтальные, в том числе восходящих влияний от корковых отделов лимбической системы, связанной с аффективными аспектами поведения.
ЗАКЛЮЧЕНИЕ
В данной работе был выполнен анализ функциональных и эффективных связей между узлами трех нейронных сетей покоя DMN, CEN и SN у подростков 11–13 и 14–16 лет. Сила частотно-специфических функциональных и эффективных связей вычислялась в электроэнцефалографическом диапазоне частот (4–40 Гц) на основе векторного авторегрессионного моделирования сигналов корковых источников, соответствующих узлам сетей DMN, CEN и SN и оцененных на основе многоканальной ЭЭГ с помощью решения обратной задачи электроэнцефалографии для случая распределенных источников.
Наиболее общий результат такого анализа состоит в том, что сила этих связей изменяется с возрастом и зависит от пола подростка.
Анализ функциональных связей выявил возрастные различия в θ-диапазоне частот, причем сила функциональных связей между узлами всех исследованных сетей в младшей возрастной группе выше, чем в старшей группе. При этом в относительно высокочастотных диапазонах (20–40 Гц) выявлены половые различия, которые заключаются в более сильной связи между узлами дефолтной сети DMN у девочек по сравнению с мальчиками.
При анализе направленных связей была обнаружена статистически значимая зависимость от возраста для всех трех нейронных сетей покоя CEN, SN и DMN. При этом влияние возраста оказалось значимо во всех частотных диапазонах для CEN и DMN, а для SN – во всех, кроме диапазонов β2 и γ. Наиболее выраженные возрастные изменения обнаружены для восходящих связей, направленных от более каудальных к более фронтальным областям в двух сетях CEN и DMN, именно: от правой латеральной теменной коры (R-LPC) к правой латеральной префронтальной коре (R-LPFC) в CEN и от задней цингулярной коры (PCC) к медиальной префронтальной коре (MPFC), при этом в младшей возрастной группе сила таких эффективных связей больше, чем в старшей. Возрастные изменения силы влияний, направленных в противоположную сторону, либо отсутствовали вовсе, либо были выражены существенно слабее. Влияние пола на силу эффективных связей проявилось преимущественно в младшей группе и заключалось в более сильных связях в DMN и СЕN у девочек, чем у мальчиков.
Помимо возрастных и половых различий в силе взаимодействий между корковыми узлами регуляторных систем мозга во всех трех исследованных нейронных сетях обнаружена значимая асимметрия в направленном влиянии двух узлов сети друг на друга. В сети CEN наблюдалась наибольшая асимметрия: влияние правой латеральной теменной коры на правую латеральную префронтальную кору было существенно больше, чем обратное влияние. Наименьшая асимметрия направленных влияний наблюдалась в сети SN, для связей дорсальной передней цингулярной коры и фронто-островкового комплекса.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института возрастной физиологии РАО (Москва).
Информированное согласие. От родителей каждого участника исследования было получено письменное информированное согласие на участие ребенка в исследовании, подписанное после разъяснения потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа поддержана РФФИ (грант № 17-06-00837-ОГН).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Физиология развития ребенка / Под ред. Безруких М.М., Фарбер. Д.А. М.: Издательство Московского психолого-социального института. Воронеж: Издательство НПО “МОДЭК”, 2010. 768 с.
Cauffman E., Steinberg L., Piquero A.R. Psychological, neuropsychological and physiological correlates of serious antisocial behavior in adolescence: The role of self-control // Criminology. 2005. V. 43. № 1. P. 133.
Casey B.J. Beyond simple models of self-control to circuit-based accounts of adolescent behavior // Annu. Rev. Psychol. 2015. V. 66. P. 295.
Sorocco K.H., Carnes N.C., Cohoon A.J. et al. Risk factors for alcoholism in the Oklahoma Family Health Patterns project: impact of early life adversity and family history on affect regulation and personality // Drug. Alcohol. Depend. 2015. V. 150. P. 38.
Мачинская Р.И. Управляющие системы мозга // Журн. высш. нерв. деят. 2015. Т. 65. № 1. С. 33.
Lindquist K.A., Wager T.D., Kober H. et al. The brain basis of emotion: a meta-analytic review // Behav. Brain. Sci. 2012. V. 35. № 3. P. 121.
Salamone J.D., Correa M. The mysterious motivational functions of mesolimbic dopamine // Neuron. 2012. V. 76. № 3. P. 470.
Salgado S., Kaplitt M.G. The Nucleus Accumbens: A Comprehensive Review // Stereotact. Funct. Neurosurg. 2015. V. 93. № 2. P. 75.
Sharp B.M. Basolateral amygdala and stress-induced hyperexcitability affect motivated behaviors and addiction // Transl. Psychiatry. 2017. V. 7. № 8. P. e1194.
Ishikawa A., Ambroggi F., Nicola S.M., Fields H.L. Dorsomedial prefrontal cortex contribution to behavioral and nucleus accumbens neuronal responses to incentive cues // J. Neurosci. 2008. V. 28. № 19. P. 5088.
Rudebeck P.H., Murray E.A. The Orbitofrontal Oracle: Cortical Mechanisms for the Prediction and Evaluation of Specific Behavioral Outcomes // Neuron. 2014. V. 84. № 6. P. 1143.
Dixon M.L., Thiruchselvam R., Todd R., Christoff K. Emotion and the prefrontal cortex: An integrative review // Psychol. Bull. 2017. V. 143. № 10. P. 1033.
Ahmed S.P., Bittencourt-Hewitt A., Sebastian C.L. Neurocognitive bases of emotion regulation development in adolescence // Dev. Cogn. Neurosci. 2015. V. 15. P. 11.
Bressler S.L., Menon V. Large-scale brain networks in cognition: emerging methods and principles // Trends. Cogn. Sci. 2010. V. 14. № 6. P. 277.
Pessoa L. Understanding emotion with brain networks // Curr. Opin. Behav. Sci. 2018. V. 19. P. 19.
Bressler S.L., Tognoli E. Operational principles of neurocognitive networks // Int. J. Psychophysiol. 2006. V. 60. № 2. P. 139.
Fox M.D., Raichle M.E. Spontaneous fluctuations in brain activity observed with functional magnetic resonance imaging // Nat. Rev. Neurosci. 2007. V. 8. № 9. P. 700.
Курганский А.В. Функциональная организация мозга человека в состоянии покоя // Журн. высш. нерв. деят. 2018. Т. 68. № 5. С. 567.
Damoiseaux J.S., Rombouts S.A.R.B., Barkhof F. et al. Consistent resting-state networks across healthy subjects // Proc. Natl. Acad. Sci. USA. 2006. V. 103. № 37. P. 13848.
Mohan A., Roberto A.J., Mohan A. et al. The Significance of the Default Mode Network (DMN) in Neurological and Neuropsychiatric Disorders // Yale J. Biol. Med. 2016. V. 89. № 1. P. 49.
Solé-Padullés C., Castro-Fornieles J., de la Serna E. et al. Intrinsic connectivity networks from childhood to late adolescence: Effects of age and sex // Dev. Cogn. Neurosci. 2016. V. 17. P. 35.
Zhou Y., Friston K.J., Zeidman P. et al. The Hierarchical Organization of the Default, Dorsal Attention and Salience Networks in Adolescents and Young Adults // Cereb. Cortex. 2018. V. 28. № 2. P. 726.
Uhlhaas P.J., Singer W. Neuronal dynamics and neuropsychiatric disorders: toward a translational paradigm for dysfunctional large-scale networks // Neuron. 2012. V. 75. № 6. P. 963.
Srinivasan R., Winter W.R., Nunez P.L. Source analysis of EEG oscillations using high-resolution EEG and MEG // Prog. Brain. Res. 2006. V. 1. № 59. P. 29.
Grech R., Cassar T., Muscat J. et al. Review on solving the inverse problem in EEG source analysis // J. Neuroeng. Rehabil. 2008. V. 5. P. 25.
Darvas F., Pantazis D., Kucukaltun-Yildirim E., Leahy R.M. Mapping human brain function with MEG and EEG: methods and validation // Neuroimage. 2004. V. 23. Suppl 1. P. S289.
Baccala L.A., Sameshima K., Ballester G. et al. Studying the interaction between brain structures via directed coherence and Granger causality // Appl. Signal. Processing. 1998. V. 5. P. 40.
Курганский А.В. Некоторые вопросы исследования кортико-кортикальных функциональных связей с помощью векторной авторегрессионной модели многоканальной ЭЭГ // Журн. высш. нерв. деят. 2010. V. 60. № 6. С. 740.
Kaminski M., Blinowska K.J. The influence of volume conduction on DTF estimate and the problem of its mitigation // Front. Comput. Neurosci. 2017. V. 11. P. 36.
Davey C.G., Pujol J., Harrison B.J. Mapping the self in the brain’s default mode network // Neuroimage. 2016. V. 132. P. 390.
Assaf M., Jagannathan K., Calhoun V.D. et al. Abnormal functional connectivity of default mode sub-networks in autism spectrum disorder patients // Neuroimage. 2010. V. 53. № 1. P. 247.
Dixon M.L., De La Vega A., Mills C. et al. Heterogeneity within the frontoparietal control network and its relationship to the default and dorsal attention networks // Proc. Natl. Acad. Sci. USA. 2018. V. 115. № 7. P. E1598.
Hallez H., Vanrumste B., Grech R. et al. Review on solving the forward problem in EEG source analysis // J. Neuroeng. Rehabil. 2007. V. 4. P. 46.
Litvak V., Mattout J., Kiebel S. et al. EEG and MEG data analysis in SPM8 // Comput. Intell. Neurosci. 2011. P. 852 961.
Pascual-Marqui R.D., Lehmann D., Koukkou M. et al. Assessing interactions in the brain with exact low-resolution electromagnetic tomography // Philos. Trans. A Math. Phys. Eng. Sci. 2011. V. 369. № 1952. P. 3768.
Chen A.C., Oathes D.J., Chang C. et al. Causal interactions between fronto-parietal central executive and default-mode networks in humans // Proc. Natl. Acad. Sci. USA. 2013. V. 110. № 49. P. 19944.
Cui J., Xu L., Bressler S.L. et al. BSMART: A Matlab/C toolbox for analysis of multichannel neural time series // Neural. Networks. 2008. V. 21. № 8. P. 1094.
Di X., Biswal B.B. Identifying the default mode network structure using dynamic causal modeling on resting-state functional magnetic resonance imaging // Neuroimage. 2014. V. 86. P. 53.
Sharaev M.G., Zavyalova V.V., Ushakov V.L. et al. Effective Connectivity within the Default Mode Network: Dynamic Causal Modeling of Resting-State fMRI Data // Front. Hum. Neurosci. 2016. V. 10. P. 14.
Sridharan D., Levitin D.J., Menon V. A critical role for the right fronto-insular cortex in switching between central-executive and default-mode networks // Proc. Natl. Acad. Sci. USA. 2008. V. 105. № 34. P. 12569.
Friston K. Causal modelling and brain connectivity in functional magnetic resonance imaging // PLoS Biol. 2009. V. 7. № 2. P. e33.
Lenroot R.K., Giedd J.N. Brain development in children and adolescents: insights from anatomical magnetic resonance imaging // Neurosci. Biobehav. Rev. 2006. V. 30. № 6. P. 718.
Цехмистренко Т.А., Васильева В.А., Шумейко Н.В. Структурные преобразования коры большого мозга у детей и подростков // Физиология человека. 2017. Т. 43. № 2. С. 5.
Uddin L.Q., Supekar K.S., Ryali S., Menon V. Dynamic reconfiguration of structural and functional connectivity across core neurocognitive brain networks with development // J. Neurosci. 2011. V. 31. № 50. P. 18 578.
Sherman L.E., Rudie J.D., Pfeifer J.H. et al. Development of the default mode and central executive networks across early adolescence: a longitudinal study // Dev. Cogn. Neurosci. 2014. V. 10. P. 148.
Allen E., Erhardt E., Damaraju E. et al. Baseline for the multivariate comparison of resting-state networks // Front. Syst. Neurosci. 2011. V. 5. P. 2.
Zhang C., Cahill N.D., Arbabshirani M.R. et al. Sex and age effects of functional connectivity in early adulthood // Brain. Connect. 2016. V. 6. № 9. P. 700.
Thatcher R.W., North D.M., Biver C.J. Development of cortical connections as measured by EEG coherence and phase delays // Hum. Brain Mapp. 2008. V. 29. № 12. P. 1400.
Spear L.P. Adolescent neurodevelopment // J. Adolesc. Health. 2013. V. 52. № 2 (Suppl 2). P. S7.
Squeglia L.M., Jacobus J., Sorg S.F. et al. Early adolescent cortical thinning is related to better neuropsychological performance // J. Int. Neuropsychol. Soc. 2013. V. 19. № 9. P. 962.
Selemon L.D. A role for synaptic plasticity in the adolescent development of executive function // Transl. Psychiatry. 2013. V. 3. № 3. P. e238.
Jung M., Mody M., Saito D.N. et al. Sex differences in the default mode network with regard to autism spectrum traits: A resting state fMRI study // PLoS ONE. 2015. V. 10. № 11. P. e0143126.
Barth C., Villringer A., Sacher J. Sex hormones affect neurotransmitters and shape the adult female brain during hormonal transition periods // Front. Neurosci. 2015. V. 9. P. 37.
Sinclair D., Purves-Tyson T.D., Allen K.M., Weickert C.S. Impacts of stress and sex hormones on dopamine neurotransmission in the adolescent brain // Psychopharmacology (Berl). 2014. V. 231. № 8. P. 1581.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


