Физиология человека, 2019, T. 45, № 5, стр. 20-29
Скрытые компоненты связанных с событиями потенциалов в зрительном Go/NoGo тесте c предупреждающим стимулом
В. А. Пономарев 1, *, М. В. Пронина 1, Ю. Д. Кропотов 1
1 ФГБУН Институт мозга человека им. Н.П. Бехтеревой РАН
Санкт-Петербург, Россия
* E-mail: valery_ponomarev@mail.ru
Поступила в редакцию 21.12.2018
После доработки 28.03.2019
Принята к публикации 03.04.2019
Аннотация
Оценивалась способность параллельного факторного анализа разделять скрытые функционально разные компоненты связанных с событиями потенциалов (ПСС) в зрительном Go/NoGo тесте c предупреждающим стимулом. Исследования выполняли, используя записи ПСС у 351 здорового испытуемого в возрасте 18–55 лет. Результаты исследований показали, что ряд известных волн ПСС, связанных с обнаружением конфликтов, переключением, принятием решений и другими процессами, описываются различными компонентами в модели параллельного факторного анализа. Анализ формы сигналов этих компонентов позволил авторам предложить рабочую гипотезу относительно последовательности этих процессов, происходящих в мозге после предъявления Go и NoGo стимулов в Go/NoGo тесте. Таким образом, использование параллельного факторного анализа является эффективным, поскольку он обеспечивает другую точку зрения относительно процессов в мозге по сравнению с традиционными методами исследования ПСС.
Одним из принципов работы мозга человека является формирование в нем модели окружающей среды, на основании которой реализуется адаптивное поведение [1]. Во многих ситуациях сети головного мозга работают прогностическим образом и формируют доминирующую модель поведения. При этом конкретные стимулы отображаются на соответствующие реакции, тем самым, формируя привычный паттерн поведения в данной ситуации или состоянии [2, 3]. Однако в некоторых ситуациях привычные ответы не являются подходящими и должны быть отменены или подавлены. Способность мозга перейти от привычного к непривычному, но более подходящему ответу обычно связывают с гипотетическими процессами, объединенными в общую концепцию когнитивного контроля [4, 5]. Но, прежде всего, мозг должен обнаружить несоответствие между доминирующей моделью и текущим контекстом [6, 7]. Иными словами, мозг должен выполнить операцию обнаружения конфликта [4, 8]. Другой операцией когнитивного контроля является подавление действий, когда привычные ответы должны быть отменены [9].
Для изучения операций когнитивного контроля широко используется Go/NoGo парадигма [10, 11], в которой выполняется какое-либо действие после go стимулов, и не выполняется после NoGo стимулов. В потенциалах, связанных с событиями (ПСС), записанных при этих условиях, наблюдается последовательность волн положительной и отрицательной полярности. Ранние компоненты ПСС, такие как волны P1, N1 и P2, зависят от модальности предъявляемых стимулов, их физических характеристик и внимания к ним [12, 13]. На поздние составляющие ПСС, такие как волны N2 и P3, физические свойства стимулов не оказывают существенного влияния [14], хотя эти волны зависят от ряда других факторов, например, от интервала между стимулами.
В зрительном Go/NoGo тесте волна N2 наблюдается в интервале от 200 до 350 мс с максимумом на средних центральных электродах. Первоначально предполагалось, что волна N2 связана с подавлением ответа, поскольку было выявлено взаимоотношение между ее амплитудой и эффективностью подавления [10, 15, 16]. В дальнейшем было предположено, что волна N2 связана с процессами обнаружения конфликта [17, 18].
Волна P3 наблюдается в интервале от 300 до 800 мс после стимула и состоит из субкомпонентов, различающихся по временным характеристикам, топографии и зависимости от вида выполняемой деятельности [19–21]. В Go/NoGo тесте волна P3 наблюдается как в Go, так и в NoGo пробах. В Go пробах величина волны P3 наибольшая в теменных зонах, в NoGo пробах – в лобно-центральных. У здоровых испытуемых в NoGo пробах величина волны P3 больше при правильной реакции, чем при ошибочной. Кроме того, волна P3 больше в NoGo пробах по сравнению с Go пробами [22]. Предполагается, что волна P3 в NoGo пробах отражает процессы подавления ответа [23–25].
Еще одной операцией когнитивного контроля является переключения с одного вида деятельности на другой. При исследовании этого процесса часто используется, так называемая, cued Go/NoGo парадигма, в которой перед стимулом, определяющим ответную реакцию (стимул-мишень), предъявляется предупреждающий стимул, сообщающий о том, какое действие необходимо выполнить. После этого предупреждающего стимула в ПСС наблюдается волна положительной полярности (P3 cue) с максимумом в теменных областях в интервале времени 400–600 мс, причем ее величина больше, если необходимо переключиться с выполнения одной задачи на другую, по сравнению со случаем повторения предыдущего задания [26, 27]. Подобный эффект также наблюдается, когда предупреждающий стимул не предъявляется, но контекст выполнения задания предполагает, что переключение должно произойти [28, 29].
Предложен целый ряд гипотез относительно функциональной роли мозговых процессов связанных с волной P3 [13, 30]. Однако, несмотря на то, что ее свойства изучены весьма подробно, дебаты все еще продолжаются. Вероятно, это связано с тем, что даже при выполнении относительно простого задания в интервале времени, соответствующем компоненту P3, в разных зонах мозга протекают функционально различные процессы. При этом ПСС представляют собой смесь сигналов от этих зон вследствие суперпозиции электрических полей.
Решение данной проблемы может быть найдено с помощью методов слепого разделения источников, основанных на математическом анализе многомерных данных [31–33] и позволяющих выделить функционально различные составляющие ПСС [34–36]. Одним из перспективных методов является параллельный факторный анализ, который позволяет представить ПСС в виде суммы компонент с различными сигналами и топографиями, величины которых изменяются от человека к человеку [37]. Целью работы являлась оценка возможностей, которые дает этот метод для исследования мозговых процессов, обеспечивающих функцию когнитивного контроля.
МЕТОДИКА
Испытуемые выполняли Go/NoGo тест с предупреждающим стимулом. Зрительные стимулы: изображений животных (Ж), растений (Р) и людей (Ч) предъявляли в центре экрана монитора на белом фоне с помощью программы Psytask. Угловые размеры изображений порядка 3.8°. В каждой пробе последовательно предъявляли два стимула – предупреждение и мишень. Длительность предъявления стимулов, интервал между стимулами в паре и между началами пар стимулов были фиксированными и составляли 100, 1000 и 3100 мс соответственно. Использовали четыре сочетания изображений: “Ж–Ж”, “Ж–Р”, “Р–Р” и “Р–Ч”. В парах стимулов “Ж–Ж” или “Р–Р” изображения были идентичными. Для поддержания внимания к тесту в пробах “Р–Ч” одновременно со вторым зрительным стимулом предъявляли звуки – последовательности быстро сменяющихся тонов длительностью 20 мс и частотами 500, 1000, 1500, 2000 и 2500 Гц и звуковым давлением порядка 70 дБ. Тест состоял из 400 проб длительностью 3000 мс, по 100 проб для каждого из сочетаний изображений. Общая длительность теста – 21 мин. Пары стимулов предъявляли равновероятно в псевдослучайном порядке. Испытуемому давали задание нажимать указательным пальцем правой рукой на кнопку как можно точнее и быстрей после предъявления пары изображений “Ж–Ж” и не нажимать в других пробах. Чтобы оценить правильность выполнения задания и интервал времени, в течение которого выполнялась ответная реакция, регистрировали сигнал от кнопки и измеряли время реакции и продолжительность удержания кнопки в нажатом состоянии. Пробы, в которых испытуемый неправильно выполнял задание, исключили из анализа.
Регистрацию и анализ ЭЭГ (и сигнала от кнопки) выполняли с помощью компьютерного электроэнцефалографа “Мицар-ЭЭГ” и программного обеспечения WinEEG. Полоса пропускания – 0.53–50 Гц, частота квантования – 250 Гц, режекторный фильтр – 45–55 Гц. Электроды устанавливали в соответствии с международной системой 10–20, референт – объединенные ушные электроды, заземляющий – в отведении Fpz, сопротивление электродов <5 кОм. Коррекции артефактов моргания выполняли путем разложения многоканальной ЭЭГ на независимые компоненты и обнуления соответствующих составляющих [38]. Оставшиеся артефакты удаляли автоматически на основе эмпирически подобранных пороговых критериев [39]. ПСС вычисляли методом усреднения для каждого из сочетания изображений (условий) отдельно. ПСС на первый стимул не могут зависеть от того, каким окажется второй стимул, поскольку после первого Ж равновероятно появление Ж или Р, а после первого Р – Р или Ч. Поэтому для этого интервала также вычисляли ПСС по пробам с первым стимулом “Ж” (или “Р”). Эти условия обозначили “Ж+” и “Р–” соответственно.
Для дальнейшего анализа выбрали только те записи ПСС, при вычислении которых усреднялось не менее 80 проб для каждого из 4-х условий. Кроме того, использовали только записи ПСС у испытуемых в возрасте от 18 до 55 лет, поскольку визуальный анализ показал, что для этой группы испытуемых латентные периоды основных компонент ПСС отличались незначительно. В результате, из имеющегося массива данных ПСС (более 700 записей) выбрали 351 (150 мужчин).
Для статистического анализа выбирали интервалы времени, в которых на графиках усредненных по всем испытуемым ПСС наблюдали выраженные различия сигналов в пробах, и для этих интервалов вычисляли средние значения электрического потенциала для каждого испытуемого, условия и электрода в отдельности. Статистическую значимость различий оценивали с помощь двухфакторного дисперсионного анализа для повторных измерений (с поправкой Ɛ Гринхауза–Гейсера на число степеней свободы) с факторами “Условие” (2 уровня для ПСС после первого стимула: условия “Ж+” и “Р–”, и 3 уровня для ПСС после второго: пробы “Ж–Ж”, “Ж–Р” и “Р–Р”) и “Локализация” (19 уровней).
Для параллельного факторного анализа ПСС объединяли в трехмерный массив размера E × × (TC) × S, где E = 19 – число электродов, T = 750 – число временных отсчетов, (так как длительность пробы – 3000 мс, а частота квантования – 250 Гц), C = 3 – число условий в тесте (пробы “Ж–Ж”, “Ж–Р” и “Р–Р”) и S = 351 – число испытуемых. Этот массив данных может быть приблизительно описан с помощью модели параллельного факторного анализа, которую для краткости будем обозначать как “CP модель” (Canonical Polyadic model) [33] и которая может быть записана в виде:
Метод оценки параметров CP модели подробно описан ранее [37]. Оценку матриц в CP модели выполняли с помощью метода наименьших квадратов, при этом использовали специально разработанный алгоритм выбора наилучшей модели. Оптимальное число R (число компонент) определялось на основе качественных критериев путем сопоставления усредненных по всем испытуемым ПСС с CP моделями с разным R. Предпочтение было отдано СР модели с таким числом компонент, в которых наблюдали большинство хорошо известных особенностей ПСС, а надежность оценки ее параметров была достаточно высокой.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Усредненные по всем испытуемым ПСС представлены на рис. 1, Б. Эти ПСС были рассчитаны, используя коррекцию артефактов моргания глаз. Но если исключить коррекцию артефактов моргания глаз из предварительной обработки ЭЭГ, то можно наблюдать соответствующую этим морганиям динамику электрического потенциала, регистрируемую с помощью лобных электрода (рис. 1, А). На графиках рис. 1, Б с помощью стрелок отмечен ряд компонентов ПСС, которые были выбраны для дальнейшего анализа. Также с помощью вертикальных стрелок отмечены средние по всем испытуемым время реакции (ВР) и момент отпускания кнопки.
Рис. 1.
Усредненный по всем испытуемым ПСС. А – сигнал электроокулограммы (ЭОГ) на электроде Fp1. Б – ПСС в пробах “Ж–Ж”, “Ж–Р” и “Р–Р”. По оси абсцисс – время, по оси ординат – величина электрического потенциала. а – пробы “Ж–Ж” (Go условие), б – пробы “Ж–Р” (NoGo условие), в – пробы “P–Р”. Моменты включения и выключения стимулов в пробе отмечены вертикальными пунктирными линиями. Момент включения первого стимула – в начале координат. Вертикальные стрелки, направленные вниз и вверх – средние по испытуемым ВР и время отпускания кнопки соответственно. На топографиях представлено пространственное распределение потенциала в моменты времени, соответствующие максимумам волн ПСС.
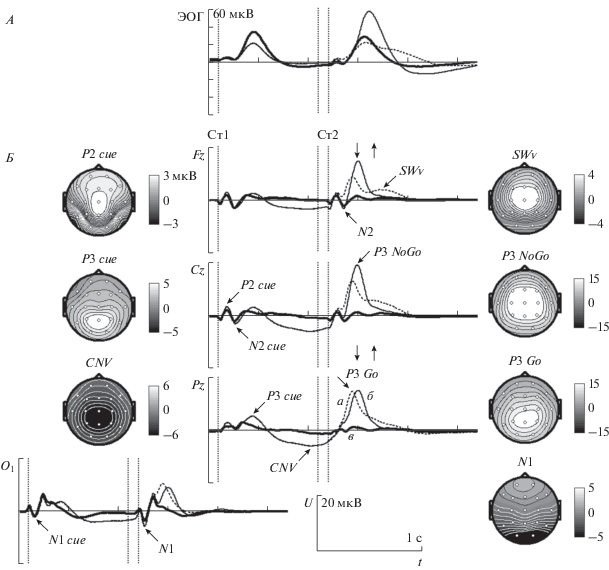
После первого предупреждающего стимула для анализа были выбраны следующие компоненты: затылочный N1 cue (с латентностью пика порядка 160 мс), лобно-центральный P2 cue (190 мс), лобно-центральный N2 cue (270 мс), теменной P3 cue (440 мс) и последующее медленное смещение электрического потенциала в отрицательную сторону, обозначенное как CNV (Contingent Negative Variation). После второго стимула были выбраны: затылочный N1 компонент (160 мс), задневисочный P2 (250 мс), лобно-центральный N2 (260 мс), P3 Go (340 мс), P3 NoGo (400 мс) и поздняя лобно-центральная волна SWv (Slow Wave visual, 620 мс). Пространственное распределение электрического потенциала для большинства из этих компонентов ПСС показано на рис. 1, Б с помощью топограм. По данным рис. 1 видно, что форма волны этих компонентов не совпадает с сигналом связанным с морганием (рис. 1, А). Т.е. эти компоненты ПСС не являются артефактами морганий.
Величина этих волн зависит от условий в тесте с высокой статистической значимостью (табл. 1). В ПСС после первого стимула величина волны N1 cue больше при условии “Р–” по сравнению с “Ж+” в отведениях O1 и O2, и меньше в T5 и T6. Величины волн P2 cue, N2 cue, P3 cue и CNV больше в пробах “Ж+”, чем в “Р–”. В ПСС после второго стимула величина N1 больше в пробах “Ж–Ж”, “Ж–Р” по сравнению “Р–Р” для электродов O1, O2, T5 и T6. При этом в отведениях T5 и T6 величина N1 больше в пробах “Ж–Ж” по сравнению с “Ж–Р”. Величина P2 наибольшая в пробах “Ж–Р” и величина N2 наименьшая в пробах “Ж–Ж”. Что касается волн P3 Go и P3 NoGo, то они практически не наблюдаются в пробах “Р–Р”, по хорошо выражены в пробах “Ж–Ж” и “Ж–Р”. Латентность волны P3 Go меньше по сравнению с P3 NoGo. При этом максимум волны P3 Go наблюдается в теменных областях, а P3 NoGo – в центральных. Наконец, волна SWv имеет наибольшую величину в пробах “Ж–Ж”.
Таблица 1.
Статистическая значимость различий компонентов ПСС
| Компонент | Интервал, (мс) | Основной эффект для фактора “Условие” | Взаимодействие факторов “Условие × Локализация” | ||||
|---|---|---|---|---|---|---|---|
| Стимул 1 | F[1,350] | Ɛ | p | F[18,6300] | Ɛ | p | |
| N1 cue | 120–160 | 33.8 | 1.0 | <10–6 | 55.8 | 0.20 | <10–6 |
| P2 cue | 160–220 | 183.2 | 1.0 | <10–6 | 115.1 | 0.23 | <10–6 |
| N2 cue | 230–320 | 60.9 | 1.0 | <10–6 | 109.4 | 0.20 | <10–6 |
| P3 cue | 380–520 | 254.6 | 1.0 | <10–6 | 173.6 | 0.19 | <10–6 |
| CNV | 700–1100 | 1714.5 | 1.0 | <10–6 | 495.9 | 0.21 | <10–6 |
| Стимул 2 | F[2,700] | Ɛ | p | F[36,12 600] | Ɛ | p | |
| *N1 | 140–180 | 109.0 | 0.79 | <10–6 | 93.0 | 0.19 | <10–6 |
| *P2 | 220–260 | 85.7 | 0.90 | <10–6 | 124.9 | 0.16 | <10–6 |
| *N2 | 240–320 | 541.5 | 0.92 | <10–6 | 223.6 | 0.19 | <10–6 |
| *P3 (Go) | 280–360 | 1018.7 | 0.98 | <10–6 | 337.6 | 0.18 | <10–6 |
| *P3 (NoGo) | 360–460 | 1685.2 | 0.89 | <10–6 | 510.5 | 0.19 | <10–6 |
| SWv | 530–800 | 224.6 | 0.99 | <10–6 | 82.5 | 0.18 | <10–6 |
Примечание: Ɛ – поправка для степеней свободы F статистики по Гринхаузу-Гейсеру. Результаты, отмеченные символом “*”, были опубликованы ранее [37], и они здесь приводятся для облегчения восприятия содержания работы.
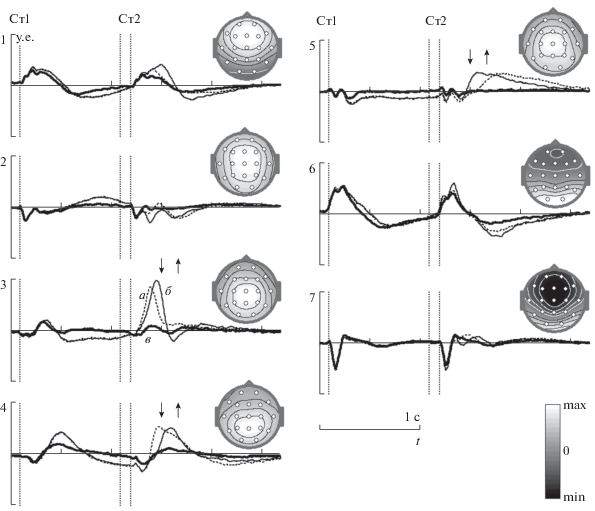
Используя метод параллельного факторного анализа, получена CP модель с числом компонент R = 7, которая в первом приближении удовлетворительно описывает ПСС. Эта модель аппроксимирует усредненные ПСС с точность до одного процента и описывает 72.4% дисперсии исходных данных. Сигналы и топографии компонент этой CP модели показаны на рис. 2. В компонентах этой модели можно наблюдать изменения сигналов во времени, которые соответствуют таким волнам ПСС, как затылочные N1 cue и N1, теменной P3 cue, CNV, задневисочный P2, лобно-центральный N2, P3 Go, P3 NoGo и SWv. Но представление сигналов, которое предлагает CP модель качественно отличается от ПСС, показанных на рис. 1, Б. В частности, форма сигналов компонент 6 и 7, описывающих волны N1 cue, N1 и P2 отличается от усредненных ПСС. Кроме того, в сигналах компонент CP модели наблюдается, по крайней мере, три поздние волны после второго стимула (компоненты 3, 4, 5), различающиеся по форме сигналов и по-разному зависящие от типа проб, что крайне сложно выявить при анализе усредненных ПСС (рис. 1, Б). При сравнении формы волн компонент CP модели (рис. 2) с сигналом связанным с морганием (рис. 1, А), видно, что они различаются.
Рис. 2.
Сигналы и топографии компонент в CP модели. На графиках по оси абсцисс – время, по оси ординат – величина сигнала в условных единицах (поскольку CP модель может быть оценена только с точностью до произвольного масштаба). Сигналы компонент нормированы так, что среднее значение величины компонент (элементов столбцов матрицы A(S)) и абсолютное значение максимума на топографиях компонент (в столбцах матрицы A(E)) равны 1. Остальные обозначение см. рис. 1.
В CP модели оценивается величина каждой из компонент для каждого испытуемого отдельно. Это позволяет оценить зависимость компонент от ряда других характеристик человека: возраста испытуемого, величины отклонения электрического потенциала от изолинии, связанного с морганием глаз, и индивидуальных поведенческих показателей, таких как средние значения ВР и длительность удержания кнопки в нажатом состоянии (ДР) и их среднеквадратичные отклонение. Коэффициенты корреляции Пирсона для этих показателей и величин компонент представлены в табл. 2.
Таблица 2.
Корреляция величин компонент с индивидуальными характеристиками испытуемых
| № | Возраст | ЭОГ Go | ЭОГ NoGo | m(ВР) | σ(ВР) | m(ДР) | σ(ДР) | σ(ВР) | m(ДР) | σ(ДР) |
|---|---|---|---|---|---|---|---|---|---|---|
| r | r | r | r | r | r | r | ρ•ВР | ρ•ВР | ρ•ВР | |
| 1 | 0.42 | 0.07 | 0.19 | 0.01 | –0.13 | 0.19 | 0.01 | –0.18 | 0.20 | 0.01 |
| 2 | –0.38 | 0.07 | –0.03 | 0.17 | 0.24 | –0.06 | 0.11 | 0.18 | –0.13 | 0.08 |
| 3 | –0.24 | 0.15 | 0.19 | –0.37 | –0.33 | –0.34 | –0.25 | –0.12 | –0.23 | –0.19 |
| 4 | 0.14 | 0.08 | 0.10 | –0.08 | –0.05 | 0.05 | 0.00 | 0.01 | 0.09 | 0.02 |
| 5 | 0.22 | 0.03 | 0.03 | 0.00 | –0.13 | 0.03 | –0.05 | –0.18 | 0.03 | –0.05 |
| 6 | –0.20 | 0.03 | –0.03 | –0.01 | 0.03 | –0.15 | –0.08 | 0.05 | –0.15 | –0.08 |
| 7 | 0.14 | 0.08 | 0.10 | –0.08 | –0.13 | 0.02 | –0.03 | –0.11 | 0.05 | –0.01 |
Примечание: № – порядковый номер компоненты (нумерации компонент см. рис. 2). “ЭОГ Go” и “ЭОГ NoGo” – среднее значение величины сигнала электроокулограммы на электроде Fp1 в Go и NoGo пробах в интервалах 440–900 мс и 400–680 мс соответственно, m(.) и σ(.) – средние значения и среднеквадратичные отклонения для индивидуальных ВР и ДР, r – коэффициент корреляции Пирсона, ρ•ВР – частный коэффициент корреляции при фиксированном m(ВР). Жирным шрифтом выделены коэффициенты корреляции статистически значимо (p < 0.001) отличные от нуля.
Большинство компонент CP модели статистически значимо (p < 0.001) зависят от возраста. Эта корреляция положительная для компонент 1 и 5, и отрицательная для компонент 2, 3 и 6. Выявлена корреляция величины компонент 1 и 3 и сигнала, связанного с морганием, в NoGo пробах. Однако формы этих двух видов сигналов не совпадают, поэтому компонент 1 и 3 не описывают артефакты, связанные с морганием. Корреляция величины компоненты 3 со всеми поведенческими показателями отрицательная и статистически значимо (p < 0.001) отличается от нуля, в том числе, для m(ВР). Кроме того, наблюдается зависимость величины компоненты 1 и m(ДР), и величины компоненты 2 и σ(ВР). Однако показатели m(ДР), σ(ВР) и σ(ДР) могут характеризовать не только степень сосредоточенности испытуемого на задании, но и индивидуальную скорость физиологических процессов, которая может быть связана с ВР. Поэтому для этих показателей были вычислены частные коэффициенты корреляции при фиксированном m(ВР) – ρ•ВР. Последний анализ показал, что величина ρ•ВР < 0.25 для всех случаев, но для некоторых из них она статистически значимо отличается от нуля.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В наших исследованиях было выявлено, что после первого стимула величина волн P2 cue, N2 cue и P3 cue больше в пробах “Ж+”, чем в “Р–”. Эффекты с похожими временными характеристиками и топографическим распределением наблюдались ранее в исследованиях, в которых первый стимул в пробе предупреждал испытуемого о необходимости переключения с одного задания на другое [40, 41]. Аналогичность этих наблюдений позволяет утверждать, что в условиях используемой экспериментальной парадигмы после первого стимула также происходит переключение с одного вида деятельности на другой. И, действительно, в нашем тесте испытуемый в среднем нажимает на кнопку приблизительно один раз в 12 с, а готовится к выполнению этой реакции в течение 1 с каждые 6 с, т.е. относительно редко. Логично предположить, что в исходном состоянии человек в течение всего теста поддерживает внимание к стимулам и распознает их. Только после предъявления изображения животного в качестве первого стимула испытуемому становится необходимо переключиться и начать выполнение другой задачи, включающей в себя подготовку ответа.
В ПСС после второго стимула в пробе наблюдаются, по крайней мере, 4 компонента: волны N2, P3 go, P3 NoGo и SWv, возможно, связанные с операциями когнитивного контроля. Волну N2 обычно связывают с процессами обнаружения конфликта [17, 18], и наши результаты не противоречат этой интерпретации.
Относительно функциональной роли процессов, отражающихся в волнах P3 Go и P3 NoGo, единого мнения пока еще не существует, но сформулировано несколько гипотез. Согласно “модели обновления контекста” (context updating model) компонент P3 возникает в том случае, когда мозг получает достаточно информации, чтобы обновить внутреннюю модель мира [42]. Согласно другой точке зрения в компоненте P3 отражаются процессы категоризации событий и принятия решения относительно того, соответствуют ли внешние стимулы некоторому внутреннему представлению о специфической категории стимулов [43]. Предполагается, что в компоненте P3 отражаются процессы, которые обеспечивают взаимосвязь между восприятием стимула и началом ответного действия [44]. Высказано предположение, что компонент P3 связан с механизмами нейронного торможения, которые подавляют постороннюю активность на время передачи информации от передних к теменным областям мозга [30]. Недавно полученные данные позволяют предположить, что P3, возможно, отражает процессы принятия решения, определяющие последующее поведение [45–48]. Причем предполагается, что компонент P3 является корковым представлением фазической реакции норадренергической системы голубого пятна среднего мозга, оказывающей влияние на процессы принятия решений и облегчающей обработку информации [49, 50].
Составляющие ПСС, наблюдаемые после волны P3, подробно изучены в слуховом Go/NoGo тесте. При равной вероятности Go и NoGo стимулов наблюдается медленная волна (SW) с латентностью пика порядка 450 мс, отрицательной полярностью в лобных зонах и положительной в теменных отделах, и, вероятно, она состоит из субкомпонентов [51–55]. Аналогичная волна (SWv) наблюдается в наших исследованиях в зрительном Go/NoGo тесте, но с другой латентностью пика и пространственным распределением (см. также иллюстрации в работах [56, 57]).
Результаты параллельного факторного анализа выявили несколько особенностей поздних компонентов ПСС. Во-первых, компонента 4 в CP модели (рис. 2) описывает волну P3 cue после первого стимула, которая, вероятно, связана с переключением с одного вида деятельности на другой. Но аналогичные волны наблюдаются после второго стимула в пробах “Ж–Ж” и “Ж–Р”. Тогда, переключение также происходит после второго стимула, причем эта операция начинается раньше в Go, чем в NoGo пробах. Во-вторых, компонента 5 в CP модели (рис. 2) описывает волну SWv. В сигналах этой компоненты волна SWv наблюдается как в Go, так и в NoGo пробах, причем с меньшим латентным периодом в NoGo пробах. Наконец, волны P3 Go, P3 NoGo описываются только одной компонентой 3 в CP модели. Отсюда следует, что пространственное распределение этих волн, вероятно, одинаково. А наблюдаемое различие пространственного распределения P3 Go и P3 NoGo в ПСС объясняется суперпозиции полей от нескольких источников сигналов.
Корреляционный анализ показал, что если и существует взаимосвязь величины компонент 4 и 5 с параметрами ответной реакции, то она относительно мала. Наиболее выраженной является взаимосвязь между ВР и величиной P3 Go и P3 NoGo компонент. Это подтверждает известные факты относительно влияния внимания на величину компоненты P3 и ВР. Другие выявленные зависимости также могут быть связаны со степенью вовлеченности испытуемого в выполнение теста.
Согласно CP модели, можно предложить следующую рабочую гипотезу относительно последовательности процессов, протекающих в мозге после предъявления второго стимула в Go и NoGo пробах. Будем считать, что волна N2 (компонент 2) связана с обнаружением конфликта, P3 Go и P3 NoGo (компонент 3) – с принятием решения о выполнении ответной реакции или ее подавлении, волна P3 cue (компонент 4) – с переключением, и волна SWv (компонент 5) – с восстановлением состояния нейронных сетей после действия. Тогда в Go пробах после распознавания стимула принимается решение о необходимости нажать кнопку, и это действие начинает выполняться. Далее, параллельно с движением начинается переключение в состояние ожидания следующего стимула, а после ответной реакции – восстановление состояния. В NoGo пробах после распознавания стимула выполняется обнаружение конфликта, и только позже – принятие решения о подавлении ранее подготовленного действия. Далее начинается переключение и параллельно, но немного позже – восстановление. Обнаружение конфликта требует времени, поэтому принятие решения и переключение в NoGo пробах происходят позже, чем в Go пробах. Выполнение движения также требует времени, поэтому восстановление состояния в Go пробах начинается позже, чем в NoGo пробах.
ЗАКЛЮЧЕНИЕ
Результаты исследования ПСС с помощью параллельного факторного анализа показали, что этот подход позволяет выделить функционально различные составляющие ПСС, которые скрыты от непосредственного наблюдения с помощью традиционно используемых методов. Эффективность этого подхода подтверждается еще и тем, что на основе полученных с помощью него результатов, представилась возможность сформулировать гипотезу относительно последовательности протекания процессов в мозге человека при выполнении Go/NoGo теста. Поэтому целесообразно рекомендовать использование этого подхода для анализа ПСС вместе с традиционными методами для повышения эффективности исследований.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены Комитетом по этике Института мозга человека им. Н.П. Бехтеревой РАН (Санкт-Петербург, Россия) и Местным комитетом по этике кантона Граубюнден (округ Гризон, Швейцария).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа поддержана РНФ (грант 16-15-10 213).
Благодарности. Авторы выражают благодарность Dr. Andreas Müller, Детский центр (Кур, Швейцария) за предоставленные записи ПСС в Go/NoGo тесте.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Picard F., Friston K. Predictions, perception, and a sense of self // Neurology. 2014. V. 83. № 12. P. 1112.
Isoda M., Hikosaka O. Cortico-basal ganglia mechanisms for overcoming innate, habitual and motivational behaviors // Eur. J. Neuroscience. 2011. V. 33. № 11. P. 2058.
Ridderinkhof K.R., Forstmann B.U., Wylie S.A. et al. Neurocognitive mechanisms of action control: Resisting the call of the sirens // Wiley Interdiscip. Rev. Cogn. Sci. 2011. V. 2. № 2. P. 174.
Botvinick M.M., Braver T.S., Barch D.M. et al. Conflict monitoring and cognitive control // Psychol. Rev. 2001. V. 108. № 3. P. 624.
Braver T. The variable nature of cognitive control: A dual mechanisms framework // Trends Cogn. Sci. 2012. V. 16. № 2. P. 106.
Carter C.S., van Veen V. Anterior cingulate cortex and conflict detection: An update of theory and data // Cogn. Affect. Behav. Neurosci. 2007. V. 7. № 4. P. 367.
Cohen M.X. A neural microcircuit for cognitive conflict detection and signaling // Trends Neurosci. 2014. V. 37. № 9. P. 480.
Ullsperger M., Fischer A.G., Nigbur R. et al. Neural mechanisms and temporal dynamics of performance monitoring // Trends Cogn. Sci. 2014. V. 18. № 5. P. 259.
Mostofsky S.H., Simmonds D.J. Response inhibition and response selection: Two sides of the same coin // J. Cogn. Neurosci. 2008. V. 20. № 5. P. 751.
Falkenstein M., Hoormann J., Hohnsbein J. ERP components in Go/Nogo tasks and their relation to inhibition // Acta Psychol. 1999. V. 101. № 2–3. P. 267.
Verleger R., Paehge T., Kolev V. et al. On the relation of movement-related potentials to the go/no-go effect on P3 // Biol. Psychol. 2006. V. 73. № 3. P. 298.
The Oxford handbook of event-related potential components / Eds. Luck S.J., Kappenman E.S. The Oxford handbook of event-related potential components. Oxford: Oxford University Press, 2012. 642 p.
Berchicci M., Spinelli D., Di Russo F. New insights into old waves. Matching stimulus- and response-locked ERPs on the same time-window // Biol. Psychol. 2016. V. 117. P. 202.
Patel S.H., Azzam P.N. Characterization of N200 and P300: Selected studies of event-related potential // Int. J. Med. Sci. 2005. V. 2. № 4. P. 147.
Kaiser S., Weiss O., Hill H. et al. N2 event-related potential correlates of response inhibition in an auditory Go/NoGo task // Int. J. Psychophysiol. 2006. V. 61. № 2. P. 279.
Smith J.L., Johnstone S.J., Barry R.J. Response priming in the Go/NoGo task: the N2 reflects neither inhibition nor conflict // Clin. Neurophysiol. 2007. V. 118. № 2. P. 343.
Nieuwenhuis S., Yeung N., van den Wildenberg W. et al. Electrophysiological correlates of anterior cingulate function in a go/nogo task: effects of response conflict and trial type frequency // Cogn. Affect. Behav. Neurosci. 2003. V. 3. № 1. P. 17.
Randall W.M., Smith J.L. Conflict and inhibition in the cued-Go/NoGo task // Clin. Neurophysiol. 2011. V. 122. № 12. P. 2400.
Picton T.W. The P300 wave of the human event-related potential // J. Clin. Neurophysiol. 1992. V. 9. № 4. P. 456.
Verleger R. On the utility of P3 latency as an index of mental chronometry // Psychophysiology. 1997. V. 34. № 2. P. 131.
Polich J. Updating P300: an integrative theory of P3a and P3b // Clin. Neurophysiol. 2007. V. 118. № 10. P. 2128.
Huster R.J., Enriquez-Geppert S., Lavallee C.F. et al. Electroencephalography of response inhibition tasks: Functional networks and cognitive contributions.// Int. J. Psychophysiol. 2013. V. 87. № 3. P. 217.
Albert J., Lopez-Martín S., Hinojosa J. et al. Spatiotemporal characterization of response inhibition // Neuroimage. 2013. V. 76. P. 272.
Smith J.L., Jamadar S., Provost A.L. et al. Motor and non-motor inhibition in the Go/NoGo task: an ERP and fMRI study // Int. J. Psychophysiol. 2013. V. 87. № 3. P. 244.
Groom M.J., Cragg L. Differential modulation of the N2 and P3 event-related potentials by response conflict and inhibition // Brain Cogn. 2015. V. 97. P. 1.
De Baene W., Brass M. Dissociating strategy-dependent and independent components in task preparation // Neuropsychologia. 2014. V. 62. P. 331.
Gajewski P.D., Ferdinand N.K., Kray J. et al. Understanding sources of adult age differences in task switching: Evidence from behavioral and ERP studies // Neurosci. Biobehav. Rev. 2018. V. 92. P. 255.
Wylie G.R., Javitt D.C., Foxe J.J. Task switching: a high – density electrical mapping study // Neuroimage. 2003. V. 20. № 4. P. 2322.
Hilgard J., Bartholow B.D., Dickter C.L. et al. Characterizing switching and congruency effects in the Implicit Association Test as reactive and proactive cognitive control // Soc. Cogn. Affect. Neurosci. 2015. V. 10. № 3. P. 381.
Polich J. Neuropsychology of P300 / The Oxford handbook of event-related potential components // Eds. Luck S.J., Kappenman E.S. Oxford: Oxford University Press, 2012. P. 159.
Cichocki A., Mandic D., Phan A.-H. et al. Tensor decompositions for signal processing applications from two-way to multiway component analysis // IEEE Signal Process. Mag. 2015. V. 32. P. 145.
Cong F., Lin Q.H., Kuang L.D. et al. Tensor decomposition of EEG signals // J. Neurosci. Methods. 2015. V. 248. P. 59.
Zhou G., Zhao Q., Zhang Y. et al. Linked component analysis from matrices to high order tensors: applications to biomedical data // Proc. IEEE. 2016. V. 104. № 2. P. 310.
Kropotov J.D., Ponomarev V.A. Differentiation of neuronal operations in latent components of event-related potentials in delayed match-to-sample tasks // Psychophysiology. 2015. V. 52. № 6. P. 826.
Kropotov J., Ponomarev V., Tereshchenko E.P. et al. Effect of aging on ERP components of cognitive control // Front. Aging Neurosci. 2016. V. 8. P. 69.
Kropotov J.D., Ponomarev V.A., Pronina M. et al. Functional indexes of reactive cognitive control: ERPs in cued go/no-go tasks // Psychophysiology. 2017. V. 54. P. 1899.
Пономарев В.А., Пронина М. В., Кропотов Ю.Д. Параллельный факторный анализ в исследовании связанных с событиями потенциалов // Физиология человека. 2019. Т. 45. №3. С. 5.
Vigário R.N. Extraction of ocular artefacts from EEG using independent component analysis // Electroencephalogr. Clin. Neurophysiol. 1997. V. 103. № 3. P. 395.
Пономарев В.А., Кропотов Ю.Д. Уточнение локализации источников вызванных потенциалов в GO/NOGO тесте с помощью моделирования структуры их взаимной ковариации // Физиология человека. 2013. Т. 39. № 1. С. 36.
Periáñez J.A., Barceló F. Updating sensory versus task representations during task-switching: insights from cognitive brain potentials in humans // Neuropsychologia. 2009. V. 47. № 4. P. 1160.
Finke M., Escera C., Barceló F. The effects of foreknowledge and task-set shifting as mirrored in cue- and target-locked event-related potentials // PLoS ONE. 2012. V. 7. P. e49486.
Donchin E., Coles M. Is the P300 component a manifestation of context updating? // Behav. Brain Sci. 1988. V. 11. № 3. P. 357.
Kok A. On the utility of P3 amplitude as a measure of processing capacity // Psychophysiology. 2001. V. 38. P. 557.
Verleger R., Jaskowskis P., Wascher E. Evidence for an integrative role of P3b in linking reaction to perception // J. Psychophysiol. 2005. V. 19. № 3. P. 165.
O’Connell R.G., Dockree P.M., Kelly S.P. A supramodal accumulation-to-bound signal that determines perceptual decisions in humans // Nat. Neurosci. 2012. V. 15. № 12. P. 1729.
Saville C.W.N., Shikhare S., Iyengar S. et al. Is reaction time variability consistent across sensory modalities? Insights from latent variable analysis of single-trial P3b latencies // Biol. Psychol. 2012. V. 91. № 2. P. 275.
Kelly S.P., O’Connell R.G. Internal and external influences on the rate of sensory evidence accumulation in the human brain // J. Neurosci. 2013. V. 33. № 50. P. 19 434.
Twomey D., Murphy P.R., O’Connell R. The classic P300 encodes a build-to-threshold decision variable // Eur. J. Neurosci. 2015. V. 42. № 1. P. 1636.
Nieuwenhuis S., Aston-Jones G., Cohen J.D. Decision making, the P3, and the locus coeruleus norepinephrine system // Psychol. Bull. 2005. V. 131. № 4. P. 510.
Nieuwenhuis S., De Geus E.J., Aston-Jones G. The anatomical and functional relationship between the P3 and autonomic components of the orienting response // Psychophysiology. 2011. V. 48. № 2. P. 162.
Loveless N.E., Simpson M., Näätänen R. Frontal negative and parietal positive components of the slow wave dissociated // Psychophysiology. 1987. V. 24. № 2. P. 340.
Spencer K.M., Dien J., Donchin E. Spatiotemporal analysis of the late ERP responses to deviant stimuli // Psychophysiology. 2001. V. 38. № 2. P. 343.
Barry R.J., De Blasio F.M. Sequential processing in the equiprobable auditory Go/NoGo task: a temporal PCA study // Int. J. Psychophysiol. 2013. V. 89. № 1. P. 123.
Borchard J.P., Barry R.J., De Blasio F.M. Sequential processing in an auditory equiprobable Go/NoGo task with variable interstimulus interval // Int. J. Psychophysiol. 2015. V. 97. № 2. P. 145.
Barry R.J., De Blasio F.M., Fogarty J.S. et al. ERP Go/NoGo condition effects are better detected with separate PCAs // Int. J. Psychophysiol. 2016. V. 106. P. 50.
Dhar M., Been P.H., Minderaa R.B. et al. Information processing differences and similarities in adults with dyslexia and adults with attention deficit hyperactivity disorder during a continuous performance test: a study of cortical potentials // Neuropsychologia. 2010. V. 48. № 10. P. 3045.
Tarantino V., Mazzonetto I., Vallesi A. Electrophysiological correlates of the cognitive control processes underpinning mixing and switching costs // Brain Res. 2016. V. 1646. P. 160.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


