Физиология человека, 2019, T. 45, № 5, стр. 99-109
Прогностическая значимость показателей системной эндотоксинемии в атерогенезе
Д. П. Покусаева 1, 2, *, И. А. Аниховская 1, 2, Л. А. Коробкова 3, М. Ю. Яковлев 1, 2, 4, Г. Г. Энукидзе 2
1 ФГБНУ Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
2 ООО Клинико-Диагностическое Общество – Клиническая база ФГБНУ
Научно-исследовательский институт общей патологии и патофизиологии
Москва, Россия
3 Автономная некоммерческая организация высшего образования
“Сколковский институт науки и технологий”
Москва, Россия
4 ФГБОУ ВО Российский национальный исследовательский медицинский университет
им. Н.И. Пирогова Министерства здравоохранения РФ
Москва, Россия
* E-mail: pokusaeva.d@yandex.ru
Поступила в редакцию 13.02.2019
После доработки 05.05.2019
Принята к публикации 03.06.2019
Аннотация
Многочисленные научные исследования свидетельствуют о наличии тесной связи между нарушениями липидного обмена и воспалительным компонентом атерогенеза. Избыток эндотоксина (ЭТ) в общем кровотоке способен индуцировать хроническое воспаление, роль которого в атерогенезе трудно переоценить. Участие липополисахарида (ЛПС) в атерогенезе у людей изучалось без оценки морфологических изменений структуры стенки сосудов. В связи с этим важно определить динамику параметров системной эндотоксинемии (СЭЕ) при прогрессировании морфологических изменений в стенке артерий. Обследовано 104 волонтера с нарушенными параметрами липидного профиля, но без клинических проявлений атеросклероза, которые считали себя “здоровыми”, относились к средней группе риска (2–4%) по шкале SCORE. Группа контроля (n = 9) сопоставима с пациентами по полу и возрасту. Всем проводилось дуплексное сканирование экстракраниального отдела брахиоцефальных артерий (БЦА), взятие венозной крови с определением показателей липидного профиля и СЭЕ: концентрация ЭТ и антител к гидрофобной и гидрофильной частям молекулы ЛПС и их соотношение. Пациенты были разделены на три группы в зависимости от выявленных ультразвуковых изменений стенки артерий: “Норма” без морфологических изменений в БЦА, “ТИМ” с утолщением комплекса интима-медиа и “АСБ” с наличием атеросклеротической бляшки. У пациентов группы “АСБ” отмечалась высокая концентрация ЭТ при сниженной активности антиэндотоксинового иммунитета (АЭИ) в сравнении с принятыми референтными значениями и с группой “ТИМ”. Уровень ЭТ не повышен, но активность АЭИ снижена как в группе “ТИМ”, так и в группе “Контроль”. У группы “Норма” все показатели СЭЕ в пределах нормы. При оценке факторов риска выявления атеросклеротической бляшки стенки БЦА ключевыми были возраст старше 55 лет и снижение антител к гидрофобной части молекулы ЛПС ниже 163 у. е. о. п. Выявленные различия по параметрам СЭЕ между группами пациентов позволяют утверждать, что повышение концентрации ЛПС в крови и снижение активности АЭИ являются факторами риска развития атеросклероза.
Ведущей причиной развития сердечно-сосудистых заболеваний (ССЗ) является атеросклероз. Теоретические модели и клинические данные подтверждают наличие тесной связи между нарушениями липидного обмена и воспалительным компонентом атерогенеза [1–3]. В физиологических условиях (отсутствия верифицированных заболеваний) в общем кровотоке условно здоровых людей всегда присутствует определенное количество эндотоксина (ЭТ) [4–6], представляющего собой липополисахарид (ЛПС), который является облигатным компонентом наружной части клеточной мембраны всех грам-негативных микроорганизмов. ЭТ является уникальной молекулой, способной индуцировать хроническое воспаление [6, 7]. При избыточном росте кишечной микробиоты возможны проатерогенные изменения липидного профиля [8, 9], что можно объяснить общими механизмами транспорта общего холестерина (ОХС) и ЭТ в системном кровотоке за счет конкурентного связывания с различными классами липопротеинов [6, 10–13]. Большая часть исследований на животных выявила, что ЛПС преимущественно связывается с липопротеинами высокой плотности (ХС ЛВП) [14]. В исследованиях же на людях было обнаружено, что ЭТ распределен между ХС ЛВП и липопротеинами низкой плотности (ХС ЛНП) в равных количествах [15, 16]. Исследования проводились с участием небольшой выборки пациентов, на биохимическом уровне и без оценки степени клинических проявлений атеросклероза [11, 17, 18].
Избыточный рост бактериальной микрофлоры в просвете кишечника провоцирует в первую очередь заболевания желудочно-кишечного тракта, которые находятся в ведении гастроэнтеролога или терапевта, и не расцениваются врачами как предикторы развития болезней атеросклеротического спектра. Не разработаны диагностические методы и критерии, направленные на оценку активности кишечной микрофлоры с точки зрения факторов риска развития атеросклероза. Исследования по изучению влияния ЛПС на морфологические изменения структуры стенки артерий при атеросклерозе немногочисленны и ограничены артериями нижних конечностей или коронарными артериями [19–22]. В связи с этим важно определение динамики параметров системной эндотоксинемии (СЭЕ) и выявление определенных референтных значений концентрации ЭТ и антител (АТ) к разным частям молекулы ЛПС при прогрессировании морфологических изменений в стенке артерий. Изучению роли АТ к молекуле ЛПС посвящено небольшое количество исследований [23–25]. Оценка роли СЭЕ в общей патологии затруднительна без определения активности антиэндотоксинового иммунитета (АЭИ) [4, 6, 26].
МЕТОДИКА
Из числа пациентов Клинической базы ФГБНУ НИИОПП (ООО “КДО” г. Москва) отобрали 104 чел. средней возрастной категории (55 лет [49–59 лет]) с нарушенными параметрами липидного профиля: повышение концентрации ОХС выше 5.3 ммоль/л, ХС ЛНП 3.0 ммоль/л, триглицеридов (ТГ) более 1.8 ммоль/л, индекса атерогенности (ИА) более 4.0, снижение ХС ЛВП менее 1.0 ммоль/л). Критериями включения было отсутствие субъективных жалоб на момент забора крови для проведения анализов и инструментальных исследований; хронические заболевания в стадии ремиссии более трех месяцев или их отсутствие; отсутствие серьезных травм и операционных вмешательств не менее чем за месяц до проведения исследования. Критерии исключения: прием липидснижающих препаратов, острая воспалительная патология на момент включения в исследование, длительный прием препаратов с противовоспалительным действием, острое нарушение мозгового кровообращения или инфаркт миокарда в анамнезе, хроническая почечная или сердечная недостаточность, сахарный диабет. Все волонтеры на момент включения в исследование оценивали себя как “здоровые”. Индекс массы тела, рассчитанный по формуле Кетле, был в пределах 22.2–28.1 кг/м2. Контрольная группа (“Контроль”) состояла из девяти человек, была сопоставима по полу и возрасту с обследуемыми и имела нормальные показатели липидного профиля. Всем пациентам проводили дуплексное сканирование экстракраниального отдела БЦА линейным датчиком с частотой 5–12 МЦ (УЗИ-сканер MEDISON SA9900, Южная Корея). При выявлении стенозирующего атеросклероза пациенты были исключены из исследования. На основании изменений в структуре стенки артерий, выявленных при ультразвуковом исследовании, пациентов разделили на три группы: у обследованных из группы “АСБ” (n = 57) в структуре стенки лоцировалась одна и более атеросклеротическая бляшка, в группе “ТИМ” (n = 20) отмечалось нарушение трехслойной структуры стенки БЦА с утолщением до 1.2 мм комплекса интима-медиа, пациенты группы “Норма” (n = 27) имели нормальную структуру стенки.
Забор венозной крови осуществляли кубитальным доступом в утренние часы (с периодом воздержания от приема пищи не менее 6 ч). Определяли такие параметры как: концентрация ОХС, ТГ, ХС ЛВП в ммоль/л с использованием биохимического анализатора “StatFax 3300” (США), набором реактивов фирмы “Analyticon” (Германия) в соответствии с прилагаемой инструкцией. Общую фракцию ХС ЛНП (в ммоль/л) рассчитывали по формуле “ХС ЛНП = ОХС – ХС ЛВП-ТГ/2,2”, индекс атерогенности рассчитывали “ИА = (ОХС-ХС ЛВП)/ХС ЛВП”. Оценивали концентрацию ЛПС в плазме крови при помощи микро-ЛАЛ-теста (принятые за норму референтные значения 0.3–1.0 EU/мл, Патент РФ № 2 169 367, реактивы Sigma, США), основанного на способности ЭТ вызывать коагуляцию белковых фракций гемолимфы мечехвоста Limulus Polyphemus. Оценку результата проводили на сопоставлении формы полученных кристаллов с данными калибровочной шкалы. Концентрацию в сыворотке крови АТ к гидрофобной части молекулы ЛПС (АТ-ЛПС-ФОБ) (референтные значения нормы 170–220 у. е. о. п.) и АТ к гидрофильной части молекулы ЭТ (референтные значения нормы 390–430 у. е. о. п.) в условных единицах оптической плотности оценивали методом “СОИС-ИФА” (Патенты РФ № 2 609 763, № 2 011 993), который представляет собой твердофазный иммуноферментный анализ. Антигеном к АТ-ЛПС-ФОБ выступал ЛПС Salmonella minnnesotа RE 595 (Sigma, США), антигеном для определения АТ-ЛПС-ФИЛ являлся E.coli O55 (Sigma, США). Регистрацию показателей экстинкции осуществляли на спектрофотометре “Immunochem 2100” (США) при длине волны 495 нм. Определяли соотношение АТ-ЛПС-ФИЛ/АТ-ЛПС-ФОБ (норма 2 : 1). Заполняли опросник, который включал такие параметры как пол, возраст, факт курения, уровень систолического артериального давления. Среди обследованных уровень артериального давления не был зафиксирован выше 150/90 мм рт. ст., что позволило классифицировать пациентов по бинарной системе: артериальная гипертензия (АГ) выявлена или нет, без деления по степени повышения артериального давления.
Статистическую обработку материалов исследования проводили с использованием программной среды вычислений Rstudio (1.1.456), пакетов прикладных программ Statistica 10 и SASJMP 11. Уровень статистической значимости был зафиксирован на уровне вероятности ошибки 0.05. С использованием критерия Колмогорова-Смирнова оценивали нормальность распределения выборки. Сравнения двух групп по количественным шкалам проводили на основе непараметрического критерия U-Манна-Уитни. Сравнения трех и более групп по количественным шкалам проводили на основе непараметрического критерия Краскела-Уоллеса. Для описания количественных показателей использовали медиану и внутриквартильный размах в формате “Mе [25; 75%]”.
Статистическую значимость различных значений для бинарных и номинальных показателей определяли с использованием критерия Хи-квадрат Пирсона. Корреляционный анализ проводили на основе непараметрической ранговой корреляции по Спирмену. При изучении взаимного влияния нескольких переменных проводили множественный регрессионный анализ. Оценка влияния фактора в распределении пациентов по группам происходила с использованием статистического однофакторного анализа рисков.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В табл. 1 представлены результаты статистического анализа различных категориальных переменных, считающихся факторами риска развития атеросклероза, среди пациентов с разной степенью выраженности атеросклеротического поражения экстракраниального отдела БЦА.
Таблица 1.
Распределение пациентов в группах в зависимости от общепризнанных факторов риска развития атеросклероза
| Показатель | Группа (состояние стенки) | Уровень р (df = 3) | |||
|---|---|---|---|---|---|
| контроль (n = 9) | норма (n = 27) | ТИМ (n = 20) | АСБ (n = 57) | ||
| Возраст, лет | 48.00 [35.00; 53.00] | 48.00 [45.00; 51.00] | 56.00 [51.50; 57.25 ] | 58.00 [53.00; 62.00] | <0.0001* |
| До 55 лет | 7 (77.8%) | 22 (81.5%) | 8 (40.0%) | 19 (33.3%) | 0.0001* |
| Курение | 4 (44.4%) | 7 (25.9%) | 3 (15.0%) | 13 (22.8%) | 0.3827 |
| АГ | 0 (0.0%) | 7 (25.9%) | 8 (40.0%) | 34 (59.6%) | 0.0009* |
| Мужчины | 7 (77.8%) | 17 (63%) | 11 (55%) | 26 (45.6%) | 0.2085 |
По возрасту пациенты из групп “ТИМ” и “АСБ” старше, чем пациенты групп “Контроль” и “Норма”. Пациентов с артериальной гипертензией (АГ) существенно больше в группах “АСБ” (60%) и “ТИМ” (40%). По полу и факту курения группы между собой не отличались.
В табл. 2, 3 представлены различия по показателям липидного профиля среди пациентов разных групп, которые позволяют сделать вывод о том, что группа “Контроль” отличается от остальных групп: по показателям ОХС, ХС ЛНП, ТГ и ИА.
Таблица 2.
Сравнение показателей липидного профиля среди групп пациентов
| Показатель | Группа (состояние стенки) | Уровень р (df = 3) |
|||
|---|---|---|---|---|---|
| контроль | норма | ТИМ | АСБ | ||
| Холестерин, ммоль/л | 4.46 [4.22; 4.92] | 6.43 [6.04; 6.82] | 5.81 [4.75; 8.28] | 6.63 [5.68; 7.51] | <0.0001* |
| Выше нормы | 0 (0.0%) | 25 (92.6%) | 13 (65.0%) | 51 (89.5%) | <0.0001* |
| ХС ЛНП, ммоль/л | 3.06 [2.45. 3. 17 ] | 4.43 [4.03; 4.78] | 3.64 [3.04; 4.98] | 4.74 [3.74; 5.28] | 0.0001* |
| Выше нормы | 6 (66.7%) | 27 (100.0%) | 15 (75.0%) | 51 (89.5%) | 0.0143* |
| ХС ЛВП, ммоль/л | 1.11 [0.99; 1.40] | 1.09 [0.94; 1.29] | 1.21 [1.07; 1.51] | 1.13 [0.98; 1.35] | 0.4809 |
| Ниже нормы | 3 (33.3%) | 8 (29.6%) | 4 (20.0%) | 17 (29.8%) | 0.8303 |
| Триглицериды, ммоль/л | 0.85 [0.75; 1.21] | 1.72 [1. 23. 2.54 ] | 1.21 [0.91; 1.92] | 1.48 [0.99; 2.07] | 0.0150* |
| Выше нормы | 0 (0.0%) | 13 (48.1%) | 6 (30.0%) | 23 (40.4%) | 0.0600 |
| Индекс атерогенности | 2.69 [2.00; 3.40] | 4.52 [3.92; 5.92] | 3.99 [3.13; 4.92] | 4.88 [3.76; 5.92] | 0.0003* |
| Выше нормы | 0 (0.0%) | 20 (74.1%) | 10 (50.0%) | 38 (66.7%) | 0.0005* |
Примечание: обозначения см. табл. 1.
Таблица 3.
Апостериорные попарные сравнения всех показателей со значимыми различиями (уровни статистической значимости)
| Показатели | Уровень р (Контроль – Норма) |
Уровень р (Контроль – ТИМ) |
Уровень р (Контроль – АСБ) |
Уровень р (Норма – ТИМ) |
Уровень р (Норма – АСБ) |
Уровень р (ТИМ – АСБ) |
|---|---|---|---|---|---|---|
| Холестерин, ммоль/л | 0.0009* | 0.0228* | <0.0001* | 0.7565 | 0.9868 | 0.4812 |
| ХС ЛНП, ммоль/л | 0.0048* | 0.1757 | 0.0005* | 0.4287 | 0.9595 | 0.1283 |
| Триглицериды, ммоль/л | 0.0221* | 0.3552 | 0.0658 | 0.4674 | 0.8060 | 0.8381 |
| Индекс атерогенности | 0.0027* | 0.1416 | 0.0013* | 0.3947 | 0.9997 | 0.3210 |
Примечание: обозначения см. табл. 1.
Концентрация ОХС в норме только у пациентов группы “Контроль”; в остальных группах у большинства она выше нормы. Уровень ХС ЛНП существенно выше нормативных показателей во всех группах, но доля тех, у кого ХС ЛНП в норме, наибольшая в группе “Контроль” (33%) и “ТИМ” (25%). Статистически значимых различий по концентрации и доли пациентов в группах по показателям ХС ЛВП и ТГ не обнаружено: ХС ЛВП и ТГ в норме у большинства пациентов. ИА выше нормы преимущественно у пациентов группы “Норма” (74%) и “АСБ” (67%).
В результате проведенного сравнения показателей СЭЕ в разных группах с принятыми за норму референтными значениями концентрации ЭТ и АТ-ЛПС (табл. 4) была выявлена статистически значимая разница по всем показателям для группы “АСБ”. Концентрация ЛПС у пациентов с наличием атеросклеротических бляшек в структуре стенки экстракраниального отдела БЦА была достоверно выше референтных значений принятой нормы (p < 0.001), а концентрация АТ-ЛПС-ФОБ достоверно снижена (p < 0.001). Среди пациентов группы “ТИМ” отмечается снижение концентрации АТ-ЛПС-ФОБ (p < 0.05). У обследованных из группы “Норма” отмечается повышение концентрации ЭТ (p < 0.05), при нормальном уровне активности АЭИ. Показатели СЭЕ у пациентов из группы “Контроль” схожи с таковыми из группы “ТИМ”: снижение концентрации АТ-ЛПС-ФОБ при нормальной концентрации ЭТ и АТ-ЛПС-ФИЛ.
Таблица 4.
Сравнение показателей СЭЕ у пациентов с разной степенью атеросклеротического поражения артерий с референтными значениями нормативных показателей
| Группа (состояние стенки) |
Показатель | ||
|---|---|---|---|
| ЭТ | АТ-ЛПС-ФОБ | АТ-ЛПС-ФИЛ | |
| значение нормы: | |||
| 0.3–1.0 EU/мл | 170–220 у.е.о.п. | 390–430 у.е.о.п. | |
| Контроль | 0.60 [0.60; 0.90] | 120.00 [86.00; 131.00] | 300.00 [220.00; 405.00] |
| p-value* | 0.1196 | <0.00001* | 0.3959 |
| Норма | 0.90 [0.60; 1.52] | 216.00 [132.50; 248.50] | 374.00 [199.00; 481.00] |
| p-value* | <0.01* | 0.4777 | 0.167 |
| ТИМ | 0.60 [0.41; 0.98] | 127.50 [105.75; 221.50] | 399.50 [195.75; 451.00] |
| p-value* | 0.4 | <0.01* | 0.3845 |
| АСБ | 1.20 [0.60; 1.80] | 123.00 [91.00; 187.00] | 265.00 [200.00; 399.00] |
| p-value* | <0.00001* | <0.00001* | <0.00001* |
В табл. 5 представлены различия по показателям СЭЕ между группами пациентов.
Таблица 5.
Сравнение показателей системной эндотоксинемии среди групп пациентов
| Показатель | Группа (состояние стенки) | Уровень р (df = 3) |
|||
|---|---|---|---|---|---|
| контроль | норма | ТИМ | АСБ | ||
| ЭТ, EU/мл | 0.60 [0.60; 0.90] | 0.90 [0.60; 1.52] | 0.60 [0.41; 0.98] | 1.20 [0.60; 1.80] | 0.0097* |
| Выше нормы | 2 (22.2%) | 9 (33.3%) | 5 (25.0%) | 33 (57.9%) | 0.0155* |
| АТ-ЛПС-ФОБ, у.е.о.п. | 120.00 [86.00; 131.00] | 216.00 [132.50; 248.50] | 127.50 [105.75; 221.50] | 123.00 [91.00; 187.00] | 0.0680 |
| Ниже нормы | 7 (77.8%) | 9 (33.3%) | 13 (65.0%) | 40 (70.2%) | 0.0473* |
| Норма | 1 (11.1%) | 8 (29.6%) | 2 (10.0%) | 6 (10.5%) | |
| Выше нормы | 1 (11.1%) | 10 (37.0%) | 5 (25.0%) | 11 (19.3%) | |
| АТ-ЛПС-ФИЛ, у.е.о.п. | 300.00 [220.00; 405.00] | 374.00 [199.00; 481.00] | 399.50 [195.75; 451.00] | 265.00 [200.00; 399.00] | 0.3432 |
| Ниже нормы | 6 (66.7%) | 15 (55.6%) | 9 (45.0%) | 42 (73.7%) | 0.2171 |
| Норма | 1 (11.1%) | 2 (7.4%) | 4 (20.0%) | 3 (5.3%) | |
| Выше нормы | 2 (22.2%) | 10 (37.0%) | 7 (35.0%) | 12 (21.1%) | |
| Отношение АТ-ЛПС-ФИЛ к АТ-ЛПС-ФОБ | 2.57 [2.25; 3.65] | 1.74 [1. 16. 2.36 ] | 2.11 [1.35. 4.44 ] | 2.14 [1.57; 2.72] | 0.1597 |
Примечание: обозначения см. табл. 1.
По концентрации ЭТ различаются группы “ТИМ” и “АСБ”: концентрация ЭТ в группе “АСБ” самая высокая, а самая низкая в группе “ТИМ”. Наибольшее число пациентов с ЭТ выше нормы также в группе “АСБ” (58%). Статистически значимых различий между группами по показателю АТ-ЛПС-ФИЛ не обнаружено. Максимальное число пациентов с уровнем АТ-ЛПС-ФОБ выше референтных значений отмечается в группе “Норма” (37%). Интересным представляется то, что число человек в группе “Норма” с повышенным уровнем ЭТ 33.3%, что близко к числу человек с увеличенным количеством АТ-ЛПС-ФИЛ. Практически аналогичную картину наблюдали в группе “Контроль”, где доля пациентов с нормальным уровнем ЛПС полностью совпадает с числом пациентов с концентрацией АТ-ЛПС-ФОБ ниже нормативных показателей (77.8 и 77.8% соответственно). Такое соответствие свидетельствует об отсутствии эндотоксиновой агрессии (ЭА) в группе “Контроль”: нет повышения концентрации ЭТ и снижения активности АЭИ. Похожие изменения в показателях СЭЕ были обнаружены и в группе “ТИМ”: низкие значения АТ-ЛПС-ФОБ при нормальном уровне ЭТ. Но группа “ТИМ” отличается от группы “Контроль” показателями липидного профиля. Хотя имеет место интересное соотношение: число тех, у кого ХС ЛНП превышают нормативные значения и число пациентов с нормальным уровнем ЭТ полностью совпадает (75 и 75%), также и с числом пациентов с повышенным уровнем ОХС и сниженным количеством АТ-ЛПС-ФОБ (65 и 65%). Эти крайне интересные факты косвенно подтверждают наличие общего для ЛПС и ОХС механизма транспорта [12, 27, 28], что побудило нас к проведению корреляционного анализа показателей СЭЕ и параметров липидного профиля.
На первом этапе проведения попарных корреляций нами было выявлено значительное влияние уровня ЭТ и соотношения АТ-ЛПС на значение ИА и концентрацию ОХС при построении линейной модели [29]. Однако при расширении выборки (с 80 до 113 чел.) в данном исследовании эти связи оказались близкими к нулю. Но при делении по половому признаку у мужчин была обнаружена положительная корреляция АТ-ЛПС-ФОБ с уровнем ОХС (rs = 0.28, р < 0.05) и ХС ЛНП (rs = 0.43, p < 0.01).
При проведении корреляционного анализа отдельно для каждой группы пациентов мы выявили, что у пациентов группы “ТИМ” определяется взаимосвязь концентрации АТ-ЛПС-ФОБ и ТГ (rs = –0.52, p < 0.05): при увеличении концентрации АТ-ЛПС-ФОБ концентрация ТГ снижается. Влияния уровня ЭТ на концентрацию ХС ЛНП или ОХС ни в одной из групп отмечено не было. В группе “Норма” отмечается положительная корреляция концентрации АТ-ЛПС-ФИЛ (rs = = 0.45, p < 0.05) и отношения АТ-ЛПС-ФИЛ/АТ-ЛПС-ФОБ (rs = 0.44, p < 0.05) на уровень ХС ЛНП, и отрицательное влияние отношения АТ-ЛПС-ФИЛ/АТ-ЛПС-ФОБ на уровень ТГ (rs = –0.44, p < 0.05). При построении множественной линейной регрессионной модели показателей липидного профиля выявлено, что концентрация ОХС увеличивается на 1.13 и 1.27 единиц при увеличении ХС ЛНП и ХС ЛВП на 1 единицу соответственно (rs = 0.8633, p < 0.0001). При включении в модель ЭТ влияния на уровень ОХС не обнаружилось. Таким образом, выявленные нами взаимосвязи могут подтверждать общность транспортных механизмов ЛПС и ОХС за счет взаимодействия АТ-ЛПС и липопротеинов. Кроме того, на основании выявленных взаимосвязей, нам представляется важным изучение роли ЭТ и АТ-ЛПС в обмене ТГ, поскольку гипертриглицеридемия является независимым фактором риска развития атеросклероза [30], ассоциируется с развитием метаболического синдрома и ожирения. Последние два могут быть проявлением вялотекущего ЛПС-индуцированного воспаления.
Изучение взаимосвязи СЭЕ с липидным обменом является ключевым элементом познания тонких механизмов атерогенеза, о чем в определенной степени может свидетельствовать обнаруженная нами логарифмическая закономерность между показателями концентрации ЭТ, значениями ИА, уровнями ОХС и ХС ЛНП (рис. 1). Если рассматривать атеросклероз как динамическую модель в зависимости от выраженности ультразвуковых изменений стенки артерии, то последовательность событий можно представить следующим образом. Нормальная структура стенки при отсутствии дислипидемии и ЭА (группа “Контроль”). Далее, при возрастании уровня ЭТ, если считать его инициирующим фактором, наблюдается схожая кривая прироста ИА, концентрации ХС ЛНП и ОХС (группа “Норма”). Затем при прогрессировании атеросклероза отмечается утолщение и уплотнение стенки, на фоне которого регистрируется снижение концентрации ЛПС, нормализация ИА, уровня ХС ЛНП и ОХС (группа “ТИМ”) на фоне истощения АЭИ (как следствие перенесенной ЭА) (табл. 5), проявляющегося в снижении количества АТ-ЛПС-ФОБ с последующим исходом в формирование атеросклеротической бляшки при возрастании уровня ЭТ, сопровождаемое приростом ИА и повышением концентрации ХС ЛНП и ОХС.
Рис. 1.
Динамическая модель взаимосвязи ультразвуковых изменений структуры стенки артерии. Ось Х – группа по состоянию стенки (1 – группа “Контроль”, 2 – группа “Норма”, 3 – группа “ТИМ”, 4 – группа АСБ); ось Y – концентрация показателей (А – ЭТ, EU/мл, Б – ИА, В – ХС ЛНП, ммоль/л, Г – ОХС, ммоль/л).
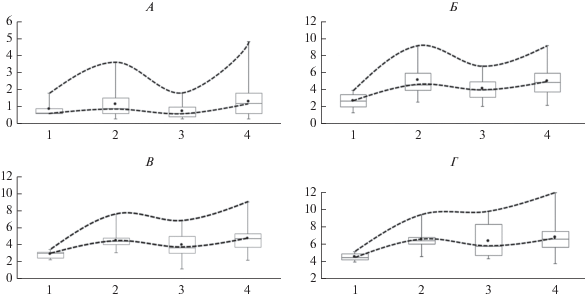
Выявленные нами закономерности формы кривой дают возможность предположить более сложные механизмы влияния ЛПС на показатели липидного профиля, нежели прямые корреляции.
Изучение роли СЭЕ в прогрессировании атеросклероза невозможно без проведения статистического однофакторного анализа рисков попадания пациентов в группу по состоянию стенки. Статистическая значимость влияния факторов на целевое событие (группа по состоянию стенки) осуществлялась с помощью критерия Хи-квадрат Пирсона с включением количественных, бинарных и номинальных факторов. Все факторы сортировались по убыванию значимости (статистика Хи-квадрат), и таким образом были отобраны ключевые факторы развития события (попадание в соответствующую группу “ТИМ”, “АСБ” и объединенная группа “ТИМ + + АСБ”). В табл. 6 представлен список факторов, влияющих на попадание пациента в группу “ТИМ”.
Таблица 6.
Топ-14 ключевых факторов риска для пациентов группы “ТИМ” (оценки абсолютных рисков, изменение риска, относительный риск)
| Фактор | ТИМ (риск, %) | Изменение риска (95% ДИ) |
Относительный риск (95% ДИ) | Уровень р | |
|---|---|---|---|---|---|
| фактор: Нет | фактор: Есть | ||||
| ХС ЛНП < 3.9 ммоль/л | 7 (23.3%) | 13 (76.5%) | 53.1 (27.9; 78.3)% | 3.28 (1.63; 6.60) | 0.0004* |
| Возраст ≥ 52.0 лет | 5 (20.0%) | 15 (68.2%) | 48.2 (23.2; 73.2)% | 3.41 (1.48; 7.85) | 0.0009* |
| Холестерин < 5.9 ммоль/л | 9 (27.3%) | 11 (78.6%) | 51.3 (25.0; 77.6)% | 2.88 (1.55; 5.36) | 0.0011* |
| Возраст: старше 55 лет | 8 (26.7%) | 12 (70.6%) | 43.9 (17.1; 70.7)% | 2.65 (1.36; 5.16) | 0.0034* |
| ХС ЛНП (Норма) | 15 (35.7%) | 5 (100.0%) | 64.3 (49.8; 78.8)% | 2.8 (1.87; 4.20) | 0.0060* |
| АТ-ЛПС-ФОБ < < 163.0 у.е.о.п. | 7 (25.9%) | 13 (65.0%) | 39.1 (12.4; 65.7)% | 2.51 (1.23; 5.12) | 0.0074* |
| Холестерин (Норма) | 13 (34.2%) | 7 (77.8%) | 43.6 (12.5; 74.6)% | 2.27 (1.30; 3.99) | 0.0175* |
| Триглицериды < 1.2 ммоль/л | 10 (31.2%) | 10 (66.7%) | 35.4 (6.7; 64.2)% | 2.13 (1.14; 3.99) | 0.0221* |
| АТ-ЛПС-ФОБ (Ниже нормы) | 7 (28.0%) | 13 (59.1%) | 31.1 (4.0; 58.1)% | 2.11 (1.03; 4.33) | 0.0315* |
| ХС ЛВП ≥ 1.4 ммоль/л | 12 (34.3%) | 8 (66.7%) | 32.4 (1.4; 63.3)% | 1.94 (1.06; 3.57) | 0.0503 |
| ЭТ< 0.9 EU/мл | 7 (29.2%) | 13 (56.5%) | 27.4 (0.1; 54.6)% | 1.94 (0.94; 3.98) | 0.0579 |
| Отношение АТ-ЛПС-ФИЛ к АТ-ЛПС-ФОБ ≥ 1.8 | 6 (28.6%) | 14 (53.8%) | 25.3 (–1.9; 52.5)% | 1.88 (0.88; 4.05) | 0.0814 |
| Индекс атерогенности (Норма) | 10 (33.3%) | 10 (58.8%) | 25.5 (–3.4; 54.3)% | 1.76 (0.93; 3.36) | 0.0895 |
| Индекс атерогенности < 4.3 | 7 (30.4%) | 13 (54.2%) | 23.7 (–3.7; 51.1)% | 1.78 (0.87; 3.65) | 0.1000 |
Примечание: обозначения см. табл. 1.
На основании табл. 6 можно сделать вывод о том, что 9 из 14 факторов имеют статистическую значимость в распределении пациентов в группу “ТИМ” с диапазоном уровней рисков от 31.1 до 64.3%. При наличии данных факторов из списка риск пациента иметь утолщенный комплекс интима-медиа БЦА увеличиваются от 23.7 до 64.3%. Лидирующими факторами с повышением уровней рисков от 48.2 до 53.1% являются: “Холестерин < 5.9 ммоль/л”, “Возраст ≥ 52.0 лет” и “ХС ЛНП < 3.9 ммоль/л”. Статистически незначимыми факторами оказались: “Индекс атерогенности < 4.3”, “Индекс атерогенности (Норма)” и “Отношение АТ-ЛПС-ФИЛ/АТ-ЛПС-ФОБ ≥ 1.8”, которые повышают риск оказаться в группе “ТИМ” от 23.7 до 25.5%.
В табл. 7 представлен список факторов, влияющих на попадание пациента в группу “АСБ”.
Таблица 7.
Топ-14 ключевых факторов риска для пациентов группы “АСБ” (оценки абсолютных рисков, изменение риска, относительный риск)
| Фактор | АСБ (риск, %) | Изменение риска (95% ДИ) | Относительный риск (95% ДИ) | Уровень р | |
|---|---|---|---|---|---|
| фактор: Нет | фактор: Есть | ||||
| Возраст ≥ 52.0 лет | 11 (35.5%) | 46 (86.8%) | 51.3 (32.2; 70.5)% | 2.45 (1.50; 3.98) | <0.0001* |
| Возраст (Старше 55 лет) | 19 (46.3%) | 38 (88.4%) | 42.0 (24.0; 60.1)% | 1.91 (1.35; 2.70) | <0.0001* |
| АТ-ЛПС-ФОБ< 163.0 у.е.о.п. | 20 (50.0%) | 37 (84.1%) | 34.1 (15.2; 53.0)% | 1.68 (1.20; 2.35) | 0.0008* |
| АТ-ЛПС-ФОБ (Ниже нормы) | 17 (48.6%) | 40 (81.6%) | 33.1 (13.3; 52.9)% | 1.68 (1.17; 2.42) | 0.0014 |
| АГ (Есть) | 23 (53.5%) | 34 (82.9%) | 29.4 (10.6; 48.3)% | 1.55 (1.14; 2.12) | 0.0039* |
| АТ-ЛПС-ФИЛ< 447.0 у.е.о.п. | 8 (44.4%) | 49 (74.2%) | 29.8 (4.5; 55.1)% | 1.67 (0.98; 2.85) | 0.0164* |
| Холестерин ≥ 7.4 ммоль/л | 40 (61.5%) | 17 (89.5%) | 27.9 (9.8; 46.1)% | 1.45 (1.14; 1.86) | 0.0218* |
| ХС ЛНП ≥ 4.8 ммоль/л | 30 (58.8%) | 27 (81.8%) | 23.0 (4.1; 41.9)% | 1.39 (1.05; 1.84) | 0.0275* |
| ЭТ ≥ 1.2 EU/мл | 24 (57.1%) | 33 (78.6%) | 21.4 (2.0; 40.9)% | 1.38 (1.01; 1.87) | 0.0355* |
| ЭТ (Вышенормы) | 24 (57.1%) | 33 (78.6%) | 21.4 (2.0; 40.9)% | 1.38 (1.01; 1.87) | 0.0355* |
| Отношение АТ-ЛПС-ФИЛ к АТ-ЛПС-ФОБ ≥ 1.8 | 18 (54.5%) | 39 (76.5%) | 21.9 (1.3; 42.5)% | 1.4 (0.99; 1.98) | 0.0356* |
| Группа (ЛП) (Норма) | 49 (64.5%) | 8 (100.0%) | 35.5 (24.8; 46.3)% | 1.55 (1.31; 1.83) | 0.0407* |
| ХС ЛНП (Норма) | 51 (65.4%) | 6 (100.0%) | 34.6 (24.1; 45.2)% | 1.53 (1.30; 1.80) | 0.0802 |
| Пол (Женский) | 26 (60.5%) | 31 (75.6%) | 15.1 (–4.5; 34.8)% | 1.25 (0.93; 1.68) | 0.1374 |
Примечание: обозначения см. табл. 1.
На основании табл. 7 можно сделать вывод о том, что 12 из 14 факторов имеют статистическую значимость в распределении пациентов в группу “АСБ” с диапазоном уровней рисков от 21.4 до 51.3%. При наличии данных факторов из списка риск, что у пациента будет лоцирована одна и более атеросклеротическая бляшка в БЦА, увеличивается от 15.1 до 51.3%. Лидирующими факторами с повышением уровней рисков от 34.1 до 51.3% являются: “АТ-ЛПС-ФОБ < 163.0 у. е. о. п.”, “Возраст старше 55 лет” и “Возраст ≥ 52.0 лет”. Статистически незначимыми факторами оказались: “ХС ЛНП (Норма)" и "Пол (Женский)”, которые повышают уровень риска от 15.1 до 34.6%.
В табл. 8 представлен список факторов, которые влияют на развитие изменений стенки артерий, включающие утолщение и формирование атеросклеротической бляшки.
Таблица 8.
Топ-14 ключевых факторов риска для пациентов объединенной группы “ТИМ + АСБ” (оценки абсолютных рисков, изменение риска, относительный риск)
| Фактор | ТИМ + АСБ (риск, %) | Изменение риска (95% ДИ) | Относительный риск (95% ДИ) | Уровень р | |
|---|---|---|---|---|---|
| фактор: Нет | фактор: Есть | ||||
| Возраст ≥ 52.0 лет | 16 (44.4%) | 61 (89.7%) | 45.3 (27.5; 63.0)% | 2.02 (1.39; 2.93) | <0.0001* |
| Возраст (Старше 55 лет) | 27 (55.1%) | 50 (90.9%) | 35.8 (19.9; 51.7)% | 1.65 (1.26; 2.15) | <0.0001* |
| АТ-ЛПС-ФОБ < 163.0 у.е.о.п. | 27 (57.4%) | 50 (87.7%) | 30.3 (13.8; 46.8)% | 1.53 (1.17; 1.99) | 0.0005* |
| АТ-ЛПС-ФОБ (Ниже нормы) | 24 (57.1%) | 53 (85.5%) | 28.3 (11.0; 45.7)% | 1.5 (1.13; 1.98) | 0.0012* |
| АГ (Есть) | 35 (63.6%) | 42 (85.7%) | 22.1 (6.0; 38.1)% | 1.35 (1.07; 1.70) | 0.0104* |
| Холестерин < 5.7 ммоль/л | 53 (67.9%) | 24 (92.3%) | 24.4 (9.8; 38.9)% | 1.36 (1.13; 1.64) | 0.0141* |
| Отношение АТ-ЛПС-ФИЛ к АТ-ЛПС-ФОБ ≥ 1.8 | 24 (61.5%) | 53 (81.5%) | 20.0 (2.1; 37.9)% | 1.32 (1.01; 1.74) | 0.0243* |
| ХС ЛНП ≥ 3.9 ммоль/л | 29 (87.9%) | 48 (67.6%) | –20.3 (–35.8; –4.7)% | 0.77 (0.63; 0.94) | 0.0282* |
| ХС ЛНП (Норма) | 66 (71.0%) | 11 (100.0%) | 29.0 (19.8; 38.3)% | 1.41 (1.24; 1.60) | 0.0378* |
| АТ-ЛПС-ФИЛ < 447.0 у.е.о.п. | 14 (58.3%) | 63 (78.8%) | 20.4 (–1.2; 42.1)% | 1.35 (0.94; 1.93) | 0.0454* |
| Триглицериды< 1.4 ммоль/л | 40 (67.8%) | 37 (82.2%) | 14.4 (–1.9; 30.8)% | 1.21 (0.97; 1.51) | 0.0964 |
| ЭТ ≥ 1.0 EU/мл | 38 (67.9%) | 39 (81.2%) | 13.4 (–3.1; 29.9)% | 1.2 (0.96; 1.50) | 0.1204 |
| ЭТ (Выше нормы) | 39 (68.4%) | 38 (80.9%) | 12.4 (–4.1; 28.9)% | 1.18 (0.94; 1.48) | 0.1502 |
| Пол (Женский) | 37 (68.5%) | 40 (80.0%) | 11.5 (–5.1; 28.1)% | 1.17 (0.93; 1.47) | 0.1821 |
Примечание: обозначения см. табл. 1.
На основании табл. 8 можно сделать вывод о том, что 10 из 14 факторов имеют статистическую значимость в выявлении у пациентов нарушенной структуры стенки и атеросклеротической бляшки с диапазоном уровней рисков от 20.4 до 45.3%. Под воздействием влияния факторов из списка, риски попадания в объединенную группу “ТИМ + АСБ” увеличиваются от 11.5 до 45.3%. Лидирующими факторами с повышением уровней рисков от 30.3 до 45.3% являются: “АТ-ЛПС-ФОБ < 163.0 у. е. о. п.”, “Возраст старше 55 лет” и “Возраст ≥ 52.0 лет”. Статистически незначимые факторы: “ЭТ (Выше нормы)” и "Пол (Женский)”, которые повышают уровень риска от 11.5 до 13.9%.
Результаты проведенного исследования показали, что у пациентов со стойкими атеросклеротическими изменениями в виде формирования атеросклеротической бляшки (группа “АСБ”) имеет место хроническая ЭА. В сравнении с пациентами из других групп с начальными изменениями стенки артерий или только с биохимическими маркерами атеросклероза (нарушения липидного профиля), в группе “АСБ” отмечается повышение концентрации ЭТ и снижение концентрации АТ к обеим частям молекулы ЛПС. Среди пациентов с утолщенным комплексом интима-медиа и с нормальным строением стенки параметры СЭЕ имеют выборочные отклонения от референтных значений нормы. Интересным представляется выявленный нами факт схожих значений в концентрации ЭТ и АТ-ЛПС-ФОБ в группах “Контроль” и “ТИМ”. По показателям СЭЕ эти две группы не отличаются, но и по параметрам липидного профиля только уровень ОХС выше в группе “ТИМ”. Больший вклад в различия между пациентами вносит возраст обследуемых и наличие АГ. Эти показатели – признанные факторы риска атеросклероза. Также как и мужской пол, который является фактором риска и вносит свой вклад в выявление корреляций между показателями СЭЕ и параметрами липидного профиля. Необходимость внесения поправок на пол и группу по состоянию стенки, при выявлении взаимодействий между показателями СЭЕ и параметрами липидного профиля не дает возможность подтвердить, что показатели СЭЕ являются независимыми факторами риска развития атеросклероза.
При проведении многофакторного анализа с оценкой рисков фактор “Возраст” стоит на первом месте для всех групп пациентов, а далее ведущими факторами выступают АТ-ЛПС. Это может определять ни столько роль нарушения микробиоты и, соответственно, влияние концентрации ЭТ на атерогенез, сколько важность состояния АЭИ на прогрессирование болезней атеросклеротической природы. При нормальном уровне АТ-ЛПС, несмотря на наличие дислипидемии, не определяется нарушение структуры стенки БЦА (группа “Норма”). При снижении концентрации АТ-ЛПС отмечается сначала отек медии и нарушение трехслойной структуры стенки артерии (группа “ТИМ”), а в дальнейшем, при продолжающейся ЭА и отсутствии должного прироста количества АТ-ЛПС, это ведет к формированию атеросклеротической бляшки. Выявленные динамические изменения структуры стенки, при соотношении их с динамикой показателей липидного профиля и СЭЕ среди групп, дают основания предполагать возможную обратимость атеросклероза за счет влияния на показатели СЭЕ и снижения степени ЭА. Этот вопрос подлежит изучению. Выявленная нами зависимость концентрации ТГ и ХС ЛНП от концентрации АТ-ЛПС-ФОБ и отношения АТ-ЛПС также требует дальнейшего изучения на уровне клеточных моделей или в экспериментах на животных.
ЗАКЛЮЧЕНИЕ
Выявленные нами достоверные различия параметров СЭЕ у пациентов без клинических проявлений атеросклероза подтверждают правомочность эндотоксиновой концепции атерогенеза [19] и дают возможность рассматривать хроническую ЭА как важный фактор риска развития и патогенеза заболеваний атеросклеротической природы. Избыток ЛПС в общем кровотоке при сниженной активности АЭИ (являющимися главными признаками наличия ЭА), позволяет использовать показатели СЭЕ в качестве прогностических маркеров течения атеросклеротического процесса.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Научно-исследовательского института общей патологии и патофизиологии (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Wu M.Y., Li C.J., Hou M.F., Chu P.Y. New Insights into the Role of Inflammation in the Pathogenesis of Atherosclerosis // Int. J. Mol. Sci. 2017. V. 18. № 10. P. 2034.
Anderson T.J., Gregoire J., Hegele R.A. et al. 2012 update of the Canadian Cardiovascular Society guidelines for the diagnosis and treatment of dyslipidemia for the prevention of cardiovascular disease in the adult // Can. J. Cardiol. 2013. V. 29. № 2. P. 151.
El Harchaoui K., van der Steeg W.A., Stroes E.S. et al. Value of low-density lipoprotein particle number and size as predictors of coronary artery disease in apparently healthy men and women. The EPIC-Norfolk prospective population study // J. Amer. Coll. Cardiology. 2007. V. 49. № 5. P. 547.
Салахов И.М., Аниховская И.А., Майский И.А. и др. Нормативные показатели системной эндотоксинемии как базисный элемент определения роли липополисахаридов кишечной микрофлоры в общей патологии // Патогенез. 2015. Т. 13. № 1. С. 18.
Findlay L., Desai T., Heath A. et al. Collaborative study for the establishment of the WHO 3(rd) International Standard for Endotoxin, the Ph. Eur. endotoxin biological reference preparation batch 5 and the USP Reference Standard for Endotoxin Lot H0K354 // Pharmeur. Bio. Sci. Notes. 2015. P. 73.
Яковлев М.Ю. Кишечный эндотоксин и воспаление / Дерматовенерология. Национальное руководство. Краткое издание. М.: ГЭОТАР-Медиа, 2013. Гл. 8. С. 70.
Rittig N., Thomsen H.H., Bach E. et al. Hormone and Cytokine Responses to Repeated Endotoxin Exposures. No Evidence of Endotoxin Tolerance After 5 Weeks in Humans // Shock. 2015. V. 44. № 1. P. 32.
Swann J.R., Want E.J., Geier F.M. et al. Systemic gut microbial modulation of bile acid metabolism in host tissue compartments // Proc. Natl. Acad. Sci. 2011. V. 108. № 1. P. 4523.
Battson M.L., Lee D.M., Weir T.L., Gentile C.L. The Gut Microbiota as a Novel Regulator of Cardiovascular Function and Disease // J. Nutr. Biochem. 2018. V. 56. P. 1.
Wu P., Jia F., Zhang B., Zhang P. Risk of cardiovascular disease in inflammatory bowel disease // J. Exp. Ther. Med. 2017. V. 13. № 2. P. 395.
Покусаева Д.П. Механизмы влияния системной эндотоксинемии на развитие и течение атеросклероза на клеточном, системном и организменном уровнях // Патогенез. 2018. Т. 6. № 2. С. 12.
Окороков П.Л., Аниховская И.А., Яковлева М.М. и др. Алиментарный фактор как вероятный индуктор воспаления или липидный компонент механизма транспорта кишечного эндотоксина // Физиология человека. 2012. Т. 38. № 6. С. 105.
Horseman M.A., Surani S., Bowman J.D. Endotoxin, toll-like receptor-4, and atherosclerotic heart disease // Current. Cardiology Reviews. 2017. V. 13. № 2. P. 86.
Li J., Lin S., Vanhoutte P.M. et al. Akkermansia Muciniphila Protects Against Atherosclerosis by Preventing Metabolic Endotoxemia – Induced Inflammation in Apoe-/-Mice // Circulation. 2016. V. 133. № 24. P. 2434.
Singh S., Singh H., Loftus E.V., Pardi D.S. Risk of cerebrovascular accidents and ischemic heart disease in patients with inflammatory bowel disease: a systematic review and meta-analysis // Clin. Gastroenterol. Hepatol. 2014. V. 12. № 3. P. 382.
Geng S., Yuan R., Li L. Chronic Polarization of Inflammatory Monocytes by Super-Low Grade Endotoxin Aggravates the Pathogenesis of Atherosclerosis // Circulation. 2017. V. 136. № 1. P. A20934.
Яковлев М.Ю. Эндотоксиновый шок // Казанский медицинский журн. 1987. Т. 68. № 3. С. 207.
Jiang D., Yang Y., Li D. Lipopolysaccharide induced vascular smooth muscle cells proliferation: A new potential therapeutic target for proliferative vascular diseases // J. Cell Proliferation. 2017. V. 50. № 2. P. e12332.
Аниховская И.А., Кубатиев А.А., Яковлев М.Ю. Эндотоксиновая теория атеросклероза // Физиология человека. 2015. Т. 41. № 1. С. 106.
Чижиков Н.В., Лиходед В.Г., Светухин А.М., Яковлев М.Ю. Эндотоксин кишечной микрофлоры в клинике и патогенезе хронической ишемии нижних конечностей. Пенза. Издательство ПГПУ им. В.Г. Белинского, 2002. 169 с.
Аниховская И.А., Кубатиев А.А., Салахов И.М. и др. Динамика концентрации эндотоксина в сыворотке крови у больных с острым неосложненным Q-инфарктом миокарда // Патологическая физиология и экспериментальная терапия. 2015. Т. 59. № 3. С. 55.
Stock J. Gut microbiota: an environmental risk factor for cardiovascular disease // Atherosclerosis. 2013. V. 229. № 2. P. 440.
Diks S.H., van Deventer S.J.H., Peppelenbosch M.P. Lipopolysaccharide recognition, internalisation, signalling and other cellular effects // J. Endotoxin Research. 2001. V. 7. № 5. P. 335.
Trebicka E., Jacob S., Pirzai W. et al. Role of antilipopolysaccharide antibodies in serum bactericidal activity against Salmonella enterica serovar Typhimurium in healthy adults and children in the United States // Clinical and vaccine immunology. 2013. V. 20. № 10. P. 1491.
Poxton I. R. Antibodies to lipopolysaccharide // J. Immunological Methods. 1995. V. 186. № 1. P. 1.
Лиходед В.Г., Бондаренко В.М., Гинцбург А.Л. Рецепторная теория атеросклероза // Вестник Российской Академии Медицинских Наук. 2010. № 5. С. 11.
Lehr H.A., Sagban T.A., Ihling C. et al. Immunopathogenesis of atherosclerosis // Circulation. 2001. V. 104. № 8. P. 914.
Neves A.L., Coelho J., Couto L. et al. Metabolic endotoxemia: a molecular link between obesity and cardiovascular disease // J. Mol. Endocrinol. 2013. V. 51. № 2. P. R51.
Покусаева Д.П., Аниховская И.А, Коробкова Л.А., Яковлев М.Ю. Коррелятивные взаимосвязи между показателями системной эндотоксинемии и липидного профиля у пациентов без клинических проявлений атеросклероза // Патогенез. 2018. Т. 16. № 4. С. 182.
Peng J., Luo F., Ruan G. et al. Hypertriglyceridemia and atherosclerosis // Lipids in Health and Disease. 2017. V. 16. № 1. P. 233.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


