Физиология человека, 2019, T. 45, № 5, стр. 91-98
Поиск белков протеома крови-регуляторов костного ремоделирования у космонавтов
Л. Х. Пастушкова 1, А. Г. Гончарова 1, Г. Ю. Васильева 1, *, С. К. Тагирова 1, 3, Д. Н. Каширина 1, О. В. Сайк 2, Й. Риттвегер 4, И. М. Ларина 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 Учреждение СО РАН Институт цитологии и генетики РАН
Новосибирск, Россия
3 ГБУЗ Городская клиническая больница № 29 им. Н.Э. Баумана Департамента здравоохранения
Москва, Россия
4 Германский аэрокосмический центр, Институт аэрокосмической медицины
Кельн, Германия
* E-mail: galvassilieva@mail.ru
Поступила в редакцию 26.11.2018
После доработки 15.02.2019
Принята к публикации 03.04.2019
Аннотация
На основе протеомики представлены современные данные об особенностях костного ремоделирования у космонавтов, совершивших длительные полеты. Описаны регуляторные белки протеома крови, достоверно связанные с процессами костного ремоделирования. С помощью анализа больших объемов данных впервые выстроены ассоциативные связи между сигнальными белками – регуляторами процессов, характеризующие новые звенья костного ремоделирования у космонавтов в острый период реадаптации после приземления.
Несмотря на фундаментальные исследования изменений системных и местных факторов ремоделирования костной ткани под влиянием комплекса факторов космического полета, регуляция процессов ремоделирования не до конца изучена. Ремоделирование костной ткани является непрерывным процессом, который направлен на сохранение механических свойств скелета в условиях меняющихся факторов среды. Депонирование кальция и обмен этим ионом с внеклеточной жидкостью вовлекает костную ткань в гомеостаз кальция. В целом, ремоделирование – это совокупность биохимических реакций, протекающих последовательно или параллельно по механизмам прямой и обратной связи, осуществляющихся под влиянием системных и местных регуляторов. Сдвиг процессов в сторону преобладания резорбции может развиться под влиянием совокупности факторов, в том числе – длительного космического полета (КП) [1, 2]. Как известно, ведущими факторами КП, влияющим на остеогенез, являются микрогравитация [3], гипомагнитная среда [4], радиационные эффекты [5, 6], гиподинамия и недостаточность витамина Д [7], изменения гормональной рецепторной чувствительности и биологических ритмов секреции гормонов [8]. На мезенхимальных стромальных клетках костного мозга показаны изменения экспрессии генов (COL15A1, CXCL12, DPT и WISP2) [9]. Отмечено, что функциональная адаптация костной системы реализуется через изменения метаболической активности остеобластов и остеокластов (изменяется содержание в сыворотке крови остеокальцина, тартрат-резистентной кислой фосфатазы, остеопротегерина и лиганда рецептора – активатора ядерного фактора каппа-В), и экспрессии генов в лейкоцитах периферической крови, вовлеченных в формирование, рост, развитие, функционирование и метаболизм костной ткани. Значительная вариабельность изменений минеральной плотности в шейке бедренной кости и изученных молекулярно-генетических маркеров, наблюдавшаяся после завершения длительных космических миссий, свидетельствует об индивидуальной вариабельности баланса процессов ремоделирования костной ткани – резорбции и костеобразования [10]. Поэтому представляется актуальным исследование протеома космонавтов для поиска регуляторных белков, повышающих метаболическую активность остеокластов.
Заслуживает внимания гипотеза о сдвиге жидкости и изменениях гидростатического давления, играющие важную роль в механотрансдукции кости и последующем костном ремоделировании. Это объясняет, как сдвиг жидкости в торакокраниальном направлении может способствовать избирательной потере плотности костной ткани, которая возникает под воздействием микрогравитации [11–13].
Другие физиологические изменения, которые наблюдаются в условиях микрогравитации, очевидно могут также способствовать потере костной массы при разгрузке скелета; в том числе низкие уровни витамина Д [7], окислительный стресс [14], радиационное облучение [5, 6], ацидоз [14] и, возможно, снижение уровня половых стероидов [15]. Описана роль RhoA-киназы в поддержании образования волокон напряжения актина и экспрессии синтазы оксида азота в условиях моделируемой микрогравитации [16]. Эти предлагаемые механизмы могут быть частью системного ответа на микрогравитацию, что в конечном итоге приводит к изменению физиологии человека. Все эти изменения имеют потенциальные последствия для долгосрочных эффектов воздействия микрогравитации на метаболизм костей.
Таким образом, регуляция костного ремоделирования – многоуровневый процесс, в который вовлечены как клеточные, так и системные регуляторные факторы. Большинство из них имеют белковую природу (регуляторные белки, белки транспортеры, белки рецепторы, ферменты, факторы роста, цитокины, др.) [8, 16]. Поэтому, по нашему мнению, именно протеомные исследования могут стать связующим звеном в интерпретации разнообразных результатов исследования изменений костной ткани под влиянием комплекса экстремальных факторов. Существующие протеомные методы на основе хромато-масс-спектрометрии позволяют проводить крупномасштабные аналитические исследования для обнаружения, идентификации и функционального исследования протеомов. Изменение экспрессии белков является свидетельством модификации регуляторных механизмов, в том числе индуцированных микрогравитацией, и получение информации такого рода важно для направленного поиска эффективных контрмер изменений костного ремоделирования в КП [17]. Большое значение имеет описание ассоциативных связей между регуляторными белками (молекулярный уровень), процессами пролиферации, дифференцировки, активности остеобластов и остеокластов (клеточный уровень), сопряжения процессов остеокласты – резорбция и остеобласты – новообразование костной ткани, ее минерализация (тканевый уровень), а также системный уровень.
Цель работы – исследование регуляторных белков протеома крови – регуляторов костного ремоделирования и описание ассоциативных связей, характеризующих процессы метаболизма кости у космонавтов после длительных космических полетов.
МЕТОДИКА
В анализе образцов крови принимали участие 18 российских космонавтов (средний ± SD возраст: 44 ± 6 лет, все мужчины) в рамках эксперимента “Протеом крови и мочи”. Венозную кровь отбирали за 30 дней до старта (сокращенно L-30), через сутки после приземления (R + 1) и через 7 дней после возвращения на Землю (R + 7) в коммерческие пробирки SARSTEDT-Monovette®, содержащие K-EDTA, отделяли плазму и замораживали при –80°С до проведения анализа. Ингибиторы протеаз или антимикробные агенты не добавляли.
Целевая панель для анализа с помощью хромато-масс-спектрометрии с мониторингом множественных реакций (ЖХ/МРМ-МС) состояла из белков, осуществляющих свои функции во внеклеточной жидкости. Для количественного определения белков крови в качестве внутренних стандартов использовали 13С/15N-меченые пептидные аналоги, отобранные и синтезированные в Genome BC Proteomics Centre (Университет Виктории, Канада). Чистота SIS пептидов составляла в среднем 94.2%. Анализ ЖХ/МРМ-МС проводили на колонке Zorbax Eclipse Plus RP-UHPLC в системе хроматографа UPLC 1290 Infinity (все от Agi-lent Technologies), сопряженного с тройным квадрупольным масс-спектрометром (Agilent 6490) через источник Jet Stream™ от Agilent в режиме электроспрейной ионизации положительными ионами. Данные мониторинга множественных реакций визуализировали и исследовали с помощью программного обеспечения Mass Hunter для количественного анализа (версия B.07.00, Agilent).
Статистический анализ проводили в программном пакете Statistica 7 с использованием многофакторного дисперсионного анализа. Поисковую систему PubMed использовали для определения функций, биологических процессов и регуляторных путей. Дополнительную информацию о свойствах и молекулярной массе белков получали с помощью базы данных Uniprot (https:// www.uniprot.org/).
Реконструкция ассоциативных генных сетей осуществляли с помощью программы ANDSystem, предназначенной для автоматической экстракции знаний по биомедицинской тематике из текстов научных публикаций и баз данных. В ассоциативные генные сети включили все достоверно различающиеся белки. Связь с функциональным состоянием костной ткани устанавливали через идентификатор *bone*, которому соответствовали основные биологические процессы, согласно генным онтологиям, указанные в базе данных Go и содержащихся в базе знаний системы ANDSystem.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Исследованы образцы крови 18 российских космонавтов, в трех временны́х точках относительно периода космического полета. В результате идентификации были получены списки белков для каждого космонавта с указанием концентрации белка в крови (фмоль/мкл). Всего определены концентрации для 125 различных белков внеклеточной жидкости. С помощью программного пакета Statistica 7 был проведен многофакторный дисперсионный анализ (ANOVA), в результате чего был получен список белков, достоверно различающихся между точками эксперимента (p-value < < 0.05). С помощью программы ANDSystem установлено, что 3 из 19 достоверно различающихся белков напрямую связаны с процессами ремоделирования костной ткани как регуляторные белки (табл. 1).
Таблица 1.
Белки, с достоверно различающимися концентрациями между фоном, +1 и +7 сут, напрямую связанные с процессами ремоделирования костной ткани
| Название белка | M ± SD, фмоль/мкл | p-values | М (кДа) | ||||
|---|---|---|---|---|---|---|---|
| L-30 | R + 1 | R + 7 | L-30 vs R + 1 | R + 1 vs R + 7 | L-30 vs R + 7 | ||
| Цистатин С | 71.9 ± 32.6 | 41.9 ± 22.52 | 49 ± 37.61 | 0.014 | 0.630 | 0.218 | 15.8 |
| Фибронектин | 121.8 ± 36.5 | 100.9 ± 21.73 | 110.9 ± 18.5 | 0.044 | 0.145 | 0.267 | 262.6 |
| Фетуин-A | 134.2 ± 75.9 | 80.3 ± 38.13 | 86.3 ± 51.1 | 0.037 | 0.794 | 0.215 | 39.3 |
Опираясь на представление, что один белок может участвовать в регуляции множества процессов [17, 18], методом ручной аннотации анализировалась связь белков с достоверно различающимися концентрациями (цистатин C, фетуин-А и фибронектин) и процессов костного ремоделирования.
Цистатин C (CysC) представляет собой ингибитор цистеиновой протеиназы, относящийся к суперсемейству цистатина, ингибирующий резорбцию кости. CysC влияет на регуляторные каскады костного морфогенетического белка (BMP) в остеобластах и участвует в процессах дифференциации остеобластов, минерализации и формировании кости [19]. В клетках, обработанных CysC, наблюдались повышенные уровни мРНК BMP-2, остеокальцинан-дифференцировочного маркера и главного фактора остеогенной транскрипции (Runx2). Ингибирование резорбции кости CysC было более длительным, по сравнению с кратковременным эффектом кальцитонина. В доступной литературе обсуждается, что Z-RLVG-CHN2 (N-бензилоксикарбонил-аргинил-лейцил-валил-глицилдиазометан ацетат) ингибирует резорбцию кости in vitro с помощью механизма, который, по-видимому, связан с ингибированием деградации костной матрицы с помощью цистатина С [19, 20]. Кроме того показано, что цистатины обратимо ингибируют деградацию костного матрикса в лакунах резорбции, прилегающих к остеокластам [21]. Другими авторами установлено, что CysC регулирует деградацию костной матрицы с участием белка-посредника катепсина К, как внеклеточно, так и внутриклеточно [22].
В данном исследовании CysC был достоверно снижен на первые сутки после завершения космического полета и его уровень не возвращался к фоновому уровню к 7 сут после приземления (табл. 1). Известно, что в ранние сроки реадаптации (до полутора месяцев) в некоторых случаях наблюдалась отрицательная динамика показателей по сравнению с первым послеполетным сканированием минеральной плотности костной ткани [23]. Полученные данные свидетельствует о роли этого регуляторного белка в процессах дифференциации остеобластов, минерализации и формировании кости во время ремоделирования кости в остром периоде реадаптации после приземления. Поэтому снижение уровня CysC после приземления может косвенно свидетельствовать о нарушении регуляции экспрессии CysC и/или связанного с ним катепсина К, что может привести к нарушению нормального метаболического обмена костной ткани. Эта гипотеза совпадает с мнением других авторов и результатами нескольких клинических исследований [22, 24].
Фетуин-А (Fetuin-A), гликопротеин, относится к суперсемейству цистатина – ингибиторов цистеиновой протеазы. Этот регуляторный белок играет регулирующую роль в процессе минерализации. Fetuin-A является сильным ингибирующим фактором эктопической кальцификации; он действует путем связывания кластеров кальция и фосфата, стабилизируя эти ионы и предотвращая их поглощение клетками [25–27]. Снижение ингибиторной функции вызывает кальцификацию сосудов.
В данном исследовании Fetuin-A достоверно снижался на первые и седьмые сутки после полета, что свидетельствует о риске активизации процессов эктопической кальцификации мягких тканей (аорта, другие сосуды, почки и т.д.) [27–30].
Фибронектин (FN) наряду с коллагеном, ламинином, протеогликанами является основным компонентом внеклеточного матрикса. Внеклеточный матрикс обеспечивает структурную и биохимическую поддержку окружающих клеток. В его составе коллаген, ламинин, витронектин, фибронектин и гликозаминогликаны. Внеклеточный матрикс может играть ключевую роль в биохимических и биофизических процессах нарушения оссификации [31]. По литературным данным, синтез костных клеток и пространственная ориентация FN неизменны в условиях микрогравитации [32]. Т.е., изменение процесса формирования ячеек костной ткани не опосредовано регуляторными звеньями фибронектин–интегрин–актин–цитоскелет-внеклеточный матрикс в условиях КП [32]. Поэтому выявление снижения FN с 1 по 7 сут после приземления в нашем исследовании свидетельствует о возможном отрицательном балансе образования связей между цитоскелетом и внеклеточным матриксом, изменением функции остеобластов. Остается неясным, почему в нашем исследовании выявлено снижение концентрации гормоноподобных пептидов иризин–фибронектин в острый период адаптации после приземления [33]. Ведь внеклеточный домен доменного белка 5 типа фибронектина III – иризин, секретируется скелетной мышцей в ответ на физические упражнения, а физическая нагрузка после приземления возрастает.
Интересно отметить, что межмолекулярная ковалентная сшивка остеопонтина и фибронектина с помощью трансглутаминазы 2 генерирует высокомолекулярные остеопонтин-полимеры in vitro с повышенной вторичной структурой и приобретенными функциональными возможностями, включая увеличение связывания с коллагеном I типа и усиление адгезии клеток, хемотаксис и миграционную активность [34]. Вероятно, в острый период адаптации после приземления происходит ингибирование матричной минерализации.
Ряд авторов отмечает, что в условиях микрогравитации выявлены изменения уровня следующих регуляторных белков: интегрин, белки цитоскелета или клеточной адгезии и белки внеклеточного матрикса (ламинин, фибронектин, коллаген I и III и остеопонтин) [9, 35, 36]. В нашем исследовании не выявлено достоверное изменение вышеуказанных показателей. Эти факты можно объяснить различиями в условиях проведения исследований в условиях микрогравитации и после приземления, доминирующим влиянием разных действующих факторов. По нашему мнению, эти различия не принципиальны. Для понимания особенностей процессов ремоделирования костной ткани при микрогравитации и после приземления важно понимание участия основных регуляторных белков и белков-посредников, отмеченных в доступных нам исследованиях.
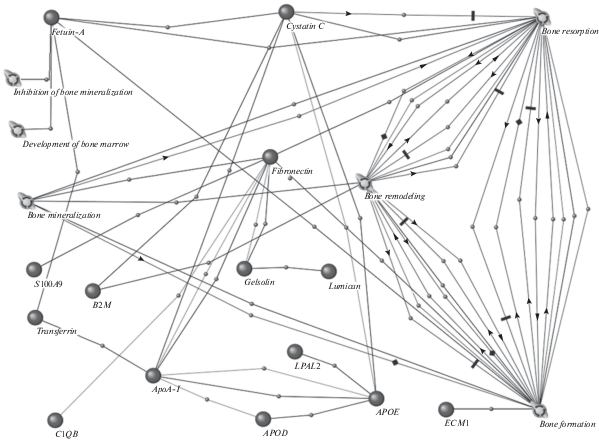
С помощью программы для автоматической экстракции данных ANDSystem была построена ассоциативная генная сеть, описывающая связь достоверно различающихся белков и биологических процессов, связанных с функциональным состоянием костной ткани (рис. 1). Установлено, что основные процессы, которые регулируются вышеописанными регуляторными белками, это резорбция, минерализация, формирование кости, ингибирование минерализации, развитие костного мозга (табл. 2).
Таблица 2.
Список процессов – регуляторов костного ремоделирования у космонавтов, связанных c сигнальными белками протеома крови, выявленными с помощью программы ANDsystem на первые сутки после полета по сравнению с фоном
| Название белков | Название процесса (прямая связь) |
Название процесса (связь через 1 посредника) |
|---|---|---|
| Цистатин С | Резорбция кости | Ингибирование минерализации кости (Фетуин-A) |
| Фетуин-A | Ингибирование минерализации кости | bone resorption (Цистатин С) |
| Развитие костного мозга | ||
| Формирование кости | ||
| Резорбция кости | ||
| Фибронектин | Резорбция кости | |
| Минерализация кости | ||
| Формирование кости |
Резорбция кости рассматривалась нами как процесс, в котором специализированные клетки, остеокласты, разрушают органические и неорганические участки кости путем эндоцитоза и транспортируют продукты разложения. В данном исследовании в процессе “резорбция кости” участвуют три регуляторных белка: CysC, Fetuin-A и FN. Учитывая прямую ассоциативную связь регуляторный белок – процесс (табл. 2, рис. 1), выявление снижения CysC, Fetuin-A и FN с 1 до 7 сут после приземления по окончании длительного КП, свидетельствует об активности резорбции костной ткани в острый период реадаптации.
Минерализация – процесс отложения минеральных веществ (гидроксиапатитов и др.), один из этапов формирования новой кости, противоположен резорбции. Этот термин часто используется как синоним процесса оссификации. Однако оссификация – процесс кальцификации как костной, так и эктопической ткани (мягких тканей, сосудов, др.). Основной регуляторный белок – FN регулирует процесс минерализации в нашем исследовании. Другой белок Fetuin-A – важнейший ингибитор эктопической оссификации (табл. 2). Ингибирование минерализации – процесс подавления формирования новой кости. CysC подавляет ингибирование минерализации, поэтому снижение его уровня после приземления ассоциативно связано со снижением минерализации (табл. 2).
Формирование кости рассматривалось как процесс формирования структуры новой кости в корковом и губчатом слоях, который также снижается после приземления. Процесс регулируют два белка: фибронектин и цистатин С.
Развитие костного мозга – процесс от образования костного мозга до формирования зрелой структуры. В данном исследовании этот процесс освещается применительно к образованию, дифференцировке и миграции остеокластов. Остеокласты образуются в костном мозге из моноцитарной клеточной линии. Ранние предшественники клеток дифференцируются под влиянием гранулоцитарно-макрофагального колониестимулирующего фактора (ГМ-КСФ). Стимулятором дальнейшей дифференцировки предшественников остеокластов является активный метаболит витамина Д (дефицит витамина Д отмечен у отдельных космонавтов [7]). Процессы образования и миграции остеокластов в кость ингибируются трансформирующим фактором роста (ТВР-β), интерфероном гамма (ИНФ-γ) и эстрогенами. Активность зрелых остеокластов регулируется паратиреодным гормоном (ПТГ), ПТГ-подобным пептидом (ПТГ-ПП), действующими местно ТВР-β и ИНФ-γ [18].
Fetuin-A, в данном исследовании, – регуляторный белок изменения процесса “развитие костного мозга”, также связан с процессами формирования и резорбции кости, что подтверждает его трактовку, как маркера активности метаболизма остеокластов (табл. 2, рис. 1).
Полученные нами данные подтверждаются результатами В.Е. Новикова и др., свидетельствующими, что у космонавтов, с потерей минеральной плотности бедренной кости более 5%, наблюдалось увеличение (не менее чем в 2 раза) экспрессии 36 ключевых генов: маркеров регуляторов дифференцировки остеобластов – костные морфогенные белки (BMP2, BMP4, BMP6) и инсулиноподобный фактор роста-1 (IGF1), маркеров дифференцировки остеобластов – тканеспецифическая щелочная фосфатаза (ALPL) и остеокальцин (BGLAP), маркеров дифференцировки остеокластов – колониестимулирующий фактор макрофагов (CSF1) и RANKL (TNFSF11), оссификации (BMP1, BMP3, FGFR2), коллагенов (COL1A1, COL2A1, COL1A2, COL3A1, COL5A1, COL10A1, COL14A1, COL15A1), адгезии и межклеточного взаимодействия (FGFR2, ITGA1, ITGA2, ITGA3, ICAM1), ростовых факторов (EGF, FGF2) и ключевых транскрипционных факторов (SMAD5, SOX9, TWIST1) [10].
В условиях воздействия комплекса факторов космического полета наблюдается сдвиг процессов костного ремоделирования в сторону резорбции [11, 23]. Быстрое изменение совокупности действующих на организм факторов после приземления вызывает острую реадаптацию костного ремоделирования, направленную на максимально быстрое приспособление к условиям жизни на Земле. Регуляторные белки в этих условиях запускают каскад реакций, которые в дальнейшем, на протяжении 3–6 (и более) мес., восстановят минеральную плотность костной ткани, силу мышечных сокращений в соответствии с “генетической памятью” об оптимальном соответствии параметров костного метаболизма к условиям Земли [30]. Однако необходимо время для изменения процессов, перешедших на новый уровень регуляции костного ремоделирования в условиях длительного космического полета. Выявленные нами изменения в виде снижения концентраций основных регуляторных белков, регуляторов резорбции, формирования структуры, минерализации и активности остеокластов свидетельствуют о незавершенности процессов реадаптации костного ремоделирования в остром периоде приспособления после приземления и необходимости исследования динамики этих маркеров, как в космическом полете, так и в течение года после полета. Применительно к клинической практике, открываются перспективы верификации этих белков как ингибиторов резорбции кости для использования в практике травматологии, ортопедии, восстановления после длительной гиподинамии и др.
В последнее время геномные и протеомные подходы привлекают внимание специалистов по гравитационной физиологии и космической медицине. Можно ожидать, что вызываемая микрогравитацией модификация протеома позволит понять молекулярные механизмы, в т.ч. выявить сети, участвующие в адаптивном ответе организма на изменения в условиях окружающей среды во время КП. Это, в свою очередь, позволит предложить определенные белки в качестве потенциальных мишеней для эффективных контрмер противодействия нежелательным для здоровья экипажа изменениям.
ВЫВОДЫ
1. Впервые исследованы регуляторные белки протеома крови применительно к регуляции костного ремоделирования у космонавтов, совершивших длительные космические полеты.
2. После 6-месячных полетов установлено достоверное снижение в протеоме крови регуляторных белков цистатина С, фетуина-А, фибронектина по сравнению с фоновым периодом.
3. По данным целевого количественного исследования протеома плазмы крови, на первые сутки после длительных КП, процессы костного ремоделирования характеризуются продолжающейся резорбцией, изменением формирования костной матрицы, усилением ингибирования минерализации.
4. Установлены основные белки – посредники реализации белок-белковых взаимодействий.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены комиссией по биомедицинской этике Института медико-биологических проблем РАН (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена в рамках базовых тем Российской академии наук 65.1 и 65.3. на 2013–2020 гг.
Благодарности. Авторы статьи выражают искреннюю благодарность космонавтам, принимавшим участие в исследовании, сотрудникам Научно-исследовательского испытательного центра подготовки космонавтов им. Ю.А. Гагарина за помощь в проведении эксперимента, заведующему лабораторией компьютерной протеомики Института цитологии и генетики РАН В.А. Иванисенко за возможность работы с программой ANDSystem, профессору Christoph H. Borchers из UVic-Genome BC Proteomics Centre (University of Victoria, Columbia, Canada) за масс-спектрометрический анализ проб.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Оганов В.С. Костная система, невесомость и остеопороз. Воронеж: ИПЦ “Научная книга”, 2014. 291 с.
Ting Huyan, Yongyong Du, Dandan Dong et al. Osteoclast-derived exosomes inhibit osteogenic differentiation through Wnt/β-catenin signaling pathway in simulated microgravity model // Acta Astronautica. 2019. V. 154. P. 140.
Mastrandrea C., Vico L. Centrifugation and Hypergravity in the Bone. Encyclopedia of Biomedical Engineering, Elsevier, 2018. P. 59.
Jiancheng Yang, Xiaofeng Meng, Dandan Dong et al. Iron overload involved in the enhancement of unloading-induced bone loss by hypomagnetic field // Bone. 2018. V. 114. P. 235.
Smith M.B., Khulapko S., Andrews H.R. et al. Bubble-detector measurements in the Russian segment of the International Space Station during 2009–12 // Radiation Protection Dosimetry. 2014. V. 163. P. 1.
Cho I.C., Chen F.H., Chao T.C., Tung C.J. A Monte Carlo Study of bone-tissue interface microdosimeters // Appl. Radiat. Isot. 2018. V. 140. P. 193.
Heer M. Nutritional interventions related to bone turnover in European space missions and simulation models // Nutrition. 2002. V. 18. № 10. P. 853.
Schmidt M.A., Goodwin Th., Cuttino M. Chapter 46: Personalized Medicine in Space Flight, Part II: Personalized Precision Medicine Approaches / Principles of Gender-Specific Medicine (Third Edition). Elsevier, Academic Press, San Diego, CA, 2017. P. 673.
Гершович П.М., Гершович Ю.Г., Буравкова Л.Б. Молекулярно-генетическая характеристика мезенхимальных стволовых клеток человека при остеогенной дифференцеровке в условиях моделирования эффектов микрогравитации // Физиология человека. 2013. Т. 39. № 5. С. 105.
Новиков В.Е., Рыкова М.П., Антропова Е.Н. и др. Минеральная плотность костной ткани и молекулярно-генетические маркеры ее ремоделирования в крови у космонавтов после длительных полетов на международной космической станции // Физиология человека. 2017. Т. 43. № 6. С. 88.
Оганов В.С., Бакулин А.В., Новиков В.Е. и др. Изменение костной ткани в космическом полете: о возможных механизмах остеопении // Остеопороз и остеопатии. 2005. № 2. С. 2.
Shreyasee Amin. Mechanical Factors and Bone Health: Effects of Weightlessness and Neurologic Injury // Curr Rheumatol Rep. 2010. V. 12. № 3. P. 170.
Vignaux G., Ndong J., Perrien D., Elefteriou F. Inner Ear Vestibular Signals Regulate Bone Remodeling via the Sympathetic Nervous System // J. Bone Miner Res. 2015. V. 30. № 6. P. 1103.
Шварц Г.Я. Фармакотерапия остеопороза. М.: Медицинское информационное агентство, 2002. 409 с.
Ivanisenko V.A., Saik O.V., Ivanisenko N.V. et al. ANDSystem: an Associative Network Discovery System for automated literature mining in the field of biology // BMC Systems Biology. 2015. V. 9. № 2. P. S2.
Zayzafoon M., Meyers V.E., McDonald J.M. Microgravity: the immune response and bone // Immunol Rev. 2005. V. 208. P. 267.
Rea G., Cristofaro F., Pani G. et al. Microgravity-driven remodeling of the proteome reveals insights into molecular mechanisms and signal networks involved in response to the space flight environment // J. Proteomics. 2016. V. 137. P. 3.
Биохимия. Учебник. Под ред. Северина Е.С. М.: ГЕОТАР-Медиа, 2013. 760 с.
Danjo A., Yamaza T., Kido M.A. et al. Cystatin C stimulates the differentiation of mouse osteoblastic cells and bone formation // Biochemical and Biophysical Research Communications. 2007. V. 360. Issue 1. P. 199.
Johansson L., Grubb A., Abrahamson M. et al. A peptidyl derivative structurally based on the inhibitory center of cystatin C inhibits bone resorption in vitro // Bone. 2000. V. 26. Issue 5. P. 451.
Strålberg F., Lerner U.H., Persson E. Osteoclastic differentiation of bone marrow macrophages is inhibited by cystatin C due to decreased expression of C-FOS and NFATC1 // Bone. 2010. V. 47. № 1. P. s143.
Yamaza T., Tsuji Y., Goto T. et al. Comparison in localization between cystatin C and cathepsin K in osteoclasts and other cells in mouse tibia epiphysis by immunolight and immunoelectron microscopy // Bone. 2001. V. 29. Issue 1. P. 42.
Vico L., B. van Rietbergen, Vilayphiou N. et al. Cortical and Trabecular Bone Microstructure Did Not Recover at Weight-Bearing Skeletal Sites and Progressively Deteriorated at Non-Weight-Bearing Sites During the Year Following International Space Station Missions // J. Bone and Mineral Research. 2017. V. 32. № 10. P. 2010.
Tumminello Francesca M., Flandina Carla, Crescimanno Marilena, Leto Gaetano. Circulating cathepsin K and cystatin C in patients with cancer related bone disease: Clinical and therapeutic implications // Biomedicine & Pharmacotherapy. 2008. V. 62. Issue 2. P. 130.
Jablonski H., Polan Ch., Wedemeyer Ch. et al. A single intraperitoneal injection of bovine fetuin-A attenuates bone resorption in a murine calvarial model of particle-induced osteolysis // Bone. 2017. V. 105. P. 262.
Jahnen-Dechent W., Brylka L., Schinke Th., McKee M.D. Letter to the Editor, concerning: “FGF23-regulated production of fetuin-A (AHSG) in osteocytes” // Bone. 2016. V. 93. P. 223.
Schoppet M., Rauner M., Benner J. et al. Serum fetuin-A levels and abdominal aortic calcification in healthy men — The STRAMBO study // Bone. 2015. V. 79. P. 196.
Herrmann M., Schaefer C., Kinkeldey A., Jahnen-Dechent W. Ectopic calcification in fetuin-A deficient mice starts in the microvasculature // Bone. V. 48. № 2. 2011. P. s241.
New S.E., Aikawa E. Cardiovascular calcification: an inflammatory disease // Circ. J. 2011. V. 75. P. 1305.
Szulc P. Abdominal aortic calcification: A reappraisal of epidemiological and pathophysiological data // Bone. 2016. V. 84. P. 25.
Kan C., Chen L., Hu Y. et al. Gli1-labeled adult mesenchymal stem/progenitor cells and hedgehog signaling contribute to endochondral heterotopic ossification // Bone. 2018. V. 109. P. 71.
Grimm D., Grosse J., Wehland M. et al. The impact of microgravity on bone in humans // Bone. 2016. V. 87. P. 44.
Dongdong Zhang, ChuHyun Bae, Junghak Lee et al. The bone anabolic effects of irisin are through preferential stimulation of aerobic glycolysis // Bone. 2018. V. 114. P. 150.
Betty Hoac, Valentin Nelea, Wenge Jiang et al. Mineralization-inhibiting effects of transglutaminase-crosslinked polymeric osteopontin // Bone. 2017. V. 101. P. 37.
Pietsch J., Gass S., Nebuloni S. et al. Three-dimensional growth of human endothelial cells in an automated cell culture experiment container during the SpaceX CRS-8 ISS space mission –The SPHEROIDS project // Biomaterials. 2017. V. 124. P. 126.
Gershovich P.M., Gershovich J.G., Zhambalova A.P. et al. Cytoskeletal proteins and stem cell markers gene expression in human bone marrow mesenchymal stromal cells after different periods of simulated microgravity // Acta Astronautica. 2012. V. 70. P. 36.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека