Физиология человека, 2019, T. 45, № 5, стр. 80-90
Количественная оценка нарушения структуры закрученного течения крови в аорте при патологическом изменении геометрии проточного канала с использованием математической модели аорты
Е. А. Талыгин 1, *, Ш. Т. Жоржолиани 1, А. В. Агафонов 1, Г. И. Кикнадзе 1, А. Ю. Городков 1, Л. А. Бокерия 1
1 ФГБУ Национальный медицинский исследовательский центр
сердечно-сосудистой хирургии им. А.Н. Бакулева МЗ РФ
Москва, Россия
* E-mail: skalolom@gmail.com
Поступила в редакцию 08.10.2018
После доработки 19.11.2018
Принята к публикации 04.04.2019
Аннотация
На сегодняшний день можно считать доказанным закрученный характер течения крови в сердце и магистральных сосудах. Структура этого течения описывается точными решениями нестационарных уравнений гидродинамики для класса смерчеобразных самоорганизующихся потоков вязкой жидкости. В наших предыдущих работах было показано, что геометрия канала аорты соответствует линиям тока течения этого класса на протяжении всего сердечного цикла, что обеспечивается особым распределением вязкоупругих свойств стенки проточного канала вдоль аорты. С возрастом, в результате патологических процессов и/или их хирургической коррекции неизбежно нарушение нормальных вязкоупругих характеристик сосудистых стенок. Подобное нарушение структуры органов сердечно-сосудистой системы различной природы вызывают негативные изменения нормальной геометрической конфигурации русла биологических проточных каналов. Таким образом, любое патологическое изменение сосудистого проточного канала сопровождается ухудшением структурных параметров потока. Однако прямое экспериментальное исследование всего разнообразия сосудистых поражений сопряжено со значительными трудностями. Поэтому исследование закономерностей изменений структурных параметров закрученной струи крови при различных патологических состояниях сосудистого русла до настоящего момента проведено не было. В рамках данной работы была построена физическая модель проточного канала аорты, учитывающая нелинейное распределение поперечной упругости стенок аорты по ее длине. Затем была выполнена компьютерная симуляция динамики построенного модельного проточного канала в течение всего сердечного цикла в соответствии со стандартной кривой изменения артериального давления. Результаты симуляции были интерпретированы в рамках полуэмпирической теории самоорганизующихся смерчеобразных течений вязкой жидкости. Подобная интерпретация позволила сформулировать количественные характеристики, зависимые от времени, устанавливающие функциональную связь между структурой течения крови и геометрией проточного канала аорты в течение всего сердечного цикла.
На сегодняшний день можно считать доказанным закрученный характер течения крови в сердце и магистральных сосудах [1–7]. В предыдущих работах было установлено, что поток крови принадлежит к классу самоорганизующихся смерчеобразных потоков вязкой жидкости, а его структура в каждый момент времени описывается частными точными решениями нестационарных уравнений гидродинамики для этого класса потоков, вывод которых был опубликован в журнале Доклады Академии Наук (ДАН СССР) в 1986 г. [8]. Эти решения позволяют связать изменение геометрии проточного канала с динамической структурой течения [2, 8, 9].
Для потока с единственной циркуляцией точные решения в цилиндрической системе координат имеют следующий вид [8]:
(1)
$\left. \begin{gathered} {{U}_{r}} = - {{C}_{0}}(t)r \hfill \\ {{U}_{z}} = 2{{C}_{0}}(t)z \hfill \\ {{U}_{\varphi }} = \frac{{{{G}_{0}}(t)}}{{2\pi r}}\left( {1 - {{e}^{{ - \frac{{{{C}_{0}}(t){{r}^{2}}}}{{2\nu }}}}}} \right) \hfill \\ \end{gathered} \right\},$Свойства смерчеобразных закрученных потоков во многом повторяют известные свойства потока крови. Они представляют собой осесимметричные самоорганизующиеся закрученные течения, характеризуемые малыми потерями энергии и высокой эффективностью массопереноса за счет дополнительных градиентов, формирующихся в силу инерционности вращения закрученной струи [7, 8]. Отличительной особенностью потоков этого класса является квазипотенциальность, т.е. независимость продольной и радиальной составляющих вектора скорости от вязкости, и потери энергии проявляются вдоль азимутальной составляющей скорости закрученного течения, причем только в узкой приосевой зоне [7]. Пограничный слой, формируемый на стенке проточных каналов при перемещении подобных течений, имеет трехмерную структуру, представляющую собой поверхностные вихревые образования, благодаря которым поток как бы катится вдоль стенки. Этим объясняется малая величина потерь кинетической энергии и выполнение условия “прилипания течения” к стенке, требующего равенства нулю суммарного вектора скорости потока, измеренного на стенке проточного канала. Таким образом, напряжения сдвига заменяются напряжениями качения [8]. Толщина пограничного слоя такой структуры может не изменяться вдоль потока.
Как следует из точных решений, в общем виде выражения для линий тока течений этого класса во взаимно ортогональных проекциях запишутся следующим образом [2, 8]:
1. Продольно-радиальная проекция:
2. Азимутально-радиальная проекция:
(2.1)
$\varphi = {{\varphi }_{0}} + \frac{{{{U}_{{0\varphi }}}}}{{2{{U}_{{0r}}}}}\left( {\frac{{R_{0}^{2}}}{{{{r}^{2}}}} - 1} \right).$Здесь Q – фиксированная константа, имеющая размерность объема (м3), φ – начальный угол закрутки течения, U0φ – начальное значение азимутальной компоненты скорости Uφ, U0r – начальное значение радиальной компоненты скорости Ur, R0 – начальный радиус течения, r – текущий радиус струи.
Смерчеобразную струю можно рассматривать как трубку тока, граница которой вычисляется путем построения тела вращения с образующей функцией – проекцией фиксированной линии тока на продольно-радиальную плоскость (2). При этом геометрия проточного канала на определенном промежутке продольной координаты соответствует этой границе при установившемся режиме течения и постоянной толщине пограничного слоя.
Ранее было показано, что геометрия канала аорты соответствует линиям тока смерчеобразной струи в течение всего сердечного цикла [3]. Это обеспечивается специальным распределением упругости стенки проточного канала вдоль аорты. Таким образом, постоянно сохраняются необходимые условия для поддержания структуры смерчеобразного течения в просвете аорты.
Вследствие того факта, что струя крови в аорте затоплена, в каждый момент сердечного цикла в аорте наряду с доминантным течением необходимым образом должны присутствовать вторичные и возвратные течения, взаимодействие с которыми увеличивает энергетические затраты. Наличие подобных течений также затрудняет определение точного объема и геометрической структуры доминантного течения. Однако в случае движения потока в канале с эластичными или активно подвижными стенками, повторяющими внешние границы закрученной струи, точные решения позволяют связать пространственную конфигурацию проточного канала с полем скоростей такого течения.
С возрастом, в результате патологических процессов и/или их хирургической коррекции неизбежно нарушение нормальной геометрической конфигурации русла биологических проточных каналов. Подобное нарушение структуры артериального сосудистого русла вызывают соответствующие негативные изменения нормальных вязкоупругих характеристик сосудистых стенок [10–14]. Таким образом, любое патологическое изменение проточного канала сосудов сопровождается нарушением нормальной динамики структурных параметров потока.
Однако экспериментальное исследование всего разнообразия сосудистых поражений является невозможным, и изучение закономерностей изменений структурных параметров закрученной струи крови при различных патологических состояниях сосудистого русла до настоящего момента проведено не было.
Целью данной работы было создание математической модели вязкоупругой аорты в течение сердечного цикла, связывающей динамическую геометрию проточного канала аорты со структурой потока крови на основании точных решений нестационарных уравнений гидродинамики для класса смерчеобразных течений вязкой жидкости.
МЕТОДИКА
Для построения модели использовали экспериментальные данные измерений геометрической конфигурации проточного канала аорты – радиуса просвета канала по длине fr(Z) и интегральной упругости стенки аорты вдоль ее длины fE(Z), полученные в предыдущем исследовании [3].
Обозначили через Z продольную координату вдоль длины аорты. Положительное направление оси Z откладывали от верхнего края фиброзного кольца аортального клапана в дистальном направлении. Аорта была сегментирована на n дискретныx отрезков Δzi = zi + 1 – zi, i = 1, …, n – 1. Величина Δzi = zi + 1 – zi незначительно варьировалась вдоль оси Z. Учитывая, что в местах отхождения сосудов от аорты геометрия и упругость стенок проточного канала изменяются, подобный способ разбиения был оправдан. Каждую дискретную точку разбиения zi продольной оси Z характеризовали двумя параметрами – Ei = fE(zi) и Ri = fR(zi).
Для достоверной реконструкции геометрической формы проточного канала аорты к значениям радиуса проточного канала аорты Ri = fR(zi) применили фильтр скользящего среднего.
Обозначили обработанные фильтром данные как FR(zi). Тогда FR(zi) можно вычислить по следующей формуле (где M – количество точек фильтра).
После выполнения процедуры интерполяции полученного вектора значений FR(zi) на всем интервале продольной координаты при количестве узлов интерполяции n = 500 получен результат интерполяции (рис. 1, А).
Рис. 1.
Интерполированная геометрия проточного канала аорты. А – двумерный профиль. Интерполяция экспериментально измеренных значений радиуса просвета проточного канала аорты по ее длине при количестве узлов интерполяции n = 500. Б – пространственная реконструкция. Построенное для интерполированной кривой изменения радиуса просвета проточного канала аорты симметричное тело вращения, которое использовалось в качестве модельной геометрии аорты.

Количество точек интерполяции выбирали, исходя из выполнения двух условий – с одной стороны, результирующая интерполирующая кривая должна быть гладкой, а с другой – процедура интерполяции должна выполняться за время, не превышающее 1 × 10–3 c.
Полученную в результате интерполяции исходных геометрических данных кривую использовали для построения тела вращения относительно продольной оси Z. Подобное построение не приводит к появлению значительных погрешностей, учитывая высокую степень аксиальной симметрии реальной аорты. Тело вращения T(x, y, z) вокруг оси Z функции FR(zi) определяли следующим выражением:
В результате получили пространственную реконструкцию проточного канала аорты (рис. 1, Б).
Моделирование геометрической конфигурации упругой аорты при различных вариантах продольного распределения упругости. Для симуляции изменения заданной геометрии аорты временной интервал, соответствующий сердечному циклу, разбивали на конечное множество m дискретных временных отрезков. На этом дискретном разбиении в соответствии со стандартными кривыми задали распределение измеренного физиологического давления P(ti). В рамках модели считали, что за промежуток времени ti давление P(ti) не изменяется и воздействует на аорту равномерно по всей длине. Таким образом, в процессе симуляции геометрическая конфигурация проточного канала аорты изменялась m раз – по количеству соответствующих временных интервалов.
Для симуляции изменения просвета аорты в течение сердечного цикла в рамках данной работы использовали интегральный параметр поперечной упругости Ej = fE(zj). По своему физическому смыслу этот параметр представляет собой относительное увеличение радиуса j-ого сегмента аорты при воздействии давления P(ti), соответствующего моменту сердечного цикла. В фиксированный момент времени сердечного цикла ti упругость вычисляли по следующей формуле:
(3)
${{E}_{j}} = \frac{{P({{t}_{i}}) - P({{t}_{{i - 1}}})}}{{({{R}_{j}}({{t}_{i}}) - {{R}_{j}}({{t}_{{i - 1}}}))}}.$Здесь P(ti) – значение давления в фиксированный момент сердечного цикла ti, P(ti – 1) – значение давления в момент ti – 1, Rj(ti), Rj(ti – 1) – соответствующие значения радиуса просвета j-ого сегмента проточного канала аорты в соседние временные отрезки сердечного цикла.
Соотношение (3) устанавливает связь между поперечной упругостью сегмента проточного канала аорты и изменением его просвета при воздействии на него физиологического поля давлений. Таким образом, варьируя распределение упругости по длине аорты, можно моделировать различные патологические изменения ее геометрической конфигурации. Помимо распределения упругости в норме, построенного на основании экспериментальных данных, смоделировали три варианта распределения упругости стенок вдоль проточного канала аорты. Рассматривали случаи, когда радиальная упругость стенки была постоянна по длине аорты, существенное снижение упругости на участке аорты, имитирующее участок с аневризмой, и скачкообразное увеличение упругости на участке аорты, имитирующее установку ригидного синтетического сосудистого имплантата. Значения смоделированных кривых упругости в случае аневризме и при установке имплантата выбирали таким образом, чтобы изменение геометрии проточного канала под воздействием физиологического поля давлений на качественном уровне совпадало с изменением реальной аорты при рассматриваемых патологических изменениях.
Анализ продольно-радиальной проекции линий тока TLJF. Поскольку для нахождения проекции линий тока закрученной струи крови на продольно-радиальную плоскость используются данные о геометрии канала, а не самой струи, то необходимо определить, откуда начинать отсчет продольной координаты. Для решения этой задачи соотношения (2) преобразовали следующим образом:
При написании соотношения (4) сердечный цикл разбивается на конечное множество дискретных моментов времени, каждому из которых соответствует конкретная геометрия проточного канала fR(Z). При этом fR(Z) в конкретный момент времени вычисляется на основании данных о распределении интегрального параметра поперечной упругости по длине аорты fE(zj), информации о геометрии в предыдущий момент времени, поскольку задана только начальная геометрия проточного канала, а также данных о величине физиологического давления в исследуемый момент времени сердечного цикла. Таким образом, следует учитывать, что величина Q сохраняет постоянное значение в пределах одного дискретного момента времени, но в течение сердечного цикла изменяется.
Объект, описываемый соотношением (4), может быть представлен как аорта, в которой в течение сердечного цикла фиксирована точка начала измерения продольно-радиального размера (верхний край фиброзного кольца аортального клапана), и отрезок, равный расстоянию от этой точки до начала цилиндрической системы координат, в которой выполняется соотношение (4). Этот объект – аппроксимированная струя. В норме абсолютные значения структурных параметров такой струи не совпадают с соответствующими параметрами реальной струи, но динамика их изменения в течение сердечного цикла предполагается идентичной.
Подставляя в соотношение (4) экспериментально полученные данные о геометрии канала fR(Z), с помощью метода наименьших квадратов было рассчитано значение z0 для каждого дискретного момента времени. Вычисленный параметр z0 позволяет качественно оценить мгновенное положение точки начала координат смерчеобразной струи. Движение этой точки отражает эволюцию структуры аппроксимированной струи крови на протяжении сердечного цикла.
Исходя из закономерностей эволюции закрученной струи в левом желудочке [2], мгновенное положение точки зарождения смерчеобразной струи не должно выходить из полости левого желудочка, т.е. величина z0 не должна превышать расстояние от фиброзного кольца аортального клапана до свободной стенки левого желудочка.
Динамика величины z0 обладает следующими особенностями:
1. Большое относительное изменение величины z0 (z0 должна превышать расстояние от свободной стенки левого желудочка до плоскости фиброзного кольца аортального клапана) в течение сердечного цикла показывает, что динамическая геометрия проточного канала слабо соответствует форме линий тока смерчеобразной струи и точка зарождения этой струи вышла из полости левого желудочка, т.е. исследуемый проточный канал подвергся таким патологическим изменениям, которые не позволяют поддерживать структуру смерчеобразной струи.
2. Несовпадение динамики параметра z0 и объема проточного канала показывает, что в этом объеме парциальная доля аппроксимированной струи относительно мала, т.е. большая часть проточного канала аорты заполнена вторичными и возвратными течениями. Это означает, что сердечный выброс уменьшается относительно нормы.
Величина Q из соотношения (4) представляет собой константу для вычисления линий тока стационарного сходящегося смерчеобразного потока, и для своего вычисления требует данных о геометрии проточного канала, являясь удобным параметром для оценки предельного объема, занимаемого струей в рассматриваемом проточном канале. Таким образом, при увеличении радиального размера канала величина Q в соотношении (4) растет, при уменьшении – убывает. Поэтому в норме при воздействии физиологического давления в течение сердечного цикла величина Q сначала возрастает, а затем убывает до первоначального значения. Характер изменения величины z0 в норме совпадает с динамикой величины Q – изначальный рост с последующим убыванием до первоначального значения. Физиологически это означает, что при увеличении объема проточного канала аорты мгновенное начало закрученной струи сдвигается от фиброзного кольца аортального клапана в полость левого желудочка, т.е. струя удлиняется. При уменьшении объема полости начало струи сдвигается из полости левого желудочка к фиброзному кольцу аортального клапана, т.е. струя укорачивается.
Определение доли объема струи в объеме проточного канала. В конце каждого сердечного цикла в полости проточного канала аорты остается объем крови, примерно равный ударному объему. В систолу следующего сердечного цикла закрученная струя крови, принадлежащая этому циклу (доминантная струя), затапливается в этот объем, в результате чего часть полости проточного канала аорты заполняется вторичными и возвратными течениями.
Пусть V0 – суммарный объем полости проточного канала аорты, Vsf – объем вторичных течений и вихревого пограничного слоя, Vdf – объем доминантной закрученной струи крови. Эти величины изменяются каждый дискретный момент сердечного цикла. Можно зафиксировать конкретный момент t0. Для вычисления V0 использовали следующее соотношение:
Пусть ra – радиус фиброзного кольца аортального клапана, rmax = max(fR(z)). Используя следующие соотношения:
Отсюда вытекает приближенное соотношение для вычисления объема вторичных течений и вихревого пограничного слоя:
Отсюда
Описанные выше соотношения позволяют оценить динамику изменения отношения объема доминантной струи крови к суммарному объему вторичных течений и вихревого пограничного слоя в каждый момент времени на протяжении всего сердечного цикла.
Следует отметить, что на данном этапе исследования смерчеобразных самоорганизующихся течений точно оценить парциальный объем вихревого пограничного слоя в общем объеме Vsf не представляется возможным. Однако, исходя из соотношений для структуры ламинарного пограничного слоя, сформулированных Л. Прандтлем, можно предполагать, что этот парциальный объем составляет примерно 10–15% Vsf. Качественный анализ формирования закрученных струй в ветвях аорты позволяет предположить, что объем среды из вторичных и возвратных течений служит для поддержания эволюции течения в ветвях.
Таким образом, в работе провели анализ динамики изменения величины z0 и объемного параметра струи Q, а также исследовали отношение суммарного объема пограничного слоя и вторичных течений к ударному объему закрученной струи крови (Vsf/Vdf) в норме и при измененной функциональной зависимости fE(Z), которая на качественном уровне имитирует патологические изменения сосудистого русла различной природы.
В разработанную модель не закладывали механизмы оттока крови из аорты в течение сердечного цикла. Учитывая, что толщина пограничного слоя вдоль стенки проточного канала аорты оставалась примерно постоянной на протяжении сердечного цикла, а изменение объема вторичных и возвратных течений примерно соответствовало изменению объема проточного канала, в норме соотношение Vsf/Vdf сохраняло постоянную величину.
Границы применимости модели. Рассмотрение потока крови в терминах смерчевой самоорганизации с использованием точных решений (1) предполагает допущение о стационарности этого потока. Однако ни экспериментальных, ни теоретических работ, посвященных исследованию закономерностей возникновения стационарных закрученных течений, на данный момент не существует. В данной работе предполагается, что характерное время установления стационарного течения значительно меньше времени нахождения модельной аорты в фиксированном геометрическом состоянии. Это позволяет рассматривать поток крови на протяжении каждого дискретного состояния модельной аорты как квазистационарный. Поэтому величина методической погрешности результатов модельной симуляции достаточно мала. Вследствие этого мгновенную геометрическую конфигурация проточного канала модельной аорты допустимо сопоставлять с формой линий тока закрученной струи крови внутри. Исследование закономерностей возникновения стационарных закрученных течений представляет собой предмет для дальнейших исследований.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Для целей моделирования сердечный цикл был разбит на 100 дискретных моментов времени. Количество моментов времени выбиралось таким образом, чтобы, с одной стороны, кривые изменения исследуемых параметров были гладкими, а с другой – соседние состояния модельной аорты имели значимые различия. Затем была произведена симуляция динамики геометрии проточного канала аорты при физиологическом изменении давления в просвете аорты в течение сердечного цикла. При этом сравнивали структурные параметры закрученного течения крови в аорте при нормальном продольном распределении упругости и при смоделированных патологических изменениях упругости стенки.
В норме величина Vsf/Vdf практически не изменяется (с 0.36 до 0.39) в течение сердечного цикла (рис. 2), что отражает постоянство толщины пограничного слоя вдоль стенки проточного канала аорты в течение сердечного цикла и постоянство соотношения объема вторичных и возвратных течений к ударному объему закрученного течения крови. Объемный показатель закрученной струи Q постепенно увеличивается примерно на 90% (c 2 × 10–5 до 3.8 × 10–5 м3), а затем плавно убывает до первоначального значения (рис. 3). Значение z0 монотонно возрастает примерно на 80% (с 0.17 до 0.31 м) в начале сердечного цикла, а затем монотонно убывает до своего начального значения (рис. 4). Поскольку геометрическая конфигурация закрученной струи крови определяется границами проточного канала аорты, изменение поперечного размера этого канала связано с соответствующим изменением радиуса самой струи. При этом для того, чтобы линии тока измененной струи по-прежнему соответствовали точным решениям, в норме требуется одновременное увеличение значения Q и z0 + z. При этом продольные размеры самого проточного канала z остаются неизменными в течение всего сердечного цикла. В результате изменение геометрической конфигурации проточного канала под воздействием физиологического давления вызывает соответствующее изменение объемного показателя закрученной струи Q и параметра, отражающего положение относительного начала координат закрученной струи z0.
Рис. 2.
Динамика соотношения суммарного объема вторичных течений и пограничного слоя к ударному объему доминантной струи крови Vsf/Vdf в течение сердечного цикла. Каждая кривая соответствует конкретному варианту распределения значения интегральной упругости стенки проточного канала аорты по ее длине: а – скачкообразное увеличение упругости на локальном участке русла, б – неизменное значение интегральной упругости по длине аорты, в – нормальные условия, г – значительное снижение упругости на участке аорты.
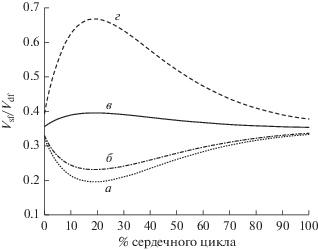
Рис. 3.
Динамика объемного показателя струи Q (м3) в течение сердечного цикла. Каждая кривая соответствует конкретному варианту распределения значения интегральной упругости стенки проточного канала аорты по ее длине: а – неизменное значение интегральной упругости по длине аорты, б – скачкообразное увеличение упругости на локальном участке аорты, в – нормальные условия, г – значительное снижение упругости на участке аорты.
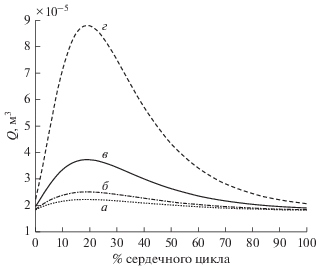
Рис. 4.
Динамика положения точки – начала цилиндрической системы координат закрученной струи z0 (м) в течение сердечного цикла. Каждая кривая соответствует конкретному варианту распределения значения интегральной упругости стенки проточного канала аорты по ее длине: а – неизменное значение интегральной упругости по длине аорты, б – скачкообразное увеличение упругости на локальном участке аорты, в – нормальные условия, г – значительное снижение упругости на участке аор-ты.

В результате нарушения нормальной упругости стенок проточного канала аорты, геометрия канала перестает соответствовать линиям тока закрученного течения, что приводит к изменениям структуры потока крови, неравномерному нарастанию на стенках пограничного слоя и изменению парциального объема вторичных и возвратных течений.
При постоянстве упругости по длине аорты величина Vsf/Vdf уменьшается приблизительно на 30% (с 0.35 до 0.24), а затем возвращается к исходному значению (рис. 2). Величина объемного показателя струи Q практически не изменяется (c 1.9 × 10–5 до 2.15 × 10–5 м3) (рис. 3). Величина z0 практически не изменяется (с 0.15 до 0.155 м) в течение сердечного цикла (рис. 4).
Постоянство значения z0 и Q означает в этом случае, что доминантная закрученная струя практически не изменяет свою геометрическую конфигурацию в течение сердечного цикла, как это следует из соотношения для Vdf. Из этого следует, в частности, что снижение величины Vsf/Vdf отражает падение суммарного объема вторичных и возвратных течений, а также уменьшение толщины вихревого пограничного слоя. Полагая, что объем среды из вторичных и возвратных течений служит источником среды для поддержания эволюции течения в ветвях, вследствие невозможности поперечного переноса среды в доминантном закрученном потоке, уменьшение суммарного объема вторичных и возвратных течений приводит к дефициту среды в дочерних потоках в ветвях. Уменьшение толщины пристеночного вихревого пограничного слоя по сравнению с нормой неизбежно приводит к возникновению сдвиговых напряжений, неблагоприятных в зоне контакта потока крови и стенки сосуда.
Уменьшение абсолютного значения Q по сравнению с нормой означает снижение предельного объема закрученной струи, соответствующей точным решениям, которая может эволюционировать в проточном канале аорты. Это означает снижение реального ударного объема потока крови в аорте в сравнении с нормой. А постоянство величины Q в течение сердечного цикла означает искажение нормальной динамики сердечного выброса.
При замене участка аорты ригидным сегментом величина Vsf/Vdf сначала уменьшается примерно на 45% (с 0.35 до 0.19), а затем увеличивается до первоначального значения (рис. 2). Величина Q сначала возрастает примерно на 30% (c 1.9 × 10–5 до 2.5 × 10–5 м3), а затем возвращается к своему первоначальному значению (рис. 3). При замене участка аорты ригидным сегментом величина z0 увеличивается примерно на 25% (с 0.16 до 0.20 м), а затем возвращается к исходному значению (рис. 4).
Инверсия нормальной динамики величины Vsf/Vdf в этом случае отражает снижение парциального объема вторичных и возвратных течений и уменьшение толщины пристеночного вихревого пограничного слоя в зоне ригидного сегмента. Анализ динамической геометрии русла проточного канала при установке ригидного сегмента показывает, что толщина пограничного слоя изменяется скачкообразно по длине аорты. Наличие сегментов проточного канала с подобным неравномерным распределением толщины пограничного слоя должно приводить к возникновению существенных сдвиговых напряжений. Одновременно наблюдается дефицит накопления ударного объема струи крови в аорте в течение сердечного цикла (недостаточное в сравнении с нормой увеличение параметра Q и z0).
При аневризме величина Vsf/Vdf увеличивается приблизительно на 90% (с 0.35 до 0.67), а затем уменьшается до начального значения (рис. 2). Значение Q увеличивается примерно на 340% (c 2.1 × 10–5 до 8.8 × 10–5 м3), а затем происходит убывание Q до исходной величины (рис. 3). Величина z0 увеличивается сначала почти на 270% (с 0.19 до 0.7 м), а затем возвращается к исходному значению (рис. 4).
В результате увеличение парциального объема вторичных и возвратных течений и неравномерного (как следует из анализа динамической геометрии аорты) утолщения вихревого пограничного слоя приводит к снижению касательных напряжений вблизи стенки как проточного канала самой аорты, так и ее ветвей, что, очевидно, чревато образованием локальных застойных участков и в конечном итоге может привести к образованию тромбов.
Увеличение объема вторичных и возвратных течений приводит к возникновению значительных нормальных напряжений на стенки проточных каналов ветвей аорты, что приводит к их травмированию и разрушению.
Динамики изменения величины Q и z0 отражают тот факт, что при данном патологическом нарушении русла в проточном канале аорты теряется сходящаяся геометрия канала. В результате этого диссипация энергии закрученного потока крови, происходящая лишь в азимутальном направлении движения, увеличивается.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Моделирование позволяет выявить закономерности протекания процессов, которые невозможно установить экспериментально. Как было сказано выше, решить задачу визуализации и точного измерения структурных показателей потока крови в аорте в норме и при нарушении упругости невозможно. Однако создание обобщающей теоретической концепции и симуляция реального процесса эволюции струи крови в аорте на ее основе позволяет получить количественные параметры, характеризующие особенности структуры и эволюции потока крови.
В соответствии с принципами самоорганизации вихревых течений, вытекающими из точных решений, в момент открытия аортального клапана внутри проточного канала аорты в объеме крови, оставшемся после предыдущего цикла, формируется аксиально расположенный вихревой шнур, длина которого должна соответствовать продольному размеру проточного канала аорты. При поступлении крови из левого желудочка этот шнур обеспечивает подсос среды из полости левого желудочка в струю, тем самым увеличивая ее радиальный размер. Это “разбухание” вихревой структуры сопровождается растяжением стенок проточного канала аорты. При этом в каждый момент сердечного цикла геометрия стенок проточного канала аорты в норме соответствует положению линий тока закрученного течения крови, а стенка проточного канала аорты в каждый момент времени вогнута относительно направления линий тока закрученного течения.
При обтекании вогнутой поверхности аорты на стенке формируется равномерная структура трехмерного пограничного слоя, состоящего из вихрей типа вихрей Гертлера. Этот пограничный слой в силу своей структуры, с одной стороны, исключает образование застойных зон на стенке аорты, а с другой – снижает сопротивление перемещению закрученного потока крови, замещая сдвиговые напряжения напряжениями качения. Уменьшение толщины этого вихревого пограничного слоя приводит к возникновению нежелательных сдвиговых напряжений. Скачкообразное изменение толщины этого пограничного слоя вдоль стенки аорты или резкое утолщение его по всей длине может привести к образованию застойных зон и зон отрыва потока.
В каждый момент времени в полости проточного канала аорты наряду с доминантным смерчеобразным потоком функционируют вторичные и возвратные течения, обеспечивающие средой дочерние потоки в ветвях аорты. Заметное уменьшение объема этих течений по сравнению с нормальными значениями приводит к дефициту и перераспределению крови в ветвях аорты. Увеличение объема вторичных и возвратных течений приводит к утолщению вихревого пограничного слоя в ветвях и появлению избыточных нормальных напряжений на стенки.
Построение модели и последующая интерпретация результатов симуляции модельной аорты позволила выполнить оценку влияния патологических нарушений вязкоупругих характеристик стенки проточного канала аорты на структуру закрученного потока крови.
1. Норма. Соотношение ударного объема закрученной струи и суммарного объема пограничного слоя и вторичных течений Vsf/Vdf практически не изменяется в течение сердечного цикла. Это позволяет обеспечить постоянную “подстройку” проточного канала под структуру закрученного течения, одновременно не затрачивая дополнительную энергию на образование и поддержку дополнительных вторичных течений. Объемный показатель струи Q увеличивается вследствие растяжения стенок проточного канала, что заставляет точку начала моментальной цилиндрической системы координат потока z0 перемещаться сначала от фиброзного кольца аортального клапана вглубь левого желудочка (удлинение закрученной струи), а затем сдвигаться из полости левого желудочка к фиброзному кольцу аортального клапана (укорочение закрученной струи).
2. Постоянная упругость по длине. Вследствие того, что кривая упругости не изменяется по длине аорты, проточный канал практически сразу после начала сердечного цикла теряет необходимую для эволюции смерчеобразного течения сходящуюся геометрию. В результате, для обеспечения требуемой для закрученного течения геометрии проточного канала, толщина пограничного слоя уменьшается, объем вторичных течений уменьшается вследствие нарушения динамической геометрии проточного канала, а ударный объем закрученной струи, напротив, увеличивается. В результате относительная толщина пограничного слоя и вторичных течений уменьшается. При этом продольный размер закрученной струи практически не изменяется вследствие того, что геометрия канала не позволяет закрученной струи аккумулировать дополнительный объем среды. Вследствие этого угнетается также и ударный объем струи.
3. Замена участка аорты ригидным сегментом. На том участке аорты, который был заменен ригидным сегментом, радиус канала на этом участке не увеличивается в течение сердечного цикла. В результате того, что на здоровых участках динамическая геометрия остается нормальной, для компенсации изменений в динамической геометрии канала на протезированном участке уменьшается толщина пограничного слоя и уменьшается объем вторичных течений по всей длине канала. В результате этого геометрическая структура доминантного потока крови практически не изменяется в течение сердечного цикла, что отражается в относительно небольшом изменении величины z0 и объемного параметра струи Q.
4. Аневризма. При аневризме на определенном участке сосудистого русла упругость стенок проточного канала значительно понижена в сравнении с нормой. Таким образом, при воздействии поля давлений на этом участке образуется “мешок”. Подобные изменения в геометрии инициируют запуск компенсаторных механизмов, что вызывает утолщение пограничного слоя на пораженном участке. В то же время скачкообразное увеличение радиуса на пораженном участке порождает отрыв пограничного слоя и образование вторичных турбулентных течений. В результате относительный объем вторичных течений и пограничного слоя значительно увеличивается в течение сердечного цикла. Для сохранения формы линий тока, продольные размеры струи увеличиваются, согласно соотношению (4).
ЗАКЛЮЧЕНИЕ
Разработана математическая модель вязкоупругой аорты, позволяющая установить количественные параметры, характеризующие влияние патологических изменений упругих свойств стенок проточного канала на структуру пульсирующего закрученного течения крови в просвете аорты. Рассмотрение течения крови в аорте в терминах смерчеобразных самоорганизующихся потоков вязкой жидкости позволяет однозначным образом связать изменение динамической геометрии проточного канала аорты со структурой потока крови внутри него. Итоговые результаты симуляции построенной математической модели аорты на качественном уровне совпадают с наблюдаемым поведением реальной аорты при патологическом нарушении геометрии ее проточного канала.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены биоэтическим комитетом Национального медицинского исследовательского центра сердечно-сосудистой хирургии им. А.Н. Бакулева (Москва).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа выполнена при финансовой поддержке РНФ (грант № 16-15-00109).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Бокерия Л.А., Городков А.Ю., Кикнадзе Г.И. и др. Анализ поля скоростей закрученного потока крови в аорте на основании трехмерного картирования с помощью магнитно-резонансной велосиметрии // Бюлл. НЦССХ им. А.Н. Бакулева РАМН. 2003. Т. 4. № 9. С. 70.
Талыгин Е.А., Городков А.Ю., Кикнадзе Г.И. и др. Количественная оценка состояния внутрисердечного потока крови по анатомии левого желудочка на основании точных решений нестационарных уравнений гидродинамики для класса смерчеобразных потоков вязкой жидкости // Успехи физиологических наук. 2016. Т. 47. № 1. С. 48.
Жоржолиани Ш.Т., Талыгин Е.А., Крашенинников С.В. и др. Изменение упругости вдоль аорты как один из механизмов поддержания физиологически адекватной смерчеобразной структуры потока крови // Физиология человека. 2018. Т. 44. № 5. С. 47.
Bremer J. Presence and influence of spiral streams in the heart of the chick embryo // American journal of anatomy. 1932. V. 49. P. 409.
Gatehouse P.D., Keegan J., Crowe L.A. et al. Applications of phase-contrast flow and velocity imaging in cardiovascular MRI // Eur. Radiol. 2005. V. 15. № 10. P. 2172.
Bockeria L.A., Kiknadze G.I., Gachechiladze I.A. et al. Analysis of structure of intraventricular blood flow based on studies of architectonics of trabecular layer in left ventricle // Cardiometry J. 2013. V. 3. P. 5.
Кикнадзе Г.И., Олейников В.Г., Гачечиладзе И.А. и др. О структуре потока в левом желудочке сердца и аорте на основании точных решений нестационарных уравнений гидродинамики и морфометрических исследований // Доклады Академии Наук (ДАН). 1996. Т. 351. С. 119.
Кикнадзе Г.И., Краснов Ю.К. Эволюция смерчеобразных течений вязкой жидкости // Доклады Академии Наук (ДАН). 1986. Т. 290. № 6. С. 1315.
Кикнадзе Г.И., Краснов Ю.К., Хабенский В.Б. Самоорганизация вихревых структур при обтекании водой сферической лунки // Доклады Академии Наук (ДАН). 1986. Т. 291. № 6. С. 1315.
Cuomo F., Roccabianca S., Dillon-Murphy D. Effects of age-associated regional changes in aortic stiffness on human hemodynamics revealed by computational modeling // PLoS ONE. 2017. V. 12. № 3. eC. 0173177.
Bond A.R., Iftikhar S., Bharath A.A., Weinberg P.D. Morphological evidence for a change in the pattern of aortic wall shear stress with age // Arterioscler. Thromb. Vasc. Biol. 2011. V. 31. № 3. P. 543.
Pierce D.M., Maier F., Weisbecker H. Human thoracic and abdominal aortic aneurysmal tissues: Damage experiments, statistical analysis and constitutive modeling // J. Mech. Behav. Biomed. Mater. 2015. № 41. P. 92.
Sommer G., Sherifova S., Oberwalder P.J. et al. Mechanical strength of aneurysmatic and dissected human thoracic aortas at different shear loading modes // J. Biomech. 2016. V. 49. № 12. P. 2374.
Khanafer K., Schlicht M.S., Berguer R. How should we measure and report elasticity in aortic tissue? // European J. Vascular and Endovascular Surgery. 2013. V. 45. № 4. P. 332.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


