Физиология человека, 2019, T. 45, № 6, стр. 109-115
Оценка показателей фосфорно-кальциевого обмена при различных уровнях 25(ОН)D у лиц юношеского возраста, проживающих в условиях Арктического региона
С. И. Малявская 1, Г. Н. Кострова 1, *, А. В. Стрелкова 1, А. В. Лебедев 1
1 ФГБОУ ВО Северный государственный медицинский университет МЗ РФ
Архангельск, Россия
* E-mail: kostrovagn@yandex.ru
Поступила в редакцию 08.10.2018
После доработки 23.01.2019
Принята к публикации 03.04.2019
Аннотация
Изучались параметры фосфорно-кальциевого обмена при различных уровнях 25(ОН)D у лиц юношеского возраста. Выборка включала 48 юношей и 126 девушек в возрасте от 18 до 20 лет. Нормальные показатели витамина D выявлены у 40 (23%), концентрация 25-ОН витамина D в плазме крови = 20–30 нг/мл обнаружена у 59 (34%), 25-ОН витамин D = 10–19 нг/мл выявлен у 56 (32%) и 25-ОН витамин D < 10 нг/мл – у 19 (11%) обследованных. Отмечена ассоциация уровня кальция с выраженностью дефицита витамина D. Выявлено отсутствие повышения паратгормона при дефиците витамина D у 75% обследованных. Не установлено корреляции уровня паратиреоидного гормона (ПТГ) с уровнем витамина D. Результаты указывают на необходимость проведения исследований, направленных на выявление причин недостаточной реакции паратгормона на дефицит витамина D.
Витамин D, в силу его чрезвычайно широких физиологических эффектов, привлекает огромное внимание научной общественности, о чем свидетельствует колоссальное количество научных статей, посвященных данной проблеме, за последнее десятилетие: только за 2017 г. в базе Pubmed было опубликовано 4312 статей, на конец июня 2018 их было 2459. Кальцитриол (активный метаболит витамина D) представляет собой жирорастворимый стероидный гормон, который через ядерные рецепторы (VDR) в различных тканях регулирует экспрессию сотен генов, параллельно модулируя активность некоторых внутриклеточных сигнальных каскадов, оказывает тем самым обширный круг воздействия на разнообразные процессы в организме человека.
Роль витамина D как одного из основных регуляторов кальциево-фосфорного гомеостаза реализуется посредством запуска экспрессии генов, участвующих в трансцеллюлярном транспорте Са (гена апикальных кальциевых каналов (TRPV6), кальций-связывающего белка (кальбиндин-D9k, D28k), Са-АТФазы) и секрецию паратиреоидного гормона (ПТГ) [1].
Существует две основные формы витамина D: витамин D2 (эргокальциферол), который содержится в продуктах преимущественно растительного происхождения и поступает в организм с пищей, витамин D3 (холекальцферол), который образуется в коже из провитамина D3 (7-дегидрохолестерина) под влиянием ультрафиолетовых лучей. В дальнейшем происходит гидроксилирование его сначала в печени с образованием промежуточной формы 25(ОН)D (кальцидиола), затем преимущественно в почечной ткани с образованием активного метаболита 1.25(ОН)2D под влиянием 1α-гидроксилазы. Основными регуляторами 1α-гидроксилазы выступают паратгормон, который стимулирует транскрипцию гена CYP27B1, кодирующего 1α-гидроксилазу [2] и фактор роста фибробластов 23 (FGF-23), ингибирующий 1-α-гидроксилазу (CYP27B1) и стимулирующий образование 24-гидроксилазы (CYP24), которая конвертирует 1.25 (ОН)2D в неактивные метаболиты в проксимальных канальцах почек [3].
Классические эффекты витамина D, связанные с влиянием на фосфорно-кальциевый обмен, хорошо изучены, это:
– повышение абсорбции кальция в кишечнике и реабсорбции в почках,
– повышение абсорбции фосфатов в кишечнике,
– подавление экспрессии гена паратгормона (ПТГ) и снижение синтеза ПТГ,
– подавление пролиферации клеток паращитовидной железы,
– восстановление чувствительности клеток паращитовидной железы к супрессивному действию кальция,
– минерализация костной ткани, повышение минеральной плотности костной ткани за счет регуляции экспрессии ряда генов в ядрах остеобластов и остеокластов [4, 5].
Дефицит витамина D3 и нарушение образования его гормонально активных форм снижает абсорбцию ионизированного кальция в тонком кишечнике, повышает уровень паратгормона и через снижение уровня кальцитонина ведет к нарушению минерализации костей, усилению резорбции костной ткани и остеопорозу, параллельно способствуя развитию многих внескелетных заболеваний и преждевременной смерти [6, 7].
Мониторинг сывороточного уровня 25(ОН)D в процессе коррекции его дефицита в комбинации с оценкой уровня кальция в крови (как общего, так и ионизированного) широко используется в качестве диагностического теста ранних нарушений фосфорно-кальциевого обмена, прежде всего, первичного и вторичного гиперпаратиреоза [8]. Современные исследования показывают, что гиперпаратиреоз в сочетании с дефицитом витамина D сопряжен с развитием целого спектра патологических состояний, что актуализирует продолжение работ в данном направлении ввиду высокой клинической значимости скрининга данных параметров [9–14].
Изучение взаимоотношений ПТГ и витамина D дало различные результаты. В большинстве из них показана обратная зависимость 25(OH)D и ПТГ [15–18]. Однако в ряде публикаций продемонстрировано, что у части обследуемых дефицит витамина D не сопровождается повышением уровня ПТГ [19–23].
Особого внимания требует уровень 25(OH)D, приводящий к повышению ПТГ, который остается объектом научного обсуждения, с точки зрения определения границы нормы обеспеченности витамином D. В анализе [19] отмечена достаточно большая вариабельность уровня 25(OH)D, при котором ПТГ достигает плато или максимально супрессирован. Вместе с тем, установление уровня 25(ОН)D, при котором максимально снижается уровень ПТГ, очень важно. Граница нормы 30 нг/мл (75 нмоль/л) предложена по результатам обзоров опубликованных работ о взаимосвязи 25(OH)D и ПТГ, в которых признано, что уровень ПТГ начинает расти при снижении уровня витамина D ниже 30 нг/мл [24]. Продолжаются исследования, направленные на установление того, является ли ПТГ основным фактором, который следует учитывать при поиске границы нормы витамина D [25].
Климатогеографическая специфика Арктического региона создает условия для развития дефицита витамина D (географическая широта, особенности фотопериодичности, высокая геомагнитная активность, жесткость погодных условий) не только в связи с ограничением возможности естественного образования витамина D в коже, но и в силу адаптивных метаболических сдвигов [26]. Таким образом, представляет интерес изучение взаимосвязей уровней 25(OH)D, кальция и ПТГ при различной обеспеченности витамином D в условиях Арктического региона.
Цель исследования – изучение зависимости параметров кальций-фосфорного обмена от уровня витамина D у лиц юношеского возраста, проживающих в городе Архангельске.
МЕТОДИКА
В поперечном (одномоментном) исследовании принимали участие 174 чел. юношеского возраста (от 18 до 20 лет), из них 48 (27.6%) юношей, 126 (72.4%) девушки. Исследование проводили на базе Центральной научно-исследовательской лаборатории Северного государственного медицинского университета (Архангельск).
Количественное определение уровня 25(ОН)D (25 гидроксивитамин D) в сыворотке крови выполняли методом иммуноферментного анализа (наборы DRG Instruments GmbH, Германия). Пороговое значение чувствительности теста – 1.9 нг/мл. Нормальный уровень обеспеченности витамином D определяли при уровне 25(ОН)D 30–80 нг/мл, недостаточность – при уровне в пределах 20–30 нг/мл, дефицит – при 10–19 нг/мл, тяжелый дефицит – при менее 10 нг/мл, согласно критериям Международного общества эндокринологов [24].
Уровень общего кальция, фосфора, щелочной фосфатазы измеряли на биохимическом анализаторе. Нормальным считали уровень кальция при величине от 2.15 до 2.56 ммоль/л, уровень фосфора при величине от 0.81 до 1.45 ммоль/л, уровень щелочной фосфатазы при величине до 150 Ед/л. Уровень паратгормона измеряли методом иммуноферментного анализа (наборы DiaSource hPTH-EASIA Kit, ЗАО “БиоХимМак”, Москва), пг/мл (норма – 16–65.0 пг/мл).
Статистическую обработку данных проводили с использованием пакета программ STATA (Stata Corp., США). Анализ нормальности распределения значений исследованных признаков выполняли при помощи критерия Шапиро−Уилка. Количественные данные представлены в виде медианы (25-й; 75-й процентили). При множественном сравнении независимых групп использовали тест Крускала−Уоллиса (для парных сравнений – критерий Манна−Уитни). Корреляционный анализ проводили с помощью коэффициента ранговой корреляции Спирмена (rs). Различия считали статистически значимыми при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Нормальные показатели витамина D выявлены у 40 (23%) лиц юношеского возраста. Умеренный дефицит (недостаточность) витамина D (концентрация 25-ОН витамина D в плазме крови = = 20–30 нг/мл) обнаружен у 59 (34%) в данном возрасте, дефицит (25-ОН витамин D = 10–19 нг/мл) выявлен у 56 (32%) и тяжелый дефицит (25-ОН витамин D < 10 нг/мл) – у 19 (11%), соответственно.
Медиана 25(ОН)D составила 21.5 (14.8; 28.6) нг/мл, половых различий в уровне 25(ОН)D не выявлено. Щелочная фосфатаза значимо выше в группе юношей (р = 0.0001) (табл. 1). Остальные параметры кальций-фосфорного обмена по полу не различались, их медианные значения находились в пределах физиологической нормы (табл. 1).
Таблица 1.
Уровни 25(ОН)D и параметры кальций-фосфорного обмена
| Параметр | 25(ОН)D, нг/мл | Кальций общий, ммоль/л | Фосфор, ммоль/л | Щелочная фосфатаза, МЕ/л | Паратгормон, пг/мл |
|---|---|---|---|---|---|
| Юноши, n = 48 | 21.3 (15.8; 29.7) | 2.32 (2.26; 2.46) | 1.08 (0.99; 1.26) | 170 (159.5; 198.0)* | 43.6 (23.1; 70.7) |
| Девушки, n = 126 | 21.7 (14.6; 27.8) | 2.35 (2.24; 2.47) | 1.17 (1.04; 1.29) | 148.5 (129.9; 172.7) | 42.9 (27.8; 60.73) |
| Вся группа, n = 174 | 21.5 (14.8; 28.6) | 2.35 (2.25; 2.47) | 1.16 (1.01; 1.28) | 157.0 (136.0; 181.5) | 43.25 (27.0; 61.7) |
Доля лиц с гиперкальциемией (уровнем общего кальция ≥2.57 ммоль/л) составила 13.2% (23 чел.). Гипокальциемия выявлена у 29 чел. (16.6%). У лиц с уровнем 25(ОН)D ниже 30 нг/мл в 24% случаев отмечена незначительная парадоксальная гиперкальциемия (уровень общего кальция от 2.56 до 2.92 ммоль/л). Уровень общего кальция в группе с тяжелым дефицитом витамина D был значимо выше, чем в группах дефицита, недостаточности и нормальной обеспеченности витамином D соответственно (табл. 2), а также по сравнению с группой с уровнем 25(ОН)D выше 10 нг/мл (р = 0.004).
Таблица 2.
Параметры кальций-фосфорного обмена и уровень паратгормона в зависимости от обеспеченности витамином D
| Уровень 25(ОН), нг/мл | Пол | Кальций общий, ммоль/л; Ме (Q1; Q3) |
Фосфор, ммоль/л Ме (Q1; Q3) |
Щелочная фосфатаза, МЕ/л Ме (Q1; Q3) |
Паратгормон, пг/мл Ме (Q1; Q3) |
|---|---|---|---|---|---|
| (1) 0–10 |
Вся группа, n = 19 | 2.40 (2.32; 2.52) | 1.24 (1.03; 1.29) | 159.0 (121.0; 170.0) | 43.6 (32.6; 56.8) |
| Юноши, n = 5 | 2.25 (2.33; 2.6) | 1.17 (0.9; 1.29) | 17.0 (16.40; 194.5) | 54.6 (24.5; 76.8) | |
| Девушки, n = 14 | 2.39 (2.33; 2.56) | 1.25 (1.09; 1.29) | 150.0 (121.0; 160.25) | 41.6 (31.4; 54.6) | |
| (2) 10–19 |
Вся группа, n = 55 | 2.35* (2.25; 2.50) | 1.13 (1.02; 1.32) | 155.5 (137.7; 182.5) | 51.5 (21.6; 71.9) |
| Юноши, n = 16 | 2.34 (2.25; 2.53) | 1.07 (1.00; 1.37) | 185.5 (155.7; 222.75) | 55.7 (22.7; 82.4) | |
| Девушки, n = 39 | 2.36 (2.24; 2.5) | 1.14 (1.02; 1.37) | 147 (136; 181) | 45.7 (21.1; 66.34) | |
| (3) 20–30 |
Вся группа, n = 55 | 2.31** (2.23; 2.46) | 1.17 (1.05; 1.35) | 159.0 (137.5; 181.0) | 43.3 (27.9; 61.4) |
| Юноши, n = 15 | 2.25 (2.12; 2.28) | 1.19 (0.99; 1.38) | 171.0 (162.0; 199.0) | 43.3 (30.4; 52.3) | |
| Девушки, n = 40 | 2.35 (2.22; 2.47) | 1.15 (1.06; 1.25) | 148 (129.3; 162.5) | 42.32 (26.7; 61.5) | |
| (4) Более 30 |
Вся группа, n = 31 | 2.35*** (2.25; 2.45) | 1.11 (0.96; 1.24) | 152.0 (125.0; 187.0) | 35.5 (21.1; 55.5) |
| Юноши, n = 7 | 2.36 (2.27; 2.38) | 1.05 (0.99; 1.18) | 167.0 (152.0; 214.0) | 11.8 (6.6; 42.5) | |
| Девушки, n = 24 | 2.28 (2.19; 2.39) | 1.12 (0.9; 1.23) | 141.5 (123.25; 170.75) | 57.6 (38.45; 75.1) |
Корреляционный анализ выявил слабую отрицательную связь между уровнем витамина D и общего кальция (R = –0.164, p = 0.033).
Уровень 25(ОН)D был значимо выше в группе с нормокальциемией, по сравнению с группой с гиперкальциемией (р = 0.018). Парагормон также был выше в группе с гиперкальциемией, но различия не достоверны.
Уровень сывороточной щелочной фосфатазы был значимо выше (р = 0.0001) в группе с тяжелым дефицитом витамина D по сравнению с группой с уровнем 25 (ОН)D выше 10 нг/мл.
Повышенный уровень паратгормона выявлен у 37 чел. (21.3%). Уровни паратгормона были выше в группе с уровнем 25(ОН)D ниже 30 нг/мл по сравнению с группой с нормальным уровнем витамина D, однако различия не были статистически значимыми, также уровни паратгормона были выше в группе с уровнем 25(ОН)D ниже 20 нг/мл по сравнению с группой с уровнем 25(ОН)D выше 20 нг/мл. При этом не установлено корреляции уровня ПТГ с уровнем витамина D.
Более 75% обследованных имеют нормальный уровень ПТГ при уровнях 25(ОН)D ниже 30 нг/мл и ниже 20 нг/мл. Слабый ответ паратгормона на дефицит витамина D отмечен как у юношей, так и у девушек (рис. 1, рис. 2). Не выявлено половых различий в уровнях паратгормона при различной степени дефицита холекальциферола: уровень значимости (p) различий концентрации паратгормона у юношей и девушек с тяжелым дефицитом (25-ОН витамин D < 10 нг/мл) составил 0.444, дефицитом (25-ОН витамин D = 10–19 нг/мл) – 0.496, недостаточностью (концентрация 25-ОН витамина D в плазме крови = 20–30 нг/мл) – 0.925. Уровень паратгормона у девушек был значимо выше, чем у юношей только при нормальном уровне 25-ОН витамина D в плазме крови (p = 0.041). Доля нормокальциемии при повышенном уровне ПТГ составила 78%.
Рис. 1.
Доля юношей и девушек с различными уровнями ПТГ при уровне 25(ОН)D ниже 20 нг/мл. А – юноши, Б – девушки; а – повышенный уровень паратгормона, б – нормальный уровень паратгормона, в – пониженный уровень паратгормона.
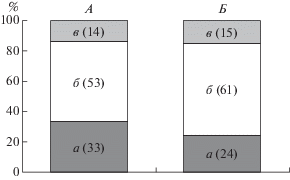
Рис. 2.
Доля юношей и девушек с различными уровнями ПТГ при уровне 25(ОН)D ниже 30 нг/мл. Обозначения см. рис. 1.

Положительная корреляционная связь между уровнем паратгормона и общего кальция (R = 0.21, р = 0.018) отмечена в группе с уровнем 25(ОН)D ниже 30 нг/мл, в этой же группе выявлена слабая отрицательная корреляционная связь между уровнем витамина D и уровнем общего кальция (R = 0.18, p = 0.037).
Несмотря на тенденцию к более низкому уровню витамина D (рис. 2) и более высокому уровню общего кальция в группе с повышенным паратгормоном, достоверных различий данных параметров, в также уровней фосфора и сывороточной щелочной фосфатазы значимо не различались (табл. 3).
Таблица 3.
Параметры кальций-фосфорного обмена в зависимости от уровня паратгормона
| Уровень паратгормона, пг/мл | Пол | Уровень 25(ОН)D, нг/мл | Кальций общий, ммоль/л |
Фосфор, ммоль/л | Щелочная фосфатаза, МЕ/л |
|---|---|---|---|---|---|
| Выше 65 | Вся группа, n = 36 | 22.5 (14.1; 29.1) | 2.35 (2.25; 2.45) | 1.14 (1.04; 1.29) | 158.0 (136.0; 182.9) |
| Юноши, n = 11 | 22.55 (16.83; 31.78) | 2.37 (2.27; 2.58) | 1.11 (0.99; 1.36) | 180 (162; 199) | |
| Девушки, n = 25 | 22.23 (13.94; 28.84) | 2.34 (2.23; 2.49) | 1.14 (1.02; 1.26) | 149.5 (130.0; 173) | |
| Ниже 65 | Вся группа, n = 129 | 19.5 (16.6; 25.1) | 2.37 (2.28; 2.53) | 1.18 (1.05; 1.26) | 148.0 (129.5; 171.5) |
| Юноши, n = 35 | 19.85 (14.84; 23.46) | 2.3 (2.28; 2.56) | 1.06 (0.96; 1.22) | 189 (167; 257) | |
| Девушки, n = 94 | 19.08 (16.84; 25.61) | 2.46 (2.27; 2.52) | 1.24 (1.09; 1.31) | 143 (1.27; 158.5) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Нами выявлена недостаточная обеспеченность лиц юношеского возраста витамином D – лишь каждый пятый участник исследования имел рекомендованные значения 25(ОН)D, у большинства отмечен дефицит витамина D. Недостаточность витамина D у лиц юношеского возраста сопровождается разнонаправленными изменениями кальций-фосфатного обмена, что отражает сложность регуляции.
Важно обратить внимание на ассоциацию уровня кальция с выраженностью дефицита витамина D, которая, вероятно, обусловлена ролью витамина D и паратгормона в регуляции фосфорно-кальциевого обмена: при дефиците витамина D абсорбция кальция в кишечнике снижается, приводя к падению ионизированного кальция, который в свою очередь стимулирует секрецию паратгормона, вызывающего мобилизацию кальция из костей и коррекцию гипокальциемии. Длительно существующий дефицит витамина D может приводить к “растормаживанию” паращитовидных желез и развитию умеренной гиперкальциемии, о чем свидетельствует более высокий уровень кальция в группах с более низкими уровнями 25(ОН)D и более высокий уровень щелочной фосфатазы в данной группе. Гипокальциемия, отмеченная при дефиците витамина D многими авторами, выявлена лишь у 16.6% обследованных.
Классическая реакция повышения уровня паратгормона в ответ на снижение уровня кальция в крови при дефиците витамина D получена в группе с уровнем 25(ОН)D ниже 30 нг/мл, о чем свидетельствует положительная корреляционная связь между уровнем паратгормона и общего кальция (R = 0.21, p = 0.018).
Вместе с тем, повышенный уровень ПТГ выявлен лишь у 21.3%, при том, что доля молодых людей с уровнем 25 (ОН)D ниже рекомендованных 30 нг/мл составила 76%. Тот факт, что более 75% обследованных имеют нормальный уровень ПТГ при уровнях 25 (ОН)D ниже 30 нг/мл показывает, что уровень ПТГ не всегда повышен у лиц с дефицитом витамина D, что совпадает с данными, полученными другими авторами [19–23]. Данное явление в литературе именуется как “функциональный гипопаратиреоидизм” [27]. Однако такая реакция паратгоромона отмечена у лиц с установленным остеопорозом, а также в более старших возрастных группах, а не у лиц юношеского возраста. По данным литературы обратная зависимость ПТГ и 25(OH)D может модулироваться рядом факторов, к которым относят возраст, пол, этническую принадлежность, изменения массы тела, сопутствующий дефицит магния, уровни половых гормонов, инсулиноподобного фактора роста 1, курение, генетические вариации VDR [27–32]. Несмотря на то, что пол является фактором, который может влиять на обратную зависимость концентрации паратгормона и 25(OH)D, в исследовании мы не выявили половых различий в уровнях паратгормона при различной степени дефицита витамина D.
Результаты, полученные нами при обследовании практически здоровых лиц юношеского возраста северного региона, указывают на возможность снижения чувствительности паращитовидных желез к гипокальциемии вследствие десенситизации и снижения экспрессии кальций-чувствительного рецептора паращитовидных желез [33], обусловленной проживанием в зоне с низкой инсоляцией и высокой вероятностью дефицита витамина D. Следует учитывать и пульсаторный характер секреции паратгормона, в связи с чем, однократное исследование уровней паратгормона и общего кальция может не отражать реальную картину с учетом малой выборки.
ЗАКЛЮЧЕНИЕ
В выборке лиц юношеского возраста, проживающих в условиях г. Архангельска, выявлен низкий уровень обеспеченности витамином D, при этом не обнаружена характерная для гиповитаминоза D гипокальциемия. Напротив, отмечена ассоциация уровня кальция с выраженностью дефицита витамина D. Полученное нами отсутствие типичной обратной корреляции уровня общего кальция и 25(ОН)D и отсутствие повышения уровня паратгормона при дефиците витамина D отражает сложность регуляции фосфорно-кальциевого обмена, что требует проведения дополнительных исследований, направленных на выявление причин недостаточной реакции паратгормона на дефицит витамина D.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным этическим комитетом Северного государственного медицинского университета (Архангельск), протокол № 04/01-16 от 03.02.2016.
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование проведено при финансовой поддержке Северного государственного медицинского университета (Архангельск).
Благодарности. Авторы статьи выражают благодарность сотрудникам Центральной научно-исследовательской лаборатории Северного государственного медицинского университета (Архангельск).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
DeLuca H.F. Overview of general physiologic features and functions of vitamin D // Am. J. Clin. Nutr. 2004. V. 80. № 6. P. 1689S.
Christakos S., Ajibade D.V., Dhawan P. et al. Vitamin D: metabolism // Endocrinol. Metab. Clin. North Am. 2010. V. 39. P. 243.
Richter B., Faul Ch. FGF23 Actions on Target Tissues-With and Without Klotho // Front Endocrinol (Lausanne). 2018. V. 2. № 9. P. 189.
Holick M.F. Vitamin D deficiency // N. Engl. J. Med. 2007. V. 357. P. 266.
Жиляев Е.В., Глазунов А.В., Глазунов П.А. и др. Нарушения обмена витамина D: клинический аспект // Клиническая медицина. 2012. Т. 90. № 7. С. 14.
Климова Ж.А., Зафт А.А., Зафт В.Б. Современная лабораторная диагностика остеопороза // Международный эндокринологический журнал. 2014. № 7(63). С. 75.
Holick M.F. The vitamin D deficiency pandemic: approaches for diagnosis, treatment and prevention // Rev. Endocr. Metab. Disord. 2017. V. 18. P. 153.
Дедов И.И., Мельниченко Г.А., Мокрышева Н.Г. и др. Первичный гиперпаратиреоз: клиника, диагностика, дифференциальная диагностика, методы лечения // Проблемы эндокринологии. 2016. № 6. С. 40.
Pascale A.V., Finelli R., Giannotti R. et al. Vitamin D, parathyroid hormone and cardiovascular risk: the good, the bad and the ugly // J. Cardiovasc Med. (Hagerstown). 2018. V. 19. № 2. P. 62.
Sotunde O.F., Kruger H.S., Wright H.H. et al. Association of 25-hydroxyvitamin D and parathyroid hormone with the metabolic syndrome in black South African women // Appl. Physiol. Nutr. Metab. 2017. V. 42. № 4. P. 413.
Raposo L., Martins S., Ferreira D. et al. Vitamin D, parathyroid hormone and metabolic syndrome – the PORMETS study // BMC Endocr. Disord. 2017. V. 17. № 1. P. 71.
Ha J., Jo K., Lim D.J. et al. Parathyroid hormone and vitamin D are associated with the risk of metabolic obesity in a middle-aged and older Korean population with preserved renal function: A cross-sectional study // PLoS One. 2017. V. 12. № 4. e0175132.
Choi S.W., Kweon S.S., Lee Y.H. et al. 25-Hydroxyvitamin D and Parathyroid Hormone Levels Are Independently Associated with the Hemoglobin A1c Level of Korean Type 2 Diabetic Patients: The Dong-Gu Study // PLoS One. 2016. V. 11. № 6. e0158764.
Van Ballegooijen A.J., Kestenbaum B., Sachs M.C. et al. Association of 25-hydroxyvitamin D and parathyroid hormone with incident hypertension: MESA (Multi-Ethnic Study of Atherosclerosis) // J. Am. Coll. Cardiol. 2014. V. 63. № 12. P. 1214.
Kilicarslan A., Aslan A.C., Gezgen G. The role of vitamin D deficiency in parathyroid hormone levels // Turk. J. Med. Sci. 2013. V. 43. № 3. P. 368.
Mahmood S., Rahman M., Biswas S.K. et al. Vitamin D and Parathyroid Hormone Status in Female Garment Workers: A Case-Control Study in Bangladesh // BioMed Res. Int. 2017. V. 2017. Article ID 4105375. https://doi.org/10.1155/2017/4105375
Serdar M.A., Batu Can B., Kilercik M. et al. Analysis of Changes in Parathyroid Hormone and 25(OH) Vitamin D Levels with Respect to Age, Gender and Season: A Data Mining Study // J. Med. Biochem. 2017. V. 36. № 1. P. 73.
Durá-Travé T., Gallinas-Victoriano F. Seasonal variations in calcidiol and parathyroid hormone levels in healthy children and adolescents in Navarre, Spain: a cross-sectional study // JRSM Open. 2016. V. 7. № 4. P. 2054270416632704.
Sai A.J., Walters R.W., Fang X., Gallagher J.C. Relationship between vitamin D, parathyroid hormone, and bone health // J. Clin. Endocrinol. Metab. 2011. V. 96. № 3. P. E436.
Shibli-Rahhal A., Paturi B. Variations in parathyroid hormone concentration in patients with low 25 hydroxyvitamin D // Osteoporos Int. 2014. V. 25. № 7. P. 1931.
Valcour A., Blocki F., Hawkins D.M., Rao S.D. Effects of age and serum 25-OH-Vitamin D on serum parathyroid hormone levels // J. Clin. Endocrinol. Metab. 2012. V. 97. № 11. P. 3989.
Garg M.K., Tandon N., Marwaha R.K. et al. The relationship between serum 25-hydroxy Vitamin D, parathormone and bone mineral density in Indian population // Clin. Endocrinol. 2014. V. 80. P. 41.
Sahota O., Mundey M.K., San P. et al. The relationship between Vitamin D and parathyroid hormone: Calcium homeostasis, bone turnover, and bone mineral density in postmenopausal women with established osteoporosis // Bone. 2004. V. 35. № 1. P. 312.
Holick M.F., Binkley N.C., Bischoff-Ferrari H.A. et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline // J. Clin. Endocrinol. Metab. 2011. V. 96. № 7. P. 1911.
Katrinaki M., Kampa M., Margioris A. et al. Vitamin D levels in a large Mediterranean cohort: reconsidering normal cut-off values // Hormones (Athens). 2016. V. 15. № 2. P. 205.
Чащин В.П., Гудков А.Б., Попова О.Н. и др. Характеристика основных факторов риска нарушений здоровья населения, проживающего на территориях активного природопользования в Арктике // Экология человека. 2014. № 1. С. 3.
Kannan S., Mahadevan S., Velayutham P. et al. Estimation of magnesium in patients with functional hypoparathyroidism // Indian J. Endocrinol. Metab. 2014. V. 18. № 6. P. 821.
Sahota O., Mundey M.K., San P. et al. Vitamin D insufficiency and the blunted PTH response in established osteoporosis: the role of magnesium deficiency // Osteoporos Int. 2006. V. 17. № 7. P. 1013.
Gunnarsson O., Indridason O.S., Franzson L. et al. Factors associatedwith elevated or blunted PTH response in vitamin D insufficient adults // J. Int. Med. 2009. V. 265. № 4. P. 488.
Paik J.M., Farwell W.R., Taylor E.N. Demographic, dietary, and serum factors and parathyroid hormone in the National Health and Nutrition Examination Survey // Osteoporos. Int. 2012. V. 23. № 6. P. 1727.
Sadat-Ali M., Al-Omran A.S., Al-Turki H.A. Parathyroid Glands response to Low Vitamin D levels in Healthy Adults: A Cross-Sectional Study // Ulster Med. J. 2015. V. 84. № 1. P. 26.
Jeong S., Kim I.W., Oh K.H. et al. Pharmacogenetic analysis of cinacalcet response in secondary hyperparathyroidism patients // Drug Des. Devel. Ther. 2016. V. 10. P. 2211.
Hendy N., Canaff L. Calcium-Sensing Receptor Gene: Regulation of Expression Geoffrey // Front. Physiol. 2016. № 7. P. 394.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


