Физиология человека, 2020, T. 46, № 1, стр. 46-53
Особенности влияния фазозависимой экзогенной афферентации на мощность фоновых ритмов ЭЭГ человека
А. А. Пушкин 1, *, А. Г. Сухов 1
1 Академия биологии и биотехнологии им. Д.И. Ивановского ЮФУ
Ростов-на-Дону, Россия
* E-mail: artyompushkin@yandex.ru
Поступила в редакцию 17.11.2018
После доработки 28.02.2019
Принята к публикации 04.04.2019
Аннотация
В исследовании участвовало 20 практически здоровых добровольцев. Зрительные стимулы, представлявшие собой диффузные вспышки света длительностью 50 мкс, предъявлялись каждому участнику исследования по 100 раз только на восходящей или только на нисходящей фазах колебаний, соответствующих индивидуально доминирующей частоте α-ритма. ЭЭГ регистрировалась от 14-ти отведений по системе 10/20. Показано, что фотостимуляция, синхронизированная с восходящей фазой α-волн, приводит к снижению мощности α-ритма в периоды не менее 1 мин после предъявления серии стимулов. В свою очередь, сенсорные стимулы, подаваемые на нисходящей фазе, приводят к повышению в ЭЭГ мощности α-ритма.
Проблема перестройки эндогенных ритмов электроэнцефалограммы (ЭЭГ) человека в ответ на воздействие фазозависимой экзогенной афферентации долгое время и до сих пор является объектом пристального внимания исследователей [1–3]. Интерес такого рода исследований обусловлен наличием многочисленных данных о связи фазы волн α-осцилляций с цикличными флуктуациями процессов возбуждения и торможения [2–5]. В частности, показано, что идентичные по физическим параметрам зрительные стимулы, попадая в разные фазы α-волн, в субъективном плане переживаются человеком по-разному. Так, установлено, что восприятие двух стимулов (с кратковренным фиксированным межстимульным временны́м интервалом) как единичного стимула, или соответственно одиночных вспышек, следующих друг за другом, зависит от фазы волны α-ритма окципитальной области коры больших полушарий головного мозга человека [3, 6, 7].
Исходя из существующих современных представлений о связи периодических изменений уровня активированности коры больших полушарий с колебаниями α-осцилляторной активности, была сформулирована гипотеза дискретно-временнóго кодирования экзогенной информации при ее поступлении в момент определенного уровня возбудимости, сочетанного с фазой эндогенных α-осцилляций ЭЭГ человека [2]. Показано, что фаза локального фонового ритма, модулируя амплитуду [8, 9] и тайминг биоэлектрической активности популяции нейронов [10, 11], определяет фундаментальные механизмы обработки информации в центральной нервной системе [2, 3, 7]. Вследствие того, что оптимальный уровень возбудимости, регламентирующий аналитико-синтетическую деятельность головного мозга, соответствует восходящей фазе α-волны, системная реакция мозга (т.е. изменения колебаний возбудимости не только в одной зоне коры), формирующаяся в ответ на сложные раздражители, полностью зависит от момента поступления стимула [12]. Так, некоторые авторы указывают на влияние фазы α-волны в организации процессов восприятия [13], в частности восприятия слуховых стимулов [14], фосфенов, индуцированных транскраниальной магнитной стимуляцией [15], осознания и идентификации околопороговых, а также замаскированных зрительных [4] и речевых [16] стимулов. Экспериментально доказана модулирующая роль фазы α-волны в процессах построения пространственно-временнóй ассоциации между событиями [3, 6, 17] предвосхищения и ожидания [18]. Также установлено, что фаза волн фоновых α-осцилляций является важным электрофизиологическим фактором, определяющим как эффективность рабочей памяти [19, 20] и внимания [21], так и скорость сенсомоторной интеграции [22, 23].
Однако, несмотря на представленные многочисленные исследования, выполненные при помощи замкнутой биоэлектронной системы триггерной стимуляции, частотно-фазовых особенностей влияния фонового ритмогенеза на функциональное состояние мозга и зависящие от него процессы восприятия и анализа сенсорной информации в ЦНС, задача выяснения особенностей долговременной (в течение 1 мин) модификации фоновых ритмов в зависимости от момента поступления экзогенной сенсорной афферентации на разных фазах эндогенного ритма не получила до сих пор должного решения. В связи с этим целью данной работы было установление особенностей зависимости между фазой подачи фотостимуляции относительно волн индивидуально доминирующего ритма ЭЭГ конкретного человека и постстимульной долговременной (в течение 1 мин) пространственно-временнóй модификацией мощности ритмов ЭЭГ. Задача целенаправленной пространственно-временнóй модификации осцилляторных процессов головного мозга потребовала, с нашей точки зрения, внесения некоторых изменений в контур схемы биоэлектронной триггерной стимуляции. Последнее объясняется тем обстоятельством, что в обычной триггерной схеме синхронизация стимула с фазой волны ЭЭГ осуществляется сугубо по фактору устанавливаемой временнóй задержки подачи и, в значительно меньшей степени, по достижению заданного экспериментатором амплитудного порога, что, в итоге, не может гарантировать подачу стимула строго в определенную фазу волны выбранной частотной полосы.
В связи с этим для реализации поставленной цели авторами данной статьи была разработана биоэлектронная схема фазозависимой управляемой от ЭВМ в режиме реального времени стимуляции, обеспечивающая предъявление экзогенного стимула в установленную фазу интересуемого частотного диапазона с учетом требуемого амплитудного порога.
МЕТОДИКА
В ЭЭГ-исследовании принимали участие 20 практически здоровых обследуемых-добровольцев обоего пола из числа студентов, аспирантов и сотрудников Южного федерального университета (ЮФУ) в возрасте от 18 до 30 лет (12 мужчин и 8 женщин, средний возраст составил 23.40 ± 5.22). Добровольцев подбирали по критерию хорошей выраженности α-ритма в затылочных отведениях.
Изучение влияния сенсорной стимуляции, синхронизированной в режиме реального времени с определенными, характерными для конкретного испытуемого, фазами α-волн на механизмы долговременных перестроек фонового ритма человека, осуществляли при одновременном использовании двух усилителей биопотенциалов мозга. С целью выделения необходимого частотного диапазона и указания фазы для подачи зрительного стимула в режиме реального времени использовали аналоговый 8-ми канальный электроэнцефалограф “Биоскрипт БСТ-112” (Германия). Сигналы с выходных каскадов аналогового электроэнцефалографа “Биоскрипт БСТ-112” подавались на входные каналы блока обработки параметров ЭЭГ и управления стимулирующими воздействиями (БОиУ). Данный БОиУ, разработанный авторами для достижения поставленной методической цели, представляет собой микропроцессорную многоканальную и эргономичную систему регистрации и модуляции ЭЭГ, обеспечивающую возможность анализа многомерных сигналов биологического генеза в режиме реального времени [24]. БОиУ конструктивно оформлен в виде отдельного блока с автономным источником питания. Сигналы на входные каналы БОиУ подаются с выходных каскадов электроэнцефалографа.
Для выделения необходимого частотного диапазона и указания фазы для подачи зрительного стимула в режиме реального времени в БОиУ используется полосовой фильтр, что обеспечивает цифровую фильтрацию сигналов для идентификации необходимой полосы частот и работы БоиУ в диапазоне колебаний биопотенциалов мозга человека. Полосовая фильтрация ЭЭГ в режиме реального времени осуществляется при помощи двух синусных фильтров нижних частот Баттерворда, которые способны обеспечить необходимую монотонность амплитудно-частотных характеристик как в полосе пропускания, так и в полосе подавления. Необходимая амплитуда и фаза α-волны в БОиУ детектируется посредством сравнения отсчетов отфильтрованной ЭЭГ, зарегистрированной при помощи БСТ-112, с мгновенными значениями амплитуд опорного синусоидального сигнала Баттерворда [24].
Сенсорный стимул предъявляли в определенную фазу α-волны, если БОиУ идентифицировал полное сходство параметров (частота, амплитуда, фаза) биопотенциалов с мгновенными значениями опорного синусоидального сигнала Баттерворда.
Активный электрод, используемый для регистрации фаз α-волн при фазозависимой сенсорной стимуляции, располагали над правой затылочной областью (O2). Зрительные стимулы, представлявшие собой диффузные вспышки света длительностью 50 мкс и с энергией вспышки 35 Дж, предъявляли на восходящей или нисходящей фазах колебаний (в зависимости от этапа исследования), соответствующих индивидуально доминирующей частоте α-ритма. Эту частоту определяли по результатам спектрального анализа 30-секундных ЭЭГ-эпох, зарегистрированных при помощи БСТ-112. В дальнейшем зрительный стимул предъявляли на восходящие или нисходящие фронты фаз фоновых α-волн ЭЭГ человека с пороговым значением амплитуды α-волн не менее 100 мкВ. В итоге, каждому испытуемому предъявляли 100 стимулов с межстимульным интервалом не менее 2222 мс. В свою очередь, диффузные вспышки света формировали стробоскопической лампой-вспышкой (фотостимулятор ФС-02), которую размещали на уровне глаз обследуемого, на расстоянии 30 см, посредством подачи на вход последней триггерного импульса от БОиУ, усиленного электростимулятором ЭСЛ-2.
Параллельно с вышеописанной процедурой сопряжения внешнего воздействия с фазой эндогенной α-волны для изучения пространственно-временнóй организации биопотенциалов при фазозависимом характере стимуляции производили регистрацию ЭЭГ монополярно с использованием 41 канального усилителя “Нейрон-Спектр 5” (Нейрософт, Россия) от 14-ти отведений хлорсеребряными (Ag/AgCl) электродами по системе 10/20 Джаспера (F8, F7, F4, F3, T4, T3, C4, C3, T6, T5, P4, P3, O2, O1). Объединенные индифферентные электроды помещали на мочках ушей обследуемых. Энцефалографические сигналы фильтровали в частотном диапазоне 1–70 Гц и оцифровывали с частотой 500 Гц по каждому каналу. Все исследования проводили в дневное время суток в слабо освещенной экранированной камере со звукоизоляцией. Все добровольцы во время регистрации электроэнцефалограммы находились в состоянии пассивного бодрствования с закрытыми глазами. При анализе ЭЭГ, для каждого из отведений проводили спектральный анализ в диапазоне частот 0.5–35 Гц с шагом по частоте 4 Гц (спектральное окно 4 Гц) на основе алгоритма быстрого преобразования Фурье с целью вычисления абсолютных значений мощности (АЗМ) ритмов ЭЭГ для 3 функциональных проб: “фон” (состояние покоя с закрытыми глазами до стимуляции), “стимуляция” (на фоне стимуляции, синхронизированной с той или иной фазой α-волн), и “последействие” (состояние покоя после завершения стимуляции). В каждом из состояний анализировали 60-секундные эпохи, не содержащие артефактов физической и физиологической природы. Значения мощности частотных диапазонов (δ-, θ-, α-, β1-, β2-), соответствующие пробам “стимуляция” и “последействие”, сравнивали с аналогичными в состоянии “фон” по всем отведениям при помощи дисперсионного анализа one-way ANOVA (для проверки гипотез о различии между средними нескольких нормально распределенных случайных величин), с последующим применением апостериорных сравнений средних значений (критерий Тьюки) для анализа эффектов взаимодействий. Сравнение значений индексов мощности между пробами осуществляли по 1-факторной схеме, т.е. в качестве группирующего признака выступала функциональная проба (фон до стимуляции, стимуляция на восходящей или нисходящей фазе в отдельности, фон после). Все расчеты производились с использованием пакета прикладных программ Statistica 10.0. Результаты представлены в виде среднего арифметического значения и ошибки среднего (M ± m).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
На первом этапе обработки данных, полученных в ходе исследования, осуществлялся мониторинг динамики показателей мощности ритмов ЭЭГ, регистрируемых во время состояния покоя до стимуляции, на фоне стимуляции, синхронизированной с восходящей фазой α-волны и в состоянии покоя после завершения стимуляции. Апостериорный сравнительный анализ средних значений мощности диапазонов показал, что зрительные стимулы, синхронизированные с восходящей фазой α-волны, вызывали статистически значимое изменение мощности только в α-частотном диапазоне по сравнению с фоном (рис. 1).
Рис. 1.
Статистически достоверные различия (p < 0.001) значений (M ± m) мощности α-ритма функциональных проб “стимуляция” (б) и “последействие” (в), полученные в результате предъявления зрительных стимулов на восходящей фазе α-волн, по сравнению со значением мощности α-ритма “фона” до стимуляции (а). По оси абсцисс обозначены отведения, в которых были зарегистрированы статистически достоверные различия значений мощности по сравнению с фоном до стимуляции. * – статистически достоверные различия значений мощности α-ритма функциональной пробы “стимуляция” по сравнению с фоном. # – статистически достоверные различия значений мощности α-ритма функциональной пробы “последействие” по сравнению с фоном.
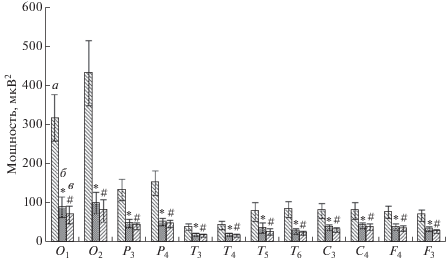
Наблюдалось статистически достоверное снижение по сравнению с фоном показателя мощности в α-частотном диапазоне ЭЭГ всех обследуемых, зарегистрированных во время сенсорной стимуляции, подаваемой на восходящей фазе α-волн, в отведениях O1 (F (2, 57) = 12.045, p < < 0.00004), O2 (F (2, 57) = 14.021, p < 0.00001), P3 (F (2, 57) = 8.2473, p < 0.00071), P4 (F (2, 57) = = 9.2531, p < 0.00033), T3 (F (2, 57) = 4.5816, p < < 0.01428), T4 (F (2, 57) = 4.9586, p < 0.01034), T5 (F (2, 57) = 5.2809, p < 0.030038), T6 (F (2, 57) = = 7.1040, p < 0.00176), C3 (F (2, 57) = 4.7180, p < < 0.01270), C4 (F (2, 57) = 4.7180, p < 0.01270), F3 (F (2, 57) = 5.7953, p < 0.00512), F4 (F (2, 57) = = 5.2150, p < 0.00832) (рис. 1). Данный эффект сохранялся и после завершения сенсорной стимуляции на протяжении 1 мин (рис. 1).
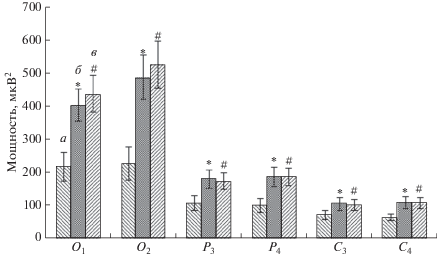
Последующий этап обработки экспериментального материала заключался в сравнительном анализе показателей мощности ритмов ЭЭГ, зарегистрированных до стимуляции, с показателями мощности ритмов во время сенсорной стимуляции, синхронизированной с нисходящей фазой α-волны. Апостериорный сравнительный анализ средних значений мощности диапазонов показал, что фотовспышки, синхронизированные с нисходящей фазой α-волны, также вызывали статистически значимые изменения мощности только в α-частотном диапазоне по сравнению с фоном. В результате было установлено, что зрительные стимулы, подаваемые на нисходящей фазе α-волн, приводили к росту показателя мощности частот α-ритма по сравнению с фоном.
Статистически достоверным это увеличение было в отведениях O1 (F (2, 57) = 4.8607, p < < 0.01124), O2 (F (2, 57) = 6.7373, p < 0.00236), P3 (F (2, 57) = 4.4507, p < 0.03493), P4 (F (2, 57) = = 4.1060, p < 0.02156), C3 (F (2, 57) = 6.4376, p < < 0.009), C4 (F (2, 57) = 6.7398, p < 0.00004) (рис. 2). Данный эффект сохранялся и после завершения сенсорной стимуляции на протяжении 1 мин (рис. 2).
Рис. 2.
Статистически достоверные различия (p < 0.001) значений (M ± m) мощности α-ритма функциональных проб “стимуляция” (б) и “последействие” (в), полученные в результате предъявления зрительных стимулов на нисходящей фазе α-волн, по сравнению со значением мощности α-ритма “фона” до стимуляции (а). По оси абсцисс обозначены отведения, в которых были зарегистрированы статистически достоверные различия значений мощности по сравнению с фоном до стимуляции. Обозначения см. рис. 1.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенное апостериорное сравнение средних значений (критерий Тьюки) выявило наличие фазозависимого влияния сенсорной стимуляции, синхронизированной с восходящей или нисходящей фазами индивидуально доминирующих α-колебаний, на выраженность долговременных перестроек мощности только в α-частотном диапазоне ЭЭГ. В частности, синхронизация кратковременного сенсорного стимула с восходящей фазой α-волны приводит к уменьшению показателя значений мощности α-ритма (рис. 1) во фронтальных, центрально-темпоральных и париетально-окципитальной областях (рис. 1).
Возможно, что восходящая фаза эндогенного потенциала α-ритма в функциональном плане является электрофизиологическим коррелятом восходящего информационного потока, определяющего дискретно-сканирующий механизм интегративно-анализирующих отделов ЦНС и обеспечивающего идентификацию [4], быструю реакцию, селективный отбор значимой информации для дальнейшего запоминания, интеграции межмодальной информации в единый образ, подавления иррелевантной информации, управление уровнем активации. Согласно представленным оригинальным данным, именно негативно-восходящий фронт α-волны отражает наибольшую метаболическую активность нейронов [25], соответствующую фазе возбуждения вертикально ориентированных пирамидных нейронов, дающих проекции в 1 слой коры [26]. Так, установлено, что подача зрительных стимулов в восходящую фазу α-волн приводит к развитию “эффекта Бергера”, т.е. супрессии α-ритма. Предъявление стимулов на нисходящей фазе α-волн, напротив, индуцирует незатухающую высокоамплитудную α-активность [27].
Представляется, что экзогенная афферентация, предъявляемая в восходящую фазу α-волны, индуцирует повышение реактивности и лабильности нейронных ансамблей. Таким образом, подача стимула в условиях высокого уровня активированности, т.е. в восходящую фазу α-волны, ассоциируется с феноменом десинхронизации биопотенциалов вследствие падения порога уровня возбудимости.
Противоположный эффект наблюдается при стимуляции, синхронизированной с нисходящей фазой фоновых α-волн, приводящей к повышению в ЭЭГ показателя мощности α-ритма (рис. 2). При этом эффект после такого рода стимуляции является пролонгированным и наблюдается не только на фоне редко (с интервалами 2 с и более) подаваемых зрительных стимулов, но и в течение десятков секунд и одной минуты после прекращения стимуляции (рис. 2). Важно отметить, что подача стимула в нисходящую фазу α-волны примечательна не снижением показателя мощности α-ритма в ответ на зрительный стимул, а ростом в центральных и париетально-окципитальных зонах. Данного рода феномен функционально, скорее всего, отражает статус торможения центральных и париетально-окципитальных областей коры больших полушарий головного мозга человека. Поскольку полагают, что рост показателя мощности, т.е. синхронизация α-ритма, отражает фазу торможения [28], развивающегося в ансамбле нейронов, то это способствует формированию более точной периодичности осцилляторной нейрональной активности. При этом важно заметить, что в момент роста мощности, регистрирующейся как в центральных областях, так и в париетально-окципитальных, когнитивные процессы продолжают осуществляться и регулируются нисходящим потоком информации [5]. Например, концентрация внимания на определенной части поля зрения приводит к подавлению α-ритма в контрлатеральном полушарии коры больших полушарий мозга человека с параллельным увеличением мощности данного ритма в ипсилатеральном полушарии [29]. Согласно данным других авторов, экзальтация α-ритма коррелирует с мнестическими процессами [30]. В частности, установлено, что рост предстимульной α-волны отражает адаптивный механизм временнóго ожидания и антиципации иррелевантного стимула [19] и блокирует процесс обработки дистрактора [18, 29]. Установлено, что индуцированная ключевым стимулом синхронизация α-ритма является электрофизиологическим коррелятом контроля доступа к хранящейся в долговременной памяти информации [31]. Поэтому рост показателя мощности α-частотного диапазона в ответ на предъявление стимула в нисходящую фазу, возможно, свидетельствует о запуске интегративных процессов сличения поступающих стимулов с эталоном долговременной памяти.
Таким образом, фаза эндогенного потенциала α-волны, отражая уровень функциональной лабильности и возбудимости нейронов, обеспечивает временнóе кодирование поступающей информации и является электрофизиологическим коррелятом сканирующего механизма, функционирующего как резонансный фильтр, и расположенного на ранней стадии приема и анализа информации. Так, эффективность сенсомоторной интеграции выше, если экзогенная информация совпадает с максимальной возбудимостью коры, т.е. с восходящим фронтом α-волны [22], когда аналитико-синтетическая деятельность головного мозга направлена на обработку информации, поступающей из внешнего мира. В свою очередь, стимул, сопряженный с нисходящим фронтом α-волны, попадает в состояние торможения процессов восприятия и анализа поступающей экзогенной информации, что определяет более длительный латентный период моторной реакции [22]. При этом важно заметить, подавление процессов анализа внешней афферентации в момент нисходящего фронта α-волны [4], на фоне последующей экзальтации альфа-частотного диапазона, отражает протекание нисходящих процессов обработки информации [31]. Поэтому отдельные фазы эндогенной α–волны отражают неоднозначные по своему функциональному назначению информационные потоки. Восходящая фаза α-волны отвечает за мониторинг изменений поступающей сенсорной информации по сенсорным каналам. Напротив, нисходящая же фаза регламентирует нисходящие потоки обработки информации [31].
Предполагаемая связь ЭЭГ и импульсной активности нейронов. Интересно, что динамика мощности α-ритма, зависимая от фазы предъявления стимула, не находит своего логического объяснения в рамках парадигмы нейросетевой таламокортикальной синаптической организации α-активности, а скорее всего, свидетельствует о его функциональной гетерогенности и пейсмекерном кортикальном происхождении. Так, стимул, приходящийся на восходящую фазу колебаний эндогенного потенциала пейсмекерного нейрона, с учетом времени (30 мс [32]) прохождения импульса от рецептора к корковому представительству, приходится на фазу “открытых” низкопороговых Ca2+ и, в последующем – Na+-каналов плазмолеммы пейсмекерных клеток. Последнее тормозит пейсмекерную активность нейронов, что приводит к “срыву” α-ритма. При этом нейронная сеть, генерирующая α-ритм, разряжается по принципу тонического типа пульсаций нейронов, т.е. функционирует в режиме единичных высокопороговых спайков, развивающихся на фоне относительной деполяризации клеточной мембраны (>–55 мВ) через каждые 12–15 мс [33, 34].
Напротив, стимул, приходящийся на нисходящую фазу колебаний эндогенного потенциала пейсмекерного нейрона, т.е. на фазу “открытых” K+-H-каналов, активирует тем самым Ih–ток – движение катионов K + внутрь клетки [35], что приводит к генерации пачки импульсов, состоящей из низкопороговых спайков, между которыми наблюдаются короткие интерспайковые интервалы (в среднем 2–5 мс) [33]. Поэтому стимул, предъявленный в нисходящую фазу потенциала α-ритма, индуцирует повышение мощности α-ритма в период стимуляции, сохраняющееся пролонгировано в течение одной минуты. Причем соотношение периодов инактивации K+-H-каналов (в среднем 90 мс) у нейронов одного ансамбля создает условия для их синхронизации и формирования индивидуального спектрального пика в α-частотном диапазоне [36]. Таким образом, открытое состояние мембранных H-каналов плазмолеммы нейронов, соответствующее нисходящему фронту α-волны ЭЭГ, осуществляет “тайминг” в пределах некоторого временнóго окна. На это указывает, в частности, то, что пейсмекерное свойство нейрональной мембраны – активность H-каналов обеспечивает как дендритную интеграцию, фасилитацию синаптической трансмиссии, генерацию ритмической активности на уровне той или иной структуры, так и интегративные функции в плоскости целого мозга [37].
ВЫВОДЫ
1. Экспериментально показано, что повторяющаяся фотостимуляция, синхронизированная с восходящей фазой колебаний ЭЭГ в диапазоне частот α-ритма, приводит к снижению показателя мощности α-ритма как во время стимуляции, так и в течение 1 мин после ее завершения.
2. Сенсорная стимуляция, синхронизованная с нисходящей фазой потенциала фонового α-ритма, приводит к увеличению в ЭЭГ показателя мощности α-частот как во время, так и после завершения стимуляции.
3. Выявленные закономерности фазозависимых влияний зрительной стимуляции на пластические перестройки параметров индивидуального α-ритма ЭЭГ человека, по-видимому, обусловлены различным состоянием пейсмекерных потенциал-зависимых каналов корковых нейронов на разных фазах α-волн.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Академии биологии и биотехнологии им. Д.И. Ивановского ЮФУ (Ростов-на-Дону).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта (№ 18-315-00201).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Zrenner C., Belardinelli P., Müller-Dahlhaus F., Ziemann U. Closed-Loop Neuroscience and Non-Invasive Brain Stimulation: A Tale of Two Loops // Front. Cell. Neurosci. 2016. V. 10. № 92. P. 1.
VanRullen R. Perceptual cycles // Trends Cogn. Sci. 2016. V. 20. № 10. P. 723.
Milton A., Pleydell-Pearce C.W. The phase of pre-stimulus alpha oscillations influences the visual perception of stimulus timing // NeuroImage. 2016. № 133. P. 53.
Mathewson K.E., Prudhomme C., Fabiani M. et al. Making waves in the stream of consciousness: entraining oscillations in EEG alpha and fluctuations in visual awareness with rhythmic visual stimulation // J. Cogn. Neurosci. 2012. V. 24. № 12. P. 2321.
Klimesch W., Sauseng P., Hanslmayr S. EEG alpha oscillations: the inhibition timing hypothesis // Brain Res. Rev. 2007. V. 53. № 1. P. 63.
Gho M., Varela F.J. A quantitative assessment of the dependency of the visual temporal frame upon the cortical rhythm // J. Physiol. Paris. 1988. V. 83. № 2. P. 95.
Samaha J., Postle B.R. The speed of alpha-band oscillations predicts the temporal resolution of visual perception // Curr. Biol. 2015. V. 25. № 22. P. 2985.
VanMeij R., Kahana M., Maris E. Phase-amplitude coupling in human electrocorticography is spatially distributed and phase diverse. The J. neuroscience: the official j. // Society for Neuro. 2012. V. 32. № 1. P. 111.
Voytek B., D’Esposito M., Crone N., Knight R.T. A method for event-related phase/amplitude coupling // NeuroImage. 2013. V. 64. P. 416.
Lorincz M.L., Kekesi K.A., Juhasz G. et al. Temporal framing of thalamic relay-mode firing by phasic inhibition during the alpha rhythm // Neuron. 2009. V. 63. № 5. P. 683.
Haegens S., Nacher V., Luna R. et al. α-oscillations in the monkey sensorimotor network influence discrimination performance by rhythmical inhibition of neuronal spiking // Proc. Natl. Acad. Sci. U.S.A. 2011. V. 108. № 48. P. 19377.
Шеповальников А.Н., Цицерошин М.Н., Апанасионок В.С. Формирование биопотенциального поля мозга человека. Ленинград: Наука, 1979. 163 с.
Jaegle A., Ro T. Direct control of visual perception with phase-specific modulation of posterior parietal cortex // J. Cogn. Neurosci. 2014. V. 26. № 2. P. 422.
Rice D.M. Hagstrom E.C. Some evidence in support of a relationship between human auditory signal-detection performance and the phase of the alpha cycle // Percept. Mot. Skills. 1989. V. 69. № 2. P. 451.
Dugue L., Marque P., VanRullen R. The phase of ongoing oscillations mediates the causal relation between brain excitation and visual perception // J. Neurosci. 2011. V. 31. № 33. P. 11889.
Straub A., Henry M., Scharinger M., Obleser J. Alpha phase determines successful lexical decision in noise // J. Neurosci. 2015. V. 35. № 7. P. 3256.
Cravo A.M., Santos K.M., Reyes M.B. et al. Visual causality judgments correlate with the phase of alpha oscillations // J. Cogn. Neurosci. 2015. V. 27. № 10. P. 1887.
Sherman M.T., Kanai R., Seth A.K., VanRullen R. Rhythmic influence of top-down perceptual priors in the phase of pre-stimulus occipital alpha oscillations // J. Cogn. Neurosci. 2016. V. 28 № 9. P. 1318.
Bonnefond M., Jensen O. Alpha oscillations serve to protect working memory maintenance against anticipated distracters // Curr. Biol. V. 22. № 20. P. 1969.
Myers N.E., Stokes M.G., Walther L., Nobre A.C. Oscillatory brain state predicts variability in working memory // J. Neurosci. 2014. V. 34. № 23. P. 7735.
Busch N.A., VanRullen R. Spontaneous EEG oscillations reveal periodic sampling of visual attention // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 37. P. 16 048.
Callaway E.I., Yeager C.L. Relationship between reaction time and electroencephalographic alpha phase // Science. 1960. V. 132. № 3441. P. 1765.
Drewes J., VanRullen R. This is the rhythm of your eyes: the phase of ongoing electroencephalogram oscillations modulates saccadic reaction time // J. Neurosci. 2011. V. 31. № 12. P. 4698.
Пушкин А.А., Лысенко Л.В., Сухов А.Г. и др. Регуляция функционального состояния мозга человека методом частотно-фазовой синхронизации сенсорных стимулов с ритмом ЭЭГ в режиме реального времени // Медицинская техника. 2017. Т. 51. № 1. С. 301.
Scheeringa R., Mazaheri A., Bojak I. et al. Modulation of visually evoked cortical fMRI responses by phase of ongoing occipital alpha oscillations // J. Neurosci. V. 31. № 10. P. 3813.
Elbert T. Slow cortical potentials reflect the regulation of cortical excitability. Slow potential changes in the human brain. Boston: Springer. MA, 1993. P. 235.
Бехтерева Н.П., Зонтов В.В. К вопросу об электрофизиологической характеристике нервных процессов // Физиол. журн. СССР. 1961. Т. 47. № 12. С. 1463.
Jensen O., Bonnefond M., VanRullen R. An oscillatory mechanism for prioritizing salient unattended stimuli // Trends Cogn. Sci. 2012. V. 16. № 4. P. 200.
Foxe J.J., Snyder A.C. The role of alpha-band brain oscillations as a sensory suppression mechanism during selective attention // Front Psychol. 2011. V. 2. № 154. P. 154.
Palva J.M., Monto S., Kulashekhar S., Palva S. Neuronal synchrony reveals working memory networks and predicts individual memory capacity // Proc. Natl. Acad. Sci. USA. 2010. V. 107. № 16. P. 7580.
Klimesch W. Alpha-band oscillations, attention, and controlled access to stored information // Trends Cogn. Sci. 2012. V. 16. № 12. P. 606.
Гусельников В.И. Электрофизиология головного мозга. М.: Высшая школа, 1976. 423 с.
Hughes S.W., Crunelli V. Thalamic mechanisms of EEG alpha rhythms and their pathological implications // Neuroscientist. 2005. V. 11. № 4. P. 357.
Hughes S.W., Magor L.L., Blethyn K. et al. Thalamic gap junctions control local neuronal synchrony and influence macroscopic oscillation amplitude during EEG alpha rhythms // Front. Psychol. 2011. № 2. P. 1.
Lopes da Silva F.H. Neurocognitive processes and the EEG/MEG. Niedermeyer’s Electroencephalography: Basic principles, clinical applications, and related fields. Philadelphia: Lippincott Williams & Wilkins, 2011. P. 1083.
Luthi A., McCormick D. H-Current: Properties of a Neuronal and Network Pacemaker // Neuron. 1998. V. 21. № 1. P. 9.
Biel M., Wahl-Schott C., Michalakis S., Zong X. Hyperpolarization-Activated Cation Channels: From Genes to Function // Physiol Rev. 2009. V. 89. № 3. P. 847.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


