Физиология человека, 2020, T. 46, № 3, стр. 64-70
Поиск ранних предикторов нарушений формирования высших психических функций и речи: нейрофизиологические аспекты
Н. Ю. Кожушко 1, *, **, С. А. Евдокимов 1
1 ФГБУН Институт мозга человека имени Н.П. Бехтеревой РАН
Санкт-Петербург, Россия
* E-mail: kozhushko@ihb.spb.ru
** E-mail: kozhushko56@list.ru
Поступила в редакцию 28.08.2019
После доработки 10.12.2019
Принята к публикации 03.02.2020
Аннотация
Обобщены итоги нейрофизиологических исследований у детей с отставанием в развитии высших психических функций и речи перинатального генеза. Выделены гипотетические источники медленной активности в лобно-височных отделах коры обоих полушарий. Показано повышение мощности компонент медленноволновой активности в соответствии со степенью тяжести отставания в развитии. Получены новые данные о локальных и распределенных источниках ритмов ЭЭГ как возможных нейромаркерах отставания в психоречевом развитии на ранних этапах онтогенеза с высокими значениями верных классификаций обследованных детей на основе их использования.
Изучение мозговых механизмов психической деятельности в немалой степени определяется возможностями естественного психологического эксперимента, инструментарием современной медицины (диагностическим и лечебным), имеющимся математическим аппаратом обработки данных. Основы современной нейропсихологии в значительной степени были заложены в нейрохирургической клинике у взрослых пациентов, реже – у детей [1–5]. В детской нейропсихологии активно внедряется коррекционно-развивающее направление при недостаточной сформированности высших психических функций (ВПФ) и речи у детей вследствие незрелости/дисфункции мозговых систем их обеспечения [6, 7]. Использование широкого спектра электрических воздействий на мозг в свое время послужило мощным толчком к интенсификации работ по лечению, реабилитации утраченных психических функций, стимулированию компенсаторных резервов [8–11].
В наших работах при использовании левополушарных транскраниальных микрополяризаций (ТКМП) у детей с отставанием в психоречевом развитии [12–15] показан достоверный прирост уровня α-активности в возрастном фокусе (теменно-затылочных отделах коры), а также значимое снижение медленной активности в лобно-височных областях левой гемисферы при позитивных изменениях в развитии. При повторных курсах ТКМП выявлено повышение средней частоты α-активности при закрытых глазах в возрастном теменно-затылочном фокусе до 9–10 Гц, а также рост ее спектральной мощности с появлением акцента и в отделах нестимулируемого (правого) полушария. Обнаружено также снижение спектральной мощности в β-диапазоне в правой задневисочной области коры при открытых и закрытых глазах. Таким образом, при положительной динамике развития детей после ТКМП можно говорить как о локальных позитивных изменениях в ЭЭГ, так и о системных эффектах в отношении нейрофизиологических параметров.
Сложившаяся система амбулаторного скрининга здоровья младенцев такова, что к концу первого года жизни при уменьшении/исчезновении патологической неврологической симптоматики ребенка снимают с учета, но он может появиться в зоне внимания специалистов ближе к 3-м годам с формулировкой “отдаленные последствия перинатального поражения ЦНС”. К данному возрасту становится заметным целый ряд проблем: слабая реакция на обращенную речь, отсутствие собственной речи, полевое поведение, слабая подражательная деятельность, несформированность навыков самообслуживания, указательного жеста и др. Зона 2–3-летнего возраста со скрытыми факторами “отдаленных” рисков нередко оказывается “белым пятном” как для неврологов, так и для нейрофизиологов.
Цель данного исследования – поиск особенностей биоэлектрической активности головного мозга, которые могут служить нейрофизиологическими предикторами отставания в развитии ВПФ и речи у детей на более ранних этапах онтогенеза на основе использования метода анализа независимых компонент ЭЭГ.
МЕТОДИКА
В обследовании участвовали дети с темповыми задержками речевого развития, моторной алалией, общим недоразвитием речи, эмоционально-волевой незрелостью, нарушениями формирования функций внимания, мышления, коммуникативных функций и т.п. ЭЭГ-исследования состояли из двух этапов в зависимости от возраста детей. В группы не включали детей с эпилепсией, церебральным параличом (ДЦП), и пациентов, принимающих длительное время психотропные средства.
На первом этапе были отобраны дети с выраженным отставанием в психическом развитии старшего возраста – от 4 до 9 лет. Основанием для этого были ранее выявленные нами достоверные различия независимых компонент ЭЭГ в группах детей с более тяжелыми формами нарушений в психоречевом развитии, в частности, с расстройствами аутистического спектра (РАС) [14]. В контрольную группу (№ 1) вошли 70 детей с перинатальной энцефалопатией в анамнезе, но без отставания в развитии (44 мальчика, средний возраст 6.4 лет, Standard Deviation (SD = 1.4)). Во 2 группу вошло 42 ребенка с РАС (36 мальчиков, средний возраст 5.9 лет, SD = 1.7). Всего на данном этапе обследовано 112 детей (средний возраст 6.4 лет, SD = 1.6). После психолого-логопедического тестирования были выделены еще две подгруппы с РАС в зависимости от выраженности отставания в развитии (тяжелые и легкие формы). На каждом этапе исследований при проведении сравнительного анализа указанные группы детей были выравнены по возрастному составу по U-критерию Манна-Уитни.
На 2-м этапе были проанализированы данные исследований детей младшего возраста – от 1 годa до 4 лет, всего 147 детей. Аналогично первому этапу в группу № 1 (контрольную) вошли дети без отставания в развитии – 26 детей (12 мальчиков, средний возраст 3.5 лет, SD = 0.56). Вторая группа – 20 детей с более тяжелым отставанием в развитии (группа 2Т), в том числе с РАС (11 мальчиков, средний возраст 3.2 лет, SD = 0.95). Для оценки специфичности нейромаркеров при определении степени отставания в развитии проводили пошаговый дискриминантный анализ с включением. Для этого была выделена еще группа со средней тяжестью нарушений развития (2С) – 30 детей (23 мальчика, средний возраст 3.4 лет, SD = 0.73), и группа с лeгкими нарушениями (2Л) – 71 ребенок (48 мальчиков, средний возраст 3.3 года, SD = = 0.81). Оценивали спектральные характеристики ранее выделенных компонент ЭЭГ по отношению к контрольной группе [12]. Анализ проводили в диапазонах медленных частот (2–7 Гц) и в α-диапазоне (7–11 Гц).
Запись ЭЭГ производили в покое в течение 2–4 мин. Расположение хлорсеребряных электродов по международной схеме “10–20”. Регистрацию ЭЭГ производили в 19 отведениях с помощью компьютерного энцефалографа (ООО “Мицар”, WinEEG, Россия). Сопротивление ЭЭГ-электродов не превышало 5 кОм. Запись монополярная по отношению к правому и левому ушному хлорсеребряным электродам (использовали объединенный референт/общий усредненный референт). Параметры фильтров верхних (ФВЧ) и нижних (ФНЧ) частот составляли соответственно 0.5 и 45 Гц. Коррекцию артефактов глазных движений осуществляли методом фильтрации главных компонент, соответствующих этим движениям с акцентом в лобных отведениях Fp1, Fp2 [16]. Применение метода главных компонент обусловлено небольшой длительностью безартефактной ЭЭГ у детей [17]. При анализе исключали также фрагменты ЭЭГ, содержащие высокоамплитудные артефакты быстрых колебаний частотой от 20 до 35 Гц амплитудой более 40 мкВ, медленных колебаний частотой от 0 до 1 Гц более 50 мкВ, а также производили удаление скачков потенциала больше 120 мкВ.
Выделение спектральных компонент проводили методами слепого разделения источников (ICA). Для выделения компонент спектров ЭЭГ использовали метод Infomax, описанный S. Makeig в EEGLab [18]. Для определения локализации предполагаемых источников независимых компонент ЭЭГ использовали метод томографии низкого разрешения sLORETA [19]. Данный метод позволяет по топографии компоненты определить ее гипотетические источники и поля Бродмана, в которых они предположительно находятся. По данным о локализации все компоненты были ассоциированы с отведениями ЭЭГ по международной схеме “10–20” .
На первом этапе проводили сравнительный анализ спектров мощности по основным диапазонам ЭЭГ: θ (4–8 Гц), α (8–13 Гц), β (13–20 Гц). Параметры вычисления спектров: стандартная эпоха анализа – 4 с, полуперекрывание эпох 50%, временное окно Хеннинга. Величину средней мощностти логарифмировали для нормализации распределения с целью сглаживания изменений возрастного характера. Также различия спектральной мощности в указанных диапазонах оценивали по эффекту Кохена (значимый порог d > 0.6).
При разложении методом ICA на компоненты использовали ЭЭГ в состоянии спокойного бодрствования с открытыми глазами. При этом производили предварительную фильтрацию от 0.5 до 35 Гц. Использовали фильтры высокого порядка – 894. Параметры вычисления спектров: стандартная эпоха анализа – 2 с, полуперекрывание эпох 50%, временное окно Хеннинга. Среднюю мощность логарифмировали для нормализации распределения. Также для оценки их различий использовали многомерный дисперсионный анализ (MANOVA).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
В группе детей с РАС старшего возраста с более выраженным отставанием в развитии были выявлены достоверные отличия в θ-диапазоне ЭЭГ по сравнению с контрольной группой в целом ряде областей (табл. 1). Компоненты были локализованы как в правом, так и в левом полушариях: в лобно-височных областях (компоненты ICF4, ICF8, ICF3), в теменных и задне-височных отделах (компоненты ICP3, ICPz, ICT6), а также в затылочных зонах коры (компоненты ICO1, ICO2). При более легких формах РАС независимые источники в θ-диапазоне выявлены только в компоненте ICF3. После использования поправки Бонферрони значимые различия остались только по двум компонентам в правом полушарии – ICF4 и ICT6, в левом – в компоненте ICF3.
Таблица 1.
Сравнительный анализ мощности спектральных компонент ЭЭГ у детей с РАС (легкие и тяжелые формы) и контрольной группы в состоянии бодрствования с открытыми глазами
| Группы сравнения РАС с контрольной группой | Статистические различия | Компоненты (IC) /области: θ-диапазон ЭЭГ (4–8 Гц) | |||||||
|---|---|---|---|---|---|---|---|---|---|
| ICF3 | ICF4 | ICF8 | ICP3 | ICPz | ICT6 | ICO1 | ICO2 | ||
| Тяжелые формы | F[1,93]=, | 20.31 | 10.36 | 14.38 | 7.89 | 9.96 | 17.71 | 9.37 | 8.18 |
| p < | 0.00002 | 0.002 | 0.0003 | 0.006 | 0.002 | 0.0001 | 0.003 | 0.005 | |
| Размер эффекта Кохена, d | 1.09 | 0.79 | 0.80 | 0.69 | 0.79 | 1.08 | 0.74 | 0.72 | |
| Легкие формы | F[1,87]=, | 12.29 | |||||||
| p < | 0.0007 | ||||||||
| Кохен, d | 0.92 | ||||||||
| Группы сравнения РАС с контрольной группой |
Статистические различия | Компоненты (IC) – β-диапазон (13–30 Гц) | |||||||
| ICF3 | ICF4 | ICF8 | ICP3 | ICPz | ICT6 | ICO1 | ICO2 | ||
| Тяжелые формы | F[1,93]=, | 16.9 | 7.4 | 8.7 | 12.4 | 7.3 | |||
| p < | 0.0001 | 0.007 | 0.004 | 0.0007 | 0.008 | ||||
| Кохен, d | 0.95 | 0.63 | 1.35 | 0.95 | 0.70 | ||||
| Легкие формы | F[1,87]=, | 11.0 | 10.1 | ||||||
| p < | 0.002 | 0.002 | |||||||
| Кохен, d | 0.84 | 0.88 | |||||||
В α-диапазоне (глаза открыты) значимые отличия по t-критерию Стьюдента не обнаружены. В β-диапазоне у детей старшей группы достоверные отличия от контроля также чаще выявлялись при более тяжелых формах отставания в развитии. Однако общее число локальных источников было меньше, чем в медленном диапазоне. В частности, справа остались компоненты ICF8, ICT6, ICO2 (но различия были уже без поправки Бонферрони), слева компонента ICF3 (осталась и с поправкой), а также компонента ICPz. У детей с легкими формами РАС, в отличие от θ-диапазона, выделен еще локальный β-источник (компонента ICO2). Он был значим по размеру эффекта Кохена, но статистически не значим по t-критерию Стьюдента.
Следует обратить внимание на то, что у отстающих детей старшего возраста для компоненты ICF3 были обнаружены существенные отличия от контрольной группы в обоих анализируемых диапазонах ЭЭГ и при разной степени выраженности РАС (с большей достоверностью при тяжелых формах) (табл. 1). В связи с широким распределением по многим областям коры данная компонента была обозначена как “глобальная”.
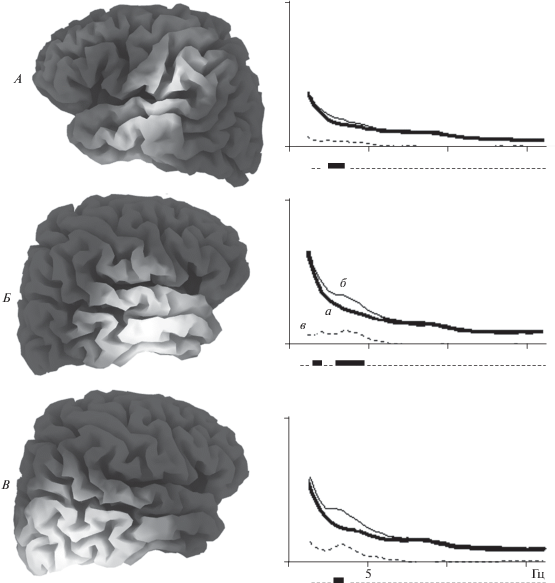
Анализ спектральных компонент на 2 этапе исследований у детей младшего возраста в бодрствовании с открытыми глазами выявил достоверные различия спектральной мощности медленной активности в диапазоне 2–7 Гц (т.е. с расширением в сторону более низких частот). Как и у отстающих детей старшего возраста, у детей младшего возраста с нарушениями развития медленная активность была достоверно выше по сравнению с контрольной группой. В младшем возрасте совпадает и часть локальных источников: слева компонента ICF3 (с широким распределением, предположительно с центром в нижне-лобной извилине, поле 44 Бродмана по sLORETA – рис. 1, А), справа – компонента ICТ6 (задневисочно – затылочная область, предположительно с центром в поле 37 Бродмана по sLORETA – рис. 1, В). В младшем возрасте был обнаружен еще один локальный источник – компонента ICT4 (височная область, предположительно с центром в поле 21 Бродмана по sLORETA – рис. 1, Б). Как видно из рисунка, в правом полушарии различия более выражены.
Рис. 1.
Достоверные межгрупповые различия спектральной мощности компонент ЭЭГ в состоянии спокойного бодрствования у детей младшего возраста (глаза открыты). По оси абсцисс – анализируемые частоты ЭЭГ (Гц); по оси ординат – значения спектров мощности. а – группа 1 (контроль), б – группа 2Т, в – межгрупповая разница (под графиками жирно отмечены области достоверных различий при р < 0.05). Слева от каждого графика на модели мозга отмечена предполагаемая локализация источников компонент ЭЭГ по sLORETA: А – компонента ICF3 (с широким распределением, предположительно с центром в нижне-лобной извилине, поле 44 Бродмана), Б – компонента ICT4 (височная область, предположительно с центром в поле 21 Бродмана); В – компонента ICТ6 (задневисочно–затылочная область, предположительно с центром в поле 37 Бродмана).
Пошаговый дискриминантный анализ у всех обследованных детей обнаружил возможность верных классификаций на уровне 85% для группы детей с тяжелыми задержками в развитии (группа 2Т) по отношению к контрольной группе. Анализ MANOVA подтвердил различия для 7 компонент в θ-диапазоне – ICF3, ICС3, ICP3, ICСz, ICT4, ICT6 и для α-диапазона – ICT6, F[7.38] = = 3.70 p < 0.004; Wilks’ Lambda = 0.59. Для детей со средней степенью выраженности отставания в развитии (группа 2С) число верных классификаций составило 91%; использованы все компоненты в θ-диапазоне – ICFp2, ICC3, ICT4, ICT5, ICP3, ICPz, ICT6 и в α-диапазоне – ICF3, ICF4, ICT3, ICC3, ICC4, ICP3, ICT6; MANOVA F[14.41] = 5.00 p < 0.00002; Wilks’ Lambda = 0.37. Для детей с легкими задержками развития (группа 2Л) верных классификаций было 85%, использованные компоненты в θ-диапазоне – ICCz и в α-диапазоне – ICF4, ICC4, ICPz, ICP4; MANOVA F[5.46] = 5.07 p < 0.0009; Wilks’ Lambda = 0.65. Таким образом, дискриминантный анализ показал возможность верных классификаций не менее 85% для всех вышеуказанных групп.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В течение 20 лет мы обследуем детей с последствиями перинатального поражения ЦНС на разных этапах диагностики и лечения. Несмотря на все многообразие проявлений отклоняющегося онтогенеза, имеются и некоторые общие нейрофизиологические закономерности.
Использование современных методов анализа ЭЭГ чаще выявляет преобладание источников медленных ритмов, заметно реже выделяются достоверные изменения быстрых форм активности [12–15, 20, 21]. Поскольку мы имеем дело с недостаточно сформированной для возраста функцией (незрелой), возможно, на уровне нейрофизиологических механизмов это имеет вид “замедления” ритмов мозга, в то время как изменения структур мозга на МРТ при этом обнаруживаются нечасто. Нами было показано более широкое распределение источников медленной активности при наиболее тяжелых формах отставания в развитии: они выделены в лобно-височных и теменно-затылочных отделах [12]. Возможно, это один из нейрофизиологических механизмов, лежащий в основе тотального недоразвития психических функций при умственной отсталости, когда “ускорение” корковой ритмики и психических процессов в ходе онтогенеза недостаточно для того, чтобы догнать нормально развивающихся сверстников.
Если перейти к особенностям межполушарных отношений, необходимо отметить следующее. Спектральные пики в виде “замедления” на частотах 5–6 Гц были выделены нами ранее в лобно-височных отделах левого полушария у детей с тяжелыми формами отставания (компоненты ICFp1, ICF3, ICT3) [12]. В данной работе при сравнении разных возрастных групп выделена также “глобальная” (широко распределенная) компонента с максимумом вблизи моторных центров речи (компонента ICF3, вблизи зоны Брока слева), причем в старшем возрасте – и в β-, и в θ-диапазонах, и также при разной тяжести отставания. Данная компонента может быть использована в качестве нейромаркера в отношении различных форм отставания в развитии на разных стадиях онтогенеза. В литературе была описана патологическая активность в ЭЭГ лобных и центральных отделов коры в системе “зеркальных” нейронов при аутизме, особенно в области Брока [22].
В наших исследованиях при анализе ЭЭГ детей старшего возраста с РАС тяжелых форм обнаружено некоторое преобладание источников в правом полушарии для быстрых форм активности (13–30 Гц). Повышение β-активности (20–30 Гц) в лобно-центральных отделах с акцентом в правом полушарии описано у пациентов с аутизмом в широком возрастном диапазоне (3–26 лет) [21]. Правополушарные акценты изменений деятельности мозга у взрослых пациентов (по данным ВП при шизофрении) описаны и в работах других авторов [23, 24].
У отстающих детей самого младшего возраста с аутичными чертами (1–4 года) правополушарный акцент выделен нами только по медленным частотам не выше 5 Гц. У старших и младших детей источники медленной активности в пределах правого полушария совпали в височной области (компоненты ICT4 и ICT6). Вероятно, наличие источников медленной активности в правой височной области в раннем возрасте может рассматриваться как предиктор отставания в развитии с наличием рисков аутизации. Клиницистам хорошо знакомы истории “ухода” в себя и регресса речи у нормально развивающихся детей после болезни, прививок и т.п. [21]. Нарушение процессов отражения внешних событий в мозгу ребенка (в системе “зеркальных” нейронов) влекут за собой цепочку отклонений в формировании подражательной деятельности, адекватных социальных реакций при адаптации, правильного распознавания эмоций других людей, т.е. проблемы развития “социального” мозга [25].
Если сравнивать распределение источников в пределах одного полушария, у детей с более тяжелыми формами отставания в левой гемисфере прослеживается тенденция к преобладанию источников в передних (лобно-височных) отделах, а в правой – в направлении кзади: в теменно-височных и затылочных отделах. Филогенетически более молодые структуры, к которым относится и левая лобно-височная область, считаются наиболее уязвимыми при нарушениях раннего онтогенеза [6]. В исследованиях у детей показана важная роль фронто-таламической системы в реализации сложных форм психической деятельности, регуляции уровня бодрствования [26].
Поражение теменно-затылочных областей и межанализаторной височно-теменно-затылочной подобласти (TPO) у взрослых приводило к семантической афазии с нарушением понимания сложных речевых конструкций при сохранении понимания смысла отдельных слов [3]. В наших исследованиях у детей с РАС, имеющих нарушения многих психических функций, самыми низкими были показатели понимания речи и выполнения речевых инструкций, а также внимания [14]. У детей младшего возраста (до 3-х лет) в зоне ТРО обнаружено интенсивное увеличение толщины коры в сочетании с аналогичными процессами в полях зрительной коры и префронтальной глазодвигательной зоны, связанных с формированием зрительного восприятия и манипулятивной деятельности [27].
Локальные источники активности ЭЭГ были выделены также в нижне-теменных и затылочных отделах обоих полушарий (ICP3, ICP4, ICPz, ICO1, ICP2). Известно, что задне-ассоциативная зона (поле 37) имеет существенное значение в восприятии и узнавании сложных зрительных образов, исполняя наряду с нижне-теменными отделами роль высшего интегрирующего звена в анализе зрительной информации [28]. Правую затылочную область связывают с механизмами зрительного опознания реальных и символических объектов [24], процессами идентификации эмоционального состояния другого человека. На ранних схемах мозга в затылочную область даже помещали зону “душевной слепоты”.
Довольно сложно определить, связаны ли механизмы вышеописанных феноменов с дисфункцией, дисбалансом межполушарных отношений, либо с дефицитарностью, недостаточной сформированностью одного из полушарий. Особую роль левого полушария в механизмах многих психических процессов, имеющих речевую основу, подчеркивают многие авторы, указывая при этом на важность межполушарного взаимодействия для оптимальной работы мозга [2–6, 10, 29–31]. Акцент на роли правого полушария в младшем возрасте делают другие авторы [1, 32–36]. Столь мозаичная картина указывает на то, что вовлеченность большого количества областей мозга соответствует сложности процессов формирования ВПФ и речи в онтогенезе даже при аномальном сценарии.
При известных ограничениях внедрения теоретических изысканий нейрофизиологов в клиническую практику необходимо отметить, что дискриминантный анализ демонстрирует возможность верных классификаций у детей с разными формами нарушений психического развития с использованием выделенных нами нейромаркеров на высоком уровне (85–91%). Исследования ЭЭГ у детей с ранним детским аутизмом еще в 1992 г. [20] продемонстрировали высокие возможности (более 80%) использования специального “ЭЭГ-синдрома” для определенных нозологических форм.
ЗАКЛЮЧЕНИЕ
Методом анализа независимых компонент ЭЭГ у детей при более тяжелых формах отставания выявлено повышение числа источников медленной активности. В пределах правого полушария общие источники медленной активности у старших и младших детей обнаружены в височной области (компоненты ICT4 и ICT6). Наличие источника медленной активности в правой височной области в раннем возрасте может быть интерпретировано как предиктор риска отставания в психоречевом развитии. Кроме того, в обеих возрастных группах выделена также “глобальная” компонента с широким распределением в левом полушарии вблизи моторных центров речи (ICF3), причем в старшем возрасте – в разных диапазонах (β и θ) и при разной тяжести отставания. Это позволяет предполагать роль данной компоненты как нейромаркера психоречевых нарушений в аномальном онтогенезe, независимо от их формы. Дискриминантный анализ показал возможность верных классификаций с использованием выделенных нейромаркеров на высоком уровне (85–91%).
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института мозга человека им. Н.П. Бехтеревой РАН (Санкт-Петербург).
Информированное согласие. Родители каждого участника исследования представили добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Симерницкая Э.Г. Мозг человека и психические процессы в онтогенезе. М.: Изд-во МГУ, 1985. 351 с.
Цветкова Л.С. Методика нейропсихологической диагностики детей. М.: Педагогическое общество России, 2000. 126 с.
Лурия А.Р. Высшие корковые функции человека. СПб.: “Питер”, 2008. 368 с.
Доброхотова Т.А. Нейропсихиатрия. М.: БИНОМ, 2013. Изд. 2. 304 с.
Храковская М.Г. Афазия. Агнозия. Апраксия. Методики восстановления. СПб.: Нестор-История, 2017. 312 с.
Семенович А.В. Нейропсихологическая коррекция в детском возрасте. М.: “Генезис”, 2017. 474 с.
Нарушения письма и чтения у детей: изучение и коррекция. Под ред. Величенковой О.А. М.: “Логомаг”, 2018. 372 с.
Электрическая стимуляция мозга и нервов у человека. Под ред. Бехтеревой Н.П. Л.: “Наука”, 1990. 263 с.
Пинчук Д.Ю. Транскраниальные микрополяризации головного мозга: клиника, физиология. СПб.: “Человек”, 2007. 496 с.
Penfield W. Mystery of the Mind. USA, New Jersev: Princeton University Press, 2015. 158 p.
Илюхина В.А. Научные предвидения в познании принципов жизнедеятельности мозга человека, их развитие и реализация. СПб.: Информ – Навигатор, 2018. 336 с.
Кожушко Н.Ю., Евдокимов С.А., Матвеев Ю.К. и др. Исследование локальных особенностей ЭЭГ у детей с нарушениями психического развития методом независимых компонент // Физиология человека. 2014. Т. 40. № 5. С. 30. Kozhushko N.Yu., Evdokimov S.A., Matveev Yu.K. et al. Study of Local EEG Specificities in Children with Mental Development Disorders Using Independent Component Analysis // Human Physiology. 2014. V. 40. № 5. P. 497.
Кожушко Н.Ю., Евдокимов С.А., Матвеев Ю.К. Нейрофизиологические маркеры возрастной динамики нарушенного психического развития у детей // Физиология человека. 2018. Т. 44. № 2. С. 99. Kozhushko N.Ju., Evdokimov S.A., Matveev Yu.K. Neurophysiological Markers of Abnormal Development in Children with Mental Disorders // Human Physiology. 2018. V. 44. № 2. P. 202.
Kozhushko N.Ju., Nagornova Zh.V., Evdokimov S.A. et al. Specificity of spontaneous EEG associated with different levels of cognitive and communicative dysfunctions in children // Int. J. Psychophysiol. 2018. V. 128. P. 22.
Кожушко Н.Ю., Евдокимов С.А. Особенности возрастной динамики ЭЭГ под влиянием транскраниальных микрополяризаций // Физиология человека. 2019. Т. 45. № 4. С. 23. Kozhushko N.Yu., Evdokimov S.A. Age-Related Changes in EEG Formation during Transcranial Direct Current Stimulation // Human Physiology. 2019. V. 45. № 4. P. 364.
Ille N., Berg P., Scherg M. Artifact correction of ongoing EEG using spatial filters based on artifact and brain signal topographies // J. Clin. Neurophysiol. 2002. V. 19. № 2. P. 113.
Терещенко Е.П., Пономарев В.А., Кропотов Ю.Д., Мюллер А. Сравнение эффективности различных методов удаления артефактов морганий при анализе количественной электроэнцефалограммы и вызванных потенциалов // Физиология человека. 2009. Т. 35. № 2. С. 124. Tereshchenko E.P., Ponomarev V.A., Kropotov Yu.D., Müller A. Comparative efficiencies of different methods for removing blink artifacts in analyzing quantitative electroencephalogram and event-related potentials // Human Physiology. 2009. V. 35. № 2. P. 241.
Makeig S., Bell A.J., Jung T.P. et al. Independent component analysis of electroencephalographic data / Adv. in Neural Information Processing Systems. MIT Press, Cambridge. MA, 1996. V. 8. P. 145.
Pascual-Marqui R.D. Standardized low resolution brain electromagnetic tomography (sLORETA): technical details // Methods Find. Exp. Clin. Pharmacol. 2002. V. 24. Suppl D. P. 5.
Горбачевская Н.Л., Якупова Л.П., Кожушко Л.Ф. и др. Топографическое ЭЭГ – картирование в детской психиатрии // Физиология человека. 1992. Т. 18. № 6. С. 40. Gorbachevskaya N.L., Yakupova L.P., Kozhushko L.F. et al. [Topographic EEG-mapping in children’s psychiatry] // Fiziol. Cheloveka. 1992. V. 18. № 6. P. 40.
Горбачевская Н.Л., Мамохина У.А., Вершинина Н.В. и др. Особенности спектральных характеристик ЭЭГ у лиц с расстройствами аутистического спектра // Психиатрия. 2018. Т. 78. № 2. С. 48.
Yasuhara A. Correlation between EEG abnormalities and symptoms of autism spectrum disorder (ASD) // Brain and Development. 2010. V. 32. № 10. P. 791.
Евдокимов С.А., Пронина М.В., Полякова Г.Ю. и др. Анализ независимых компонент вызванных потенциалов пациентов с установленными диагнозами шизофрения, обсессивно-компульсивное и депрессивное расстройство // Журн. высш. нерв. деят. им. И.П. Павлова. 2014. Т. 64. № 5. С. 500. Evdokimov S.A., Pronina M.V., Polyakova G.Y. et al. [Analysis of Independent Components for event-related potentials from patients with an established diagnosis of schizophrenia, obsessive-compulsive and depressive disorders] // Zhurnal Vysshei Nervnoi Deyatelnosti Imeni I.P. Pavlova. 2014. V. 64. № 5. P. 500.
Кропотов Ю.Д., Пронина М.В., Поляков Ю.И., Пономарев В.А. Функциональные биомаркеры в диагностике психических заболеваний: когнитивные вызванные потенциалы // Физиология человека. 2013. Т. 39. № 1. С. 14. Kropotov J.D., Pronina M.V., Polya-kov J.I., Ponomarev V.A. Functional biomarkers in the diagnostics of mental disorders: cognitive event-related potentials // Human Physiology. 2013. V. 39. № 1. P. 8.
Рамачандран В. Мозг рассказывает. Что делает нас людьми. М.: “Карьера пресс”, 2012. 422 с.
Мозговые механизмы формирования познавательной деятельности в предшкольном и младшем школьном возрасте / Под ред. Мачинской Р.И., Фарбер Д.А. Воронеж: МОДЭК, 2014. 440 с.
Цехмистренко Т.А., Васильева В.А., Шумейко Н.С. Структурные преобразования коры большого мозга у детей и подростков // Физиология человека. 2017. Т. 43. № 2. С. 5. Tsekhmistrenko T.A., Vasilyeva V.A., Shumei-ko N.S. Structural rearrangements of the cerebral cortex in children and adolescents // Human Physiology. 2017. Т. 43. № 2. P. 123.
Глезер В.Д. Зрение и мышление. Л.: “Наука”, 1985. 246 с.
Бехтерева Н.П. Магия мозга и лабиринты жизни. М.: АСТ. СПб.: “Сова”, 2007. 349 с.
Павлова Л.П. Доминанты деятельного мозга человека. СПб.: Информ-Навигатор, 2017. 430 с.
Ньюкиктьен Ч. Детская поведенческая неврология. М.: “Теревинф”, 2018. Т. 2. 336 с.
Nuss R., Peterson H., Koch D. Differential effects on congenital left and right brain injury on intelligence // Brain Cogn. 1989. V. 9. № 2. P. 258.
Сергиенко Е.А., Дозорцева А.В. Функциональная асимметрия полушарий мозга // Функциональная межполушарная асимметрия. М.: “Научный мир”, 2004. С. 218.
Цветкова Л.С., Цветков А.В. Речь и правое полушарие головного мозга: афазия vs аномия // Теория и практика общественного развития. 2014. № 13. С. 70.
Gainotti G. Lower – and higher – level models of right hemisphere language. A selective survey // Funct. Neurol. 2016. V. 31. № 2. P. 67.
Skeide M.A., Friederici A.D. The ontogeny of the cortical language network // Nat. Rev. Neurosci. 2016. V. 17. № 5. P. 323.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


