Физиология человека, 2020, T. 46, № 4, стр. 88-97
Исследование белкового профиля плазмы в сопоставлении с биохимическими параметрами крови добровольцев в 21-суточной антиортостатической гипокинезии
Д. Н. Каширина 1, *, Л. Х. Пастушкова 1, А. Г. Бржозовский 1, А. Г. Гончарова 1, А. М. Носовский 1, М.-А. Кусто 2, Н. М. Новоселова 2, А. С. Кононихин 1, 3, Е. Н. Николаев 3, 4, И. М. Ларина 1
1 ФГБУН ГНЦ РФ – Институт медико-биологических проблем РАН
Москва, Россия
2 Университет Анже
Анже, Франция
3 Институт биохимической физики имени Н.М. Эмануэля РАН
Москва, Россия
4 Сколковский институт науки и технологий
Московская обл., Сколково, Россия
* E-mail: daryakudryavtseva@mail.ru
Поступила в редакцию 21.01.2020
После доработки 10.03.2020
Принята к публикации 20.03.2020
Аннотация
Исследование изменений протеома внеклеточных жидкостей тела в условиях моделированной невесомости средней продолжительности (21 сут) остается актуальным для уточнения физиологических механизмов регуляции гомеостаза и имеет важное значение для гравитационной физиологии и медицины. С помощью методов полуколичественной протеомики на основе масс-спектрометрии были исследованы образцы плазмы 8 здоровых добровольцев, участвующих в эксперименте с антиортостатической гипокинезией (АНОГ –6°). Каждый испытуемый участвовал как в контрольной сессии, так и в сессии с физическими тренировками в качестве профилактической меры предотвращения негативных сдвигов. К концу АНОГ в обеих сессиях выявлено достоверное изменение концентрации белков, участвующих в процессах дегрануляции тромбоцитов, коагуляции крови, фибринолизе, регуляции протеолиза, активации комплемента и иммунного ответа. Показано изменение биохимических параметров углеводного обмена и регуляции объема циркулирующей крови (достоверное увеличение концентрации ренина и тенденция к увеличению альдостерона; достоверное повышение концентрации инсулина натощак и тенденция к увеличению индекса инсулинорезистентности). Физические тренировки не оказали существенного влияния на биохимические параметры, лишь изменялась представленность фракций холестерина, а именно, достоверное снижение концентрации холестерина липопротеинов высокой плотности, наблюдавшееся в АНОГ, становилось недостоверным. Однако белковый состав плазмы крови добровольцев в эксперименте с применением мер профилактики изменялся меньше по сравнению с АНОГ. Физические тренировки способствовали повышению концентрации белков, участвующих в нормализации углеводного и липидного обменов: белка, стимулирующего макрофаги, и фосфатидилинозитолгликан-специфической фосфолипазы D, что указывает на эффективность профилактических мер.
Антиортостатическая гипокинезия (АНОГ) является одной из моделей, воспроизводящей физиологические эффекты невесомости у человека.
Она приводит к перераспределению жидких сред организма в краниальном направлении, что вызывает взаимообусловленные адаптационные механизмы, в частности, сердечно-сосудистой, эндокринной, центральной и периферической нервных систем [1–4]. Неблагоприятное воздействие АНОГ на сердечно-сосудистую систему (ССС) реализуется на фоне уменьшения объема циркулирующей плазмы, перераспределении вазоконстрикторных и прессорных влияний в сосудах различных регионов тела [5]. Профилактические мероприятия, такие, как использованный в 60-дневной АНОГ комплекс физических упражнений с сопротивлением вибрации (RVE), хотя и ограничивают снижение спонтанной чувствительности к барорефлексу, вызванное 60-дневной АНОГ, но оказывают лишь незначительное влияние на сердечную гемодинамику и не позволяют эффективно предотвратить ортостатическую неустойчивость в периоде реабилитации после эксперимента. При этом показано, что эти меры способны купировать изменения вегетативной нервной системы, связанные с дезадаптацией сердечно-сосудистой системы [6]. В данном эксперименте (21 сут АНОГ) другими исследователями было отмечено снижение массы (LVmass) и диастолического объема (LVDV) левого желудочка, в то время как с помощью RVE удалось сохранить массу и диастолический объем левого желудочка, и сократительную способность сердца во время АНОГ, доказав тем самым эффективность контрмер для ССС в данном случае [7].
Известно, что углеводный обмен при АНОГ также претерпевает изменения: увеличивается секреция инсулина и происходит нарушение толерантности к глюкозе [8]. Развивающаяся инсулинорезистентность может стать причиной эндотелиальной дисфункции, которая не позволяет сосудам эффективно функционировать и опасна развитием сердечно-сосудистых заболеваний. Поэтому своевременное предупреждение инсулинорезистентности, дисфункции эндотелия и поиск средств и методов восстановления функций сосудов остаются наиболее перспективными направлениями в предупреждении и лечении сердечно-сосудистых заболеваний.
В данной работе для прояснения молекулярных механизмов изменений, происходящих во время 21-суточной АНОГ, а также для выявления процессов, включающихся в процесс адаптации организма при применении контрмер, был исследован белковый состав плазмы крови добровольцев методами протеомики, в сопоставлении с биохимическими параметры плазмы.
МЕТОДИКА
Исследованы образцы плазмы 8 здоровых добровольцев, участвующих в эксперименте с антиортостатической гипокинезией, организованном Институтом космической медицины и физиологии в г. Тулузе (MEDES-IMPS, Франция). Все испытатели участвовали как в контрольной сессии антиортостатической гипокинезии без контрмер, так и во второй сессии с физическими тренировками, включающими приседания и подъемы ног с сопротивлением вибрации (RVE). Перерыв между сессиями составлял 4 мес. Все упражнения выполнялись на интегрированном тренажере, поставляемом (Novotec Medical, Германия). В этом исследовании вибрационная платформа Galileo® Fitness (Novotec Medical, Германия) была объединена с системой, предназначенной для упражнений в положении лежа на –6°. Тренировки проводили два раза в неделю с интервалом 3–4 дня. Первая тренировка была во второй день АНОГ. Методика подробно описана в статье [9]. Образцы собирали за сутки до эксперимента и на 21 сут гипокинезии как в контрольной сессии АНОГ, так и с применением профилактических мер. В данных временных точках было исследовано более 15 биохимических параметров крови, включая ренин, альдостерон, мочевину и различные фракции холестерина в образцах крови анализировали уровни глюкозы, инсулина, холестерина и др. с использованием автоматического анализатора Architect c16000 для клинической химии (Abbot Laboratories, США). Индекс резистентности к инсулину (HOMA_IR) рассчитывали как концентрацию инсулина натощак (мкЕд/мл) умноженную на концентрацию глюкозы натощак (ммоль/л)/22.5.
Часть плазмы, собираемой у добровольцев до экспериментов и на 21 сут каждой сессии, анализировали с помощью протеомного метода. Образцы плазмы очищали от мажорных белков с помощью колонок Top 12 (Pierce Chemical Co, США) и затем проводили стандартную пробоподготовку с использованием 10 кДа фильтров (Merc, Великобритания). Белки плазмы восстанавливали, алкилировали и подвергали трипсинолизу. Протеомный анализ образцов осуществляли с помощью метода высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией на системе, состоящей из хроматографа Dionex Ultimate3000 (Thermo Fisher Scientific, Waltham, США) в сочетании с MaXis 4G (Bruker Daltonics, Германия) с использованием источника ионов наноспрея (режим положительных ионов, 1600 В) (Bruker Daltonics, Германия).
Для полуколичественного анализа с помощью программы MaxQuant (version: 1.5.4.1) проводили идентификацию белков по базе данных SwissProt и по следующим параметрам: enzyme – trypsin; missed cleavage – 2; taxonomy – Human; fixed modifications – Сarbamidomethyl (C); variable modifications – Oxidation (M), Acetylation (N-term); peptide tolerance ±20 ppm; MS/MS (fragments) tolerance ±0.5 Дa. Обязательным условием идентификации белка было наличие в спектре как минимум одного уникального пептида данного белка. Для полуколичественного анализа использовали метод “без метки” с дополнительной опцией “match between the runs”. Для статистического анализа и определения молекулярных функций и биологических процессов, в которых участвуют белки, использовали программный пакет Perseus (version: 1.5.5.3). Для статистического анализа использовали программный пакет Statistica 10. Функциональный анализ белков проводили с помощью веб-ресурсов DAVID, String и программы Cytoscape.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Всего в образцах плазмы крови обследуемых в обеих сессиях АНОГ с использованием методов протеомики было количественно оценено 239 белков. С помощью методов статистики (t-тест) выявлено 29 белков, концентрация которых достоверно менялась (p-value ≤ 0.01) к концу АНОГ, проводимой без физических упражнений, по сравнению с исследованием фоновых образцов (табл. 1).
Таблица 1.
Белки, достоверно различающиеся к 21 сут АНОГ и АНОГ с физической нагрузкой
| Биологические процессы | Белки, достоверно различающиеся к 21 сут АНОГ | Белки, достоверно различающиеся к 21 сут АНОГ с RVE | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| белок | ген | р-value | отношение средней интенсивности пиков на 21 сут АНОГ к фону | динамика к концу АНОГ | белок | ген | р-value | отношение средней интенсивности пиков на 21 сут АНОГ c RVE к фону | динамика к концу АНОГ с RVE | |
| Активация комплемента | Ig γ-2 chain C region | IGHG2 | 0.0023 | 3.04 | ↑ | Complement factor B | CFB | 0.0001 | 1.36 | ↑ |
| Complement C1q subcomponent subunit C | C1QC | 0.0001 | 1.77 | ↑ | Complement C1s subcomponent | C1S | 0.0003 | 1.36 | ↑ | |
| Ig γ-1 chain C region | IGHG1 | 0.0018 | 1.71 | ↑ | Complement C3 | C3 | 0.0072 | 0.88 | ↓ | |
| C4b-binding protein β chain | C4BPB | 0.0076 | 1.62 | ↑ | ||||||
| Complement C1q subcomponent subunit B | C1QB | 0.0001 | 1.59 | ↑ | ||||||
| Complement C5 | C5 | 0.0042 | 1.3 | ↑ | ||||||
| Complement C4-A | C4A | 0.0011 | 1.22 | ↑ | ||||||
| Complement component C6 | C6 | 0.0019 | 0.61 | ↓ | ||||||
| Дегрануляция тромбоцитов | Serum albumin | ALB | 0.0006 | 1.85 | ↑ | Selenoprotein P | SEPP1 | 0.0065 | 1.69 | ↑ |
| Fibrinogen β chain | FGB | 0.0001 | 1.7 | ↑ | Inter-α-trypsin inhibitor heavy chain H3 | ITIH3 | 0.0008 | 1.41 | ↑ | |
| Fibrinogen γ chain | FGG | 0.0007 | 1.56 | ↑ | Extracellular matrix protein 1 | ECM1 | 0.0005 | 1.38 | ↑ | |
| Vitamin K-dependent protein S | PROS1 | 0.0031 | 1.44 | ↑ | ||||||
| Inter-α-trypsin inhibitor heavy chain H4 | ITIH4 | 0.0021 | 1.3 | ↑ | ||||||
| Kallistatin | SERPINA4 | 0.0006 | 1.48 | ↑ | ||||||
| Коагуляция крови | Heparin cofactor 2 | SERPIND1 | 0.0013 | 1.39 | ↑ | Heparin cofactor 2 | SERPIND1 | 0.003 | 0.72 | ↓ |
| Antithrombin-III | SERPINC1 | 0.0001 | 0.72 | ↓ | ||||||
| Prothrombin | F2 | 0.0001 | 0.38 | ↓ | ||||||
| Метаболизм липидов | Apolipoprotein M | APOM | 0.0002 | 1.86 | ↑ | Apolipoprotein B-100 | APOB | 0.0013 | 0.69 | ↓ |
| Cholinesterase | BCHE | 0.0039 | 0.68 | ↓ | Apolipoprotein A-I | APOA1 | 0.0001 | 0.66 | ↓ | |
| Apolipoprotein E | APOE | 0.0044 | 1.29 | ↑ | ||||||
| Метаболизм углеводов | Phosphatidylinositol-glycan-specific phospholipase D | GPLD1 | 0.0092 | 1.5 | ↑ | |||||
| Hepatocyte growth factor-like protein | MST1 | 0.0048 | 1.37 | ↑ | ||||||
| Воспалительный ответ | Pigment epithelium-derived factor | SERPINF1 | 0.0072 | 0.73 | ↓ | Attractin | ATRN | 0.0038 | 1.51 | ↑ |
| Extracellular matrix protein 1 | ECM1 | 0.0005 | 1.38 | ↑ | ||||||
| Адгезия | Zinc-α-2-glycoprotein | AZGP1 | 0.0021 | 1.91 | ↑ | α-1-microglobulin | AMBP | 0.0013 | 0.36 | ↓ |
| Cell surface glycoprotein MUC18 | MCAM | 0.0093 | 0.85 | ↓ | ||||||
| α-1-microglobulin | AMBP | 0.0013 | 0.36 | ↓ | ||||||
| Окисл.-восст. процессы | Ceruloplasmin | CP | 0.0001 | 0.7 | ↓ | |||||
| Транспорт витаминов | Afamin | AFM | 0.0001 | 0.52 | ↓ | |||||
| Вазодилатация | Angiotensinogen | AGT | 0.0093 | 0.71 | ↓ | |||||
| Процессинг белков | Carboxypeptidase N catalytic chain | CPN1 | 0.003 | 1.34 | ↑ | |||||
| Inter-α-trypsin inhibitor heavy chain H2 | ITIH2 | 0.0003 | 1.41 | ↑ | ||||||
Как показал анализ с использованием веб-ресурса STRING по базе данных GO, большинство данных белков участвовало в процессах дегрануляции тромбоцитов, коагуляции крови, фибринолизе, регуляции протеолиза, активации комплемента и иммунного ответа. Отметим, что подобные результаты были получены в отношении участия в биологических процессах изменившихся белков после космического полета [10]. Схожие процессы указывают на наличие общих механизмов адаптации как в наземном эксперименте, так и во время космического полета.
При исследовании влияния использованных в АНОГ профилактических средств в виде физических упражнений с сопротивлением вибрации на белковый состав крови, была выявлена модификация протеома плазмы, по сравнению с АНОГ. Так, общее количество достоверно изменяющихся белков уменьшилось, что свидетельствует об эффективности данного комплекса мер профилактики. Кроме того, были определены 13 белков (табл. 1), концентрации которых достоверно изменились к концу АНОГ с RVE. Данные белки, по данным базы GO, участвуют в процессах дегрануляции тромбоцитов, регуляции активации комплемента, воспалительного ответа и протеолиза, метаболизме холестерина (MST1) и глюкозы (GPLD1). В целом, наблюдается схожий, хотя и менее выраженный, ответ физиологических систем организма на воздействие АНОГ, несмотря на применение мер профилактики неблагоприятных последствий. Основные изменения отмечены преимущественно в процессах регуляции углеводного и липидного обмена в группе с применением мер профилактики (физнагрузка) и активной регуляции гомеостаза жидкостей тела человека в группе без применения мер профилактики.
При сравнении протеомных профилей плазмы крови одних и тех же добровольцев спустя 4 мес. выявлено 20 достоверно изменившихся белков, осуществляющих свои функции во внеклеточном секторе, которые относятся к наиболее вариабельной части протеома, участвуя в тесно взаимодействующих каскадах гемостаза, ответа на стресс и регуляции иммунных функций.
Как в контрольной сессии, так и в сессии с применением мер профилактики, к концу эксперимента наблюдалось достоверное повышение активности ренина плазмы, и выраженное, хотя и не достоверное, повышение альдостерона, что отражает влияние перераспределения жидкостей в торако-краниальном направлении в этих условиях [3]. Ренин и альдостерон являются главными участниками ренин-ангиотензин-альдостероновой системы (РААС) — гормональной системы, которая регулирует кровяное давление и объем крови в организме, который, как известно, уменьшается в условиях АНОГ.
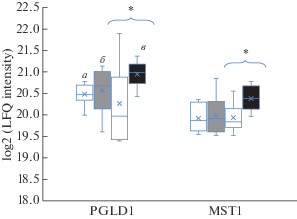
К концу эксперимента в обеих сессиях у добровольцев наблюдалось достоверное повышение концентрации инсулина натощак и тенденция к увеличению индекса инсулинорезистентности (рис. 1). При этом у 6 добровольцев уровень инсулина натощак к концу эксперимента без профилактических средств поднимался выше нормы в 7 мкЕд/мл, к концу гипокинезии с RVE уровень инсулина натощак поднимался выше нормы у 5 добровольцев. Данные изменения могут иметь негативное влияние на сосуды человека. Известно, что инсулин потенциирует расслабление мышц стенки сосудов (вазодилатацию) за счет высвобождения оксида азота. Но у пациентов с ожирением и инсулинорезистентностью свойство инсулина усиливать эндотелий-зависимую вазодилатацию значительно снижается [11]. Неспособность коронарных артерий к дилатации в ответ на физиологические раздражители может являться первым шагом формирования нарушений микроциркуляции — микроангиопатий. К тому же, высокие значения инсулина в крови могут способствовать развитию атеросклероза и нарушению процесса фибринолиза при взаимодействии с факторами свертываемости крови. Интересно отметить, что в АНОГ с RVE достоверно повышались 2 белка, участвующие в метаболизме углеводов: белок, стимулирующий макрофаги (MSP, ген MST1) и фосфатидилинозитолгликан-специфическая фосфолипаза D (GPLD1) (рис. 2).
Рис. 1.
Диаграммы размаха, отражающие динамику концентраций инсулина и глюкозы натощак и индекса инсулинорезистентности (HOMA-IR). а – фон, б – АНОГ, в – АНОГ + RVE; * – достоверные различия с p-value ≤ 0.05.
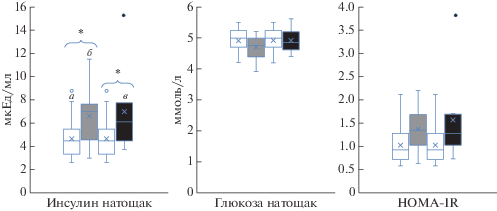
Рис. 2.
Диаграммы размаха, отражающие динамику концентраций белка, стимулирующего макрофаги (MST1) и фосфатидилинозитолгликан-специфической фосфолипазы D (PGLD1). Обозначения см. рис. 1.
Белок, стимулирующий макрофаги, синтезируется и секретируется гепатоцитами и циркулирует в плазме. Функция MSP заключается в индукции макрофагов, миграции и фагоцитозе. Однако MSP также ингибирует индуцируемую липополисахаридами (LPS) продукцию воспалительных медиаторов, включая индуцибельный оксид азота и простагландины [12].
Известно, что белок, стимулирующий макрофаги, значительно подавляет экспрессию ключевых генов ферментов печени, участвующих в глюконеогенезе: фосфоенолпируваткарбоксикиназы (PEPCK) и глюкозо-6-фосфатазы (G6PC) что, в конечном итоге, снижает продукцию глюкозы. Данные результаты были получены на первичных гепатоцитах, где при действии MSP резко снижалось образование глюкозы в реакции глюконеогенеза [13], что указывает на новую регуляторную роль MSP в глюконеогенезе в печени.
J.A. Bezerra et al. была отмечена роль MSP в развитии нарушения толерантности к глюкозе и атерогенном структурировании липидов [14, 15]. Кроме того, как гомолог MSP, фактор роста гепатоцитов (HGF) оказывал позитивное влияние на эффективность терапии ожирения, инсулинорезистентности и метаболического синдрома [16]. Предполагается, что MSP может вызывать эффекты, аналогичные HGF. К тому же, поскольку AMPK является хорошо известным основным регулятором клеточного ответа, нормализующего как воспаление, так и метаболические нарушения [17, 18], ее участие в передаче сигналов MSP указывает на ценность исследования MSP при метаболическом синдроме. В нашем эксперименте физические нагрузки с вибрацией способствовали повышению концентрации данного белка, что может оказать положительное влияние на метаболизм углеводов и липидов. Мы полагаем, что дальнейшие исследования в этой области помогут выработать меры по нормализации углеводного обмена в условиях длительных моделированных или реальных космических полетов.
Фосфатидилинозитол-гликан-специфическая фосфолипаза D является ферментом, который у людей кодируется геном GPLD1. Гликозилфосфатидилинозитол-специфическая фосфолипаза D1 гидролизует инозитол-фосфатную связь в белках, закрепленных фосфатидилинозитол-гликанами, тем самым высвобождая присоединенный белок из плазматической мембраны. Было показано, что фосфатидилинозитол-гликан-специфическая фосфолипаза D взаимодействует с аполипопротеином A1 (APOA1) и аполипопротеином A4 (APOA4) [19].
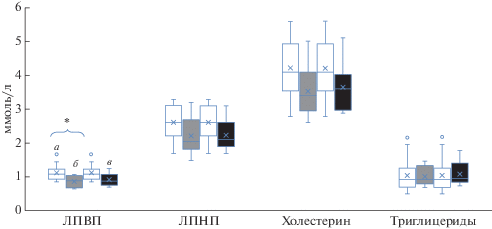
GPLD1 (также называемый GPI-PLD) является амфифильным белком, связанным с HDL в сыворотке [20]. Стоит отметить, что к концу эксперимента с АНОГ без профилактических мер достоверно снижалась концентрация холестерина липопротеинов высокой плотности (HDL), в то время как к концу сессии с физической нагрузкой данное снижение было не достоверным (рис. 3). Хотя фоновые показатели HDL были достаточно низкими, после воздействия условий АНОГ у 6 добровольцев уровни HDL опустились ниже уровня нормы в 1 ммоль/л, что означает повышение риска сердечно-сосудистых заболеваний. После сессии АНОГ с RVE уровень HDL опустился ниже нормы у 5 добровольцев. Полагаем, что значимую роль в изменении композиции холестериновых фракций играл белок GPLD1.
Рис. 3.
Диаграммы размаха, отражающие динамику концентраций холестерина липопротеинов высокой и низкой плотности, общего холестерина и триглицеридов. Обозначения см. рис. 1.
Выявлена связь повышенного уровня GPLD1 в плазме с диабетом 2 типа и с повышением глюкозы натощак и/или нарушением толерантности к глюкозе [21]. Сопоставимые исследования на людях отсутствуют, и потенциальная роль GPLD1 при диабете в настоящее время неизвестна. Однако расщепление субстрата GPLD1 приводит к появлению молекул, которые могут выступать в качестве инсулин-миметических низкомолекулярных частиц [22, 23]. S. Suzuki et al. продемонстрировали, что лечение мышей некоторыми видами низкомолекулярных инсулин-миметиков приводит к снижению уровня глюкозы в плазме, увеличению содержания гликогена в печени и скелетных мышцах и снижению толерантности к глюкозе у мышей db/db и мышей C57B6N на диете с высоким содержанием жира [23].
Было высказано предположение, что GPLD1 играет роль в метаболизме глюкозы путем расщепления связи GPI на транспортере глюкозы 4 (GLUT4), что способствует его транслокации в скелетных мышцах крысы [24]. Сообщалось, что сывороточные уровни GPLD1 повышаются у диабетических крыс [25, 26], и предполагается, что фермент подвержен влиянию различных состояний, таких как резистентность к инсулину и диабет 2 типа (СД2) [27]. Это увеличение может быть частью компенсаторного ответа на повышенную потребность в инсулине [28]. Кроме того, GPLD1 может играть важную роль в воспалении и патогенезе диабета, гидролизуя “якоря” GPI некоторых воспалительных мембранных белков и повышая экспрессию цитокинов макрофагов [27].
Анализ уровней мРНК в печени диабетических крыс показал, что экспрессия генов была снижена у животных, получавших инсулин в 0.7 раза, по сравнению с контрольными животными, не получавшими инсулин. Следовательно, инсулин снижает синтез гликозилфосфатидилинозитолфосфолипазы D у диабетических животных, что приводит к снижению уровня ферментов в сыворотке [26]. При этом сверхэкспрессия GPLD1 приводит к снижению уровня глюкозы натощак, к снижению толерантности к глюкозе, и, возможно, к увеличению синтеза инсулина [28]. Все эти результаты указывают на связь между гликозилфосфатидилинозитолфосфолипазой D и функцией инсулина.
Возможно, в сессии эксперимента с применением RVE увеличение концентрации данного белка было результатом повышенной потребности в инсулине при физической нагрузке, т.к. GPLD1 способствует снижению толерантности к глюкозе.
Таким образом, при физической нагрузке повышается синтез или секреция таких важных белков, как MSP и GPLD1, которые играют важную роль в нормализации углеводного обмена, что указывает на положительный эффект даже редких (3 раза в неделю) физических нагрузок с сопротивлением вибрации, выявляемый в улучшении обмена веществ.
Известно, что АНОГ оказывает негативное влияние на функционирование сосудов, в том числе изменение проницаемости и формирование петехий (мельчайшие кровоизлияния на коже и слизистых оболочках) [29]. Это может быть связано с нарушением целостности монослоя эндотелия и собственно кровеносных сосудов во время АНОГ. Следует отметить, что повышение концентрации инсулина в плазме к 21 сут АНОГ в обеих сессиях могло провоцировать изменения протеома и изменять липидограмму [30]. Эти факторы стимулируют развитие эндотелиальной дисфункции и снижение эластичности сосудов в целом. Микро- и макрососудистые изменения различного генеза, в сочетании с перераспределением объема жидкостных сред в условиях АНОГ являются ведущими факторами провокации сердечно-сосудистых заболеваний в группах риска.
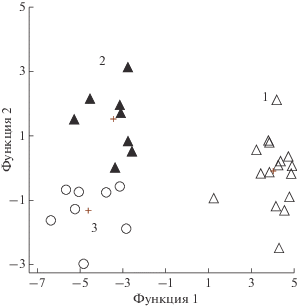
В результате проведения дискриминантного анализа биохимических параметров было выявлено, что среднегрупповые значения фоновых показателей обеих сессий (рис. 4, точки 1 и 3) не различаются p > 0.05, в то время как средние в АНОГ и в АНОГ с физической нагрузкой отличаются достоверно p < 0.014 (рис. 4, точки 2 и 4). Основными показателями, внесшими вклад в различия при завершении воздействия, оказались концентрация инсулина натощак и мочевины, хотя и остальные из 17 биохимических параметров вносили свой вклад. Таким образом, физические упражнения с сопротивлением вибрации сильнее всего повлияли на изменения концентрации инсулина натощак. Возможно, что именно углеводный обмен претерпевает изменения при применении мер профилактики, что подтверждается описанными выше результатами протеомного анализа плазмы.
ЗАКЛЮЧЕНИЕ
Таким образом, как в условиях АНОГ без профилактики, так и при использовании физических нагрузок показано достоверное увеличение концентрации ренина и инсулина натощак к 21 сут, в то время как концентрация альдостерона, и индекс инсулинорезистентности имели тенденцию к увеличению. Одновременно выявлено достоверное изменение концентрации белков, участвующих в процессах дегрануляции тромбоцитов, коагуляции крови, фибринолизе, регуляции протеолиза, активации комплемента и иммунного ответа. Белковый состав плазмы крови добровольцев, исследованный методами протеомики на основе масспектрометрии, в эксперименте с применением профилактики модифицировался в меньшей степени, по сравнению с АНОГ. Показано изменение концентрации 13 белков, по сравнению с 29 белками в АНОГ без профилактики, что указывает на эффективность профилактических мер. Физические упражнения с сопротивлением вибрации практически не предотвращали изменения биохимических параметров и белковой композиции плазмы крови обследованных, участвующих в эксперименте с антиортостатической гипокинезией. Наблюдавшиеся изменения были связаны с регуляцией углеводного и липидного обменов, в частности, повышалась концентрация белков, участвующих в нормализации углеводного и липидного обменов – белка, стимулирующего макрофаги, и фосфатидилинозитолгликан-специфической фосфолипазы D.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены этическим комитетом Центральной университетской больницы г. Тулузы (Франция).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Работа была выполнена при поддержке РФФИ (грант № 18-34-00524).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Ларина И.М., Попова И.А., Михайлов В.М. и др. Гормональные механизмы обеспечения мышечной работы во время длительной антиортостатической гипокинезии // Физиология человека. 1999. Т. 25. № 3. С. 117. Larina I.M., Popova I.A., Mikhailov V.M. et al. [The hormonal mechanisms supporting muscle work during prolonged head-down tile hypokinesia] // Fiziol. Cheloveka. 1999. V. 25. № 3. P. 117.
Григорьев А.И. Водно-солевой обмен и функции почек у человека при длительной гипокинезии // Нефрология. 2001. № 3. С. 7.
Михайлов В.М. Гипокинезия как фактор риска в экстремальных условиях // Авиакосмическая и экологическая медицина. 2001. Т. 35. № 2. С. 26. Mikhailov V.M. [Hypokinesia as a risk factor in extreme conditions] // Aviakosm. Ekolog. Med. 2001. V. 35. № 2. Р. 26.
Batchu S.N., Smolock E.M., Dyachenko I.A. et al. Autonomic dysfunction determines stress-induced cardiovascular and immune complications in mice // J. Am. Heart Assoc. 2015. V. 4. № 5. P. e001952.
Baranov M.V., Katuntsev V.P., Shpakov A.V., Baranov V.M. A Method of Ground Simulation of Physiological Effects of Hypogravity on Humans // Bull. Exp. Biol. Med. 2016. V. 160. № 3. P. 401.
Coupé M., Yuan M., Demiot C. et al. Low-magnitude whole body vibration with resistive exercise as a countermeasure against cardiovascular deconditioning after 60 days of head-down bed rest // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2011. V. 301. № 6. P. R1748.
Greaves D., Arbeille P., Guillon L. et al. Effects of exercise countermeasure on myocardial contractility measured by 4D speckle tracking during a 21-day head-down bed rest // Eur. J. Appl. Physiol. 2019. V. 119. № 11–12. P. 2477.
Афонин Б.В. Влияние космических полетов и условий антиортостатической гипокинезии различной продолжительности на концентрацию инсулина в крови // Космическая биология и авиакосмическая медицина. 1989. Т. 23. № 3. С. 77. Afonin B.V. [Effect of space flight antiorthostatic hypokinesia of various durations on blood insulin level] // Kosm. Biol. Aviakosm. Med. 1989. V. 23. № 3. P. 77.
Kermorgant M., Nasr N., Custaud M.A. et al. Effects of resistance exercise and nutritional supplementation on dynamic cerebral autoregulation in Head-Down Bed Rest // Front. Physiol. 2019. V. 10. P. 1114.
Brzhozovskiy A.G., Kononikhin A.S., Pastushkova L.Kh. et al. The effects of spaceflight factors on the human plasma proteome, including both real space missions and ground-based experiments // Int. J. Mol. Sci. 2019. V. 20. № 13. P. 3194.
Prieto D., Contreras C., Sánchez A. Endothelial dysfunction, obesity and insulin resistance // Curr. Vasc. Pharmacol. 2014. V. 12. № 3. P. 412.
Wang M.H., Zhou Y.Q., Chen Y.Q. Macrophage-stimulating protein and RON receptor tyrosine kinase: potential regulators of macrophage inflammatory activities // Scand. J. Immunol. 2002. V. 56. № 6. P. 545.
Chanda D., Li T., Song K.H. et al. Hepatocyte growth factor family negatively regulates hepatic gluconeogenesis via induction of orphan nuclear receptor small heterodimer partner in primary hepatocytes // J. Biol. Chem. 2009. V. 284. № 42. P. 28510.
Bezerra J.A., Carrick T.L., Degen J.L. et al. Biological effects of targeted inactivation of hepatocyte growth factor-like protein in mice // J. Clin. Invest. 1998. V. 101. № 5. P. 1175.
Yu S., Allen J.N., Dey A. et al. The Ron Receptor Tyrosine Kinase Regulates Macrophage Heterogeneity and Plays a Protective Role in Diet-Induced Obesity. Atherosclerosis, and Hepatosteatosis // J. Immunol. 2016. V. 197. № 1. P. 256.
Tsukagawa E., Adachi H., Hirai Y. et al. Independent association of elevated serum hepatocyte growth factor levels with development of insulin resistance in a 10-year prospective study // Clin. Endocrinol. 2013. V. 79. № 1. P. 43.
O’Neill L.A., Hardie D.G. Metabolism of inflammation limited by AMPK and pseudo- starvation // Nature. 2013. V. 493. № 7432. P. 346.
Zhang B.B., Zhou G., Li C. AMPK: an emerging drug target for diabetes and the metabolic syndrome // Cell Metab. 2009. V. 9. № 5. P. 407.
Deeg M.A., Bierman E.L., Cheung M.C. GPI-specific phospholipase D associates with an apoA-I- and apoA-IV-containing complex // J. Lipid Res. United States. 2001. V. 42. № 3. P. 442.
Hoener M.C., Brodbeck U. Phosphatidylinositol-glycanspecific phospholipase D is an amphiphilic glycoprotein that in serum is associated with high-density lipoproteins // Eur. J. Biochem. 1992. V. 206. № 3. P. 747.
von Toerne C., Huth C., de las Heras Gala T. et al. MASP1, THBS1, GPLD1 and ApoA-IV are novel biomarkers associated with prediabetes: the KORA F4 study // Diabetologia. 2016. V. 59. № 9. P. 1882.
Schofield J.N., Stephens J.W., Hurel S.J. et al. Insulin reduces serum glycosylphosphatidylinositol phospholipase D levels in human type I diabetic patients and streptozotocin diabetic rats // Mol. Genet. Metab. 2002. V. 75. № 2. P. 154.
Suzuki S., Suzuki C., Hinokio Y. et al. Insulin-mimicking bioactivities of acylated inositol glycans in several mouse models of diabetes with or without obesity // PLoS One. 2014. V. 9. № 6. P. e100466.
Kristiansen S., Richter E.A. GLUT4-containing vesicles are released from membranes by phospholipase D cleavage of a GPI anchor // Am. J. Physiol. Endocrinol. Metab. 2002. V. 283. № 2. P. 374.
Deeg M.A., Bowen R.F., Williams M.D. et al. Increased expression of GPI-specific phospholipase D in mouse models of type 1 diabetes // Am. J. Physiol. Endocrinol. Metab. 2001. V. 281. № 1. P. 147.
Schofield J.N., Stephens J.W., Hurel S.J. et al. Insulin reduces serum glycosylphosphatidylinositol phospholipase D levels in human type I diabetic patients and streptozotocin diabetic rats // Mol. Genet. Metab. 2002. V. 75. № 2. P. 154.
Qin W., Liang Y.Z., Qin B.Y. et al. The clinical significance of glycoprotein phospholipase D levels in distinguishing early stage latent autoimmune diabetes in adults and type 2 diabetes // PLoS One. 2016. V. 11. № 6. P. 1.
Raikwar N.D., Bowen-Deeg R.F., Du X.S. et al. Glycosylphosphatidylinositol-specific phospholipase D improves glucose tolerance // Metabolism. 2010. V. 59. № 10. P. 1413.
Ganse B., Limper U., Bühlmeier J. et al. Reproducible pattern of distribution and increased appearance after bed rest // Aviat. Space Environ. Med. 2013. V. 84. № 8. P. 864.
Matczuk J., Zalewska A., Łukaszuk B. et al. Insulin Resistance and Obesity Affect Lipid Profile in the Salivary Glands // J. Diabetes Res. 2016. V. 2016. P. 8 163 474.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека