Физиология человека, 2020, T. 46, № 4, стр. 98-110
Общие движения как отражение нормального или нарушенного двигательного развития младенцев
И. А. Солопова 1, *, В. А. Селионов 1, И. Ю. Долинская 1, 2, Е. С. Кешишян 3
1 ФГБУН Институт проблем передачи информации имени А.А. Харкевича, РАН
Москва, Россия
2 Московский физико-технический институт
Долгопрудный, Россия
3 ФГБОУ ВО Российский национальный исследовательский медицинский университет
имени Н.И. Пирогова Минздрава РФ
Москва, Россия
* E-mail: solopova@iitp.ru
Поступила в редакцию 09.10.2019
После доработки 02.12.2019
Принята к публикации 20.03.2020
Аннотация
Двигательная активность младенцев начинает проявляться уже на первых месяцах (на 9–10 нед.) внутриутробного развития. Постоянно видоизменяясь в ходе созревания плода, эти движения сохраняются и после рождения и носят название “общие движения”. В постнатальном периоде сложность и вариабельность движений являются критерием правильного двигательного развития младенцев. Нарушения в созревании нервной системы отражаются в отклонениях от нормальных паттернов общих движений. Исследуя эти паттерны можно диагностировать перинатальные повреждения мозга. Это особенно касается детей, родившихся преждевременно, в связи с увеличенным риском развития у них неврологических и двигательных нарушений. В данном обзоре описаны основные типы общих движений, характерные для нормального двигательного развития, атипичные двигательные паттерны, которые имеют прогностическую ценность для раннего предсказания детского церебрального паралича, а также предполагаемые нейронные субстраты, обуславливающие развитие нормальных и ненормальных общих движений. Представлены различные методы оценки общих движений: как качественные, основанные на визуальной оценке двигательных паттернов, так и количественные, использующие распознавание и анализ общих движений конечностей посредством автоматизированных методов.
Двигательная активность младенцев в первые месяцы жизни является важной предпосылкой для развития произвольных двигательных навыков человека и адекватной реакции на изменяющееся окружение. В процессе двигательного онтогенеза новорожденный ребенок проходит несколько этапов: от спонтанной двигательной активности до произвольных координированных движений, переход к которым происходит в процессе созревания и развития его нервной системы и, в особенности, кортикоспинального тракта. Именно посредством непроизвольных движений в младенчестве человек познает окружающий мир и учится управлять своим телом, поэтому качественные и количественные показатели таких движений являются высокими предикторами формирования нормальных целенаправленных движений в старшем возрасте [1]. Изучение двигательного поведения плода в утробе матери стало возможным после развития 3D/4D ультразвуковых технологий. Было показано, что уже в первом триместре беременности у человеческого плода наблюдается большое разнообразие специфических паттернов движений [2, 3]. Первые движения плода появляются уже на 7 нед. концептуального возраста, они состоят из медленных и маленьких поворотов головы и/или туловища из стороны в сторону. В 8–9 нед. появляется вздрагивание, к 9 нед. добавляются медленные маленькие движения отдельных конечностей, и через несколько дней начинаются совместные движения рук и ног. К 10 нед. добавляются различные движения головы, такие как сгибание, разгибание, повороты с большими амплитудами, возникает контакт руки с лицом или ртом, увеличивается частота движений. Возникают сложные и вариабельные двигательные паттерны, в которых все части тела принимают участие и при которых направление движений, амплитуда и скорость постоянно изменяются. Предполагается, что подобная вариабельность является показателем оптимального развития мозга [4].
После рождения двигательная активность ребенка видоизменяется, формируются стабильные двигательные паттерны, которые изменяются в процессе созревания центральной нервной системы (ЦНС). Впервые такие паттерны у новорожденных и младенцев первых месяцев жизни были описаны H.F. Prechtl и J.W. Fargel [5]. Многогранная спонтанная двигательная активность с различной степенью сложности паттернов была названа авторами общими движениями (ОД), которые они считали неотъемлемым атрибутом двигательного развития, и которые, как было описано выше, наблюдаются от ранней эмбриональной жизни и далее, вплоть до конца первой половины первого года жизни. ОД представляют собой сложный и вариабельный двигательный паттерн, который включает движения рук, ног, шеи, туловища и головы. Было описано два основных типа ОД, характерных для нормального двигательного развития здоровых доношенных младенцев, зависящих от возраста: “writhing” – “извивающиеся” движения и “fidgety” – “беспокойные” движения [6–9]. “Извивающиеся” движения наблюдаются первые два месяца после рождения и характеризуются медленной и умеренной скоростью, с маленькими ограниченными амплитудами. Согласно H.F. Prechtl они характеризуются высокой сложностью и большой вариабельностью в отношении амплитуды, скорости и ускорения, но не в отношении формы. Траектории движений конечных точек рук и ног имеют форму эллипса. В возрасте после рождения от 6 до 9 нед. извивающиеся движения постепенно видоизменяются, приобретая новые черты, возникают “беспокойные” движения. “Беспокойные” движения – круговые движения небольшой амплитуды и умеренной скорости (более мелкие и быстрые по сравнению с извивающимися движениями), характеризующиеся увеличением вариабельности ускорений шеи, корпуса и конечностей во всех направлениях и плавностью, за исключением периодов нервного возбуждения и плача. Эти движения непрерывны у бодрствующих младенцев, за исключением состояния фокусирования внимания. На фоне беспокойных движений могут наблюдаться и различные другие движения, такие как осциллирующие покачивания и саккадические движения рук, сильные удары, манипуляции пальцами, возня с одеждой, подъем ног с или без контакта с кистями рук, повороты туловища [10, 11]. Подобный тип ОД наблюдается до 4–5-месячного возраста, впоследствии они заменяются произвольными целенаправленными движениями. Тем не менее, вплоть до шестимесячного возраста, беспокойные ОД все еще можно отчетливо наблюдать у спящих младенцев [12].
Качественные описания изменений двигательной активности, наблюдаемой H.F. Prechtl в первые месяцы жизни ребенка, нашли свое отражение в некоторых значениях параметров, предлагаемых исследователями для количественной оценки двигательного развития. L. Meinecke et al. [13] на основе комбинаций зарегистрированных кинематических данных младенцев, предложили 8 параметров, которые отражали качественные наблюдения при визуальной оценке ОД. Сравнение значений этих параметров в возрасте у доношенных детей 1 и 3 мес. [1] выявило увеличение кросс-корреляции ускорения правой и левой ног на 25% при переходе от “извивающихся” к “беспокойным” движениям, что отражает более высокую межконечностную координацию при беспокойных движениях. Также было обнаружено снижение величин отклонения траекторий движения ног от их среднего значения на 8–11%, что, по мнению авторов, указывает на снижение вариабельности и разнообразия выполняемых движений, и соответствует круговой форме “беспокойных” движений, осуществляемых с небольшими скоростями.
Количественное подтверждение тому, что трансформация от “извивающихся” к “беспокойным” движениям сопровождается уменьшением их амплитуды и изменением характера от элипсоидных движений к круговым, было получено в работе L. Adde et al. [14]. Было показано, что при переходе от одного типа ОД к другому средняя вариабельность пространственного центра движения снизилась на 7.5% (вариабельность в горизонтальном и вертикальном направлениях былa меньше на 12.9 и 16.3% соответственно), это предполагает, что беспокойные движения – маленькие и вариабельные, равномерно распределенные вдоль всего тела.
Особенности мышечной активности при разных типах спонтанных движений
При нормальном развитии в течение первых месяцев жизни у новорожденных происходят прогрессивные нейромоторные изменения, связанные с изменением возбудимости мотонейронов и реакций интернейронного аппарата спинного мозга на входящие сенсорные сигналы (физиологическое снижение чувствительности двигательных единиц) и мышечного тонуса: уменьшение пропорции “периодического” паттерна двигательных единиц и снижение частоты их импульсации [15, 16], уменьшение амплитуды Н-рефлекса [17, 18], увеличение порога фазического рефлекса на растяжение, постепенное уменьшение иррадиации рефлекса на растяжение на другие мышцы [19], увеличение скорости проведения по нисходящим моторным путям [20].
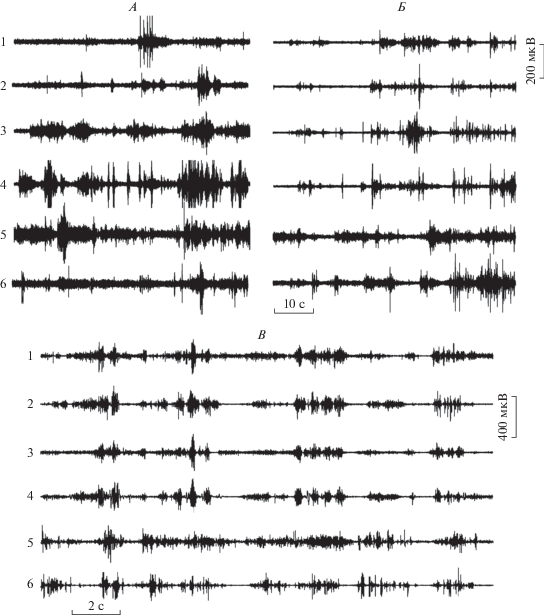
Наряду с этими изменениями происходят и изменения в координации активности мышц, результатом которых является трансформация типа ОД младенцев в первые месяцы жизни. Было показано, что при паттерне извивающихся движений наблюдается синхронная активация мышц антагонистов [21, 22]. При трансформации от одного паттерна ОД к другому коактивация антагонистических мышечных групп для нижних конечностей сохраняется, однако уже на 3 мес. при ударяющих движениях обнаруживаются реципрокные вспышки мышц-антагонистов плеча [21]. Авторы обнаружили, что по мере взросления организма (от рождения до 4 мес. жизни) происходит укорочение длительности пачек фазической мышечной активности, снижение их амплитуды и уменьшение тонической активности во всех исследованных мышцах верхних и нижних конечностей (рис. 1, А, Б). Эти изменения авторы объяснили повышением порога активации двигательных единиц вследствие спинальной и супраспинальной реорганизации. Изменения ЭМГ-активности могут указывать на развивающиеся изменения в свойствах нейрональных мембран, переход от полинейрональной к мононейрональной мышечной иннервации, изменения функциональных связей в спинальных цепях (связанных с формированием тормозных процессов, в частности, увеличение торможения Реншоу) и изменения супраспинальных влияний.
Рис. 1.
Паттерны ЭМГ-активности мышц при разных типах нормальных общих движений (ОД) и при атипичных ОД. Представлены данные собственных исследований. A – пример ЭМГ-активности здорового, доношенного ребенка в возрасте 1 мес. с извивающимся типом движений, Б – ЭМГ-активность этого же ребенка в возрасте 3.5 мес. с беспокойным типом движений. В – пример судорожно-синхронизированных ОД у недоношенного младенца. Представлена активность следующих мышц левой ноги и руки (сверху вниз): 1 – m. rectus femoris; 2 – m. biceps femoris; 3 – m. tibialis anterior; 4 – m. gastrocnemius lateralis; 5 – m. biceps brahialis; 6 – m. triceps brahialis.
Нейронные структуры, обуславливающие общие движения, и ответственные за переход от одного типа ОД к другому
Появление первых движений плода на 7 нед. концептуального возраста соответствует как образованию синаптических контактов в спинном мозге (6–7 нед.), так и формированию нервно-мышечных контактов [4]. Первые движения плода обнаруживаются еще до того, как завершится формирование рефлекторных путей спинного мозга (примерно на 10–11 нед.) [23, 24], что подчеркивает эндогенную или спонтанную генерацию ранней двигательной активности. В процессе созревания нервной системы, между 5 и 25 нед. гестационного возраста образуются новые нейроны [4]. К середине седьмой недели начинается кортикальный нейрогенез. Новообразованные нейроны мигрируют из мест своего формирования к более поверхностным слоям коры, и первые популяции нейронов сосредотачиваются в подкорковом слое, который является важным местом нейронной дифференциации и синаптогенеза. Уже в возрасте 9–10 нед. нейроны подкоркового слоя развивают синаптическую активность [25]. В настоящее время предполагается [26], что именно нейроны области подкоркового слоя отвечают за сложность и вариабельность ОД плода, и что их активность передается к нейронным сетям, составляющим генераторы ритмики в стволе мозга и в спинном мозге [23, 27]. Наличие сложных и разнообразных ОД между 9–10 нед. концептуального возраста и 3–5 мес. после рождения соответствует временнóму присутствию подкоркового слоя в первичной сенсомоторной коре. Это подтверждается исследованиями, которые были проведены на эмбрионах цыплят и морских свинок [3, 28]. Исследования на человеческих плодах с анэнцефалией показали, что их движения не обладают сложностью и вариабельностью [29, 30]. Предполагается, что активация сложных и вариабельных ОД первоначально возникает в подкорковом слое. В подтверждение этого магнитно-резонансные исследования состояния плода в покое показали, что в 20 нед. наибольшая активность мозга проявляется в подкорковом слое [31]. Наибольшая активность нейронов подкоркового слоя длится до 26 нед., после чего, в связи с прогрессивным уменьшением его толщины, активность снижается (рис. 2). Таламокортикальные связи, которые изначально связывали нейроны подкоркового слоя с таламусом, формируют связи с кортикальным слоем. Постепенное снижение роли подкоркового слоя и его почти полное исчезновение между 36 нед. и 3–6 мес. после рождения происходит параллельно с постепенной трансформацией ОД в произвольные [32].
Рис. 2.
Схема трансформаций, происходящих в головном мозге в разные периоды гестации и после рождения. По вертикали – гипотетическая толщина клеточных слоев. Слой “ПЖЗ + ЖЗ” отражает суммарную толщину поджелудочковой и желудочковой зон – область генерации нейронов и глиальных клеток. Cлой “ПЗ + ОБВ” отражает промежуточную зону, постепенно переходящую в околожелудочковое белое вещество. На полоске гипервозбудимости интенсивность серого цвета отражает степень возбудимости нервной системы. Активность кортикальных сетей появляется в мозге между 9 и 10 нед. гестационного возраста и градуально увеличивается (показано интенсивностью цвета) до среднего эмбрионального возраста, после чего происходит постепенное снижение этой активности от широко распределенной до локальной и ограниченной (“разрежение”, указано уменьшением пятен). Адаптирован из [4].
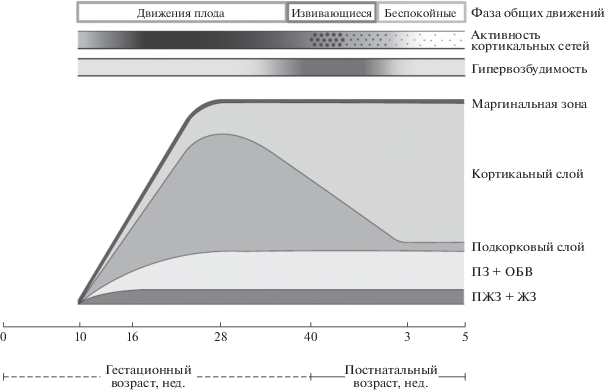
Извивающиеся ОД начинаются на 36–38 нед. гестационного возраста, в тот момент времени, когда подкорковый слой значительно утончается, параллельно с чем происходит увеличение межполушарных связей через мозолистое тело и формирование длинных кортико-кортикальных связей [27, 33]. Начиная с этого возраста и до 6–8 нед. после рождения также происходят изменения в кортикальной нейропередающей системе, что приводит к увеличению возбудимости мотонейронов в этот период. К 3 мес. скорректированного возраста возбудимость снижается [3, 21].
По мере того, как активность нейронных сетей, первоначально генерируемая нейронами подкоркового слоя, постепенно сдвигается в сторону коркового слоя, появляются беспокойные движения. Возникновение таких движений связывают с начавшимися изменениями в уже сформированных сетях первичной сенсомоторной коры [34]. A. Ritterband-Rosenbaum et al. показали, что фаза беспокойных движений характеризуется зависящей от активности реорганизацией функциональных связей между волокнами кортикоспинального тракта и спинальными мотонейронами [35]. Предполагается, что активность кортикальных сетей становится менее интенсивна, и более ограниченная группа нейронов участвует в этой активности, что приводит к замещению ОД специфическими целенаправленными движениями. Считается, что именно в период беспокойных движений (2–5 мес. скорректированного возраста), когда кортикальная активность в первичных сенсомоторных областях коры сдвигается от подкоркового к корковому слою, оценка ОД имеет наибольшую предсказательную ценность [36].
Атипичные общие движения
Атипичные ОД можно наблюдать у недоношенных детей в период до 38–40 нед. гестационного возраста, у детей сразу после рождения и в первые 4–5 нед. скорректированного возраста. Выделяют две формы атипичных спонтанных движений – умеренно ненормальные и с полной определенностью ненормальные. Умеренно ненормальные движения – это движения недостаточно вариабельные и сложные и лишенные плавности, а определенно ненормальные ОД – практически полностью лишены сложности, изменчивости и плавности. Отсутствие сложности, вариабельности и плавности происходит вследствие повреждения или дисфункции подкоркового, или коркового слоя и/или эфферентных связей через околожелудочковое белое вещество [4]. Ненормальные ОД, которые сохраняются, несмотря на изменения, происходящие в развивающемся мозге, предполагают фундаментальные нарушения в целостности мозга. Качество ОД отражает целостность обширных нейронных сетей, вовлекающих не только корковые области, но также их связи с подкорковыми областями. У детей, родившихся преждевременно, нарушения развития мозга обычно наблюдаются в околожелудочковом белом веществе (обычно происходят на 24–34 нед. гестации) и в подкорковом слое [37]. У доношенных младенцев поражения мозга более гетерогенные: поражения наблюдаются в корковых областях, базальных ганглиях, таламусе [38]. Предсказательная ценность атипичных ОД у недоношенных детей выше, чем у детей, родившихся в срок.
В настоящее время в литературе описаны пять признаков атипичных движений: движения с бедным репертуаром [39, 40]; судорожно синхронизированные ОД [39–41]; хаотичные ОД [42]; ненормальные беспокойные движения [40] и полное отсутствие беспокойных движений [40, 43]. При ОД с бедным репертуаром чередование последовательных компонентов движения является монотонным и движения различных частей тела не происходят сложным образом, как это наблюдается при нормальных ОД. В большей степени такие движения наблюдаются у младенцев с нарушениями развития мозга, подтвержденными ультразвуковым исследованием. В процессе развития младенца за такими движениями могут следовать нормальные, ненормальные беспокойные движения, или движения могут совсем отсутствовать. Предсказательная способность будущих двигательных нарушений, в том числе и детского церебрального паралича (ДЦП), при бедном репертуаре ОД в большей степени низкая [11, 40].
Судорожно-синхронизированные ОД (рис. 1, В) представляют собой ригидные и потерявшие нормальный, плавный характер движения, все мышцы конечностей и тела сокращаются и расслабляются почти одновременно. Последовательное наблюдение этой ненормальной картины во время целого ряда недель может являться фактором для предсказания развития спастического ДЦП с высокой точностью [36, 39–41].
Хаотические ОД с большой амплитудой происходят беспорядочно без какой-либо плавности для всех конечностей. Они последовательно появляются, затем прерываются [42, 43]. Хаотические ОД могут наблюдаться после преждевременного рождения, и в раннем возрасте после рождения, но, в значительной степени, редко. Младенцы с хаотическими ОД часто развивают судорожно-синхронизированные ОД на несколько недель позже [11].
Ненормальные беспокойные движения выглядят подобно нормальным беспокойным движениям, но их амплитуда и скорость преувеличены, сами движения происходят рывками [40]. Ненормальные беспокойные движения редки, поэтому их прогностическая ценность очень низкая [11].
Если беспокойные движения никогда не наблюдались от 9 до 20 нед. после рождения, эту ненормальность называют “отсутствием беспокойных движений”. При этом, обычно может наблюдаться какой-либо другой тип движений. Отсутствие беспокойных движений обладает высокой предсказуемостью для вероятного появления последующих неврологических повреждений, в особенности для ДЦП [36, 40, 44].
Таким образом, из всех типов атипичных движений наиболее надежными предсказателями церебрального паралича в будущем являются судорожно-синхронизированные ОД или отсутствие ОД беспокойного характера.
Некоторые признаки атипичных ОД у младенцев высокого риска были документированы в количественном выражении. Движения здоровых детей характеризуются высокой степенью сложности и вариабельности, что подразумевает присутствие различных двигательных паттернов, которые различаются по скорости, амплитуде, вовлеченности суставов. Атипичные движения не обладают вариабельностью, более стереотипны и монотонны. Такие движения представляют паттерны, которые повторяются несколько раз во время записи и показывают сходные временны́е траектории. Они могут отличаться в некоторой степени по скорости, амплитуде или инициации, но основные формы их траектории остаются прежними. Для количественного отражения таких движений L. Meinecke et al. [13] предложили параметр “периодичность движений”, который характеризует именно повторяющиеся движения конечностей с большими амплитудами. Значения этого параметра были в несколько раз выше у больных детей с атипичными движениями. Для количественного выражения вариабельности движений также был предложен индекс стереотипности [45, 46]. Сравнение значения этого индекса у здоровых доношенных младенцев и у недоношенных детей высокого риска в скорректированном возрасте 3 мес. показало, что для детей, у которых впоследствии был подтвержден диа-гноз ДЦП, этот индекс, рассчитанный для рук, был существенно выше (в ~3 раза), а для ног незначительно ниже, чем у детей, развивающихся нормально. Другими исследователями было показано [47, 48], что количество движений у детей с отсутствием “беспокойных” движений было в 1.6 раз меньше, а вариабельность пространственного центра движения была в 1.3 раза выше, чем у детей, развивающихся нормально. Больные дети имели более асимметричную форму суммарного распределения движений, и большую общую площадь, охватываемую движениями. Все это, по мнению авторов, предполагает менее стабильный двигательный паттерн у детей с отсутствием беспокойных движений.
Как уже было описано раньше, движения здоровых детей, в отличие от атипичных движений детей с нарушениями двигательного развития, характеризуются плавными и гармоничными траекториями движений рук и ног. L. Adde et al. [47] показали, что изменения скорости и ускорения центроида движения у здоровых детей были на ~24% меньше, чем у больных детей, что, по их мнению, может отражать плавность выполнения движений. L. Meinecke et al. [13] предложили, в качестве параметра оценки плавности движений ребенка, отклонение траектории движения от движущегося скользящего среднего значения этой траектории и показали, что у больных детей этот параметр существенно превышает (в 2–3 раза) таковой у детей с нормальными паттернами движений.
Особенности общих движений у недоношенных детей
Преждевременное рождение связано с увеличением риска неврологических и двигательных нарушений, таких как ДЦП [49], задержками развития, координационными расстройствами [50]. Риск тем больше, чем с меньшим гестационным возрастом родился ребенок. Было показано [51], что раннее определение подобных рисков и раннее начало терапии на первом году жизни, может улучшить моторный выход в раннем детстве и, потенциально, в дальнейшей жизни ребенка.
У недоношенного ребенка с гестационным возрастом 33–38 нед. ОД составляют 33–35% всей его двигательной активности. На протяжении периода с 33 по 38 нед. это соотношение – ОД/вся двигательная активность, не меняется, также никаких изменений не наблюдается ни в скорости ОД, ни в интервале между ОД [52]. Недоношенные младенцы обычно имеют очень бедный репертуар ОД по сравнению с доношенными сверстниками [11, 53–55]. Очень мало различий наблюдается между двигательной активностью плода и преждевременно родившегося ребенка, указывая, что ни увеличение влияния силы гравитации после рождения [16], ни созревание нервной системы не оказывают воздействия на появление ОД [56]. Резкие синхронизированные движения и отсутствие беспокойных движений у недоношенных детей проявляется реже, чем у их доношенных сверстников [54, 57]. R.F.M. Zorzenon [58] оценивал ОД недоношенных высокого риска (<32 нед. гестационного возраста, с низким весом (<1500 г) и неврологическими изменениями ЦНС (гидроцефалия, пери- или интравентрикулярные кровоизлияния, судороги)) от 30 нед. постконцептуального возраста до 40 нед. с целью исследования траектории развития ОД до возраста, соответствующего рождению доношенного ребенка. Движения младенцев были оценены с использованием оптимальной шкалы ОД, разработанной C. Einspieler [57], в периоды 30–33, 34–36 и 38–40 нед. постконцептуального возраста. Такая оценка не выявила значимых различий между первой и второй возрастными группами, и показала, что большинство недоношенных имели в эти периоды бедный репертуар таких движений. В обеих группах младенцы имели большие движения туловища, высокую частоту монотонных и непродолжительных движений с низкими амплитудами, менее часто встречались вариабельные последовательные движения, и еще менее часто синхронизированные движения. Однако к 36–38 нед. постконцептуального возраста наблюдалось прогрессивное улучшение качества ОД: они становились более разнообразными, сильными и напряженными, приобретали “извивающийся” характер, амплитуды движений конечностей увеличивались, а движения туловища уменьшались. Этот прогресс, в двигательном развитии недоношенных младенцев высокого риска, авторы связывают как с созреванием нервной системы, так и с грамотными медицинскими мероприятиями в неонатальном периоде. Тем не менее, большинство здоровых недоношенных младенцев в возрасте 38–42 нед., т.е. на момент рождения доношенного ребенка, все еще имеют бедный репертуар ОД и количество недоношенных, проявляющих такой бедный паттерн, связан со степенью недоношенности: 73% для младенцев умеренной (~32 нед.) и 68% для младенцев малой (~36 нед.) степени недоношенности [59]. Остальные недоношенные младенцы проявляют нормальный паттерн ОД “извивающегося” характера, как и 90% доношенных детей. Развитие недоношенных детей, начиная с возраста, соответствующего рождению доношенного ребенка, т.е. с 38–40 нед. и в первые 18 нед. скорректированного возраста во многих аспектах было сходным с развитием доношенных детей. Тем не менее, было отмечено [52], что “извивающийся” характер ОД длится дольше у доношенных детей, а “беспокойный” тип ОД у недоношенных детей начинается раньше, в то время как начало манипулятивных движений не отличается. К 3 мес. скорректированного возраста недоношенные дети без двигательных нарушений, развивают “беспокойные” движения, также как и здоровые доношенные младенцы [59, 60]. Показано [60], что при переходе к беспокойным движениям, самые заметные изменения связаны с изменениями в ускорении движений конечностей и вариабильности ОД: ускорение движений рук и ног возрастает в 3–4 раза по сравнению с 35–37 нед. гестационного возраста, движения становятся более независимыми и сложными, значительно уменьшается коэффициент эксцесса для скорости (в 1.3 раза) и ускорения (1.5 раза), что свидетельствует о том, что движения становятся более плавными.
Отведения ЭМГ обнаружили, что длительность пачек импульсов (720–1160 мс) у недоношенных детей, родившихся без неврологических повреждений (гестационный возраст при рождении 28–33 нед.), была существенно больше во время их ОД до 38 нед. гестационного возраста, чем во время извивающихся движений у детей, родившихся в срок (420–800 мс) [61]. При этом в гестационном возрасте 33–34 нед. средняя амплитуда пачек ЭМГ и тоническая активность у детей, родившихся преждевременно, отличались существенной вариабельностью, и по этому параметру ОД были сходны с извивающимися движениями детей, родившихся в срок. Впоследствии, в возрасте, когда движения переходят в стадию “беспокойные”, никаких значимых различий в параметрах ЭМГ при ОД у доношенных и здоровых недоношенных младенцев не наблюдается.
S. Miyagishima et al. [62] провели сравнительный количественный анализ антигравитационной составляющей ОД, выраженной в способности младенцев поднимать и разводить конечности в вертикальной плоскости, в которой активируются экстензорные мышцы, у недоношенных младенцев с низким весом при рождении, но без повреждений ЦНС в перинатальный период и у доношенных младенцев. Было показано, что в первые три месяца скорректированного возраста движения конечностей, совершаемые антигравитационными мышцами, у недоношенных младенцев менее развиты по сравнению с их доношенными сверстниками, однако параметры антигравитационной составляющей движений сильно коррелируют с паттерном ОД. У недоношенных с бедным репертуаром ОД руки и ноги во время движений были чаще и более широко разведены в стороны, а высота поднятия конечностей относительно тела была существенно меньше, чем у таких же недоношенных детей, но с нормальным паттерном ОД. При этом в три месяца скорректированного возраста у детей, как недоношенных, так и доношенных, с нормальным паттерном ОД исследуемые антигравитационные параметры были сходными. Авторы предположили, что отставание в двигательном развитии недоношенных младенцев может быть связано не с недоношенностью как таковой, а с неврологическими дисфункциями.
Методы оценки общих движений
Оценка ОД – важнейший инструмент, который может предсказать нарушения движений у младенцев высокого риска. Одним из самых простых и доступных методов оценки таких движений является систематическое наблюдение за поведением лежащего на спине ребенка одним или несколькими опытными наблюдателями с использованием видеорегистрации с последующей оценкой их качества [11, 39]. Для оценки ОД требуется, чтобы ребенок лежал от 2 до 10 мин в спокойном состоянии, поскольку плач ребенка всегда влияет на качество движений (беспокойные движения исчезают, наблюдается увеличение тонической и пачечной мышечной активности [21]). Показано, что описанный метод надежно предсказывает ДЦП у младенцев высокого риска с чувствительностью 98% и специфичностью 95% [63]. Для сравнения, метод магнитно-резонансной томографии (МРТ) предсказывает ДЦП с чувствительностью 86% и специфичностью 89%, и часто не диагностирует нарушения у детей с мягкой формой этого заболевания [64, 65]. Подобный метод оценки ОД является самым распространенным в настоящее время, тем не менее, результаты оценки зависят от опыта клинициста, который оценивает ОД, субъективности интерпретации, а также от состояния ребенка.
C. Einspieler et al. разработали оптимальную шкалу оценки ОД [57]. Согласно этой шкале, отдельно визуально оцениваются движения шеи и туловища (максимальная оценка – 4), верхних конечностей (максимальная оценка – 18) и нижних конечностей (максимальная оценка – 18). Более высокая оценка (максимальная суммарная оценка – 42) соответствует более правильному паттерну движений. Все ОД были поделены на четыре категории: нормальные (медиана – 39) (движения последовательные, амплитуда, скорость и интенсивность вариабельны), бедный репертуар движений (медиана – 25) (последовательность движений монотонна, амплитуда скорость и интенсивность ненормальной вариабельности), резкие синхронизированные ОД (медиана – 12) (не имеют обычной гладкости и кажутся ригидными, так как мышцы конечностей и туловища сокращаются почти одновременно и расслабляются почти одновременно) и “хаотичные ОД” (медиана – 14) (амплитуда большая, а скорость высокая; движения постоянно кажутся резкими). При использовании этой шкалы движения оптимально оценивать в возрасте от рождения до 5 нед. после рождения.
Недавно исследователи ОД из разных стран и континентов объединились и провели длительное обследование большого количества детей (468 чел.), которым впоследствии был поставлен диагноз ДЦП различной степени тяжести [36]. В возрасте 3–5 мес., в период “беспокойных” движений младенцев, была проведена расширенная оценка двигательного репертуара (выраженная в баллах), и включающая в себя оценку качества ОД по H.F. Prechtl, оценку антигравитационных движений и позных паттернов. Было показано, что такая оценка позволяет не только прогнозировать ДЦП, но и включает в себя раннее предсказание вида этого заболевания (спастический, дискинетический, атаксический, гипотонический) и степени двигательных нарушений. Было установлено, что степень развития больших моторных функций, оцененная по шкале Gross Motor Function Classification Sistem (GMFCS) [66], сильно коррелирует с суммарным количеством баллов, полученным при расширенной оценке движений ребенка в возрасте 3–5 мес. Кроме того, были выделены некоторые двигательные паттерны, такие как атипичное выгибание позвоночника, судорожно-синхронизированные движения, которые оказались напрямую связаны с более тяжелыми двигательными нарушениями (уровни III–V по GMFCS). Было также выявлено, что асимметричные двигательные паттерны ОД надежно предсказывают возникновение односторонних поражений при ДЦП, а круговые движения рук связаны с развитием дискинетических форм ДЦП.
Несмотря на высокую надежность, визуальная оценка ОД занимает много времени, опирается исключительно на опыт клинициста и субъективна. В настоящее время все большую популярность приобретают методы регистрации и анализа ОД, сфокусированные на длительной, объективной и количественной оценке [67]. Исследования ведутся в направлении распознавания и анализа движений конечностей через автоматизированные методы. Распознавание движений в клинических приложениях означает автоматическое обнаружение, классификацию и оценку качества движений конечностей, фокусируясь на выявлении отклонений от нормы. Используются системы пространственного захвата и видеоанализа движений, а также беспроводные датчики, установленные на теле младенца [45, 60, 68]. Такие датчики предоставляют точные данные о кинематике движений человека, часто в сочетании с физиологическими данными. На основе 3-мерной регистрации движений с использованием системы видеозахвата L. Meinecke et al. [13] разработали метод объективной оценки двигательной активности у младенцев первых месяцев жизни. Из записанных данных о движениях они извлекли 53 количественных параметра и определили их 8 оптимальных комбинаций, которые позволили надежно выявлять различия между здоровыми детьми и детьми, находящимся в группе риска. N. Kanemaru et al. [69] на основе видеоанализа движений предложили метод оценки ОД для предсказания развития ДЦП у недоношенных детей, используя индекс подергивания конечностей (вычисленный как временнóй интеграл квадрата величины подергивания (скорость изменения ускорения) на единицу движения). С помощью компьютерного анализа видеорегистрации ОД у недоношенных детей на момент, соответствующий гестационному возрасту 36–44 нед. (гестационный возраст рождения доношенного ребенка), они проанализировали данные 145 младенцев и показали, что этот индекс у детей, у которых впоследствии развился ДЦП (подтвержденный в возрасте 3 лет) был существенно выше, чем в группе младенцев, развивающихся впоследствии без отклонений. Используя данные видеоанализа, S. Miyagishima et al. исследовали параметры антигравитационных движений конечностей (ширину разведения и высоту поднятия рук и ног) у недоношенных младенцев с низким весом при рождении в 3 мес. скорректированного возраста и обнаружили сильную корреляцию между этими параметрами и большими моторными функциями ребенка в возрасте 6–12 мес. [58, 70]. Тем не менее, системы видеозахвата очень дорогие, должны быть установлены в контролируемой среде, требуют калибровки и установки датчиков на теле ребенка, а также экспертов для углубленного анализа и интерпретации зарегистрированных данных.
Типичные методы для автоматизированного анализа данных включают в себя последовательное вероятностное моделирование, например, с использованием подходов Марковиана [71], статистических методов моделирования специфических телодвижений [65, 72]. Первые попытки автоматизированной оценки ОД без установки датчиков была предпринята L. Adde et al. [47, 73] с использованием метода вычитания фона и дифференциации фрагментов. Программное обеспечение вычисляло различия в изменениях параметров пикселей между последующими видеофрагментами и экспортировало переменные движения, отражая количество движений и распределение движений ребенка на видео. Метод показал 81% чувствительности и 70% специфичности для выявления ДЦП. С использованием этого метода были также определены количественные различия между извивающимися и беспокойными движениями и показано, что вариабельность перемещения пространственного центра движений младенца была ниже при беспокойных движениях, чем при извивающихся [14]. В других исследованиях с использованием метода смещения оптического потока была получена более точная информация о скорости и направлении движений конечностей [74, 75]. Подобная количественная оценка кинематических особенностей движений позволила разработать алгоритмы классификации движений и разделить ОД на типичные и атипичные [76]. Результаты такой классификации показали до 92% точности в прогнозировании ДЦП.
Первое использование трехмерной акселерографии в клинической практике у недоношенных детей было применено S. Ohgi et al. [77]. Миниатюрные беспроводные акселерометры, укрепленные на теле младенца, измеряли ускорение верхних конечностей у недоношенных младенцев с и без поражений мозга в скорректированном возрасте 1 мес. У детей с повреждениями головного мозга наблюдались нестабильные и непредсказуемые ОД с большим количеством степеней свободы. В дальнейшем была разработана модель для автоматического, с использованием методов машинного обучения, определения атипичных паттернов двигательной активности, таких как резко-синхронизированные движения [78]. Исследование было признано успешным, атипичные движения определялись с точностью 70–90%. F. Heinze et al. [79] на основе метода акселерометрии разработали классификатор для выявления различий между нормальными и атипичными движениями, и апробировали метод на 19 здоровых младенцах и 4 детях, с поражением нервной системы. Уровень распознавания патологических движений достигал 88–92%. Однако авторы отмечают, что было исследовано лишь небольшое количество младенцев с поражениями нервной системы, и необходимы дальнейшие исследования на большой выборке детей.
Таким образом, наряду с общепризнанным методом H.F. Prechtl визуальной оценки ОД [11, 36, 56], компьютерная оценка ОД и анализ полученных данных может облегчить труд врачей и способствовать выявлению аномального двигательного развития как можно раньше. Использование компьютерного зрения и акселерометрии может предложить перспективные методы объективного измерения качества и количества движений младенца. Применение этих технологий может оказаться полезным не только для выявления младенцев с высоким риском развития двигательных нарушений, но и для оценки методов лечения, направленных на воздействие на развивающийся мозг.
ЗАКЛЮЧЕНИЕ
Общие движения являются индикатором функциональной целостности ЦНС новорожденных. Некоторый ненормальный паттерн их выражения связан с бедным неврологическим выходом, предполагая, что оценка ОД – важный инструмент для диагностики перинатальных поражений мозга. Раннее выявление младенцев, которые имеют риск возможного неблагоприятного исхода развития нервной системы, требует методов оценки, которые приведут к раннему вмешательству, чтобы минимизировать нарушения развития и максимизировать потенциал развития младенца [80, 81], поскольку существуют доказательства положительного эффекта раннего вмешательства, особенно в тот период, когда мозг наиболее пластичен и подвержен изменениям [51, 82–85]. Однако из-за большого количества сложных факторов, влияющих на развитие нервной системы, и сложности в оценке пластичности головного мозга, прогнозировать, у кого из детей будет развиваться ДЦП на основе одной оценки, всегда будет сложно. Наилучшим выбором будет комбинация методов диагностики: неврологическая оценка, оценка ОД и нейровизуализация, что, вероятно, улучшит как положительное, так и отрицательное предсказание.
Финансирование работы. Работа осуществлялась при поддержке РФФИ (грант № 18-015-00187).
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Disselhorst-Klug C., Heinze F., Breitbach-Faller N. et al. Introduction of a method for quantitative evaluation of spontaneous motor activity development with age in infants // Exp. Brain Res. 2012. V. 218. № 2. P. 305.
Luchinger A.B., Hadders-Algra M., Van Kan C.M., De Vries J.I.P. Fetal onset of general movements // Pediatr. Res. 2008. V. 63. № 2. P. 191.
Kurjak A., Tikvica A., Stanojevic M. et al. The assessment of fetal neurobehavior by three-dimensional and four-dimensional ultrasound // J. Matern. Fetal Neonatal Med. 2008. V. 21. № 10. P. 675.
Hadders-Algra M. Neural substrate and clinical significance of general movements: an update // Dev. Med. Child. Neurol. 2018. V. 60. № 1. P. 39.
Prechtl H.F., Fargel J.W., Weinmann H.M., Bakker H.H. Postures, motility and respiration of low-risk pre-term infants // Dev. Med. Child. Neurol. 1979. V. 21. № 1. P. 3.
Prechtl H.F., Hopkins B. Developmental transformations of spontaneous movements in early infancy // Early Hum Dev. 1986. V. 14. № 3–4. P. 233.
Amiel-Tison C., Grenier A. Neurological assessment during the first year of life. N.Y.; Oxford: Oxford Univ. Press, 1986. V. 5. P. 88.
Hadders-Algra M. Early human motor development: From variation to the ability to vary and adapt // Neurosci. Biobehav. Rev. 2018. V. 90. P. 411.
Hadders-Algra M., Prechtl H.F.R. Developmental course of general movements in early infancy. I. Descriptive analysis of change in form // Early Hum. Dev. 1992. V. 28. № 3. P. 201.
Hopkins B., Prechtl H.F.R. A qualitative approach to the development of movements during early infancy / Continuity of Neural Functions Form Prenatal to Postnatal Life // Ed. Prechtl H.F.R. Clin. Dev. Med. № 94. Oxford: Blackwell Scientific Publications, 1984. P. 179.
Ferrari F., Frassoldati R., Berardi A. et al. The ontogeny of fidgety movements from 4 to 20 weeks post-term age in healthy full-term infants // Early Hum. Dev. 2016. V. 103. P. 219.
Einspieler C. Abnormal spontaneous movements in infants with repeated sleep apneas // Early Hum. Dev. 1994. V. 36. № 1. P. 31.
Meinecke L., Breitbach-Faller N., Bartz C. et al. Movement analysis in the early detection of newborns at risk for developing spasticity due to infantile cerebral palsy // Hum. Mov. Sci. 2006. V. 25. № 2. P. 125.
Adde L., Yang H., Sæther R. et al. Characteristics of general movements in preterm infants assessed by computer-based video analysis // Physiother. Theory Pract. 2018. V. 34. № 4. P. 286.
Зарипова Ю.P., Соколов А.Л., Мейгал А.Ю. Активность двигательных единиц у здоровых детей на первом году жизни // Детская больница. 2011. Т. 45. № 3. С. 23.
Зарипова Ю.P., Мейгал А.Ю. Характеристика поверхностной электромиограммы у доношенных и недоношенных детей в неонатальном периоде: возможное влияние гравитации // Физиология человека. 2018. Т. 44. № 4. С. 74. Zaripova Yu.R., Meigal A.Yu. Parameters of Surface Electromyograms in Full-Term and Preterm Infants in the Neonatal Period: The Possible Contribution of Gravity // Human Physiol. 2018. V. 44. № 4. P. 436.
Hakamada S., Hayakawa F., Kuno K., Tanaka R. Development of the monosynaptic reflex pathway in the human spinal cord // Brain Res. 1988. V. 470. № 2. P. 239.
Vecchierini-Blineau M.F., Guiheneuc P. Excitability of the monosynaptic reflex pathway in the child from birth to four years of age // J. Neurol. Neurosurg. Psychiatry. 1981. V. 44. № 4. P. 309.
O’Sullivan M.C., Eyre J.A., Miller S. Radiation of phasic stretch reflex in biceps brachii to muscles of the arm in man and its restriction during development // J. Physiol. 1991. V. 439. P. 529.
Koh T., Eyre J.A. Maturation of corticospinal tracts assessed by electromagnetic stimulation of the motor cortex // Arch. Dis. Child. 1988. V. 63. № 11. P. 1347.
Hadders-Algra M., Van Eykern L.A., Klip-Van A.W.J. et al. Developmental course of general movements in early infancy. II. EMG correlates // Early Hum. Dev. 1992. V. 28. № 3. P. 231.
Thelen E., Fisher D.M. The organization of spontaneous leg movements in newborn infants // J. Mot. Behav. 1983. V. 15. № 2. P. 353.
Geertsen S., Willerslev-Olsen M., Lorentzen J., Nielsen J.B. Development and aging of human spinal cord circuitries // J. Neurophysiol. 2017. V. 118. № 2. P. 1133.
Okado N. Development of the human cervical spinal cord with reference to synapse formation in the motor nucleus // J. Comp. Neurol. 1980. V. 191. № 3. P. 495.
Kostovic I., Sedmak G., Vuksic M., Judas M. The relevance of human fetal subplate zone for developmental neuropathology of neuronal migration disorders and cortical dysplasia // CNS Neurosci. Ther. 2015. V. 21. № 2. P. 74.
Marvın-Padilla M. The mammalian neocortex new pyramidal neuron: a new conception // Front. Neuroanat. 2014. V. 7. P. 51.
Kostovic I., Judas M. Transient patterns of cortical lamination during prenatal life: do they have implications for treatment? // Neurosci. Biobehav. Rev. 2007. V. 31. № 2. P. 1157.
Van Kan C.M., De Vries J.I., Luchinger A.B. et al. Ontogeny of fetal movements in the guinea pig // Physiol. Behav. 2009. V. 98. № 3. P. 338.
Visser G.H., Laurini R.N., de Vries J.I. et al. Abnormal motor behaviour in anencephalic fetuses // Early Hum. Dev. 1985. V. 12. № 2. P. 173.
Andonotopo W., Kurjak A., Kosuta M.I. Behavior of an anencephalic fetus studied by 4D sonography // J. Matern. Fetal Neonatal. Med. 2005. V. 17. № 2. P. 165.
Schopf V., Kasprian G., Brugger P.C., Prayer D. Watching the fetal brain at ‘rest’ // Int. J. Dev. Neurosci. 2012. V. 30. № 1. P. 11.
Krmpotic-Nemanic J., Kostovic I., Bogdanovic N. et al. Cytoarchitectonic parameters of developmental capacity of the human associative auditory cortex during postnatal life // Acta Oto-Laryngologica 1988. V. 105. № 5–6. P. 463.
Molnár Z., Clowry G.J., Šestan N. et al. New insights into the development of the human cerebral cortex // J. Anat. 2019. V. 235. № 3. P. 432.
Leighton A.H., Lohmann C. The wiring of developing sensory circuits – from patterned spontaneous activity to synaptic plasticity mechanisms // Front. Neural. Circuits. 2016. V. 10. P. 71.
Ritterband-Rosenbaum A., Herskind A., Li X. A critical period of corticomuscular and EMG-EMG coherence detection in healthy infants aged 9–25 weeks // J. Physiol. 2017. V. 595. № 8. P. 2699.
Einspieler C., Arend F. Bos A.F. et al. Cerebral Palsy: Early Markers of Clinical Phenotype and Functional Outcome // J. Clin. Med. 2019. V. 8. № 10. P. 1616.
Hadders-Algra M. Early diagnosis and early intervention in cerebral palsy // Front. Neurol. 2014. V. 5. P. 185.
Ferrari F., Todeschini A., Guidotti I. General movements in full-term infants with perinatal asphyxia are related to basal ganglia and thalamic lesions // J. Pediatr. 2011. V. 158. № 8. P. 904.
Ferrari F., Cioni G., Prechtl H.F. Qualitative changes of general movements in preterm infants with brain lesions // Early Hum Dev. 1990. V. 23. № 3. P. 193.
Prechtl H.F., Einspieler C., Cioni G. et al. An early marker for neurological deficits after perinatal brain lesions // Lancet. 1997. V. 349. № 9062. P. 1361.
Ferrari F., Cioni G., Einspieler C. et al. Cramped synchronized general movements in preterm infants as an early marker for cerebral palsy // Arch Pediatr Adolesc Med. 2002. V. 156. № 5. P. 460.
Ferrari F., Prechtl H.F., Cioni G. et al. Posture, spontaneous movements, and behavioural state organisation in infants affected by brain malformations // Early Hum Dev. 1997. V. 50. № 1. P. 87.
Bos A.F., van Asperen R.M., de Leeuw D.M., Prechtl H.F.R. The influence of septicaemia on spontaneous motility in preterm infants // Early Hum. Dev. 1997. V. 50. № 1. P. 61.
Einspieler C., Cioni G., Paolicelli P.B. et al. The early markers for later dyskinetic cerebral palsy are different from those for spastic cerebral palsy // Neuropediatrics. 2002. V. 33. № 2. P. 73.
Karch D., Kang K.S., Wochner K. et al. Kinematic assessment of stereotype in spontaneous movements in infants // Gait Posture. 2012. V. 36. № 2. P. 307.
Philippi H., Karch D., Kang K.S. et al. Computer-based analysis of general movements reveals stereotypies predicting cerebral palsy // Dev. Med. Child Neurol. 2014. V. 56. № 10. P. 960.
Adde L., Helbostad J.L., Jensenius A.R. et al. Using computer-based video analysis in the study of fidgety movements // Early Hum. Dev. 2009. V. 85. № 9. P. 541.
Adde L., Helbostad J.L., Jensenius A.R. et al. Early prediction of cerebral palsy by computer-based video analysis of general movements: A feasibility study // Dev. Med. Child Neurol. 2010. V. 52. № 8. P. 773.
Spittle A.J., Orton J. Cerebral palsy and developmental coordination disorder in children born preterm // Semin Fetal Neonatal Med. 2014. V. 19. № 2. P. 84.
Fjørtoft T., Grunewaldt K.H., Løhaugen G.C.C. et al. Assessment of motor behaviour in high-risk-infants at 3 months predicts motor and cognitive outcomes in 10 years old children // Early Hum. Dev. 2013. V. 89. № 10. P. 787.
Spittle A., Orton J., Anderson P.J. et al. Early developmental intervention programmes provided post hospital discharge to prevent motor and cognitive impairment in preterm infants // Cochrane Database Syst. Rev. 2015. № 11. https://doi.org/10.1002/14651858.CD005495.pub4
Cioni G., Prechtl H.F. Preterm and early postterm motor behaviour in low-risk premature infants // Early Hum. Dev. 1990. V. 23. № 5. P. 159.
Snider L.M., Majnemer A., Mazer B. et al. A comparison of the general movements assessment with traditional approaches to newborn and infant assessment: concurrent validity // Early Hum. Dev. 2008. V. 84. № 5. P. 297.
Ma L., Yang B., Meng L. et al. Effect of early intervention on premature infants’ general movements // Brain Dev. 2015. V. 37. № 4. P. 387.
Nakajima Y., Einspieler C., Marschik P.B. et al. Does a detailed assessment of poor repertoire general movements help to identify those infants who will develop normally? // Early Hum. Dev. 2006. V. 82. № 1. P. 53.
Einspieler C., Prechtl H.F. Prechtl’s assessment of general movements: a diagnostic tool for the functional assessment of the young nervous system // Ment. Retard. Dev. Disabil. Res. Rev. 2005. V. 11. № 1. P. 61.
Einspieler C., Marschik P.B., Pansy J. et al. The general movement optimality score: a detailed assessment of general movements during preterm and term age // Dev. Med. Child Neurol. 2015. V. 58. № 4. P. 361.
Zorzenon R.F.M., Takaara L.K., Linhares M.B. General spontaneous movements in preterm infants differentiated by post-conceptional ages // Early Hum. Dev. 2019. V. 134. P. 1.
Spittle A.J., Walsh J., Olsen J.E. et al. Neurobehaviour and neurological development in the first month after birth for infants born between 32–42 week’ gestation // Early Hum. Dev. 2016. V. 96. P. 7.
Bultmann C.S., Orlikowsky T., Häusler M. et al. Spontaneous movements in the first four months of life: An accelerometric study in moderate and late preterm infants // Early Hum. Dev. 2019. V. 130. P. 1.
Hadders-Algra M. General movements in early infancy: what do they tell us about the nervous system? // Early Hum. Dev. 1993. V. 34. № 1. P. 29.
Miyagishima S., Asaka T., Kamatsuka K. et al. Characteristics of antigravity spontaneous movements in preterm infants up to 3 months of corrected age // Infant Behav. Dev. 2016. V. 44. P. 227.
Bosanquet M., Copeland L., Ware R., Boyd R. A systematic review of tests to predict cerebral palsy in young children // Dev. Med. Child. Neurol. 2013. V. 55. № 5. P. 418.
Herskind A., Greisen G., Nielsen J. Early identification and intervention in cerebral palsy // Dev. Med. Child. Neurol. 2014. V. 57. № 1. P. 29.
Prechtl H.F. Qualitative changes of spontaneous movements in fetus and preterm infant are a marker of neurological dysfunction // Early Hum. Dev. 1990. V. 23. № 3. P. 151.
Palisano R.J., Rosenbaum P., Walter S. et al. Development and reliability of a system to classify gross motor function in children with cerebral palsy // Dev. Med. Child Neurol. 1997. V. 39. № 4. P. 214.
Marcroft C., Khan A., Embleton N.D. et al. Movement recognition technology as a method of assessing spontaneous general movements in high risk infants // Front. Neurol. 2015. V. 5. P. 284.
Ohgi S., Morita S., Kek K.L., Mizuike C. A dynamical systems analysis of spontaneous movements in newborn infants // J. Mot. Behav. 2007. V. 39. № 3. P. 203.
Kanemaru N., Watanabe H., Kihara H. et al. Jerky spontaneous movements at term age in preterm infants who later developed cerebral palsy // Early Hum. Dev. 2014. V. 90. № 8. P. 387.
Miyagishima S., Asaka T., Kamatsuka K. et al. Spontaneous movements of preterm infants is associated with outcome of gross motor development // Brain Dev. 2018. V. 40. № 8. P. 627.
Moeslund T.B., Granum E. A survey of computer vision-based human motion capture // Comput. Vis. Image Underst. 2001. V. 81. № 3. P. 231.
Waldmeier S., Grunt S., Delgado-Eckert E. et al. Correlation properties of spontaneous motor activity in healthy infants: a new computer-assisted method to evaluate neurological maturation // Exp. Brain Res. 2013. V. 227. № 4. P. 433.
Rahmati H., Aamo O.M., Stavdahl Ø. et al. Video-based early cerebral palsy prediction using motion segmentation // Conf. Proc. IEEE Eng. Med. Biol. Soc. 2014. V. 2014. P. 3779.
Stahl A., Schellewald C., Stavdahl Ø. et al. An Optical Flow Based Method to Predict Infantile Cerebral Palsy // IEEE Trans. Neural. Syst. Rehab. Eng. 2012. V. 20. № 4. P. 605.
Støen R., Songstad N.T., Silberg I.E. et al. Computer-based video analysis identifies infants with absence of fidgety movements // Pediatr. Res. 2017. V. 82. № 4. P. 740.
Orlandi S., Raghuram K., Smith C.R. et al. Detection of Atypical and Typical Infant Movements using Computer-based Video Analysis // Conf. Proc. IEEE Eng. Med. Biol. Soc. 2018. V. 2018. P. 3598.
Ohgi S., Morita S., Loo K.K., Mizuike C. Time series analysis of spontaneous upper-extremity movements of premature infants with brain injuries // PhysTher. 2008. V. 88. № 9. P. 1022.
Mingming F., Dana G., Dan M.C., Donald J.P. Augmenting gesture recognition with erlang-cox models to identify neurological disorders in premature babies / Inter. Joint Conf. on Perv. and Ubi-Comp. Pittsburgh, Pennsylvania, US Sep. 5–8. 2012. P. 411. https://doi.org/10.1145/2370216.2370278
Heinze F., Hesels K., Breitbach-Faller N. et al. Movement analysis by accelerometry of newborns and infants for the early detection of movement disorders due to infantile cerebral palsy // Med. Biol. Eng. Comput. 2010. V. 48. № 8. P. 765.
Cerebral Palsy in Infancy: Targeted Activity to Optimize Early Growth and Development / Ed. Shepherd R.B. London: Churchill Livingstone Elsevier, 2013. 356 p.
Morgan C., Darrah J., Gordon A.M. et al. Effectiveness of motor interventions in infants with cerebral palsy: a systematic review // Dev. Med. Child Neurol. 2016. V. 58. № 9. P. 900.
Eyre J. Corticospinal tract development and activity dependent plasticity / Cerebral Palsy in Infancy // Ed. Shepherd R. Oxford, England: Elsevier, 2014. P. 53.
Herskind A., Greisen G., Nielsen J.B. Early identification and intervention in cerebral palsy // Dev. Med. Child Neurol. 2015. V. 57. № 1. P. 29.
Hadders-Algra M. Early diagnosis and early intervention in cerebral palsy // Front Neurol. 2014. V. 24. № 5. P. 185.
Hutchon B., Gibbs D., Harniess P. et al. Early intervention programmes for infants at high risk of atypical neurodevelopmental outcome // Dev. Med. Child Neurol. 2019. V. 61. № 12. P. 1362.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


