Физиология человека, 2020, T. 46, № 4, стр. 44-51
Модуляция кровотока в коже ног человека при чрескожной электростимуляции спинного мозга
Г. И. Лобов 1, *, Ю. П. Герасименко 1, Т. Р. Мошонкина 1
1 ФГБУН Институт физиологии имени И.П. Павлова РАН
Санкт-Петербург, Россия
* E-mail: LobovGI@infran.ru
Поступила в редакцию 20.01.2020
После доработки 05.02.2020
Принята к публикации 20.03.2020
Аннотация
У 12 здоровых волонтеров методом лазерной допплеровской флоуметрии зарегистрировали изменения кровоснабжения кожи передне-латеральной поверхности голени при чрескожной электростимуляции спинного мозга (ЧЭССМ) подпороговыми биполярными стимулами частотой 30 Гц. Установлено, что ЧЭССМ в области позвонков Т7 и L1 приводит к значительному увеличению кожного кровотока. При интенсивности стимулов 90% от двигательного порога прирост перфузии кожи при стимуляции в области L1 составил около 74%, а при стимуляции в области Т7 – 38% по отношению к исходному уровню. Можно полагать, что вазодилатация и гиперемия кожи при ЧЭССМ обусловлены преимущественно за счет антидромной стимуляции сенсорных нервных волокон. Важным модулятором, способствующим вазодилатации при ЧЭССМ, является оксид азота (NO), выделяющийся из нервных окончаний и слоя эндотелиальных клеток. Ингибирование цистатионин-γ-лиазы достоверно снижает прирост кровотока в коже при ЧЭССМ. Таким образом, установлено, что в процесс вазодилатации в коже при ЧЭССМ наряду с NO вовлечен H2S.
Спинальный уровень регуляции сосудистого тонуса является критическим для регулирования метаболизма органов и тканей, для функционирования сердечно-сосудистой системы (ССС) в целом. В грудном и поясничном отделах спинного мозга расположены центры симпатической нервной системы, иннервирующие гладкомышечные клетки сосудов, а также модулирующие активность нейронов шейных узлов, влияющие на работу сердца. Травма спинного мозга у человека сопровождается выраженными множественными нарушениями функций ССС: гипотензией, гипотермией, дисрегуляцией коронарного кровотока, ортостатической гипотонией, нарушениями кровообращения в коже [1].
Экспериментальные исследования спинальных механизмов регуляции периферического кровообращения у человека, как правило, проводят исключительно в клинических условиях, с участием пациентов. До недавних пор такие исследования с участием здоровых людей были недоступны по этическим причинам. Разработка метода чрескожной электрической стимуляции спинного мозга (ЧЭССМ) человека [2] сняла это ограничение, так как важнейшим достоинством этого метода является абсолютная неинвазивность и, как следствие, отсутствие инфекционных и аппаратных осложнений [3]. Доказано, что ЧЭССМ избирательно воздействует на нейронные сети на разных уровнях спинного мозга [4].
Ранее мы исследовали механизмы регуляции периферического кровотока у человека, в которые вовлечены нейронные сети поясничного отдела спинного мозга. Для этого применяли ЧЭССМ на уровне позвонков T11–T12 и L1–L2 и регистрировали кровоток в коже пальцев стопы и коже голени [5, 6]. Кожа как ткань для оценки эффектов ЧЭССМ на кровоток была выбрана не только из-за удобства исследования, но и потому, что в коже представлены все виды регуляции микроциркуляторного кровотока и достаточно хорошо изучены местные механизмы его модуляции [7]. В частности, было доказано, что в дилатации сосудов кожи при электростимуляции спинного мозга принимает участие оксид азота (NO) [6, 8]. Однако в настоящее время не решен вопрос с источником этого NO: пока нет убедительного ответа на вопрос – NO имеет нейрональное или эндотелиальное происхождение?
В последние годы показано, что помимо NO, важную роль в модуляции кровотока в коже играет сероводород (H2S), являющийся сильным вазодилататором [9]. В стенке кожных сосудов найдены два фермента, продуцирующие H2S – цистатионин-γ-лиаза и 3-меркаптопируватсульфуртрансфераза. Эти ферменты локализованы в цитозоле или в митохондриях клеток кровеносных сосудов [10]. Помимо этого, уровень H2S в коже также может быть повышен неферментативно из различных форм хранения серы, таких как тиосульфат, тиоцистеин и сульфит [10]. К тому же, стало известно, что между этими двумя газотрансмиттерами (NO и H2S) существуют сложные взаимоотношения, способные увеличивать или уменьшать вазодилатационный эффект [9].
Было показано, что электрическая стимуляция спинного мозга на поясничном уровне [11] и на грудном уровне [12] вызывает одинаковый сосудодвигательный эффект у пациентов с травмой спинного мозга – предотвращает ортостатическую гипотензию, нормализует кровообращение в магистральных сосудах головного мозга. Одной из наших задач было сравнить спинальные механизмы регуляции периферического кровообращения у человека, реализованные на поясничном и грудном уровне.
Исходя из описанного, в данном исследовании были поставлены следующие задачи: 1) изучить у здоровых добровольцев особенности реакций микроциркуляторного русла кожи голени при ЧЭССМ сегментов, расположенных на разных уровнях спинного мозга: в грудном отделе (уровень позвонков Т7–Т8) и в поясничном отделе (уровень позвонков L1–L2), 2) определить источник(и) NO в коже, способствующий вазодилатации и гиперемии при ЧЭССМ, и 3) изучить роль H2S в ЧЭССМ-индуцируемой кожной гиперемии.
МЕТОДИКА
Исследование выполняли на 12 добровольцах в возрасте 24–45 лет (7 мужчин, 5 женщин). Все испытуемые были здоровыми, не имели сердечно-сосудистых или метаболических заболеваний, не принимали какие-либо лекарственные препараты и не курили в течение последних суток. В помещении, в котором проводили исследование, поддерживали температуру 22–23°С.
Стимулирующие электроды (катоды) располагали накожно, по средней линии позвоночника, на двух уровнях между остистыми отростками соседних позвонков Т7–Т8 (далее уровень Т7) и L1–L2 (далее уровень L1), аноды помещали над гребнями подвздошных костей. Техника проведения ЧЭССМ и применяемое оборудование были подробно описаны ранее [6]. На первом этапе определяли минимальную интенсивность тока, вызывающего двигательные ответы в мышцах ног на одиночные монополярные импульсы длительностью 1 мс при стимуляции каждого из двух уровней спинного мозга – двигательный порог (ДП). У разных испытуемых ДП составлял от 45 до 110 мА. Для определения двигательного ответа использовали метод поверхностной электромиографии (ЭМГ). Регистрировали активность m. biceps femoris, m. rectus femoris, m. gastrocnemius lateralis и m. tibialis anterior на обеих ногах. Для регистрации ЭМГ-активности использованы электроды H124SG (Covidien-ARBO-Kendall, Германия), комплекс A-M Systems (AM-Systems Inc., США) и программное обеспечение Lab Chart (ADInstruments, США).
После определения ДП с помощью многофункционального лазерного диагностического комплекса ЛАКК М (LAZMA, Россия) определяли показатель микроциркуляции (ПМ – поток крови (перфузия ткани кровью) в единицу времени в зондируемом объеме, измеряемый в перфузионных единицах, пф. ед.) – исходный уровень кровотока в коже передне-латеральной поверхности нижней трети голени. Лазерная допплеровская флоуметрия (ЛДФ) имеет целый ряд преимуществ по сравнению с другими методами при оценке кровотока в коже: сигнал является непрерывным, имеет хорошую временнýю разрешающую способность, область измерения очень маленькая (высокое пространственное разрешение), метод измеряет поток крови на небольшую глубину, т.е. только в коже, не затрагивая подкожные структуры с их специфическим кровоснабжением [7, 13]. После записи исходного кровотока регистрировали влияние на кровоток непрерывной ЧЭССМ на уровнях Т7 и L1. Использовали биполярные импульсы частотой 30 Гц, заполненные частотой 5 кГц, длительность серии – 1 мин. Применяли интенсивность тока величиной 30, 60 и 90% от индивидуального ДП.
В заключительной части работы исследовали механизмы регуляции кровотока, активируемые при ЧЭССМ. Применяли следующие вещества: 7-Nitroindazole (7-NI) (Sigma-Aldrich, США), являющийся селективным ингибитором нейрональной синтазы NO, и DL-Propargylglycine (PAG) (Sigma-Aldrich, США), являющийся необратимым ингибитором фермента цистатионин-γ-лиазы. 7-NI и PAG растворяли в дистиллированной воде. Препараты вводили в кожу ионофоретически, применяли аппарат для электрофореза “Элфор-Проф” (“Невотон”, Россия). Сила тока при ионофорезе составляла 1 мА, длительность ионофореза – 2 мин. Предварительно оценивали эффект ионофореза 0.9% раствора NaCl с указанной силой тока на кровоток в коже. Ионофорез 0.9% раствора NaCl на протяжении 2–3 мин не вызывал значимых изменений параметров кожного кровотока. По завершении ионофореза 7-NI или PAG проводили непрерывную ЧЭССМ по протоколу, использованному на втором этапе исследования. ЛДФ-грамму (запись кровотока в коже, осуществленная методом ЛДФ) регистрировали на протяжении 2 мин до ионофореза и на протяжении 1 мин после ионофореза 7-NI или PAG.
Для математической обработки ЛДФ-грамм применяли прилагаемое к комплексу ЛАКК-М стандартное программное обеспечение (версия 3.0.2.376). Для анализа амплитудно-частотных характеристик использовали вейвлет-преобразование, которое осуществлялось программой, поставляемой производителем в комплекте с прибором. Вейвлет-анализ ЛДФ-грамм позволяет оценить амплитуду колебаний кровотока в разных частотных диапазонах и рассчитать величины нейрогенного, миогенного или эндотелизависимого компонентов в общем тонусе исследуемых кровеносных сосудов кожи [13]. Статистическую обработку данных выполняли с помощью электронных таблиц “Microsoft Excel” и пакета прикладных программ “Statistica for Windows”, v.10. Результаты анализа представлены средними значениями данных (М) и величинами стандартной ошибки. Нормальность распределения полученных данных определяли по W-критерию Шапиро—Уилка. Оценку статистической значимости различий средних осуществляли на основе t-критерия Стьюдента. Статистически значимыми считали результаты при р < 0.05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
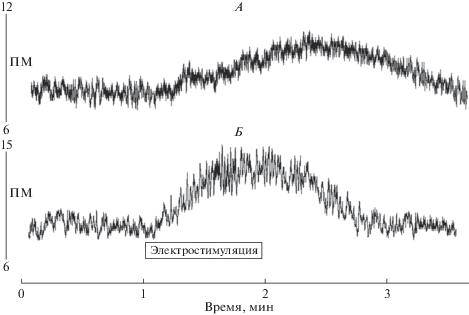
Непрерывная ЧЭССМ с амплитудой тока 30% от ДП сопровождалась относительно медленным и низкоамплитудным повышением ПМ в коже голени. При этой величине тока скорость повышения ПМ и его амплитуда при непрерывной ЧЭССМ на уровнях Т7 и L1 отличались незначительно. Увеличение стимулирующего тока до 60% от ДП приводило к возрастанию амплитуды увеличения ПМ кожи голени (табл. 1). При этом скорость повышения ПМ и его амплитуда при ЧЭССМ на уровне L1 были достоверно выше по сравнению с ЧЭССМ на уровне Т7. Максимальные изменения величины кровотока в коже голени были зарегистрированы при ЧЭССМ, составляющей 90% от ДП. Важно отметить, что при стимуляции на уровне L1 скорость прироста ПМ и его амплитуда были существенно выше по сравнению со скоростью, полученной при стимуляции СМ на уровне Т7. В то же время следует подчеркнуть, что у всех испытуемых при ЧЭССМ на уровне L1, несмотря на высокую скорость прироста ПМ, кровоток начинал снижаться сразу же после прекращения ЧЭССМ, а при ЧЭССМ на уровне Т7 увеличение кровотока в коже продолжалось еще 15–20 с после прекращения ЧЭССМ (рис. 1).
Таблица 1.
Показатель микроциркуляции (ПМ) в коже голени при непрерывной ЧЭССМ на уровне Т7 и L1
| Интенсивность ЧЭССМ | ПМ в покое, пф. ед. | ПМ, Т7, пф. ед. | ПМ, L1, пф. ед. |
|---|---|---|---|
| 30% ДП | 7.24 ± 0.37 | 8.02 ± 0.51 | 8.95 ± 0.43* |
| 60% ДП | 7.24 ± 0.37 | 8.77 ± 0.54* | 10.19 ± 0.53# |
| 90% ДП | 7.24 ± 0.37 | 9.97 ± 0.54# | 12.63 ± 0.62# |
Рис. 1.
Динамика показателя микроциркуляции (ПМ) в коже передне-латеральной части голени во время ЧЭССМ током интенсивностью 90% от ДП на протяжении 1 мин. А – стимуляция на уровне Т7, Б – стимуляция на уровне L1. ПМ представлен в перфузионных единицах (пф. ед.).
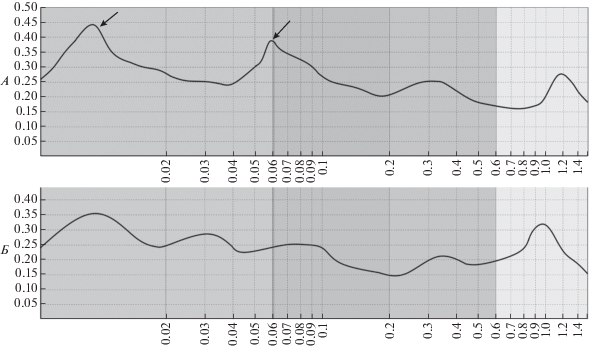
Обработка данных ЛДФ-грамм, записанных во время ЧЭССМ, посредством вейвлет-анализа показала выраженное увеличение амплитуды колебаний кровотока на частотах ~0.01 и ~0.06 Гц (рис. 2). Первая высокоамплитудная волна имеет эндотелиальное происхождение, а вторая вызвана активацией сенсорных нервных волокон [13]. При этом наиболее выраженные увеличение амплитуды колебаний в нейрогенном диапазоне были зарегистрированы при ЧЭССМ с амплитудой 90% ДП как при стимуляции в области L1, так и при стимуляции в области Т7.
Рис. 2.
Амплитудно-частотный спектр колебаний кровотока в коже голени пациента В. в покое (А) и при ЧЭССМ на уровне L1 (Б) с интенсивностью тока 90% от ДП. Стрелками указаны пики осцилляций с частотой ~0.01 Гц (эндотелиального генеза) и ~0.06 Гц (вызываемые при активации сенсорных нервов). По оси абсцисс – частота колебаний кровотока (Гц), по оси ординат – амплитуда колебаний (усл. ед.).
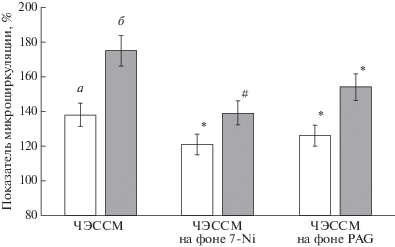
Вопрос о местных механизмах, способствующих вазодилатации при ЭССМ, как уже указывалось во введении, является сложным и недостаточно изученным. Что касается механизмов, активируемых в коже при ЧЭССМ, то такие сведения практически отсутствуют. С целью идентификации источника NO, выделяющегося в стенке кровеносных сосудов кожи при ЧЭССМ, применили селективный ингибитор нейрональной синтазы NO – 7NI. Результаты электростимуляции после ионофореза 7NI представлены на рис. 3. На этом же рисунке представлены данные о кровотоке при ЧЭССМ после ионофореза PAG. В обоих вариантах после применения ингибиторов прирост кровотока при ЧЭССМ достоверно снижался.
Рис. 3.
Изменения показателя микроциркуляции в коже передне-латеральной части голени во время ЧЭССМ током интенсивностью 90% от ДП после ионофореза ингибиторов. а – при стимуляции в области Т7, б – при стимуляции в области L1. ПМ представлен в % от исходного уровня в интактной коже. Различия достоверны: * – р < 0.05; # – р < 0.01.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как и в нашей предыдущей работе по изучению изменений кровотока в коже голени при ЧЭССМ поясничного отдела [6], в данном исследовании непрерывная ЧЭССМ подпороговыми стимулами сопровождалась возрастанием кровотока в коже голени, при этом степень прироста ПМ коррелировала с амплитудой применяемого тока. Поскольку в работе [6] стимулирующие электроды располагались на небольшом расстоянии относительно друг друга (Т11 и L1), то и результаты ЧЭССМ при стимуляции соседних участков спинного мозга отличались незначительно. В настоящем исследовании стимулирующие электроды были расположены достаточно далеко один от другого (Т7 и L1), поэтому при ЧЭССМ прирост кровотока в первой или второй области сильно отличались (табл. 1). При ЧЭС-СМ в области L1 током в 90% от ДП прирост кровотока составил 74% по отношению к исходному, в то время как при ЧЭССМ в области Т7 током такой же величины – только 38%. Можно полагать, что разница в реакциях системы кровоснабжения кожи объясняется тем, что стимулируя разные сегменты спинного мозга, мы влияли на разные отделы регуляции сосудистого кровотока. Симпатические нейроны, расположенные в ганглиях в области Т7 иннервируют преимущественно органы брюшной полости (нижней ее части) и малого таза и дают относительно небольшое количество нервных волокон, идущих к сосудам нижних конечностей. А симпатические нервные волокна (в т.ч. и холинергические) нижерасположенных ганглиев “соединяются с пояснично-крестцовым сплетением и распределяются по нижней конечности вдоль главных нервов, седалищного и бедренного, и от этого иннервация распространяется на сосуды бедра и голени” [14]. Аналогичное распределение наблюдается и в отношении сенсорных нервных волокон. Вследствие особенностей иннервации сосудов нижних конечностей эффект стимуляции нижерасположенных сегментов спинного мозга является более выраженным.
Вторая особенность, выявленная в процессе исследования – различия в скорости прироста ПМ при ЧЭССМ в области Т7 и L1. Однако ответить на вопрос: в чем причина различий в скорости нарастания ПМ и длительности увеличения кровотока при ЧЭССМ на уровне Т7 и L1 в настоящее время не представляется возможным. Необходима дополнительная специальная серия исследований.
Анализ литературных данных свидетельствует о том, что местные механизмы, приводящие к возрастанию кровотока в коже при ЭССМ и тепловом воздействии, изучены недостаточно [15, 16]. В нескольких исследованиях установлено, что часть рефлекторной вазодилатации в коже людей обусловлена выделением в окончаниях сенсорных нервов NO [17]. В то же время другие авторы в механизмах кожной рефлекторной вазодилатации отдают предпочтение роли эндотелиальной синтазы NO [18]. Ранее нами также была показана важная роль NO в увеличении кровотока в коже при ЧЭССМ. В предыдущей работе мы применяли L-NAME, являющейся неспецифическим ингибитором всех синтаз NO, что создавало определенные сложности в идентификации источника NO, образующегося при ЧЭССМ [6]. В данной работе, с целью определения роли нервов в образовании и выделении NO при ЧЭССМ, мы применяли 7-Nitroindazole, являющийся селективным ингибитором нейрональной синтазы NO. 7-NI вводили в кожу посредством электрофореза непосредственно перед ЧЭССМ и измерением кровотока. В коже, обработанной 7-NI, ЧЭССМ приводила к уменьшению скорости развития гиперемии, по сравнению с интактной кожей, амплитуда повышения ПМ также была ниже (рис. 2). Однако, если сравнивать уменьшение прироста ПМ при ЧЭССМ интенсивностью в 90% от ДП на фоне L-NAME [6] и на фоне 7-NI в одинаковых экспериментальных условиях, то хорошо видно, что L-NAME оказывал больший ингибирующий эффект на прирост ПМ при ЧЭС-СМ в области L1. L-NAME ингибирует оба вида синтаз NO и это приводит к уменьшению кровотока на ~40% относительно прироста при стимуляции 90% от ДП [6]. 7-NI, который селективно ингибирует только нейрональную синтазу, вызывает уменьшение кровотока на ~20% относительно прироста при 90% от ДП (рис. 2). Таким образом, можно заключить, что при ЧЭССМ NO, образующийся в стенке кровеносных сосудов, имеет как нейрогенное, так и эндотелиальное происхождение. Как известно, активация сенсорных нервов стимулирует выделение в нервных окончаниях нейронального NO и кальцитонин-ген родственного пептида (CGRP) [19], а последний может активировать эндотелиальную синтазу NO, как это было установлено в культуре некоторых тканей [20] и непосредственно в стенке микрососудов [21]. Возможно и прямое взаимодействие нейрональной и эндотелиальной синтаз NO, как это было показано в миокарде [22]. Блокада синтеза NO в наших экспериментах, как с помощью L-NAME, так и с 7-NI, лишь уменьшала величину ЧЭССМ-индуцированной вазодилатации в коже голени, но не отменяла ее, что подразумевает активацию при ЧЭССМ и других сигнальных путей, приводящих к релаксации гладкомышечных клеток сосудов кожи, вазодилатации и гиперемии.
В заключительной серии экспериментов мы протестировали гипотезу о том, что в реализации вазодилатационного эффекта ЧЭССМ может принимать участие H2S. Как уже говорилось ранее, H2S обнаружен во многих тканях и признан одним из газотрансмиттеров [23]. H2S имеет довольно низкий барьер для межклеточного транспорта и может хорошо выполнять функцию паракринной сигнальной молекулы. В последнее десятилетие было показано, что H2S оказывает множество физиологических эффектов на стенку сосуда. H2S вырабатывается сосудистыми клетками и обладает антиоксидантными, антиапоптотическими, противовоспалительными и вазоактивными свойствами [24].
Основным механизмом, посредством которого H2S влияет на активность сигнальных белков, является персульфидирование реакционно-способных остатков цистеина на белках-мишенях с образованием персульфидной группы (-SSH) [23]. В зависимости от природы целевого белка, влияние H2S может занять от нескольких секунд до нескольких дней. Например, персульфидирование AТФ-чувствительных К-каналов приводит к гиперполяризации и расслаблению клеток гладких мышц, что происходит в течение нескольких секунд. Признано, что основное действие H2S в сосудистой сети является сосудорасширяющим, хотя в ряде случаев был выявлен вазоконстрикторный эффект [25].
В нашем исследовании мы проводили ЧЭССМ после ионофореза в кожу голени DL-Propargylglycine, являющегося необратимым ингибитором цистатионин-γ-лиазы – основного фермента, продуцирующего H2S в сосудистой стенке. После ионофореза PAG амплитуда прироста ПМ была достоверно меньшей по сравнению с интактной кожей (рис. 3). Полученные данные, несомненно, свидетельствуют о вовлечении H2S в процесс вазодилатации при ЧЭССМ, однако объяснить активацию цистатионин-γ-лиазы при ЧЭССМ довольно сложно. В этом отношении чрезвычайно интересной является работа [23], в которой было показано, что доноры NO приводят к увеличению расслабления гладкой мускулатуры, вызванному H2S. Можно рассмотреть следующую гипотетическую схему, объясняющую участие H2S в ЧЭССМ-вызванной вазодилатации сосудов кожи голени: ЧЭССМ посредством атидромной активации окончаний сенсорных нервов приводит к выделению нейронального NO (доказано [19]), который, действуя на цистатионин-γ-лиазу, приводит к ее активации. Дополнительно стимулировать цистатионин-γ-лиазу может также NO, продуцируемый эндотелием (рассмотрено выше). Активация цистатионин-γ-лиазы приводит к образованию H2S, который оказывает дополнительный вазодилатационный эффект, используя другие сигнальный пути, отличные от сигнальных путей, активируемых NO [26, 27].
ВЫВОДЫ
1. ЧЭССМ на уровне позвонков Т7–Т8, так же, как и при стимуляции на уровне позвонков L1–L2, непрерывными электрическими импульсами с частотой 30 Гц и интенсивностью 30–90% от двигательного порога, приводит к возрастанию перфузии кожи голени.
2. Величина и скорость изменения кровотока при стимуляции в области L1–L2, достоверно отличаются от таковой при стимуляции в области Т7–Т8, что демонстрирует возможность использования ЧЭССМ для адресного воздействия на разные отделы регуляции кровотока.
3. Доказано, что увеличение микрокровотока в коже голени при ЧЭССМ вызвано преимущественно антидромной активацией сенсорных нервных волокон, выделяющих в своих окончаниях NO.
4. Установлено, что наряду с нейрональным NO, вазодилатационный эффект в коже голени при ЧЭССМ модулируется эндотелиальным NO.
5. Впервые показано, что в процесс вазодилатации в коже при ЧЭССМ вовлечен H2S, продуцируемый цистатионин-γ-лиазой.
Этические нормы. Все исследования проведены в соответствии с принципами биомедицинской этики, сформулированными в Хельсинкской декларации 1964 г. и ее последующих обновлениях, и одобрены локальным биоэтическим комитетом Института физиологии им. И.П. Павлова РАН (Санкт-Петербург).
Информированное согласие. Каждый участник исследования представил добровольное письменное информированное согласие, подписанное им после разъяснения ему потенциальных рисков и преимуществ, а также характера предстоящего исследования.
Финансирование работы. Исследование выполнено при финансовой поддержке Программы “Фундаментальные научные исследования для долгосрочного развития и обеспечения конкурентоспособности общества и государства” (тема 63.4, (0113-2019-0006)), гранта РФФИ № 16-29-08277 и программой фундаментальных исследований Президиума РАН № 1.42.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией данной статьи.
Список литературы
Garstang S.V., Miller-Smith S.A. Autonomic nervous system dysfunction after spinal cord injury // Phys. Med. Rehabil. Clin. N. Am. 2007. V. 18. № 2. P. 275.
Harkema S., Gerasimenko Y., Hodes J. et al. Effect of epidural stimulation of thelumbosacral spinal cord on voluntary movement, standing, and assisted step-ping after motor complete paraplegia: a case study // Lancet. 2011. V. 377. № 9781. P. 1938.
Gerasimenko Y., Gorodnichev R., Moshonkina T. et al. Transcutaneous electrical spinal cord stimulation in humans // Ann. Phys. Rehabil. Med. 2015. V. 58. № 4. P. 225.
Gerasimenko Y., Gorodnichev R., Puhov A. et al. Initiation and modulation of locomotor circuitry output with multisite transcutaneous electrical stimulation of the spinal cord in noninjured humans // J. Neurophysiol. 2014. V. 113. № 3. P. 834.
Лобов Г.И., Щербакова Н.А., Городничев Р.М. и др. Эффект чрескожной электростимуляции спинного мозга на кровоток в коже нижних конечностей // Физиология человека. 2017. Т. 43. № 5. С. 36. Lobov G.I., Shcherbakova N.A., Gorodnichev R.M. et al. Effect of transcutaneous electrical spinal cord stimulation on the blood flow in the skin of lower limbs // Human Physiology. 2017. V. 43. № 5. P. 518.
Лобов Г.И., Герасименко Ю.П., Мошонкина Т.Р. Механизмы вазодилатации в коже при чрескожной электростимуляции спинного мозга на уровне поясничного утолщения // Физиология человека. 2019. Т. 45. № 4. С. 53. Lobov G.I., Gerasimenko Yu.P., Moshonkina T.R. Mechanisms of Vasodilation in Skin during Lumbar Transcutaneous Spinal Cord Stimulation // Human Physiology. 2019. V. 45. № 4. P. 389.
Johnson J.M., Minson C.T., Kellogg D.L., Jr. Cutaneous vasodilator and vasoconstrictor mechanisms in temperature regulation // Compr. Physiol. 2014. V. 4. № 1. P. 33.
Ozüm Ü., Akyol M., Balaban H. et al. Effect of cervical spinal cord electrical stimulation on nitric oxide levels in brain and dermal tissues: an evaluation using by real-time nitric oxide measurement // Acta Neurochir. (Wien). 2012. V. 154. № 9. P. 1641.
Branco L.G., Soriano R.N., Steiner A.A. Gaseous mediators in temperature regulation // Compr. Physiol. 2014. V. 4. № 4. P. 1301
Streeter E., Hart J., Badoer E. An investigation of the mechanisms of hydrogen sulfide-induced vasorelaxation in rat middle cerebral arteries // Naunyn Schmiedebergs Arch. Pharmacol. 2012. V. 385. № 10. P. 991.
Aslan S.C., Legg Ditterline B.E., Park M.C. et al. Epidural spinal cord stimulation of lumbosacral networks modulates arterial blood pressure in individuals with spinal cord injury-induced cardiovascular deficits // Front. Physiol. 2018. V. 9. P. 565.
Phillips A.A., Squair J.W., Sayenko D.G. et al. An autonomic neuroprosthesis: noninvasive electrical spinal cord stimulation restores autonomic cardiovascular function in individuals with spinal cord injury // J. Neurotrauma. 2018. V. 35. № 3. P. 446.
Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем (Руководство для врачей). М.: Либроком, 2013. 496 с.
Dellon A.L., Höke A., Williams E.H. et al. The sympathetic innervation of the human foot // Plast. Reconstr. Surg. 2012. V. 129. № 4. P. 905.
Van Duijnhoven N.T., Janssen T.W., Green D.J. et al. Effect of functional electrostimulation on impaired skin vasodilator responses to local heating in spinal cord injury // J. Appl. Physiol. (1985). 2009. V. 106. № 4. P. 1065.
Smith C.J., Craighead D.H., Alexander L.M. Effects of vehicle microdialysis solutions on cutaneous vascular responses to local heating // J. Appl. Physiol. (1985). 2017. V. 123. № 6. P. 1461
Wong B.J. Sensory nerves and nitric oxide contribute to reflex cutaneous vasodilation in humans // Am. J. Physiol. Regul. Integr. Comp. Physiol. 2013. V. 304. № 8. P. R651.
Bruning R.S., Santhanam L., Stanhewicz A.E. et al. Endothelial nitric oxide synthase mediates cutaneous vasodilation during local heating and is attenuated in middle-aged human skin // J. Appl. Physiol. (1985). 2012. V. 112. № 12. P. 2019.
Croom J.E., Foreman R.D., Chandler M.J., Barron K.W. Cutaneous vasodilation during dorsal column stimulation is mediated by dorsal roots and CGRP // Am. J. Physiol. 1997. V. 272. № 2. Pt. 2. H950.
Yan L., Yinghui T., Bo Y. et al. Effect of calcitonin gene-related peptide on nitric oxide production in osteoblasts: an experimental study // Cell Biol. Int. 2011. V. 35. № 8. P. 757.
Wu M., Komori N., Qin C. et al. Roles of peripheral terminals of transient receptor potential vanilloid-1 containing sensory fibers in spinal cord stimulation-induced peripheral vasodilation // Brain Res. 2007. V. 1156. P. 80.
Idigo W.O., Reilly S., Zhang M.H. et al. Regulation of endothelial nitric-oxide synthase (NOS) S-glutathionylation by neuronal NOS: evidence of a functional interaction between myocardial constitutive NOS isoforms // J. Biol. Chem. 2012. V. 287. № 52. P. 43 665.
Hosoki R., Matsuki N., Kimura H. The possible role of hydrogen sulfide as an endogenous smooth muscle relaxant in synergy with nitric oxide // Biochem. Biophys. Res. Commun. 1997. V. 237. № 3. P. 527.
Bełtowski J. Hydrogen sulfide in pharmacology and medicine. An update // Pharmacol. Rep. 2015. V. 67. № 3. P. 647.
Kimura H. The physiological role of hydrogen sulfide and beyond // Nitric Oxide. 2014. V. 41. P. 4.
Zhao W., Zhang J., Lu Y., Wang R. The vasorelaxant effect of H(2)S as a novel endogenous gaseous K(ATP) channel opener // EMBO J. 2001. V. 20. № 21. P. 6008.
Li L., Rose P., Moore P.K. Hydrogen sulfide and cell signaling // Annu. Rev. Pharmacol. Toxicol. 2011. V. 51. P. 169.
Дополнительные материалы отсутствуют.
Инструменты
Физиология человека


